蛋白质TabZIP60在调控植物对氮素吸收中的应用的制作方法
本发明涉及生物
技术领域:
,具体涉及蛋白质tabzip60在调控植物对氮素吸收中应用。
背景技术:
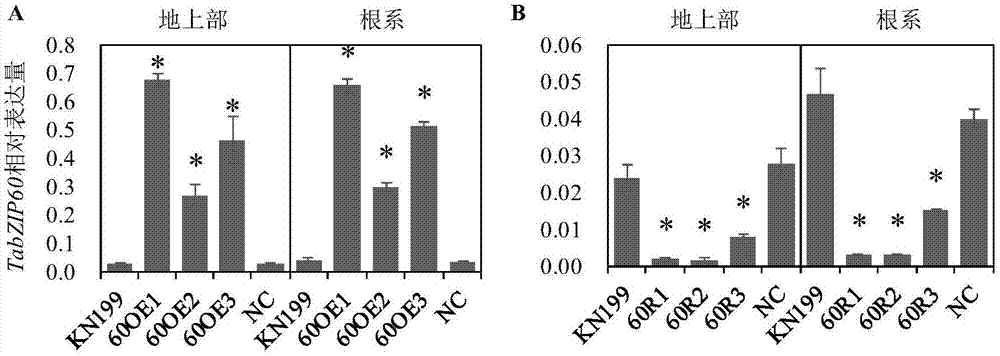
氮素是植物生长发育所必需的大量营养元素,缺氮是制约着农作物产量的重要因素。我国的人口数量约占了世界人口的五分之一,且仍在逐年增加;但农业可耕种面积只有世界的7%,呈逐年减少的趋势。为了用不断减少的土地养活不断增加的人口,我国大量使用化肥以增加单位面积粮食产量。多年的研究表明化肥确实能够实现大范围的增产,但是化肥的过量使用不仅直接导致了化肥利用效率的降低,也导致了严重的环境问题和资源浪费。我国水稻、小麦和玉米的氮肥农学效率分别为10.4kg/kg、8.0kg/kg和9.8kg/kg,氮肥利用率分别为28.3%、28.2%和26.1%,远低于国际水平,与20世纪80年代相比呈下降趋势。面临巨大的资源环境压力,粮食增产不能单纯依靠增加肥料用量来实现。减少化肥投入,通过基因工程等生物手段选育养分高效农作物新品种将具有重要的意义。技术实现要素:本发明的目的是提供一种蛋白质tabzip60在调控植物对氮素吸收中应用。第一方面,本发明要求保护tabzip60蛋白或其相关生物材料在调控植物对氮素的吸收、利用和/或分配中的应用。所述相关生物材料可为能够表达所述tabzip60蛋白的核酸分子或含有所述核酸分子的表达盒、重组载体、重组菌或转基因细胞系。其中,所述植物对氮素的吸收、利用和/或分配可体现为如下中至少一种:(a1)植物根系氮浓度;(a2)植物地上部氮积累量;(a3)植物根系氮积累量;(a4)植物总吸氮量;(a5)植物籽粒氮积累量;(a6)植物籽粒中氨基酸含量;(a7)植物地上部不同器官的氮转出效率。第二方面,本发明要求保护一种培育具有如下(b1)-(b7)所示性状中至少一种的植物品种的方法。本发明所提供的培育具有如下(b1)-(b7)所示性状中至少一种的植物品种的方法,可包括使受体植物中tabzip60蛋白的表达量和/或活性降低的步骤。进一步,本发明提供了一种培育具有如下(b1)-(b7)所示性状中至少一种的转基因植物的方法。本发明所提供的培育具有如下(b1)-(b7)所示性状中至少一种的转基因植物的方法,具体可包括如下步骤:对受体植物中tabzip60蛋白的编码基因进行抑制表达,得到转基因植物;所述转基因植物与所述受体植物相比具有如下(b1)-(b7)所示性状中至少一种。(b1)根系氮浓度提高(高氮条件下);(b2)根系氮积累量提高(高氮条件下);(b3)籽粒氮积累量提高;(b4)籽粒中如下7种氨基酸的含量提高:谷氨酸、甘氨酸、丙氨酸、酪氨酸、苯丙氨酸、组氨酸和赖氨酸;(b5)开花期到花后14天倒4叶片和叶鞘的氮素转出效率提高;(b6)开花期倒四叶和穗部的氮浓度提高;(b7)花后14天旗叶、旗叶鞘以及倒二鞘的氮浓度降低。第三方面,本发明要求保护一种培育具有如下(c1)-(c11)所示性状中至少一种的植物品种的方法。本发明所提供的培育具有如下(c1)-(c11)所示性状中至少一种的植物品种的方法,可包括使受体植物中tabzip60蛋白的表达量和/或活性提高的步骤。进一步,本发明提供了一种培育具有如下(c1)-(c11)所示性状中至少一种的转基因植物的方法。本发明所提供的培育具有如下(c1)-(c11)所示性状中至少一种的转基因植物的方法,具体可包括如下步骤:向受体植物中导入能够表达tabzip60蛋白的核酸分子,得到转基因植物;所述转基因植物与所述受体植物相比具有如下(c1)-(c11)所示性状中至少一种。(c1)根系氮浓度降低(高氮和低氮条件下);(c2)地上部氮积累量降低(高氮条件下);(c3)根系氮积累量降低(高氮条件下);(c4)总吸氮量降低(高氮条件下);(c5)籽粒氮积累量降低;(c6)籽粒中如下10种氨基酸的含量提高:天冬氨酸、丝氨酸、谷氨酸、甘氨酸、丙氨酸、异亮氨酸、酪氨酸、苯丙氨酸、组氨酸和赖氨酸;(c7)开花期到花后14天叶片和叶鞘的氮素转出效率提高;(c8)开花期到花后14天茎秆的氮素转出效率降低;(c9)开花期的倒四鞘和穗部氮浓度降低;(c10)花后14天地上部除了倒三叶外所有叶片和叶鞘的氮浓度降低;(c11)成熟期倒二叶鞘的氮浓度提高。在本发明中,以上所有的“氮浓度”均表示氮素在其中的质量百分含量(单位为%);以上所有的“氮积累量”均表示其中的氮素的质量(单位可为克或毫克)。在本发明的具体实施方式中,所述高氮为2mmn;所述低氮为0.2mmn。在第二方面中,所述“对受体植物中tabzip60蛋白的编码基因进行抑制表达”可通过向所述受体植物中导入含有如式(i)所示的dna片段的干扰载体实现;seq正向-x-seq反向(i)所述seq正向的序列为seqidno.3的第1-435位;所述seq反向的序列与所述seq正向的序列反向互补(具体为seqidno.3的第617-1051位);所述x是所述seq正向与所述seq反向之间的间隔序列,在序列上,所述x与所述seq正向及所述seq反向均不互补。在本发明中,式(i)中所述x具体如seqidno.3的第442-610位所示。更加具体的,式(i)所示的dna片段的核苷酸序列如seqidno.3所示。在本发明的具体实施方式中,所述干扰载体具体为将所述如式(i)所示的dna片段插入到pubi-163载体的多克隆位点处(bamhi和kpni)所得的重组质粒。在第三方面中,所述“向受体植物中导入能够表达所述tabzip60蛋白的核酸分子”可通过向所述受体植物中导入含有所述tabzip60蛋白的编码基因的重组表达载体实现。所述重组表达载体可用现有的植物表达载体构建。所述植物表达载体包括双元农杆菌载体和可用于植物微弹轰击的载体等,如pcambia-1300-221、pgreen0029、pcambia3301、pcambia1300、pbi121、pbin19、pcambia2301、pcambia1301-ubin或其它衍生植物表达载体。所述植物表达载体还可包含外源基因的3’端非翻译区域,即包含聚腺苷酸信号和任何其它参与mrna加工或基因表达的dna片段。所述聚腺苷酸信号可引导聚腺苷酸加入到mrna前体的3’端。使用所述基因构建重组表达载体时,在其转录起始核苷酸前可加上任何一种增强型、组成型、组织特异型或诱导型启动子,例如花椰菜花叶病毒(camv)35s启动子、泛素基因ubiquitin启动子(pubi)、胁迫诱导型启动子rd29a等,它们可单独使用或与其它的植物启动子结合使用;此外,使用本发明的基因构建重组表达载体时,还可使用增强子,包括翻译增强子或转录增强子,这些增强子区域可以是atg起始密码子或邻接区域起始密码子等,但必需与编码序列的阅读框相同,以保证整个序列的正确翻译。所述翻译控制信号和起始密码子的来源是广泛的,可以是天然的,也可以是合成的。翻译起始区域可以来自转录起始区域或结构基因。为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所用重组表达载体进行加工,如加入可在植物中表达的编码可产生颜色变化的酶或发光化合物的基因、具有抗性的抗生素标记物或是抗化学试剂标记基因等。也可不加任何选择性标记基因,直接以逆境筛选转化植株。在本发明中,所述重组载体中启动所述tabzip60蛋白的编码基因转录的启动子为ubi启动子。更加具体的,所述重组表达载体为将所述tabzip60蛋白的编码基因插入到pubi-163载体的多克隆位点处(hindiii和ecori)所得的重组质粒。在上述方法中,将携带有所述tabzip60蛋白的编码基因的所述重组表达载体或者携带有所述如式(i)所示的dna片段的所述的干扰载体导入所述受体植物,具体可为:通过使用ti质粒、ri质粒、植物病毒载体、直接dna转化、显微注射、电导、农杆菌介导等常规生物学方法转化植物细胞或组织,并将转化的植物组织培育成植株。在第一方面、第二方面和第三方面中,所述tabzip60蛋白均可为如下任一所示蛋白质:(a1)氨基酸序列为seqidno.1的蛋白质;(a2)将seqidno.1所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质;(a3)与(a1)-(a2)中任一所限定的氨基酸序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且具有相同功能的蛋白质;(a4)在(a1)-(a3)中任一所限定的蛋白质的n端和/或c端连接标签后得到的融合蛋白。相应的,在第一方面、第二方面和第三方面中,所述“能够表达所述tabzip60蛋白的核酸分子”均可为所述tabzip60蛋白的编码基因。更进一步,所述tabzip60蛋白的编码基因具体可如下任一所述的dna分子:(b1)seqidno.2所示的dna分子;(b2)在严格条件下与(b1)限定的dna分子杂交且编码所述tabzip60蛋白的dna分子;(b3)与(b1)或(b2)限定的dna序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且编码所述tabzip60蛋白的dna分子。上述严格条件可为用6×ssc,0.5%sds的溶液,在65℃下杂交,然后用2×ssc,0.1%sds和1×ssc,0.1%sds各洗膜一次。在第一方面、第二方面和第三方面中,所述植物均可为单子叶植物,也可为双子叶植物。进一步地,所述单子叶植物可为禾本科植物。更进一步地,所述禾本科植物可为小麦。在本发明的具体实施方式中,所述植物具体为小麦品种kn199(科农199)。实验证明,本发明所提供的蛋白质tabzip60调控植物产量:与野生型植物相比,tabzip60超量表达转基因植物根系氮浓度降低(高氮和低氮条件下);地上部氮积累量降低(高氮条件下);根系氮积累量降低(高氮条件下);总吸氮量降低(高氮条件下);籽粒氮积累量降低;籽粒中如下10种氨基酸的含量提高:天冬氨酸、丝氨酸、谷氨酸、甘氨酸、丙氨酸、异亮氨酸、酪氨酸、苯丙氨酸、组氨酸和赖氨酸;开花期到花后14天叶片和叶鞘的氮素转出效率提高;开花期到花后14天茎秆的氮素转出效率降低;开花期的倒四鞘和穗部氮浓度降低;花后14天地上部除了倒三叶外所有叶片和叶鞘的氮浓度降低;成熟期倒二叶鞘氮的浓度提高。与野生型植物相比,tabzip60减量表达转基因植物的根系氮浓度提高(高氮条件下);根系氮积累量提高(高氮条件下);籽粒氮积累量提高;籽粒中如下7种氨基酸的含量提高:谷氨酸、甘氨酸、丙氨酸、酪氨酸、苯丙氨酸、组氨酸和赖氨酸;开花期到花后14天倒4叶片和叶鞘的氮素转出效率提高;开花期倒四叶和穗部的氮浓度提高;花后14天旗叶、旗叶鞘以及倒二鞘的氮浓度降低。因此,可以利用蛋白质tabzip60调控植物对氮素的吸收、利用和/或分配。本发明对选育高品质植物新材料的具有重要应用价值。附图说明图1为tabzip60转基因系的表达量鉴定。其中,a为tabzip60超量表达鉴定。b为tabzip60减量表达鉴定。nc代表空载对照。图中表达量是相对于taactin的表达量。图中数据为3个重复的平均值±s.e.。*代表差异达到p<0.05显著性。图2为tabzip60超量表达系的氮吸收利用相关性状鉴定结果。其中,a为地上部氮浓度。b为根系氮浓度。c为地上部氮积累量。d为根系氮积累量。e为小麦总吸氮量。a-e均为左侧为高氮条件,右侧为低氮条件。图中数据为平均值±s.e.(n≥3)。*代表差异达到p<0.05显著性。图3为tabzip60减量表达系的氮吸收利用相关性状鉴定结果。其中,a为地上部氮浓度。b为根系氮浓度。c为地上部氮积累量。d为根系氮积累量。e为小麦总吸氮量。a-e均为左侧为高氮条件,右侧为低氮条件。图中数据为平均值±s.e.(n≥3)。*代表差异达到p<0.05显著性。图4为2016-2017生长季tabzip60转基因系的籽粒氮积累量的测定结果。60oe1、60oe2和60oe3为超量表达系,60oe1-、60oe2-和60oe3-为对应的阴性系,60r1、60r2和60r3为减量表达系,60r1-、60r2-和60r3-为对应的阴性系。图中数据是3个重复的平均值±s.e.。*代表差异达到p<0.05显著性。图5为tabzip60转基因系与kn199地上部各部分氮浓度测定结果。其中,a-c分别为开花期氮浓度(a),花后14天氮浓度(b),成熟期氮浓度(c)。黑色箭头指示叶片,橙色箭头指示叶鞘,蓝色箭头指示茎,紫色箭头指示穗部。图中数据是3个重复的平均值±s.e.。*代表差异达到p<0.05显著性。图6为tabzip60转基因系灌浆期地上部氮转出效率的时间进程。图中数据为3个重复的平均值±s.e.。*代表差异达到p<0.05显著性。具体实施方式下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。小麦品种kn199(科农199):遗传所李俊明培育的品种,公众可从商业途径得到或从中国科学院遗传与发育生物学研究所获得。pubi-163载体:记载于“shao,a.,ma,w.y.,zhao,x.q.,hu,m.y.,he,x.,teng,w.,li,h.,andtong,y.p.(2017).theauxinbiosynthetictryptophanaminotransferaserelatedtatar2.1-3aincreasesgrainyieldofwheat.plantphysiol.174,2274-2288.”一文,公众可从申请人处获得,仅可用于重复本发明实验使用。实施例1、转tabzip60基因小麦的构建一、转tabzip60基因植株的制备(一)tabzip60基因的获得1、提取小麦品种kn199的总rna,反转录得到其基因组cdna。2、以步骤1得到的cdna为模板,以如下引物为引物进行pcr扩增构建超量表达tabzip60转基因系小麦所需序列:tabzip60-oe-f:5’-aagcttatggattttccgggagggagcggg-3’(下划线所示序列为hindiii酶切识别位点);tabzip60-oe-r:5’-gaattcttaccaagggcccgtcagcgtcctc-3’(下划线所示序列为ecori酶切识别位点)。以如下引物为引物进行pcr扩增构建减量表达tabzip60转基因系小麦所需序列:tabzip60-rnai-f1:5’-ggatcccctatggtgaatcctctgtcc-3’(下划线所示序列为bamhⅰ酶切识别位点);tabzip60-rnai-r1:5’-gaattcttgcctgctaaccttctcg-3’(下划线所示序列为ecorⅰ酶切识别位点);tabzip60-rnai-f2:5’-ggtacccctatggtgaatcctctgtcc-3’(下划线所示序列为kpni酶切识别位点);tabzip60-rnai-r2:5’-aagcttttgcctgctaaccttctcg-3’(下划线所示序列为hindiii酶切识别位点)。pcr体系:模板cdna4μl,kodplusdna聚合酶1μl,10×pcrbufferforkodplus4μl,dntps(2mmeach)4μl,25mm的mgso42μl,上下游引物各20mm,再用双蒸水将反应体系补足至40μl。pcr反应程序:98℃2min;98℃30sec,58℃30sec,68℃45sec,38个循环。用于超量表达tabzip60基因的pcr产物(记为pcr产物1)的核苷酸序列为“5’-aagctt+seqidno.2+gaattc-3’”。其中,seqidno.2为tabzip60基因的cdna序列(编码seqidno.1所示的tabzip60蛋白)。减量表达tabzip60基因的pcr产物有两种,其一记为pcr产物2,另一记为pcr产物3;其中pcr产物2的核苷酸序列为“5’-ggatcc+seqidno.2的第595-1029位+gaattc-3’”,pcr产物3的核苷酸序列为“5’-ggtacc+seqidno.2的第595-1029位+aagctt-3’”。(二)tabzip60基因克隆载体的构建用hindiii和ecori双酶切上述pcr产物1,得到基因片段;hindiii和ecori双酶切pubi-163载体,得到载体大片段,将基因片段与载体大片段连接,得到重组质粒,将其命名为pubi-163-tabzip60,将重组质粒送测序,结果正确。pubi-163-tabzip60中tabzip60基因由ubi启动子启动。pubi-163-tabzip60载体的结构描述:将seqidno.2所示dna片段替换pubi-163载体的酶切位点hindiii和ecori之间的小片段后所得的重组质粒。用bamhⅰ和ecorⅰ双酶切上述pcr产物2,得到基因片段s1,用kpni和hindiii双酶切上述pcr产物3,得到基因片段s2,用ecorⅰ和kpni酶切pubi-163载体回收载体内含子片段s3,用bamhi和kpni酶切pubi-163载体回收载体骨架v1。然后将v1、s3分别与s1、s2连接构建成pubi-tabzip60-rnai载体。测序并酶切验证。pubi-tabzip60-rnai载体的结构描述:将seqidno.3所示dna片段替换pubi-163载体的酶切位点bamhⅰ和kpni之间的小片段后所得的重组质粒。seqidno.3的第1-435位为茎环结构双链部分的正向序列,第436-441位为ecori的识别序列,第442-610位为内含子序列,第611-616位为hindiii的识别序列,第617-1051位为茎环结构双链部分的反向序列。(三)转基因小麦的获得将pubi-163-tabzip60载体和pubi-tabzip60-rnai载体用基因枪的方法分别转入野生型小麦kn199中,得到t0代tabzip60超量表达和减量表达转基因小麦。提取t0代tabzip60超量表达和减量表达转基因小麦叶片的基因组dna,以其作为模板,用各自的上游引物和下游引物进行pcr扩增,得到1000bp和800bp左右的片段,即为阳性t0代tabzip60超量表达和减量表达转基因小麦。用于鉴定tabzip60超量表达转基因小麦的引物:上游引物t-oepf:5’-aagcttatggattttccgggagggagcggg-3’;下游引物t-oepr:5’-gaattcttaccaagggcccgtcagcgtcctc-3’。用于鉴定tabzip60减量表达转基因小麦的引物:上游引物t-rnaipf:5'-tcggagtagaatactgtttcaaactacc-3'(ubi上的序列);下游引物t-rnaipr:5'-aatggtgatcatccagctctc-3'(内含子上的序列)。将上述鉴定为阳性的t0代转tabzip60超量表达和减量表达转基因小麦培养至t2代,t1-t2代按照t0代的鉴定方法进行鉴定,收获种子。实验同时设置向野生型小麦品种kn199中导入pubi-163载体的空载对照(下文简称空载对照植株)。二、转基因植株的检测(一)dna水平检测分别提取t2代tabzip60超量表达小麦、tabzip60减量表达小麦以及野生型小麦kn199的叶片的dna,分别以其为模板,以t-oepf和t-oepr(具体序列同上)为引物鉴定tabzip60超量表达系,以t-rnaipf和t-rnaipr为引物(具体序列同上)鉴定tabzip60减量表达系,同时以各自的载体为阳性对照(pc),以野生型小麦kn199号作为阴性对照(wt)。pcr反应体系:dna模板(约20ng/μl)2μl;正向引物(10μm)0.5μl;反向引物(10μm)0.5μl;10×pcr扩增缓冲液2μl;dntpmixture1μl;taqdna聚合酶0.2μl;ddh2o补足至20μl。pcr反应程序:94℃,3min;94℃30s,60℃30s,72℃40s,40个循环;72℃5min。tabzip60超量表达小麦的目的pcr扩增条带为1000bp左右,tabzip60减量表达小麦的目的pcr扩增条带为800bp左右。野生型小麦kn199没有目的条带,三个t2代tabzip60超量表达小麦株系(60oe1、60oe2和60oe3)和三个t2代tabzip60减量表达小麦株系(60r1、60r2和60r3)经初步鉴定为阳性小麦。(二)rna水平检测1、分别提取t2代tabzip60超量表达小麦、tabzip60减量表达小麦以及野生型小麦kn199的茎和根的总rna,并反转录成cdna。2、分别以步骤1得到的cdna为模板,以tabzip60rtpf和tabzip60rtpr为引物进行rt-pcr,扩增tabzip60基因,同时以taactinpf和taactinpr为引物进行rt-pcr,扩增内参基因taactin。引物如下:上游引物tabzip60rtpf:5’-ttccctcagagcaacatgtttg-3’;下游引物tabzip60rtpr:5’-cgacggcgaaaccatagc-3’;上游引物taactinpf:5'-accttcagttgcccagcaat-3';下游引物taactinpr:5'-cagagtcgagcacaataccagttg-3'。pcr体系:dna模板(约20ng/μl)2μl;上游引物(10μm)0.4μl;下游引物(10μm)0.4μl;2×mixture(lightcyclersybrgreenimaster,roche)10μl;ddh2o补足至20μl。pcr程序:94℃,5min;94℃20s,60℃20s,72℃15s,45个循环。定量分析:采用rochelightcycler480ⅱrealtimepcr仪分析其ct值。以taactin基因为内参,t2代tabzip60转基因小麦和野生型小麦kn199中的tabzip60基因用2-δct进行相对定量。60oe1、60oe2和60oe3三个t2代tabzip60超量表达小麦以及60r1、60r2和60r3三个t2代tabzip60减量表达小麦中tabzip60基因的检测结果如图1所示。图1表明,与野生型小麦kn199相比,60oe1、60oe2和60oe3三个t2代tabzip60超量表达小麦中tabzip60基因的表达量显著增加。而60r1、60r2和60r3三个t2代tabzip60减量表达小麦中tabzip60基因的表达量显著。经过步骤(一)的dna水平检测和步骤(二)的rna水平检测确定60oe1、60oe2和60oe3三个t2代tabzip60超量表达小麦以及60r1、60r2和60r3三个t2代tabzip60减量表达小麦构建成功。实施例2、tabzip60转基因小麦对氮素吸收、利用和分配相关性状的鉴定供试小麦:tabzip60超量表达小麦60oe1、60oe2和60oe3,tabzip60减量表达小麦60r1、60r2和60r3,野生型小麦kn199,以及空载对照植株(nc)和各转基因系分离出来的阴性对照系。一、水培条件下将各供试小麦的种子用1%的双氧水过夜处理打破休眠,然后移栽到育苗盘上培养7天,待其长到两叶一心时选择长势一致的小麦幼苗分别移栽到高氮营养液(2mmn)和低氮营养液(0.2mmn)中培养,培养液配方详见如下表1。培养14天后,将地上部与根系分开,然后分别测定地上部氮浓度(%)、根系氮浓度(%)、地上部氮积累量(毫克/株)、根系氮积累量(毫克/株)和小麦总吸氮量(毫克/株)。表1小麦水培营养液配方试剂高氮(mm)低氮(mm)ca(no3)21.00.1mgso4·7h2o1.01.0cacl22.53.4h3bo30.0010.001(nh4)6mo7o24·4h2o0.000050.00005cuso4·5h2o0.00050.0005znso4·7h2o0.0010.001结果显示:(1)tabzip60超量表达系的氮吸收利用相关性状鉴定结果如图2所示。在高氮条件下,与受体亲本kn199相比,tabzip60超量表达系(60oe1、60oe2和60oe3)根系氮浓度降低,地上部氮浓度无差异,地上部、根系和整株氮积累量都显著降低。在低氮条件下,与受体亲本kn199相比,tabzip60超量表达系(60oe1、60oe2和60oe3)只有根系氮浓度显著降低,转基因系的其他性状与受体亲本无显著性差异。(2)tabzip60减量表达系的氮吸收利用相关性状鉴定结果如图3所示。在高氮条件下,与受体亲本kn199相比,tabzip60减量表达系(60r1、60r3和60r5)的根系氮浓度、根系氮积累量显著增加,而其它测定的性状如地上部氮浓度等无显著性差异。在低氮条件下,与受体亲本kn199相比,tabzip60减量表达系的测定性状无显著性差异。综上所述,tabzip60与小麦对氮素的吸收利用有关,影响了根系氮浓度和吸氮量等。二、大田条件下1、籽粒氮积累量的测定在2016-2017年对纯合的tabzip60超量表达和减量表达转基因系t4代的籽粒氮积累量进行了鉴定。每个转基因系种3个重复,每个重复1行。田间表型鉴定采用2m行长,行距30cm,株距5cm,成熟后每行选择10株代表性单株测定籽粒氮积累量。籽粒氮积累量的含义是籽粒中所有氮素的质量;单位是克;测定方式是先测定籽粒总重(克),然后用凯氏定氮仪测定籽粒中氮素的浓度(%),二者相乘即为籽粒氮积累量。结果显示,与受体亲本kn199和阴性对照(各转基因系分离出来的阴性对照系)相比,tabzip60超量表达转基因系的籽粒氮积累量显著降低。与受体亲本kn199和阴性对照(各转基因系分离出来的阴性对照系)相比,tabzip60减量表达转基因系的籽粒氮积累量显著增加。见图4。2、籽粒中氨基酸含量的测定检测了kn199和tabzip60各转基因系籽粒中的14种氨基酸含量(所用检测仪器为biochrom30aminoacidanalyzer(amersham,cambridge,uk)。结果发现:超量表达tabzip60后,籽粒中的氨基酸含量有不同程度的增加,其中谷氨酸和天冬氨酸等10种氨基酸的浓度得到显著增加。减量表达tabzip60后,籽粒中的各氨基酸含量也有不同程度提高,其中谷氨酸和甘氨酸等7种氨基酸的浓度得到显著增加。见表2。表2kn199和tabzip60转基因系的氨基酸含量注:表中数据为平均值±s.e.(n≥3)。*代表差异达到p<0.05显著性。3、tabzip60对小麦氮素利用的影响由于tabzip60的表达受到供氮水平的调控,上述结果表明通过转基因改变tabzip60表达量影响了小麦对氮素的吸收和籽粒籽粒中氨基酸组成。本发明进一步分析了tabzip60是否参与调控氮素在小麦植株中的分配和再利用。在开花期,花后14天(14dpa)和成熟期三个时期每个转基因系取10个生长状态基本一致的单穗,每个单穗的地上部分为10个部分:旗叶(flagleaf)、倒二叶(top2ndleaf)、倒三叶(top3rdleaf)、倒四叶(top4thleaf)、旗叶鞘(topsheath)、倒二叶鞘(top2ndsheath)、倒三叶鞘(top3ndsheath)、倒四叶鞘(top4ndsheath),茎(stem)和穗部(spike)。每个转基因系取10个单穗混样检测各部分的地上部生物量和氮浓度。结果显示:tabzip60超量表达系在开花期的倒四鞘和穗部氮浓度显著低于kn199,其余部位与kn199没有显著性差异。在14dpa期除了倒三叶外所有叶片和其余叶鞘的氮浓度都显著低于kn199。在成熟期,倒二叶鞘氮的浓度显著高于kn199,其余部位的氮浓度高于kn199但没达到显著性。减量表达系与kn199相比在开花期倒四叶和穗部的氮浓度显著提高,其他部位的氮浓度无显著性变化。在14dpa期减量表达系的旗叶、旗叶鞘以及倒二鞘的氮浓度显著降低,其余部位的氮浓度无显著性变化。在成熟期,减量表达系各部位的氮浓度都无显著性变化。见图5。本发明随后根据各部位氮浓度和生物量计算氮转出效率(ntranslocationefficiency),氮转出效率可以反映氮素的再利用效率。计算公式如下:氮转出效率=氮转出量/开花期该器官含氮量。以花后14天为分界线将开花期到收获期分成两个时间段分别计算地上部各部位在这两个时间段的氮转运效率:开花期到花后14天(anthesis-14dpa)和花后14天到成熟期(14dpa-maturity)。两个时段的转出效率相加即为灌浆期氮总转出效率。分析结果显示,改变tabzip60表达量影响了营养器官向外转出氮素的时间进程,但对多数器官的氮素总转出效率影响不显著,这与改变tabzip60表达量并不显著影响氮素收获指数(nhi)的结果相符。比较转基因系和kn199不同器官在不同时段氮素转出效率的高低,可以发现超量表达tabzip60-6d主要加快了开花期到花后14天叶片和叶鞘的氮素转出,延缓了茎秆的氮素转出;减量表达tabzip60主要加快了开花期到花后14天倒4叶片和叶鞘的氮素转出。见图6。<110>中国科学院遗传与发育生物学研究所<120>蛋白质tabzip60在调控植物对氮素吸收中的应用<130>gncln181549<160>3<170>patentinversion3.5<210>1<211>361<212>prt<213>triticumaestivuml.<400>1metasppheproglyglyserglyargproproproproproglngln151015hisglnhisglnleuleuproprometthrproleuproleuthrarg202530glnglyserservaltyrserleuthrpheaspglupheglnserala354045ileglyglyproglylysasppheglysermetasnmetaspgluleu505560leuargasniletrpthralaglugluserglnalaileglyalagly65707580proasnalaalaalaserserseralaalaalaglyproasphisgly859095glyileglnargglnglyserleuthrleuproargthrleusergln100105110lysthrvalaspgluvaltrpargaspmetmetphepheglyglypro115120125seralaseralaseralaalaalaglualaproproproalaglnarg130135140glnglnthrleuglygluvalthrleugluglupheleuvalargala145150155160glyvalvalarggluaspmetproglyproproproprovalserpro165170175alaprovalalaglnalaproproproglnproglnmetleuphepro180185190glnserasnmetphealaprometvalasnproleuserleualaasn195200205glyleumetthrglyalatyrglyglnglyglyglyglyglyglygly210215220alaproalametvalserproserprothrglyargprovalmetser225230235240asnglytyrglylysmetgluglyleuasnleuserserleuserpro245250255proprometprotyrvalpheserglyglyleuargglyarglyspro260265270proalametglulysvalvalgluargargglnargargmetilelys275280285asnarggluseralaalaargserargglnarglysglnsertyrmet290295300metgluleugluthrgluvalalalysleulysgluargasngluglu305310315320leuglnarglysglnalagluileleugluargglnlysasngluval325330335pheglulysvalserargglnalaglyprothrserlysargilecys340345350leuargargthrleuthrglyprotrp355360<210>2<211>1086<212>dna<213>triticumaestivuml.<400>2atggattttccgggagggagcgggaggccgccgccgccgccgcagcagcaccagcaccag60ctgctgccgccgatgacgccgctgccgctcacgcgccagggctcctcggtctactcgctc120acgttcgacgagttccagagcgcgatcggcgggccgggcaaggacttcggatccatgaac180atggacgagctcctccgcaacatctggacggccgaggagtcgcaggccatcggcgccggc240cccaacgccgccgcctcgtcctccgccgcggcggggccggaccacggcggcatccagcgc300cagggctccctcacgctcccccggacgctcagccagaagaccgtcgacgaggtctggcgc360gacatgatgttcttcggagggccctccgcctccgcctccgcggccgccgaggctcccccg420ccggcccagaggcagcagacgctcggggaggtcacgctcgaggagttcctcgtgcgcgcc480ggcgtcgtgcgcgaggacatgccgggcccgccgccgcccgtctcgccggcgcccgtggcc540caggcgccgcctccgcagccgcagatgctgttccctcagagcaacatgtttgctcctatg600gtgaatcctctgtccctggcgaatgggttgatgaccggagcatacggacagggaggaggc660ggtggtggtggtgcgcccgctatggtttcgccgtcgccgacggggaggccggtcatgtcc720aacggctacggcaagatggaaggcctcaacttgtcctcgctgtcgccgccgccgatgccg780tatgttttcagcggcgggctgagggggaggaagccaccggccatggagaaggtggtcgag840aggaggcagcggcggatgatcaagaaccgggagtctgcggcgaggtcgcgccagaggaaa900cagagttacatgatggaattggagactgaggtggcaaaacttaaagagcggaatgaggag960ttgcagagaaaacaggcggagatcctagagaggcaaaagaatgaggtattcgagaaggtt1020agcaggcaagctggacctacctcaaagaggatctgcctgcggaggacgctgacgggccct1080tggtaa1086<210>3<211>1051<212>dna<213>artificialsequence<400>3cctatggtgaatcctctgtccctggcgaatgggttgatgaccggagcatacggacaggga60ggaggcggtggtggtggtgcgcccgctatggtttcgccgtcgccgacggggaggccggtc120atgtccaacggctacggcaagatggaaggcctcaacttgtcctcgctgtcgccgccgccg180atgccgtatgttttcagcggcgggctgagggggaggaagccaccggccatggagaaggtg240gtcgagaggaggcagcggcggatgatcaagaaccgggagtctgcggcgaggtcgcgccag300aggaaacagagttacatgatggaattggagactgaggtggcaaaacttaaagagcggaat360gaggagttgcagagaaaacaggcggagatcctagagaggcaaaagaatgaggtattcgag420aaggttagcaggcaagaattcaagcttacgtcctcccctgcgcggcgcgcaacaagggac480gacgacggcacccagatacaaaaaaaaatggtgatcatccagctctctcaagaaaatatc540aagttcttcagagttcagattacacacactctagcttgaactagtaggcgtgcttgatct600tgatcttaccaagcttttgcctgctaaccttctcgaatacctcattcttttgcctctcta660ggatctccgcctgttttctctgcaactcctcattccgctctttaagttttgccacctcag720tctccaattccatcatgtaactctgtttcctctggcgcgacctcgccgcagactcccggt780tcttgatcatccgccgctgcctcctctcgaccaccttctccatggccggtggcttcctcc840ccctcagcccgccgctgaaaacatacggcatcggcggcggcgacagcgaggacaagttga900ggccttccatcttgccgtagccgttggacatgaccggcctccccgtcggcgacggcgaaa960ccatagcgggcgcaccaccaccaccgcctcctccctgtccgtatgctccggtcatcaacc1020cattcgccagggacagaggattcaccatagg1051当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1