甜茶素、壳聚糖联用在制备抗糖尿病药物中的应用的制作方法
本发明属于抗糖尿病药物领域,具体涉及甜茶素与壳聚糖在制备抗糖尿病药物中的应用。
背景技术:
人口老龄化加剧、生活方式和饮食习惯的改变和快速的城市化导致了代谢综合征和糖尿病的高风险。糖尿病是一种以空腹血糖或餐后血糖升高为特征、以胰岛素分泌受损或敏感所致、累计多脏器损伤的严重代谢性疾病。高血糖症是糖尿病的主要特征,慢性高血糖是可导致氧化应激的增加,长期血糖水平过高可造成活性氧生成的恶性循环,血管内皮细胞的损伤,引起各种并发症的发生。
糖尿病的治疗及其并发症的预防一直被认为是医学界研究的热点问题。患者为了更好的控制血糖水平,往往需要终生服药。目前临床用于治疗的口服药物中应用最为广泛的是双胍类和磺酸类药物,主要通过降低肝脏葡萄糖的输出,促进脂肪细胞和组织细胞对葡萄糖摄取利用和改善胰岛素抵抗作用,或刺激胰岛β细胞释放胰岛素,从而降低血糖。然而长期用药会带来胃肠道不良反应、低血糖等,对肝、肾功能不全的患者,以及妊娠期、哺乳期妇女带来不良反应,限制了用药人群。
甜茶作为一种蔷薇科悬钩子属落叶灌木,主要生长在我国广西省境内。甜茶叶中含有的甜茶素是一种无毒低热值高甜度的非糖甜味剂。在食品工业生产与加工过程中,甜茶素可作为糖类甜味剂的替代品使用,有利于减少能量的摄入,降低肥胖、代谢综合征等疾病发生。
近年来,有研究表明甜茶素具有调节血糖、血脂的潜在功效。田翠平等人发现对链脲佐菌素(streptozotocin,stz)致糖尿病模型鼠给予甜茶素能够促进胰岛素分泌,降低实验组大鼠的血糖值;对正常小鼠进行甜茶素干预能够降低血糖水平,抑制l-a-丙氨酸引起的糖异生作用。梁小庆等人通过对四氧嘧啶(alloxan)致高血糖大鼠给予甜茶素灌胃后发现,甜茶素不仅会减轻胰岛细胞的损伤,促进胰岛素释放,还可以抑制胰高血糖素的分泌,维持正常的脂代谢。
壳寡糖是高分子物质壳聚糖经物理、化学和生物酶解等方式降解形成的一种可直接溶于水并可被机体吸收的低聚糖,是一种n-乙酰-d-氨基葡萄糖通过β-1,4-糖苷键连接而成线性多糖。具有生物兼容性好、易于降解、且具有无毒和抗菌等特点而广泛应用于生物医学和制药领域。研究表明,对糖尿病大鼠进行壳寡糖干预后,血糖水平明显下降,血清胰岛素水平升高,tc和tg水平下降。刘冰等人发现原代培养的胰岛细胞和胰岛β细胞系nit-1细胞在给予壳寡糖后,显示壳寡糖可以促进胰岛细胞增殖,并且促进胰岛素分泌;同时在stz诱导的实验性糖尿病大鼠中,壳寡糖可以减轻肝细胞脂肪变性,修复受损的肝细胞,并且增强肝脏对胰岛素的敏感性。祝君梅等人以尾静脉注射四氧嘧啶的方法造模后,中、高剂量(300mg/kg、500mg/kg)的壳寡糖干预一段时间,可以明显降低糖尿病大鼠的血糖值。
国内外关于甜茶素和壳寡糖单独作用对于糖尿病治疗及改善作用和机制的研究有很多,但未见对二者联合用药的作用效果的探究。另外大多集中在对血糖的检测以及各生化指标的测定,而对糖尿病引起的并发症及多器官病变的研究较为空白。
技术实现要素:
本发明通过用不同剂量的甜茶素、壳寡糖单独作用以及两者联合分别干预stz造模的实验性糖尿病小鼠,对小鼠的血糖、血脂以及其他血液生化指标进行测定,并制作小鼠的肝、肾、胰腺的病理切片,于镜下观察其病理学改变,各组间进行比较,评价甜茶素、壳寡糖以及联合各剂量组对糖尿病小鼠的作用效果,研究结果表明甜茶素与壳聚糖联合用药,能够实现有效降低血糖生化指标、胰岛素、血脂水平,恢复肝脏及肾脏功能,为协助治疗糖尿病的临床应用提供理论依据。
本发明第一方面,提供一种甜茶素的浸提方法,称取除杂后的甜茶粉末,加入提取溶剂于微波消解仪中进行提取,提取完成后离心将上清液分离,加入提取溶剂继续提取。其中,提取溶剂的ph值为2~4.
优选的,提取溶剂的ph值为3。
优选的,上述除杂后的甜茶粉末制备方法如下:取适量甜茶叶,用料理机粉碎后过筛,将甜茶粉置于索式提取器中,加入石油醚煮沸提取,除脂溶性杂质和色素。取出固体样品自然风干。
进一步优选的,上述制备方法中,取甜茶叶用料理机粉碎后过50~70目筛,更为优选的,过60目筛。其中10g甜茶粉需要加入150~200ml石油醚提取,煮沸时间为25~35min。更为优选的,提取次数为3次。
优选的,上述微波消解仪的工作功率为1000~1400w;更优选的,为1200w。
优选的,上述提取的时间为25~35min;更优选的,为30min,提取3次。
优选的,上述甜茶粉末与提取溶剂的比例为1g:30-50ml;更为优选的,为1g:40ml。
本发明第二方面,提供上述浸提方法得到的甜茶素。
本发明第三方面,提供一种组合物,该组合物由甜茶素与壳聚糖组成。
优选的,组合物中的甜茶素为上述浸提方法制备得到的甜茶素。
优选的,上述组合物中,甜茶素剂量为4.12~16.48mg/kg,壳聚糖的剂量为6.87~27.47mg/kg。
进一步优选的,上述组合物中,甜茶素与壳聚糖的质量比为3:5。
本发明第四方面,提供甜茶素与壳聚糖联用在制备抗糖尿病药物中的应用。
本发明第五方面,提供甜茶素与壳聚糖联用在制备升胰岛素药物中的应用。
本发明的第六方面,提供甜茶素与壳聚糖联用在制备修复肾功能药物中的应用,优选的,该修复肾功能药物为针对糖尿病患者的修复肾功能药物。
本发明第七方面,提供甜茶素与壳聚糖联用在制备抗脂肪肝药物中的应用。
本发明的有益效果
1.现有技术中多采用大孔树脂吸附的方法分离和提取甜茶素,能够收到良好的提取效果,但本领域公知,大孔树脂分离耗时长、工艺复杂。本发明针对甜茶素的提取,提供了一种采用微波浸提从甜茶粉末中提取甜茶素的方法,大大节约了提取时间,提取工艺简单,提取率可达到92.43%。并且在本发明的研究过程中发现:微波浸提时,提取溶剂的ph值对提取率有较大的影响。
2.现有技术中对于壳聚糖与甜茶素对糖尿病的改善效果已有文献公开,但现有技术中并未公开将壳聚糖与甜茶素联用用于糖尿病的治疗。本发明的研究过程中发现,甜茶素与壳聚糖联用,能够实现调节血糖指标,降低血脂,改善肝、肾、胰腺病理状态的综合治疗效果,大于单一成分治疗的加和。单独使用低剂量的甜茶素及壳聚糖治疗糖尿病小鼠时,难以收到良好、综合的降血糖效果。
附图说明
构成本申请的一部分的说明书附图用来提供对本申请的进一步理解,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。
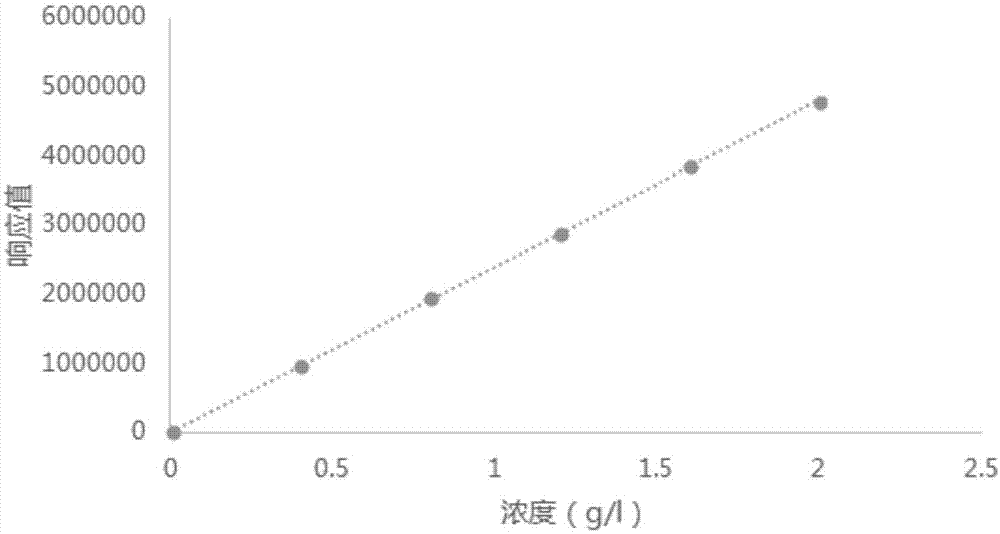
图1为甜茶素标准曲线图;
图2为肝脏病理组织切片染色图;
其中图2a-2c分别为模型对照组、标准对照组、空白对照组。图2d-2f分别为联合用药高、中、低剂量组。
图3为肾脏病理组织学切片染色图;
其中图3a-3c分别为模型对照组、标准对照组、空白对照组。图3d-3f分别为联合用药高、中、低剂量组。
图4为胰腺病理组织学切片染色图;
其中图4a-4c分别为模型对照组、标准对照组、空白对照组。图4d-4f分别为联合用药高、中、低剂量组。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
术语解释部分:
fbg(fastingblood-glucose):空腹血糖;
ogtt(oralglucosetolerancetest):口服糖耐量试验;
hg(hepaticglycogen):肝糖原;
bun(ureanitrogen):血尿素氮;
cre(creatinine):肌酐;
ins(insulin):胰岛素;
hba1c(hemoglobina1c):糖化血红蛋白;
tc(totalcholesterol):总胆固醇;
tg(triglyceride):甘油三酯;
hdl(highdensitylipoprotein):高密度脂蛋白;
ldl(lowdensitylipoprotein):低密度脂蛋白;
ast(aspartateaminotransferase):谷草转氨酶;
alt(alanineaminotransferase):谷丙转氨酶;
正如背景技术所介绍的,现有技术中存在尚未公开将壳聚糖与甜茶素联用于糖尿病的研究,为了解决如上的技术问题,本申请对于壳聚糖与甜茶素联用对糖尿病的治疗效果,进行了研究。
为了使得本领域技术人员能够更加清楚地了解本申请的技术方案,以下将结合具体的实施例与对比例详细说明本申请的技术方案。
实施例1甜茶素的提取方法研究
1材料
1.1主要试剂
甜茶素标准品(纯度98%,购于美康生物科技股份有限公司),甜茶叶(产自广西金秀县),纤维素酶购于北京索莱宝科技有限公司,乙腈(色谱纯)、石油醚(分析纯)、盐酸(36.0~38.0%)、硝酸(65.0~68.0%)、硫酸(95.0~98.0%)均购于国药集团化学试剂有限公司。
1.2主要仪器
高效液相色谱仪(l-2130,日本hitachi公司)、料理机(jyl-c012,九阳股份有限公司)、高速离心机(5424型,德国eppendorf公司)、超声(kq-500de,昆山市超声仪器有限公司)、微波消解仪(意大利milestone公司)。
2方法
2.1样品前处理
取适量甜茶叶,用料理机粉碎后过60目筛,称取10g甜茶粉,分两次于索式提取器中,加入150~200ml石油醚煮沸提取30分钟,每次提取3遍,除脂溶性杂质和色素。取出样品于通风橱自然风干。
2.2微波提取法
准确称取除杂后的甜茶粉末0.50g,按固液比1:40加水作为提取溶剂于微波消解仪中进行提取。在原料质量一定的情况下,用l9(34)正交设计试验对浸提液的ph值、微波炉的功率和浸提时间三个因素进行筛选,探索微波提取最佳条件。
表1-1微波提取法因素水平
提取完成,待冷却后,取离心后的上清液,残渣加入溶剂继续提取,共提取3次。测定提取液中甜茶素含量并计算浸提百分率。
2.3甜茶素含量测定
用高效液相色谱仪测定甜茶素的含量,具体方法参考gb8027-2014。色谱条件:c18反向色谱柱,250mm×4.6mm,粒径5μm。流动相:乙腈:磷酸钠缓冲液=32:68。流动相流速:1ml/min。检测波长:210nm。进样量:10μl。柱温:40℃。
2.3.1标准曲线绘制
精密称取0.0200g甜茶素标准品于10ml容量瓶中,以30%的乙腈水溶液溶解,即得到2.0g/l的溶液,再分别对其稀释后,配制成1.6g/l、1.2g/l、0.8g/l、0.4g/l的标准溶液,溶剂作为空白,在210nm处测定其峰面积。
2.4统计学分析
通过标准曲线计算样品中甜茶素的含量,计算浸提率,用spss20.0进行统计学分析。
3结果
3.1甜茶素标准曲线
用高效液相色谱法测定甜茶素的含量,横坐标为甜茶素浓度(g/l),纵坐标为测定的峰面积。根据标准曲线得到回归方程:y=2e+06x+6982.6,相关系数为:r=0.99988。结果如图1所示。
3.2微波提取法
本发明采用正交实验设计对微波提取法的试验参数进行研究,正交试验涉及结果如下表所示。
表1-2微波提取法正交试验及结果
以测定的甜茶素浸提率为参考指标,由表中结果可知,浸提液ph值和微波消解仪功率对提取率有明显的影响(p<0.1),其中ph值的影响更为显著(p<0.05),浸提时间对提取率的影响并不显著(p>0.05)。极差分析结果表明,各因素对浸提率的影响大小为ph值>功率>浸提时间。结果显示微波提取法最优浸提条件为a3b3c2,即在浸提液ph值等于3,以微波消解仪功率在1200w,提取30分钟,浸提率最高可达92.43%。
实施例2甜茶素与壳聚糖联用对糖尿病小鼠模型的治疗效果
1材料
1.1实验动物及饲料
spf级昆明种雄性小鼠310只,体重在26±2g,山东大学实验动物中心提供。大小鼠维持饲料:北京科澳协力饲料有限公司提供。
1.2主要试剂
糖化血红蛋白试剂盒、胰岛素试剂盒、肝糖原试剂盒均购于南京建成生物工程研究所;链脲菌佐素购于北京索莱宝科技有限公司;甜茶素购于西安天丰生物科技有限公司;壳寡糖购于山东卫康生物医药科技有限公司;二甲双胍购于北京京丰制药有限公司;生理盐水购于山东华信制药集团股份有限公司;浓硫酸、葡萄糖购于国药集团化学试剂有限公司。
1.3主要仪器
多功能酶标仪(tecaninfinite200pro序列,瑞士tecan公司)、数显电热恒温水箱(8302型,北京市长风仪器仪表有限公司)、低温离心机(5430r,德国eppendorf公司)、旋涡混匀器(g560e,美国scientificindustries公司)、血糖仪(三诺生物传感股份有限公司),轮转式切片机(rm2235型,leica公司)、显微镜(dx45型,olympus公司)。
2方法
2.1糖尿病模型小鼠的制备
将小鼠适应性喂养5天后,随机抽取13只小鼠作为空白对照组。剩余297只小鼠用于制备糖尿病模型。动物禁食24h后,按65mg/kg一次性腹腔注射stz溶液(临用现配),正常摄食饮水7d后,禁食不禁水5h,尾静脉取血测空腹血糖(fbg),将血糖值在14.0-25.0mmol/l的小鼠视为高血糖小鼠。
2.2实验动物的处理
按照随机数字表法,根据小鼠体重和fbg分为11组,即:(1)甜茶素高剂量组(300mg/kg/d.bw)、(2)甜茶素中剂量组(150mg/kg/d.bw)、(3)甜茶素低剂量组(75mg/kg/d.bw)、(4)壳寡糖高剂量组(500mg/kg/d.bw)、(5)壳寡糖中剂量组(250mg/kg/d.bw)、(6)壳寡糖低剂量组(125mg/kg/d.bw)、(7)联合高剂量组((甜茶素150mg+壳寡糖250mg)/kg/d.bw)、(8)联合中剂量组((甜茶素75mg+壳寡糖125mg)/kg.bw)、(9)联合低剂量组((甜茶素37.5mg+壳寡糖62.5mg)/kg.bw)、(10)标准对照组(二甲双胍150mg/kg.bw)、(11)模型对照组(生理盐水)。各组试剂按如上剂量用10ml生理盐水配制且均现用现配,以灌胃量0.1ml/kg.bw对所有小鼠进行连续12w的灌胃操作,期间小鼠自由进食摄水,观察记录小鼠每日的生存状态,并记录其饮水量。于灌胃4w、8w、12w称量小鼠体重。
口服糖耐量(ogtt)测试于实验结束后进行。摘眼球取血先取0.3~0.5ml血液于乙二胺四乙酸二钠(edta)抗凝离心管,迅速充分震荡后于-70℃冰箱保存;再在普通离心管中取0.8~1ml血液,4℃保存2小时后离心,取上清液于-70℃冰箱保存。之后处死小鼠,取肝脏、胰腺、肾脏做病理切片,在显微镜下观察。
2.3指标的测定
2.3.1一般状态观察
观察小鼠的一般生存状况,包括进食量、饮水量、体型体态、毛发色泽、精神状态、皮肤情况等,发现异常及时记录。
2.3.2空腹血糖测定
实验小鼠禁食不禁水5h,碘棉球消毒尾部,用采血针刺破尾静脉,弃掉第一滴血后,用血糖仪测定血糖值并记录数据,测量完成后用棉球止血。
2.3.3口服糖耐量
12w后对各组小鼠进行ogtt试验,禁食不禁水5h,各组小鼠分别给予相应剂量的受试物。15~20分钟后经口给予2.0g/kg.bw葡萄糖溶液,测定0h、0.5h、1h、2h尾静脉血糖,按下列公式计算曲线下面积:
血糖曲线下面积=1/4×0h血糖值+1/2×0.5h血糖值+3/4×1h血糖值+1/2×2h血糖值
2.3.4ins测定方法
小鼠血清胰岛素用生物素双抗体夹心酶联免疫吸附法测定,具体步骤按照说明书进行操作。
2.3.5hg测定方法
取75mg肝组织于试管中,沸水煮20分钟后流水冷却,再加入双蒸水配制成糖原检测液。按照试剂盒说明书利用酶标仪测定吸光度。
2.3.6ast的测定方法
用全自动生化分析仪测定血清中的以上指标,按照试剂盒说明书操作。
2.4小鼠肝脏、肾脏、胰腺、眼球病理切片
低温下处死动物后,取其肝脏、肾脏、胰腺浸泡在10%的甲醛中固定,脱水后进行浸蜡、包埋、切片,进行he染色后(脱蜡复水、染色、脱水、透明、固封)镜下观察。
2.5统计分析
用spss20.0进行统计学分析,服从正态分布的连续性变量用均数±标准差
3.结果
3.1小鼠造模情况观察
表2-1-1小鼠的基本状况
与正常组相比,糖尿病造模小鼠出现三多一少症状,小鼠毛发稀疏、光泽度下降,垫料潮湿有异味,个别小鼠出现口鼻轻微出血、腹水、极度消瘦等情况。与模型对照组相比,标准对照组、甜茶素各剂量组、壳寡糖各剂量组以及联合作用各剂量组的糖尿病小鼠生存状况有所提高,尤其是中、高剂量组患病小鼠的皮肤毛色、精神状态以及垫料的情况都有明显改善。
3.2血糖水平
表2-2-1高剂量组小鼠空腹血糖水平
a与空白对照组相比p<0.05;b与模型对照组相比p<0.05;c与标准对照相比p<0.05。
表2-2-2中剂量组小鼠空腹血糖水平
a与空白对照组相比p<0.05;b与模型对照组相比p<0.05;c与标准对照相比p<0.05。
表2-2-3低剂量组小鼠干预前后空腹血糖水平
a与空白对照组相比p<0.05;b与模型对照组相比p<0.05;c与标准对照相比差p<0.05)。3.2口服耐糖量水平
表2-3-1高剂量组小鼠口服糖耐量水平
a与空白对照组相比p<0.05;b与模型对照组相比p<0.05;c与标准对照相比p<0.05。
联合高剂量组空腹血糖值、糖耐量曲线下面积均高于空白对照组,低于模型对照组(p<0.05);与标准对照组相比,联合作用高剂量组降糖比较低,口服糖耐量曲线下面积升高;与甜茶素高剂量组相比降糖比较高;与壳寡糖高剂量组相比,降糖作用明显较好,血红蛋白水平和糖耐量曲线下面积均显著降低(p<0.05)。
表2-3-2中剂量组小鼠口服糖耐量水平
a与空白对照组相比p<0.05;b与模型对照组相比p<0.05;c与标准对照相比p<0.05。
联合中剂量组空腹血糖水平、糖耐量曲线下面积均高于空白对照组,低于模型对照组(p<0.05);与标准对照组相比,联合作用中剂量组降糖比较低、口服糖耐量曲线下面积显著升高(p<0.05);与壳寡糖中剂量组相比,降糖作用明显较好,血红蛋白水平和糖耐量曲线下面积均显著降低(p<0.05)。
表2-3-3低剂量组小鼠口服糖耐量水平
a与空白对照组相比p<0.05;b与模型对照组相比p<0.05;c与标准对照相比p<0.05。
联合低剂量组空腹血糖水平和糖耐量曲线下面积均高于空白对照组,糖耐量曲线下面积低于模型对照组(p<0.05);与标准对照组相比,联合作用低剂量组糖化血红蛋白水平和口服糖耐量曲线下面积显著升高(p<0.05);与甜茶素低剂量组相比,糖化血红蛋白水平显著升高(p<0.05);与壳寡糖低剂量组相比,控制血糖作用明显较好,血红蛋白水平和糖耐量曲线下面积均显著降低(p<0.05)。3.3血清胰岛素
表2-4-1高剂量组小鼠血清胰岛素水平
a与空白对照组相比p<0.05;b与模型对照组相比p<0.05;c与标准对照相比p<0.05。
联合作用高剂量组血清胰岛素水平显著低于空白对照组和标准对照组(p<0.05),高于模型对照组(p<0.05)。
表2-4-2中剂量小鼠血清胰岛素水平
a与空白对照组相比p<0.05;b与模型对照组相比p<0.05;c与标准对照相比p<0.05。
联合作用中剂量组血清胰岛素水平显著低于空白对照组和标准对照组(p<0.05),高于模型对照组(p<0.05)。
表2-4-3低剂量组小鼠胰岛素水平
a与空白对照组相比p<0.05;b与模型对照组相比p<0.05;c与标准对照相比p<0.05。
联合作用低剂量组血清胰岛素水平显著低于空白对照组和标准对照组(p<0.05),高于模型对照组(p<0.05)。
3.4肝功能水平测定
表2-5-1高剂量组小鼠肝糖原、转氨酶水平
a与空白对照组相比p<0.05;b与模型对照组相比p<0.05;c与标准对照相比p<0.05。
联合作用高剂量组hg水平显著高于模型对照组,低于标准对照组和空白对照组(p<0.05)。联合作用高剂量组ast水平高于模型对照组(p<0.05)。
表2-5-2中剂量小鼠肝糖原、转氨酶水平
a与空白对照组相比p<0.05;b与模型对照组相比p<0.05;c与标准对照相比p<0.05。
表2-5-3低剂量组小鼠肝糖原、转氨酶水平
a与空白对照组相比p<0.05;b与模型对照组相比p<0.05;c与标准对照相比p<0.05。
联合作用低剂量组hg水平低于标准对照组和空白对照组(p<0.05)。联合作用低剂量组ast水平高于标准对照组和空白对照组(p<0.05);与模型对照组相,ast水平显著降低(p<0.05)。
联合作用中剂量组hg水平显著高于模型对照组,低于标准对照组和空白对照组(p<0.05)。联合作用中剂量组ast水平高于空白对照组和标准对照组(p<0.05)。
4.病理切片染色结果
肝脏切片结果图2所示:其中,模型对照组(图2a):肝细胞排列极为杂乱,肝索模糊不清,视野内多数肝细胞出现脂肪变性,少数肝细胞核被挤压明显,部分细胞出现空泡样改变。
标准对照组(图2b):肝细胞排列较为规整,肝索较为清晰,视野内仅见个别细胞出现脂肪变性,未见脂肪空泡。
空白对照组(图2c)肝小叶结构完整,肝索清晰,肝细胞排列规整,胞核大小一致,未见细胞变性。
其中联合作用组低剂量(图2f)组肝细胞排列紊乱,肝索模糊,视野内约一半以上肝细胞出现脂肪变性,个别细胞出现空泡样改变,个别肝细胞核被挤压;中、高剂量组与之相比损伤较轻,未见空泡样变性,中剂量组(图2e)仍可见少数细胞出现脂肪变性,高剂量组(图2f)肝细胞排列较为规整,肝索清晰,仅个别细胞出现脂肪变性。
肾脏切片结果如图3所示:模型对照组(图3a):肾小球体积显著增大,系膜基质显著增生,内部结构不清晰,肾间质可见大量炎细胞浸润;肾小管上皮细胞水肿,细胞核被挤压到边缘,个别细胞出现变性。
标准对照组(图3b):肾小球结构较为清晰,体积增大程度较低,肾间质可见少量中性粒细胞浸润,肾小管上皮细胞可见水肿,未见变性。
空白对照组(图3c):肾小球结构完整清晰,体积大小正常,肾小管毛细血管基底膜分布均匀,肾小管细胞未见变性,肾小官腔未见渗出,未见炎性细胞浸润。
联合作用组:三组肾小球结构较为清晰,均未见体积明显增大,肾间质有少量中性粒细胞浸润,肾小管上皮细胞水肿,未见细胞变性;低剂量组(图3f)可见系膜基质轻度增生。
胰腺切片结果如图4所示:模型对照组(图4a):胰岛形状不规则、面积小,细胞数量少,极少数细胞出现空泡样变性,胞核固缩明显,血管管腔大小不一。
标准对照组(图4b):视野范围内胰岛数目较多,形状不规则,细胞数目多、排列较为规整,胰岛内可见少量炎细胞浸润,血管管腔大小基本一致,未见扩张。
空白对照组(图4c):正常组胰腺病理切片胰岛结构完整,胰岛细胞较多排列规整,血管壁均匀未见扩张。
联合作用组:中、低剂量组胰岛面积小、形状较为规则,细胞数目较少,极少数细胞出现空泡样变性,低剂量组可见部分胞核大小不一;高剂量组(图4d)胰岛细胞数量多、排列规整,可见少量炎细胞浸润,未见细胞变性。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!