一种基于多支杂交链式反应的核酸检测方法及应用与流程
本发明涉及生物检测技术领域,具体涉及一种基于多支杂交链式反应的核酸检测方法及其用于液体活检中药物/生物小分子、dna、rna、抗原/抗体、酶、外泌体和细胞中的精准分析检测。
背景技术:
精准医学分析中的液体活检是当前热门的检测技术之一,血清、血浆或血液中特定dna,rna,药物/生物小分子,蛋白,外泌体以及细胞含量的变化,可用于早期疾病筛查与诊断、疾病术后复发判断以及药代水平监测。当前基因测序已成功应用于癌症早期筛查,通过检测基因突变预判人群患癌症的几率,该方法具有较高的准确率,然而该技术当前的检测成本仍较高,不利于广泛推广使用,因此迫切需要简便、低成本、高准确性的传感器研制。
随着dna纳米技术的不断发展,涌现出了各种dna纳米结构材料用于检测人体外周血中的疾病相关dna,rna等,由于人体外周血中的靶标分子含量普遍较低,当前研制的传感器常用滚环放大法(rollingcircleamplification,rca)(lizardip.m.,huangx.x.,zhuz.r.,wardp.b.,thomasd.c.,wardd.c.,nat.genetics.,1998,19,225-232.)和杂交链式反应(hybridizationchainreaction,hcr)(dirksr.m.,piercen.a.,p.natl.acad.sci.u.s.a.,2004,101,15275-15278.)用于放大输出检测信号,检测各种生物靶标分子。hcr相比rca不需要额外加入聚合酶,且在室温下就能发生反应,产物是具有重复单元的双链长链结构。
申请公布号为cn106093438a的专利文献公开了一种利用杂交链反应便携式检测血管内皮生长因子的方法,在聚乙烯微孔上,将vegf与适配体和抗体形成抗体-蛋白-适配体的夹心结构,在适配体的末端包含有一段18碱基的延长序列,然后利用合成的两端蔗糖转移酶标记的辅助探针,这两端酶标探针以18碱基的延长序列为模板,引发链杂交扩增反应,从而在微孔上固定大量的蔗糖转移酶,这些酶催化蔗糖转化为葡萄糖,利用血糖仪指示产生的葡萄糖浓度,进而测出待分析目标物中血管内皮生长因子的含量。
杂交链式反应已被广泛应用于各类生物靶标分子的检测,当前存在的主要瓶颈缺陷有以下几点:
a.hcr在溶液环境中对比在界面的杂交效率更高,然而溶液中常用的信号输出方法如荧光、显色、化学发光等,其信号输出灵敏度相对界面技术较差;信号输出灵敏度相对更高的电化学、界面荧光增强、拉曼光谱和表面等离子共振等技术,又需要hcr在界面进行,降低了hcr的杂交效率。
b.hcr中使用的发卡探针不能通用,随着检测对象的改变而改变。
c.hcr中使用的发卡探针稳定性随着检测对象的改变而改变,发卡结构稳定性较差时,容易自身引发杂交链式反应,降低检测过程中的信噪比。
d.界面引发杂交链式反应的传感器一般灵敏度更高,但通常需要多步骤进行靶标检测。
e.不能调控靶标的有效检测浓度范围。
当前发展出的利用杂交链式反应结合酶催化的方法可以实现dna和rna几百个甚至几十个拷贝的检测灵敏度,然而这些方法均较为繁琐,需要多步骤处理实现靶标分子的检测,使这些方法局限于实验室的理想检测环境,难以应用于临床检测。
技术实现要素:
本发明的目的在于提供一种基于多支杂交链式反应的核酸检测方法,利用三条发卡探针对目标dna进行单向或双向杂交链式反应,形成多支杂交链式反应产物,再利用界面捕获,信号放大输出,进而实现靶标分子的检测,以解决传统杂交链式反应在靶标分析中的部分缺陷,如检测灵敏度低、杂交效率差、实验步骤繁琐、检测探针不能通用、动态检测范围不可控等。
为实现上述目的,本发明采用如下技术方案:
一种基于多支杂交链式反应的核酸检测方法,包括以下步骤:
(1)将待测样本预处理得到含有目标dna的溶液,所述目标dna包含a序列;
(2)合成发夹探针:根据目标dna序列设计发夹探针h1、h2、h3,h1包括h1b、h1a’、h1c三个部分,其中h1b的部分序列与h1c的部分序列互补成双链作为h1发夹结构的茎部,h1a’为a序列的互补序列;h2包括h2b’、h2d、h2c’三个部分,其中h2b’的部分序列和h2c’的部分序列互补成双链作为h2发夹结构的茎部,h2b’与h1b互补,h2c’与h1c互补;h3包括h3e、h3f、h3e’、h3g四个部分,其中h3e与h3e’互补成双链作为h3发夹结构的茎部,h3f形成发夹结构的环部,h3g为h3的3’端单链粘性末端,h3e’和h3g与h2d互补;
或者h1包括a和b两个部分,其中a的部分序列与b的部分序列互补成双链作为h1发夹结构的茎部,a为a序列的互补序列;h2包括a’、h2d和b’三个部分,其中a’的部分序列与b’的部分序列互补成双链作为h2发夹结构的茎部,a’与a互补,b’与b互补;h3的设计同上;
所述h2或h3上修饰有信号标记;
(3)基于多支杂交链式反应进行核酸检测:往含有目标dna的溶液中加入h1、h2、h3,混合,室温下反应,形成多支杂交链反应产物,再将金界面上自组装有dna探针的载体置于反应溶液中,所述dna探针具有与h3中的h3f及h3e的部分序列互补配对的序列,dna探针与h3杂交将多支杂交链反应产物捕获到金界面上;然后分析金界面上的信号标记变化测定溶液中目标dna的含量,进而计算出待测样本中目标物的含量。
本发明检测方法的原理如下:
在目标dna存在下,可以识别打开发卡h1(根据设计可以将h1环部分碱基或粘性末端方向的碱基作为靶标特异性识别位点),从而双向或单向引发杂交链式反应,h2被打开后,环部位碱基变为单直链,可以继续打开h3,使杂交链式直链产物变为多支长链产物,通过多支单链与任意界面组装的探针杂交,可以高效的将hcr产物多价捕获于界面。在各发卡探针上修饰荧光信号标记或电化学信号标记,界面的信号增量与靶标的浓度正相关,根据荧光强度或电化学信号判断核酸浓度。通过构建标准检测曲线,实现未知样品靶标浓度检测。
由于杂交链式反应是在溶液体系中进行,使得杂交效率显著提升,再通过多价捕获方式高效地将杂交反应产物捕获到界面上,通过分析信号标记变化实现超灵敏核酸检测。
针对发夹探针的设计,本发明提供了两种方案,方案一:在传统发夹结构h1的中间位置插入与目标dna互补的序列,在传统发夹结构h2的中间位置插入目标dna互补链以外的一段碱基序列,该段碱基序列与h3互补。具体地:h1包括h1b、h1a’、h1c三个部分,h1a’为a序列的互补序列,h1b和h1c并非完全互补配对,h1b包括b1和b2,h1c包括c1和c2,b2与c2互补成双链作为h1发夹结构的茎部,h1a’和c1作为发夹结构的环部,b2的长度小于h1a’;h2包括h2b’、h2d、h2c’三个部分,h2b’包括b2’和b1’,h2c’包括c2’和c1’,b2’与c2’互补成双链作为h2发夹结构的茎部,b1’和h2d作为发夹结构的环部,h2b’与h1b互补,h2c’与h1c互补;h3包括h3e、h3f、h3e’、h3g四个部分,h3e’和h3g与h2d互补。
目标dna与h1的环序列中的h1a’互补,打开h1后暴露出茎部的h1b、h1c,h1b、h1c分别引发hcr反应,实现双向hcr反应。h2发夹结构变为直链后,中间的h2d可以通过toehold链取代杂交打开h3,形成多支杂交链反应产物。采用该方案的设计,在检测不同目标核酸序列时,只需要更改h1中的识别序列h1a’即可,h2和h3可以通用,在h2或h3修饰信号标记,信号探针的公用可以极大节省检测成本。
方案二:采用传统发夹结构h1,h2为在传统发夹结构的中间位置插入目标dna互补链以外的一段碱基序列,与h3互补。具体地:h1包括a和b两个部分,a包括a1和a2,b包括b1和b2,a2和b2互补成双链作为h1发夹结构的茎部,b1作为发夹结构的环部,a与a序列互补;h2包括a’、h2d和b’三个部分,a’包括a2’和a1’,b’包括b2’和b1’,a2’和b2’互补成双链作为h2发夹结构的茎部,a1’和h2d作为发夹结构的环部,a’与a互补,b’与b互补;h3的设计同上。
目标dna与h1的茎部序列a互补,打开h1后暴露出另一端的b引发hcr反应,实现单向hcr反应。采用该方案的设计,在检测不同目标核酸序列时,h1和h2中的识别序列均需更改,h3可以通用。
上述两种方案的h3的设计是相同的,h3中h3e’和h3g与h2中的h2d互补杂交,h3f和h3e与界面上dna探针互补配对,实现杂交链式反应产物的界面捕获。
由于h3中的h3e’和h3g与h2d互补,那么h3e的序列是与h2的环序列h2d的部分序列是一致的,因此,dna探针是有可能会h2互补杂交的,为降低dna探针打开h2发夹结构的几率,设计dna探针仅与h3e的部分序列互补配对,并增加h3环序列h3f的碱基,保证dna探针与h3的结合能大于dna探针与h2的结合能。
基于上述发夹探针的设计,本发明提供的检测方法可以在一个反应体系中进行,只需一步即可实现靶标的识别、界面多价捕获及信号放大输出。本发明研究表明,在没有目标dna存在时,三个发夹探针在杂交溶液中能保持自身稳定性。
所述的待测样本为dna、rna、药物/生物小分子、抗原/抗体、酶、外泌体或肿瘤细胞。本发明提供的检测方法除了检测dna、rna,还可以检测其他生物靶标分子,步骤(1)中,通过核酸适配体或dna酶的预处理,释放出与靶标分子含量对应的目标dna。本领域技术人员可以根据具体靶标分子选择相应的预处理方法,如核酸适配体或与靶标分子部分互补的双链探针与靶标分子结合后,释放的互补链即为所述的目标dna,用于引发杂交链式反应。
检测方法中对于杂交溶液的缓冲体系没有特定要求,通常为高盐、中性稍偏碱性的缓冲条件,该条件有利于杂交反应。作为优选,步骤(1)中,所述的含有目标dna的溶液的缓冲体系为spsc溶液。spsc溶液组成为:50mmna2hso4/nah2so4,1mnacl,ph7.5。
步骤(2)中,发夹探针h1、h2、h3可以为dna、rna、肽核酸(pna)或锁核酸(lna)。
所述的dna探针也可以为肽核酸或锁核酸。
研究表明,在h1中增加茎部分杂交的碱基数,可以提高发卡结构的稳定性,使目标核酸识别打开发卡结构的能力减弱,且h1参与杂交链式反应的活性也同样减弱,因此可以将目标核酸的动态检测范围往高浓度调节,只有更高的浓度才可以产生同等的信号变化。
当在检测系统中加入可与h1茎部互补的辅助链时,可以辅助靶标核酸打开h1发卡结构,增加h1的识别活性以及参与杂交链式反应的活性,从而可以将核酸的动态检测范围往低浓度调节,产生同等信号变化需要更少的目标核酸。
因此,通过改变h1的自由能,或加入辅助链,可以精确调控h1与目标dna结合的能力,从而调控dna动态检测范围。
本领域技术人员可以根据具体情况对h1、h2、h3序列进行替换、缺失或添加碱基等设计操作,同等达到上述多支与单/双向杂交链式反应。作为优选,步骤(2)中,h1b、h1a’、h2d序列长度均为18-28bp。考虑到成本及稳定性等因素,这个长度范围较适合。
更为优选,h1b、h1a’、h2d序列长度均为24bp,其中b1、c1、b1’、c1’、a1、b1、a1’、b1’为6bp,b2、c2、b2’、c2’、a2、b2、a2’、b2’为18bp。h3由两个18个碱基的茎部h3e、h3e’,8个碱基的环部h3f和6个碱基的粘性末端h3g组成。对应的dna探针由20个碱基组成,其中8个与h3f互补,剩余12个与h3e互补。
作为优选,所述的信号标记为生物素或荧光基团。
作为优选,h1、h2、h3的工作浓度为1nm-100μm。
当h2或h3上标记有生物素(biotin)时,杂交链反应结束,往反应溶液中加入过量辣根过氧化物酶修饰的链霉亲和素(sa-hrp),与多支杂交链反应产物中的生物素结合,再将界面上自组装有dna四面体顶端探针的金电极置于反应溶液中对多支杂交链反应产物进行捕获,然后将金电极取出充分清洗后置于含双氧水的tmb底物溶液中,检测辣根过氧化物酶催化tmb还原而产生催化还原电流。催化还原电流与电极界面的辣根过氧化物酶数量正相关,同时辣根过氧化物酶数量与目标dna正相关,因此可以通过检测催化还原电流变化定量分析待测溶液中目标dna。具体地,绘制标准曲线,进而根据标准曲线进行定量分析。
作为优选,在100μl含有目标dna的spsc溶液中加入100nm的h1、h2-biotin和h3,室温下反应2.5h,反应体系中sa-hrp的浓度为2.5μg/ml。在上述条件下,可获得最佳信噪比。
当h2或h3上标记有fam-dabcyl荧光猝灭基团时,当溶液中没有目标dna存在时,荧光和淬灭基团距离约为2nm,fam发射的荧光被近距离淬灭,当目标dna加入引发多支杂交链式反应后,fam与dabcyl的距离增加到约10.2nm,fam发射的荧光显著增强,通过荧光开关实现目标dna检测。
作为优选,在100μl含有目标dna的spsc溶液中加入50nm的h1、h2-biotin和h3,室温下反应2.5h。在上述条件下,杂交反应获得几乎接近饱和的荧光强度。
步骤(3)中,dna探针与反应溶液在室温下孵育30min,可获得最佳信噪比。
本发明的另一个目的是提供一种基于多支杂交链式反应的生物靶标分子检测传感器,所述生物靶标分子经预处理后得到包含a序列的目标dna,所述的检测试剂盒包括发夹探针h1、h2、h3,h1包括h1b、h1a’、h1c三个部分,其中h1b的部分序列与h1c的部分序列互补成双链作为h1发夹结构的茎部,h1a’为a序列的互补序列;h2包括h2b’、h2d、h2c’三个部分,其中h2b’的部分序列和h2c’的部分序列互补成双链作为h2发夹结构的茎部,h2b’与h1b互补,h2c’与h1c互补;h3包括h3e、h3f、h3e’、h3g四个部分,其中h3e与h3e’互补成双链作为h3发夹结构的茎部,h3f形成发夹结构的环部,h3g为h3的3’端单链粘性末端,h3e’和h3g与h2d互补;
或者h1包括a和b两个部分,其中a的部分序列与b的部分序列互补成双链作为h1发夹结构的茎部,a为a序列的互补序列;h2包括a’、h2d和b’三个部分,其中a’的部分序列与b’的部分序列互补成双链作为h2发夹结构的茎部,a’与a互补,b’与b互补;h3的设计同上;
所述h2或h3的5’端标记有生物素或荧光基团;
还包括金界面上自组装有dna探针的电极或芯片,所述dna探针具有与h3的h3f及h3e的部分序列互补配对的序列。
本发明提供的发夹探针h1、h2、h3形成的多支杂交链式产物通过杂交多价捕获到任意传感界面,因此,除了上述的电化学传感器和荧光传感器,本发明提出的杂交链式反应技术也可以应用到其他传感领域,比如:spr、微天平、表面荧光增强、拉曼等界面传感领域。
作为优选,还包括用于辅助目标dna打开h1发夹结构的辅助链,所述h1的3’端具有单链粘性末端h1x,所述辅助链与h1x及h1c的部分序列互补。
上述检测传感器的缓冲体系采用spsc溶液。
发夹探针h1、h2、h3可以为dna、rna、肽核酸(pna)或锁核酸(lna)。所述的dna探针也可以为肽核酸或锁核酸。
具体地,当目标dna为p53基因中的exon-5时,h1的序列如seqidno.1、seqidno.2或seqidno.3所示,h2的序列如seqidno.4所示,h3的序列如seqidno.5所示;
当目标dna为p53基因中的exon-6时,h1的序列如seqidno.6所示,h2的序列如seqidno.4所示,h3的序列如seqidno.5所示。
在检测不同dna动态浓度范围时,利用辅助链改变h1的稳定性,所述辅助链的序列如seqidno.7或seqidno.8所示。
本发明具备的有益效果:
(1)本发明提供的检测方法中杂交链式反应在溶液中进行,显著提高杂交效率;通过设计三条发夹探针,形成多支杂交链式反应产物,通过多价捕获的方式高效地将反应产物捕获到界面上,通过分析信号标记实现超灵敏核酸检测。
上述步骤只需一步即可实现靶标的识别、界面多价捕获及信号方法输出,解决了传统方法步骤繁琐的缺陷,基于该技术提供的检测传感器具有市场商品化前景。
(2)本发明设计的信号探针具有通用性,极大节约检测成本。
(3)通过调节h1发夹结构的稳定性,可以提高或减弱h1识别靶标的亲和能力,从而实现核酸检测动态范围的调整。
附图说明
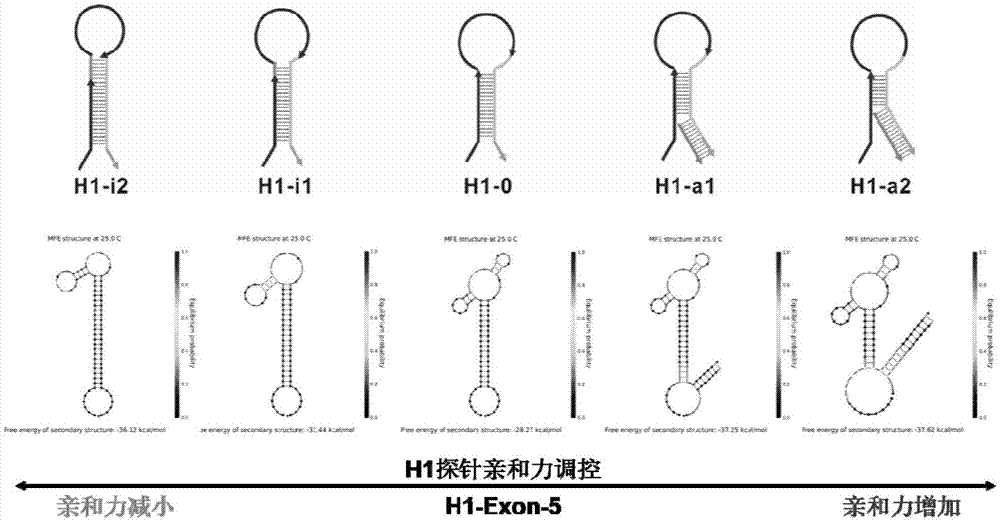
图1为运用nupack软件模拟设计的五个h1结构的自由能。
图2为实施例1中双向链式杂交的结果,其中(a)双向链式杂交反应原理图;(b)5个h1结构分别与目标dna识别能力琼脂糖凝胶电泳验证;(c)5个h1结构分别与目标dna识别并引发双向杂交链式反应琼脂糖凝胶电泳验证;(d)双向杂交链式反应机理琼脂糖凝胶电泳验证。
图3为5个h1结构用于识别0和100nm目标dna时,荧光强度动态变化,(a)h1-i2结构;(b)h1-i1结构;(c)h1-0结构;(d)h1-a1结构;(e)h1-a2结构。
图4为双向链式杂交反应验证,(a)双向链式杂交反应3’端方向和5’端方向原理示意与荧光强度变化验证;(b)3’端方向和5’端方向杂交链式反应凝胶电泳验证;(c)双向杂交链式反应一步法识别目标dna,金界面杂交链式产物多价捕获及荧光成像,0和100nm目标dna时界面荧光强度对比。
图5为通过双向杂交链式反应荧光开关效应检测目标dna,(a)在溶液中通过双向杂交链式反应荧光开关效应检测0.5pm-50μm之间浓度的dna,荧光强度与核酸浓度正相关。不同的h1结构可以调控dna检测的动态范围,检测灵敏度约有5个数量级的调控;(b)荧光增强百分比与核酸浓度正相关。
图6为电化学催化检测目标dna,(a)电化学催化检测0和10nm目标dna时的循环伏安曲线;(b)电化学催化检测0和10nm目标dna时的i-t曲线。
图7为sa-hrp与链式杂交反应产物中biotin预结合时的浓度优化。
图8为5个h1结构电化学检测目标dna,(a)h1-i2结构用于电化学检测1nm-10μm之间目标dna时,与稳定催化电流值正相关;(b)h1-i1结构用于电化学检测100pm-1μm之间目标dna时,与稳定催化电流值正相关;(c)h1-0结构用于电化学检测1pm-100nm之间目标dna时,与稳定催化电流值正相关;(d)h1-a1结构用于电化学检测100fm-10nm之间目标dna时,与稳定催化电流值正相关;(e)h1-a2结构用于电化学检测10fm-1nm之间目标dna时,与稳定催化电流值正相关;以该条测得的标准曲线为例,作hill曲线拟合后,浓度与信号换算关系式为:y=110.32+(12132.78*x0.32)/(1.29+x0.32),其中x为dna浓度,单位fm,y为测得的电催化稳定电流值,单位na;(f)5个h1结构通过双向杂交链式反应检测目标dna对应的检测限变化以及同时检测1nmexon-5时对应的稳定催化电流值。
图9为双向杂交链式反应与单向杂交链式反应琼脂糖凝胶电泳验证。
图10为3个h1结构分别与目标dna通过粘性末端识别并引发单向杂交链式反应琼脂糖凝胶电泳验证。
图11为不同的h1结构通过双向或单向杂交链式反应催化检测目标dna,(a)5个h1结构通过双向杂交链式反应电化学催化在不同动态范围检测目标dna;(b)3个h1结构分别与目标dna通过粘性末端识别并引发单向杂交链式反电化学催化在不同动态范围检测目标dna;(c)为(a)中背景及检测限浓度对应的稳定催化电流值;(d)为(b)中背景及检测限浓度对应的稳定催化电流值。
图12为利用h1-a2结构在75%血清中电化学检测exon-5和exon-6,(a)不同exon-5浓度和不同exon-6浓度的7个样本,浓度为100pm,200pm,500pm和1000pm;(b)75%血清中检测exon-5和exon-6的标准曲线。
具体实施方式
下面结合具体实施例进一步阐述本发明的特色和优点,所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
实施例1
基于双向链式杂交反应与荧光开关效应的核酸检测
1、发卡探针的设计:在经典杂交链式反应序列基础上,根据检测目标dna(p53基因中的一段dna序列exon-5),同时结合nupack软件设计相关发卡探针,委托生工生物工程股份有限公司(上海)合成与修饰相关核酸序列。
发卡探针浓度使用紫外分光光度计准确定量,用spsc缓冲液(50mmna2hso4/nah2so4,1mnacl,ph7.5)将所有发卡探针稀释成5μm,在pcr中95℃2min,快速降温至4℃,形成稳定的发卡结构。
表1设计的dna探针
注:a20,sh-b20,sh-c20,sh-d20用于合成dna四面体探针组装于电极或金片界面捕获hcr产物;检测用单链探针也是可行的。
h1(exon-5)-inhibitator-1、h1(exon-5)-inhibitator-2、h1(exon-5)分别形成发夹结构h1-i1、h1-i2、h1-0;h1(exon-5)中加入activator-1为h1-a1,h1(exon-5)中加入activator-2为h1-a2。
图1用nupack软件分析了不同h1发卡结构的自由能,当茎部碱基对数目增加时,茎环结构的自由能下降,茎环稳定性增加,与靶标的识别亲和能力下降。当加入辅助链通过粘性末端与h1杂交时,h1茎部的稳定性降低,可以提高与靶标的结合能力。
图2(a)为双向链式杂交反应原理图。不同h1发卡结构(1μm)与相同浓度的核酸(200nm)杂交效率通过凝胶电泳验证,结果如图2(b),h1-a2与dna杂交的产率最高,说明h1-a2的识别活性最强,h1-i2的识别活性最低。同理,不同h1引发的双向链式杂交反应效率也各不相同(图2(c)),当没有引发dna存在时,三个发卡结构在杂交溶液中能保持自身的稳定性,而加入目标dna后,有大分子量的杂交链式产物生成。图2(c)通过凝胶电泳进一步验证了发卡结构自身的稳定性。
图3通过实时监测荧光强度变化进一步考察不同h1结构引发的双向链式杂交反应。100μlspsc溶液中含有50nm的h1,fam-h2-dabcyl和h3,当溶液中没有目标核酸存在时,发卡结构保持稳定,h2上的猝灭和荧光基团距离约为2nm,fam发射的荧光被近距离猝灭,荧光强度随着时间变化基本保持稳定。当加入100nmexon-5时,双向链式杂交反应引发,猝灭和荧光基团距离增加,随着时间的推移,荧光逐渐增强。不同的h1结构识别核酸的能力不同,且参与hcr反应时的活性也不同,因此荧光变化速率在识别活性最好的h1-a2体系中最快。
图4(a)验证了3’方向和5’方向的链式杂交反应,h1识别目标dna(表1中dna1)后,加入3’termination时,3’方向的杂交链式反应被封闭;加入5’termination(序列与dna2一致)时,5’方向的杂交链式反应被封闭。将上述杂交产物分别标记为5’trigger和3’trigger,同样在含有50nm的h1,h2和h3的spsc溶液中加入100nm5’trigger或3’trigger,从荧光强度变化可以看出5’trigger和3’trigger可以在各自方向引发链式杂交反应,从而验证了h1通过环序列被打开后可以引发双向杂交链式反应。
图4(b)通过凝胶电泳进一步验证5’trigger和3’trigger的形成和3’方向和5’方向链式杂交反应。
图4(c)使用荧光成像验证一步实现靶标识别,多价捕获与信号放大输出。浓度均为100nm的h1、h2、h3探针溶液中加入100nm目标dna1(总体积为100μl),引发双向链式杂交反应后,每个链式产物上均有多支单链结构,可以与组装在金片界面的四面体顶端探针杂交,从而高效的通过多价捕获将链式杂交产物杂交在金界面,通过荧光显微镜对金片成像输出相应荧光信号,目标物浓度越高,金界面的荧光强度越强。图4(c)中荧光成像结果分别为0nm和100nmexon-5引发双向链式杂交反应,含有100nm目标物的金界面荧光强度显著增加。此处只是对提出方法的示范检测与验证,并没有通过此方法详细研究核酸的检测性能。若结合具有荧光增强的金芯片以及微阵列点样技术,可以进一步提高核酸检测的灵敏度并实现高通量分析测试。
在spsc缓冲溶液中,将10nmh1、fam-h2-dabcyl和h3与不同浓度的exon-5(0-50μm)混合,在室温条件下孵育2.5h,利用荧光光谱仪测量各浓度目标dna对应的荧光强度(激发电压800v,激发狭缝5nm,发射狭缝5nm,激发波长492nm,波长扫描范围502-700nm)。图5为不同h1结构引发双向链式杂交反应检测exon-5,不同的h1识别活性可以调控检测动态范围,h1-i2(10nm-50μm),h1-i1(1nm-50μm),h1-0(50pm-50μm),h1-a1(5pm-50μm),h1-a2(0.5pm-50μm)。
实施例2
基于双向链式杂交反应与电化学催化的核酸检测
发卡探针的设计:将h2上荧光基团修饰改为生物素修饰,其余序列均保持一致。
100μlspsc溶液中含有100nm的h1,h2-biotin和h3,在目标dna(表1中dna1)存在时引发双向杂交链式反应,2.5小时后,在溶液中加入过量辣根过氧化物酶修饰的链霉亲和素,可以与双向杂交链式反应产物上的biotin结合,上述复合物通过多支h3与金界面自组装的dna四面体顶端探针杂交而多价捕获于电极界面,将电极置于tmb底物溶液中,双氧水存在下,辣根过氧化物酶催化tmb还原而产生催化还原电流。催化还原电流与电极界面的辣根过氧化物酶数量正相关,同时辣根过氧化物酶数量与核酸分子正相关,因此通过催化还原电流放大电信号灵敏分析目标核酸。
由图6可见,10nm目标dna存在时,其循环伏安曲线中,相比无目标dna存在时有一个明显的还原峰(图6(a)),稳定催化还原电流(6841na)远远大于背景信号(110.6na)(图6(b))。
检测过程中优化了hcr反应溶液与sa-hrp预结合时sa-hrp的浓度,结果是当浓度为2.5μg/ml时,获得最佳的信噪比(图7)。
不同活性的h1分别可以检测不同dna动态浓度范围,h1-i2可以检测1nm-10μm(图8(a)),h1-i1可以检测100pm-10μm(图8(b)),h1-0可以检测1pm-1μm(图8(c)),h1-a1可以检测100fm-100nm(图8(d)),h1-a2可以检测10fm-10nm(图8(e))。图8(f)可见,h1五个结构具有不同的最低检测限,相同的1nm目标dna存在下,随着h1活性的增加,催化还原电流逐渐增强。
实施例3
基于单向链式杂交反应与电化学催化的核酸检测
同样采用发夹探针h1、h2、h3,将目标dna改成为dna2,可以与h1的茎部通过链取代反应打开h1。
目标核酸dna2通过h1上的粘性末端链取代杂交打开引发h1,h2单向链式杂交反应,打开的h2同样可以通过链取代打开h3形成多支杂交链式长链产物,电化学检测过程基本与检测dna1一致。
图9通过琼脂糖凝胶电泳验证目标dna1和dna2可以分别双向和单向引发杂交链式反应。
图10通过琼脂糖凝胶电泳验证dna2单向引发不同活性h1杂交链式反应。
总结了双向杂交链式反应和单向杂交链式反应不同动态范围分别检测dna1(图11(a)和11(c))和dna2(图11(b)和11(d))。不同活性的h1分别可以检测不同dna2动态浓度范围,h1-i2可以检测1nm-10μm,h1-i1可以检测1pm-1μm,h1-0可以检测1fm-1nm。
实施例4
血清中基于双向链式杂交反应与电化学催化的核酸检测
在血清中检测dna时,由于大量非靶标以外的生物分子干扰,以及杂交所需的盐离子浓度降低,杂交链式反应的效率降低。为了提高血清中杂交链式反应效率,75μl血清中加入25μl2xspsc缓冲溶液。血清中有大量的白蛋白,可以起到封闭的作用,防止辣根过氧化物酶在电极界面的吸附,因此在75%血清中检测dna1获得了与在缓冲液中相当的检测灵敏度。
图12(a)结果为h1-a2作为核酸识别结构在75%血清中电化学检测不同exon-5浓度和不同exon-6浓度的7个样本,浓度分别为100pm,200pm,500pm和1000pm,检测的结果与实际加入的核酸浓度基本一致,说明在复杂环境中有很好的检测准确性。
75%血清中分别检测exon-5和exon-6的标准曲线构建,检测范围均为10fm-10nm(图12(b))。
序列表
<110>嘉兴学院
<120>一种基于多支杂交链式反应的核酸检测方法及应用
<160>16
<170>siposequencelisting1.0
<210>1
<211>78
<212>dna
<213>人工序列(artificialsequence)
<400>1
ttaacccacgccgaatcctagactggcaaccagccctgtctgtaggaacaaagtagtcta60
ggattcggcgtgccaatt78
<210>2
<211>81
<212>dna
<213>人工序列(artificialsequence)
<400>2
ttaacccacgccgaatcctagactactgacaaccagccctgtctgtaggaacaaagtagt60
ctaggattcggcgtgccaatt81
<210>3
<211>84
<212>dna
<213>人工序列(artificialsequence)
<400>3
ttaacccacgccgaatcctagactactttggacaaccagccctgtctgtaggaacaaagt60
agtctaggattcggcgtgccaatt84
<210>4
<211>72
<212>dna
<213>人工序列(artificialsequence)
<400>4
agtctaggattcggcgtgggttaatccttcctcttccgacacgaccttcacgccgaatcc60
tagactactttg72
<210>5
<211>50
<212>dna
<213>人工序列(artificialsequence)
<400>5
ctcttccgacacgaccttgtatcagtaaggtcgtgtcggaagaggaagga50
<210>6
<211>78
<212>dna
<213>人工序列(artificialsequence)
<400>6
ttaacccacgccgaatcctagactgacctcaggcgaccctgggcaacccaaagtagtcta60
ggattcggcgtgccaatt78
<210>7
<211>12
<212>dna
<213>人工序列(artificialsequence)
<400>7
aattggcacgcc12
<210>8
<211>15
<212>dna
<213>人工序列(artificialsequence)
<400>8
aattggcacgccgaa15
<210>9
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>9
agtctaggattcggcgtgggttaa24
<210>10
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>10
cacgccgaatcctagactactttg24
<210>11
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>11
ttcctacagacagggctggttgtc24
<210>12
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>12
ggttgcccagggtcgcctgaggtc24
<210>13
<211>92
<212>dna
<213>人工序列(artificialsequence)
<400>13
tgatacaaggtcgtgtcggattttttttttctcaactgcctggtgatacgaggatgggca60
tgctcttcccgacggtattggaccctcgcatg92
<210>14
<211>62
<212>dna
<213>人工序列(artificialsequence)
<400>14
cgtgtagcaagctgtaatcgacgggaagagcatgcccatccactactatggcgggtgata60
aa62
<210>15
<211>62
<212>dna
<213>人工序列(artificialsequence)
<400>15
cgattacagcttgctacacgattcagacttaggaatgttcgacatgcgagggtccaatac60
cg62
<210>16
<211>62
<212>dna
<213>人工序列(artificialsequence)
<400>16
cgtatcaccaggcagttgagacgaacattcctaagtctgaaatttatcacccgccatagt60
ag62
- 还没有人留言评论。精彩留言会获得点赞!