一种7β-羟基类固醇脱氢酶突变体、编码序列、重组表达载体、基因工程菌及应用的制作方法
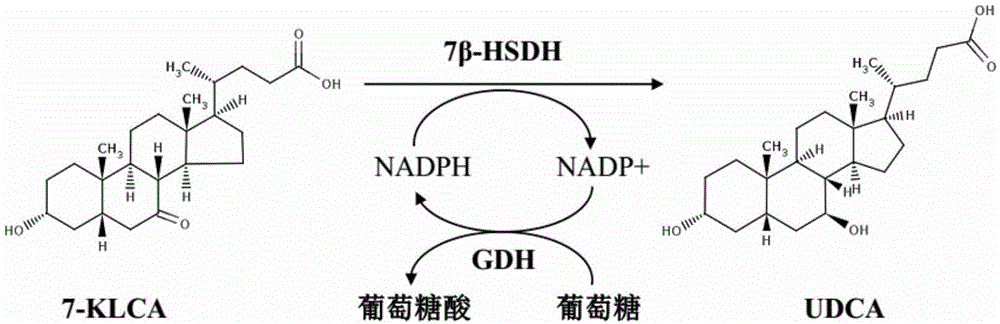
本发明属于基因工程及酶工程领域,具体涉及一种7β-羟基类固醇脱氢酶突变体、编码序列、重组表达载体、基因工程菌及它们在制备熊去氧胆酸和牛磺熊去氧胆酸中的应用。
背景技术:
:熊去氧胆酸(udca)和牛磺熊去氧胆酸(t-udca)是名贵中药——“熊胆粉”的主要有效成分,目前已应用于治疗各种胆石疾病,各种急性、慢性肝病,具有明显的疗效。udca和t-udca传统的制备方法是从熊胆汁中提取,但这种方法提取过程困难、产物收率低、手段过于残忍,有违动物保护法。当前,工业上生产udca和t-udca的方法除了“熊胆提取法”外,主要有化学合成法和酶法,其中化学合成法由于成本较高、工艺步骤多、“三废”严重和条件苛刻等缺点已逐步被淘汰;而酶法具有成本较低、工艺简单、绿色无污染及反应条件温和等优点,因此日益受到重视。酶法生产udca或t-udca主要是利用7β-羟基类固醇脱氢酶(7β-hydroxysteroiddehydrogenase,7β-hsdh,ec1.1.1.201)催化7-酮石胆酸(7-klca)和牛磺-7-酮石胆酸(t-7-klca)7位上的酮基加氢变成羟基,从而得到这2种重要的医用原料药。野生型7β-羟基类固醇脱氢酶来源十分广泛,目前,国内外科研工作者已经筛选出众多产7β-羟基类固醇脱氢酶的微生物并将其编码基因克隆出来,如活泼瘤胃菌属(ruminococcusgnavus)、扭链瘤胃球菌(ruminococcustorquesatcc35915)、产气柯林斯菌(collinsellaaerofaciens)、撒丁岛梭菌(clostridiumabsonum)等。但是这些野生型菌株普遍存在活性偏低,受产物udca或t-udca反馈抑制严重等缺点。随着基因工程、蛋白工程、酶工程和生物信息技术的发展,许多科研工作者运用理性设计、半理性设计和定向进化等手段对野生型7β-羟基类固醇脱氢酶进行突变改造。如中国专利cn105274070a中,刘志斌等对来源于活泼瘤胃菌属的7β-hsdh进行突变,其突变子ru-8c2和ru-4f9的活力由野生型的5.1u/ml提高到9.5u/ml和16.6u/ml,其对应的氨基酸残基变化分别为t210n和l3m/t219n。如中国专利cn106636285a中,傅荣昭等对来源于turneriellaparva的野生型7β-hsdh进行突变,突变体v38r+v39r活力由254.8u/ml提高到412.8u/ml,其反应温度由25℃提高到30℃,酶液投量和nadp+投量显著降低。mingminzheng等(j.agric.foodchem.,2017,65(6),pp1178–1185)对来源于ruminococcustorquesatcc35915的7β-hsdh进行突变,他们采用易错pcr和dna重排的定向进化手段,其突变子v3-1由野生型的8.60μmol/min/mg提高到51.4μmol/min/mg,比活由21.9u/mg提高到41.8u/mg,对应的氨基酸残基为t189v/v207m。虽然,国内外科研工作者利用基因工程及蛋白工程技术对7β-羟基类固醇脱氢酶进行突变改造,使其活性有了成倍的提高,但是,突变酶的活力依旧偏低、受产物抑制依旧很严重。因此,开发一种还原活力高、还原氧化活力比值高及产物抑制弱的酶具有重要意义。技术实现要素:本发明首要目的在于提供一种7β-羟基类固醇脱氢酶突变体,以解决制备熊去氧胆酸或牛磺熊去氧胆酸时,野生型酶的还原活力偏低、氧化活力偏高、还原氧化活力比值偏小和受产物反馈抑制严重,反应时间长等技术问题。为实现上述目的,本发明采用以下技术方案:本发明提供的技术方案之一是:提供一种7β-羟基类固醇脱氢酶突变体。本发明中利用易错pcr技术对产气柯林斯菌(collinsellaaerofaciens)来源的野生型7β-羟基类固醇脱氢酶进行定向改造,以获得还原活力高,还原氧化活力比值大及受产物反馈抑制作用弱的突变体。一种7β-羟基类固醇脱氢酶突变体,至少将具有seqidno.2所示氨基酸序列第175位的谷氨酸突变成天冬氨酸。进一步的,将具有seqidno.2所示氨基酸序列第175位的谷氨酸突变成天冬氨酸,该突变体命名为ca7β-1,其氨基酸序列如seqidno.4所示。该突变体比野生型的7β-羟基类固醇脱氢酶还原活力高。一种7β-羟基类固醇脱氢酶突变体,至少将具有seqidno.2所示氨基酸序列第175位和第197位的谷氨酸均突变成天冬氨酸。进一步的,将具有seqidno.2所示氨基酸序列第175位和第197位的谷氨酸均突变成天冬氨酸该突变体命名为ca7β-2,其氨基酸序列如seqidno.6所示。该突变体的还原活力高,还原氧化活力比值大及受产物反馈抑制作用弱,使得反应时间大幅缩短,且能将底物7-klca或t-7-klca转化完全。本发明第二个目的在于提供上述7β-羟基类固醇脱氢酶突变体的编码基因序列。本发明提供的技术方案之二是:提供一种编码7β-羟基类固醇脱氢酶突变体的基因序列,为编码上述的7β-羟基类固醇脱氢酶突变体中的任一种的基因序列。所述编码基因序列的制备方法为本领域常规的制备方法,所述制备方法包括:(1)从自然界中提取;(2)通过基因克隆技术获得;(3)通过人工全基因合成中的任一种。如本领域技术人员所知:所述编码基因序列在不影响表达功能的前提下可以适当引入替换、缺失、改变、插入或增加碱基来制得。进一步地,所述编码7β-羟基类固醇脱氢酶突变体的基因序列如序列seqidno.3所示;更进一步地,所述编码7β-羟基类固醇脱氢酶突变体的基因序列如序列seqidno.5所示。本发明第三个目的在于提供上述7β-羟基类固醇脱氢酶突变体的编码基因序列的重组表达载体。本发明提供的技术方案之三是:提供一种含有上述7β-羟基类固醇脱氢酶突变体的编码基因序列中的一种或几种的重组表达载体。所述重组表达载体可通过本领域常规方法获得,即:将本发明所述的编码基因序列连接于各种表达载体上构建而成。所述的表达载体为本领域常规的各种载体。所述载体包括:各种质粒、粘粒、噬菌体或病毒载体等,本发明所述载体优选原核表达载体pet30a(+)。本发明第四个目的在于提供上述7β-羟基类固醇脱氢酶突变体的编码基因序列重组表达载体的基因工程菌。本发明提供的技术方案之四是:提供一种包含有上述重组表达载体的一种或几种的基因工程菌。所述重组表达基因工程菌的制备方法为:将上述重组表达载体转化至宿主细胞中制得。其中所述宿主细胞包括大肠杆菌(e.coli),优选为大肠杆菌bl21(de3)。将上述重组表达载体通过电转化或者化学转化的方法转入大肠杆菌bl21(de3)中,即可得本发明优选的重组基因工程菌。本发明的第五个目的是提供上述7β-羟基类固醇脱氢酶突变体的应用,包括:使用上述的7β-羟基类固醇脱氢酶突变体催化7-酮石胆酸制备熊去氧胆酸,或者使用上述的7β-羟基类固醇脱氢酶突变体催化牛磺-7-酮石胆酸制备牛磺熊去氧胆酸。进一步的,催化反应中用到的辅酶nadph是由葡萄糖脱氢酶催化葡萄糖合成得到的,反应完后nadph转变成nadp+,nadp+在葡萄糖脱氢酶催化下转变成葡萄糖酸,从而实现辅酶nadph的循环再生。本发明上述7β-羟基类固醇脱氢酶突变体的应用,具体如下:是在添加nadp+和葡萄糖,由葡萄糖脱氢酶(gdh)催化葡萄糖循环制备nadph的条件下,直接催化7-酮石胆酸(7-klca)制备熊去氧胆酸(udca),该方法能大大减少昂贵辅酶nadph的投量,从而有效地节省成本;或者是在添加nadp+和葡萄糖,由葡萄糖脱氢酶(gdh)催化葡萄糖循环制备nadph的条件下,催化牛磺-7-酮石胆酸(t-7-klca)制备牛磺熊去氧胆酸(t-udca)。本发明采用7β-羟基类固醇脱氢酶的高通量筛选方法,同时利用还原反应和氧化反应筛选有益突变体。本发明所述高通量筛选方法是采用nadph测定法,其在340nm处有最大吸收峰,分别以7-klca和udca为底物测定该酶的还原活力和氧化活力,其中还原活力测定nadph的消耗量,通过酶标仪测定其在340nm的吸光值,数值越小,酶活性越高;氧化活力测定nadph的生成量,通过酶标仪测定其在340nm的吸光值,数值越大,酶活性越高;为了使反应向正方向进行,得到更多的udca,因此,还原活力高,氧化活力低即还原氧化活力比值大的突变子为有益突变体。本发明具有以下有益效果:1、本发明的7β-羟基类固醇脱氢酶突变体,与野生型7β-hsdh氨基酸序列存在特定位点的氨基酸不同,具有还原活力高,还原氧化活力比值大及受产物反馈抑制作用弱等优点。2、与现有酶法制备熊去氧胆酸和牛磺熊去氧胆酸方法相比,本发明提供的方法具有反应条件温和、反应速率快、转化效率高、底物反应浓度大和辅酶添加少等优点,其反应时间从24小时缩短到2小时,7-klca摩尔转化率由91%提高到100%,t-7-klca摩尔转化率由89.2%提高到99.5%,可以更有效,快速地催化合成udca和t-udca。构成本申请的一部分的附图用来提供对本发明的进一步理解,但并不构成对本发明的不当限定。附图说明图1是本发明实施例中的7β-hsdh催化合成熊去氧胆酸以及葡萄糖脱氢酶催化下的辅酶nadph循环再生;图2是本发明实施例中的7β-hsdh催化合成牛磺熊去氧胆酸以及葡萄糖脱氢酶催化下的辅酶nadph循环再生;图3是本发明实施例的重组表达载体pet-7β-hsdh-wt构建流程图。具体实施方式以下实施例及其说明用于解释本发明,但并不构成对本发明的不当限定。本申请中下述实施例中所使用的方法如无特殊说明均为常规方法,如《分子克隆实验指南》(j.萨姆布鲁克,d.w.拉塞尔著,黄培堂,汪嘉玺,朱厚础,等译。第3版,北京:科学出版社,2002)中所述的方法进行。基因合成、突变引物合成以及序列测序均为泰和永昌(长沙)生物技术有限公司完成。大肠杆菌宿主菌为e.colibl21(de3)购于merck公司。大肠杆菌宿主菌还可以是e.colibl21(de3)plys,购于天根公司。原核表达载体pet30a(+)购于merck公司。dna内切酶ecori、xhoi和dpni及dnat4连接酶购于fermentas公司,其余试剂及材料均为市售。同时,本发明中的氨基酸无特别说明外均用其缩写或代号标明(氨基酸中英文名称及其缩写和代号见表1)。表1氨基酸中英文名称及其缩写和代号中文名称英文名称缩写代号中文名称英文名称缩写代号丙氨酸alaninealaa脯氨酸prolineprop精氨酸arginineargr亮氨酸leucineleul天冬酰胺asparagineasnn异亮氨酸isoleucineilei天冬氨酸asparticacidaspd甘氨酸glycineglyg半胱氨酸cysteinecysc苯丙氨酸phenylalaninephef谷氨酰胺glutamineglnq蛋氨酸methioninemetm谷氨酸glutamicacidglue赖氨酸lysinelysk苏氨酸threoninethrt组氨酸histidinehish色氨酸tryptophantrpw缬氨酸valinevalv丝氨酸serinesers酪氨酸tyrosinetyry实施例1:野生型7β-hsdh重组基因工程菌的构建、表达及重组蛋白的纯化1-1野生型7β-hsdh重组基因工程菌的构建及表达为了得到还原活力高、氧化活力低和产物抑制弱的突变型7β-hsdh,本发明采用的野生型7β-hsdh基因及氨基酸序列是来源于产气柯林斯菌(collinsellaaerofaciens)(genebank登录号:wp_006236005),通过大肠杆菌密码子偏爱性将该编码基因进行优化并进行全基因合成,并将该野生型7β-羟基类固醇脱氢酶命名为ca7β-wt,其编码基因命名为7β-hsdh-wt,其核苷酸序列及氨基酸序列见seqidno:1和seqidno:2。参照图2,将全基因合成的野生型7β-hsdh编码基因7β-hsdh-wt与原核表达载体pet30a(+)分别进行ecori和xhoi双酶切,酶切3小时后分别进行切胶回收,将回收产物按照产物:载体为3:1的摩尔比例进行混合,加入t4dnaligase于16℃过夜连接。将连接产物5μl转入50μl的dh5α感受态大肠杆菌中,涂布于含50μg/ml卡那霉素的lb固体培养基平板于37℃中进行过夜培养。挑选单菌落进行菌落pcr验证,将阳性克隆接种于含50μg/ml卡那霉素的lb培养基过夜培养,提质粒,进行ecori和xhoi双酶切验证,将大小正确的克隆子送往测序公司进行dna测序验证,序列比对正确后,将该重组表达载体命名为pet-7β-hsdh-wt,这样就得到了在n端和c端都带有一个his-tag的质粒,其表达的野生型7β-hsdh蛋白带有两个组氨酸标签,可用固定化金属螯合亲和层析(imac)的方式进行蛋白纯化。通过化学转化的方法将上述重组表达载体pet-7β-hsdh-wt转化入e.colibl21(de3)或者e.colibl21(de3)plys感受态大肠杆菌细胞,转化细胞涂布于含50μg/ml卡那霉素的lb固体培养基平板于37℃中进行过夜培养即获得重组野生型7β-hsdh基因工程菌。挑取单菌落接种于装有lb培养基的三角瓶中,其中lb培养基为100ml且含有50μg/ml的卡那霉素,于37℃,250rmp的恒温摇床中培养8个小时后,加入1%的乳糖,于25℃,250rmp的恒温摇床中诱导表达8小时,即得到重组野生型7β-hsdh蛋白。1-2重组野生型7β-hsdh蛋白的分离纯化由于在表达载体构建过程中引入了原核表达载体pet30a(+)中的n和c端的2个his-tag,因此,本发明人利用该组氨酸标签进行固定化金属螯合亲和层析(imac)来纯化重组蛋白,具体方法如下。取100ml过夜诱导后的野生型7β-hsdh发酵液,离心后弃上清收集菌体(10000rpm、4℃、10min),用磷酸盐缓冲液(ph8.0、0.1mol/l)反复洗涤菌体两次,离心收集菌体,浓缩5倍重悬于20ml磷酸盐缓冲液(ph8.0、0.1mol/l)中。将上述处理后的菌液置于冰水中进行超声破碎直至澄清,其中的超声破碎条件为:工作2s,间隔5s。将上述破碎后的裂解液置于低温高速离心机中离心(12,000rpm、4℃、20min),收集上清,得到重组野生型7β-hsdh蛋白,将该粗重组蛋白进样到已活化并结合ni+的ida树脂上,用不同浓度的咪唑进行梯度洗脱,利用蛋白层析系统(bio-rad)进行实时监控,当计算机中出现稳定的蛋白峰时,开始收集直到该峰消失为止。重组酶蛋白经过分离纯化后密封于无菌袋中放置于4℃冰箱以备后续实验。实施例2:7β-hsdh突变体的制备2-1突变体文库构建及高通量筛选方法2-1-17β-hsdh突变体文库的构建为了提高野生型7β-hsdh的活力,本发明人以重组表达载体pet-7β-hsdh-wt为dna模板,其中引物为t7通用引物(seqidno:7和8),通过易错pcr的方法构建一个随机突变体文库,并通过调整易错pcr反应体系中mg2+和mn2+浓度以及dctp和dttp寡核苷酸浓度,使该突变体文库的碱基错配率为千分之五,即保证一个突变体有1到3个氨基酸发生突变,构建突变体文库的具体过程如下。易错pcr反应体系:10×buffer5μl2mmol/ldntps5μl100mmol/ldctp0.5μl100mmol/ldttp0.5μl10mmol/lmncl25μl50mmol/lmgso45μl引物t7promoter2μl引物t7terminator2μl模板pet-7β-hsdh-wt1μltaqdna聚合酶1.5μlddh2o22.5μl易错pcr反应条件是:先95℃预变性5min;然后94℃变性30s,55℃退火1min,72℃1.5min,共30个循环;最后72℃延伸10min。将上述得到的易错pcr产物进行电泳并切胶回收纯化,将纯化后的产物与原核表达载体pet30a(+)分别进行ecori和xhoi双酶切,酶切3小时分别进行切胶回收,将回收产物按照产物:载体为3:1的摩尔比例进行混合,加入t4dnaligase于16℃过夜连接。次日,按照实施例1-2的方法构建重组基因工程菌,即可得到一个库容量大的突变体文库。2-1-27β-hsdh突变体文库的高通量筛选方法本发明中7β-hsdh突变体文库的高通量筛选方法是采用nadph测定法,其在340nm处有最大吸收峰,分别以7-klca和udca为底物测定该酶的还原活力和氧化活力,其中还原活力测定nadph的消耗量,通过酶标仪测定其在340nm的吸光值,数值越小,酶活性越高;氧化活力测定nadph的生成量,通过酶标仪测定其在340nm的吸光值,数值越大,酶活性越高;为了使反应向正方向进行,得到更多的udca,因此,还原活力高,氧化活力低即还原氧化活力比值大的突变子为有益突变体。具体方法及操作步骤如下所述:(1)酶液的制备用高温灭菌后的牙签,小心挑取突变体文库中的单菌落接种于装有lb培养基的96孔细胞培养板中,其中lb培养基体积为200μl/孔且含有50μg/ml的卡那霉素,于37℃,250rmp的恒温摇床中培养8个小时后,加入1%的乳糖,于25℃,250rmp的恒温摇床中诱导培养8小时。诱导完毕后,将96孔细胞培养板放入-86℃的超低温冰箱中冷冻2个小时,取出放置于室温中半个小时,后置于96孔细胞培养板离心机中于4,000rmp,4℃离心20分钟。(2)反应及测定a、还原反应:取20μl上清液加入含有180μl反应液(150μl0.3mmo/l的nadph,30μl10mmo/l的7-klca,nadph和7-klca都用0.05mol/lph8.0的tris-hcl配置)的96孔微孔板中于30℃放置30分钟,反应完后将96孔微孔板放入酶标仪中,于波长340nm处测定其吸光度,读取数值。b、氧化反应:取20μl上清液加入含有180μl反应液(150μl0.3mmo/l的nadp+,30μl10mmo/l的udca,nadp+和udca都用0.05mol/lph8.0的tris-hcl配置)的96孔微孔板中于30℃放置30分钟,反应完后将96孔微孔板放入酶标仪中,于波长340nm处测定其吸光度,读取数值。2-27β-hsdh突变体的制备(1)第一轮突变从上述突变子文库中筛选了约20000个克隆,得到10个数值变化明显的突变子。接着对这10个突变子进行摇瓶筛选。具体过程为:将这10个突变子接种于含100mllb培养基的500ml摇瓶中进行发酵及诱导,并通过hplc法测定活力,得到1个比对照还原活力高3.5倍、氧化活力略低的突变子,命名为ca7β-1,经过测序结果显示其在第175位点氨基酸发生了改变,由e突变成了d。(2)第二轮突变在7β-hsdh催化生产udca或t-udca过程中,我们发现,7β-hsdh会受到产物udca或t-udca的强烈抑制,使其活性迅速下降且不能连续进行批次反应,导致酶法制备udca或t-udca的成本过高。因此,需要通过对7β-hsdh进行蛋白工程改造以降低其受产物udca或t-udca的抑制作用。本发明人,沿着这一目标设定开发路线,对上述7β-hsdh突变体进行进一步改造。以ca7β-1编码基因为模板,加入t7通用引物进行易错pcr,按照实施例2-1-1方法得到一个随机突变体文库,同时按照实施例2-1-2方法进行突变体文库筛选,只是在反应过程中加入25mm的产物udca或t-udca以筛选耐受高浓度产物udca或t-udca的突变子。在所述随机突变体文库中共筛选了约20000个克隆子,得到1个活力比ca7β-1有显著提升的突变子,通过摇瓶发酵复筛选,测定其还原活力和氧化活力分别为39.8u/ml和49.1u/ml,还原氧化活力比为0.81,并将其命名为ca7β-2,经测序后,显示ca7β-2在第175和197位点氨基酸都由e突变为d。表2突变体与野生型ca7β性质初步比较注:还原活力是以7-klca为底物的测定的;氧化活力是以udca为底物的测定的。实施例3:野生型与突变型7β‐hsdh受产物抑制的比较将上述野生型及突变型7β-hsdh按照实施例1的方法进行纯化,并将所得到的纯酶液以相同酶量(1000u)分别置于10mm、25mm、50mm和100mm浓度的udca溶液中(由于t-udca产物抑制实验结果与udca的相似,这里仅以udca为例说明),于30℃温育1个小时后,测定其残余活力,具体数据如表3所示。结果表明,随着udca浓度的增加,野生型ca7β-wt的活力急剧下降,在100mm的浓度下,其活力以及下降了将近90%;而ca7β-2突变体比野生型ca7β-wt有着更好的udca耐受性,其受udca的反馈抑制作用减弱非常多,在100mm的浓度下,其活力仅下降了8.4%。表3野生型与突变型7β-hsdh对udca浓度耐受性比较实施例4野生型与突变型7β-hsdh制备udca或t-udca的应用4-1野生型与突变型7β-hsdh制备udca实验将上述野生型与突变型7β-hsdh纯酶,以相同酶量(2000u)分别置于终浓度为100mm的7-klca、2mmnadp+、150mm的葡萄糖、3000u葡萄糖脱氢酶(gdh)(购于湖南宝利士生物技术有限公司)的1l反应体系中,于30℃,ph8.00条件下反应,反应过程中不断滴加3mol/l的碳酸钠,使ph恒定在8.00,每隔一定时间取样测定反应液中的7-klca和udca的含量,当反应达到终点后(判定终点的方法是:7-klca反应完全或者增加反应时间其不再减少),记录下总反应时间。将上述反应液通过膜过滤,纯酶用tris-hcl缓冲液清洗,备用。取上述反应液,检测udca生成量,同时计算7-klca的摩尔转化率,具体实验对比数据见表4。4-2野生型与突变型7β-hsdh制备制备t-udca实验按照上述实施例4-1的方法,只是将底物7-klca替换成t-7-klca,其他条件一致,当反应完成时,检测t-udca生成量,同时计算t-7-klca的摩尔转化率,具体实验对比数据见表4。表4野生型与突变型7β-hsdh制备udca或t-udca的应用实验对比由上表可知,野生型7β-hsdh在30℃,反应24小时,7-klca和t-7-klca的摩尔转化率仅为91%和89.2%;ca7β-1在反应3小时后,7-klca和t-7-klca的摩尔转化率都达到了99%以上;ca7β-2在反应2小时后,7-klca摩尔转化率达到了100%,t-7-klca的摩尔转化率达到了99.5%。实验结果表明,野生型7β-hsdh由于受产物udca和t-udca的抑制作用,无论增加多少时间,其都不能将底物7-klca和t-7-klca转化完全;而ca7β-2突变体还原活力和还原氧化活力比值大幅度提高,同时低了产物udca和t-udca的抑制作用,使得其反应时间从24小时缩短到2小时,且能将底物7-klca和t-7-klca转化完全。上述的对实施例的描述是为便于该
技术领域:
的普通技术人员能理解和应用本发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。序列表<110>湖南福来格生物技术有限公司<120>一种7β-羟基类固醇脱氢酶突变体、编码序列、重组表达载体、基因工程菌及应用<160>8<170>siposequencelisting1.0<210>1<211>789<212>dna<213>优化后的产气柯林斯菌(collinsellaaerofaciens野生型7β-hsdh编码基因)<400>1atgaatctgcgtgagaagtacggtgaatggggtctgatcctgggtgcaaccgagggcgta60ggtaaagcgttctgcgaaaagatcgcagcaggcggtatgaacgtagtgatggttggtcgc120cgtgaggaaaaactgaatgtactggcaggcgagatccgcgaaacttacggtgtagagact180aaagtggttcgcgcagacttcagccagccaggtgcagcggaaaccgttttcgcagctact240gaaggtctggacatgggcttcatgtcctatgttgcctgcctgcattctttcggcaaaatc300caggacactccgtgggaaaaacatgaggcaatgattaacgtaaacgtggtaaccttcctg360aaatgcttccatcactacatgcgtatctttgcggctcaggatcgtggtgccgttatcaac420gtttcctccatgactggtatcagcagctctccgtggaacggtcagtatggtgcgggtaaa480gcgtttatcctgaaaatgaccgaggctgtagcgtgcgagtgtgaaggtactggtgttgat540gtggaggttatcaccctgggcaccaccctgaccccgagcctgctgtccaatctgccaggc600ggtccgcagggtgaagcggtgatgaagattgcgctgactccggaagaatgtgtggatgaa660gcattcgagaaactgggcaaagaactgtctgttatcgctggtcagcgcaacaaagattct720gtacatgactggaaggcgaaccacaccgaagatgaatacatccgttacatgggctctttc780taccgcgat789<210>2<211>263<212>prt<213>优化后的产气柯林斯菌(collinsellaaerofaciens野生型7β-hsdh氨基酸序列)<400>2metasnleuargglulystyrglyglutrpglyleuileleuglyala151015thrgluglyvalglylysalaphecysglulysilealaalaglygly202530metasnvalvalmetvalglyargarggluglulysleuasnvalleu354045alaglygluilearggluthrtyrglyvalgluthrlysvalvalarg505560alaasppheserglnproglyalaalagluthrvalphealaalathr65707580gluglyleuaspmetglyphemetsertyrvalalacysleuhisser859095pheglylysileglnaspthrprotrpglulyshisglualametile100105110asnvalasnvalvalthrpheleulyscysphehishistyrmetarg115120125ilephealaalaglnaspargglyalavalileasnvalsersermet130135140thrglyileserserserprotrpasnglyglntyrglyalaglylys145150155160alapheileleulysmetthrglualavalalacysglucysglugly165170175thrglyvalaspvalgluvalilethrleuglythrthrleuthrpro180185190serleuleuserasnleuproglyglyproglnglyglualavalmet195200205lysilealaleuthrprogluglucysvalaspglualapheglulys210215220leuglylysgluleuservalilealaglyglnargasnlysaspser225230235240valhisasptrplysalaasnhisthrgluaspglutyrileargtyr245250255metglyserphetyrargasp260<210>3<211>789<212>dna<213>ca7β-1突变体(e175d编码基因)<400>3atgaatctgcgtgagaagtacggtgaatggggtctgatcctgggtgcaaccgagggcgta60ggtaaagcgttctgcgaaaagatcgcagcaggcggtatgaacgtagtgatggttggtcgc120cgtgaggaaaaactgaatgtactggcaggcgagatccgcgaaacttacggtgtagagact180aaagtggttcgcgcagacttcagccagccaggtgcagcggaaaccgttttcgcagctact240gaaggtctggacatgggcttcatgtcctatgttgcctgcctgcattctttcggcaaaatc300caggacactccgtgggaaaaacatgaggcaatgattaacgtaaacgtggtaaccttcctg360aaatgcttccatcactacatgcgtatctttgcggctcaggatcgtggtgccgttatcaac420gtttcctccatgactggtatcagcagctctccgtggaacggtcagtatggtgcgggtaaa480gcgtttatcctgaaaatgaccgaggctgtagcgtgcgagtgtgatggtactggtgttgat540gtggaggttatcaccctgggcaccaccctgaccccgagcctgctgtccaatctgccaggc600ggtccgcagggtgaagcggtgatgaagattgcgctgactccggaagaatgtgtggatgaa660gcattcgagaaactgggcaaagaactgtctgttatcgctggtcagcgcaacaaagattct720gtacatgactggaaggcgaaccacaccgaagatgaatacatccgttacatgggctctttc780taccgcgat789<210>4<211>263<212>prt<213>ca7β-1突变体(e175d氨基酸序列)<400>4metasnleuargglulystyrglyglutrpglyleuileleuglyala151015thrgluglyvalglylysalaphecysglulysilealaalaglygly202530metasnvalvalmetvalglyargarggluglulysleuasnvalleu354045alaglygluilearggluthrtyrglyvalgluthrlysvalvalarg505560alaasppheserglnproglyalaalagluthrvalphealaalathr65707580gluglyleuaspmetglyphemetsertyrvalalacysleuhisser859095pheglylysileglnaspthrprotrpglulyshisglualametile100105110asnvalasnvalvalthrpheleulyscysphehishistyrmetarg115120125ilephealaalaglnaspargglyalavalileasnvalsersermet130135140thrglyileserserserprotrpasnglyglntyrglyalaglylys145150155160alapheileleulysmetthrglualavalalacysglucysaspgly165170175thrglyvalaspvalgluvalilethrleuglythrthrleuthrpro180185190serleuleuserasnleuproglyglyproglnglyglualavalmet195200205lysilealaleuthrprogluglucysvalaspglualapheglulys210215220leuglylysgluleuservalilealaglyglnargasnlysaspser225230235240valhisasptrplysalaasnhisthrgluaspglutyrileargtyr245250255metglyserphetyrargasp260<210>5<211>789<212>dna<213>ca7β-2突变体(e175d/e197d编码基因)<400>5atgaatctgcgtgagaagtacggtgaatggggtctgatcctgggtgcaaccgagggcgta60ggtaaagcgttctgcgaaaagatcgcagcaggcggtatgaacgtagtgatggttggtcgc120cgtgaggaaaaactgaatgtactggcaggcgagatccgcgaaacttacggtgtagagact180aaagtggttcgcgcagacttcagccagccaggtgcagcggaaaccgttttcgcagctact240gaaggtctggacatgggcttcatgtcctatgttgcctgcctgcattctttcggcaaaatc300caggacactccgtgggaaaaacatgaggcaatgattaacgtaaacgtggtaaccttcctg360aaatgcttccatcactacatgcgtatctttgcggctcaggatcgtggtgccgttatcaac420gtttcctccatgactggtatcagcagctctccgtggaacggtcagtatggtgcgggtaaa480gcgtttatcctgaaaatgaccgaggctgtagcgtgcgagtgtgatggtactggtgttgat540gtggaggttatcaccctgggcaccaccctgaccccgagcctgctgtccgatctgccaggc600ggtccgcagggtgaagcggtgatgaagattgcgctgactccggaagaatgtgtggatgaa660gcattcgagaaactgggcaaagaactgtctgttatcgctggtcagcgcaacaaagattct720gtacatgactggaaggcgaaccacaccgaagatgaatacatccgttacatgggctctttc780taccgcgat789<210>6<211>263<212>prt<213>ca7β-2突变体(e175d/e197d氨基酸序列)<400>6metasnleuargglulystyrglyglutrpglyleuileleuglyala151015thrgluglyvalglylysalaphecysglulysilealaalaglygly202530metasnvalvalmetvalglyargarggluglulysleuasnvalleu354045alaglygluilearggluthrtyrglyvalgluthrlysvalvalarg505560alaasppheserglnproglyalaalagluthrvalphealaalathr65707580gluglyleuaspmetglyphemetsertyrvalalacysleuhisser859095pheglylysileglnaspthrprotrpglulyshisglualametile100105110asnvalasnvalvalthrpheleulyscysphehishistyrmetarg115120125ilephealaalaglnaspargglyalavalileasnvalsersermet130135140thrglyileserserserprotrpasnglyglntyrglyalaglylys145150155160alapheileleulysmetthrglualavalalacysglucysaspgly165170175thrglyvalaspvalgluvalilethrleuglythrthrleuthrpro180185190serleuleuseraspleuproglyglyproglnglyglualavalmet195200205lysilealaleuthrprogluglucysvalaspglualapheglulys210215220leuglylysgluleuservalilealaglyglnargasnlysaspser225230235240valhisasptrplysalaasnhisthrgluaspglutyrileargtyr245250255metglyserphetyrargasp260<210>7<211>20<212>dna<213>t7promoterprimer<400>7taatacgactcactataggg20<210>8<211>19<212>dna<213>t7terminatorprimer<400>8gctagttattgctcagcgg19当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1