高毒力株幽门螺杆菌的环介导等温扩增检测方法和试剂盒与流程
本发明属于医学分子生物学诊断技术领域,具体涉及一种高毒力株幽门螺杆菌的环介导等温扩增检测方法和试剂盒。
背景技术:
该部分内容仅提供与本发明有关的背景信息,并不必然构成现有技术。
幽门螺旋杆菌(helicobacterpylori,hp)是一种微需氧,显微镜下呈螺旋形的革兰氏阴性杆菌。是目前所知能够在人体胃液中生存的唯一微生物种类。流行病学调查显示,世界范围内hp在普通人群的感染率高达50%以上,发展中国家甚至达到70%~90%。感染的分布也存在差异,经济越落后、文化水平越低感染率越高。
幽门螺旋杆菌感染可表现为胃炎、消化道溃疡、淋巴增生性胃淋巴瘤等。hp胃部感染的不良预后是胃癌,早在1994年国际癌症研究中心就将其列为i类致癌物。长期以来hp感染及机制一直是世界关注及研究的热点之一。但是,流行病学调查显示,并非所有感染hp者均导致胃部疾病,感染者只有10%发展为有明显症状的消化性溃疡或者胃炎,最终发展成胃癌的仅占1%左右。究竟是什么关键因素最终导致hp感染后的不同结局呢?研究表明,人体感染hp除了遗传易感性及环境易感性之外,还与其具有独特的毒力因子有关,例如尿素酶、鞭毛蛋白、粘附因子、细胞毒素相关蛋白(caga)和空泡细胞毒素(vaca)等。已经公认,由caga基因编码的caga蛋白是最重要的毒力因子之一,caga蛋白可以通过诱导更多的酪氨酸磷酸化和白介素-8的分泌,也可以通过调节一些信号通道系统,刺激肿瘤细胞增殖和提高肿瘤细胞侵袭作用而促进胃癌的发生。hp菌株可以根据有无caga基因将其分为两种类型,一种是高毒力hp株,有caga基因,表达caga蛋白,具有毒素活性,可导致胃部炎症或者胃癌;另一种为低毒力hp株,无caga基因,不表达caga蛋白,不具备毒素活性,不会引起胃炎等疾病的发生。因此,caga基因被认为高毒力hp菌株最重要的标志物,如果能够通过某种方法,只检测caga基因,从而把携带有caga蛋白的高毒力hp株的人群筛选出来,利用三联或者四联药物加以根治,就可以大大减少由hp感染造成的胃癌的发病率。
临床上检测hp的方法有许多种,例如血清学实验、呼气实验、分离培养法、尿素酶法、分子生物学(如pcr)法等。各有利弊,如血清法检测抗体,不适合现症感染;呼气试验容易受抗生素、铋制剂等敏感药物干扰导致假阳性,而且放射性元素会对人体有一定危害,尤其不适用于孕妇和小儿;分离培养法是目前公认的诊断hp感染的“金标准”,但培养条件要求苛刻,敏感性低且耗时费力;胃幽门螺旋杆菌快速尿素酶法属于侵入性有创检查,患者痛苦较大,且适用于用药前的首次胃镜检查,不适合复检。以上几种方法均侧重于hp的普查,并不能区分高毒力菌株和低毒力菌株,有文献报道可以通过pcr检测毒力基因caga或者尿素基因(urea)来诊断高毒力hp感染,pcr方法灵敏高效,但费用高昂,不适合在基层医院推广普及。
环介导基因恒温扩增技术(loop-mediatedisothermalamplificationofnucleicacid,lamp)是一种新型恒温基因扩增技术,其通常是针对靶基因的六个独立区域设计两对特殊内、外引物,同时利用bst脱氧核苷酸聚合酶启动循环链置换反应,完成核酸扩增。该技术具有快速、简便、敏感性和特异性高、检测范围广等优点。近年来,该技术已逐步应用于病原微生物的检测,但目前尚未见该方法应用于高毒力幽门螺旋杆菌的检测,更无合适高效的引物用于该领域的lamp检测。
技术实现要素:
针对上述现有技术的不足,本发明基于caga基因在幽门螺杆菌菌株中稳定性与独特性,提供了一种速度快、灵敏度高、特异性检测高毒力株幽门螺杆菌的lamp检测用引物组及检测方法以及试剂盒。
本发明的目的之一在于提供一种检测高毒力株幽门螺杆菌的lamp检测用引物,所述lamp检测引物包括:
f3:5'-gggagaaaaatgttactcttca-3'(seqidno.1);
b3:5'-cgaaactagtgatagcgagat-3'(seqidno.2);
fip:5'-gaggcgttggtgtatttgaa-cctaaaacatgatggcgtg-3'(seqidno.3);
bip:5'-gaatcccaataagggtgtaggcg-gcaaattaaagatagctaccttgt-3'(seqidno.4);
lb:5'-ggcgtttcccatttagaagtagg-3'(seqidno.5)。
本发明的目的之二在于提供上述引物组在基于环介导等温扩增法检测高毒力株幽门螺杆菌中的应用。
本发明的目的之三在于提供一种检测高毒力株幽门螺杆菌的lamp检测方法,所述方法包括使用上述lamp检测用引物进行lamp扩增。
具体的,所述检测方法包括:
s1.配置lamp反应体系,通过lamp反应程序对反应模板进行扩增;
s2.通过肉眼观察反应管颜色变化判断检测样品中是否含有高毒力株幽门螺杆菌。
其中,所述步骤s1中,
lamp反应体系为:5pm的外引物f3和b3各1μl;40pm的内引物fip和bip各1μl;20pm环引物lb1μl;2×反应缓冲液12.5μl;1μl的bstdna聚合酶;荧光染料1μl;2μl的待测dna样品,加去离子水至25μl体系。
其中,所述dna模板包括但不限于从纯培养菌落、胃粘膜组织、胃液、肠液、唾液、牙斑、粪便中获得的dna样品;
由于本发明检测方法的高灵敏度和高特异性,本发明中dna样品通过沸水浴法获得dna粗提物即可正常使用,无需昂贵的提取试剂和繁杂的提取步骤。
lamp反应条件为:63℃恒温60min。
所述步骤s2中,如肉眼观察反应产物为绿色浑浊液体,则确认含有高毒力株幽门螺杆菌;如反应产物为橙色透明液体,则表明不含有高毒力株幽门螺杆菌。
本发明的目的之四在于提供一种高毒力株幽门螺杆菌的lamp检测试剂盒,所述试剂盒包括前述引物组、反应缓冲液、bstdna聚合酶。
其中,所述反应缓冲液组分如下:
tris-hcl0.8μmol;kcl0.4μmol;mgso40.32μmol;(hn4)2so40.4μmol;tween200.04μl;甜菜碱32μmol;4×dntps0.056μmol;
所述试剂盒还包括荧光染料。
本发明的目的之五在于提供上述试剂盒在基于环介导等温扩增法检测高毒力株幽门螺杆菌中的应用。
本发明的有益技术效果:
1.直接检测高毒力基因caga,只筛选caga阳性的患者进行药物治疗,阴性者不予处理,避免“滥杀无辜”。
2.从分子水平检测基因,敏感性高于血清法、呼气法、培养法、尿素酶法等传统方法,当细菌感染数量很低时,仍能获得理想的试验结果。
3.应用5条引物识别caga基因的7个片段进行扩增,特异性高于pcr方法,提取dna无需专门的试剂盒,只需要沸水浴10min,12000rpm×4min离心粗提dna即可,避免了引入化学试剂对后续核酸扩增的影响。
4.可预先将每个反应所需试剂、引物及染料混合并分装于各反应管中,检测时只需要在反应管中加入样本dna,盖好管盖,放入水浴锅,从反应开始至结果判读均不需要打开反应管,避免因多次加样带来的污染及随机误差。
5.反应速度快,产量大,可在30-60min内完成并肉眼可见浑浊或者颜色变化,大大缩短检测时间。
6.对标本类型无要求,胃粘膜组织、胃液、唾液、牙斑、粪便等标本均可用于检测。
7.不受临床治疗用药的干扰,无论是否活菌,只要存在caga基因,均可检测。
8.费用低廉,可适用于疗效观察的重复检测、多样本检测。
9.操作简单,不需要温度循环,在恒温仪器或水浴锅中即可进行反应,技术要求低于pcr,适合基层医院推广。
总之,本发明采用的环介导等温扩增技术,具有成本低、反应时间短、特异性强、灵敏度高、操作简便等特点,具有广阔的应用前景。
附图说明
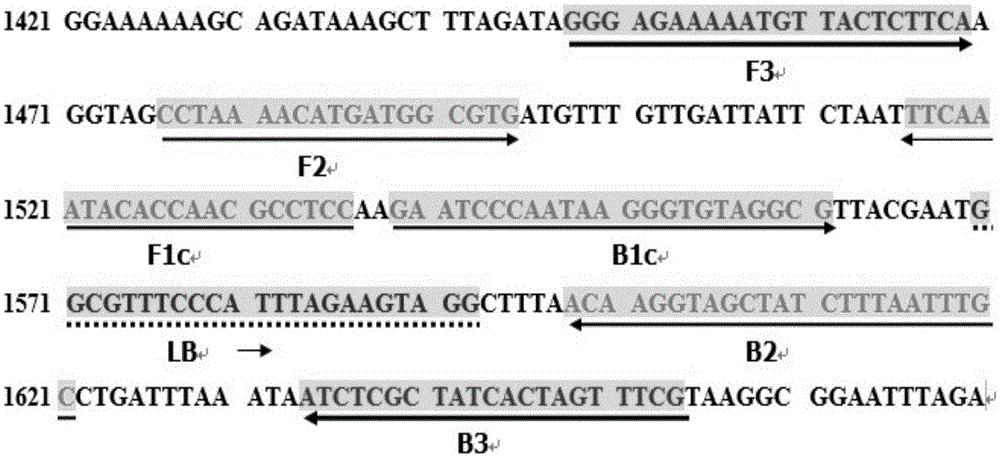
图1为caga基因lamp引物设计思路示意图;
图2为lamp目视鉴定hp结果。图中,1.阳性对照;2.阴性对照;3.临床样本;4.临床样本;
图3lamp与pcr敏感度的检测结果图;其中,图3a表示lamp敏感性检测结果:1~8,hpnctc11637标准菌株dna102~10-5ng/μl;图3b表示pcr检测结果:m,dl2000dnamarker;1~8,hpnctc11637标准菌株dna102~10-5ng/μl。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
如前所述,近年来,lamp技术已逐步应用于病原微生物的检测,但目前尚未见该方法应用于高毒力幽门螺旋杆菌的检测,更无合适高效的引物用于该领域的lamp检测。
有鉴于此,本发明的一个典型实施方式中,提供一种检测高毒力株幽门螺杆菌的lamp检测用引物,所述lamp检测引物包括:
f3:5'-gggagaaaaatgttactcttca-3'(seqidno.1);
b3:5'-cgaaactagtgatagcgagat-3'(seqidno.2);
fip:5'-gaggcgttggtgtatttgaa-cctaaaacatgatggcgtg-3'(seqidno.3);
bip:5'-gaatcccaataagggtgtaggcg-gcaaattaaagatagctaccttgt-3'(seqidno.4);
lb:5'-ggcgtttcccatttagaagtagg-3'(seqidno.5)。
虽然lamp技术已经得到广泛应用,但是引物设计仍是lamp技术成功的关键因素。本发明中,环介导等温扩增的特异性、准确性和扩增效率是本发明所面临的一个关键难题。由于caga基因存在多态性,因此有报道指出即使采用同一对引物用于扩增不同地区菌株的caga基因,caga基因的阳性检出率也不相同。因此,本发明人在通过引物软件设计的多组引物组设计基础上,重点考虑提高扩增覆盖度以提高阳性检出率,并通过不断调整摸索,并结合引物二聚体和发夹分析软件,最终获得上述引物组。而且,尽管添加环引物可提高扩增效率,但是也容易引起引物间的非特异性配对,产生假阳性的结果,导致实验结果的不准确。申请人发现,通过调整引物浓度比例可有效改善这一情况,当引物f3、b3、fip、bip与lb的浓度比达到1:1:8:8:4时,不仅扩增效率较高,同时可有效避免引物间的非特异性配对现象的发生。
本发明的又一具体实施方式中,提供上述引物组在基于环介导等温扩增法检测高毒力株幽门螺杆菌中的应用。
本发明的又一具体实施方式中,提供一种检测高毒力株幽门螺杆菌的lamp检测方法,所述方法包括使用上述lamp检测用引物进行lamp扩增。
本发明的又一具体实施方式中,所述检测方法包括:
s1.配置lamp反应体系,通过lamp反应程序对反应模板进行扩增;
s2.通过肉眼观察反应管颜色变化判断检测样品中是否含有高毒力株幽门螺杆菌。
本发明的又一具体实施方式中,所述步骤s1中,
lamp反应体系为:5pm的外引物f3和b3各1μl;40pm的内引物fip和bip各1μl;20pm环引物lb1μl;2×反应缓冲液12.5μl;1μl的bstdna聚合酶;荧光染料1μl;2μl的待测dna模板,加去离子水至25μl体系。
其中,所述dna模板包括但不限于从纯培养菌落、胃粘膜组织、胃液、肠液、唾液、牙斑、粪便中获得的dna样品;
由于本发明检测方法的高灵敏度和高特异性,本发明中dna样品通过沸水浴法(沸水浴10min,12000rpm×4min离心)获得dna粗提物即可正常使用,无需昂贵的提取试剂和繁杂的提取步骤。
lamp反应条件为:63℃恒温60min。
本发明的又一具体实施方式中,所述步骤s2中,如肉眼观察反应产物为绿色浑浊液体,则确认含有高毒力株幽门螺杆菌;如反应产物为橙色透明液体,则表明不含有高毒力株幽门螺杆菌。
本发明的又一具体实施方式中,提供一种高毒力株幽门螺杆菌的lamp检测试剂盒,所述试剂盒包括前述引物组、反应缓冲液、bstdna聚合酶。
其中,所述反应缓冲液组分如下:
tris-hcl0.8μmol;kcl0.4μmol;mgso40.32μmol;(hn4)2so40.4μmol;tween200.04μl;甜菜碱32μmol;4×dntps0.056μmol;
所述试剂盒还包括荧光染料。
本发明的又一具体实施方式中,提供上述试剂盒在基于环介导等温扩增法检测高毒力株幽门螺杆菌中的应用。
以下通过实施例对本发明做进一步解释说明,但不构成对本发明的限制。应理解这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的试验方法,通常按照常规条件进行。
实施例
1.材料与方法
1.1实验菌株与临床样本
共有10株细菌用于此次研究,幽门螺杆菌nctc11637(作为阳性对照用于特异性与敏感性的测定)、肺炎链球菌atcc6305、无乳链球菌atcc9925、粪肠球菌atcc29212、金黄色葡萄球菌atcc25923、大肠埃希氏菌atcc25922、肺炎克雷伯菌atcc700603、铜绿假单胞菌atcc27853、化脓链球菌atcc19615购自中国科学院微生物研究所、幽门螺杆菌临床分离株由本实验室菌种库提供。
188例临床样本包括胃粘膜组织、胃液、肠液、唾液、牙斑、粪便等,取自消化科门诊不同年龄、不同性别初次就诊患者。
1.2dna提取
纯培养菌落dna的提取:用取菌环刮取固体平板上纯培养的菌落,置于含0.2ml无菌双蒸水的ep管中,沸水浴10min,12000rpm离心4min,取上清转移至新的ep管中,即为细菌dna,-20℃保存,可直接用于lamp反应。
临床样本dna的提取:临床胃液、肠液、唾液、血液等液体样本先12000rpm离心5min,去上清,将沉淀与蒸馏水1:1混合后置沸水中水浴10min,12000rpm离心4min,取上清转移至新的ep管中,即为样本dna;咽拭子、牙斑拭子等样本置于1ml蒸馏水中,充分震荡,弃去拭子,按照液体样本方法提取dna;粪便样本dan提取:用无菌瓶留取适量粪便标本,加入5倍体积的生理盐水,搅拌后过滤掉粪渣,再按照液体样本方法提取dna;胃粘膜组织等固体样本置于1倍体积蒸馏水中,沸水浴10min,12000rpm离心4min,取上清转移至新的ep管中,即为样本dna,-20℃保存,可直接用于lamp反应。
用于pcr的样本dna均用专门的提取液(天根生物有限公司,北京,中国)按说明书进行dna提取。
1.3靶基因引物设计与合成
查询ncbi数据库幽门螺杆菌caga基因的核酸序列,genbankid:ab015416.1,保守序列3444bp,共设计5条引物,外引物f3、b3;内引物fip、bip,环引物lb,caga基因lamp引物设计思路见图1。设计的引物由博尚生物工程有限公司合成。为验证lamp扩增特异性与灵敏度而同步进行的常规pcr实验,就用本次实验所设计的lamp外引物f3与b3分别作为pcr的上游引物与下游引物。引物序列见表1。
表1caga靶基因引物组序列及长度
1.4lamp反应体系及操作方法
lamp反应总体系为25μl,包括反应缓冲液(2×reactionmix,rm)12.5μl(ph8.8的tris-hcl0.8μmol;kcl0.4μmol;mgso40.32μmol;(hn4)2so40.4μmol;tween200.04μl;甜菜碱32μmol;dntps0.056μmolх4种),bstdna聚合酶1.0μl(newenglandbiolabs,ipswich,ma,美国),荧光目视检测试剂(fd)1.0μl(荣研生物科技(中国)有限公司.上海,中国),外引物f3、b3各1μl(5pmol),内引物fip、bip各1μl(40pmol),环引物lb1μl(20pmol),去离子水(dw)3.5μl,待检dna2μl。反应温度设定为63℃恒温;反应时间定为60min。停止反应后肉眼观察浊度与颜色变化,颜色由浅橙色透明变为绿色浑浊为阳性。
预先分装检测:如先设置4个lamp反应,取其中一管加入反应缓冲液50μl,bstdna聚合酶4.0μl,荧光目视检测试剂(fd)4.0μl,外引物f3、b3各4μl,内引物fip、bip各4μl,环引物lb4μl,去离子水(dw)14μl,微量振荡器混匀,平均分装到4个管中(每管23μl),检测时在每个反应管中加入相应的阳性对照、阴性对照或者样本dna2μl,盖好管盖,放入水浴锅。观察结果时只需用镊子提取出lamp管即可,从反应开始至结果判读均不需要打开反应管。
1.5lamp反应的特异性
按照上述25μl的lamp扩增体系,分别以幽门螺杆菌nctc11637标准菌株、肺炎链球菌atcc6305、无乳链球菌atcc9925、粪肠球菌atcc29212、金黄色葡萄球菌atcc25923、大肠埃希氏菌atcc25922、肺炎克雷伯菌atcc700603、铜绿假单胞菌atcc27853、化脓链球菌atcc19615、幽门螺杆菌临床分离株的粗提dna为模板,进行lamp与pcr扩增,检测幽门螺杆菌caga基因的扩增特异性。
pcr反应体系设计为25μl,包括:2×taqmastermix(taqdnapolymerase,2×taqpcrbuffer,3mmmgcl2和400μmdntpmix)12.5μl;上游引物(f3:(5′-gggagaaaaatgttactcttca-3′)、下游引物(b3:5′-cgaaactagtgatagcgagat-3′)各1μl(5pmol),靶dna1μl;去离子水9.5μl。反应条件:预变性94℃×2min,然后变性94℃×30s,退火58℃×30s,延伸72℃×30s,30个循环,72℃终延伸2min。取pcr产物,2%琼脂糖凝胶电泳150v×30min,凝胶成像系统下成像。
1.6lamp敏感性及与传统pcr方法比较
用微量分光光度计检测幽门螺杆菌nctc11637标准菌株的dna的浓度,并调整为100ng/μl,用双蒸水进行10倍连续倍比稀释,使dna浓度分别为102ng/μl、101ng/μl、100ng/μl、10-1ng/μl、10-2ng/μl、10-3ng/μl、10-4ng/μl、10-5ng/μl,然后分别用上述方法进行lamp与pcr扩增,检测lamp扩增敏感性。
1.7临床样本的检测
188例不同年龄、不同性别消化科门诊初次就诊病例,在未服用任何药物、未做任何有创或无创检查前,先做呼气试验筛选hp阳性病例(尽管hp分离培养法是诊断hp感染的“金标准”,但培养条件要求苛刻,敏感性低容易漏检,而且耗时费力,本发明采用更灵敏快速的呼气试验代替培养法进行临床样本验证试验)。再收集hp阳性患者的临床样本,做胃镜检查者收集其胃粘膜组织或者胃液、肠液,未做胃镜者收集其唾液、牙斑或者粪便等。用上述方法粗提dna,用建立的lamp检测方法进行幽门螺杆菌caga基因的扩增,和经典pcr法进行比较。
2结果
2.1目视判断hp株caga基因lamp扩增结果
本发明预先设置4个lamp反应管,用幽门螺杆菌nctc11637标准菌株dna作为阳性对照;去离子水代替标准菌株dna做阴性对照来检测临床样本dna,1小时后判断结果。反应结果见图2所示,1号为阳性对照,2号为阴性对照,3号与4号为呼气试验阳性(表明感染hp株)的两例临床样本,3号样本与阳性对照一致,显示绿色浑浊,表明含有caga基因,4号样本与阴性对照一致,浅橙色透明,表明不含caga基因。
2.2lamp反应的特异性
25μl的lamp反应体系与25μl的pcr反应体系分别进行10株完全不同菌株的dna扩增,两种方法结果如表2所示,lamp扩增结果与pcr方法一致,表明caga作为靶基因进行lamp扩增具有高度特异性。
表2.lamp、pcr两种方法检测结果
2.3lamp与pcr扩增敏感性比较
连续倍比稀释后8个浓度幽门螺杆菌nctc11637标准菌株的dna,分别编号1~8,即hpnctc11637标准菌株dna102~10-5ng/μl各浓度。分别进行lamp与pcr扩增,反应结果如图3所示.图3a显示lamp反应结果,1、2、3、4、5号管显示阳性(绿色浑浊),表明lamp扩增caga基因的敏感性为0.01ng/μl;图3b看出,只有1、2、3号管pcr结果显示出条带,表明pcr反应的敏感度只有1ng/μl,lamp扩增的敏感度比pcr高100倍。
2.4临床样本检测结果
188例就诊患者检测出呼气试验阳性127例。此127例样本的粗提dna检测出lamp阳性111例,pcr阳性110例,如表3所示。111例lamp阳性表明在hp感染阳性的样本中有87.40%(111/127)的hp株携带有caga基因,与相关报道一致(我国hp感染株有90%左右携带有caga基因);pcr方法阳性例数比lamp少1例,可能由于此例为极低浓度高毒力hp株(含有caga基因的靶dna的浓度低于1ng/μl)与低毒力hp株混合感染,导致pcr方法检测不出来。
表3呼气试验、lamp和pcr方法检测临床样本
综上所述,利用lamp技术检测caga基因,反应快速,产物量非常大,阳性结果颜色变化清晰明显,裸眼容易判断;检测的特异性与敏感性均优于pcr技术,而且费用低廉,技术要求低,水煮法dna提取简单无污染,适合基层医院或者社区医院普及推广,可作为筛查高毒力株hp的理想检测技术。
应注意的是,以上实例仅用于说明本发明的技术方案而非对其进行限制。尽管参照所给出的实例对本发明进行了详细说明,但是本领域的普通技术人员可根据需要对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围。
sequencelisting
<110>济南市中心医院
<120>高毒力株幽门螺杆菌的环介导等温扩增检测方法和试剂盒
<130>
<160>5
<170>patentinversion3.3
<210>1
<211>22
<212>dna
<213>人工合成
<400>1
gggagaaaaatgttactcttca22
<210>2
<211>21
<212>dna
<213>人工合成
<400>2
cgaaactagtgatagcgagat21
<210>3
<211>40
<212>dna
<213>人工合成
<400>3
ggaggcgttggtgtatttgaacctaaaacatgatggcgtg40
<210>4
<211>47
<212>dna
<213>人工合成
<400>4
gaatcccaataagggtgtaggcggcaaattaaagatagctaccttgt47
<210>5
<211>23
<212>dna
<213>人工合成
<400>5
ggcgtttcccatttagaagtagg23
- 还没有人留言评论。精彩留言会获得点赞!