手性双膦配体、其制备方法、中间体及应用与流程
本发明涉及一种手性双膦配体、其制备方法、中间体及应用。
背景技术:
过渡金属催化的炔醛和炔酮的偶联已成为当前有机化学中有效构建烯丙醇衍生物的有效方法。通过使用各种过渡金属催化剂,如ti、ni、rh、ir、ru和pd以及各种偶联组分和还原或烷基化试剂的组合,这类反应近年来的发展已经大大扩展了其范围和应用。其中,由mori、montgomery和jamison开创的π系统的镍催化的偶联反应,由于其开发的反应具有广泛的底物范围和良好的官能团相容性,而显得格外引人注目。然而,这些底物的对映选择性环化,尤其是关于手性叔醇的对映选择性环化构建的报道还很少。手性叔醇的合成是更加困难的,因为酮的不对称加成(四取代碳合成)通常比醛的加成更具有挑战性。此外,镍催化反应通常以相当高的催化负载量(5至30mol%的ni催化剂),这使得其对于镍催化合成的实用性而言是不够“绿色”的。因此,有效的对映选择性镍催化反应的开发仍然是合成化学家的主要挑战之一。
吡咯和哌啶是有机合成中的重要组成部分,多取代的吡咯和哌啶衍生物广泛存在于生物活性天然产物和药物的结构中。一般而言,它们的光学活性形式可以增强其生物活性。然而,有效合成手性取代的吡咯和哌啶的方法仍然是有限的。在过去的二十年中,科学家们已经开发了许多金属催化的环化以构建官能团化的吡咯和哌啶衍生物。然而,现有技术中n-炔酮的对映选择性环化反应的催化剂仍然存在收率低、对映选择性不高、催化效率低或过渡金属用量大等技术问题。
技术实现要素:
本发明所要解决的技术问题是现有技术中n-炔酮的对映选择性环化反应的催化剂收率低、对映选择性不高、催化效率低或过渡金属用量大的技术问题,进而提供一种手性双膦配体、其制备方法、中间体及应用。相对于现有技术中的膦配体,本发明的手性双膦配体用于n-炔酮的对映选择性环化反应,实现了较高的收率、较佳的对映选择性或较低的过渡金属用量。
本发明提供了一种如式i所示的化合物:
其中,r1和r1’各自独立地为c1-c10烷基;
r2、r3、r4、r5和r6各自独立地为氢、c1-c10烷基、c1-c10烷氧基、c3-c10环烷基、卤素、
r2’、r3’、r4’、r5’和r6’各自独立地为氢、c1-c10烷基、c1-c10烷氧基、c3-c10环烷基、卤素、
每个r10独立地为c1-c4烷基;每个r11独立地为c1-c4烷基;
所述的5-10元杂环或5-10元杂芳环中的每个杂原子独立地为n、o或s,杂原子的个数为1、2或3个;
当所述的r1和r1’各自独立地为c1-c10烷基时,所述的c1-c10烷基可以独立地为c1-c4烷基,如叔丁基。
当所述的r2、r3、r4、r5、r6、r2’、r3’、r4’、r5’和r6’各自独立地为c1-c10烷基时,所述的c1-c10烷基可以独立地为c1-c4烷基,如甲基、乙基、正丙基、异丙基或叔丁基。
当所述的r2、r3、r4、r5、r6、r2’、r3’、r4’、r5’和r6’各自独立地为c1-c10烷氧基时,所述的c1-c10烷氧基可以独立地为c1-c4烷氧基,如甲氧基、乙氧基、正丙氧基、异丙氧基或叔丁氧基。
当所述的r2、r3、r4、r5、r6、r2’、r3’、r4’、r5’和r6’各自独立地为c3-c10时,所述的c3-c10环烷基可以独立地为c3-c6环烷基,如环丙基、环丁基、环戊基或环己基。
当所述的r2、r3、r4、r5、r6、r2’、r3’、r4’、r5’和r6’各自独立地为卤素时,所述的卤素可以独立地为氟、氯、溴或碘,例如氟。
当所述的r2、r3、r4、r5、r6、r2’、r3’、r4’、r5’和r6’各自独立地为c6-c20芳基时,所述的c6-c20芳基可以独立地为c6-c12芳基,例如苯基。
当所述的r2、r3、r4、r5、r6、r2’、r3’、r4’、r5’和r6’各自独立地为
当所述的每个r10独立地为c1-c4烷基时,所述的c1-c4烷基可以独立地为甲基。
当所述的每个r11独立地为c1-c4烷基时,所述的c1-c4烷基可以独立地为甲基。
当所述的r2、r3、r4、r5和r6中任意两个相邻的基团和与其相连的碳原子一起共同形成c5-c10环烷烃时,所述的c5-c10环烷烃可以为c5-c6环烷烃。
当所述的r2、r3、r4、r5和r6中任意两个相邻的基团和与其相连的碳原子一起共同形成6-10元芳环时,所述的6-10元芳环可以为苯环。
当所述的r2、r3、r4、r5和r6中任意两个相邻的基团和与其相连的碳原子一起共同形成5-10元杂环,所述的5-10元杂环可以为5或6元杂环,例如
当所述的r2、r3、r4、r5和r6中任意两个相邻的基团和与其相连的碳原子一起共同形成5-10元杂芳环时,所述的5-10元杂芳环可以为5或6元杂芳环。
当所述的r2’、r3’、r4’、r5’和r6’中任意两个相邻的基团和与其相连的碳原子一起共同形成c5-c10环烷烃时,所述的c5-c10环烷烃可以为c5-c6环烷烃。
当所述的r2’、r3’、r4’、r5’和r6’中任意两个相邻的基团和与其相连的碳原子一起共同形成6-10元芳环时,所述的6-10元芳环可以为苯环。
当所述的r2’、r3’、r4’、r5’和r6’中任意两个相邻的基团和与其相连的碳原子一起共同形成5-10元杂环,所述的5-10元杂环可以为5或6元杂环,例如
当所述的r2’、r3’、r4’、r5’和r6’中任意两个相邻的基团和与其相连的碳原子一起共同形成5-10元杂芳环时,所述的5-10元杂芳环可以为5或6元杂芳环。
在本发明的一些方案中,所述的r1和r1’各自独立地为c1-c10烷基;
所述的r4、r5、r6、r4’、r5’和r6’各自独立地为氢、c1-c10烷基、c1-c10烷氧基、c3-c10环烷基、卤素、
所述的r2和r3各自独立地为氢、c1-c10烷基、c1-c10烷氧基、c3-c10环烷基、卤素、
所述的r2’和r3’各自独立地为氢、c1-c10烷基、c1-c10烷氧基、c3-c10环烷基、卤素、
在本发明的一些方案中,所述的r1和r1’各自独立地为c1-c10烷基;
所述的r4、r5、r6、r4’、r5’和r6’各自独立地为氢、氟、甲基、乙基、异丙基、甲氧基、异丙氧基或
所述的r2和r3各自独立地为氢、氟、甲基、乙基、异丙基、甲氧基、异丙氧基或
所述的r2’和r3’各自独立地为氢、氟、甲基、乙基、异丙基、甲氧基、异丙氧基或
在本发明的一个实施方案中,所述的如式i所示的化合物中,所述的
在本发明的一个实施方案中,所述的如式i所示的化合物中,
在本发明的一个实施方案中,所述的如式i所示的化合物中,
在本发明的一个实施方案中,所述的r1和r1’相同。
在本发明的一个实施方案中,所述的r1和r1’为叔丁基。
在本发明的一个实施方案中,所述的如式i所示的化合物中,
r1和r1’相同;
r1和r1’为c1-c10烷基;
r3、r4、r5、r3’、r4’和r5’均为氢;
r2、r6、r2’和r6’各自独立地为c1-c10烷氧基。
所述的如式i所示的化合物可以选自如下任一结构:
本发明还提供了一种如上所述的如式i所示的化合物的制备方法,其包括如下步骤:在有机溶剂中,将如式ii所示的化合物在还原剂的存在下进行如下所示的还原反应,得到如式i所示的化合物即可;
其中,r1、r2、r3、r4、r5、r6、r1’、r2’、r3’、r4’、r5’、r6’、
所述的还原反应中,所述的有机溶剂可以为本领域该类反应的常规溶剂,如醚类溶剂(如四氢呋喃)。
所述的还原反应中,所述的有机溶剂的用量可不做具体限定,只要不影响反应进行即可。
所述的还原反应中,所述的还原剂可以本领域该类反应常规的还原剂,例如有机硅烷还原剂(如聚甲基氢硅氧烷)。所述的还原剂的用量可以为常规用量。
所述的还原反应还可以加入脱水剂,所述的脱水剂可以为钛酸酯类脱水剂,例如四异丙氧基钛。
所述的还原反应的反应温度可以为20-100℃(例如20-30℃)。
所述的还原反应一般以所述的如式ii所示的化合物不再反应时作为反应终点。
本发明还提供了一种如式ii所示的化合物:
其中,r1、r2、r3、r4、r5、r6、r1’、r2’、r3’、r4’、r5’、r6’、
在本发明的一个实施方案中,所述的如式ii所示的化合物为
本发明还提供了一种如上所述的如式ii所示的化合物的制备方法,其包括如下步骤:在有机溶剂中,将如式iii所示的化合物与如式iii-a所示的化合物在钯催化剂、膦配体和碱的存在下进行如下所示的suzuki偶联反应,得到如式ii所示的化合物即可;
其中,r1、r2、r3、r4、r5、r6、r1’、r2’、r3’、r4’、r5’、r6’、
并且,
所述的suzuki偶联反应的条件可以为本领域该类反应的常规条件,本发明优选以下条件。
所述的suzuki偶联反应中,所述的有机溶剂可以为醚类溶剂,如二氧六环。所述的有机溶剂的用量可以不做具体限定,只要不影响反应进行即可。
所述的suzuki偶联反应中,所述的钯催化剂可以为pd2(dba)3。所述的钯催化剂的用量为本领域该类反应的常规用量。
所述的suzuki偶联反应中,所述的膦配体可以为bidime(即
所述的suzuki偶联反应中,所述的碱可以为氟化钾。所述的碱的用量可以为本领域该类反应的常规用量。
所述的suzuki偶联反应的反应温度可以为80-120℃(例如100℃)。
所述的suzuki偶联反应一般以所述的如式iii所示的化合物不再反应时作为反应终点。
本发明还提供了一种如式iii所示的化合物:
其中,r1、r1’、
在本发明的一个实施方案中,所述的如式iii所示的化合物为
本发明还提供了一种如上所述的如式iii所示的化合物的制备方法,其包括如下步骤:在有机溶剂中,将如式iv所示的化合物和phntf2(即n-苯基双(三氟甲磺酰亚胺))在碱存在的条件下进行如下所示的偶联反应,得到如式iii所示的化合物即可;
其中,r1、r1’、
所述的偶联反应的条件可以为本领域该类反应的常规条件,本发明优选以下条件。
所述的偶联反应中,所述的有机溶剂可以为氯代烃类溶剂,例如二氯甲烷。所述的有机溶剂的用量可以不做具体限定,只要不影响反应进行即可。
所述的偶联反应中,所述的phntf2与所述的如式iv所示的化合物的摩尔比可以为6-10:1(如8:1)。
所述的偶联反应中,所述的碱可以为叔胺碱,例如三乙胺。所述的碱与所述的如式iv所示的化合物的摩尔比可以为10-20:1(如12:1)。
所述的偶联反应的反应温度可以为20-30℃。
所述的偶联反应一般以所述的如式iv所示的化合物不再反应时作为反应终点。
本发明还提供了一种如式iv所示的化合物:
其中,r1、r1’、
在本发明的一个实施方案中,所述的如式iv所示的化合物为
本发明还提供了一种如上所述的如式iv所示的化合物的制备方法,其包括如下步骤:在有机溶剂中,将如式v所示的化合物在钯催化剂和h2存在的条件下进行如下所示的催化氢化反应,得到如式iv所示的化合物即可;
其中,r1、r1’、
所述的催化氢化反应的条件可以为本领域该类反应的常规条件,本发明优选以下条件。
所述的催化氢化反应中,所述的有机溶剂可以为醇类溶剂,例如甲醇。所述的有机溶剂的用量可以不做具体限定,只要不影响反应进行即可。
所述的催化氢化反应中,所述的钯催化剂可以为pd/c。所述的钯催化剂的用量可以为本领域该类反应的常规用量。
所述的催化氢化反应的反应温度可以为20-30℃。
所述的催化氢化反应一般以所述的如式v所示的化合物不再反应时作为反应终点。
本发明还提供了一种如式v所示的化合物:
其中,r1、r1’、
在本发明的一个实施方案中,所述的如式v所示的化合物为
本发明还提供了一种如式v所示的化合物的制备方法,其包括如下步骤:在有机溶剂中,将如式vi-a所示的化合物和如式vi-b所示的化合物在钯催化剂、膦配体、联硼酸酯和碱的存在下进行如下所示的ullmann偶联反应,得到如式v所示的化合物即可;
其中,r1、r1’、
所述的ullmann偶联反应的条件可以为本领域该类反应的常规条件,本发明优选以下条件。
所述的ullmann偶联反应中,所述的有机溶剂可以为醚类溶剂和水的混合溶剂,例如二氧六环和水的混合溶剂(二氧六环和水的体积比可以为3-5:1,如4:1)。所述的有机溶剂的用量可以不做具体限定,只要不影响反应进行即可。
所述的ullmann偶联反应中,所述的钯催化剂可以为pd(oac)2。所述的钯催化剂的用量可以为本领域该类反应的常规用量。
所述的ullmann偶联反应中,所述的膦配体可以为sphos(即2-双环己基膦-2',6'-二甲氧基联苯)。所述的膦配体的用量可以为本领域该类反应的常规用量。
所述的ullmann偶联反应中,所述的联硼酸酯可以为联硼酸频哪醇酯。所述的联硼酸酯的用量可以为本领域该类反应的常规用量。
所述的ullmann偶联反应中,所述的碱可以为koac。所述的碱的用量可以为本领域该类反应的常规用量。
所述的ullmann偶联反应的反应温度可以为20-30℃。
上述制备方法可以进行随意组合,从而得到制备如式i、ii、iii、iv或v所示的化合物的路线(例如iii→ii→i,iv→iii→ii→i,v→iv→iii→ii→i,v→iv→iii→ii,iv→iii→ii,等等)。
本发明还提供了一种如上所述的如式i所示的化合物在如下所示的还原环化反应中作为金属配体的应用:
所述的还原环化反应包括如下步骤:在有机溶剂中,将化合物a在如式i所示的化合物、镍化合物和还原剂的存在下进行反应,得到化合物b即可;
其中,r1、r2、r3、r4、r5、r6、r1’、r2’、r3’、r4’、r5’、r6’、
n为1或2;
r7为取代或未取代的c6-c20芳基(例如c6-c12芳基,又如苯基)、取代或未取代的5-20元杂芳基(例如5-12元杂芳基,又如
r8为c1-c20烷基(例如c1-c10烷基,又如c1-c4烷基,再如甲基或乙基)或取代或未取代的c6-c20芳基(例如c6-c12芳基,又如苯基);
所述的取代的c6-c20芳基、取代的5-20元杂芳基、取代的c1-c20烷基或取代的c3-c20环烷基中的取代基各自独立地为卤素(例如氟或氯)、c1-c5卤代烷基(例如c1-c5氟代烷基,又如三氟甲基)或c1-c5烷氧基(例如甲氧基);所述的取代基的个数为一个或多个;当取代基的个数为多个时,所述的取代基相同或不同;
r9为氨基保护基(例如叔丁氧羰基、三氟甲磺酰基、苄基或对甲苯磺酰基,优选为对甲苯磺酰基)。
所述的还原环化反应的条件可以为本领域该类反应的常规条件,本发明优选以下条件。
所述的还原环化反应中,所述的有机溶剂可以为醚类溶剂,例如二氧六环。所述的有机溶剂的用量可以不做具体限定,只要不影响反应进行即可。
所述的还原环化反应中,所述的如式i所示的化合物与所述的化合物a的摩尔比可以为0.001-0.2:1。
所述的还原环化反应中,所述的镍化合物可以为本领域该类反应常规的镍化合物。本发明优选0价镍化合物,例如ni(cod)2。所述的镍化合物与所述的化合物a的摩尔比可以为0.0005-0.2:1,优选为0.005-0.1:1。
所述的还原环化反应中,所述的还原剂可以为有机硅烷还原剂,例如三乙基硅烷。所述的还原剂与所述的化合物a的摩尔比可以为2-4:1(如3:1)。
所述的还原环化反应的反应温度可以为20-100℃(例如60℃、80℃)。
在本发明的一些方案中,所述的化合物a选自如下任一结构:
在本发明中,术语“烷基”是指具有指定数目碳原子的饱和的直链或支链的一价烃基,例如c1-c10烷基是指具有1-10个碳原子的烷基。烷基的例子包括但不限于甲基(me)、乙基(et)、丙基(如正丙基、异丙基)、丁基(如正丁基、异丁基、s-丁基、t-丁基)和戊基(如n-戊基、异戊基、新戊基)。烷基任选地被一个或多个本发明所描述的取代基所取代。
在本发明中,术语“卤代烷基”是指烷基(如本发明中所定义)中的一个或多个氢原子被卤素(如本发明中所定义)所取代,卤素的个数可以为一个或多个;当卤素的个数为多个时,卤素相同或不同。卤代烷基的例子包括但不限于三氟甲基和二氟甲基。
在本发明中,术语“烷氧基”是指通过氧桥连接到分子其他部分的烷基(如本发明中所定义)。
在本发明中,术语“环烷基”或“环烷烃”是指具有指定数目环碳原子数的非芳香族的饱和或不饱和的环烃基,环烷基可以为单环或多环(例如二环和三环),可以为并环、螺环和桥环结构。环烷基内任选包含一个或多个双键或三键。单环的环烷基包括但不限于环丙基、环丁基、环戊基、1-环戊-1-烯基、1-环戊-2-烯基、1-环戊-3-烯基、环己基、1-环己-1-烯基、1-环己-2-烯基、1-环己-3-烯基、环己二烯基、环庚基、环辛基、环壬基、环癸基、环十一烷基和环十二烷基。环烷基还包括多环的环烷基结构,其中多环的结构任选地包括与饱和或部分不饱和的环烷基或杂环基或芳基或杂芳基环稠合的饱和或部分不饱和的环烷基。具有7到12个原子的双环碳环可以布置为例如双环[4,5]、[5,5]、[5,6]或[6,6]系统,或布置为桥接环系统例如双[2.2.1]庚烷、双环[2.2.2]辛烷和双环[3.2.2]壬烷。
在本发明中,术语“杂环”是指环烷烃(如本发明中所定义)内的至少一个环碳原子被选自n、o和s的杂原子代替形成的非芳香族的饱和或部分不饱和的环烃基。
在本发明中,术语“芳基”或“芳环”是指任何稳定的在各环中可高达7个原子的单环或者多环(例如双环或三环)碳环,其中至少一个环是芳香环。芳基的实例包括不限于苯基、萘基、四氢萘基、2,3-二氢化茚基、联苯基、菲基、蒽基或者苊基(acenaphthyl)。可以理解,在芳基取代基是二环取代基,且其中一个环是非芳香环的情况中,连接是通过芳环进行的。
在本发明中,术语“杂芳基”或“杂芳环”是指各环中可高达7个原子的稳定单环或者多环(例如双环或三环)碳环,其中至少一个环是芳香环并且含有至少一个选自o、n和s的杂原子。杂芳基可以通过其中的杂原子或碳原子连接到分子中的其他部分。杂芳基的例子包括但不限于吖啶基、咔唑基、噌啉基、喹喔啉基、吡唑基、吲哚基、苯并三唑基、呋喃基。
在本发明中,除非另有说明,术语“卤素”是指f、cl、br、i。
在本发明中,室温指20-30℃。
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:相对于现有技术中的膦配体,本发明的手性双膦配体用于n-炔酮的对映选择性环化反应,实现了较高的收率、较佳的对映选择性或较低的过渡金属用量。
附图说明
图1为效果实施例2中化合物3a的x射线晶体衍射图。
图2为效果实施例2中化合物3o的x射线晶体衍射图。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
实施例1(s,s)-di-bi-dime(l4)的制备
步骤1
室温下,向氮气保护下的s1(2.00g,8.84mmol,1.0当量)和咪唑(1.20g,17.68mmol,2.0当量)的二氯甲烷溶液(25ml)中,加入tbdpscl(3.20g,11.49mmol,1.3当量)。在室温下搅拌过夜后,反应用水淬灭,dcm萃取,饱和盐水洗涤,无水硫酸钠干燥,过滤,并在真空下浓缩。通过柱色谱(洗脱液:dcm/meoh100/1)纯化残余物,得到s2,为白色固体(4.11g,99%).s2:[α]d25=–8.2(c=1.0,chcl3).1hnmr(500mhz,cdcl3)δ7.81(dd,j=7.7,1.5hz,2h),7.81(dd,j=7.7,1.5hz,2h),7.50–7.42(m,3h),7.39–7.35(m,1h),7.34–7.29(m,2h),6.90(t,j=8.2hz,1h),6.39(dd,j=8.2,1.8hz,1h),6.02(dd,j=8.1,3.5hz,1h),4.56(d,j=13.7hz,1h),4.38(dd,j=13.2,10.8hz,1h),1.32(d,j=16.0hz,9h),1.12(s,9h);13cnmr(126mhz,cdcl3)δ166.29(d,j=17.6hz),157.97(d,j=1.5hz),135.51(d,j=40.3hz),135.44(d,j=0.8hz),132.14(d,j=183.7hz),130.14(d,j=1.9hz),128.01(d,j=19.6hz),113.03(d,j=5.8hz),106.43(d,j=5.4hz),104.70(d,j=92.8hz),65.79(d,j=60.0hz),34.22(d,j=73.2hz),26.56,24.69(d,j=0.8hz),19.62;31pnmr(162mhz,cdcl3)δ63.13;hrms(esi)计算值[m+na,c27h33nao3psi]+:487.1829;实测值:487.1832.
步骤2
室温下,向氮气保护下的s2(4.10g,8.82mmol,1.0当量)的dcm(90ml)溶液中,加入nbs(1.65g,9.27mmol,1.05当量)。在室温下搅拌4小时后,将反应用水淬灭,dcm萃取,饱和盐水洗涤,无水硫酸钠干燥,过滤,并在真空下浓缩。粗产物(s3)无需纯化,直接进行下一步反应。
在0℃下,向上述粗产物(s3)的thf(20ml)溶液中加入tbaf(13.3ml,13.24mmol,1.5当量,1.0m的thf溶液),并在0℃下搅拌5分钟。用水淬灭,etoac萃取,饱和盐水洗涤,无水无水硫酸钠干燥,过滤,并在真空下浓缩。残余物无需进一步纯化即可使用。
在0℃下,向上述残余物和k2co3(3.66g,26.47mmol,3.0当量)在dmf(50ml)中的溶液中,氮气保护下滴加苄溴(1.26ml,10.59mmol,1.2当量)并在室温下搅拌过夜。然后将反应用水淬灭,etoac萃取,饱和盐水洗涤,无水na2so4干燥,过滤,并在真空下浓缩。通过柱色谱(洗脱液:dcm/meoh50/1)纯化残余物,得到浅黄色固体状的s4(3.3g,95%)。s4:[α]d25=–41.9(c=1.0,meoh).1hnmr(500mhz,cdcl3)δ7.50(d,j=8.6hz,1h),7.44–7.38(m,2h),7.37–7.31(m,2h),7.31–7.26(m,1h),6.44(dd,j=8.7,4.5hz,1h),5.13(q,j=12.0hz,2h),4.60(dd,j=14.0,3.1hz,1h),4.48(dd,j=14.0,10.6hz,1h),1.21(d,j=16.6hz,9h);13cnmr(126mhz,cdcl3)δ162.23(d,j=16.7hz),159.61(d,j=2.1hz),138.97(d,j=1.3hz),135.48,128.65,128.25,127.41,106.54(d,j=6.2hz),105.07(d,j=88.2hz),98.19(d,j=6.9hz),70.99,66.87(d,j=58.4hz),34.00(d,j=73.6hz),24.65(d,j=0.8hz);31pnmr(162mhz,cdcl3)δ65.18;hrms(esi)计算值[m+h,c18h21bro3p]+:395.0407;实测值:395.0406.
步骤3
在室温,氮气保护条件下将s4(1.30g,3.29mmol,1.0当量),pd(oac)2(148mg,0.66mmol,0.2当量),sphos(567mg,1.38mmol,0.42当量),(bpin)2(585mg,2.30mmol,0.7当量)和koac(968mg,9.87mmol,3.0当量)溶于二氧六环/水(15ml,4/1)中,并在80℃下搅拌24小时。然后将反应用水淬灭,etoac萃取,饱和盐水洗涤,无水na2so4干燥,过滤,并在真空下浓缩。通过柱色谱(洗脱液:dcm/meoh20/1)纯化残余物,得到浅黄色固体状的s5(670mg,65%).s5:[α]d25=–32.7(c=1.0,meoh).1hnmr(500mhz,cdcl3)δ7.48–7.41(m,4h),7.40–7.33(m,6h),7.33–7.27(m,2h),6.59–6.53(m,2h),5.24–5.14(m,4h),4.51–4.33(m,4h),1.24(d,j=16.4hz,18h);13cnmr(126mhz,cdcl3)δ163.71(d,j=16.5hz),159.85(d,j=2.0hz),137.77,135.99,128.66,128.15,127.45,115.06(d,j=5.7hz),104.77(d,j=6.2hz),103.35(d,j=91.2hz),70.78,66.31(d,j=59.3hz),33.78(d,j=73.7hz),24.79;31pnmr(162mhz,cdcl3)δ64.88;hrms(esi)计算值[m+h,c36h41o6p2]+:631.2373;实测值:631.2377.
步骤4
将s5(825mg,1.31mmol,1.00当量),pd/c(800mg,10%)溶于meoh(15ml)中,将反应体系抽真空并充满氢气(1个大气压)。将反应混合物在氢气下搅拌过夜,然后反应体系用硅藻土(etoac洗脱液)过滤,得到s6,为白色固体(560mg,95%)。s6:[α]d25=+12.1(c=1.0,meoh).1hnmr(500mhz,cd3od)δ7.34(d,j=8.3hz,2h),6.51(dd,j=8.2,4.6hz,2h),4.69(dd,j=14.3,3.2hz,2h),4.28(dd,j=14.2,10.7hz,2h),1.30(d,j=16.6hz,18h);13cnmr(126mhz,cd3od)δ165.00(d,j=17.0hz),160.58(d,j=2.3hz),139.49,114.58(d,j=5.9hz),108.90(d,j=6.8hz),101.68(d,j=94.2hz),66.76(d,j=60.7hz),34.41(d,j=74.0hz),24.82;31pnmr(162mhz,cd3od)δ69.13;hrms(esi)计算值[m+h,c22h29o6p2]+:451.1434;实测值:451.1432.
步骤5
在室温下向s6(560mg,1.31mmol,1.0当量)的dcm溶液中加入三乙胺(2.2ml,15.70mmol,12.0当量)和phntf2(3.74g,10.47mmol,8.0当量),在室温下搅拌过夜。然后将反应用水淬灭,dcm萃取,饱和盐水洗涤,无水na2so4干燥,过滤,并在真空下浓缩。通过柱色谱(洗脱液:dcm/meoh50/1)纯化残余物,得到白色固体状的s7(735mg,78%)。s7:[α]d25=+15.6(c=1.0,chcl3).1hnmr(500mhz,cdcl3)δ7.52(d,j=8.4hz,2h),7.13(dd,j=8.4,3.6hz,2h),4.58(dd,j=14.1,1.7hz,2h),4.48(dd,j=13.9,10.9hz,2h),1.26(d,j=16.9hz,18h);13cnmr(126mhz,cdcl3)δ163.39(d,j=16.5hz),149.76,137.48,121.04(d,j=5.1hz),118.58(q,j=320.8hz),113.75(d,j=4.7hz),108.45(d,j=84.8hz),66.54(d,j=59.1hz),34.47(d,j=72.1hz),24.08;31pnmr(162mhz,cdcl3)δ63.67;hrms(esi)计算值[m+na,c24h26f6nao10p2s2]+:737.0239;实测值:737.0240.
步骤6
在室温下,向氮气保护的s7(735mg,1.03mmol,1.0当量),(2,6-二甲氧基苯基)硼酸(1.85g,8.23mmol,8.0当量)和kf(657mg,11.3mmol,11.0当量)的10ml超干的二氧六环溶液在中,加入pd2(dba)3(94mg,0.10mmol,0.1当量)和bi-dime(75mg,0.23mmol,0.22当量),并在100℃下搅拌过夜。然后将反应用水淬灭,etoac萃取,饱和盐水洗涤,无水na2so4干燥,过滤,并在真空下浓缩。通过柱色谱(洗脱液:dcm/meoh20/1)纯化残余物,得到灰色固体s8(700mg,98%)。s8:[α]d25=+48.1(c=1.0,meoh).1hnmr(500mhz,cdcl3)δ7.61(d,j=7.6hz,2h),7.33(t,j=8.4hz,2h),6.98(dd,j=7.6,3.6hz,2h),6.69(d,j=8.4hz,2h),6.60(d,j=8.3hz,2h),4.46(dd,j=13.8,0.9hz,2h),4.36(dd,j=13.6,10.4hz,2h),3.82(s,6h),3.76(s,6h),0.93(d,j=15.9hz,18h);13cnmr(126mhz,cdcl3)δ162.43(d,j=19.3hz),158.81,157.61,137.91(d,j=5.8hz),135.58,130.13,125.08(d,j=9.2hz),121.37(d,j=6.4hz),117.30(d,j=1.9hz),114.63(d,j=91.6hz),104.52,103.19,65.22(d,j=60.9hz),56.08,55.52,33.80(d,j=71.6hz),23.81;31pnmr(162mhz,cdcl3)δ62.75;hrms(esi)计算值[m+h,c38h45o8p2]+:691.2584;实测值:691.2583.
步骤9
在室温下,向s8(680mg,0.98mmol,1.0当量)的thf(20ml)溶液中加入聚甲基氢硅氧烷pmhs(5.4g)和四异丙氧基钛(2.3ml,7.88mmol,8.0当量)。将混合物在氮气下回流搅拌12小时,然后在真空下蒸馏除去大部分thf。小心地向残余物中加入30%脱气的naoh溶液(30ml)。添加过程中释放出气体。用脱气的乙醚萃取,用无水na2so4干燥,过滤,在真空下浓缩,并通过中性氧化铝柱(et2o洗脱),得到所需产物(s,s)-di-bi-dime(l4)为白色固体(610mg,90%)。l4:[α]d25=+47.1(c=1.0,chcl3).1hnmr(500mhz,cdcl3)δ7.54(d,j=7.7hz,2h),7.31(t,j=8.3hz,2h),6.96–6.90(m,2h),6.68(d,j=8.4hz,2h),6.61(d,j=8.4hz,2h),4.82(dd,j=12.6,1.4hz,2h),4.51(dd,j=24.7,12.5hz,2h),3.79(s,6h),3.73(s,6h),0.81(d,j=12.0hz,18h);13cnmr(126mhz,cdcl3)δ160.63,158.04,157.37,137.40(d,j=18.4hz),132.05,129.03,125.27(d,j=12.8hz),123.66(d,j=4.5hz),120.51,120.01,104.56,103.70,70.19(d,j=26.1hz),55.96(d,j=1.7hz),55.47,31.10(d,j=18.6hz),26.74(d,j=14.5hz);31pnmr(162mhz,cdcl3)δ–6.93;hrms(esi)计算值[m+h,c38h45o6p2]+:659.2686;实测值:659.2687.
实施例2链状n-炔酮的制备
步骤1
将叔丁基甲苯磺酰基氨基甲酸酯(17.7g,65.3mmol,1.0当量)和k2co3(13.5g,97.9mmol,1.5当量)溶解在65mldmf中并在室温下搅拌4小时。然后将(3-溴丙炔基苯(14.0g,71.8mmol,1.1当量)加入到上述溶液中,并在室温下搅拌10小时。将反应用水淬灭,etoac萃取,饱和盐水洗涤,无水na2so4干燥,过滤,并在真空下浓缩。将残余物溶于60mldcm和20mlcf3cooh中并在室温下搅拌过夜。用水淬灭,etoac萃取,饱和盐水洗涤,无水na2so4干燥,过滤,并在真空下浓缩。将残余物用己烷/etoac重结晶,得到s9,为白色固体(17.5g,94%)。s9:1hnmr(400mhz,cdcl3)δ7.85–7.78(m,2h),7.32–7.27(m,3h),7.26–7.20(m,2h),7.17–7.09(m,2h),4.63(t,j=5.8hz,1h),4.08(d,j=6.1hz,2h),2.36(s,3h);esi-ms:m/z286.2[m+h]+.
步骤2
在0℃下,向s2(5.0g,17.5mmol,1.0当量),2-溴-1-苯基乙酮(3.7g,18.4mmol,1.05当量),bu4ni(647.2mg,1.75mmol,0.1当量)的dmf(35ml)溶液中,加入k2co3(3.6g,26.3mmol,1.5当量),并在0℃下搅拌1小时。然后将反应用水淬灭,etoac萃取,饱和盐水洗涤,无水na2so4干燥,过滤,并在真空下浓缩。将残余物用己烷/etoac重结晶,得到1a,为白色固体(6.0g,85%)。1a:1hnmr(500mhz,cdcl3)δ8.01–7.95(m,2h),7.84–7.79(m,2h),7.63–7.57(m,1h),7.51–7.45(m,2h),7.33–7.26(m,3h),7.25–7.19(m,2h),7.12–7.07(m,2h),4.81(s,2h),4.49(s,2h),2.39(s,3h);13cnmr(126mhz,cdcl3)δ193.46,143.90,136.12,135.00,133.92,131.69,129.79,128.92,128.64,128.24,128.22,127.80,122.07,86.33,81.67,51.99,38.41,21.60;esi-ms:m/z404.3[m+h]+.
按照同样的方法制备链状n-炔酮1b-1p
1b:白色固体,92%产率。1hnmr(500mhz,cdcl3)δ8.01–7.95(m,2h),7.84–7.78(m,2h),7.32–7.26(m,3h),7.25–7.20(m,2h),7.13–7.07(m,2h),6.97–6.91(m,2h),4.75(s,2h),4.47(s,2h),3.87(s,3h),2.38(s,3h);13cnmr(126mhz,cdcl3)δ191.95,164.15,143.87,136.20,131.74,130.67,129.79,128.62,128.25,128.07,127.87,122.20,114.12,86.28,81.79,55.67,51.75,38.42,21.63;hrms(esi)计算值[m+na,c25h23nnao4s]+:456.1240;实测值:456.1244.
1c:白色固体,80%产率。1hnmr(500mhz,cdcl3)δ8.08–8.01(m,2h),7.85–7.77(m,2h),7.33–7.21(m,5h),7.19–7.06(m,4h),4.76(s,2h),4.47(s,2h),2.39(s,3h);13cnmr(126mhz,cdcl3)δ192.08,166.19(d,j=256.1hz),144.03,135.93,131.69,131.45(d,j=3.0hz),131.08(d,j=9.4hz),129.83,128.71,128.27,127.84,122.03,116.11(d,j=22.0hz),86.46,81.52,52.09,38.50,21.61;hrms(esi)计算值[m+na,c24h20fnnao3s]+:444.1040;实测值:444.1042.
1d:白色固体,73%产率。1hnmr(500mhz,cdcl3)δ7.96–7.92(m,2h),7.82–7.78(m,2h),7.47–7.42(m,2h),7.33–7.26(m,3h),7.25–7.20(m,2h),7.13–7.06(m,2h),4.74(s,2h),4.45(s,2h),2.38(s,3h);13cnmr(126mhz,cdcl3)δ192.57,144.07,140.45,135.88,133.33,131.71,129.86,129.77,129.28,128.74,128.29,127.85,122.01,86.52,81.48,52.19,38.53,21.64;hrms(esi)计算值[m+na,c24h20clnnao3s]+:460.0745;实测值:460.0745.
1e:白色固体,64%产率。1hnmr(500mhz,cdcl3)δ8.14–8.08(m,2h),7.84–7.79(m,2h),7.76–7.71(m,2h),7.35–7.21(m,5h),7.12–7.06(m,2h),4.79(s,2h),4.46(s,2h),2.40(s,3h);13cnmr(126mhz,cdcl3)δ193.03,144.18,137.70,135.71,135.04(q,j=32.6hz),131.68,129.90,128.80,128.75,128.30,127.85,125.96(q,j=3.6hz),123.56(d,j=272.8hz),121.91,86.66,81.35,52.58,38.63,21.61;hrms(esi)计算值[m+na,c25h20f3nnao3s]+:494.1008;实测值:494.1009.
1f:浅黄色固体,92%产率。1hnmr(500mhz,cdcl3)δ7.85–7.77(m,2h),7.59–7.54(m,1h),7.54–7.48(m,1h),7.41–7.36(m,1h),7.33–7.26(m,3h),7.25–7.19(m,2h),7.17–7.07(m,3h),4.79(s,2h),4.48(s,2h),3.85(s,3h),2.39(s,3h);13cnmr(126mhz,cdcl3)δ193.39,160.01,143.92,136.29,136.10,131.71,129.93,129.81,128.66,128.25,127.81,122.08,120.74,120.53,112.49,86.36,81.65,55.62,52.16,38.42,21.62;hrms(esi)计算值[m+na,c25h23nnao4s]+:456.1240;实测值:456.1242.
1g:浅黄色固体,86%产率。1hnmr(500mhz,cdcl3)δ7.83–7.77(m,3h),7.54–7.47(m,1h),7.31–7.26(m,3h),7.25–7.20(m,2h),7.15–7.10(m,2h),7.04–6.95(m,2h),4.83(s,2h),4.51(s,2h),3.91(s,3h),2.38(s,3h);13cnmr(126mhz,cdcl3)δ194.97,159.14,143.54,136.72,134.67,131.65,130.99,129.60,128.51,128.23,127.76,125.52,122.36,121.05,111.67,85.83,82.38,56.11,55.73,38.43,21.60;hrms(esi)计算值[m+na,c25h23nnao4s]+:456.1240;实测值:456.1243.
1h:浅黄色固体,79%产率。1hnmr(500mhz,cdcl3)δ8.27–8.21(m,1h),8.06(s,1h),7.72(d,j=8.2hz,2h),7.27–7.20(m,3h),7.19–7.14(m,3h),7.13–7.07(m,2h),6.99–6.93(m,2h),4.42(s,2h),4.35(s,2h),3.74(s,3h),2.25(s,3h);13cnmr(126mhz,cdcl3)δ188.54,143.99,137.30,136.83,135.72,131.72,129.78,128.52,128.17,127.96,126.72,123.74,123.06,122.63,122.26,113.99,109.86,86.41,81.51,53.34,38.55,33.83,21.59;hrms(esi)计算值[m+h,c27h25n2o3s]+:457.1580;实测值:457.1582.
1i:白色固体,79%产率。1hnmr(500mhz,cdcl3)δ7.79–7.74(m,2h),7.32–7.24(m,5h),7.17–7.12(m,2h),4.45(s,2h),4.40(s,2h),2.39(s,3h),1.18(s,9h);13cnmr(126mhz,cdcl3)δ208.92,143.74,136.42,131.68,129.73,128.70,128.34,127.68,122.16,86.11,81.88,49.72,43.64,37.85,26.48,21.60;hrms(esi)计算值[m+na,c20h25nnao3s]+:406.1447;实测值:406.1447.
1j:白色固体,82%产率。1hnmr(500mhz,cdcl3)δ7.96(d,j=7.3hz,2h),7.77(d,j=8.2hz,2h),7.59(t,j=7.4hz,1h),7.47(t,j=7.7hz,2h),7.31(d,j=8.0hz,2h),4.74(s,2h),4.21(s,2h),2.42(s,3h),1.94(tq,j=7.5,2.0hz,2h),0.90(t,j=7.5hz,3h);13cnmr(126mhz,cdcl3)δ193.62,143.67,136.29,135.10,133.82,129.61,128.88,128.18,127.81,88.45,71.81,51.80,38.04,21.64,13.56,12.27;hrms(esi)计算值[m+na,c20h21nnao3s]+:378.1134;实测值:378.1138.
1k:白色固体,86%产率。1hnmr(500mhz,cdcl3)δ8.00–7.94(m,2h),7.69–7.62(m,1h),7.56–7.49(m,2h),7.42–7.27(m,5h),5.05(s,2h),4.67(s,2h);13cnmr(126mhz,cdcl3)δ191.55,134.50,134.20,131.96,129.22,129.18,128.53,128.09,121.64,119.91(q,j=322.3hz),87.12,80.73,52.32,39.89;hrms(esi)计算值[m+na,c18h14f3nnao3s]+:404.0539;实测值:404.0541.
1l:白色固体,77%产率。1hnmr(500mhz,cdcl3)δ7.96–7.89(m,2h),7.53–7.47(m,1h),7.42–7.31(m,6h),7.29–7.17(m,6h),4.01(s,2h),3.78(s,2h),3.66(s,2h);13cnmr(126mhz,cdcl3)δ197.52,138.03,136.23,133.35,131.92,129.50,128.65,128.55,128.45,128.43,128.32,127.59,123.21,86.29,84.21,59.58,58.38,43.46;hrms(esi)计算值[m+h,c24h22no]+:340.1696;实测值:340.1699.
1m:白色固体,75%产率。1hnmr(500mhz,cdcl3)δ8.04–7.98(m,2h),7.60(t,j=7.4hz,1h),7.49(t,j=7.6hz,2h),7.31–7.22(m,5h),5.78(d,j=8.3hz,1h),5.56–5.48(m,1h),3.04(dd,j=17.1,5.8hz,1h),2.89(dd,j=17.0,5.1hz,1h),1.47(s,9h);13cnmr(126mhz,cdcl3)δ197.35,155.27,134.88,133.84,131.71,128.93,128.75,128.22,128.07,123.16,84.17,84.12,80.16,53.93,28.45,24.75;hrms(esi)计算值[m+na,c22h23nnao3]+:372.1570;实测值:372.1573.
1n:白色固体,90%产率。1hnmr(500mhz,cdcl3)δ7.98–7.92(m,2h),7.85–7.77(m,2h),7.59–7.52(m,1h),7.48–7.40(m,2h),7.31–7.18(m,5h),7.11–7.05(m,2h),4.44(s,2h),3.71(t,j=7.1hz,2h),3.45(t,j=7.1hz,2h),2.33(s,3h);13cnmr(126mhz,cdcl3)δ198.10,143.65,136.47,135.61,133.42,131.53,129.61,128.68,128.45,128.13,128.07,127.83,122.11,85.58,82.31,42.82,39.01,38.57,21.44;hrms(esi)计算值[m+h,c25h24no3s]+:418.1471;实测值:418.1465.
1o:白色固体,80%产率。1hnmr(500mhz,cdcl3)δ7.95(dd,j=8.3,1.1hz,2h),7.76(d,j=8.3hz,2h),7.59–7.54(m,1h),7.46(t,j=7.7hz,2h),7.29(d,j=8.0hz,2h),4.15(t,j=2.2hz,2h),3.60(t,j=7.3hz,2h),3.39(t,j=7.3hz,2h),2.41(s,3h),1.92(qt,j=7.5,2.2hz,2h),0.89(t,j=7.5hz,3h);13cnmr(126mhz,cdcl3)δ198.29,143.52,136.61,135.87,133.49,129.51,128.77,128.15,127.93,87.62,72.39,42.64,38.62,38.57,21.60,13.54,12.24;hrms(esi)计算值[m+h,c21h23no3s]+:370.1471;实测值:370.1472.
1p:白色固体,93%产率。1hnmr(500mhz,cdcl3)δ8.06–7.93(m,2h),7.81(d,j=8.2hz,2h),7.33–7.20(m,5h),7.20–7.04(m,4h),4.42(s,2h),3.68(t,j=7.0hz,2h),3.43(t,j=7.0hz,2h),2.35(s,3h).13cnmr(126mhz,cdcl3)δ196.66,167.02,164.99,143.80,135.62,133.05(d,j=3.0hz),131.61,130.86(d,j=9.4hz),129.71,128.57,128.22,127.93,122.16,85.67,82.35,42.92,39.21,38.71,21.53;19fnmr(376mhz,cdcl3)δ–104.62(m).hrms(esi)计算值[m+na,c25h22fnnao3s]+:458.1197;实测值:458.1204.`
1q:白色固体,85%产率。1hnmr(400mhz,cdcl3)δ7.99(dd,j=8.7,5.4hz,2h),7.75(d,j=8.2hz,2h),7.29(d,j=8.0hz,2h),7.14(t,j=8.5hz,2h),4.14(s,2h),3.59(t,j=7.2hz,2h),3.37(t,j=7.2hz,2h),2.42(s,3h),1.93(dd,j=15.1,7.6hz,2h),0.90(t,j=7.5hz,3h);13cnmr(126mhz,cdcl3)δ196.79,167.07,165.04,143.61,135.84,133.14(d,j=2.9hz),130.87(d,j=9.3hz),129.57,128.65(d,j=267.4hz),127.97,116.03,115.86,87.68,72.42,42.69,38.76,38.76,21.64,13.58,12.28;19fnmr(376mhz,cdcl3)δ–104.69(m);hrms(esi)计算值[m+na,c21h22fnnao3s]+:410.1197;实测值:410.1201.
效果实施例1
操作如下:在手套箱中,氮气保护下,将ni(cod)2(2μmol,1mol%),膦配体(1μmol/2μmol,0.5mol%/1mol%)和二氧六环(0.5ml)加入到5ml的小瓶中,配备磁子搅拌。将底物1a(0.2mmol,1.0当量)一次性加入到溶液中,搅拌5分钟,然后加入三乙基硅烷(et3sih,0.6mmol,3.0当量)。封闭小瓶,并将所得混合物在25℃下搅拌12小时。用饱和碳酸氢钠(nahco3)淬灭,乙酸乙酯(etoac)萃取,饱和nacl洗涤,无水硫酸钠干燥,过滤,并在真空下浓缩。通过柱色谱(10%石油醚/etoac)纯化残余物,得到化合物2a。
采用如上操作,不同的膦配体、膦配体的用量以及ni(cod)2的用量的反应结果如下表所示:
表1不同的膦配体的反应结果
效果实施例2
以化合物1a为还原环化的底物,以实施例1制备的双膦配体l4和ni(cod)2为催化剂,三乙基硅烷为还原剂,高配体承载量(s/c=1000)制备光学活性的手性吡咯三级醇类化合物2a。
操作如下:在手套箱中,氮气保护下,向搅拌的ni(cod)2(0.682mg,2.48μmol,0.1mol%),l4(0.816mg,1.24μmol,0.05mol%)的二氧六环(3ml)黄色溶液的反应瓶中,一次性加入n-炔酮1a(1.0g,2.48mmol,1.0当量)。将所得棕色溶液搅拌15分钟,然后加入三乙基硅烷(et3sih,1.19ml,7.44mmol,3.0当量)。将小瓶密封,并将所得混合物在60℃下搅拌12小时。用饱和碳酸氢钠(nahco3)淬灭,用乙酸乙酯(etoac)萃取,用饱和nacl洗涤,经无水硫酸钠(na2so4)干燥,过滤,并在真空下浓缩。通过柱色谱(10%石油醚/etoac)纯化残余物,得到化合物2a,为无色油状物(1.26g,98%收率,99:1er)。
2a:无色油状物,98%产率,99:1er,0.05mol%l4。er值由手性高压液相测定;高压液相条件:手性ad-h柱,25℃,流速:1ml/min,正己烷/异丙醇:98/2,254nm,6.8min(r),10.2min(s)。其绝对构型由3a(2a脱硅基产物)的x-ray单晶结构确定;[α]d25=+23.6(c=1.0,chcl3);1hnmr(500mhz,cdcl3)δ7.75(d,j=8.0hz,2h),7.48(d,j=7.4hz,2h),7.41–7.25(m,8h),7.16(d,j=7.6hz,2h),6.45(s,1h),4.38(d,j=14.9hz,1h),4.21(dd,j=14.9,1.8hz,1h),3.68(d,j=9.6hz,1h),3.44(d,j=9.6hz,1h),2.44(s,3h),0.91(t,j=7.9hz,9h),0.55(q,j=7.7hz,6h);13cnmr(126mhz,cdcl3)δ144.01,143.98,142.39,135.92,132.59,129.89,128.78,128.59,128.19,127.95,127.75,127.55,126.10,126.10,83.10,60.68,50.56,21.65,7.14,6.25;hrms(esi)计算值[m+na,c30h37nnao3ssi]+:542.2156;实测值:542.2159.
化合物2a合成化合物3a
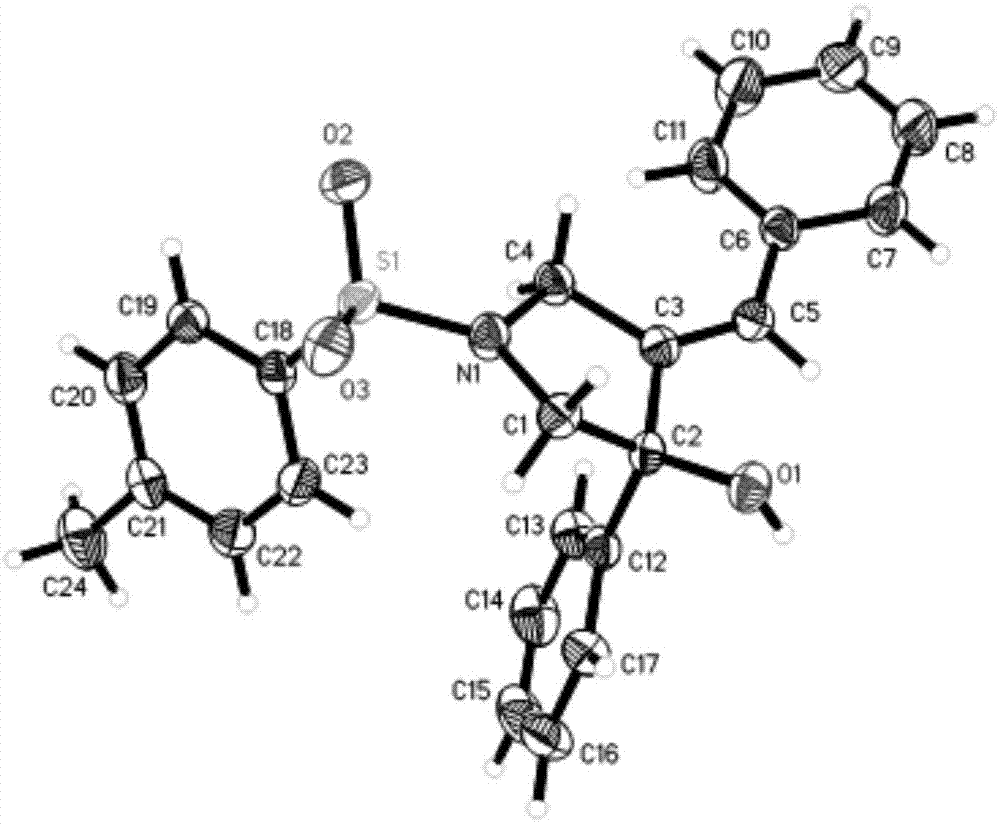
在0℃下,向2a(520mg,1.0mmol,1.0当量)的thf(10ml)溶液中加入tbaf(1.0mthf溶液,1.5ml,1.5当量),在0℃下搅拌0.5小时。用水淬灭,etoac萃取,饱和盐水洗涤,无水na2so4干燥,过滤,并在真空下浓缩。通过柱色谱(20%石油醚/etoac)纯化残余物,得到化合物3a,为白色固体(390mg,96%)。3a:[α]d25=+24.5(c=1.0,chcl3);1hnmr(500mhz,cdcl3)δ7.63(d,j=8.2hz,2h),7.39–7.32(m,2h),7.29–7.13(m,8h),7.03(d,j=7.4hz,2h),6.19(t,j=2.3hz,1h),4.40(dd,j=15.0,2.4hz,1h),4.16(dd,j=15.0,2.5hz,1h),3.47(q,j=10.4hz,2h),2.42(s,1h),2.32(s,3h);13cnmr(126mhz,cdcl3)δ144.03,142.58,141.59,135.64,132.98,129.93,128.76,128.65,128.44,128.01,127.97,127.94,126.61,126.31,82.05,61.50,50.72,21.68;hrms(esi)计算值[m+na,c24h23nnao3s]+:428.1291;实测值:428.1292.化合物3a的x射线晶体衍射图如图1所示。
以实施例2制备的化合物1b-1p为还原环化的底物,以双膦配体l4和ni(cod)2的络合物为催化剂,三乙基硅烷为还原剂,制备光学活性的手性吡咯三级醇类化合物2b-1q(反应操作同效果实施例2中化合物1a)。
2b:无色油状物,87%产率,98:2er,0.5mol%l4。er值由手性高压液相测定;高压液相条件:手性ad-h柱,25℃,流速:1ml/min,正己烷/异丙醇:98/2,254nm,15.4min(r),24.6min(s);[α]d25=+19.1(c=1.0,chcl3);1hnmr(500mhz,cdcl3)δ7.73(d,j=8.0hz,2h),7.43–7.26(m,7h),7.15(d,j=7.5hz,2h),6.84(d,j=8.6hz,2h),6.47(s,1h),4.34(d,j=14.8hz,1h),4.18(d,j=14.8hz,1h),3.82(s,3h),3.68(d,j=9.5hz,1h),3.39(d,j=9.5hz,1h),2.43(s,3h),0.90(t,j=7.9hz,9h),0.53(dd,j=15.6,7.7hz,6h);13cnmr(126mhz,cdcl3)δ159.01,143.91,142.39,135.96,135.70,132.73,129.87,128.76,128.60,127.89,127.68,127.47,125.53,113.49,82.70,60.30,55.35,50.33,21.64,7.14,6.24;hrms(esi)计算值[m+h,c31h40no4ssi]+:550.2447;实测值:550.2431.
2c:无色油状物,90%产率,99:1er,0.5mol%l4。er值由手性高压液相测定;高压液相条件:手性ad-h柱,25℃,流速:1ml/min,正己烷/异丙醇:98/2,254nm,6.9min(r),10.6min(s);[α]d25=+11.9(c=1.0,chcl3);1hnmr(500mhz,cdcl3)δ7.74(d,j=8.2hz,2h),7.48–7.42(m,2h),7.40–7.31(m,4h),7.28(t,j=7.4hz,1h),7.15(d,j=7.4hz,2h),7.02–6.96(m,2h),6.44(t,j=2.3hz,1h),4.34(dd,j=14.9,2.3hz,1h),4.21(dd,j=14.9,2.6hz,1h),3.66(d,j=9.6hz,1h),3.40(d,j=9.6hz,1h),2.44(s,3h),0.89(t,j=7.9hz,9h),0.58–0.49(m,6h);13cnmr(126mhz,cdcl3)δ162.16(d,j=246.4hz),144.08,142.13,139.95(d,j=3.1hz),135.74,132.47,129.91,128.81,128.57,127.91,127.86(d,j=2.0hz),127.80,126.08,114.98(d,j=21.4hz),82.63,60.46,50.43,21.62,7.09,6.23;hrms(esi)计算值[m+h,c30h37o3nfssi]+:538.2247;实测值:538.2234.
2d:无色油状物,74%产率,99:1er,0.5mol%l4。er值由手性高压液相测定;高压液相条件:手性ad-h柱,25℃,流速:1ml/min,正己烷/异丙醇:98/2,254nm,7.2min(r),9.4min(s);[α]d25=+11.6(c=1.0,chcl3);1hnmr(500mhz,cdcl3)δ7.73(d,j=8.2hz,2h),7.43–7.32(m,6h),7.31–7.25(m,3h),7.14(d,j=7.4hz,2h),6.41(t,j=2.2hz,1h),4.35(dd,j=15.0,2.3hz,1h),4.20(dd,j=15.0,2.6hz,1h),3.63(d,j=9.7hz,1h),3.40(d,j=9.7hz,1h),2.44(s,3h),0.89(t,j=7.9hz,9h),0.58–0.48(m,6h);13cnmr(126mhz,cdcl3)δ144.14,142.91,141.98,135.70,133.42,132.43,129.94,128.84,128.59,128.36,127.93,127.51,126.34,110.10,82.69,60.50,50.50,21.67,7.11,6.25;hrms(esi)计算值[m+h,c30h37o3nclssi]+:554.1952;实测值:554.1935.
2e:无色油状物,98%产率,>99:1er,0.25mol%l4。er值由手性高压液相测定;高压液相条件:手性ad-h柱,25℃,流速:1ml/min,正己烷/异丙醇:98/2,254nm,7.7min(r),9.0min(s);[α]d25=+13.4(c=1.0,chcl3);1hnmr(500mhz,cdcl3)δ7.76(d,j=8.1hz,2h),7.59(dd,j=19.6,8.4hz,4h),7.41–7.33(m,4h),7.32–7.27(m,1h),7.15(d,j=7.5hz,2h),6.41(s,1h),4.38(dd,j=15.0,2.0hz,1h),4.26(dd,j=15.0,2.3hz,1h),3.65(d,j=9.8hz,1h),3.44(d,j=9.8hz,1h),2.45(s,3h),0.90(t,j=7.9hz,9h),0.61–0.51(m,6h);13cnmr(126mhz,cdcl3)δ148.77,144.26,141.87,135.57,132.20,129.96,129.70(q,j=32.4hz),128.86,128.57,128.04,127.98,126.91,126.27,125.21(q,j=3.7hz),124.21(q,j=272.2hz),82.87,60.73,50.69,21.61,7.07,6.24;hrms(esi)计算值[m+h,c31h37o3nf3ssi]+:588.2210;实测值:588.2216.
2f:无色油状物,98%产率,99:1er,0.25mol%l4。er值由手性高压液相测定;高压液相条件:手性ad-h柱,25℃,流速:1ml/min,正己烷/异丙醇:98/2,254nm,12.3min(s),22.3min(r);[α]d25=+34.3(c=1.0,chcl3);1hnmr(500mhz,cdcl3)δ7.75(d,j=8.2hz,2h),7.41–7.31(m,4h),7.31–7.26(m,1h),7.22(t,j=8.0hz,1h),7.18–7.13(m,2h),7.13–7.09(m,1h),7.02–6.97(m,1h),6.84–6.80(m,1h),6.44(t,j=2.3hz,1h),4.40(dd,j=14.9,2.3hz,1h),4.21(dd,j=14.9,2.6hz,1h),3.81(s,3h),3.64(d,j=9.7hz,1h),3.46(d,j=9.7hz,1h),2.44(s,3h),0.91(t,j=7.9hz,9h),0.56(q,j=7.6hz,6h);13cnmr(126mhz,cdcl3)δ159.46,145.83,143.98,142.23,135.91,132.57,129.88,129.19,128.77,128.58,127.93,127.76,126.33,118.47,112.71,112.19,83.14,60.96,55.29,50.63,21.63,7.15,6.26;hrms(esi)计算值[m+h,c31h40no4ssi]+:550.2447;实测值:550.2432.
2g:无色油状物,98%产率,99:1er,0.5mol%l4,60℃。er值由手性高压液相测定;高压液相条件:手性ad-h柱,25℃,流速:1ml/min,正己烷/异丙醇:98/2,254nm,12.2min(s),14.9min(r);[α]d25=+27.0(c=1.0,chcl3);1hnmr(500mhz,cdcl3)δ7.83(dd,j=7.7,1.7hz,1h),7.79(d,j=8.2hz,2h),7.38(d,j=8.0hz,2h),7.33(t,j=7.6hz,2h),7.26–7.20(m,2h),7.08(d,j=7.4hz,2h),7.00(td,j=7.6,0.8hz,1h),6.67(d,j=7.9hz,1h),6.04(t,j=2.1hz,1h),4.63(dd,j=14.1,2.0hz,1h),4.03(dd,j=14.1,2.9hz,1h),3.55(s,2h),3.10(s,3h),2.45(s,3h),0.98(t,j=7.9hz,9h),0.79–0.63(m,6h);13cnmr(126mhz,cdcl3)δ155.26,144.43,143.70,136.67,132.92,132.06,129.62,128.86,128.71,128.49,128.31,127.45,127.33,124.48,120.36,111.05,82.94,60.39,54.33,51.97,21.65,7.30,6.16;hrms(esi)计算值[m+h,c31h40no4ssi]+:550.2447;实测值:550.2433.
2h:无色油状物,80%产率,99:1er,1mol%l4,80℃。er值由手性高压液相测定;高压液相条件:手性od-h柱,25℃,流速:1ml/min,正己烷/异丙醇:98/2,254nm,13.3min(s),20.5min(r);[α]d25=+25.9(c=1.0,chcl3);1hnmr(500mhz,cdcl3)δ7.79(d,j=8.3hz,2h),7.61(d,j=8.0hz,1h),7.41–7.27(m,7h),7.21(t,j=7.4hz,1h),7.18–7.15(m,2h),7.13(d,j=7.7hz,2h),7.09(s,1h),6.44(t,j=3.0hz,1h),4.71(d,j=3.0hz,2h),3.84(s,3h),2.42(s,3h),1.00(t,j=8.0hz,9h),0.62(q,j=8.0hz,6h);13cnmr(126mhz,cdcl3)δ144.33,138.65,137.12,137.10,133.16,131.54,130.08,128.72,128.02,127.82,127.60,127.00,126.49,123.28,122.38,120.18,119.91,117.53,109.66,105.90,53.17,33.05,21.68,6.71,5.92;hrms(esi)计算值[m-otes,c27h25n2o2s]+:441.1637;实测值:441.1619.
2i:无色油状物,94%产率,>99:1er,1mol%l4,80℃。er值由手性高压液相测定其脱硅基产物3i;高压液相条件:手性ad-h柱,25℃,流速:1ml/min,正己烷/异丙醇:80/20,254nm,16.3min(r),21.8min(s);[α]d25=–40.7(c=1.0,chcl3);1hnmr(500mhz,cdcl3)δ7.74–7.69(m,2h),7.41–7.35(m,2h),7.33–7.26(m,3h),7.18–7.14(m,2h),6.45(t,j=2.4hz,1h),4.26(dd,j=14.9,2.8hz,1h),4.05(dd,j=14.9,2.2hz,1h),3.82(d,j=10.0hz,1h),2.89(d,j=10.0hz,1h),2.40(s,3h),0.96(s,9h),0.81(t,j=7.9hz,9h),0.46–0.28(m,6h);13cnmr(126mhz,cdcl3)δ143.93,140.19,136.05,132.24,129.84,128.81,128.65,127.89,127.51,126.77,86.32,54.49,51.48,39.95,25.13,21.62,7.23,6.46;hrms(esi)计算值[m+na,c28h41nnao3ssi]+:522.2469;实测值:522.2465.
2j:无色油状物,83%产率,92:8er,1mol%l4,80℃。er值由手性高压液相测定其脱硅基产物3j;高压液相条件:手性od-h柱,25℃,流速:1ml/min,正己烷/异丙醇:85/15,230nm,14.1min(r),17.8min(s);[α]d25=+17.1(c=1.0,chcl3);1hnmr(500mhz,cdcl3)δ7.72(d,j=8.2hz,2h),7.39–7.33(m,4h),7.30–7.22(m,3h),5.35(tt,j=7.3,2.5hz,1h),4.13–4.06(m,1h),3.85–3.79(m,1h),3.48–3.41(m,2h),2.46(s,3h),1.99–1.91(m,2h),0.93(t,j=7.5hz,3h),0.89(t,j=7.9hz,9h),0.53(q,j=7.7hz,6h);13cnmr(126mhz,cdcl3)δ144.24,143.87,140.76,132.58,129.80,129.08,128.05,127.95,127.24,126.15,82.18,62.86,49.59,22.77,21.68,13.23,7.15,6.26;hrms(esi)计算值[m+h,c26h38no3ssi]+:472.2336;实测值:472.2338.
2n:无色油状物,95%产率,90:10er,2mol%l4。er值由手性高压液相测定;高压液相条件:手性ad-h柱,25℃,流速:1ml/min,正己烷/异丙醇:99/1,254nm,10.9min(r),15.5min(s);[α]d25=–14.9(c=1.0,chcl3);1hnmr(400mhz,cdcl3)δ7.52(d,j=7.8hz,2h),7.41–7.32(m,4h),7.32–7.22(m,6h),7.20(d,j=7.8hz,2h),6.85(s,1h),4.35(d,j=12.8hz,1h),3.67–3.58(m,1h),3.18(d,j=12.8hz,1h),3.03(t,j=10.1hz,1h),2.67(d,j=13.5hz,1h),2.36(s,3h),2.17–2.07(m,1h),0.74(t,j=7.9hz,9h),0.39–0.18(m,6h);13cnmr(126mhz,cdcl3)δ143.51,141.58,138.51,136.65,133.85,129.63,129.10,128.55,128.52,128.05,127.82,127.40,127.31,127.17,77.32,45.02,43.96,37.82,21.60,7.04,6.38;hrms(esi)计算值[m+h,c31h40no3ssi]+:534.2493;实测值:534.2495.
2o:无色油状物,95%产率,90:10er,2mol%l4。er值由手性高压液相测定;高压液相条件:手性ad-h柱,25℃,流速:1ml/min,正己烷/异丙醇:99/1,254nm,6.2min(r),8.1min(s),其绝对构型由3o(2o脱硅基产物)的x-ray单晶结构确定;[α]d25=–18.9(c=1.0,chcl3);1hnmr(500mhz,cdcl3)δ7.59(d,j=8.2hz,2h),7.26–7.18(m,7h),5.58(t,j=7.4hz,1h),3.99(d,j=12.7hz,1h),3.43–3.37(m,1h),3.21(d,j=12.8hz,1h),3.03(ddd,j=12.1,9.3,3.1hz,1h),2.45(ddd,j=13.3,6.4,3.2hz,1h),2.35(s,3h),2.11(dtd,j=14.8,7.4,3.5hz,2h),1.92(ddd,j=13.2,9.1,3.9hz,1h),0.95(t,j=7.5hz,3h),0.67(t,j=7.9hz,9h),0.29–0.13(m,6h);13cnmr(126mhz,cdcl3)δ143.48,142.37,135.41,134.08,129.67,129.60,128.23,127.76,127.71,127.36,77.19,44.12,43.71,38.17,21.60,20.83,14.34,7.03,6.41;hrms(esi)计算值[m+na,c27h39nnao3ssi]+:508.2312;实测值:508.2320.
3o(2o脱硅基产物):3o的制备参考3a的合成步骤.白色固体;[α]d25=–24.8(c=1.0,chcl3);1hnmr(500mhz,chcl3)δ7.68(d,j=8.1hz,2h),7.36–7.28(m,6h),7.28–7.24(m,1h),5.14(t,j=7.3hz,1h),4.16(d,j=13.1hz,1h),3.58(d,j=13.1hz,1h),3.52–3.44(m,1h),3.17(td,j=11.7,2.8hz,1h),2.44(s,3h),2.39–2.31(m,1h),2.17–1.99(m,2h),1.84–1.79(m,1h),1.78(s,1h),0.90(t,j=7.5hz,3h);13cnmr(126mhz,chcl3)δ143.74,143.62,135.52,134.02,131.74,129.78,128.22,127.78,127.47,126.35,77.41,77.16,76.91,75.34,43.84,42.90,38.79,21.63,20.78,13.96;hrms(esi)计算值[m+h,c21h26no3s]+:372.1628;实测值:372.1629。化合物3o的x射线晶体衍射图如图2所示。
- 还没有人留言评论。精彩留言会获得点赞!