大菱鲆蛋白质二硫键异构酶A3的重组蛋白及其制备和应用的制作方法
本发明属于分子生物学技术领域,具体说是一种大菱鲆蛋白质二硫键异构酶a3的重组蛋白及其制备和应用。
背景技术:
蛋白质合成是每一个真核生物中必然发生的生物过程,其中蛋白折叠也是必需的,而目前为止仅有两个酶能够催化这一进程:一个是蛋白质二硫键异构酶(pdi),另一个是肽基脯氨酸异构酶(ppi)。蛋白二硫键异构酶于1963年首次由goldberger等学者发现,后来由anfinsen等学者从人肝组织中分离纯化出来,并测定了其分子结构。典型的pdi分子结构包括三个部分:两个包含cxxc活性位点的硫氧还原蛋白活性结构域,负责催化蛋白质二硫键的氧化、还原和异构化;两个没有活性位点的底物结合结构域,负责底物和酶的特异性结合;一个c-末端的内质网驻留信号,负责将酶锚定在内质网上。
除了作为蛋白折叠酶催化二硫键的形成,pdi还具有其他方面的生理功能。例如:pdi通过参与免疫细胞对病毒的融合和吞噬过程,在免疫反应中发挥着重要作用;pdi还可作为分子伴侣,既能帮助新生蛋白质的正确折叠,又能使错误折叠与未折叠蛋白恢复生物活性;pdi家族成员还可参与精子与卵细胞的融合过程,而且可能与卵巢的早期发育有关;此外,pdi还与酵母生孢反应、小鼠体内血栓形成、前胶原成熟加工、内质网中抗坏血酸盐的积累、t细胞抗原呈递等多种生物过程有关。
温度是鱼类生活史中一种非常重要的环境因子,它不仅影响着鱼类的摄食、胚胎发育、标准代谢,而且可以影响鱼类的免疫反应、氧化还原酶活性、消化酶活性等生命活动。研究发现,在适宜的温度范围内,鱼体温度随着环境温度的升高而相应上升,大脑、心脏、肝脏等维持生命的重要组织器官活性增强,各种酶的活性提高,生理生化反应速率加快,细胞生理代谢增强,基础代谢速度增强,新陈代谢周期缩短,鱼体内的氧消耗量增加,鱼类的耗氧率增大。研究鱼类的温度胁迫响应机制,发掘功能基因,有助于培育抗高温新品种,从根本上解决温室效应引起海水升温对养殖业造成的危害问题,同时还可以开发具有我国自主知识产权的海洋基因工程蛋白/酶制品,解决一些科研或者生产难题。因此阐述鱼类pdis的结构和功能具有十分重要的理论和实践意义。
技术实现要素:
本发明要解决的技术问题在于提供一种大菱鲆蛋白质二硫键异构酶a3的重组蛋白及其制备和应用。
为实现上述目的,本发明采用的技术方案为:
一种大菱鲆蛋白质二硫键异构酶的重组蛋白,所述重组蛋白为蛋白质二硫键异构酶a3,简称smpdia3,所述重组蛋白的基因序列为seqidno.1。
本发明还提供一种大菱鲆蛋白质二硫键异构酶a3的重组蛋白制备方法,其特征在于所述方法的步骤如下:
(1)以大菱鲆smpdia3基因编码区为模板,采用p1和p2引物进行pcr扩增,待用;
(2)pet-28a载体以bamhi/hindiii酶切,待用;
(3)将步骤(1)的pcr扩增产物与步骤(2)酶切后的pet-28a载体通过in-fusionhd酶重组,转化,测序鉴定,提取阳性克隆质粒,完成克隆载体构建;
(4)将步骤(3)构建的载体转入e.coiltransettea(de3)表达菌株中进行诱导表达,而后纯化、浓缩,即得到具有序列表seqidno.1中氨基酸序列的重组蛋白smpdia3;
所述引物p1和p2的序列分别为p1:
5’—aatgggtcgcggatccagtgatgtgctggagtacacgg—3’;p2:
5’—gtgcggccgcaagcttttatagctcaatcctcttctttttc—3’。
大菱鲆蛋白质二硫键异构酶a3蛋白的重组蛋白的应用,所述重组蛋白smpdia3在制备变性蛋白复性中的应用。
本发明与现有技术相比的有益效果:
本发明利用体外重组表达技术获得了大菱鲆蛋白质二硫键异构酶a3蛋白smpdia3,该蛋白可以显著提高变性蛋白的复性率,在开发新的蛋白体外融合表达载体、变性蛋白复性添加剂等方面具有潜在的应用价值。
附图说明
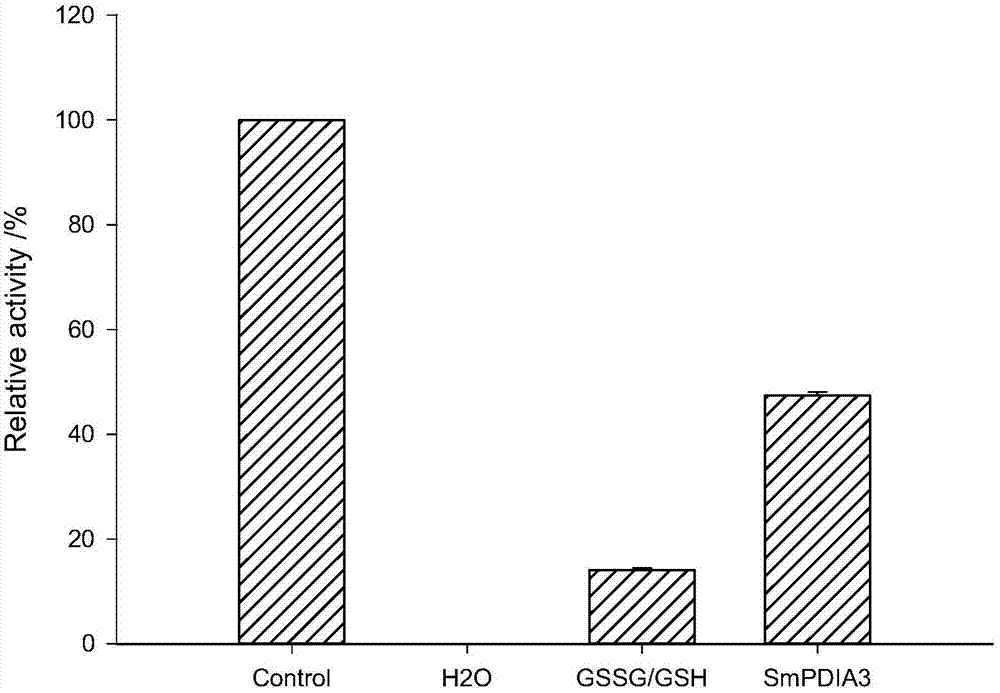
图1为大菱鲆蛋白质二硫键异构酶a3基因重组蛋白促进变性溶菌酶蛋白复性率作用图。
具体实施方式
下面通过实施里来对本发明的技术方案作进一步解释,但本发明的保护范围不受实施例任何形式上的限制。
实施例1
大菱鲆smpdia3基因编码区的体外原核重组表达,包括下列步骤:
1、重组载体的构建
本发明中采用的重组载体为宝日医生物技术(北京)有限公司的pet28a(+)载体。通过pcr技术,使用基因特异性引物p1和p2扩增大菱鲆smpdia3基因除去信号肽的编码区片段。反应条件为:首先94℃预变性5分钟,然后进入下列循环:94℃变性30秒,50℃退火30秒,72℃延伸30秒,35个循环,最后72℃延伸5分钟。将pcr产物纯化回收,待用。将pet-28a载体以bamhi/hindiii酶切,酶切产物纯化回收,待用。将pcr扩增产物与酶切后的pet-28a载体通过in-fusionhd酶重组,转化后菌落pcr筛选并测序,提取阳性克隆质粒,完成克隆载体构建。
所述引物p1为5’—aatgggtcgcggatccagtgatgtgctggagtacacgg—3’;
引物p2为5’—gtgcggccgcaagcttttatagctcaatcctcttctttttc—3’。
2、重组蛋白的表达
以北京全式金生物技术有限公司的e.coiltransettea(de3)大肠杆菌为重组表达菌株,将上述构建的重组载体转化到宿主菌中,挑取单克隆,提取质粒,测序验证读码框正确。挑取单克隆,接种于5mllb液体培养基中,37℃恒温震荡培养箱中培养12-16小时,过夜培养,然后将此培养液以体积比1:100的比例接种到200ml新的lb液体培养基中,转移到28℃、150rpm培养至菌液的od600nm约为0.6时。加入iptg,使终浓度达到0.5mmol/l,继续培养6小时。4℃,5000rpm离心10分钟,收集菌体,于-20℃冻存备用。取1ml菌液离心,弃去上清后,加入320ul的pbs缓冲液充分重悬菌体,然后在冰浴条件下进行超声波破碎。超声完成后,4℃12000rpm离心5分钟,分别收集上清和沉淀。收集得到的上清、沉淀(用pbs重悬)及超声破碎的菌液各取40ul,加入10ul5×sdsloadingbuffer,99℃加热10分钟,3000rpm离心后放冰上冷却,sds-page检测表达产物,本发明所重组的蛋白大部分为可溶性蛋白。
3、重组蛋白的纯化
将上述所得可溶性蛋白采用北京全式金生物技术有限公司镍亲和层析树脂纯化获得了重组蛋白,用pbs缓冲液透析去除咪唑,用peg2000浓缩蛋白。
具体步骤如下:
(1)得到的上清小心加入装填有镍离子螯合亲和层析树脂填料的柱子中,反复上样4次后,将柱子在4℃堵口静置30分钟,使目的蛋白和填料更好的结合;
(2)用30ml预冷的10mmol/l、20mmol/l的咪唑溶液清洗杂蛋白;
(3)用30ml预冷的30mmol/l咪唑溶液,洗脱目的蛋白,收集流出液,用sds-page检测融合蛋白的表达;
(4)选用截留分子量为8000-14000d的透析袋,将待透析的蛋白溶液加入透析袋中,放入预冷的pbs缓冲液中,辅以磁力搅拌器4℃透析,每12小时更换一次透析液,更换6-7次;
(5)透析结束后,将透析袋取出置于冰上,用peg20000白色薄片进行浓缩,每30min换一次peg20000,直至透析袋内液体体积为3-4ml,用0.22μm滤膜抽滤除菌,分装保存。即得到seqidno.1氨基酸所示的大菱鲆smpdia3基因重组蛋白。
seqidno.1
mgsshhhhhhssglvprgshmasmtggqqmgrgssdvleytdddfeskigvhdlilveffapwcghckrlapeyeaaatrlkgivpiakvdctsssnvcskygvsgyptlkifrdgedsgpydgprtadgivsflkkqagpasvelkaeadfdkyvaeqdasvvgffapdestsqaeflkaasalrdnyrfahtnseallqsqgidgegvvlfrpprlnnkfedssvkytegtftsikikkfiqdnifgicphmtddnkdqlkskdllvayydvdynknpkgsnywrnrvmkvaksfldqgkklnfavanknmfshdvsefgldgssgelplvairttkgdkyvmaeefsrdgktlerflqdyfdgtlkrylksepipedndgpvkvlvaenfdsivnddskdvliefyapwcghckslepkynelgekladdpniviakmdatandvpspyevsgfptiffspagrkmnpkkyeggrevsdflsylkreasnpvvvqeeakkkkkriel
序列特征:
长度:510个氨基酸
类型:氨基酸
链型:单链
拓扑结构:包括36.79%的α螺旋、19.51%的β折叠、38.62%的无规则卷曲和5.08%的β转角。
特性:相对分子质量为54.92kda,理论等电点为5.40,具有两个活性位点wcghck。
来源:大菱鲆
实施例2:大菱鲆smpdia3原核重组蛋白的分子伴侣活性分析
促进变性溶菌酶复性的实验:
取20ul20mg/ml的溶菌酶溶液加入30ul1mol/l的dtt、130ul8mol/l的盐酸胍和20ul1mol/l的pbs混匀后在37℃、120rpm条件下变性4h,然后取10ul变性液加水稀释至100ul,混匀后37℃复性2h,为实验组1;取10ul变性液加40ul10mmol/l的gssg、20ul10mmol/l的gsh、10ul1mol/l的pbs和20ul的h2o,混匀后37℃复性2h,为实验组2;将实验组2中20ul的h2o替换成20ul的smpdia3蛋白作为实验组3;另取10ul20mg/ml的溶菌酶溶液稀释100倍,37℃放置6h作为对照组。取四组溶液各20ul,按照溶菌酶(lzm)测试盒说明书的要求测量它们在530nm处的透光度,根据各组的透光度,计算出不同实验组相较于对照组的复性程度(参见图1)。
实验结果表明,重组smpdia3蛋白能够有效地促进变性溶菌酶的复性。
序列表
<110>中国水产科学研究院黄海水产研究所
<120>大菱鲆蛋白质二硫键异构酶a3重组蛋白及其制备和应用
<160>3
<170>siposequencelisting1.0
<210>1
<211>38
<212>dna
<213>人工序列(artificialsequence)
<400>1
aatgggtcgcggatccagtgatgtgctggagtacacgg38
<210>2
<211>41
<212>dna
<213>人工序列(artificialsequence)
<400>2
gtgcggccgcaagcttttatagctcaatcctcttctttttc41
<210>3
<211>510
<212>prt
<213>人工序列(artificialsequence)
<400>3
metglyserserhishishishishishisserserglyleuvalpro
151015
argglyserhismetalasermetthrglyglyglnglnmetglyarg
202530
glyserseraspvalleuglutyrthraspaspaspphegluserlys
354045
ileglyvalhisaspleuileleuvalgluphephealaprotrpcys
505560
glyhiscyslysargleualaproglutyrglualaalaalathrarg
65707580
leulysglyilevalproilealalysvalaspcysthrserserser
859095
asnvalcysserlystyrglyvalserglytyrprothrleulysile
100105110
pheargaspglygluaspserglyprotyraspglyproargthrala
115120125
aspglyilevalserpheleulyslysglnalaglyproalaserval
130135140
gluleulysalaglualaasppheasplystyrvalalagluglnasp
145150155160
alaservalvalglyphephealaproaspgluserthrserglnala
165170175
glupheleulysalaalaseralaleuargaspasntyrargpheala
180185190
histhrasnserglualaleuleuglnserglnglyileaspglyglu
195200205
glyvalvalleupheargproproargleuasnasnlysphegluasp
210215220
serservallystyrthrgluglythrphethrserilelysilelys
225230235240
lyspheileglnaspasnilepheglyilecysprohismetthrasp
245250255
aspasnlysaspglnleulysserlysaspleuleuvalalatyrtyr
260265270
aspvalasptyrasnlysasnprolysglyserasntyrtrpargasn
275280285
argvalmetlysvalalalysserpheleuaspglnglylyslysleu
290295300
asnphealavalalaasnlysasnmetpheserhisaspvalserglu
305310315320
pheglyleuaspglyserserglygluleuproleuvalalailearg
325330335
thrthrlysglyasplystyrvalmetalagluglupheserargasp
340345350
glylysthrleugluargpheleuglnasptyrpheaspglythrleu
355360365
lysargtyrleulyssergluproileprogluaspasnaspglypro
370375380
vallysvalleuvalalagluasnpheaspserilevalasnaspasp
385390395400
serlysaspvalleuilegluphetyralaprotrpcysglyhiscys
405410415
lysserleugluprolystyrasngluleuglyglulysleualaasp
420425430
aspproasnilevalilealalysmetaspalathralaasnaspval
435440445
proserprotyrgluvalserglypheprothrilephepheserpro
450455460
alaglyarglysmetasnprolyslystyrgluglyglyarggluval
465470475480
serasppheleusertyrleulysargglualaserasnprovalval
485490495
valglngluglualalyslyslyslyslysargilegluleu
500505510
- 还没有人留言评论。精彩留言会获得点赞!