一种α-1,2-岩藻糖基转移酶及制备人乳寡糖中的应用的制作方法
本发明涉及一种α-1,2-岩藻糖基转移酶及制备人乳寡糖中的应用,属于生物工程技术领域。
背景技术:
人乳寡糖(humanmilkoligosaccharides,hmos)是一类存在于母乳中的天然低聚糖,是公认的在营养学和生物医学应用领域具有很高潜力的天然分子。近年来,hmos一直是国际生物技术领域备受关注的方向,合成这类功能性寡糖的研究显著增多,这归因于其在人体中所具有的多种生物学作用的不断揭示,其生理功能包括调节肠道菌群、益生菌增殖、防御呼吸系统及泌尿系统的感染、调节免疫系统提高机体免疫力及促进婴儿大脑发育等。在过去20年间,已尝试通过有机化学合成以及酶促手段制备hmos。
在生物系统中,leloir型糖基转移酶(gt,ec2.4.1.-)和糖苷酶(亦称为糖苷水解酶;gh,ec3.2.1.-)构成了碳水化合物加工酶的两个主要类别,这两类酶的作用都是将糖基从供体转移到受体,结果是产生寡糖。但是,糖基转移酶在工业规模的合成中的应用,因所需酶的表达和溶解性问题而使其可获得性受到限制,并且还受到活化的供体糖的高成本的限制。这些核苷酸供体通常可以原位产生,但该过程需要额外的酶。
岩藻糖基转移酶(fucosyltransferase)属于糖基转移酶家族中的一类己糖基转移酶,催化从核苷二磷酸岩藻糖将岩藻糖基转移至受体分子,通常是二磷酸鸟苷岩藻糖(gdp-岩藻糖)转移到包括寡糖、糖蛋白、以及糖脂的受体。基于岩藻糖的添加部位的不同,岩藻糖基转移酶被分类为:α-1,2-岩藻糖基转移酶、α-1,3/4-岩藻糖基转移酶、α-1,6-岩藻糖基转移酶、以及o-岩藻糖基转移酶。α-1,2-岩藻糖基转移酶广泛地存在于脊椎动物、无脊椎动物、植物、以及细菌中,但这些酶的大多不能在细菌系统中以活性形式表达,极大限制了寡糖的大规模合成制备。
值得注意的一点是,目前仅有来源于嗜热蓝绿藻(thermosynechococcuselongatus)、幽门螺杆菌(helicobacterpylori)和大肠杆菌(escherichiacoli)等的α-1,2-岩藻糖基转移酶基因能在细菌中活性表达。因此发现高效稳定且有特异性的新型α-1,2-岩藻糖基转移酶具有重要的现实意义。本发明利用pcr技术从密螺旋体t.primitia基因组dna中获取α-1,2-岩藻糖基转移酶基因,并连接到pet15载体中,将重组表达载体导入大肠杆菌bl21(de3)表达系统中对该新型基因进行高效表达,为岩藻糖基化寡糖的大量合成奠定基础。
技术实现要素:
本发明目的在于提供一一种α-1,2-岩藻糖基转移酶及制备人乳寡糖中的应用,以达到能够高效合成岩藻糖基化系列寡糖的目的。本发明糖基转移酶来源的密螺旋体treponemaprimitia菌株,扩增α-1,2-岩藻糖基转移酶基因后,构建同源重组表达载体,并实现了目的基因在大肠杆菌表达菌株bl21(de3)中的高效表达,以实现α-1,2-岩藻糖基转移酶制剂大量化生产,以及制备岩藻糖基化寡糖及其衍生物的目的。
为实现上述目的,本发明采用如下技术方案:
一种α-1,2-岩藻糖基转移酶,所述α-1,2-岩藻糖基转移酶氨基酸序列如seqidno:2所示。
编码所述α-1,2-岩藻糖基转移酶的基因,核苷酸序列如seqidno:1所示。
所述的基因的制备方法:设计引物,上游引物为:catatgatattattttggtc,下游引物为:ggatccttatttatcaataacgaagg;然后以原始介属密螺旋体t.primitia基因组dna为模板,利用聚合酶链式反应进行基因扩增,获得α-1,2-岩藻糖基转移酶基因序列。
一种重组表达载体,包含所述的α-1,2-岩藻糖基转移酶基因的核苷酸序列。
一种基因工程菌,所述基因工程菌由所述的重组表达载体转化至宿主微生物中获得。
所述的岩藻糖基转移酶的制备方法,所述方法包括:将如所述的基因工程菌接种至新鲜培养基中,前期培养至od600为0.6-0.8后,加入异丙基-β-d-硫代吡喃半乳糖苷为0.1-0.3mmol/l,诱导温度16-24℃,转速160-200rpm,培养20-24h后收集菌体,采用镍亲和柱纯化制备。
所述的α-1,2-岩藻糖基转移酶在制备岩藻糖基化寡糖中的应用,
制备方法包括以下步骤:
(1)提供具有α-1,2-岩藻糖基转移酶活性的多肽,其氨基酸序列选自以下:(a)seqidno:2所示的氨基酸序列;(b)将seqidno:2中氨基酸序列经过取代、缺失或添加一个或几个氨基酸得到的氨基酸序列;
(2)提供供体底物和受体底物,使得所述α-1,2-岩藻糖基转移酶的多肽催化岩藻糖残基从gdp-岩藻糖残基供体底物转移到受体底物,通过生物酶法合成体系合成人乳和人血型h抗原岩藻糖基化寡糖。
所述受体底物为以下的一种或几种组成:lacto-n-tetraose、lacto-n-neotetraose、galβ1,3galnacαpron3、galβ1,3galnacβpron3、galβ1,3glcnacαpron3、galβ1,3glcnacβpron3。
本发明的优点在于:
1、本发明提供的α-1,2-岩藻糖基转移酶活性高,稳定性好(见实施例一(6)),用其制备人乳寡糖既可减少生产成本,又可达到规模化生产的目的。
2、本发明提供的α-1,2-岩藻糖基转移酶合成寡糖与化学法合成寡糖相比,在酶的专一性和高效性上占有重大优势。对于合成不同的糖,化学合成法需要对糖基供体进行严谨的设计保护基团及立体异构性的要求,而酶法合成仅需要通过供体与受体的构型选择合适的酶类即可。
附图说明
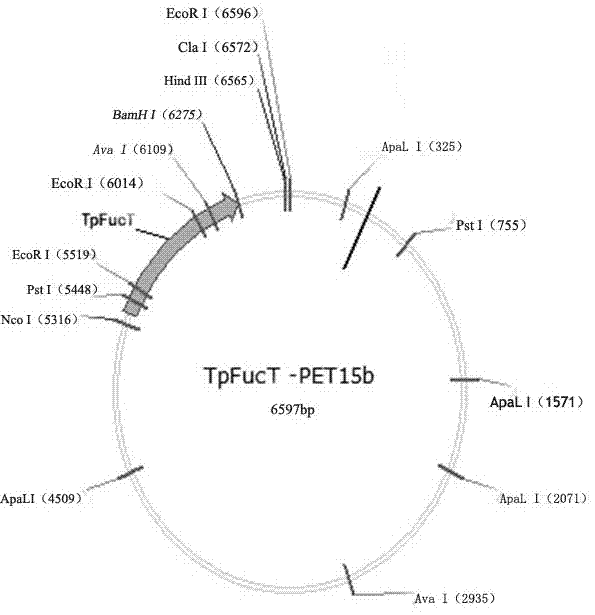
图1重组质粒pet15b-tpfuct物理图谱。
图2重组质粒pet15b-tpfuct双酶切鉴定的琼脂糖凝胶电泳图。泳道从左到右依次表示:重组质粒pet15b-tpfuct、dnamarker。
图3咪唑梯度洗脱纯化岩藻糖基转移酶sds-page分析,泳道从左到右依次表示:0%elutebuffer洗脱状况、8%elutebuffer洗脱状况、10%elutebuffer洗脱状况、20%elutebuffer洗脱状况、30%elutebuffer洗脱状况、蛋白marker。
图4以galβ1,3glcnacβpron3为受体底物时反应活性分析。
具体实施方式
实施例1
(1)根据ncbi数据库提供的treponemaprimitia(ncbireferencesequence:nc_015578.1)的基因组dna为模板,设计引物catatgatattattttggtc和ggatccttatttatcaataacgaagg,引物由上海生工合成后,进行pcr扩增,得到大小为897bp的目的基因片段(图2)。
pcr扩增条件为:94℃预变性5min后开始以下循环:94℃变性1min,52℃退火40s,72℃延伸反应2.5min,进行30个循环,最后72℃反应5min,4℃保温。
pcr反应体系:10×taq酶buffer(5μl),模板dna(1μl),上游引物(1μl),下游引物(1μl),dntps(1μl),ddh2o(40.5μl),taq酶(0.5μl)设计引物,上游引物为:catatgatattattttggtc,下游引物为:ggatccttatttatcaataacgaagg。
重组表达载体的构建参照《分子克隆实验指南》。将pcr产物进行琼脂糖凝胶电泳,并以凝胶回收试剂盒回收凝胶上的目的基因。将目的基因tpfuct与质粒pet15b(购买于上海生工)均用两种限制性内切酶(ndei和bamhi)酶切。酶切体系为:目的基因tpfuct与质粒pet15b各0.1μl,ndei和bamhi酶各0.5μl;酶切缓冲液(rbuffer)2μl,另加去离子水补足至20μl,在37℃下进行酶切。产物进行琼脂糖凝胶电泳,再以试剂盒回收凝胶上的目的条带。将酶切过的目的基因与载体用dna连接酶连接,反应于金属浴中进行,反应时间7h,获得重组表达载体tpfuct-pet15b(图1)。
(2)将上述验证正确的重组质粒转化到大肠杆菌bl21(de3)中,按如下步骤进行:取制备好的大肠杆菌bl21(de3)感受态细胞,置于冰上30min融化,吸取50μl感受态细胞与2μl的tpfuct-pet15b质粒(浓度100ng/ml)混合,置于42℃水浴中热激1.5min,随后立即冰浴2min冷却,加入700μl的新鲜lb培养基,于37℃、100rpm条件下复苏培养45min,之后取80μl菌液涂布于含有氨苄青霉素(100ug/ml)的lb平板,37℃恒温培养箱培养16h后挑取单菌落,pcr和双酶切鉴定重组子,证明重组表达载体tpfuct-pet15b构建成功。
(3)挑取上述平板上的阳性转化子,接种到lb液体培养基中,置于37℃、200rpm摇床上振荡培养17h,得种子液;再以1%(v/v)的接种量将种子液接种到新鲜的lb培养基中,于37℃振荡培养至od600为0.7,经异丙基-β-d-硫代吡喃半乳糖苷(iptg)诱导,iptg终浓度0.2mmol/l,于16-24℃诱导22h,转速180rpm。
(4)诱导表达后,将发酵液于4000r/min、4℃离心1h收集菌体。将菌体用10mmph7.0trsi-hc1缓冲液重悬后,以pluson2s/off3s的频率下超声6min中以破碎菌体;将破碎后液体于10000r/min、4℃离心30h去除细胞碎片后收集上清液,利用ni柱亲和层析法纯化得到可溶性岩藻糖基转移酶,用镍亲和柱纯化分离的过程如下:向镍亲和柱加入去离子水至柱顶端自然洗脱后用3倍体积的bindingbuffer自然洗脱;再将经滤膜过滤的粗酶液上柱,慢流使样品与柱充分结合,待样品流干后分别用7倍柱体积的washingbuffer连续梯度洗脱去除杂蛋白,最后用5倍elutionbuffer洗脱目的蛋白,收集洗脱液。sds-page分析目的蛋白表达情况(图3),基因工程菌经诱导后有明显的特异表达条带,条带分子量与预期大小分子量35.2kd基本一致。获得的目的蛋白即为α-1,2-岩藻糖基转移酶tpfuct,其氨基酸氨基酸如seqidno.2所示,编码所述α-1,2-岩藻糖基转移酶的基因,核苷酸如seqidno.1所示。
(5)纯化后的α-1,2-岩藻糖基转移酶tpfuct,能够以lnt、lnnt、galβ1,3galnacαpron3、galβ1,3galnacβpron3、galβ1,3glcnacαpron3、galβ1,3glcnacβpron3寡糖为受体底物,以gdp-岩藻糖为供体底物,反应生成相对应的fucα-1,2-lnt、fucα-1,2-lnnt、fucα-1,2galβ1,3galnacαpron3、fucα-1,2galβ1,3galnacβpron3、fucα-1,2galβ1,3glcnacαpron3、fucα-1,2galβ1,3glcnacβpron3人乳和人血型h抗原岩藻糖基化寡糖。
(6)岩藻糖基转移酶活性中以galβ1,3glcnacβpron3为受体时反应活性最高,产率高达98%。高分辨质谱对产物进行分析,在m/z:635.2(m-h)+有离子峰,反应合成岩藻糖基化寡糖fucα-1,2galβ1-3glcnacαpron3(图4)。
实施例2
α-1,2-岩藻糖基转移酶制备岩藻糖基化寡糖的反应为:
(1)gdp-fucose的合成反应:将0.1mol/latp1.5ml、0.1mol/lgtp1.5ml,0.1mol/lmgcl21ml,0.1mol/ll-fucose1ml,酶fkp1ml,酶pmppa1ml,1mol/ltris-hcl(ph8.0)1ml,混匀,离心,置于37℃反应,待确定反应已基本完全,终止反应。加入等量乙醇,混匀,离心取上清,干燥,过凝胶柱初步纯化,冻干。
(2)寡糖的合成反应:取一洁净离心管,向其中加入适量gdp-fucose以及同等质量的galβ1,3glcnacβpron3,以20mmol/l的mgcl2溶液溶解,并以tris-hcl调节ph至7.0,再加入一定量的α-1,2-岩藻糖基转移酶tpfuct(根据反应情况补料添加),于40℃进行反应,以薄层层析法检验,待反应基本完全终止反应,反应生成岩藻糖基化寡糖fucα-1,2galβ1-3glcnacαpron3,用凝胶柱法对其进行纯化。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
sequencelisting
<110>福建农林大学
<120>一种α-1,2-岩藻糖基转移酶及制备人乳寡糖中的应用
<130>4
<160>4
<170>patentinversion3.3
<210>1
<211>939
<212>dna
<213>人工序列
<400>1
atgatattattttggtcagacggtggactaggtaatcaattttttcaatatgtttttatt60
aaaacattgcagcaaaaaaatgaaaatgttataatatttggcaatgggtttaaagatata120
gacgatatttttgaaaaaatagaatttacaaaaattaaatacttttctaaaataatcagt180
ttttgtatgaatagaattgctaaatcatttatttgttatttggcatacaataatgtaatt240
tcatatatatttgtaaaagaagaatatatacttagtaaaaaatatcaaagggaaggtgat300
actgtttcttttaaaaaaggattattcacgaatataaaatatatagaatcaaattttttt360
cagtctgaaatattctttaataaagaaattgtaggaaaaattaagctaaaacaaaaattt420
ataattcaagctgaaagatttattcagatgataccagtaggcgctaataaaatatttgtt480
catatcagaaggggagactatgaaaattttaaagtttgtgaaaaatcagttatattaccg540
tttgcttattttcatagttgtataaaatattttcttgaagtaatagaaaatccatatttt600
atatttttatctgatgaaataaacttaataaaaactgaatttacttatcttgaaaatatg660
attatttcagaaaatcagcattacggtgttgactttgcaataatgactttatgtaataat720
gccatattgagcccaagttcatttagctggtggggtagctatcttatgaaaaacaaagac780
ataatattagccccaaaatactggatgggttttgcaagcagaattgagtttcaaaaaaat840
ccattggcatcatatatgaaaatagttgatgttgaaacatttgtgattgataaataagac900
acgcgtgatctgtattgctcggggtggactgtgctgtga939
<210>2
<211>298
<212>prt
<213>人工序列
<400>2
metileleuphetrpseraspglyglyleuglyasnglnphephegln
151015
tyrvalpheilelysthrleuglnglnlysasngluasnvalileile
202530
pheglyasnglyphelysaspileaspaspilepheglulysileglu
354045
phethrlysilelystyrpheserlysileileserphecysmetasn
505560
argilealalysserpheilecystyrleualatyrasnasnvalile
65707580
sertyrilephevallysgluglutyrileleuserlyslystyrgln
859095
arggluglyaspthrvalserphelyslysglyleuphethrasnile
100105110
lystyrilegluserasnphepheglnsergluilephepheasnlys
115120125
gluilevalglylysilelysleulysglnlyspheileileglnala
130135140
gluargpheileglnmetileprovalglyalaasnlysilepheval
145150155160
hisileargargglyasptyrgluasnphelysvalcysglulysser
165170175
valileleuprophealatyrphehissercysilelystyrpheleu
180185190
gluvalilegluasnprotyrpheilepheleuseraspgluileasn
195200205
leuilelysthrgluphethrtyrleugluasnmetileileserglu
210215220
asnglnhistyrglyvalaspphealailemetthrleucysasnasn
225230235240
alaileleuserproserserphesertrptrpglysertyrleumet
245250255
lysasnlysaspileileleualaprolystyrtrpmetglypheala
260265270
serargileglupheglnlysasnproleualasertyrmetlysile
275280285
valaspvalgluthrphevalileasplys
290295
<210>3
<211>20
<212>dna
<213>人工序列
<400>3
catatgatattattttggtc20
<210>4
<211>26
<212>dna
<213>人工序列
<400>4
ggatccttatttatcaataacgaagg26
- 还没有人留言评论。精彩留言会获得点赞!