基于磁流变液技术的恒温扩增型太赫兹多通道微流控芯片及其用于病原菌检测的方法与流程
本发明涉及病原菌检测领域,具体涉及基于磁流变液技术的恒温扩增型太赫兹多通道微流控芯片,还涉及利用微流控芯片检测病原菌的方法。
背景技术:
快速准确检测病原菌的种属,对于感染性疾病的诊断和后续治疗至关重要。传统的病原菌检测方法所需时间较长,从收集标本到准确获取病原菌的类型通常需要几天到一周左右。此外,细菌培养操作繁琐,且不同细菌需要不同的酶学和生化反应鉴定而消耗大量的试剂。为了快速鉴定病原菌的种属,一系列包括飞行质谱技术、荧光定量pcr、核酸测序在内的分子生物学方法被提出,但由于各自弊端这些方法均未能替代传统的细菌培养与鉴定方法。基质辅助激光解吸电离飞行时间质谱(maldi-tof-ms)可通过细菌特异性的电荷区分不同类型的病原菌,但其检测灵敏度仅为105-106cfu4。此外,质谱技术只能检测培养后的单一样本,无法检测混合样本,并在区分大肠杆菌和志贺氏菌等方面仍存在一定的缺陷。荧光定量pcr方法可以通过不同荧光标记同时检测多种病原菌,但是受限于仪器昂贵、操作繁琐,无法在实际临床工作中常规展开。因此,建立一种快速、准确检测病原菌的新方法对于感染性疾病的诊断和治疗具有重要的意义。
太赫兹(terahertz,thz)波是指频率为0.1-10thz,波长为3mm到30μm,介于毫米波与红外光之间频谱范围的电磁波。近几年来,thz波在生物医学应用领域掀起了研究热潮,已经成为当前物理学与生物医学交叉领域收到极大重视的研究热点。在病原菌检测方面,组成病原菌的核酸、蛋白、糖类和脂类等生物大分子之间/内的弱相互作用力(氢键、范德华力等)、骨架震动和转动的能级等正好处于thz波的频率范围内,使得thz波对病原菌内部的含水量和胞内结构等代谢变化具有较好的敏感性。因此,可以通过病原菌内部含水量和胞内结构的差异实现不同种属病原菌的区分。但是利用现有thz波检测技术检测病原菌仍然存在特异性、灵敏度和水敏感性问题。(1)特异性问题:thz波对病原菌菌体进行直接检测是利用不同种属病原菌胞内含水量和胞内结构不同的原理,这种方法虽然可以区分纯化培养后的病原菌,但是本质上并不具备较高的检测特异性。考虑到临床样本存在结果类似的病原菌或多种病原菌混杂的情况,直接检测的方式无法在临床样本中特异地区分病原菌的种属。(2)灵敏度问题:前期研究结果表明,在不借助任何信号放大技术的前提下,thz光谱只能检测到108cfu以上的病原菌。(3)水敏感问题:室温时1thz频率下水对thz波的吸收系数高达250cm-1左右,液相环境中病原菌的thz吸收信号往往被湮没。因此,由于特异性、敏感性和水敏感性问题的限制,现有的thz波检测技术尚无法满足临床病原菌的实际检测需求。
磁流变液是一种在外加磁场作用下材料特性发生急剧变化的新型智能材料。磁流变液由微米量级的可磁化的固体颗粒(分散质)分散于母液如硅油中形成的悬浮体,在外加磁场下流变性质会发生急剧变化,其粘度成数量级增加且表现出较强的抗剪切力,使材料整体呈类固体状,在此状态下材料的介电常数等物理特性也会发生进一步变化。由于磁流变液效应具有可逆性、响应迅速的特点,已经广泛应用于自动控制、医疗、汽车工业、飞机制造等诸多领域。但是目前为止,未见磁流变液技术用于太赫兹波检测领域的报道。
技术实现要素:
有鉴于此,本发明的目的之一在于提供一种基于磁流变液技术的恒温扩增型太赫兹多通道微流控芯片;本发明的目的之二在于提供利用所述的微流控芯片检测病原菌的方法,(1)通过设计特异性锁式探针对病原菌靶核酸片段进行杂交反应,形成的环状dna分子模板被包被的捕获探针捕获,并在phi29dna聚合酶作用下进行等温扩增反应,提高检测特异性;(2)同时将rca产物与纳米颗粒结合,形成“rca产物-纳米颗粒”聚合物,利用超材料纳米颗粒可提高灵敏度;(3)进一步再利用磁流变液技术解决水敏感性,通过磁流变液中的硅油和rca反应体系中的水分子不互溶的特性,将rca反应体系中的水分离,仅有磁流变液中的硅油作为溶剂进入超材料纳米颗粒信号放大模块,成功解决了水敏感性问题。同时在磁场作用下,样本整体会由液体状态变为类固体状,在此状态下进一步增大样本整体的介电常数,从而提高在超材料上的信号响应,实现太赫兹波检测灵敏度的二次提高。通过以上三种技术的联合,达到高特异性和高灵敏度检测病原菌的目的。
为达到上述目的,本发明提供如下技术方案:
1、基于磁流变液技术的恒温扩增型太赫兹多通道微流控芯片,包括rca反应模块、磁流变液交换模块、超材料纳米颗粒信号放大模块和微流体芯片结构,所述微流体芯片结构为设置有多条检测通道的“罗盘型”结构,中心设置有总入口,每条检测通道由内至外依次连接有rca反应模块、磁流变液交换模块和超材料纳米颗粒信号放大模块。
优选的,所述rca反应模块由两端设置有入口和出口的圆形腔室构成,rca反应模块的圆形腔室两侧的微流体管道上各设置有一个控制阀门。
优选的,所述磁流变液交换模块位于rca反应模块和超材料纳米颗粒信号放大模块之间的微流体管道上,包含至少一个磁流变液管道。
优选的,所述磁流变液管道的内径为12~15μm,所述微流体管道的内径为15~20μm;所述磁流变液的由直径为8~10μm的可磁化固体和硅油组成,所述可磁化固体的质量分数为20~40%,介电常数为40~70pf/mm;直径8~10μm的可磁化固体适合于结合“rca产物-纳米颗粒”聚合物。
优选的,所述超材料纳米颗粒信号放大模块含有超材料,所述超材料由硅基底上周期性排列的金属开口谐振环组成。
优选的,所述超材料纳米颗粒信号放大模块的硅片为450~500μm厚,硅片上的金膜为150~250μm厚,每个周期由1~5个金属开口谐振环所组成,中间的缺口大小为3.5~5μm,在限定的缺口大小下“rca产物-纳米颗粒”聚合物能够覆盖于超材料缺口内,有效介电常数改变导致电容的改变,最终导致了共振频率的位移。
2、利用所述的微流控芯片检测病原菌的方法,包括如下步骤:
(1)探针设计:根据不同病原菌的16srdna序列设计与不同病原菌靶序列相匹配的锁式探针和捕获探针,所述锁式探针与病原菌靶序列连接形成滚环扩增的环形模板,所述捕获探针特异性识别和捕获病原菌靶序列rca产物;
(2)样本准备:将不同的病原菌培养后,提取不同病原菌的基因组dna,形成含有不同病原菌靶序列的混合样本溶液;
(3)锁式探针与病原菌靶序列连接:在微流体芯片不同通道的rca反应模块底部固定针对某一特定病原菌的捕获探针,然后分别加入含有针对某一特定病原菌的锁式探针的溶液,然后通过芯片中央的总入口向各个腔室内注入等量的含有不同病原菌靶序列的混合样本溶液,在腔室内特定的锁式探针可与特定病原菌靶序列连接形成滚环扩增的环形模板;
(4)rca反应:分别通过rca反应模块腔室的入口注入rca反应所需试剂:phi29dna聚合酶、dntps混合液、bsa和反应buffer进行rca反应,反应后与模块底部包被的捕获探针结合固定,形成rca产物复合物,从rca反应模块腔室的入口注入纯水冲洗去除盐离子成分,从而对rca产物进行纯化,然后将纯化的rca产物复合物与纳米颗粒结合,形成“rca产物-纳米颗粒”聚合物;
(5)磁流变液反应:向磁流变液管道中通入磁流变液材料,控制磁流变液流速为2~3μl/min,“rca产物-纳米颗粒”通过吸附作用随磁流变液材料流入超材料纳米颗粒信号放大模块,去除样本中的水分子,待磁流变液材料完全吸附“rca产物-纳米颗粒”进入超材料纳米颗粒信号放大模块后并沉降至超材料表面,通入强磁场产生磁流变液效应,使磁流变液变硬并增大超材料和磁变液的介电常数;
(6)太赫兹检测:将传感器放入太赫兹时域光谱仪,在18~25℃下采用透射模式进行测量,光路中配置有密闭装置并冲入高浓度氮气使检测池相对湿度降至2%以下,并测量高阻硅的透射光谱作为样本的参考信号,在样本进入超材料纳米颗粒信号放大模块前后分别测量所述超材料纳米颗粒信号放大模块的透射光谱,根据共振频率位移判断不同病原菌。
本发明中,纳米颗粒的直径优选为40~60nm,在此直径范围内的纳米颗粒能够较好的与rca产物结合形成“rca产物-纳米颗粒”,并且适合磁流变液流体性质,容易被磁流变液吸附在最短的时间内将“rca产物-纳米颗粒”吸附进入超材料纳米颗粒信号放大模块。
优选的,所述病原菌为大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、鲍曼不动杆菌、肺炎链球菌、痢疾志贺菌、表皮葡萄球菌、粪肠球菌。
优选的,所述捕获探针的核苷酸序列如seqidno.1~8所示;所述锁式探针的核苷酸序列如seqidno.9~16。
优选的,步骤(3)中,向腔室内注入锁式探针终浓度为100nm,95℃变性5min后冰浴3min,然后置于60℃的水浴箱中进行杂交反应30min;随后加入质量分数为0.05%的bsa和5u的e.colidna连接酶,在37℃条件下连接45min;然后将连接混合液加入到核酸外切酶酶切体系,体系中含有10u的exonucleasei和exonucleaseiii,酶切反应在37℃反应30min后,95℃,5min灭活外切酶;步骤(5)中,所述磁流变液的由直径为8~10μm的可磁化固体和硅油组成,所述可磁化固体的质量分数为20~40%,介电常数为40~70pf/mm,所述磁场强度为10~40gs。
本发明中,通过将微流体芯片结构为设置有多条检测通道的“罗盘型”结构,可以同时平行检测多个病原菌。为了解决水敏感问题增加磁流变液交换模块,将扩增产物复合物通过吸附作用随磁流变液进入超材料纳米颗粒信号放大模块,由于rca反应体系中的水与磁流变液中的硅油不互溶,因此成功将rca反应体系中的水分离,仅有磁流变液中的硅油进入超材料纳米颗粒信号放大模块,成功解决了水敏感性问题。为了进一步提高灵敏度在将rca扩增产物中加入纳米金,形成“rca产物-纳米颗粒”聚合物。然后通过外加磁场使流变性质发生急剧变化,增大超材料表面介电常数改变进一步提高灵敏度。最后通过太赫兹检测,太赫兹检测过程中通过外加磁场使流变性质发生急剧变化,增大超材料表面介电常数改变进一步提高灵敏度。
本发明的有益效果在于:本发明公开了基于磁流变液技术的恒温扩增型太赫兹多通道微流控芯片及其用于病原菌检测的方法,具有特异性好、灵敏度高、能够解决水敏感性问题,具体体现如下:
(1)本发明通过rca反应,通过设计致病菌的锁式探针,特异识别基因组靶序列,通过连接酶连接成环形dna分子,作为滚环扩增的模板,其靶序列与固定的捕获探针杂交,实现了原位复制,并提高检测的特异性;
(2)本发明通过将纯化的rca产物复合物与纳米颗粒结合,形成“rca产物-纳米颗粒”聚合物,由于纳米颗粒与超材料表面结合能够提高超材料表面介电常数改变,增大太赫兹超材料的共振频率位移,提高检测的灵敏度。
(3)本发明加入磁流变液交换模块,通过磁流变液将扩增产物复合物进入超材料纳米颗粒信号放大模块,而反应体系中的水无法进入超材料纳米颗粒信号放大模块,解决thz测量过程中的水敏感问题。此外,磁流变液材料在外加磁场使流变性质发生急剧变化,增超材料表面介电常数改变,使太赫兹超材料的共振频率位移增加,可实现检测灵敏度的二次放大。
(4)本发明设置多条检测通道的“罗盘型”结构,可同时平行检测多种病原菌,提高临床检测病原菌的效率。
附图说明
为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图进行说明:
图1为基于磁流变液技术的恒温扩增型太赫兹多通道微流控芯片的结构图。
图2为rca反应模块反应原理图。
图3为磁流变液交换模块反应原理图(a:磁流变液交换模块反应原理图;b:“磁性颗粒-rca产物-纳米颗粒”聚合物的介电常数随外加磁场强度变化图)。
图4为超材料纳米颗粒信号放大模块(a:检测原理图;b:超材料结构示意图)。
图5为基于磁流变液技术的恒温扩增型太赫兹多通道微流控芯片检测病原菌的流程图。
图6为基于磁流变液技术的恒温扩增型太赫兹多通道微流控芯片检测病原菌的结果图(a:大肠杆菌反应前后太赫兹超材料的频率位移;b:金黄色葡萄球菌反应前后太赫兹超材料的频率位移;c:铜绿假单胞菌反应前后太赫兹超材料的频率位移;d:鲍曼不动杆菌反应前后太赫兹超材料的频率位移;e:肺炎链球菌反应前后太赫兹超材料的频率位移;f:痢疾志贺菌反应前后太赫兹超材料的频率位移;g:表皮葡萄球菌反应前后太赫兹超材料的频率位移;h:粪肠球菌反应前后太赫兹超材料的频率位移)。
图7为基于磁流变液技术的恒温扩增型太赫兹多通道微流控芯片检测病原菌的灵敏度表征(a:太赫兹检测信号;b:太赫兹检测频率位移效果)。
图8为基于磁流变液技术的恒温扩增型太赫兹多通道微流控芯片及其用于病原菌检测的方法检测病原菌的特异性表征。
具体实施方式
下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好的理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
实施例1、基于磁流变液技术的恒温扩增型太赫兹多通道微流控芯片
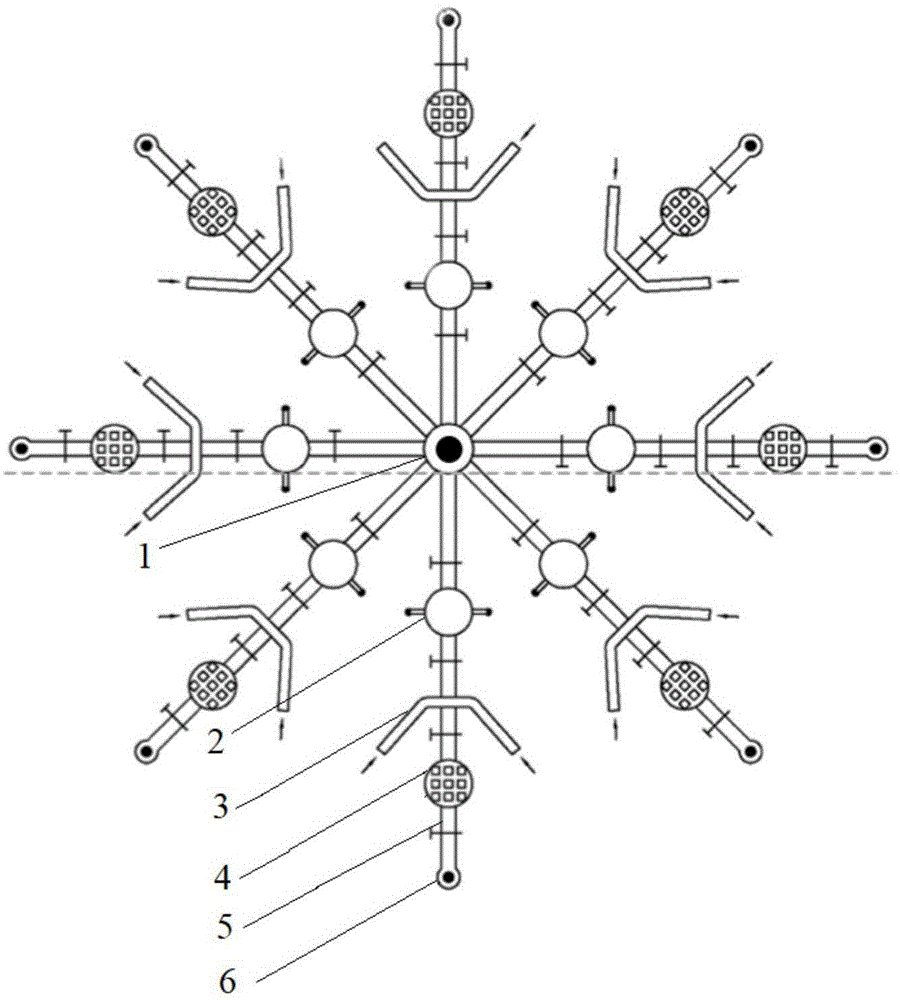
由于临床患者经常出现多种病原菌的混合感染,在保障检测灵敏度的同时实现多种病原菌的高通量平行检测具有十分重要的意义。因此,本发明采用微流体技术,结合rca反应、磁流变液和thz波检测信号放大,构建微型化、集成化、自动化和高通量的太赫兹超材料纳米生物传感器,具体结构如图1所示。由图1可以看出,基于磁流变液技术的恒温扩增型太赫兹多通道微流控芯片,包括rca反应模块2,磁流变液交换模块3、超材料纳米颗粒信号放大模块4和微流体芯片结构5。微流体芯片结构5为设置有多条检测通道的“罗盘型”结构,微流体芯片结构5中心设置有总入口1,每条检测通道的最外侧设置有出口6,每条检测通道由内至外依次连接有rca反应模块2、磁流变液交换模块3和超材料纳米颗粒信号放大模块4。
rca反应模块原理图如图2所示。由图2可以看出,rca反应模块2由两端设置有入口和出口的圆形腔室构成,rca反应模块2的圆形腔室两侧的微流体管道上各设置有一个控制阀门,反应时首先在rca反应模块2底部包被捕获探针,然后通过芯片中央的总入口向各个腔室内注入等量的含有不同病原菌靶序列的混合样本溶液,关闭两端的控制阀门即可形成封闭的反应腔室,随后通过入口向腔室内注入锁式探针和反应试剂,进行rca反应,随后与包被于rca反应模块底部的捕获探针形成rca产物复合物,为了避免扩增缓冲液中各复杂盐离子成分对thz波检测的干扰,利用冲洗步骤去除盐离子成分,实现产物的纯化,然后将纯化的rca产物与纳米金颗粒(40~60nm)结合,形成“rca产物-纳米颗粒”聚合物。
磁流变液交换模块原理图如图3所示。由图3中a可以看出,磁流变液交换模块3位于rca反应模块3和超材料纳米颗粒信号放大模块4之间的微流体管道上,包含至少一个磁流变液管道,用于传送磁流变液,其磁流变液管道的内径为12~15μm。在rca反应模块2形成“rca产物-纳米颗粒”聚合物后,打开rca反应模块2与磁流变液交换模块3之间的阀门,向磁流变液管道通入磁流变液材料,磁流变液材料与“rca产物-纳米颗粒”聚合物随液流进入超材料纳米颗粒信号放大模块4,由于磁流变液与rca反应液不溶,所以rca反应液中的水相无法进入超材料纳米颗粒信号放大模块4,待磁流变液完全吸附扩增产物复合物后通入10~40gs的强磁场。在磁场强度为10~40gs范围内,随着磁场强度增加介电常数随之增加(图3,b),然后使用thz波检测。
超材料纳米颗粒信号放大模块3结构如图4所示。由图4可以看出,超材料由硅基底上周期性排列的金开口谐振环组成,硅片为450~500μm厚,硅片上的金膜为150~250μm厚,金膜表面修饰有纳米金颗粒,每个周期由2~5个金属开口谐振环所组成,中间的缺口大小为3.5~5μm,可容纳“rca产物-纳米颗粒”聚合物。其中超材料由现有光刻技术制备,如果把纳米金修饰的超材料的开口谐振环(srr)看作为一个电感电容电路元件,共振的频率即可表示为
实施例2、基于磁流变液技术的恒温扩增型太赫兹多通道微流控芯片检测病原菌的方法
基于磁流变液技术的恒温扩增型太赫兹多通道微流控芯片检测病原菌的方法,本实施例选择临床常见的8种病原菌为研究对象,具体为大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、鲍曼不动杆菌、肺炎链球菌、痢疾志贺菌、表皮葡萄球菌、粪肠球菌,具体步骤如图5所示:
(1)探针及病原菌靶序列设计:首先分别查找8种菌的16srdna基因组序列,并设计病原菌靶序列,然后根据靶序列设计具有quickcuttmhpaⅰ酶切位点的锁式探针以及相应的捕获探针,并将捕获探针偶联于rca反应模块底部,具体如表1所示。
表1、8种病原菌的靶序列、锁式探针以及相应的捕获探针
(2)标本制备:将大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、鲍曼不动杆菌、肺炎链球菌、痢疾志贺菌、表皮葡萄球菌和粪肠球菌8种菌株分别接种于哥伦比亚血琼脂平板,在温度为37℃、co2体积分数为5%的恒温孵箱中培养过夜,培养后挑选无污染、形态典型的单菌落,利用灭菌生理盐水充分润洗去除培养基成分,随后离心富集,重悬于灭菌生理盐水中,根据麦氏比浊法配置成浓度大约为108cfu/ml的菌液;取1ml细菌菌液,加入到1.5ml的离心管中,在室温(18~25℃)条件下,8000rpm,2min,去除上清液,收集细菌沉淀;将收集的细菌沉淀按照takaraminibestbacteriagenomicdnaextractionkitver.3.0使用说明书提取病原菌基因组dna,把提取的基因组dna溶于ce缓冲液中,3min后12000rpm室温离心2min,然后收集dna溶液从而获取不同病原菌的基因组dna。
(3)rca反应准备:在rca反应模块底部包被针对某一特定病原菌的捕获探针,然后分别加入含有针对某一特定病原菌的锁式探针溶液(终浓度为100nm),然后通过芯片中央的总入口向各腔室内注入等量的含有不同病原菌靶序列的混合样本溶液,构建连接反应体系(10μl的连接反应体系,ph7.8,30mmtris-hcl,10mm(nh4)2so4,4mmmgcl2,0.1mmnad,1.2mmedta)中,震荡混匀,在95℃实验条件下进行变性5min后,立即冰浴3min,然后把反应体系混合液放入60℃的水浴箱中进行杂交反应,持续30min;杂交反应结束后加入质量分数为0.05%的bsa和5u的e.colidna连接酶,在37℃条件下连接45min;将连接混合液加入到20μl的核酸外切酶酶切体系(ph9.5,67mmglycine-koh,1mmdtt,6.7mmmgcl2)中,体系中含有10u的exonucleasei和exonucleaseiii,酶切反应在37℃反应30min,然后在95℃实验条件下持续5min灭活核酸外切酶,获得滚环扩增的环形模板。
(4)rca反应:分别通过rca反应模块的入口向rca反应模块腔室内的滚环扩增的环形模板中注入0.5u/μlphi29dna聚合酶,1mmdntps混合液以及0.2μg/μlbsa,在温度为37℃条件下rca反应1小时,由于锁式探针和匹配模板序列互补杂交成环形dna分子,在phi29dna聚合酶作用下启动了rca反应,将dntps转变成一条长的单链dna片段不断延长,反应后与包被的捕获探针形成rca产物复合物(即将环形模板固定于腔室底部),利用冲洗步骤去除盐离子成分,实现产物的纯化,避免扩增缓冲液中各复杂盐离子成分对thz波检测的干扰,然后将纯化的rca产物复合物与纳米颗粒结合,形成“rca产物-纳米颗粒”聚合物。
(4)磁流变液:反应结束后通过磁流变液管道通入磁流变液,“rca产物-纳米颗粒”聚合物随磁流变液流入超材料纳米颗粒信号放大模块,而rca反应体系中的水被排除,待磁流变液完全吸附“rca产物-纳米颗粒”聚合物并沉降至超材料表面后通入强磁场,磁流变液在500~2000gs强磁场下产生磁流变液效应,使总样本变硬,粘度增加至变硬,其中磁流变液的由直径为8~10μm的可磁化固体和硅油组成,可磁化固体的质量分数为20~40%,介电常数为40~70pf/mm。
(5)太赫兹光谱检测:实验采用太赫兹时域光谱仪(thz-tds,terahertztime-domainspectroscopy)在室温(18~25℃)下采用透射模式进行测量,为了避免水蒸气的强烈吸收影响检测结果,在光路中配置有密闭装置并冲入高浓度氮气,使检测池相对湿度降至2%以下;并测量高阻硅的透射光谱作为样本的参考信号,以消除硅片本身带来f-p驻波的影响,结果如图6所示。超材料纳米颗粒信号放大模块由于“rca产物-纳米颗粒”聚合物结合导致超材料表面微环境有效介电常数的改变,导致大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、鲍曼不动杆菌、肺炎链球菌、痢疾志贺菌、表皮葡萄球菌和粪肠球菌8种细菌反应前后超材料的共振频率均发生位移,表明检测体系中含有对应的病原菌。由于在rca反应模块使用了特定的锁式探针和捕获探针,即rca扩增产物中也含有特定病原菌的产物,避免了在检测过程中各病原菌之间的干扰。
实施例3、基于磁流变液技术的恒温扩增型太赫兹多通道微流控芯片检测病原菌的灵敏度和特异性表征
灵敏度表征:按照上述实验方法,区别为各rca反应模块底部均包被大肠杆菌捕获探针,并加入针对大肠杆菌的锁式探针,分别加入浓度梯度为10-7,10-8,10-9,10-10,10-11的大肠杆菌基因组dna,同时以不含大肠杆菌基因组dna为对照,然后进行太赫兹光谱检测,结果如图7所示。结果显示,本发明的方法检测病原菌最低可检测10-10m浓度的病原菌核酸片段。
特异性表征:按照上述实验方法,区别为各rca反应模块底部均包被大肠杆菌捕获探针,并加入针对大肠杆菌的锁式探针,分别加入不含大肠杆菌的病原菌的基因组dna,然后进行太赫兹光谱检测。依次分别包被金黄色葡萄球菌、铜绿假单胞菌、鲍曼不动杆菌、肺炎链球菌、痢疾志贺菌、表皮葡萄球菌和粪肠球菌的捕获探针,并加入相应的锁式探针,并加入不含对应病原菌的基因组dna,结果如图8所示。结果显示,“rca产物-纳米颗粒”聚合物不会导致超材料表面微环境有效介电常数的改变,表明本发明的检测方法具有较好的特异性。
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
序列表
<110>中国人民解放军陆军军医大学第一附属医院
<120>基于磁流变液技术的恒温扩增型太赫兹多通道微流控芯片及其用于病原菌检测的方法
<160>24
<170>siposequencelisting1.0
<210>1
<211>86
<212>dna
<213>人工序列(artificialsequence)
<400>1
ctgttaccgttcgacttgcatgagcaccaatagtcttcagttcacatcaaatgccacgtt60
aacagtcaggcctagcaagcttcttc86
<210>2
<211>88
<212>dna
<213>人工序列(artificialsequence)
<400>2
agcaagcttctcgtccgttcgcaggtcatcagtcattcaagtcaacatcaaatgccacgt60
taacagtcaggcctgctaacatcagaga88
<210>3
<211>86
<212>dna
<213>人工序列(artificialsequence)
<400>3
ctgaacgtgcgcaaggaaatgcgcgaccaatagtcttcatgtgacatcaaatgccacgtt60
aacagtcaggcctagatcgagctgaa86
<210>4
<211>88
<212>dna
<213>人工序列(artificialsequence)
<400>4
aagcaccttatatgcaagcttgagcaccaatagtcttcagttcatacatcaaatgccacg60
ttaacagtcaggcctcatgcctgcaggt88
<210>5
<211>85
<212>dna
<213>人工序列(artificialsequence)
<400>5
gagttgcgaacgggtgagtaatgtattatcgtgtctgcgtgacatcaaatgccacgttaa60
cagtcaggcctttgcttctctggat85
<210>6
<211>88
<212>dna
<213>人工序列(artificialsequence)
<400>6
cattctgatccacgattactagcgatgcttcttcggtgcccatacatcaaatgccacgtt60
aacagtcaggcctacgtattcaccgtga88
<210>7
<211>82
<212>dna
<213>人工序列(artificialsequence)
<400>7
ggtcagaggatgtcaagattatacttcacgactcacctcaacatcaaatgccacgttaac60
agtcaggccttatctctagagg82
<210>8
<211>85
<212>dna
<213>人工序列(artificialsequence)
<400>8
gcaaatctcttaaagcttctctactggtatgctggtttcatcaacatcaaatgccacgtt60
aacagtcaggcctccgcgaggtcat85
<210>9
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>9
gaactgaagactattggtgct21
<210>10
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>10
tgacttgaatgactgatgacct22
<210>11
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>11
cacatgaagactattggtcgc21
<210>12
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>12
atgaactgaagactattggtgct23
<210>13
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>13
cacgcagacacgataataca20
<210>14
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>14
atgggcaccgaagaagca18
<210>15
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>15
tgaggtgagtcgtgaagtat20
<210>16
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>16
tgatgaaaccagcataccagt21
<210>17
<211>55
<212>dna
<213>人工序列(artificialsequence)
<400>17
aggcctaacacatgcaagtcgaacggtaacaggaagaagcttgcttctttgctga55
<210>18
<211>56
<212>dna
<213>人工序列(artificialsequence)
<400>18
tgcaagtcgagcgaacggacgagaagcttgcttctctgatgttagcggcggacggg56
<210>19
<211>55
<212>dna
<213>人工序列(artificialsequence)
<400>19
ctgcaggcgcttcagctcgatctgcatttccttgcgcacgttcaggtccagcgcc55
<210>20
<211>55
<212>dna
<213>人工序列(artificialsequence)
<400>20
tctagagtcgacctgcaggcatgcaagcttgcatataaggtgcttctacaccgct55
<210>21
<211>61
<212>dna
<213>人工序列(artificialsequence)
<400>21
caggttacctacgcgttactcacccgttcgcaactcatccagagaagcaagctcctcctt60
c61
<210>22
<211>60
<212>dna
<213>人工序列(artificialsequence)
<400>22
gaagtcggaatcgctagtaatcgtggatcagaatgtcacggtgaatacgttcccgggcct60
<210>23
<211>52
<212>dna
<213>人工序列(artificialsequence)
<400>23
aaccttaccaaatcttgacatcctctgacccctctagagatagagttttccc52
<210>24
<211>54
<212>dna
<213>人工序列(artificialsequence)
<400>24
atccgaactgagagaagctttaagagatttgcatgacctcgcggtctagcgact54
- 还没有人留言评论。精彩留言会获得点赞!