一种利托菌素磁珠、制备方法及其应用与流程
本发明属于纳米材料和细菌检验技术领域,具体涉及一种利托菌素磁珠、制备方法及其应用。
背景技术:
肺炎球菌(spn)为革兰氏阳性菌,属链球菌属,由于经常成双排列,故又名肺炎链球菌。spn是一种重要的条件致病菌,寄生在健康人鼻咽部,正常情况下并不致病,当寄生的环境发生变化时,如机体抵抗力下降时,麻疹、流感等呼吸道病毒感染以后,或营养不良、老年体弱等情况下,spn将透过黏膜防御体系发生侵袭性感染,可进入下呼吸道引起肺炎,可穿过血脑屏障引起细菌性脑膜炎,也可穿过肺泡上皮细胞、侵袭血管内皮细胞进入血液引起菌血症,还可从鼻咽部移行进入鼻窦,引起鼻窦炎,通过咽鼓管进入中耳,引起中耳炎。根据spn感染部位不同,可分为侵袭性肺炎球菌性疾病(ipd)和非侵袭性肺炎球菌性疾病(nipd)两大类。ipd是指spn侵入原本无菌的部位和组织所引发的感染,主要包括脑膜炎、菌血症和菌血症性肺炎等。nipd即spn感染到原本与外环境相通的部位所引起的疾病,主要包括急性中耳炎、鼻窦炎和非菌血症性肺炎等。肺炎球菌可以导致95种少见的ipd感染,包括骨髓炎、心包炎、心内膜炎、腹膜炎、化脓性关节炎、胰腺脓肿、肝脓肿、牙龈感染、腹股沟淋巴结炎、卵巢脓肿、睾丸脓肿、坏死性筋膜炎、溶血尿毒症综合征等,严重威胁人类的生命安全。
因此,对肺炎球菌进行快速准确的检测是非常必要的。目前,对肺炎球菌检测的主要方法包括培养法、免疫法、普通pcr(聚合酶链式反应)法或实时定量pcr法。一般,培养法是通过处理样品,在一定条件(如培养基、温度等)下培养,离心、过滤,洗涤实现细菌与样品分离的过程。其操作繁琐,易污染、耗时且浓缩效率低,检测吸附时间长,耽误治疗时机;免疫检测方法是一种基于抗原-抗体特异性结合反应原理的微生物快速分离富集技术,以其高度的靶标特异性在微生物快速检测中得到广泛应用,缩短了常规检测所需的增菌时间,但特异性差;普通pcr法或实时定量pcr法能够提供基因诊断的灵敏度,降低了分析的难度,但检测时间较长并且需要特定设备。而且,患者提供的样品中肺炎球菌的含菌量往往非常低,尤其是盥洗液中的只含有痕量的肺炎球菌,为诊断带来了极大的挑战。
技术实现要素:
针对目前肺炎球菌快速检测中存在的局限性,本发明的目的是提供一种利托菌素磁珠、制备方法及其应用,解决现有的方法吸附肺炎球菌时灵敏度低、尤其对于痕量肺炎球菌吸附分离时间久和富集效率低的问题。
为了实现上述目的,本发明采用如下技术方案予以实现:
一种利托菌素磁珠,包括fe3o4纳米磁珠以及包覆在fe3o4纳米磁珠表面的利托菌素。
本发明还公开了一种利托菌素磁珠的制备方法,其特征在于,包括:将fe3o4纳米磁珠与利托菌素溶液混合后在室温下搅拌8~27h,得到表面包覆利托菌素的fe3o4纳米磁珠,即利托菌素磁珠。
具体的,所述的利托菌素经过预处理后与fe3o4纳米磁珠混合,利托菌素的预处理过程为:
将利托菌素和2,2,2-三氯乙醇共同混合在二氯甲烷溶液中,再加入催化剂和吸水剂,室温下搅拌0.5~4h;然后蒸发去除溶液中的二氯甲烷,得到初步预处理的利托菌素;
将l-精氨酸溶于mes溶液中,再加入活化剂,室温下搅拌10~30min,得到活化后l-精氨酸溶液;
将活化后l-精氨酸溶液加入到初次处理的利托菌素溶液中,室温下搅拌0.5~6h,得到预处理后的利托菌素溶液。
具体的,所述的利托菌素和2,2,2-三氯乙醇的质量比为4~33:1;所述的l-精氨酸与利托菌素的质量比为1:2~10。
具体的,所述的活化剂由edc溶液和hns溶液混合而成,所述的l-精氨酸与edc和nhs按照物质的量为5:4:1的比例混合。
具体的,所述的催化剂为4-二甲氨基吡啶、硼酸、三乙基苄基氯化铵、对甲苯磺酸、硫酸铜或氧化锌;所述的吸水剂为二环己基碳二亚胺、醋酸酐、醋酸钠、五氧化二磷或硫酸钠;所述的催化剂、吸水剂和利托菌素的物质的量的比例为1~100:50~500:1000。
具体的,所述的fe3o4纳米磁珠经过预处理后与利托菌素混合,fe3o4纳米磁珠的预处理过程为:
将聚丙烯酸分散在mes溶液中,再加入活化剂,在室温下搅拌10~30min,得到活化后的聚丙烯酸溶液;
将表面经过硅烷化处理的fe3o4纳米磁珠加入到乙醇和水的混合液中,室温下搅拌5~10min;然后加入3-氨基丙基三乙氧基硅烷溶液,继续在室温下搅拌反应6~12h,洗涤,得到初步预处理的fe3o4纳米磁珠;
将初步预处理的fe3o4纳米磁珠加入mes溶液中搅拌均匀,再加入活化后的聚丙烯酸溶液,室温下搅拌反应0.5~6h,洗涤,得到预处理后的fe3o4纳米磁珠。
具体的,所述的活化剂由hns溶液和edc溶液混合而成,聚丙烯酸、edc与hns按照物质的量为35~210:4:1的比例混合,其中,聚丙烯酸的平均分子量为2000~45000;
所述的fe3o4纳米磁珠的质量与3-氨基丙基三乙氧基硅烷的体积比为1:0.5~25;所述的fe3o4纳米磁珠的质量与聚丙烯酸的体积比为0.1~5:1,其中质量单位为g,体积单位为m;
具体的,fe3o4纳米磁珠与利托菌素的质量比为1:1~5;所述的fe3o4纳米磁珠与利托菌素溶液混合后搅拌过程为:在室温下先以200~800rpm搅拌2~3h后,再调整搅拌速度为50~200rpm搅拌6~24h。
本发明还公开了上述利托菌素磁珠用于吸附肺炎球菌的应用。
与现有技术相比,本发明的有益效果是:
(1)本发明制备的利托菌素磁珠对肺炎球菌具有特异性,在吸附过程中能够与肺炎球菌细胞壁结合,具有准确性高、操作简便和特异性强等优势,能够从较为复杂、细菌含量极低的样品中快速分离富集肺炎球菌,提高了肺炎球菌的检测效率和阳性率。
(2)本发明通过l-精氨酸修饰利托菌素,降低了利托菌素与磁珠表面羧基结合的空间位阻,然后通过聚丙烯酸修饰磁珠,增大了磁珠的比表面积,最后将l-精氨酸修饰的利托菌素修饰到聚丙烯酸磁珠表面,从而得到了一种能够快速富集样品中痕量细菌的功能性磁珠。
附图说明
图1是实施例1制备的利托菌素磁珠tem图。
图2是利托菌素磁珠吸附肺炎球菌tem图。
图3是利托菌素磁珠吸附肺炎球菌后的环介导等温扩增结果。
图4是加入2,2,2-三氯乙醇和不加入2,2,2-三氯乙醇的磁珠的粒径和吸附效率。
图5是不同浓度的l-精氨酸、丝氨酸和半胱氨酸修饰利托菌素对磁珠吸附效率的影响。
图6是不同用量的活化剂对磁珠粒径以及吸附效率的影响。
图7是本发明制备的利托菌素磁珠对肺炎球菌检测灵敏度和特异性的验证结果图,(a)为肺炎球菌检测灵敏度,(b)为肺炎球菌特异性验证。
以下结合说明书附图和具体实施方式对本发明做具体说明。
具体实施方式
利托菌素(ristocetin)是一种糖肽类抗生素,可以与利托菌素细菌胞壁快速结合,抑制其细胞壁的合成。同时,利托菌素在细胞壁上的结合位点较为偏僻,不易于其他化合物形成竞争,有利于利托菌素发挥抗菌作用。磁性纳米材料由于具有较好的生物相容性和磁响应性,可以修饰各种表面活性基团,而被广泛用于微生物或其他物质的检测。本发明通过将利托菌素修饰到磁性纳米材料的表面获得了一种能够快速富集样品中痕量肺炎球菌的功能性磁珠,提高了样品检测结果的阳性率。本发明制备了一种利托菌素磁珠,该磁珠包括核心fe3o4纳米磁珠以及包覆在fe3o4纳米磁珠表面的利托菌素,通过下述实施例中磁珠的形貌图综合能谱测定,可以证实fe3o4纳米磁珠表面包裹的是利托菌素。
本发明将fe3o4纳米磁珠与利托菌素溶液混合后在室温下、200~800rpm的搅拌速度搅拌8~27h,得到表面包覆利托菌素的fe3o4纳米磁珠,即利托菌素磁珠,为了使得制备的利托菌素磁珠具备更好的吸附性,对fe3o4纳米磁珠和利托菌素溶液进行了前期预处理,主要包括以下步骤:
步骤一:利托菌素的预处理
步骤1.1:将利托菌素和2,2,2-三氯乙醇按照质量比为4~33:1的比例混合在二氯甲烷溶液中,再加入催化剂和吸水剂,室温、50~200rpm下搅拌0.5~4h,对利托菌素中的羧基进行保护;然后蒸发去除溶液中的二氯甲烷,再加入mes溶液定容至所需体积,得到初步预处理的利托菌素溶液。
其中,催化剂为4-二甲氨基吡啶、硼酸、三乙基苄基氯化铵(tebac)、对甲苯磺酸、硫酸铜或氧化锌,优选4-二甲氨基吡啶;吸水剂为二环己基碳二亚胺、醋酸酐、醋酸钠、五氧化二磷或硫酸钠,优选二环己基碳二亚胺;催化剂、吸水剂和利托菌素的物质的量的比例为1~100:50~500:1000。
步骤1.2:将l-精氨酸溶于mes溶液中,再加入活化剂,室温、100rpm下搅拌10~30min,得到活化后l-精氨酸溶液。其中,活化剂由hns溶液和edc溶液混合而成,l-精氨酸与edc和nhs按照物质的量为5:4:1的比例混合,本发明中的mes溶液能够促进活化剂的活化效果。
步骤1.3:将活化后l-精氨酸溶液加入到初次处理的利托菌素溶液中,其中,l-精氨酸与利托菌素的质量比为1:5~10,l-精氨酸可以延长利托菌素的链,使得与磁珠结合效率更高;然后室温、100-500rpm下搅拌0.5~6h,得到预处理后的利托菌素溶液,即l-精氨酸修饰的利托菌素,备用。
步骤二:fe3o4纳米磁珠的预处理
步骤2.1:将聚丙烯酸(paa)分散在mes溶液中,再加入活化剂,其中,活化剂的用量取决于paa的羧基含量,活化剂由hns溶液和edc溶液混合而成,聚丙烯酸、edc与hns按照物质的量为35~210:4:1的比例混合;在室温、100~500rpm下搅拌10~30min,得到活化后的聚丙烯酸溶液;聚丙烯酸能够修饰磁珠表面,增加磁珠的比表面积,活化剂活化聚丙烯酸表面的羧基。优选的,聚丙烯酸的平均分子量为2000~45000。
步骤2.2:将fe3o4纳米磁珠加入到乙醇和水按照体积比为10:1混合的混合液中,在室温、200~850rpm下搅拌5~10min,使磁珠分散均匀,此处需要注意的是,fe3o4纳米磁珠表面经过氨基改性,如fe3o4@sio2磁珠;然后加入3-氨基丙基三乙氧基硅烷(aptes)溶液,加入标准为:fe3o4纳米磁珠的质量与3-氨基丙基三乙氧基硅烷的体积比为1:0.5~25,其中质量单位为g,体积单位为ml。继续在室温、下搅拌反应6~12h,用去离子水和无水乙醇交替洗涤3~5次,去离子水定容,得到初步预处理的fe3o4纳米磁珠;
步骤2.3:将初步预处理的fe3o4纳米磁珠加入mes溶液中搅拌均匀,再加入活化后的聚丙烯酸溶液,其中,fe3o4纳米磁珠的质量与聚丙烯酸的体积比为0.1~5:1。在室温、100~1000rpm下搅拌反应0.5~6h,用去离子水和无水乙醇交替洗涤3~5次,去离子水定容,得到预处理后的fe3o4纳米磁珠。
步骤三:利托菌素磁珠的制备
步骤3.1:将经过步骤二预处理后的fe3o4纳米磁珠重新分散在mes溶液中,加入上述活化剂,再次活化预处理fe3o4纳米磁珠表面羧基,活化剂的加入量是预处理后的fe3o4纳米磁珠的物质的量的0.01~0.1倍;
步骤3.2:将经过步骤3.1处理的fe3o4纳米磁珠加入到步骤一获得的利托菌素溶液中,fe3o4纳米磁珠与利托菌素的质量比为1:1~5,在室温下先以200~800rpm搅拌2~3h后,再调整搅拌速度为50~200rpm搅拌6~24h,最终得到利托菌素修饰的磁性纳米材料fe3o4纳米磁珠,即利托菌素磁珠。
将本发明制备的利托菌素磁珠用于吸附肺炎球菌的应用,比如盥洗液中痕量肺炎球菌的吸附。具体为:将本发明制备的磁珠加入盥洗液中,常温条件下吸附样品中的肺炎球菌,吸附10左右,期间颠倒混匀2次。然后磁分离去除上清,得到利托菌素磁珠吸附的肺炎球菌;通过后续的分离后即可对分离的细菌进行检测。
以下给出本发明的具体实施例,需要说明的是本发明并不局限于以下具体实施例中,凡在本申请技术方案基础上做的等同变换均落入本发明的保护范围。
实施例1
步骤一:利托菌素的预处理
步骤1.1:称取2.217g利托菌素溶于50ml二氯甲烷中,另外将0.187g2,2,2-三氯乙醇溶于50ml二氯甲烷中,并逐滴加入到利托菌素溶液中,利托菌素与2,2,2-三氯乙醇的质量比12:1,以4-二甲氨基吡啶(dmap)做催化剂,二环己基碳二亚胺(dcc)做吸水剂,室温150rpm条件下反应2h,对利托菌素中的羧基进行保护;旋转蒸发去除二氯甲烷,并用mes缓冲液定容至50ml,即得25mm羧基保护的利托菌素;
步骤1.2:另取0.436gl-精氨酸,溶于50mlmes缓冲液中,即得25mml-精氨酸溶液,分别加入一定量的hns和edc,室温条件下100rpm活化30min,nhs和edc与l-精氨酸的比例为n(l-精氨酸):n(edc):n(nhs)=5:4:1;
步骤1.3:将活化的l-精氨酸逐滴加入到羧基保护的利托菌素mes缓冲液中,室温条件下250rpm反应6h,即得100ml25mm的l-精氨酸修饰的利托菌素,备用。
步骤二:fe3o4纳米磁珠的预处理
步骤2.1:取6.25g聚丙烯酸(paa)分散在50mlmes缓冲液中,分别加入一定量的hns和edc,室温条件下150rpm活化30min,备用。所述聚丙烯酸的平均分子量为5000,具体比例为n(-cooh):n(edc):n(nhs)=140:4:1,即0.4824gedc和0.0724gnhs。
步骤2.2:取200mgfe3o4@sio2,加入到100ml醇水比为10:1的混合液中,室温条件下,450rpm机械搅拌10min,然后缓慢逐滴加入1ml3-氨基丙基三乙氧基硅烷(aptes),继续反应8h,去离子水和无水乙醇交替洗涤5次,去离子水定容至10ml,得到20mg/ml氨基磁珠。
步骤2.3:将上述氨基磁珠磁分离后重新分散在50mlmes缓冲液中,500rpm机械搅拌20min。然后逐滴加入1.6ml步骤一得到的活化的聚丙烯酸,室温条件下750rpm反应2h。去离子水和无水乙醇交替洗涤5次,并用去离子水定容至10ml,得到处理后的磁珠,磁珠的质量浓度为40mg/ml。
步骤三:利托菌素磁珠的制备
步骤3.1:将步骤二获得的磁珠,重新分散在mes缓冲液中,然后加入一定量的nhs和edc,再次活化fe3o4@aptes@paa的表面羧基,此时nhs和edc的用量是磁珠的物质的量的0.08倍和0.02倍,即0.2130gedc和0.0320gnhs;
步骤3.2:另取15ml25mm步骤一获得的l-精氨酸修饰的利托菌素逐滴(1ml/min)加入到步骤3.1获得的磁珠中,利托菌素与磁珠的质量比为1:1,室温条件下500rpm反应2.5h后,调整搅拌速度至100rpm,继续反应8h,得到利托菌素修饰的磁性磁珠。
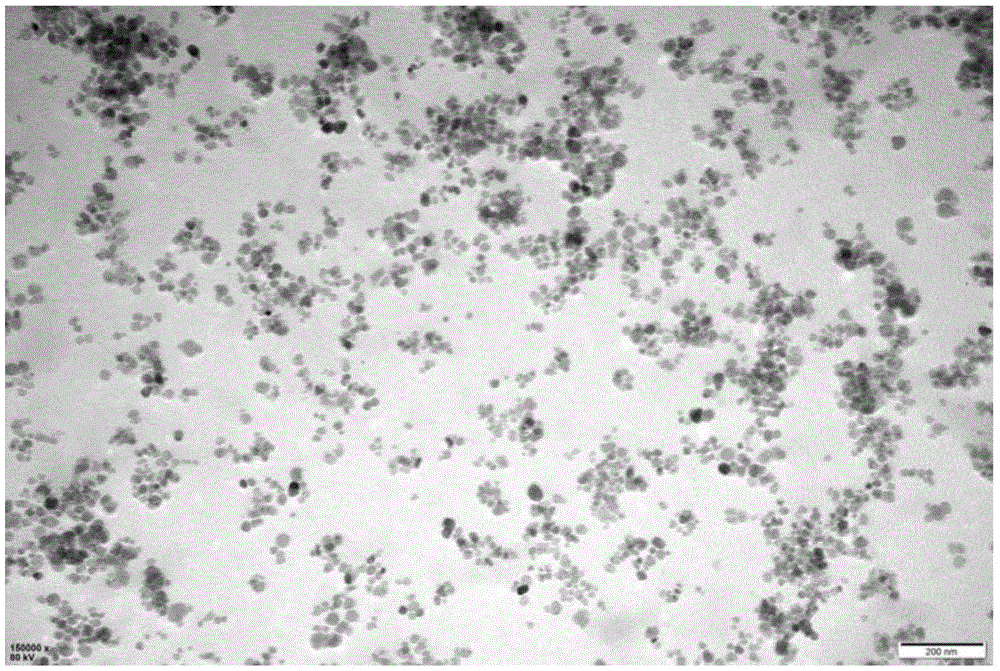
如图1所示为本实施例制备的利托菌素磁珠的形貌图,可以看出,磁珠分散均匀,粒径为50±4nm。
将本实施例制备的磁珠加入到5ml盥洗液中,常温条件下吸附样品中的肺炎球菌,吸附时间为10min,期间颠倒混匀2次。然后磁分离去除上清,得到利托菌素磁珠吸附的肺炎球菌,如图2所示,利托菌素磁珠包被在肺炎球菌的表面,对肺炎球菌的吸附效率达到了98%以上。
向利托菌素磁珠-细菌复合物中加入50μl裂解液,100℃加热处理5min,再次磁分离,上清即可作为模板进行检验。裂解液中包含1%tritonx-100、10mmtris-hcl、1mmedta。检测体系中包含6~10ubstdnapolymerase、1.2~1.6mmdntp、2.5μl10×buffer、4~8mmmgso4、引物、指示剂和2μldna模板,反应条件为63-68℃,恒温扩增30~60min,85℃5~10min结束反应。其中,引物的具体引物序列如下:
f3:cgctgtaaacgatgagtgct
b3:cggtcagagggatgtcaaga
fip:ttgcggtcgtactccccagg-cctttccggggtttagtgc
bip:ctcaaaggaattgacgggggcc-tcttcgcgttgcttcgaatt
lb:gcggtggagcatgtggtt
检测结果如图3所示,可以在20min左右检测到肺炎球菌,说明本发明制备的产品对肺炎球菌具有较强的特异性。
实施例2
本实施例与实施例1的区别在于:利托菌素与2,2,2-三氯乙醇的质量比4:1。
将本实施例制备的磁珠用于吸附肺炎球菌,吸附效率为86%左右。
实施例3
本实施例与实施例1的区别在于:步骤1.1中利托菌素与2,2,2-三氯乙醇的质量比33:1。
将本实施例制备的磁珠用于吸附肺炎球菌,吸附效率为89%左右。
对比例1
本对比例与实施例1的区别在于:未使用2,2,2-三氯乙醇对利托菌素进行处理。
本对比例制备的利托菌素磁珠的平均粒径为54nm±6nm。将本对比例制备的磁珠用于吸附肺炎球菌,吸附效率仅为53%左右。如图4所示。
实施例4
本实施例与实施例1的区别在于:步骤1.3中l-精氨酸与利托菌素的质量比为1:2,如图5所示的62.5mm的l-精氨酸。
将本实施例制备的磁珠用于吸附肺炎球菌,吸附效率为85%左右,如图5所示。
实施例5
本实施例与实施例1的区别在于:步骤1.3中l-精氨酸与利托菌素的质量比为1:10,如图5所示的12.5mml-精氨酸。
将本实施例制备的磁珠用于吸附肺炎球菌,吸附效率为89%左右,如图5所示。
对比例2
本对比例与实施例1的区别在于:步骤1.3中未加入l-精氨酸。
将获得的利托菌素磁珠对肺炎球菌进行吸附,其附效率如图5所示。
对比例3
本对比例与实施例1的区别在于:步骤1.3中使用丝氨酸代替l-精氨酸。
将获得的利托菌素磁珠对肺炎球菌进行吸附。同时对比较了不同浓度的丝氨酸修饰的利托菌素与预处理后的fe3o4纳米磁珠结合制备的磁珠对细菌吸附效率,如图5所示。
对比例4
本对比例与实施例1的区别在于:步骤1.3中使用半胱氨酸代替l-精氨酸。
将获得的利托菌素磁珠对肺炎球菌进行吸附。同时对比较了不同浓度的半胱氨酸修饰的利托菌素与预处理后的fe3o4纳米磁珠结合制备的磁珠对细菌吸附效率。如图5所示。
如图5可以看出,未经l-精氨酸以及经过丝氨酸和半胱氨酸修饰的利托菌素均可连接到改性fe3o4磁珠表面,但修饰效率较低,表现在对细菌的吸附效率上不足40%。随着l-精氨酸的使用量增加,利托菌素磁珠对细菌的吸附效率快速增高,并于实施例1中的浓度(25mm)时达到98%,而丝氨酸和半胱氨酸修饰的利托菌素磁珠对细菌吸附效率的增加较为缓慢,当浓度为25mm时,吸附效率仅为59.24%和67.28%。
实施例6
本实施例与实施例1的区别在于:fe3o4纳米磁珠的质量与聚丙烯酸的体积比为0.1:1。
将本实施例制备的磁珠用于吸附肺炎球菌,吸附效率为86%左右。
实施例7
本实施例与实施例1的区别在于:fe3o4纳米磁珠的质量与聚丙烯酸的体积比为5:1。
将本实施例制备的磁珠用于吸附肺炎球菌,吸附效率为82%左右。
实施例8
本实施例与实施例1的区别在于:步骤2.1中聚丙烯酸、edc与hns的物质的量比例为35:4:1。
将本实施例制备的磁珠用于吸附肺炎球菌,吸附效率为77%左右。图6所示为磁珠的粒径及其吸附效率。
实施例9
本实施例与实施例1的区别在于:步骤2.1中聚丙烯酸、edc与hns的物质的量比例为210:4:1。
将本实施例制备的磁珠用于吸附肺炎球菌,吸附效率为88%左右。附图6所示为磁珠的粒径及其吸附效率。
对比例5
本对比例与实施例1的区别在于:步骤2.1中不加入活化剂,不对聚丙烯酸进行活化处理。
将本实施例制备的利托菌素磁珠用于吸附肺炎球菌,吸附效率如图6所示,可以看出,不使用nhs和edc活化剂活化聚丙烯酸时,磁珠对肺炎球菌的吸附效为55%。
实施例10
实施例与实施例1的区别在于:步骤2.3中聚丙烯酸与fe3o4纳米磁珠的搅拌速度分别为100rpm、250rpm、500rpm和1000rpm,搅拌时间分别为0.5h、1h、4h、6h。室温条件下750rpm反应2h。如下表1所示。
表1.聚丙烯酸与磁珠在不同转速及时间混合对磁珠粒径的影响
从1可以看出,750rpm条件下搅拌2h,所得磁珠粒径较小,粒径较为均匀。而100rpm条件下搅拌0.5h的磁珠虽然粒径同样较小,但颗粒不均匀,其原因在于低速搅拌条件下磁珠与聚丙烯酸分散性较差,容易团聚,因此粒径大小不均,同时,由于反应时间短,导致部分磁珠尚未修饰到磁珠表面。而当转速高于1000rpm时,容易发生飞溅,导致颗粒不均匀。因此,本发明步骤2.3中,fe3o4纳米磁珠与聚丙烯酸在750rpm搅拌2h,获得的磁珠粒径最小,且分布均匀。
实施例11
本实施例与实施例1的区别在于:fe3o4纳米磁珠与利托菌素的质量比为1:1。
将本实施例制备的磁珠用于吸附肺炎球菌,吸附效率为83%左右。
实施例12
本实施例与实施例1的区别在于:fe3o4纳米磁珠与利托菌素的质量比为1:5。
将本实施例制备的磁珠用于吸附肺炎球菌,吸附效率为91%左右。
实施例13
本实施例分别以105、104、103、102、101、100cfu的肺炎球菌验证本发明制备的利托菌素磁珠的灵敏度;同时以沙门氏菌、大肠杆菌、蜡样芽胞杆菌、疱疹病毒、结核分枝杆菌、单核增生李斯特菌和解淀粉芽孢杆菌作为对照菌种,检验引物的特异性。结果如图7所示,从图7(a)可以看出,本发明的检测灵敏度可以达到100cfu,且检测时间仅为1h,可以满足精准医疗,快速检验的需求,且如图7(b)所示,本发明的利托菌素磁珠对肺炎球菌具有良好的特异性。
- 还没有人留言评论。精彩留言会获得点赞!