检测猪流行性腹泻病毒的RPA-LED可视化试剂盒的制作方法
本发明涉及病毒检测领域,尤其涉及一种检测猪流行性腹泻病毒的rpa-led可视化试剂盒。
背景技术:
猪流行性腹泻(porcineepidemicdiarrhea,ped)是由猪流行性腹泻病毒(porcineepidemicdiarrheavirus,pedv)引起的急性肠道传染病,主要临床特征为腹泻、呕吐和脱水,其临床症状、病理变化与猪传染性胃肠炎病毒(transmissiblegastroenteritisvirus,tgev)极其相似难以区分。pedv感染可发生于不同年龄段的猪,其中感染最严重的是仔猪,发病率和死亡率常达100%。pedv在我国猪群中一直广泛传播,2010年10月,由于pedv变异引发了ped在我国大规模的爆发,造成大量仔猪死亡,给我国的养猪业造成了巨大的经济损失。
pedv是有囊膜的单股正链rna病毒,在分类地位上隶属于尼多病毒目(nidovirales)、冠状病毒科(coronaviridae)、冠状病毒属(coronavirus)i群,与猪传染性胃肠炎病毒(transmissiblegastroenteritisvirus,tgev)、猪呼吸道冠状病毒(porcinerespiratorycoronavirus,prcov)、人冠状病毒229e同属。pedv粒子呈多形性,大多数呈球形,直径大小为95~190nm(平均直径约为130nm)囊膜上分布着长度为18~23nm的纤突,由内向外呈放射状排列。pedv的基因组全长约为28kb,5’端非编码区(5’-untranslatedregion,utr)有帽子结构,3’端有poly(a)尾巴和至少7个开放阅读框(orf),同时有编码s、e、n、m基因的4个结构蛋白和orf1a、orf1b以及orf3基因的3个非结构蛋白。整个基因组从5’到3’的顺序依次为:5’-orf1a/1b-s-orf3-e-m-n-3’。duarte等通过研究证实了pedv各蛋白片段的大小,其中编码非结构蛋白的orf(1a和1b)占到整个基因组的三分之二大小的长度,而编码基因组结构蛋白的s蛋白为150~220kda、e蛋白为7kda、m蛋白为20~30kda、n蛋白为58kda,orf3是一种调节基因,编码一种辅助蛋白。
1971年英国首次报道pedv,随后欧洲几个国家相继出现了类似的病毒性腹泻,1978年在比利时首次分离到pedv并将其命名为cv777株。ped主要发生在冬、春寒冷季节,病猪和潜伏感染猪呕吐物和腹泻粪便中含有大量病毒为该病的主要传染源,可通过直接接触进行传播。当猪场发生pedv感染时主要通过粪-口途径进行传播,不同年龄和品种的猪都能受到感染并表现不同程度的症状,但仔猪的病情尤其严重死亡率可高达100%。2000年以来,欧洲已少有爆发急性,但该疾病在包括中国、韩国和日本在内的亚洲国家中的流行却愈发的严重起来。
由于ped与tge、轮状病毒病、大肠杆菌等肠道感染性疾病的相似性,尤其是pedv与tgev两种病毒,仅仅通过临床症状和病理变化几乎不能特异性区分,因此实验室诊断对于pedv的确诊是十分必要的。
目前用于猪流行性腹泻病毒的检测方法主要包括病原学诊断,血清学方法和分子生物学方法。病毒分离鉴定是传统的检测方法,但是耗时较长,不适合于大批样品的检测。常用的血清学诊断方法主要有:酶联免疫吸附试验(enzyme-linkedimmunosorbentassay,elisa)、微量血清中和试验等,特异性强,结果真实可靠,但是实际操作中费时费力,敏感性较低且易有交叉污染,因此在临床应用过程中有一定的局限性。而rt-pcr、荧光定量pcr检测方法虽然操作简便,特异性强,敏感性高,但需要相关的仪器设备,并对技术人员的操作技能和分析能力要求较高。
重组酶聚合酶等温扩增技术(recombinaseploymeraseamplication,rpa)是一种新型核酸等温扩增技术,经过研究人员的努力,rpa技术已经获得了快速的发展。rpa产物检测方法主要分为三种:凝胶电泳检测、实时荧光rpa(real-timerpa)和核酸试纸条rpa。其中凝胶电泳检测是rpa扩增与琼脂糖凝胶检测技术相结合,即将rpa扩增产物经过商品试剂盒纯化后直接用琼脂糖凝胶电泳进行检测,与lamp技术相比该过程仅需要一对引物即可完成对目的片段的扩增。实时荧光rpa是基于荧光标记探针的检测方法,通过观察荧光信号的强度来达到对扩增产物的实时监控。rpa技术在基因扩增方面具有很大的优势,但引物设计比较复杂。
以上这些方法的不足限制了在基层和临床检测中的推广应用。鉴于此,迫切需要建立一种快速、简便、准确的检测方法。
技术实现要素:
本发明的一个目的是提供一种检测猪流行性腹泻病毒的重组酶聚合酶等温扩增引物组。所述引物组包括序列如seqidno:1-3所示的上游引物、下游引物和探针。
具体的,序列如下:
上游引物:
5'-biotin-acaagtactctgcgttcttgtatggtgtca-3'(seqidno:1)
下游引物:5'-cttacctgtacgccagtagcaaccttatag-3'(seqidno:2)
探针:
5'-fam-gattgaaagaccaccaagaatgtgtcctgc-thf-ccacaaccga
atgct-c3spacer-3'(seqidno:3)。
所述上游引物和所述下游引物的终浓度为15-420nm。
所述探针的终浓度为5-120nm。
本发明的第二个目的是提供一种检测猪流行性腹泻病毒的逆转录重组酶聚合酶等温扩增试剂,包括重组酶聚合酶、dntps和权利要求1所述的引物组。
本发明的第三个目的是提供一种检测猪流行性腹泻病毒的逆转录重组酶聚合酶等温扩增试剂盒,所述试剂盒含有如上所述的引物组,或如上所述的试剂。
所述试剂盒还包括水解缓冲液和醋酸镁溶液。优选的,所述醋酸镁溶液为280mm醋酸镁溶液。
所述试剂盒包括核酸检测试纸条。优选的,所述核酸检测试纸条为通用型核酸检测试纸条。
所述试剂盒包括全封闭式靶核酸快速检测装置。所述全封闭式靶核酸快速检测装置通过将核酸检测试纸条置入一个掌上塑料检测装置内得到。
本发明第四个目的是提供如上所述的试剂盒进行猪流行性腹泻病毒检测的方法,包括以下步骤:
s1、配制反应体系:将上游引物、下游引物、探针、水解缓冲液、待检测样品和水混匀后加至重组酶聚合酶里面,反复吹打混匀,然后加入醋酸镁溶液得到反应混合物;
s2、将步骤s1中得到的反应混合物在恒温下反应;
s3、将步骤s2恒温反应后的产物用核酸检测试纸条进行检测并观察结果;
s4、结果判定:直接肉眼判读。
判断标准为:
阴性:试纸条质控区(c线)出现一条红色条带,检测区(t线)没有条带。阴性结果表明样本中不含目的核酸片段,或其数量低于试纸条的最低检测限;
阳性:试纸条出现两条红色条带,一条位于质控区(c线),一条位于检测区(t线)。阳性结果表明样本中含有待检测的核酸片段,且其数量达到或高于试纸条的最低检出量,即所检测的样本感染了猪流行性腹泻病毒;
无效:试纸条质控区(c线)和检测区(t线)均未出现条带,提示所用的试纸条和反应试剂可能已经损坏、失效或者操作有误。
在一个具体实施例中,上述s1具体为:将2.1μl10μm上游引物、2.1μl10μm下游引物、0.6μl10μm探针、29.5μl水解缓冲液、待检测样品和水混匀,涡旋并离心后添加至冷冻干燥的重组酶聚合酶冻干酶粉里面,反复吹打混匀,然后加入2.5μl醋酸镁溶液得到反应混合物;
优选的,在s2中,恒温反应条件为25-40℃下反应。
更优选的,在s2中,恒温反应条件为:在37℃下反应20min。
优选的,在s3中,用核酸检测试纸条进行检测2~5min后观察结果。
优选的,在s1中,待检测样品为4μl,水为9.2μl。
优选的,在s1中,的反应体系在反应管中配制;所在s2中,在恒温反应5min后,取出反应管,上下颠倒混匀,离心后继续反应15min。
如下a)或b)的应用也属于本发明的保护范围:
a)如上所述的引物组在制备所述的试剂或者所述的试剂盒中的应用;
b)所述的引物组,试剂,或所述的试剂盒在制备检测或辅助检测待测样品中是否含有猪流行性腹泻病毒的产品中的应用。
本发明的所公开的试剂盒的反应原理为:
重组酶聚合酶等温扩增技技术(rpa)是一个在重组酶聚合酶介导下,模拟生物体内dna复制过程的等温扩增技术。具有操作简便、反应时间短、特异性强、敏感性高的特点,于37℃~39℃,恒温反应20min即可对目的片段完成扩增。
重组酶聚合酶等温扩增技术是被称为可以替代pcr的核酸检测技术。其扩增原理是,重组酶与引物结合形成复合物后,寻找匹配的dna同源序列,紧密结合发生重组,在单链dna结合蛋白的作用下,模板dna开始解链,引物与模板dna配对,在bsudna聚合酶的作用下复制延伸,对目的片段进行指数级扩增。rpa与pcr不同,整个过程仅需要在37℃~39℃等温条件下反应15min~20min即可得到扩增产物,不需要高温变性和退火的过程,整个反应简单、快速、高效。rpa反应可以在水浴锅或者直接用人体温进行加热,反应结束后可直接通过侧向流动层析试纸条读取检测结果。
在整个反应体系中,需要生物素标记的反向引物和羧基荧光素(fam)标记的特异性探针,该探针5'端进行抗原标记fam,3'端标记聚合酶延伸封闭基团c3-spacer,在距羧基荧光基团约30个碱基处有一个四氢呋喃脱碱基位点(tetrahydrofuranabasic-sitemimic,thf),该位点可被大肠杆菌核酸外切酶nfo识别并进行切割,产生自由的羟基末端,然后便在dna聚合酶的作用下延伸。此时形成的扩增产物为5'端含有6-fam,3'端含有生物素的二元复合物。将经rpa扩增后的产物用于核酸试纸条检测,基于抗原抗体免疫反应,含有fam-biotin双标记扩增子与抗fam抗体的金标颗粒结合成三元复合物,该复合物在免疫层析试纸条上自下由上进行扩散,当扩散到标有生物素抗体的检测线上时,该复合物即被捕获并显色,其他未被捕获的探针和金标颗粒标记的抗fam的抗体形成的不含生物素的两元复合物继续向上扩散,当扩散至被标记有羊抗fam抗体的质控线时被捕获显色。
本发明具有以下有益效果:
(1)本发明将rpa技术和横向流动试纸条技术(lateralflowdipstick,lfd)相结合建立快速检测pedv的方法,,通过特异性和灵敏度评价,可用于现场临床检测,为pedv的现场检测提供了一种灵敏、可靠的新方法。本发明的引物和探针是从靶标序列两端设计多对引物,两两组合筛选而得到。
(2)采用本发明的引物和探针组合,通过rpa技术对猪流行性腹泻病毒进行检测,本方法具有较高的灵敏度、特异性和重复性。
本发明选用的针对猪流行性腹泻病毒m基因设计的引物是经过筛选获得的,特异性好,与猪传染性胃肠炎病毒、猪繁殖与呼吸综合征病毒、猪瘟病毒、猪细小病毒、猪伪狂犬病病毒、猪圆环病毒ⅱ型和大肠杆菌的基因组无交叉反应。
rpa能够将痕量的核酸模板扩增到可以检测的水平,本发明所建立的检测方法可检测到1pg含量的cdna模板。
(3)本发明将rpa技术结合核酸试纸条技术用于检测猪流行性腹泻病毒的方法,既具有分子生物学检测的高灵敏、高通量,又具有免疫学检测的特异性好、操作简便的优点。
(4)所用一次性核酸检测装置为全封闭式靶核酸扩增产物快速检测装置。核酸试纸条使用时核酸产物的交叉污染以及外泄容易造成假阳性的发生,采用全封闭式靶核酸扩增产物快速检测装置,避免了气溶胶的扩散污染。
(5)检测速度快:与pcr相比,不用经过变性、退火、延伸三个步骤,在常温下20min左右即可完成反应。
(6)不需要复杂的仪器设备,适合于现场检测,本发明所建立检测方法可以在常温等温条件下扩增、试纸条可视化检测,不需要pcr仪、荧光定量pcr仪、电泳仪、电泳槽等复杂的仪器设备,且rpa不需要复杂的样品处理,可以真正实现便携式的现场快速核酸检测。
附图说明
利用附图对本发明作进一步说明,但附图中的实施例不构成对本发明的任何限制。
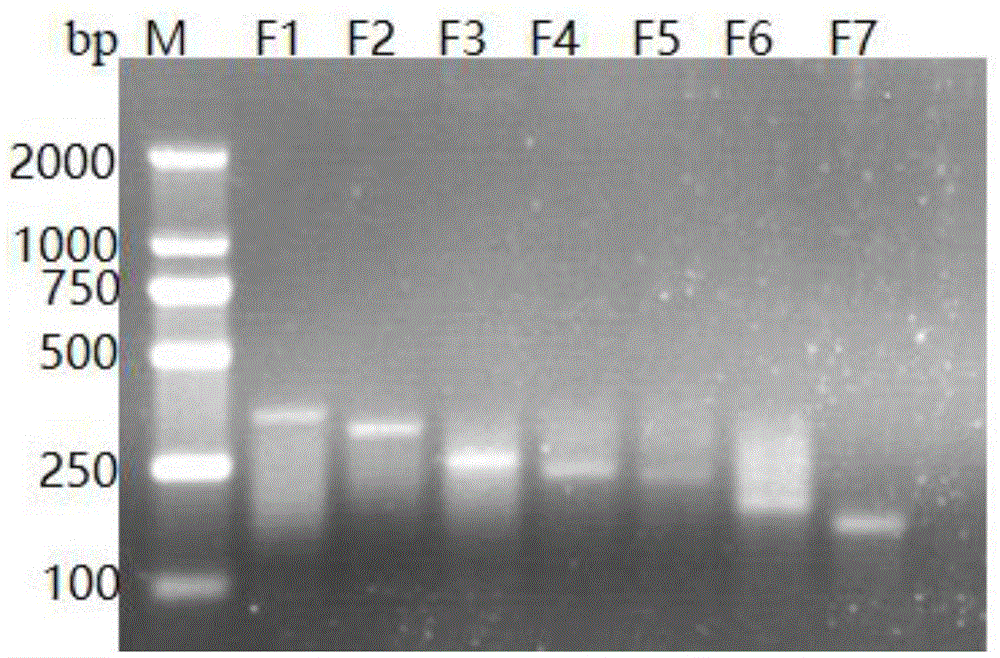
图1pedvrpa琼脂糖凝胶电泳检测体系的建立及上游引物筛选结果图,以r3为下游引物,分别与上游引物f1~f7进行rpa琼脂糖凝胶电泳反应。
图2pedvrpa琼脂糖凝胶电泳检测体系的建立及下游引物筛选结果图,以f5为上游引物,分别与下游引物r1~r7进行rpa琼脂糖凝胶电泳反应。
图3pedvrpa-lfd检测方法建立结果图,分别表示为1:ddh2o(空白对照);2:pedvcv777株(阳性);3:pedv感染阳性病料。
图4为pedvrpa-lfd检测方法反应温度优化结果图,分别表示为1:15℃;2:20℃;3:25℃;4:30℃;5:35℃;6:37℃;7:40℃;8:45℃;9:50℃;10:ddh2o(空白对照)。
图5为pedvrpa-lfd检测方法反应时间优化结果图,分别表示为1:5min;2:10min;3:15min;4:20min;5:25min;6:30min;7:35min;8:ddh2o(空白对照)。
图6为pedvrpa-lfd检测方法引物、探针浓度优化结果图,引物和探针终浓度分别为1:420nm,150nm;2:150nm,50nm;3:120nm,40nm;4:90nm,60nm;5:60nm,20nm;6:30nm,10nm;7:15nm,5nm;8:3nm,1nm;9:ddh2o空白对照。
图7为pedvrpa-lfd检测试剂盒的特异性试验结果图,图中1~9的基因组分别为1:ddh2o(空白对照);2:pedv(阳性对照);3:tgev(传染性胃肠炎病毒);4:prrsv(猪繁殖与呼吸综合征病毒);5:csfv(猪瘟病毒);6:ppv(猪细小病毒);7:prv(伪狂犬病毒);8:pcv-2(猪圆环病毒2型);9:大肠杆菌。
图8为pedvrpa-lfd检测试剂盒的拷贝数敏感性试验结果图。图中的模板分别表示为1:ddh2o(空白对照);2:1010拷贝/反应;3:109拷贝/反应;4:108拷贝/反应;5:107拷贝/反应;6:106拷贝/反应;7:105拷贝/反应;8:104拷贝/反应;9:103拷贝/反应;10:102拷贝/反应;11:101拷贝/反应。
图9为pedvrpa琼脂糖凝胶电泳检测方法的拷贝数敏感性试验结果图。图中的模板分别表示为1:1010拷贝/反应;2:109拷贝/反应;3:108拷贝/反应;4:107拷贝/反应;5:106拷贝/反应;6:105拷贝/反应;7:104拷贝/反应;8:103拷贝/反应;9:102拷贝/反应;10:101拷贝/反应。
图10为pedvpcr琼脂糖凝胶电泳检测方法的拷贝数敏感性试验结果图。图中的模板分别表示为1:ddh2o(空白对照);2:1010拷贝/反应;3:109拷贝/反应;4:108拷贝/反应;5:107拷贝/反应;6:106拷贝/反应;7:105拷贝/反应;8:104拷贝/反应;9:103拷贝/反应;10:102拷贝/反应;11:101拷贝/反应。
图11为pedvrpa-lfd检测试剂盒的cdna敏感性试验结果图。1:ddh2o(空白对照);2:1μg;3:100ng;4:10ng;5:1ng;6:100pg;7:10pg;8:1pg;9:100fg;10:10fg。
图12为pedvrpa琼脂糖凝胶电泳检测方法的cdna敏感性试验结果图。1:1μg;2:100ng;3:10ng;4:1ng;5:100pg;6:10pg;7:1pg;8:100fg;9:10fg。
图13为pedvpcr琼脂糖凝胶电泳检测方法的cdna敏感性试验结果图。1:ddh2o(空白对照);2:1μg;3:100ng;4:10ng;5:1ng;6:100pg;7:10pg;8:1pg;9:100fg;10:10fg。
图14为pedvrpa-lfd检测试剂盒的病毒滴度敏感性试验结果图。1:ddh2o(空白对照);2:107.5tcid50/ml;3:106.5tcid50/ml;4:105.5tcid50/ml;5:104.5tcid50/ml;6:103.5tcid50/ml;7:102.5tcid50/ml;8:101.5tcid50/ml;9:100.5tcid50/ml;10:10-0.5tcid50/ml;11:10-1.5tcid50/ml。
图15为pedvrpa琼脂糖凝胶电泳检测方法的病毒滴度敏感性试验结果图。1:107.5tcid50/ml;2:106.5tcid50/ml;3:105.5tcid50/ml;4:104.5tcid50/ml;5:103.5tcid50/ml;6:102.5tcid50/ml;7:101.5tcid50/ml;8:100.5tcid50/ml;9:10-0.5tcid50/ml;10:10-1.5tcid50/ml。
图16为pedvpcr琼脂糖凝胶电泳检测方法的病毒滴度敏感性试验结果图。1:ddh2o(空白对照);2:107.5tcid50/ml;3:106.5tcid50/ml;4:105.5tcid50/ml;5:104.5tcid50/ml;6:103.5tcid50/ml;7:102.5tcid50/ml;8:101.5tcid50/ml;9:100.5tcid50/ml;10:10-0.5tcid50/ml;11:10-1.5tcid50/ml。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于本发明而不用于限制本发明的范围。
以下实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
twistampnfokit购自英国twistdx公司;引物由上海生工生物工程技术服务有限公司合成;提取病毒rna试剂盒购自omegabio-tek公司;m-mlv反转录酶、rna酶抑制剂、2×taqpcrmixdna聚合酶、随机引物、dntp(2.5mm)、琼脂糖购自takara公司;全封闭式靶核酸扩增产物快速检测装置购自杭州优思达生物技术有限公司。
实施例1检测猪流行性腹泻病毒的重组酶聚合酶等温扩增引物组的制备
本实施例公开了引物及探针的设计和筛选过程。
m基因是pedv基因组中较保守的基因。通过对genbank中已公布的18株m基因同源序列进行比对分析,确定猪流行性腹泻病毒m基因的保守区域,并以此作为rpa引物设计的模板。rpa对引物长度的要求是30-35bp,扩增产物在500bp之内,扩增效率较高。要建立一种快速、敏感的检测方法,需要进行多次引物的筛选,引物个别碱基差异会对扩增效果产生影响,所以,在保守基因区域,设计一系列梯度候选物,两两组合从中选择最佳引物。应用引物设计软件primepremier6.0进行rpa引物设计,同时应用生物软件oligo7.0对引物进行筛选,以确保各引物对之间产生的二聚体较少为原则。
下述的三条引物是本发明的发明人通过比较分析大量的猪流行性腹泻病毒m基因薛烈后设计得到的:
上游引物:
5'-biotin-acaagtactctgcgttcttgtatggtgtca-3'(seqidno:1)
下游引物:5'-cttacctgtacgccagtagcaaccttatag-3'(seqidno:2)
探针:
5'-fam-gattgaaagaccaccaagaatgtgtcctgc-thf-ccacaaccgaatgct-c3spacer-3'(seqidno:3)。
实施例2检测检测猪流行性腹泻病毒的逆转录重组酶聚合酶等温扩增试剂的优化及试剂盒的组装
所述试剂包括重组酶聚合酶、dntps和实施例1所述的引物组。
一种检测猪流行性腹泻病毒的逆转录重组酶聚合酶等温扩增试剂盒,所述试剂盒含有如实施例1所述的或如上所述的试剂。
所述试剂盒还包括水解缓冲液和醋酸镁溶液。所述醋酸镁溶液为280mm醋酸镁溶液。
所述核酸检测试纸条为通用型核酸检测试纸条。
所述试剂盒包括全封闭式靶核酸快速检测装置。所述全封闭式靶核酸快速检测装置通过将核酸检测试纸条置入一个掌上塑料检测装置内得到。
猪流行性腹泻病毒rpa-lfd反应具体步骤如下:
1.病毒rna的抽提:
取本实验室保藏pedv灭活病毒(华南农业大学兽医学院微生物与免疫学教研室保藏),使用omegaviralrnakit抽提rna,所用离心管等耗材均经0.1%depc水处理,确保无rna酶的污染,按照以下步骤进行抽提:
(1)配置qvlbuffer:每管(即每个样品)含有500μlqvlbuffer,添加5μlcarrierrna,现配现用;
(2)添加150μl样品,充分混匀30s;
(3)室温静置5min~10min;
(4)添加350μl无水乙醇,充分混匀30s;
(5)添加750μl混合液至hibindrna结合柱中,操作要仔细而迅速,13000g离心30s,弃滤液;
(6)重复步骤(5)至所有的液体全部经过滤柱;
(7)换新的2ml收集管,加500μlvhbbuffer,13000g离心30s后,弃滤液;
(8)换新的2ml收集管,加500μlwashbufferⅱ,13000g离心30s后,弃滤液;
(9)空管13000g离心2min后,弃滤液;
(10)换新的1.5mlep管,加30μl~50μldepc水,静置3min~5min,13000g离心1min;
(11)所得rna置-80℃冷冻保存。
2.cdna合成
以提取的rna为模板,用m-mlv酶进行反转录反应,反应体系如下:
(1)配置rna反转录预体系,将提取的rna吸取5.75μl于新的1.5mlep管中,再加入1μl随机引物,70℃水浴10min后立即冰浴2min。
(2)配置rna反转录反应体系,rna引物混合液6.75μl,5×buffer2μl,dntp0.5μl,rri0.25μl,m-mlv0.5μl,充分混匀,然后30℃水浴10min,42℃水浴1h。
3.pedvrpa-试纸条检测体系的建立
(1)探针设计:探针5’端标记fam基团,中间thf替代g或c(dspacer),且dspacer两侧尽量避免g、c,dspacer距5’端至少30个碱基,距3’端至少15个碱基,3’端修饰c3-spacer。
(2)在筛选出的最佳引物中,将探针相对应的引物的5’标记生物素(biotin)。rpa-lfd反应体系中引物与探针核苷酸序列如下所示:
上游引物:
5'-biotin-acaagtactctgcgttcttgtatggtgtca-3'(seqidno:1)
下游引物:5'-cttacctgtacgccagtagcaaccttatag-3'(seqidno:2)
探针:
5'-fam-gattgaaagaccaccaagaatgtgtcctgc-thf-ccacaaccga
atgct-c3spacer-3'(seqidno:3)。
具体操作步骤如下:
①以ddh2o作为阴性对照,以病毒cdna为模板作为阳性对照,分别加入下列组分:29.5μl水解缓冲液(rehydrationbuffer),9.2μl的ddh2o,2.1μl上游引物(10μm),2.1μl下游引物(10μm),0.6μl探针(10μm),4μl模板;
②将上述47.5μl混合液转移到含有冻干酶粉的0.2ml的twistampnfokit反应管中,经移液器反复吹打直至完全溶解;
③加入2.5μl的280mm的醋酸镁溶液,反应即刻发生;
④将反应管放入37℃的水浴中;
⑤反应5min后,取出反应管,上下颠倒混匀,短暂离心后继续放入37℃水浴中反应15min;
⑥反应结束后,用核酸试纸条密闭反应装置进行检测,通过试纸条的显色进行结果判定。检测结果的判定:试纸条上质控线和检测线都出现红色条带的为阳性样品;仅在质控线上出现红色条带的为阴性样品。试验结果如图1所示。
实施例3pedvrpa-lfd检测方法反应条件的优化
(1)首先,我们确定rpa-lfd检测方法的最佳反应温度,我们分别试验了在15℃、20℃、25℃、30℃、35℃、37℃、40℃、45℃、50℃不同温度下的反应,并且将反应时间设定为20min。试验结果如图4所示,在37℃条件下检测线显色最亮即反应产物的量最多。表明该试验的最佳反应温度为37℃,因此,我们选择37℃作为该检测方法的反应温度。
(2)其次,我们确定在37℃条件下,不同的孵育时间对于扩增结果的影响,我们试验了5min、10min、15min、20min、25min、30min、35min的实验结果,试验结果如图5所示,在扩增10min的时候,试纸条上出现了微弱的条带;当反应时间在20min~35min之间时试纸条带上没有出现可观测的差异。因此,我们选择20min作为该检测方法的反应时间。
(3)最后,我们确定引物和探针的最佳反应浓度,我们分别试验了在反应体系中引物终浓度420nm,探针终浓度150nm;引物终浓度150nm,探针终浓度50nm;引物终浓度120nm,探针终浓度40nm;引物终浓度90nm,探针终浓度60nm;引物终浓度60nm,探针终浓度20nm;引物终浓度30nm,探针终浓度10nm;引物终浓度15nm,探针终浓度5nm;引物终浓度3nm,探针终浓度1nm不同的引物和探针浓度,同时以ddh2o作为空白对照。试验结果如图6所示,当引物终浓度低于15nm,探针终浓度低于5nm时,试纸条仅在质控区(c)出现红色条带,在检测区(t)内无红色条带出现;当引物终浓度为15nm,探针终浓度为5nm时,检测线上出现较弱的红色条带,当引物终浓度高于15nm,探针终浓度高于5nm时,检测线上的红色条带没有可观察的差异。结果表明该试验的引物最佳反应浓度范围为15~420nm,探针最佳反应浓度范围为5~120nm。
实施例4pedvrpa-lfd检测方法特异性分析
为确认pedvrpa核酸试纸条方法的特异性,分别用tgev、prrsv、csfv、ppv、prv、pcv-2、大肠杆菌的基因组作为特异性对照组进行pedvrt-rpa核酸试纸条反应,同时以猪流行性腹泻病毒(pedv)cv777株作为阳性对照,ddh2o为空白对照。结果如图7所示:只有pedvcv777株阳性模板试纸条检测线上出现了明显的红色条带,说明pedvrt-rpa核酸试纸条检测方法具有良好的特异性。
实施例5pedvrpa-lfd检测方法敏感性分析
(1)pedvrpa-lfd检测方法拷贝数敏感性分析,以拷贝数为1010拷贝/反应作为初始浓度,进行10倍倍比稀释(10-1~10-9)。结果显示:pedvrpa核酸试纸条检测方法最少可以检测到103拷贝/反应(图8),比pedvrpa琼脂糖凝胶电泳检测方法(图9)以及pedv常规pcr检测方法(图10)相比敏感性高一个数量级。对比分析可得,pedvrpa核酸试纸条检测方法具有较广的检测范围且结果判定也更加的准确直观。
(2)pedvrpa-lfd检测方法的cdna含量敏感性分析,对所建立的pedvrpa核酸试纸条检测方法进行cdna敏感性研究,以pedvcdna含量1μg作为初始模板量,进行10倍倍比稀释。结果显示:pedvrpa核酸试纸条检测方法最低检测限达1pg(图11),pedvrpa琼脂糖凝胶电泳检测方法(图12)以及pedv常规pcr检测方法(图13)最低检测限达10pg。对比分析可得,pedvrpa核酸试纸条检测方法具有很好的敏感性且用核酸试纸条进行检测操作更加方便省时,结果判定也更加的准确直观。
(3)pedvrpa核酸试纸条方法的病毒滴度敏感性研究。对所建立的pedvrpa核酸试纸条检测方法进行病毒滴度敏感性研究,以107.5tcid50/mlpedvcv777株作为初始毒株浓度,进行10倍倍比稀释(10-1~10-9)。结果显示:pedvrpa核酸试纸条检测方法可以检测到的tcid50/ml最低检测限达102.5(图14),与pedvrpa琼脂糖凝胶电泳检测方法(图15)相比敏感性一致,但比pedv常规pcr检测方法敏感性高一个数量级(图16)。对比分析可得,pedvrpa核酸试纸条检测方法具有很好的敏感性且用核酸试纸条进行检测操作更加方便省时,结果判定也更加的准确直观。
实施例6pedvrpa-lfd检测方法用于临床样品结果分析
将采集的38份疑似pedv感染的临床病料分别用pcr和rpa核酸试纸条方法进行检测。结果显示,pcr方法检测时17份呈阳性,阳性率为44.7%;rpa核酸试纸条方法检测时20份呈阳性,阳性率为52.6%,二者的符合率为84.5%。结果表示,pedvrpa核酸试纸条检测方法的临床检出率更高。
以上对本发明的具体实施例进行了详细描述,但其只是作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
序列表
<110>华南农业大学
<120>检测猪流行性腹泻病毒的rpa-led可视化试剂盒
<160>3
<170>siposequencelisting1.0
<210>1
<211>30
<212>dna
<213>人工序列
<400>1
acaagtactctgcgttcttgtatggtgtca30
<210>2
<211>30
<212>dna
<213>人工序列
<400>2
cttacctgtacgccagtagcaaccttatag30
<210>3
<211>45
<212>dna
<213>人工序列
<400>3
gattgaaagaccaccaagaatgtgtcctgcccacaaccgaatgct45
- 还没有人留言评论。精彩留言会获得点赞!