一种数字化微阵列器官芯片的制作方法
本实用新型涉及生物技术领域,具体涉及一种基于微流控技术的数字化微阵列器官芯片及其应用。
背景技术:
“器官芯片”技术是在微流体装置中通过连续灌注的方式培养活细胞用以模拟组织和器官的生理功能。其可为细胞生长提供模拟体内的物理环境(流体剪切力,循环应变和机械压缩等),使其更加真实的代表细胞和器官。器官芯片内能够控制液体流动,从而增强许多细胞类型的分化和功能的长期保持。现有的器官芯片可以利用微流控技术、微细加工和生物材料来模拟体内复杂的三维微环境,如利用微流体装置在3D组织结构中培养人微血管内皮细胞,模拟了淋巴管和血管的微通道。也可以模拟在体内观察到的生物肿瘤表型,即由坏死核心,内部静止细胞环和外部增殖细胞区组成的梯度状结。
数字化分析是目前一种高通量的精准分析体系,可以在微观结构上对分析单元分割并独立分析,具有高平行性,高重复性等特点,可用于提高器官芯片精准分析水平。目前,数字化药物筛选平台都是基于384和1536孔板,但该方法在精度上受限于孔板数目,且无法实现3D动态培养。同时,难以进一步减少试剂的消耗、像素量受限于孔板数目、难以进行液体的精确分配,且受到液体蒸发的影响。而基于微流控技术的数字化分析,主要有两种模式:微阵列模式和微滴模式。基于微滴模式的数字化分析,难以去除细胞生长过程中所产生的毒性代谢物质,及添加营养物质,大大限制了微滴分析平台在器官芯片中的研究应用。虽然以微孔为基础微阵列的器官芯片技术具有了数字化分析的雏形,但是目前微阵列器官芯片都是在芯片内对细胞进行截留,成团培养,都面临着通量较低的缺陷。
因此,发展一种数字化微阵列器官芯片,通过在微孔矩阵内进行3D微球培养及检测,此种3D微球借助微滴生成原理,高通量产生3D球体凝胶支架,冻干后可产生一定孔隙,冻干支架吸附细胞后可进行培养。此种方法是在数字化器官芯片外的高通量制备,区别于现有的器官芯片是在芯片内对细胞进行截留,成团培养的特点。该数字化微阵列器官芯片是含有细胞的微球直接注入后进行培养和检测。该数字化的微阵列器官芯片克服了目前已有器官芯片的通量较低的缺陷,实现了高通量的数字化分析。该数字化器官芯片平台具有精准度高,重复性好的特点,可在药物筛选,疾病建模,药物化合物优化和细胞毒性测试需求方面发挥作用。
技术实现要素:
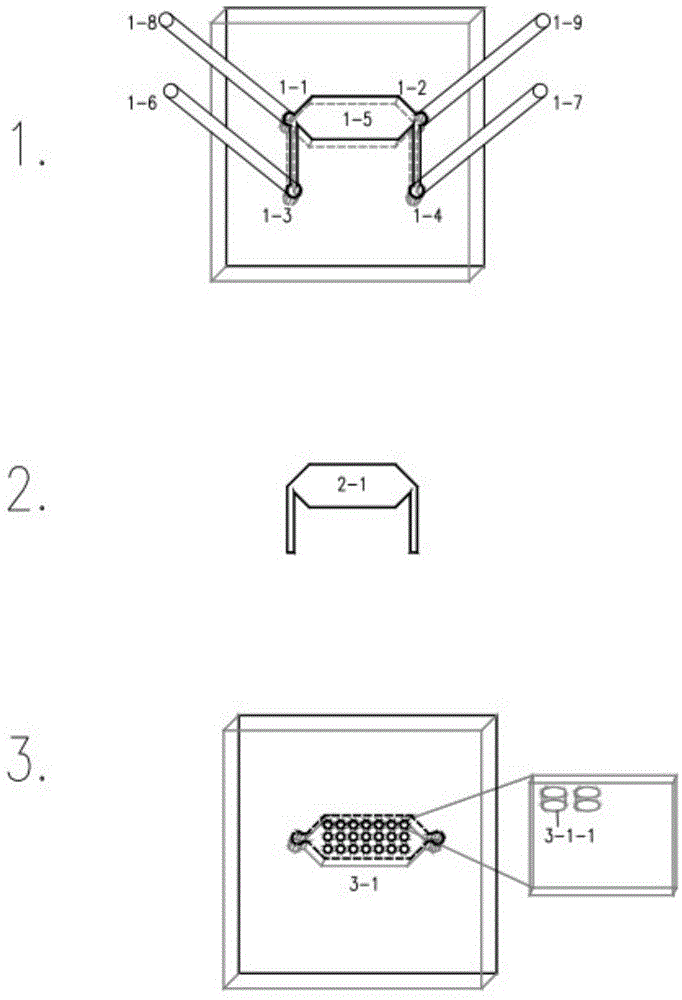
有鉴于此,本实用新型要解决的技术问题在于克服现有技术的缺陷,提供了一种数字化微阵列器官芯片,包括顶板、PET膜以及底板;所述顶板包括液体输入、输出管道,所述顶板、PET膜形成上腔室用于添加细胞培养液,所述PET膜和底板形成下腔室,所述上下腔室被一层PET膜分隔。所述底板排列有微阵列孔,所述微阵列孔用于微球培养及数字化检测。
在某些实施方式中,所述顶板、PET膜、底板通过离子键依次连接;所述顶板开设有注液孔、排液孔和注球孔、排气孔,所述注液孔及排液孔处连通有注液管及排液管,所述注球孔及排气孔处连通有注球管及排气管。所述顶板有上腔室为细胞培养液灌流腔室。
在某些实施方式中,所述上下腔室之间设有PET薄膜,孔径为3~10 μm。
在某些实施方式中,所述下腔室,位于所述薄膜正下方,其横截面积为1-3 cm2。
在某些实施方式中,所述底板上为微孔,个数为200~10,000个,孔径为100~300 µm,厚度为100~200 µm。
在某些实施方式中,所述上腔室腔为U状结构。
在某些实施方式中,所述注液孔孔径为1-2 mm;所述液体排出孔孔径为1-2 mm;所述注球孔孔径为1-2 mm;所述排气孔孔径为1-2 mm;所述注液管管径为0.5-1 mm,长度为8-10 cm;所述排液管管径为0.5-1 mm,长度为8-10 cm;所述注球管管径为0.5-1 mm,长度为1-2 cm;所述排气管管径为0.5-1 mm,长度为1-2 cm。
在某些实施方式中,所述顶板和底板均为PDMS板,且其边长分别为10-15 mm;所述顶板和底板的厚度分别为2-5 mm。
本实用新型还提供了一种数字化微阵列器官芯片的应用,其特征在于,包括以下步骤:
S10:将含有细胞的微球注入到所述的下腔室的底板中,用夹子封闭注球孔和排气孔,静置4小时;
S20:将细胞培养液注入所述的上腔室中;
S30:对S20步骤中数字化微阵列器官芯片与蠕动泵相连培养,培养一定时间后可进行微阵列分析。
在某些实施方式中,将细胞或微球注入到数字化微阵列器官芯片中时,进样速度为0.5-2 mL/min。
本实用新型提供的一种数字化微阵列器官芯片有益效果是:
数字化微阵列器官芯片为微流体芯片,在一块几平方厘米的芯片可以对含有不同细胞类型的微球进行循环的长期培养,并可对其细胞活性进行高通量分析的一种平台。这是一种可用于药物筛选,疾病建模和细胞毒性研究的重要平台。具有仿生、高通量、廉价等特点。该数字化微阵列器官芯片可更好的模拟体内环境并进行高通量分析,拥有巨大的市场化前景。
综上所述,本实用新型针对现有技术存在的问题,利用器官芯片上的微阵列,建立了一种高通量检测方法。该数字化微阵列器官芯片及其应用在药物筛选,疾病建模和细胞毒性测试等方面具有较好的应用前景。
附图说明
应当理解的是,以下附图仅示出了本实用新型的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1 为实用新型的结构分解示意图。
图2为本实用新型的组合图。
图3为本实用新型的组合图。
附图标号说明:顶板1,注液孔1-1,排液孔1-2,注球孔1-3,排气孔1-4,上腔室1-5,注液管1-6,排液管1-7,注球管1-8,排气管1-9,PET膜2-1,底板3,下腔室3-1,微孔3-1-1。
具体实施方式
下面详细描述本实用新型的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,旨在用于解释本实用新型,而不能理解为对本实用新型的限制。
在本实用新型的描述中,需要理解的是,术语“长度”、“宽度”、“上”、“下”、“前”、“后”、“左”、“右”、“竖直”、“水平”、“顶”、“底”“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本实用新型和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本实用新型的限制。
在本实用新型中,除非有明确的限定,在本实用新型描述中,PET膜孔径范围可进行调节,大小可为3~10μm,同时应当理解的是,作为数字化微阵列器官芯片芯片,其材质可为PDMS,但不局限于PDMS,还可为PMMA或其他可雕刻或镂空为具有对应大小孔径的材料均为本专利所保护范围。此外,术语“上腔室”、“下腔室”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征。
在本实用新型中,除非另有明确的规定和限定,术语“相连”、“连接”、“固定”等术语应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或成一体;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通或两个元件的相互作用关系。对于本领域的普通技术人员而言,可以根据具体情况理解上述术语在本实用新型中的具体含义。
实施例
参见图1,本实用新型提供了一种数字化微阵列器官芯片,包括顶板、PET膜以及底板;所述顶板包括液体输入、输出管道,所述顶板、PET膜形成上腔室用于添加细胞培养液,所述PET膜和底板形成下腔室,所述上下腔室被一层PET膜分隔。所述底板排列有微阵列孔,所述微阵列孔用于微球培养及数字化检测。
上述,可以理解的是,数字化微阵列器官芯片为微流体芯片,在一块几平方厘米的芯片可以对含有不同细胞类型的微球进行循环的长期培养,并可对其细胞活性进行高通量分析的一种平台,可用于药物筛选,疾病建模和细胞毒性研究。该芯片具有仿生、高通量、廉价等特点。该数字化微阵列器官芯片可更好的模拟体内环境并进行高通量分析,拥有巨大的市场化前景。
综上所述,本实用新型针对现有技术存在的问题,利用器官芯片上的微阵列,建立了一种高通量检测方法。该数字化微阵列器官芯片及其应用在药物筛选,疾病建模和细胞毒性测试等方面具有较好的应用前景。
在本实用新型实施例中,所述顶板、PET膜、底板通过离子键合依次连接;所述顶板开设有注液孔、排液孔和注球孔、排气孔,所述注液孔及排液孔处连通有注液管及排液管,所述注球孔及排气孔处连通有注球管及排气管。
在本实用新型实施例中,所述上下腔室之间设有PET薄膜,孔径为3 μm。
在本实用新型实施例中,所述上腔室为U状结构,其横截面积为1 cm2。该结构可用于培养基的灌注和持续流动,有利于物质交换和长期培养。
在本实用新型实施例中,所述注液孔孔径为1 mm;所述液体排出孔孔径为1 mm;所述注球孔孔径为1 mm;所述排气孔孔径为1 mm;所述注液管管径为1 mm,长度为10 cm;所述排液管管径为1 mm,长度为10 cm;所述注球管管径为1 mm,长度为1cm;所述排气管管径为1 mm,长度为2 cm。该结构可用于分别添加培养基和微球,有利于微球的固定和培养。
在本实用新型实施例中,所述顶板和底板均为PDMS板,且其边长分别为1.2 cm;所述顶板和底板的厚度依次为2mm。
在本实用新型实施例中,所述底板上为微孔,个数为10,000个,孔径为100 µm,厚度为100 µm。由于微孔的结构设计,在使用时,本实用新型的结构可以达到单位时间10,000个通量,相比较现有技术中常用产品的低于100个通量来说,其分析效率极大提高。
本实用新型还提供了一种数字化微阵列器官芯片的应用,包括以下步骤:
S10:将含有细胞的微球注入到所述的下腔室的底板中,用夹子封闭注球孔和排气孔,静置4小时;
S20:将细胞培养液注入所述的上腔室中;
S30:将S20步骤中数字化微阵列器官芯片与蠕动泵相连培养,培养一定时间后可进行微阵列分析。
可以理解的是,步骤S10中可采用微流注射泵、自动进样器或手动进样器将收集的微球注入到所述数字化微阵列器官芯片1中。
可以理解的是,步骤S30后可对微阵列进行细胞活性分析。
需要理解的是,该芯片可以直接对微阵列结构中的微球进行检测,该种检测方式即为原位检测。
需要理解的是,将数字化微阵列器官芯片上微阵列结构中的微球从芯片上冲洗下来,再进行检测的过程为非原位检测。
在本实用新型实施例中,将微球或者细胞注入到数字化微阵列器官芯片1中时,进样速度为1 mL/min。
以上所述仅为本实用新型的优选实施例而已,并不用于限制本实用新型,对于本领域的技术人员来说,本实用新型可以有各种更改和变化。凡在本实用新型的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本实用新型的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!