依赖慢病毒疫苗颗粒可减少体内的病毒反弹和病毒储备的制作方法
关于联邦政府资助的研究的声明
本发明是在美国政府的支持下完成的,并获得了美国国立卫生研究院(nationalinstitutesofhealth)授予的资助号r01mh102144。美国政府享有本发明的某些权利。
相关申请的交叉引用
本申请要求2017年10月23日提交的美国临时申请no.62/575,629的优先权,该申请的内容通过引用整体合并于此。
本公开体现了用于治疗hiv感染的组合物,制品,方法学等。
背景技术:
hiv在解剖保护区(例如外周血,淋巴组织和大脑)中的持久性阻止了病毒的根除。尽管联合抗逆转录病毒疗法(cart)可以通过标准的临床检测将病毒复制抑制到无法检测的水平,但它不能选择性地消除病毒库。
cart的成功以血浆病毒血症的急剧减少为特征(1-5),已使hiv感染从致命疾病转变为可控制的慢性感染。但是,在存在cart的情况下病毒库的持久性无法治愈(6-13)。
已经提出主要的病毒库是血液中的cd4t细胞和单核细胞/巨噬细胞谱系的细胞(14、15)。两者都是hiv-1的天然靶标。eisele和siliciano将病毒库定义为“受感染的细胞群体,可以在几年的时间范围内以最佳haart方案在人类患者中持久保持具有复制能力的hiv-1”(15)。长期以来,人们已经认识到血液cd4t细胞和巨噬细胞均可被hiv感染(15-17)。在高致病性猿猴免疫缺陷病毒/hiv1型(shiv)嵌合病毒感染中,cd4t细胞和巨噬细胞均被确定为主要储库。特别是,在cd4+t细胞耗尽后,巨噬细胞可在猕猴中维持较高的病毒载量(18)。
众所周知,由于病毒储库的持续存在,随着cart的停止,病毒反弹总是会发生的(6-13)。在过去的10到15年中,hiv研究领域一直广泛关注血液中的cd4t细胞作为主要储藏室和反弹病毒的来源(14、15)。另外,新出现的证据表明组织中的其他细胞类型也可以作为重要的病毒库。例如,已经证明反弹的血浆病毒不能完全反映静止的cd4t细胞的病毒遗传库(19、20),表明存在其他提供反弹病毒的储库(21-23)。另一方面,已证明即使同时发生cart(21-23),体内仍可能发生低水平的持续病毒产生,这表明诸如肠道和淋巴结等组织中的细胞可能继续产生低水平的艾滋病毒。
因此,基于这些发现,反弹病毒可能来自hiv储库,这些储库允许(a)具有复制能力的hiv持续存在,(b)在最佳cart方案下在人类患者中连续产生低水平的病毒颗粒或病毒蛋白。病毒库可能包括“潜伏库”,例如具有复制能力的hiv但不产生病毒蛋白的静止cd4t细胞,以及可以连续产生病毒颗粒或病毒蛋白的“活性库”。已知巨噬细胞具有代谢活性并支持持续不断的病毒生产(24)。巨噬细胞对艾滋病毒感染的细胞病理学影响极小,并且可以长期存活以进行病毒生产(18、25)。总之,来自大量动物和人体研究的大量实验证据表明,血液cd4t细胞和组织巨噬细胞都是主要的病毒库和反弹病毒的重要来源。
发明概述
一方面,本文提供了通过注射到受试者体内的治疗性疫苗(hiv样颗粒)来减少siv/hiv病毒反弹并减少病毒库的方法和组合物等。
如下文在体内动物试验中所详述,本发明人首次令人惊讶地发现,具有或不具有功能基因的rev依赖性载体可以治愈hiv/siv感染,并完全消除病毒反弹。这是因为(1)表达功能基因的rev依赖型载体可以递送治疗性有毒蛋白质或核酸序列,从而诱导hiv/siv+细胞的杀伤或凋亡。空的依赖rev的载体还可以通过竞争性抑制hiv/sivtat和rev调节的病毒基因转录和病毒基因组包装来灭活病毒库。在没有cart的情况下,依赖rev的载体本身可以促进抗hiv/siv免疫以完全阻断病毒反弹,这确实是出乎意料的,无法预测。
通过这样做,本发明人确定杀死hiv+阳性细胞涉及非常复杂的治疗策略,如下所示:
(1)首先,使用抗体或抗hiv/siv清除受试者体内的cd8t细胞,以确保人体的杀伤性t细胞(cd8)不排斥治疗性疫苗。
(2)在注射疫苗颗粒期间,受试者需要从抗hiv治疗(cart)休息约2周,以使注射的疫苗颗粒能够扩增和复制。
(3)在疫苗颗粒扩增后,需要重新启动抗hiv治疗(cart)以降低病毒对基线的载量。本发明人在下面的动物试验中发现,如果不重新开始抗hiv治疗(cart),则疫苗将不起作用,因为cart可以通过减少hiv/siv复制来帮助载体起作用。仅通过动物试验发现了这一点,无法预测。
(4)本发明人在下述动物试验中还发现更昔洛韦治疗约2周或更长时间可降低病毒载量。
(5)在siv+/hiv+细胞中表达hsv-1tk(胸苷激酶)或traf6等治疗性基因可以降低体内病毒反弹。在目前的动物试验之前尚不清楚。
(6)将单纯疱疹病毒(hsv)胸苷激酶基因传递到hiv/siv感染的细胞中,可以将hiv+细胞转化为类似于体内“hsv感染的细胞”的细胞。这些细胞可以通过使用抗hsv药物如更昔洛韦来减少。
(7)即使没有功能基因的表达,依赖rev的载体本身也可以减少病毒载量和反弹。在目前的动物试验之前尚不清楚。
一方面,提供了用于减少受试者中的siv/hiv病毒反弹和减少病毒库的组合物。在一个实施方案中,该组合物是一种治疗性疫苗(hiv样颗粒)。在另一个实施方案中,所述组合物包含依赖于rev的载体。在另一个实施方案中,rev依赖性载体包含治疗基因,例如hsv-1tk(胸苷激酶)或traf6(肿瘤坏死因子)。在另一个实施方案中,rev依赖性载体是不表达治疗基因的空的rev依赖性载体。在一个实施方案中,并且如本文所用,所述受试者是患者,例如人类患者或动物。
在另一方面,提供了用于减少受试者中的siv/hiv病毒反弹和减少病毒库的方法,其包括向受试者施用包含可以启动抗hiv应答或诱导杀死hiv+细胞的基因的组合物。在一个实施方案中,该组合物包含依赖于rev的载体。
在另一方面,提供了用于减少受试者中的siv/hiv病毒反弹并灭活病毒贮库的方法,其包括向受试者施用包含表达基因或不表达基因的rev依赖性载体的组合物。该载体可通过竞争性抑制hiv转录和病毒基因组包装来灭活病毒库。
在另一方面,本文提供了用于选择性杀死受试者中hiv感染的细胞的rev依赖性载体系统,其中所述载体包含单纯疱疹病毒胸苷激酶基因(hsv-tk)。
在另一方面,本申请提供了rev依赖性载体系统,用于选择性杀死受试者中hiv感染的细胞,其中所述载体包含肿瘤坏死因子(traf6)。
在另一方面,本文提供了用于减少受试者中的siv/hiv病毒反弹和减少病毒库的方法,其包括向受试者施用包含单纯疱疹病毒胸苷激酶基因(hsv-tk)的rev依赖性载体系统。
在另一方面,本文提供了用于减少受试者中的siv/hiv病毒反弹和减少病毒储库的方法,其包括向受试者施用包含肿瘤坏死因子(traf6)的rev依赖性载体系统。
在另一方面,本文提供了用于减少受试者中的siv/hiv病毒反弹和减少病毒库的方法,其包括向受试者施用不表达任何基因的rev依赖性载体系统。
在另一个方面,提供了一种杀死需要其的受试者的hiv+阳性细胞的方法,包括:(a)施用抗体或抗hiv/siv来从受试者体内消耗cd8t细胞,以确保不会排斥cd8t细胞。人体杀伤性t细胞(cd8)的治疗性疫苗;(b)注射包含rev依赖性载体系统的hiv疫苗颗粒,以选择性杀死hiv感染的细胞;(c)在注射疫苗颗粒期间停止抗hiv治疗(cart)一个足够长的时间使注射的疫苗颗粒能够扩增和复制,而没有抗hiv/siv药物阻止颗粒感染细胞;(d)在疫苗颗粒扩增后,再次启动抗hiv治疗(cart),以将病毒载量降低至基线。当然,本领域普通技术人员将理解,取决于抗hiv药物的类型,完全不需要停止cart,并且逐渐减小cart即可。例如,在一个实施方案中,当抗hiv药物是逆转录酶抑制剂时,该药物将阻断细胞的rev依赖性颗粒感染。在其他实施方案中,当抗hiv药物是蛋白酶抑制剂或病毒装配抑制剂时,这些抗hiv药物可能不抑制细胞感染,因此cart逐渐减少就足够了。
在一个实施例中,足够的时间是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20天,或优选大约两周后,病毒载量又降至无法检测的水平。在另一个实施方案中,足以降低血浆病毒血症的时间足以降低至小于1、2、3、4或5%。在另一个实施方案中,该方法进一步包括施用细胞因子例如il-2和inf-γ,hdac抑制剂例如丙戊酸或伏立诺他;诸如氟达拉滨的化学治疗药物;与病毒包膜结合的杂合cd4-毒素;或能够表达hsv1-tk的基于hivltr的慢病毒载体。
另一方面,提供了一种减少病毒反弹的方法,该方法包括:向需要治疗hiv-1的患者施用足以降低患者血浆病毒血症的haart方案一段时间;以及此后抑制方案并在抑制期内施用rev依赖性慢病毒载体,以使rev依赖性慢病毒在hiv-1感染的细胞中充分复制;然后向患者施用第二种haart方案。在一实施方案中,足以降低血浆病毒血症的时间足以降低至小于1、2、3、4或5%。在另一个实施方案中,该方法进一步包括施用细胞因子例如il-2和inf-γ,hdac抑制剂例如丙戊酸或伏立诺他;诸如氟达拉滨的化学治疗药物;与病毒包膜结合的杂合cd4-毒素;或能够表达hsv1-tk的基于hivltr的慢病毒载体。在另一个实施方案中,该方案包括施用一种或多种选自替诺福韦、emtriva和norvir的抗病毒剂。
在另一方面,提供了一种疫苗,其在药学上可接受的介质中包括rev依赖性载体,该载体包含单纯疱疹病毒胸苷激酶基因(hsv-tk)或无基因(空的rev依赖性载体)。
在另一方面,提供了一种治疗组合物,其在药学上可接受的介质中包括rev依赖性载体,其包含肿瘤坏死因子(traf6)或无基因(空rev依赖性载体)。
最后,提供了一种在受试者中抑制hiv/siv转录的方法,其包括向受试者施用不表达任何功能基因的rev依赖性载体系统。如上所述,在一些实施方案中,受试者是患者,例如人类患者或动物。
附图说明
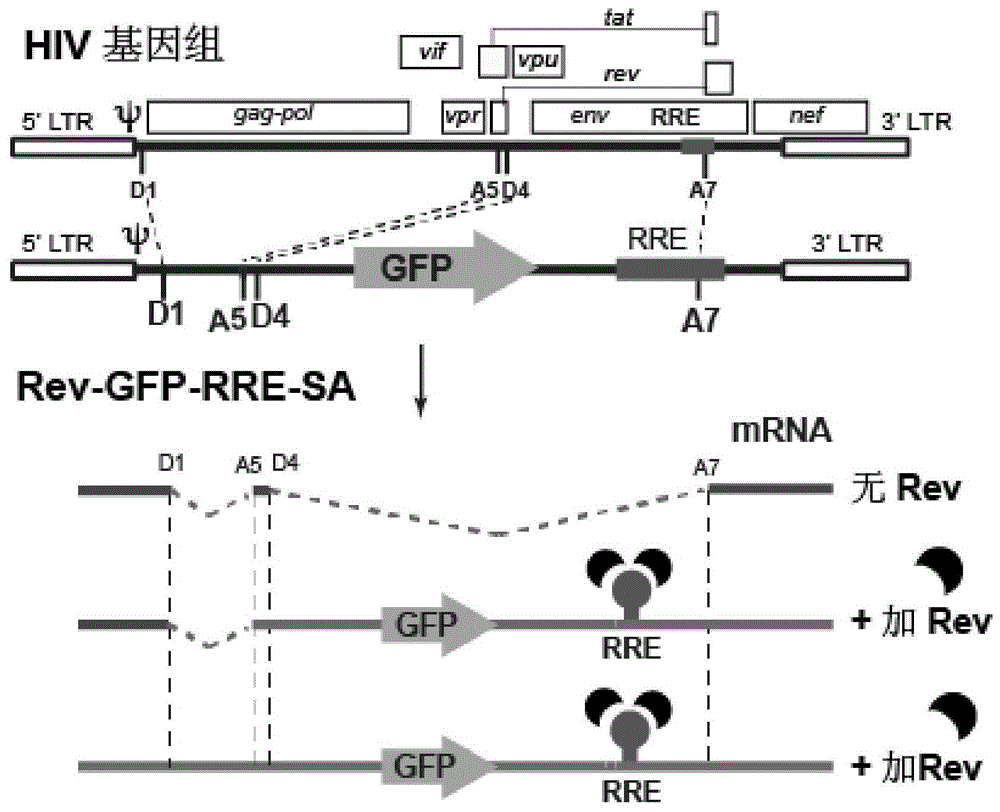
图1示出了依赖于rev的载体rev-gfp-rre-sa。显示的是包装信号(ψ)、rre、剪接供体(d1、d4)和受体(a5、a7)及其参与剪接。在没有hivrev的情况下,剪接所有转录本,并去除gfporf,没有gfp表达。在rev的存在下,rev与rre结合,阻止剪接,并介导未剪接和单剪接的含gfp的mrna的核输出和翻译。表达gfp。
图2显示了用于鉴定hiv感染的巨噬细胞的rev依赖性病毒粒子的组装。(a)通过将hek293t细胞与三种质粒prev-gfp-rre-sa、共转染来组装病毒颗粒;pcmvδr8.2和phcmv-g。(b)用依赖rev的gfp报告病毒追踪hiv感染的巨噬细胞。用hivad8感染血液单核细胞衍生的巨噬细胞,然后用vnl-gfp-rre-sa进行超级感染。(a)感染巨噬细胞的光学显微镜检查。(b)用pe标记的抗体(红色荧光)对相同的细胞进行hiv-1p24染色。(c)gfp也观察到相同的区域。
图3显示了rev依赖性载体在介导hiv依赖性基因表达中的高度特异性。(a)cem-ss细胞未感染或未感染hiv-1(nl4-3.hsa),随后在24h过度感染了rev-gfp-rre-sa。为了进行比较,还用rev-gfp-rre-sa或hiv-1(nl4-3.hsa)单独感染了细胞。在72小时时分析了hsa和gfp的表达。(b)用不同剂量的rev-gfp-rre-sa(x轴)超级感染hiv感染的细胞(hsa+)。流式细胞仪产生的hiv阳性细胞百分比在3天后(y轴)变为gfp阳性。非线性曲线拟合(矩形双曲线)得出r2=99.4;最大gfp阳性=86.1±6.3%(最佳拟合值±标准误差);kd=128.1±21.5ngp24。虚线是95%的置信带。
图4提供了携带an1o、dt-a、traf6和hsv1-tk的依赖于rev的载体的示意图。
图5显示了依赖sivrev的载体向目标siv储层的发展。(a)基于sivmac239构建携带治疗基因(hsv1-tk或traf6)的sivrev依赖性载体。这些siv载体的结构类似于hivrev依赖性载体。显示的是包装信号(ψ)、rre、剪接供体(d1、d3)和受体(a6、a7)。对于traf6(r),将traf6以相反的方向放置。(b)辅助质粒pad-siv3+。该质粒不包含病毒包膜基因和nef基因。两者均由env和nef表达载体(pltr-siv-env和pltr-siv-nef)提供。为了组装病毒粒子,将sivrev依赖型载体psiv-hsv-1-tk-rre、psiv-traf6-rre或psiv-traf6(r)-rre与pad-siv3+和pltr-siv-env共转染。和pltr-siv-nef导入hek293t细胞。共转染后48和72小时收获病毒,并浓缩用于动物注射。
图6提供了依赖于rev的载体组装、纯化和浓缩的示意图。使用浓缩(500-1000倍)的颗粒注射(静脉内)小鼠和恒河猴以评估毒性。
图7给出了研究组a至d的不同治疗和载体注射设计的示意图。
图8提供了对rev依赖性载体的动物试验的结果的总结,其遵循图7中描述的不同治疗和载体注射的示意图。y轴是血浆病毒载量(拷贝数/ml);x轴是siv感染后数周的时间。
图9显示了用rev依赖性载体治疗的动物(d组)中csf病毒载量的定量。y轴是以csf为单位的病毒载量(份数/毫升);x轴是以星期为单位的时间。
发明详述
艾滋病毒储存库的持续存在仍然是消灭病毒的最大障碍。特别地,来自单核细胞/巨噬细胞谱系的细胞抵抗hiv介导的杀伤并支持持续的病毒产生。感染的巨噬细胞也可以渗透到大脑中,并产生持续的病毒产生部位,引起病理生理后果,包括与hiv相关的神经认知障碍(hand)。当前的抗逆转录病毒疗法(art)不能针对和消除cns中的hiv储备。如下所述,本发明人开发了靶向和杀死这些长寿命病毒库的新策略。
最近针对艾滋病毒库的临床和实验尝试主要集中在“打击并杀死”策略上(26-35)。该方法的主要科学原理是假设病毒库主要以潜伏感染的静息cd4t细胞的形式存在,这些cd4t细胞不表达任何病毒基因(14、15、36、37)。因此,可以用激活病毒基因表达的药物处理这些细胞,这可能导致活化的hiv本身或人类免疫系统杀死储库细胞。例如,感染的患者已经接受了cart加上细胞因子(例如il-2和inf-(26-29)),hdac抑制剂(例如丙戊酸或伏立诺他(30、31、34、38)或化疗药物)的治疗,氟达拉滨(39-41),希望清除潜在的水库。但是,鉴于不同细胞亚型和组织中hiv潜伏期的复杂性,可能难以激活所有潜伏感染的细胞。另外,还不知道“电击”是否总是会导致被感染细胞死亡(30-34)。
还针对艾滋病毒储存库的替代方法进行了测试。例如,hiv感染的细胞已被杂合cd4毒素靶向,该毒素可与被感染细胞表面显示的病毒包膜结合(42)。此外,其他几项研究探索了流行的crispr-cas9基因编辑技术,以靶向病毒库(43-48)。该方法在组织培养条件下简单有效。但是,发现hiv可以迅速产生抵抗cas9编辑的突变。可通过一次使多个病毒基因失活或将crispr与其他抗hiv药物联合使用来解决该问题。的确,通过进一步的改进,最近的一项研究测试了raav载体,该载体可在人源化小鼠模型中递送多重crispr-cas9靶向多个hiv基因。这项研究产生了令人兴奋的结果,证明了在体内完全灭活病毒库的可能性(49)。
在过去的15年中,本发明人已经开发了依赖于hivrev的慢病毒载体,用于选择性靶向hiv储库(50-54)。依赖rev的慢病毒载体在仅存在于感染细胞中的hivrev蛋白的控制下表达治疗基因,从而赋予高特异性。在细胞培养条件下,依赖rev的载体可以选择性杀死hiv阳性细胞,而未感染的细胞则不受伤害(52、53)。参见,例如,2007年6月14日公布的美国2007-0134767。
基于这些体外结果,本发明人最近在siv/猕猴模型中进行了rev依赖性载体的首次动物试验。结果表明,依赖rev的载体可以有效减少cart停止引起的siv反弹。在其中一只接受治疗的动物中,血浆病毒载量降至检测阈值。自12个月前所有治疗方法终止以来,该动物一直将病毒载量控制在无法检测的水平。
如下文在体内动物试验中所详述,本发明人首次令人惊讶地发现,具有或不具有功能基因的rev依赖性载体可以治愈hiv/siv感染,并完全消除病毒反弹。这是因为(1)表达功能基因的rev依赖型载体可以递送治疗性有毒蛋白质或核酸序列,从而诱导hiv/siv+细胞的杀伤或凋亡。空的依赖rev的载体还可以通过竞争性抑制hiv/sivtat和rev调节的病毒基因转录和病毒基因组包装来灭活病毒库。在没有cart的情况下,依赖rev的载体本身可以促进抗hiv/siv免疫以完全阻断病毒反弹,这确实是出乎意料的,无法预测。
这些结果表明,依赖rev的载体具有减少体内病毒库,实现hiv长期缓解的潜力,并可以有效治愈hiv/siv感染。
a.定义
病毒库是指感染的细胞群,它允许(a)具有复制能力的hiv-1持续存在,(b)在最佳haart方案下持续产生患者的病毒颗粒或病毒蛋白。病毒库可能包括“潜伏库”,例如静止的cd4t细胞,它们携带有复制能力的hiv,但不产生病毒颗粒或病毒蛋白。病毒库也可能包括“活动库”,例如感染的巨噬细胞,它们可以连续产生病毒颗粒或病毒蛋白。众所周知,巨噬细胞具有代谢活性并支持持续不断的病毒生产(41)。巨噬细胞对艾滋病毒感染的细胞病理学影响极小,并且可以长时间存活以进行病毒生产(2,42)。
病毒重新激活意味着可以通过免疫刺激(例如细胞因子刺激(43)或静止t细胞的cd3/cd28激活)或药物介导的激活(例如伏立诺他(18))来诱导潜伏的病毒库产生病毒或病毒蛋白。
病毒复制意味着新的感染周期,其中先前未感染的细胞被感染并产生传染性病毒,并继续感染其他细胞(33)。
病毒产生是指由先前感染的细胞产生的病毒,但释放的病毒可能不会再感染细胞。
基于以上定义,rev依赖性载体能够靶向“活性和潜在的贮库”和“病毒再活化”,并能减少“病毒产生”或“病毒复制”。
hiv样颗粒是指能够刺激免疫力并因此起治疗疫苗作用的组装的依赖rev的载体。
空载体是指包含ltr和rre但不表达用于靶向siv+细胞的功能性治疗基因(例如traf6)的rev依赖性载体,但仍然可以降低体内病毒反弹。之所以如此,是因为空载体可以通过多种方式抑制hiv复制,例如(1)竞争性抑制hiv转录、剪接和核输出;(2)竞争性抑制hiv基因组包装;(3)保护未感染的细胞不被感染;(4)增强抗hiv免疫力。
因此,空载体与hiv竞争病毒蛋白和包装;空载体本身可能会激发免疫力;空载体可以保护未感染的细胞。
rev是hiv生命周期中必需的病毒早期蛋白质。rev通过与未剪接和部分剪接的病毒mrna中存在的rev响应元件(rre)结合,调节hivmrna的剪接、核输出和基因组包装。rev依赖性慢病毒载体,在本文中也称为rev依赖性载体系统,依靠rev-rre相互作用来调节基因表达,从而仅在hiv+细胞中选择性表达治疗基因。
b.hivrev依赖的慢病毒载体
如下所述,本发明人在依赖于rev的载体系统中测试了一系列治疗基因,例如白喉毒素、来自炭疽杆菌的炭疽溶菌素o、人traf6或单纯疱疹病毒胸苷激酶基因(hsv-tk)。在体外选择性杀死hiv感染的细胞。在下面描述的动物试验中,hsv-tk和肿瘤坏死因子(traf6)被用作体内靶向siv+细胞的治疗基因。hsv-tk磷酸化更昔洛韦,通过竞争性抑制dgtp掺入dna合成而引起凋亡(tomicic2002)。预期用更昔洛韦治疗被siv感染的恒河猴会杀死siv+细胞,从而减少病毒库。第二个基因traf6是tnf受体相关因子,可调节nf-κb通路。已经表明traf6的过表达引发细胞凋亡(he,2006)。
hivrev是一种病毒编码的早期蛋白质,对于病毒复制至关重要。rev调节未剪接和单剪接的病毒mrna的核输出(60、61),是翻译病毒结构蛋白(例如gag和env)所必需的(62-64)。rev与未剪接和单剪接的病毒mrna上的调节元件,即rev响应元件(rre)直接结合(60)。这种rev-rre相互作用是病毒mrna核输出(60)和多体体缔合蛋白翻译所必需的(64)。rev-rre相互作用也可能会影响包装的病毒基因组rna二聚化(65-67)。
对rev的公认的病毒需求已导致本发明人使用rev-rre相互作用作为调节剂,仅在hiv感染的细胞中实现治疗基因的选择性表达。为此,本发明人构建了hiv-rev依赖性载体,其中将治疗基因或报道基因置于rre之前和多个剪接位点之间(d1,a5,d4,a7)(图1)。与gag或env相似,这种排列将治疗性基因或报告基因调节为晚期基因,并使其表达完全依赖rev。依赖rev的载体还包含病毒基因组rna包装信号(ψ)。因此,当与hiv装配辅助载体共转染时,它将被包装成病毒颗粒作为基因组rna(50)。
如图2a所示,将hivrev依赖的gfp载体组装成病毒体颗粒(图2a),然后在不存在或不存在的情况下,使用该颗粒转导人血单核细胞衍生的巨噬细胞(mdm)和cd4t细胞。艾滋病毒的存在(50)。依赖rev的载体已显示出以高特异性鉴定hiv+巨噬细胞和t细胞的强大能力。
c.hivrev依赖的慢病毒载体在hivtat和rev蛋白的控制下表达治疗基因
本发明的依赖rev的慢病毒载体在hivtat和rev蛋白的控制下表达治疗基因,具有显着的特异性。他们证明,在细胞培养条件下,依赖rev的载体可以选择性杀死hiv阳性巨噬细胞,而未感染的细胞则不受伤害。基于这些体外结果,如下所述,本发明人提供了这些载体在siv/猕猴模型中的体内治疗功效。
本公开提供了第一动物试验数据,其表明可以通过注射到受试者体内的治疗性疫苗(hiv样颗粒)来减少siv/hiv病毒反弹和病毒库。如下所述,本发明的类hiv治疗性疫苗颗粒可以被注射到受试者体内并进入细胞中,以表达可以引发抗hiv反应或诱导杀死hiv+细胞的基因。
本公开还提供了抗疱疹药物更昔洛韦通过诱导杀死hiv+细胞来治疗hiv感染的用途。通过在hiv+细胞中表达单纯疱疹病毒(hsv)胸苷激酶(hsv-tk)将hiv+细胞转化为类似于单纯疱疹病毒感染细胞的细胞,这成为可能。
通过这样做,本发明人确定杀死hiv+阳性细胞涉及非常复杂的治疗策略方案,如下所示:
(1)首先,使用抗体从受试者体内消耗cd8t细胞,以确保人体的杀伤性t细胞(cd8)不排斥治疗性疫苗。
(2)受试者在注射疫苗颗粒期间需要从抗hiv治疗(cart)休息约2周,以使注射的疫苗颗粒能够扩增和复制。
在疫苗颗粒扩增后,再次启动抗hiv治疗(cart)以将病毒载量降低至基线。本发明人在下面的动物试验中发现,如果不重新启动抗hiv治疗(cart),该疫苗将无效。仅通过动物试验发现了这一点,无法预测。
(4)本发明人还在下述动物试验中发现,更昔洛韦治疗2周可降低病毒载量。
(5)traf6在siv+/hiv+细胞中的表达可以降低病毒的反弹。在目前的动物试验之前尚不清楚。
(6)最后,traf6疫苗颗粒不需要消耗cd8t细胞。这是令人惊讶的,并且与需要在注射前清除cd8t细胞的hsv-tk载体形成对比。
在构建本发明的rev依赖性载体的过程中,如下所述,本发明人令人惊讶地发现,具有或不具有功能基因的rev依赖性载体可以治愈hiv/siv感染,并完全消除病毒反弹。这是因为(1)表达功能基因的rev依赖型载体可以递送治疗性有毒蛋白质或核酸序列,从而诱导hiv/siv+细胞的杀伤或凋亡。空的依赖rev的载体还可以通过竞争性抑制hiv/sivtat和rev调节的病毒基因转录和病毒基因组包装来灭活病毒库。在没有cart的情况下,依赖rev的载体本身可以促进抗hiv/siv免疫以完全阻断病毒反弹,这确实是出乎意料的,无法预测。
d.方法论
(1)用于猕猴体内研究的基于siv的rev依赖性载体的开发
如下所述,本发明人测试了依赖rev的载体以靶向猕猴的siv感染。为此,通过掺入来自sivmac239基因组的多个剪接位点(d1,a6,d3,a7)、rre和loopa(ψ),将所有基于hiv的载体转化为基于siv的载体。将hsv1-tk基因克隆到基于siv的载体中(图5)。siv还编码rev蛋白,rev功能在hiv和siv株之间是非常保守的。已显示sivrev能够诱导不完全剪接的mrna的胞质表达(108),hiv-1和hiv-2的rev蛋白也可以激活siv基因表达(109)。另外,人traf6与猴traf6相同。
为了组装病毒颗粒,本发明人获得了基于siv的辅助质粒pad-siv3+(110、111),以及同一载体的非整合形式pad-d64v(112、113)。另外,将sivmac239nef和gp160克隆到基于ltr的表达载体(pltr-siv-nef和pltr-siv-env,数据未显示)。siv的包膜蛋白使用ccr5作为进入的共受体。因此,组装的依赖rev的病毒颗粒将优先感染巨噬细胞和某些ccr5+t细胞,例如活化的记忆cd4t细胞。将这些质粒共转染到hek293t细胞中,组装成病毒颗粒,然后注入动物体内(图5b)。
(2)使用依赖rev的hsv1-tk载体靶向siv储层
hiv主要通过外围感染的单核细胞/巨噬细胞进入中枢神经系统(1-3、44-48)。为了有效地靶向中枢神经系统,必须停止这种主要的病毒流入源。本发明人的初步研究表明,依赖rev的载体可以在体外有效杀死被hiv感染的细胞(6、7)。基于这些令人鼓舞的结果,发明人试图测试依赖sivrev的载体靶向siv感染的能力,从而减少外周和cns中的活性病毒产生。为此,基于hsv1-tk系统的几个优点,将克隆的hsv1-tk用作治疗基因(图1),包括:
(a)优越的安全性:与毒素杀死细胞相比,已在体外和体内研究了核苷类似物/hsv-tk介导的细胞杀伤作用(114-118年)。该系统还经历了数项临床试验,显示出杀死多种细胞类型(118-120)所需的理想安全性和功效。值得注意的是,即使在高浓度的hsv-tk载体下,每次注射>1010转导单位,也观察不到极少的副作用(119、120),这表明在这项研究中,rev依赖的hsv1-tk载体系统将被类似地耐受。实际上,hsv-tk系统已被用于hiv介导的动员和杀死癌细胞的活动(121、122)。
(b)能够在体内动员和扩增:在没有更昔洛韦(gcv)的情况下,hsk-tk载体介导的杀伤作用不会发生。细胞可以稳定地携带该载体并渗入大脑,类似于siv+巨噬细胞。该载体还包含功能齐全的ltr,包装信号(ψ)和rre,类似于先前描述的条件复制慢病毒载体,可以在感染患者的hiv中动员(105)。发明人预期,将siv-hsv1-tk-rre载体注射入感染了siv的猕猴后会扩增。被siv-hsv1-tk-rre感染的巨噬细胞也将渗入大脑,并在cns中通过siv复制而扩增。
(c)更昔洛韦能够对cns进行靶向:已证明gcv可以穿越血脑屏障(bbb),这将使cns特异性靶向hiv感染的细胞(123)。值得注意的是,在大鼠体内进行hsv-tk载体鞘内注射和全身性gcv给药后,已观察到脑中肿瘤细胞的靶向杀伤作用(124)。hsv1-tk系统的这些特征表明,使用依赖rev的hsv1-tk载体和gcv的cns特异性靶向hiv储库是可行的。
(d)能够靶向有丝分裂后的细胞:已经表明,hiv/siv感染的脑巨噬细胞具有比正常细胞更高的dna代谢水平。这些受感染的细胞表达增殖细胞核抗原(pcna),这是指示siv刺激这些非增殖细胞中dna合成和修复活性的标志物(125,126)。hiv/siv刺激的dna合成和dna修复活性可用于hsv1-tk介导的杀伤。使用hsv1-tk和gcv杀死末端分化的滑膜衬里细胞的类似方法已应用于兔炎症性关节炎模型(127)。这种治疗有效地抑制了炎症,并减少了hsv-tk转导的膝盖的关节肿胀。
(e)可以组装高滴度的颗粒:在没有gcv的情况下,hsv1-tk缺乏细胞毒性,因此可以生产高滴度的慢病毒颗粒。先前的研究表明,可以产生高滴度的病毒颗粒(>1010转导单位)并将其注射到动物体内(119、120)。产生更高滴度的病毒颗粒的可行性将极大地促进动物研究。
(3)cd8耗竭模型可加速感染和中枢神经系统疾病。
给siv感染的猕猴注射带有hsv1-tk的siv-rev依赖性颗粒。中断抗逆转录病毒药物的使用以允许载体的传播和扩增。在没有gcv的情况下,不会发生rev介导的hsv1-tk对siv阳性细胞的杀伤。但是将发生依赖siv的媒介动员,并在1-2周内最大化(105)。预期携带hsv1-tk的感染巨噬细胞也将渗透到大脑中,并在cns中通过siv复制而扩增。
为了进一步促进载体的动员和扩增,如果需要,还可以用临床hdac抑制剂(如伏立诺他)治疗动物,以刺激潜伏细胞的病毒复制(18)。在载体动员,扩增和细胞刺激后,将静脉内施用gcv以诱导hsv1-tk介导的外周血中siv阳性细胞的杀伤,旨在阻止siv感染的巨噬细胞持续流入大脑。考虑到gcv也可以从血浆进入cns,也会杀死大脑中的siv阳性细胞。监测此方法的有效性,以观察art停用后病毒反弹的任何显着延迟或减弱。还将对预防或延缓sive(siv脑炎)的可能有益作用进行监测。
(4)hsv1-tk载体靶向恒河猴的siv感染。
在本研究中,总共使用了8只印度恒河猴,将它们分为4组(每组2只猴子,a至d组)。每组中使用的动物数量是根据以前在动物研究中的经验得出的(131、133、134)。治疗方案列于表1。
对于d组,将使用我们通常在tnprc中使用的标准协议(131、133、134)将100tcid50的sivmac239感染猴子。如上所述,将用cm-t807处理动物以消耗cd8t细胞。将动物感染6周,然后用art(替诺福韦、emtriva和norvir)治疗6个月。将停止art3天,并向siv感染的猴子静脉注射0.5ml高浓度(109-1010transductionunit/ml)rev依赖性颗粒vsiv-hsv1-tk-rre。注射载体后,将使用cm-t807进一步消耗28天后再生的cd8t细胞(130)。注射载体后,抗病毒治疗将中断两周,然后恢复3个月(表1)。vsiv-hsv1-tk-rre感染和载体在体内传播需要在慢病毒载体注射之前进行计划的art中断。媒介物动员也需要cd8耗竭和媒介物注射后两周的art中断,以使媒介物动员在7至10天内最大化(105)。art的恢复将抑制不受控制的siv传播。
为了进行比较,在c组中,将与d组中的动物相同地感染,治疗并随后注射vsiv-hsv1-tk-rre载体,但是在注射载体后,将不会恢复art。这将允许更高程度的载体扩增和具有主动siv复制的动员。注射载体后3个月内将密切监测d和c组的动物。载体注射后3个月,更昔洛韦将以10mg/kg/天的剂量静脉内给药,以诱导siv+细胞的死亡和衰变。更昔洛韦血浆水平将通过每天静脉内维持。注射两个星期。服用更昔洛韦后,将终止所有治疗,并继续监测病毒反弹持续12个月。
对于其他对照,b组将同样感染siv并接受art治疗,但不会注射依赖rev的颗粒vsiv-hsv1-tk-rre。b组的抗病毒治疗将在6个月末终止,以使病毒反弹。
a组中的猴子将感染sivmac239,但不会受到任何干预。
预计a和b组的动物会在4-5个月内不使用抗病毒药物治疗aids(130),而c和d组的动物可能会受到病毒反弹的明显抑制或延迟。这些动物也可能没有艾滋病,并减少了脑病毒负荷和siv损伤。
表1.siv和vsiv-hsv1-tk-rre注射和治疗方案
(5)监测hsv1-tk载体的治疗效果
vsiv-hsv1-tk-rre载体的治疗功效可通过监测其能力来评估:
(a)完全抑制或显着降低停药后血浆病毒反弹。
(b)减少外周血中的siv+细胞,包括cd4t细胞和单核细胞。
(c)大大减少脑脊液(csf)病毒载量。
(d)显着减少大脑中的siv+巨噬细胞/小胶质细胞。
(e)显着减少淋巴组织和肠道中的siv+细胞。
(f)显着减少大脑中的siv病变。
表2.用于功效评估的测定总结
终止抗病毒治疗后,hsv1-tk载体介导的血浆病毒反弹减少:在病毒感染后两周开始对所有组中的注射猴子进行采血(每抽20ml外周血),并将每月进行一次,直至研究结束。血浆sivrna将使用标准协议进行测量,该协议可以检测低至50拷贝的rna/ml(135,136)。简而言之,将使用qiagen病毒rna试剂盒从500微升无细胞血浆中制备病毒rna,然后使用mmlv-rt反转录。如前所述(134,136),将进一步使用sivdna标准液对病毒cdna进行pcr扩增和定量。
(b)hsv1-tk载体介导的外周血siv+细胞减少:先前的研究表明,外周血中的血液记忆cd4t细胞和单核细胞都可能带有转录活性hiv(28、137、138)。为了测量外周血中活性病毒库的减少,每2个月抽取pbmc(50ml),并将其纯化并基于cd14、cd163和cd68的流式细胞仪对单核细胞/巨噬细胞谱系的细胞进行分选。还可以鉴定cd4t细胞,并与cd3、cd4、cd28和cd95进行分类,以确保其幼稚、以及中央记忆(cd28+cd95+)和效应记忆(cd28-cd95+)(139,140)。分选的细胞也将被直接裂解以提取总基因组dna,以进行sivdna的标准实时pcr扩增和sivdna的整合拷贝,如所述(141,142)。作为一种补充方法,也可以通过先前描述的定量限制稀释培养法从pbmc中回收潜伏病毒(24、143)。
(c)hsv1-tk载体介导的脑脊液(csf)病毒载量的减少:研究表明art可以全身性地减少病毒载量,从而降低csf中的病毒载量(35,129)。但是,病毒dna仍然存在,而某些猕猴中枢神经系统的炎症仍在继续(35)。我们期望hsv1-tk载体可以靶向sivdna+细胞,从而导致脑脊液中病毒载量的减少。在最终终止抗逆转录病毒治疗后2个月和即将实施安乐死之前,将从麻醉过的猕猴的小脑髓水箱中获取csf。病毒rna将通过如上所述的标准实时rt-pcr进行测量(135,136)。
(d)hsv1-tk载体介导的大脑siv+巨噬细胞/小胶质细胞减少的研究:在研究结束时,将对安乐死的猴子和对照组动物实施安乐死。脑组织中siv+细胞的减少将通过三种不同的补充方法进行测量:1)流式细胞仪分选和pcr(siv-dna),2)荧光原位杂交(siv-dna/rna),3)免疫组织化学组织染色(sivp24)。siv+细胞的细胞身份也可以通过与标记的抗体共染色来鉴定,包括单核细胞/巨噬细胞谱系(125、130、144-146)的cd14、cd163、cd68和mac387+。为了通过流式细胞仪测量siv+细胞,首先将组织消化(147)。收集悬浮液中的细胞,洗涤,然后用流式细胞仪分选。如上所述,将通过实时pcr针对siv-dna和整合的siv-dna提取基因组dna并对其进行测量。荧光原位杂交也将证实组织细胞中病毒dna的减少(148-150)。对于组织免疫组织化学染色,将小块组织立即在固定缓冲液(pbs中的2%福尔马林,0.04%戊二醛,0.01%np-40)中固定4小时,持续2小时,然后切片并用siv-gag-specific染色抗体55-2f12。染色的组织将被清洗并固定在显微镜下。
(e)hsv1-tk载体介导的淋巴组织和肠道中siv+细胞的减少:除大脑外,尸检时完整的组织采集将包括胸腺、脾脏、多个淋巴结、肠、肺、骨髓、肾脏、和肝脏(131,133,134)。将通过三种方法与上述类似地分析这些组织中siv+细胞的减少。siv+细胞的细胞身份也可以通过与上面列出的标记抗体共染色来鉴定,包括单核细胞/巨噬细胞谱系细胞的cd14、cd163、cd68。cd4t细胞的cd3、cd4、cxcr4和ccr5;cd28和cd95用于中枢记忆和效应t细胞亚群;ki67,cd38,hla-da和cd69用于活性细胞。
(f)hsv1-tk载体介导的脑siv损伤的减轻:
组织病理学检查将在脑的四个区域(额叶、皮质、基底膜、海马和脑干)的h&e(苏木精和曙红)染色切片上进行。我们将检查由siv感染引起的炎症或神经病变/损伤的可能减轻。tnprc拥有4名临床病理学家,他们定期分析并提供所收集组织的组织学发现的报告。在研究结束时,将使用我们在杜兰(tulane)常规执行的标准规程(131,133,134)监测并记录疾病发展为aids的可能临床症状。
具体实施方式
以下实施例是说明性而非限制性的。
实施例1:依赖于rev的gfp载体的构建
如图2a所示,通过将hek293t细胞与表达gfp的rev-gfp-rre-sa、辅助构建体pcmvδ8.2(68)和表达vsv-g信封。组装的粒子用于识别hiv(ad8)感染的人类巨噬细胞(mdm)。如图2b所示,在hiv感染后24小时,细胞以低m.o.i(每百万细胞5ngp24)被rev-gfp-rre-sa颗粒超级感染。5天后,将细胞固定并染色以检测细胞内hivp24的存在。仅在hivp24阳性细胞中检测到gfp,而在p24阴性细胞中未检测到gfp,这表明了特异性,并表明单个依赖于rev的gfp病毒颗粒能够检测巨噬细胞中hiv的存在(50)。
依赖rev的载体还可以使用浓缩病毒有效鉴定80-90%的hiv+细胞(52、53)。如图3所示,使用不同剂量的rev-gfp-rre-sa颗粒来超级感染hiv感染的人t细胞cem-ss。即使在使用最高剂量的情况下,也仅在hiv感染的细胞中检测到gfp,而未感染的t细胞中未检测到gfp,这证实了对hiv触发报道基因表达的严格要求。当使用不同剂量的rev-gfp-rre-sa颗粒超感染hiv+t细胞时,我们观察到gfp+细胞呈剂量依赖性增加。拟合这些数据的曲线是矩形双曲线,将其定义为一个可饱和的过程,它预测gfp报告病毒可以将80-90%的hiv感染细胞作为靶标(50)(图3b)。
hiv依赖rev的载体rev-gfp-rre-sa(或pnl-gfp-rre-sa)已保存在nihaids研究和参考试剂计划(目录号11466)中,目前可供研究使用。
实施例2:治疗基因在hiv感染的细胞中的选择性表达
根据以上实施例1中显示的数据,似乎可以在hiv感染的细胞中选择性表达治疗基因。因此,我们将一系列治疗性基因插入载体中(图4)。我们克隆了四种不同类型的治疗基因:炭疽芽孢杆菌中的炭疽溶血素o(alno);和来自白喉棒状杆菌的白喉毒素a链(dt-a);原生的促凋亡人类基因traf6(肿瘤坏死因子受体相关因子6)(69,70);和单纯疱疹1病毒胸苷激酶基因(hsv1-tk)。这些治疗基因通过不同的机制诱导细胞死亡(51-53)。
为了有效地将这些治疗基因传递到hiv阳性细胞中,我们还克服了多个技术障碍,以产生抗毒素细胞系以组装高滴度依赖rev的颗粒。我们已经成功地产生了几种抗毒素的细胞系,例如抗dt-a的5h7细胞(52、53),并用它们来产生足够数量的病毒颗粒。我们还测试了这些组装的rev依赖性颗粒选择性杀死hiv阳性t细胞和巨噬细胞的能力。这些研究的结果已经发表在young等人的文章中。(52)和王等。(53)。依赖rev的alno病毒颗粒可以选择性杀死98%的感染巨噬细胞(将hiv阳性巨噬细胞从12.2%减少至0.27%)(52),表明这些载体可有效减少hiv阳性细胞。我们还构建了非整合型rev依赖性载体,可将traf6作为游离型dna释放,以减轻整合介导的诱变的潜在风险。非整合的traf6颗粒消除了66%的hiv阳性外周血单核细胞。王等人也报道了该结果。(53)。
对于体内递送,为了证明rev依赖型载体的安全性,我们用高浓度的rev-an101-rre-sa相同地感染了健康的巨噬细胞(无hiv)两周,但未检测到非特异性杀死巨噬细胞。如(52)中所述,rev-an10-rre-sa(在空载体处理的对照中只有1%的凋亡细胞与2%的凋亡细胞),从而证明对未感染细胞的非特异性杀伤作用极小。作为补充证据,我们类似地用rev-an10-rre-sa感染了hiv阴性jurkatt细胞,并观察到载体dna稳定整合了数月,而没有非特异性杀死hiv阴性jurkat细胞。相反,在hiv阳性的j1.1jurkat细胞中,类似的感染导致j.1.1的杀死和anlo-载体dna在6天内的消失(52)。使用依赖rev的traf6载体也获得了相似的结果(53)。当用traf6颗粒对未感染hiv的细胞进行相同处理时,我们观察到细胞培养7天后细胞死亡的增加最小(低于2%)(从traf6中的4.4%背景死细胞变为6.2%死细胞)。这明显低于hiv阳性细胞减少66%的程度。根据这些结果,我们得出结论,依赖rev的traf6颗粒不具有引起健康细胞大规模非特异性杀伤的能力(53)。
实施例3:在猕猴的siv感染中开发rev依赖性载体
为了使用siv/猕猴模型验证载体在体内的功效,我们通过整合rre、多个剪接位点(d1,a6,d3,a7)和loopa将基于hiv的载体转化为基于siv的载体()来自sivmac239基因组。siv还编码rev,并且rev功能在hiv和siv株之间是保守的。已显示sivrev能够诱导不完全剪接的mrna的胞质表达(71),hiv-1和hiv-2的rev蛋白也可以激活siv基因表达(72)。
hsv1-tk基因和人traf6基因(与猴traf6相同)也被克隆到基于siv的载体中(图5)。hsv1-tk的选择基于该系统的几个优点:(1)优越的安全性-该系统已经研究了30多年,并且已经进行了多次临床试验,几乎没有观察到副作用(73,74);(2)能够靶向有丝分裂后细胞-hiv/siv刺激的dna合成和dna修复活性(75,76)可用于hsv1-tk介导的杀伤。使用hsv1-tk杀死终末分化的滑膜衬里细胞的类似方法已应用于兔炎症性关节炎模型(77)。(3)可以组装高滴度的颗粒-在缺乏更昔洛韦(gcv)的情况下缺乏hsv1-tk的细胞毒性已允许生产高滴度的慢病毒颗粒(>1010转导单位)(73,74)促进动物研究。
traf6是一种本地人类基因,仅在过度表达时才诱导凋亡(69、70)。此外,本发明人的初步研究表明,traf6的过度表达对hek293t细胞的毒性极小,尽管对其他细胞也具有毒性。使用hek293t细胞装配了高滴度的traf6病毒(53)。
实施例4:体内动物研究
为了进行拟议的动物试验,有必要首先开发大规模生产慢病毒颗粒的方案,然后通过阴离子交换和尺寸排阻色谱柱将其进一步浓缩500到1,000倍(图6)。首先通过静脉内(i.v.)注射评估这些颗粒在小鼠和恒河猴中的毒性。作为一项初步研究,使用乔治梅森大学和杜兰大学批准的iacuc方案将浓缩的sivrev依赖型病毒颗粒注射入5只小鼠和2只恒河猴中,以进行初步安全性评估(将动物圈养在这里)(gmu的小鼠,猴子在杜兰(tulane)。所有动物均表现健康,无明显不良反应。将这两只猕猴安乐死以收集组织进行毒性检查。检查了多个组织,并且在注射的动物和正常对照动物之间没有观察到多个组织的差异。
对于最初的动物研究,猕猴分为4组(a至d组,每组两只动物)(表3和图7)。
表3.siv和vsiv-hsv1-tk-rre注射和治疗方案
对于a组,使用标准感染方案(78、79、80)用100tcid50的sivmac239感染猴子,但未接受任何治疗。
对于b组,动物也同样感染了siv,但接受了art治疗11个月。然后终止抗病毒治疗,使病毒反弹。
对于c组,将动物感染,用art治疗1个月,然后中断0.5-ml浓缩的vsiv-hsv1-tk-rre载体注射2周。注射载体后,art未恢复。这是为了允许载体扩增和动员与主动siv复制。
对于d组,与c组相似地治疗和注射动物,但是在载体注射后恢复art3个月。对于vsiv-hsv1-tk-rre感染和载体在体内的传播,需要在慢病毒载体注射期间进行计划的art中断。这些峰值在7到10天之内(81)。恢复art将抑制不受控制的siv传播。
大约3个月的载体注射后,终止art,更昔洛韦以10mg/kg/天的剂量静脉内给药2周,以诱导c和d组siv+细胞的死亡和衰变。更昔洛韦给药后,所有治疗终止,并监测病毒反弹。
在该实验中,在将c和d组的载体注射之前,还用抗cd8抗体cm-t807瞬时清除了cd8t细胞。cd8耗竭的主要原理是防止携带rev依赖型载体的细胞快速清除。此外,随着cd8的耗竭,该疾病的进展更快,而中枢神经系统疾病的一致性更高(77%的动物)(82-84)。这可以提供更鲁棒的模型系统来评估载体对快速病毒反弹的作用。
实验结果总结在图8中。
正如预期的那样,对于a组中的动物,未经art治疗,感染的动物仍保留了较高的病毒载量。
正如预期的那样,对于b组动物,art治疗可减少病毒负荷,并在art终止后迅速反弹。
对于c组动物,vsiv-hsv1-tk-rre/更昔洛韦的注射未能抑制art终止后的病毒反弹,这表明单独的载体无法与不受控制的siv复制竞争。
但是,对于d组中的动物,vsiv-hsv1-tk-rre/更昔洛韦的施用确实在art终止后阻断了病毒反弹。特别地,用更昔洛韦治疗的两只动物之一,kc50的病毒载量降低至基线。更昔洛韦终止后,kc50中再次发生siv病毒反弹。随后,我们向动物注射了第二种载体vsiv-traf6(r)-rre,这也减少了病毒反弹。首次注射vsiv-traf6(r)-rre之后,四个月后,我们进行了第二次批量注射vsiv-traf6(r)-rre。上一次注射是在2017年8月21日进行的,该注射进一步将病毒载量降低到检测阈值。注射后终止所有治疗。
目前,kc50一直在自我控制病毒反弹,并将病毒载量稳定地维持在无法检测的水平。
对于第二只动物jt43,在d组中,我们观察到了类似的病毒反弹延迟模式,尽管病毒反弹高于kc50。在第二批vsiv-traf6(r)-rre注射之前,jt43于2017年夏天被安乐死。
我们进一步量化了脑脊液(csf)中的病毒载量,发现kc50一直稳定地保持着不可检测的病毒载量。
我们的概念验证动物研究的结果(图8和图9)提供了第一个实验证据,即基于rev的载体具有巨大的潜力,可在体内减少病毒反弹,并最终可以治愈或起作用治愈。
重要的是,考虑到该动物感染了最具致病性的sivmac239,并且其对mamua*01,b*08和masa阴性,因此在外周血和csf中kc50的长期病毒释放是显着且前所未有的。b*17表达式。
实施例5:空的依赖rev的载体可以抑制hiv复制并减少病毒载量和反弹
如以上在实施例4的动物研究数据中所证明的,本发明人意外地发现,依赖rev的载体本身也可以减少病毒载量和反弹,即使没有功能基因的表达。换句话说,空的依赖rev的载体可以抑制hiv复制并减少病毒载量和反弹。在目前的动物试验之前,这既不是未知的也不是预期的。
如上所述,空载体是指rev依赖性载体,其包含ltr和rre但不包含用于靶向siv+细胞的治疗性基因,例如traf6,但仍然可以降低体内病毒反弹。这样做的原因有很多,其中包括:
1)竞争性抑制hiv转录,剪接和核输出:依赖rev的载体同时包含ltr和rre。一旦进入hiv+细胞,rev依赖型载体便可以竞争细胞因子和hivtat与ltr的结合,以及rev与rre的结合。因此,该载体可以抑制hiv转录,剪接和病毒rna核输出。
2)竞争性抑制hiv基因组包装:依赖rev的载体还含有功能性基因组包装信号。一旦进入hiv+细胞,rev依赖的载体便可以竞争参与病毒基因组包装的细胞和病毒蛋白。在依赖rev的载体存在下,感染hiv的细胞将释放有缺陷的病毒颗粒。
3)保护未感染细胞免于感染:rev依赖性载体可被递送到健康的,未感染hiv的细胞中。如果细胞携带依赖rev的载体,则可以使该细胞对hiv感染部分或完全抵抗。
4)抗hiv免疫力的刺激:依赖rev的载体病毒粒子具有与hiv粒子相同的结构。将依赖rev的颗粒注射到体内后,它们将像减毒疫苗颗粒一样刺激抗hiv免疫力。
因此,从实施例4中提供的动物数据中,本申请提供了用于降低受试者中的siv/hiv病毒反弹和灭活病毒库的方法,包括向受试者施用包含表达基因或不表达rev的载体的组合物。基因。该载体可通过竞争性抑制hiv转录和病毒基因组包装来灭活病毒库。
- 还没有人留言评论。精彩留言会获得点赞!