耐碱性提高的Fc结合性蛋白质、该蛋白质的制造方法、使用该蛋白质的抗体吸附剂和使用该抗体吸附剂分离抗体的方法与流程
本发明涉及对免疫球蛋白具有亲和性的fc结合性蛋白质。更详细而言,本发明涉及与天然型相比对碱的稳定性(耐碱性)提高的fc结合性蛋白质、该蛋白质的制造方法、将该蛋白质固定于不溶性载体而得到的抗体吸附剂、和使用该抗体吸附剂分离抗体的方法。另外,本发明涉及一种fc结合性蛋白质,其通过将人fcγriiia中的特定位置的氨基酸残基置换为其它特定的氨基酸残基而提高了利用基因重组体的生产率。
背景技术:
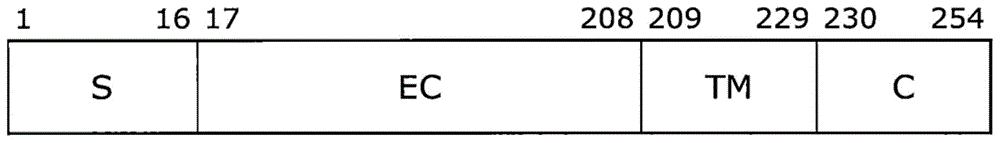
:fc受体为与免疫球蛋白分子的fc区结合的一组分子。各个分子通过fc受体上的识别结构域基于属于免疫球蛋白超家族的识别结构域识别单个或同一组中的免疫球蛋白同种型。由此决定在免疫应答中动员哪种辅助细胞。fc受体可以进一步分为几种亚型,有针对igg(免疫球蛋白g)的受体即fcγ受体、与ige的fc区结合的fcε受体、与iga的fc区结合的fcα受体等。另外,各受体可以进一步进行细分,据报道fcγ受体存在有fcγri、fcγriia、fcγriib和fcγriiia、fcγriiib(非专利文献1)。fcγ受体中的fcγriiia存在于自然杀伤细胞(nk细胞)和巨噬细胞等细胞的表面,是参与在人免疫机制中也较重要的adcc(抗体依赖性细胞毒性)活性的重要受体。关于该fcγriiia与人igg的亲和性,据报道表示结合强度的结合常数(ka)为107m-1以下(非专利文献2)。另外,已知抗体的糖链结构不同则fcγriiia与抗体的结合性也不同(非专利文献3)。在uniprot(登录号:p08637)等公共数据库中,公布了天然型的人fcγriiia的氨基酸序列(序列号1)。另外,也同样地公布了人fcγriiia的结构上的功能结构域、用于跨过细胞膜的信号肽序列、细胞膜贯穿区域的位置。图1示出了人fcγriiia的结构简图。需要说明的是,图1中的编号表示氨基酸编号,该编号对应于序列号1中记载的氨基酸编号。即,序列号1中的第1位的甲硫氨酸(met)至第16位的丙氨酸(ala)为止为信号序列(s),第17位的甘氨酸(gly)至第208位的谷氨酰胺(gln)为止为细胞外区域(ec),第209位的缬氨酸(val)至第229位的缬氨酸(val)为止为细胞膜贯穿区域(tm),以及、第230位的赖氨酸(lys)至第254位的赖氨酸(lys)为止为细胞内区域(c)。需要说明的是,已知fcγriiia对于igg1至igg4为止的人igg亚类、特别是与igg1和igg3强结合,而与igg2和igg4的结合弱。抗体的糖链结构极大地关系着抗体药物的药效和稳定性,因此制造抗体药物时糖链结构的控制极为重要。fcγriiia识别抗体的糖链结构,因此将fcγriiia固定于不溶性载体而得到的吸附剂可以通过基于抗体的糖链结构的结合性差异来分离抗体(专利文献2和3)。因此,上述吸附剂在制造抗体药物时的工序分析、分取中是有用的。但是,在欲使用上述吸附剂进行抗体药物的工业化制造时,由于天然型的fcγriiia不具有耐碱性而难以通过碱洗涤实现上述吸附剂的再利用,因此不适合于上述工业化制造用途。专利文献1公开了一种fc结合性蛋白质,其通过将天然型的fcγriiia的细胞外区域的氨基酸残基中的特定位置的氨基酸残基置换为其它的氨基酸残基,从而提高了耐碱性。但是,即使是专利文献1中公开的fc结合性蛋白质,也难以说耐碱性充分,在用于抗体药物的工业化制造用途时,在制造成本方面存在课题。需要说明的是,人fcγriiia存在基因多态性,即序列号1中的第176位的氨基酸为苯丙氨酸的类型(序列号1的形态)和为缬氨酸的类型(genbank(aah17865.1)所公布的、序列号19的形态),已知缬氨酸的类型的抗体亲和性高、苯丙氨酸的类型的抗体亲和性低(非专利文献4和5)。现有技术文献专利文献专利文献1:日本特开2017-118871号公报专利文献2:日本特开2015-086216号公报专利文献3:日本特开2016-169197号公报非专利文献非专利文献1:takai.t.,jpn.j.clin.immunol.,28,318-326,2005非专利文献2:j.galon等,eur.j.immunol.,27,1928-1932,1997非专利文献3:c.l.chen等,acschem.biol.,12,1335-1345,2017非专利文献4:h.r.koene等,blood,90,1109-1114,1997非专利文献5:p.bruhns等,blood,16,3716-3725,2009技术实现要素:发明要解决的问题本发明的课题包括:提供对碱的稳定性(耐碱性)提高的fc结合性蛋白质、该蛋白质的制造方法、和使用该蛋白质的抗体吸附剂。另外,如上所述,fcγriiia识别抗体的糖链结构,因此将fcγriiia固定于不溶性载体而得到的吸附剂在制造抗体药物时的工序分析、分取中是有用的。但是,在欲使用上述吸附剂进行抗体药物的工业化制造时,以往的fcγriiia的利用基因重组体的生产率差,在成本方面存在课题。因此,根据情况,本发明的至少一个课题包括:提供与以往的fcγriiia相比利用基因重组体的生产率提高的fcγriiia氨基酸置换体。用于解决问题的方案本发明人们为了解决上述课题进行了深入研究,结果确定了人fcγriiia中的与稳定性提高有关的氨基酸残基,并且发现将该氨基酸残基置换为其它的氨基酸残基而成的变异体对碱具有优异的稳定性。另外,本发明人们将序列号1所示的人fcγriiia的氨基酸序列中的第176位的氨基酸残基包罗性地置换为其它的氨基酸残基,结果发现了与以往的fcγriiia相比利用基因重组体的生产率提高的氨基酸置换体。基于这些见解,本发明人们完成了本发明。即,本发明包含以下的[1]至[11]中记载的方式。[1]一种fc结合性蛋白质,其包含下述氨基酸残基且具有抗体结合活性,所述氨基酸残基为:在序列号4记载的氨基酸序列的第33位的甘氨酸至第208位的谷氨酰胺为止的氨基酸残基中至少具有以下所示的35处氨基酸置换的氨基酸残基;(1)序列号4的第37位的谷氨酸向甘氨酸的置换(2)序列号4的第39位的亮氨酸向甲硫氨酸的置换(3)序列号4的第43位的缬氨酸向谷氨酸的置换(4)序列号4的第45位的苯丙氨酸向异亮氨酸的置换(5)序列号4的第49位的谷氨酰胺向脯氨酸的置换(6)序列号4的第51位的酪氨酸向天冬酰胺的置换(7)序列号4的第56位的赖氨酸向谷氨酰胺的置换(8)序列号4的第64位的谷氨酰胺向精氨酸的置换(9)序列号4的第67位的酪氨酸向组氨酸的置换(10)序列号4的第70位的谷氨酸向天冬氨酸的置换(11)序列号4的第72位的天冬酰胺向天冬氨酸的置换(12)序列号4的第81位的丝氨酸向精氨酸的置换(13)序列号4的第84位的丝氨酸向脯氨酸的置换(14)序列号4的第90位的酪氨酸向苯丙氨酸的置换(15)序列号4的第91位的苯丙氨酸向异亮氨酸的置换(16)序列号4的第94位的丙氨酸向丝氨酸的置换(17)序列号4的第96位的苏氨酸向丝氨酸的置换(18)序列号4的第108位的天冬酰胺向丝氨酸的置换(19)序列号4的第133位的缬氨酸向谷氨酸的置换(20)序列号4的第135位的赖氨酸向缬氨酸的置换(21)序列号4的第137位的谷氨酸向甘氨酸的置换(22)序列号4的第138位的天冬氨酸向谷氨酸的置换(23)序列号4的第148位的赖氨酸向精氨酸的置换(24)序列号4的第156位的苏氨酸向甲硫氨酸的置换(25)序列号4的第157位的酪氨酸向苯丙氨酸的置换(26)序列号4的第163位的甘氨酸向缬氨酸的置换(27)序列号4的第174位的酪氨酸向缬氨酸的置换(28)序列号4的第181位的赖氨酸向谷氨酸的置换(29)序列号4的第187位的苯丙氨酸向丝氨酸的置换(30)序列号4的第194位的丝氨酸向精氨酸的置换(31)序列号4的第196位的天冬酰胺向赖氨酸的置换(32)序列号4的第200位的谷氨酸向甘氨酸的置换(33)序列号4的第201位的苏氨酸向丙氨酸的置换(34)序列号4的第203位的天冬酰胺向天冬氨酸的置换(35)序列号4的第206位的异亮氨酸向缬氨酸的置换[2]根据[1]所述的fc结合性蛋白质,其为以下的(a)、(b)或(c):(a)包含在序列号4记载的氨基酸序列的第33位的甘氨酸至第208位的谷氨酰胺为止的氨基酸残基中具有(i)和(ii)的氨基酸残基的fc结合性蛋白质:(i)上述(1)~(35)的氨基酸置换(ii)具有(i)以外的1个或多个氨基酸的置换、缺失、插入或添加中的1种以上;(b)包含上述(1)~(35)的氨基酸置换且具有下述的氨基酸序列的fc结合性蛋白质,所述氨基酸序列与由序列号4记载的氨基酸序列的第33位的甘氨酸至第208位的谷氨酰胺为止的氨基酸残基构成的氨基酸序列具有70%以上的同源性;(c)包含下述的氨基酸序列且具有抗体结合活性的fc结合性蛋白质,所述氨基酸序列为:在相对于序列号4记载的氨基酸序列的第33位的甘氨酸至第208位的谷氨酰胺为止的氨基酸序列具有70%以上的序列同源性的氨基酸序列中具有上述(1)~(35)的氨基酸置换的氨基酸序列。[3]根据[1]或[2]所述的fc结合性蛋白质,其进一步至少具有以下所示的氨基酸置换中的任一种。(36)序列号4的第192位的缬氨酸向异亮氨酸的置换(37)序列号4的第192位的缬氨酸向丙氨酸的置换(38)序列号4的第192位的缬氨酸向酪氨酸的置换[4]根据[1]~[3]中任一项所述的fc结合性蛋白质,其至少包含序列号7、9或11记载的氨基酸序列中的第33位的甘氨酸至第208位的谷氨酰胺为止的氨基酸残基。[5]一种多核苷酸,其编码[1]~[4]中任一项所述的fc结合性蛋白质。[6]一种表达载体,其包含[5]所述的多核苷酸。[7]一种能生产fc结合性蛋白质的转化体,其是用[6]所述的重组载体转化宿主而得到的。[8]根据[7]所述的转化体,其中,宿主为大肠杆菌。[9]一种fc结合性蛋白质的制造方法,其包括:通过培养[7]或[8]所述的转化体而生产fc结合性蛋白质的工序;和、由得到的培养物回收所生产的上述fc结合性蛋白质的工序。[10]一种抗体的吸附剂,其是将[1]至[4]中任一项所述的fc结合性蛋白质固定于不溶性载体而得到的。[11]一种抗体的分离方法,其包括:向填充有[10]所述的吸附剂的柱中添加包含抗体的溶液,使该抗体吸附于上述吸附剂的工序;和、使用洗脱液洗脱吸附于上述吸附剂的抗体的工序。[12]根据[11]所述的分离方法,其中,具有不同的糖链结构的抗体基于与fc结合性蛋白质的结合性的差异而被分离。以下详细说明本发明。本发明的fc结合性蛋白质为对抗体的fc区具有结合性的蛋白质,其至少包含由序列号4记载的氨基酸序列构成的fc结合性蛋白质的氨基酸序列中的、相当于天然型人fcγriiia的细胞外区域(图1的ec区)的第33位的甘氨酸至第208位的谷氨酰胺为止(序列号1中的第17位的甘氨酸至第192位的谷氨酰胺为止)的氨基酸残基,其中,该第33位至第208位的氨基酸残基中至少发生了特定位置处的氨基酸置换。因此,本发明的fc结合性蛋白质可以包含位于细胞外区域的n末端侧的信号肽区域(图1的s)的全部或一部分,也可以包含位于细胞外区域的c末端侧的细胞膜贯穿区域(图1的tm)和细胞内区域(图1的c)的全部或一部分。上述特定位置处的氨基酸置换具体为glu37gly(该表述表示序列号4的第37位的谷氨酸被置换为甘氨酸,以下同样)、leu39met、val43glu、phe45ile、gln49pro、tyr51asn、lys56gln、gln64arg、tyr67his、glu70asp、asn72asp、ser81arg、ser84pro、tyr90phe、phe91ile、ala94ser、thr96ser、asn108ser、val133glu、lys135val、glu137gly、asp138glu、lys148arg、thr156met、tyr157phe、gly163val、tyr174val、lys181glu、phe187ser、ser194arg、asn196lys、glu200gly、thr201ala、asn203asp和ile206val。需要说明的是,本发明的fc结合性蛋白质只要至少具有上述特定位置处的氨基酸置换即可,只要具有抗体结合活性则也可以进一步具有氨基酸残基的置换、缺失、插入和添加中的任一种以上。作为上述方式的具体例,可列举以下的(i)至(v)所示的、具有抗体结合活性的fc结合性蛋白质:(i)包含序列号4记载的氨基酸序列的第33位的甘氨酸至第208位的谷氨酰胺为止的氨基酸残基、其中具有上述特定位置处的氨基酸置换、并且至少进一步具有val192ile、val192ala或val192tyr的氨基酸置换的fc结合性蛋白质;(ii)包含序列号4记载的氨基酸序列的第33位的甘氨酸至第208位的谷氨酰胺为止的氨基酸残基、其中具有上述特定位置处的氨基酸置换、并且进一步具有上述特定位置处的氨基酸置换以外的1个或多个氨基酸残基的置换、缺失、插入和添加中的任一种以上的fc结合性蛋白质;(iii)包含序列号4记载的氨基酸序列的第33位的甘氨酸至第208位的谷氨酰胺为止的氨基酸残基、其中具有上述特定位置处的氨基酸置换、并且进一步具有上述特定位置处的氨基酸置换以外的1个或多个氨基酸残基的置换、缺失、插入和添加中的任一种以上、并且进一步具有val192ile、val192ala或val192tyr的氨基酸置换的fc结合性蛋白质;(iv)具有下述的氨基酸序列且具有上述特定位置处的氨基酸置换的fc结合性蛋白质,所述氨基酸序列为:相对于由序列号4记载的氨基酸序列的第33位的甘氨酸至第208位的谷氨酰胺为止的氨基酸残基构成的氨基酸序列具有70%以上的同源性的氨基酸序列;(v)具有下述的氨基酸序列且具有上述特定位置处的氨基酸置换以及val192ile、val192ala或val192tyr的氨基酸置换的fc结合性蛋白质,所述氨基酸序列为:相对于由序列号4记载的氨基酸序列的第33位的甘氨酸至第208位的谷氨酰胺为止的氨基酸残基构成的氨基酸序列具有70%以上的同源性的氨基酸序列;(vi)在相对于由序列号4记载的氨基酸序列的第33位的甘氨酸至第208位的谷氨酰胺为止的氨基酸残基构成的氨基酸序列具有70%以上的同源性的氨基酸序列中具有上述特定位置处的氨基酸置换的fc结合性蛋白质;(vii)在相对于由序列号4记载的氨基酸序列的第33位的甘氨酸至第208位的谷氨酰胺为止的氨基酸残基构成的氨基酸序列具有70%以上的同源性的氨基酸序列中具有上述特定位置处的氨基酸置换以及val192ile、val192ala或val192tyr的氨基酸置换的fc结合性蛋白质。上述(i)、(iii)、(v)和(vii)中记载的val192ile、val192ala或val192tyr的氨基酸置换为提高利用基因重组体的生产率的氨基酸置换。因此,通过使至少具有上述特定位置处的氨基酸置换的本发明的fc结合性蛋白质进一步具有上述氨基酸置换,可得到与天然型fcγriiia相比耐碱性提高、且利用基因重组体的生产率也提高的fc结合性蛋白质。在本说明书中,“1个或多个氨基酸残基的置换、缺失、插入或添加”、以及“氨基酸残基的置换、缺失、插入和添加中的任一种以上”也根据氨基酸残基在蛋白质的立体结构中的位置、以及氨基酸残基的种类而不同,例如可以为1至50个氨基酸残基的置换、缺失、插入或添加,优选为1至40个、更优选为1至30个、进一步优选为1至20个(1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个或20个)、特别优选为1至10个(1个、2个、3个、4个、5个、6个、7个、8个、9个或10个)氨基酸残基的置换、缺失、插入或添加。另外,本说明书中的“置换”、“缺失”、“插入”和“添加”也包含基于基因所来源的微生物的个体差异、种属差异等的也可天然产生的变异(mutant或variant)。例如,对于人fcγriiia而言,已知具有leu82his、leu82arg、gly163asp、tyr174his中的任一种以上的氨基酸置换的氨基酸置换体,本发明的fc结合性蛋白质可以进一步包含这些氨基酸置换。上述(iv)和(v)中的氨基酸序列的同源性可以为70%以上、71%以上、72%以上、73%以上、74%以上、75%以上、76%以上、77%以上、78%以上、79%以上或80%以上。上述(vi)和(vii)中的氨基酸序列的同源性可以为70%以上、71%以上、72%以上、73%以上、74%以上、75%以上、76%以上、77%以上、78%以上或79%以上,可以优选为80%以上、81%以上、82%以上、83%以上或84%以上,可以更优选为85%以上、86%以上、87%以上、88%以上或89%以上,可以进一步优选为90%以上、91%以上、92%以上、93%以上、94%以上、95%以上、96%以上、97%以上、98%以上或99%以上。在本说明书中,氨基酸序列的“同源性”与氨基酸序列的“同一性”含义相同。在此,氨基酸序列的“同一性(同源性)”是指:按照使欲比较的2个氨基酸序列的氨基酸残基尽量多地一致的方式排列两个氨基酸序列,将一致的氨基酸残基数除以总氨基酸残基数而得的值用百分率表示的数值。在进行上述排列时,根据需要在进行比较的2个序列中的一者或两者中适宜地插入空位。对这种序列的排列方法没有特别限定,可以使用例如blast、fasta、clustalw等已知的序列比较程序来进行。在插入空位的情况下,上述总氨基酸残基数为将1个空位计作1个氨基酸残基而数出的残基数。在进行比较的2个序列之间如此数出的总氨基酸残基数不同的情况下,将一致的氨基酸残基数除以长序列的总氨基酸残基数,来算出序列同一性(%)。本发明的fc结合性蛋白质可以进一步具有保守性置换,所述保守性置换是指:在两氨基酸的物理性质和化学性质、或其中一种性质类似的氨基酸之间进行置换。本领域技术人员已知:在保守性置换的情况下,不仅是fc结合性蛋白质,通常在发生了置换的蛋白与未发生置换的蛋白之间,蛋白质的功能是得到维持的。作为保守性置换的一例,可列举甘氨酸与丙氨酸之间、天冬氨酸与谷氨酸之间、丝氨酸与脯氨酸之间、或谷氨酸与丙氨酸之间所发生的置换(蛋白质的结构与功能,medicalsciencesinternational公司,9,2005)。另外,在本发明的fc结合性蛋白质的n末端侧或c末端侧,可以进一步添加从存在杂质的溶液中分离目标抗体时有用的寡肽。作为上述寡肽,可列举聚组氨酸、聚赖氨酸、聚精氨酸、聚谷氨酸、聚天冬氨酸等。另外,可以在本发明的fc结合性蛋白质的n末端侧或c末端侧进一步添加将本发明的fc结合性蛋白质固定于色谱用支持体等固相时有用的包含半胱氨酸的寡肽。添加于fc结合性蛋白质的n末端侧或c末端侧的寡肽的长度没有特别限制。将上述寡肽添加于本发明的fc结合性蛋白质时,可以制作编码上述寡肽的多核苷酸、之后用本领域技术人员已知的方法通过基因工程手段添加到fc结合性蛋白质的n末端侧或c末端侧,也可以将化学合成的上述寡肽通过化学手段键合添加于本发明的fc结合性蛋白质的n末端侧或c末端侧。另外,还可以在本发明的fc结合性蛋白质的n末端侧添加用于促进在宿主中的高效表达的信号肽。作为宿主为大肠杆菌时的上述信号肽的例子,可例示pelb、dsba、male(uniprotno.p0aex9中记载的氨基酸序列中的第1位至第26位为止的区域)、tort等使蛋白质分泌至周质空间中的信号肽(日本特开2011-097898号公报)。作为本发明的fc结合性蛋白质的优选形态,可列举包含由以下的(a)、(b)或(c)所示的氨基酸序列构成的多肽的fc结合性蛋白质。这些fc结合性蛋白质在对碱的稳定性(耐碱性)提高方面是优选的。(a)fcr35d(序列号7记载的氨基酸序列中的第33位至第208位为止的氨基酸残基)其为下述多肽:是序列号4记载的氨基酸序列中的第33位的甘氨酸至第208位的谷氨酰胺为止的氨基酸残基,其中在该第33位至第208位为止的氨基酸残基中具有glu37gly、leu39met、val43glu、phe45ile、gln49pro、tyr51asn、lys56gln、gln64arg、tyr67his、glu70asp、asn72asp、ser81arg、ser84pro、tyr90phe、phe91ile、ala94ser、thr96ser、asn108ser、val133glu、lys135val、glu137gly、asp138glu、lys148arg、thr156met、tyr157phe、gly163val、tyr174val、lys181glu、phe187ser、ser194arg、asn196lys、glu200gly、thr201ala、asn203asp和ile206val的氨基酸置换。(b)fcr36i(序列号9记载的氨基酸序列中的第33位至第208位为止的氨基酸残基)其为下述多肽:是序列号4记载的氨基酸序列中的第33位的甘氨酸至第208位的谷氨酰胺的氨基酸残基,其中在该第33位至第208位的氨基酸残基中具有glu37gly、leu39met、val43glu、phe45ile、gln49pro、tyr51asn、lys56gln、gln64arg、tyr67his、glu70asp、asn72asp、ser81arg、ser84pro、tyr90phe、phe91ile、ala94ser、thr96ser、asn108ser、val133glu、lys135val、glu137gly、asp138glu、lys148arg、thr156met、tyr157phe、gly163val、tyr174val、lys181glu、phe187ser、val192ile、ser194arg、asn196lys、glu200gly、thr201ala、asn203asp和ile206val的氨基酸置换。(c)fcr36a(序列号11记载的氨基酸序列中的第33位至第208位为止的氨基酸残基)其为下述多肽:是序列号4记载的氨基酸序列中的第33位的甘氨酸至第208位的谷氨酰胺为止的氨基酸残基,其中在该第33位至第208位为止的氨基酸残基中具有glu37gly、leu39met、val43glu、phe45ile、gln49pro、tyr51asn、lys56gln、gln64arg、tyr67his、glu70asp、asn72asp、ser81arg、ser84pro、tyr90phe、phe91ile、ala94ser、thr96ser、asn108ser、val133glu、lys135val、glu137gly、asp138glu、lys148arg、thr156met、tyr157phe、gly163val、tyr174val、lys181glu、phe187ser、val192ala、ser194arg、asn196lys、glu200gly、thr201ala、asn203asp和ile206val的氨基酸置换。需要说明的是,在序列号7、9和11记载的fc结合蛋白中,第1位的甲硫氨酸至第26位的丙氨酸为止为male信号肽,第27位的赖氨酸至第32位的甲硫氨酸为止为连接子序列,第33位的甘氨酸至第208位的谷氨酰胺为止为能够与抗体的fc区结合的多肽(fcr35d(序列号7)、fcr36i(序列号9)或fcr36a(序列号11))的氨基酸序列,第209位至第210位的甘氨酸为止为连接子序列,第211位至第216位的组氨酸为标签序列。作为编码本发明的fc结合性蛋白质的多核苷酸(以下也简单表述为本发明的多核苷酸)的制作方法的一例,可例示:(i)由本发明的fc结合性蛋白质的氨基酸序列转换成核苷酸序列,人工合成包含该核苷酸序列的多核苷酸的方法;和(ii)直接人工制备或使用pcr法之类的dna扩增方法由fc结合性蛋白质的cdna等制备编码fc结合性蛋白质的整体或部分序列的多核苷酸,将制备的该多核苷酸用适当的方法连结的方法。在上述(i)的方法中,优选在由氨基酸序列转换成核苷酸序列时考虑所转化的宿主中的密码子使用频率而进行转换。作为一例,在宿主为大肠杆菌(escherichiacoli)时,在精氨酸(arg)的情况下,aga/agg/cgg/cga的使用频率低;在异亮氨酸(ile)的情况下,ata的使用频率低;在亮氨酸(leu)的情况下,cta的使用频率低;在甘氨酸(gly)的情况下,gga的使用频率低;在脯氨酸(pro)的情况下,ccc的使用频率低(为所谓的稀有密码子),因此按照避开这些密码子的方式进行转换即可。也可以利用公共数据库(例如,上总dna研究所的主页中的codonusagedatabase等)来分析密码子的使用频率。在向本发明的多核苷酸导入变异的情况下,可以使用易错pcr法。关于易错pcr法的反应条件,只要为可以向编码fc结合性蛋白质的多核苷酸中导入所期望的变异的条件就没有特别限定,例如,使作为底物的4种脱氧核苷酸(datp/dttp/dctp/dgtp)的浓度不均匀,将mncl2以0.01至10mm(优选为0.1至1mm)的浓度添加到pcr反应液中进行pcr,由此可以向多核苷酸中导入变异。另外,作为易错pcr法以外的变异导入方法,可列举使作为诱变剂的化学试剂接触、作用于包含fc结合性蛋白质的整体或部分序列的多核苷酸或照射紫外线而向多核苷酸中导入变异来进行制作的方法。在该方法中,作为用作诱变剂的化学试剂,可使用本领域技术人员通常使用的诱变性化学试剂,如羟胺、n-甲基-n'-硝基-n-亚硝基胍、亚硝酸、亚硫酸、肼等。表达本发明的fc结合性蛋白质质的宿主没有特别限制。作为一例,可列举动物细胞(cho(chinesehamsterovary,中华仓鼠卵巢)细胞、hek细胞、hela细胞、cos细胞等)、酵母(酿酒酵母(saccharomycescerevisiae)、巴斯德毕赤氏酵母(pichiapastoris)、多形汉逊酵母(hansenulapolymorpha)、日本裂殖酵母(schizosaccharomycesjaponicus)、八孢裂殖酵母(schizosaccharomycesoctosporus)、粟酒裂殖酵母(schizosaccharomycespombe)等)、昆虫细胞(sf9、sf21等)、大肠杆菌(jm109株、bl21(de3)株、w3110,等)和枯草芽胞杆菌。需要说明的是,从生产率角度出发优选使用动物细胞、大肠杆菌作为宿主,进一步优选使用大肠杆菌作为宿主。使用本发明的多核苷酸来转化宿主的情况下,可以使用本发明的多核苷酸本身,更优选使用在表达载体(例如,在原核细胞、真核细胞的转化中通常使用的噬菌体、黏粒、质粒等)的适当的位置插入有本发明的多核苷酸的表达载体。需要说明的是,该表达载体只要能够在所转化的宿主内稳定地存在并复制则没有特别限制,以大肠杆菌为宿主的情况下,可例示:pet质粒载体、puc质粒载体、ptrc质粒载体、pcdf质粒载体、pbbr质粒载体。另外,上述适当的位置是指不破坏表达载体的复制功能、所希望的抗生素标记、转导性相关区域的位置。向上述表达载体中插入本发明的多核苷酸时,优选以与表达所需要的启动子之类的功能性多核苷酸连结的状态插入。作为该启动子的例子,在宿主为大肠杆菌的情况下,可列举trp启动子、tac启动子、trc启动子、lac启动子、t7启动子、reca启动子、lpp启动子、进而λ噬菌体的λpl启动子、λpr启动子;宿主为动物细胞的情况下,可列举sv40启动子、cmv启动子、cag启动子。为了使用通过上述方法制备的插入了本发明的多核苷酸的表达载体(以下记作本发明的表达载体)来转化宿主,可以用本领域技术人员通常使用的方法进行。例如,作为宿主选择属于埃希氏杆菌(escherichia)属的微生物(大肠杆菌jm109株、大肠杆菌bl21(de3)株、大肠杆菌w3110株等)的情况下,可以通过公知的文献(例如molecularcloning,coldspringharborlaboratory,256,1992)中记载的方法等进行转化。需要说明的是,宿主为动物细胞的情况下,可以使用电穿孔、脂质体转染。对于用上述的方法转化而得到的转化体,通过用适当的方法筛选,可得到能够表达本发明的fc结合性蛋白质的转化体(以下记作本发明的转化体)。关于由本发明的转化体制备本发明的表达载体,可以通过适合于转化中所使用的宿主的方法从本发明的转化体中提取本发明的表达载体,从而制备。例如,本发明的转化体的宿主为大肠杆菌的情况下,可以从培养转化体而得到的培养物中使用碱提取法或qiaprepspinminiprepkit(qiagen制)等市售的提取试剂盒进行制备。对本发明的转化体进行培养,由得到的培养物回收本发明的fc结合性蛋白质,由此可以制造本发明的fc结合性蛋白质。需要说明的是,本说明书中,培养物除了指所培养的本发明的转化体的细胞本身以外,也包括培养中所使用的培养基。本发明的蛋白质制造方法中所使用的转化体只要用适合于培养对象宿主的培养基进行培养即可,宿主为大肠杆菌的情况下,作为优选的培养基的一例,可列举添加了必要的营养源的lb(luria-bertani)培养基。需要说明的是,为了通过有无导入本发明的表达载体来选择性地增殖本发明的转化体,优选向培养基中添加对应于该载体所包含的抗药性基因的药剂而进行培养。例如,该载体包含卡那霉素抗性基因的情况下,可以向培养基中添加卡那霉素。另外,培养基中除了碳、氮和无机盐供给源之外,也可以添加适当的营养源,也可以根据期望含有选自由谷胱甘肽、半胱氨酸、胱胺、巯基乙酸盐和二硫苏糖醇组成的组的一种以上还原剂。进而,也可以添加甘氨酸之类的促进由上述转化体向培养液分泌蛋白质的试剂;具体而言,宿主为大肠杆菌的情况下,优选对培养基添加2%(w/v)以下的甘氨酸。宿主为大肠杆菌的情况下,培养温度通常为10℃至40℃、优选为20℃至37℃、更优选为25℃左右,根据所表达的蛋白质的特性进行选择即可。宿主为大肠杆菌的情况下,培养基的ph为ph6.8至ph7.4,优选为ph7.0左右。另外,本发明的载体中含有诱导性的启动子的情况下,优选在本发明的fc结合性蛋白质能够良好表达的条件下实施诱导。作为诱导剂,可例示出iptg(isopropyl-β-d-thiogalactopyranoside,异丙基-β-d-硫代半乳糖苷)。宿主为大肠杆菌的情况下,测定培养液的浊度(600nm处的吸光度),在达到约0.5至1.0时添加适当量的iptg,之后继续进行培养,由此能够诱导fc结合性蛋白质的表达。iptg的添加浓度可以从0.005至1.0mm的范围适宜选择,优选为0.01至0.5mm的范围。关于与iptg诱导相关的各种条件,按照该
技术领域:
中已知的条件进行即可。为了从培养本发明的转化体而得到的培养物中回收本发明的fc结合性蛋白质,可以采用适合于本发明的转化体中的本发明的fc结合性蛋白质的表达形态的方法,从该培养物中进行分离/纯化,从而回收本发明的fc结合性蛋白质。例如,在培养上清中表达的情况下,通过离心分离操作分离菌体,从得到的培养上清中纯化本发明的fc结合性蛋白质即可。另外,在细胞内(包括周质)表达的情况下,通过离心分离操作收集菌体之后,添加酶处理剂、表面活性剂等或使用超声波、弗氏压碎器等将菌体破碎而提取本发明的fc结合性蛋白质,之后进行纯化即可。为了对本发明的fc结合性蛋白质进行纯化,使用该
技术领域:
中公知的方法即可,作为一例,可列举使用了液相色谱法的分离/纯化。液相色谱法中有离子交换色谱法、疏水性相互作用色谱法、凝胶过滤色谱法、亲和色谱法等,通过组合这些色谱法进行纯化操作,从而可以高纯度地制备本发明的fc结合性蛋白质。作为测定所得到的本发明的fc结合性蛋白质对igg的结合活性的方法,可以使用例如酶联免疫吸附测定法(enzyme-linkedimmunosorbentassay,以下记作elisa)法、表面等离子共振法等测定对于igg的结合活性。在使用人fc结合性蛋白质的修饰型的情况下,结合活性的测定中使用的igg优选为人igg,特别优选为人igg1、人igg3。通过使本发明的fc结合性蛋白质与不溶性载体结合,由此可以制造本发明的吸附剂。上述不溶性载体没有特别限定,可例示出:以琼脂糖、海藻酸盐(alginate)、角叉菜胶、几丁质、纤维素、糊精、葡聚糖、淀粉之类的多糖为原料的载体;以聚乙烯醇、聚甲基丙烯酸酯、聚(甲基丙烯酸2-羟乙基酯)、聚氨酯之类的合成高分子为原料的载体;以二氧化硅等陶瓷为原料的载体。其中,优选以多糖为原料的载体、以合成高分子为原料的载体作为不溶性载体。作为上述优选的载体的一例,可列举:toyopearl(东曹制)等导入了羟基的聚甲基丙烯酸酯凝胶、sepharose(gehealthcare制)等琼脂糖凝胶、cellufine(jnc制)等纤维素凝胶。关于不溶性载体的形状,没有特别限定,可以是粒状物或非粒状物、多孔性或非多孔性中的任一者。为了将fc结合性蛋白质固定于不溶性载体,对不溶性载体赋予n-羟基琥珀酰亚胺(nhs)活化酯基、环氧基、羧基、马来酰亚胺基、卤代乙酰基、三氟代乙烷磺酰基(tresyl)、甲酰基、卤代乙酰胺等活性基团,通过该活性基团使人fc结合性蛋白质与不溶性载体共价结合而进行固定即可。关于赋予了活性基团的载体,可以直接使用市售的载体;也可以在适当的反应条件下向载体表面导入活性基团而制备。作为赋予了活性基团的市售的载体,可例示出:toyopearlaf-epoxy-650m、toyopearlaf-tresyl-650m(均为东曹制)、hitrapnhs-activatedhpcolumns、nhs-activatedsepharose4fastflow、epoxy-activatedsepharose6b(均为gehealthcare制)、sulfolinkcouplingresin(thermoscientific制)。另一方面,作为向载体表面导入活性基团的方法,可例示出:使存在于载体表面的羟基、环氧基、羧基、氨基等与具有2个以上活性位点的化合物中的一个活性位点反应的方法。作为该化合物的一例中的、对载体表面的羟基、氨基导入环氧基的化合物,可例示出:环氧氯丙烷、乙二醇二缩水甘油醚、丁二醇缩水甘油醚、己二醇二缩水甘油醚。作为在用上述化合物对载体表面导入环氧基之后向载体表面导入羧基的化合物,可例示出:2-巯基乙酸、3-巯基丙酸、4-巯基丁酸、6-巯基丁酸、甘氨酸、3-氨基丙酸、4-氨基丁酸、6-氨基己酸。作为向存在于载体表面的羟基、环氧基、羧基、氨基导入马来酰亚胺基的化合物,可例示出:n-(ε-马来酰亚胺己酸)酰肼、n-(ε-马来酰亚胺丙酸)酰肼、4-[4-n-马来酰亚胺苯基]乙酰肼、2-氨基马来酰亚胺、3-氨基马来酰亚胺、4-氨基马来酰亚胺、6-氨基马来酰亚胺、1-(4-氨基苯基)马来酰亚胺、1-(3-氨基苯基)马来酰亚胺、4-(马来酰亚胺)苯基异氰酸酯、2-马来酰亚胺乙酸、3-马来酰亚胺丙酸、4-马来酰亚胺丁酸、6-马来酰亚胺己酸、(n-[α―马来酰亚胺乙酰氧基]琥珀酰亚胺酯)、(马来酰亚胺间苯甲酰)n-羟基琥珀酰亚胺酯、(琥珀酰亚胺基-4-[马来酰亚胺甲基]环己烷-1-羰基-[6-氨基己酸])、(琥珀酰亚胺基-4-[马来酰亚胺甲基]环己烷-1-羧酸)、(马来酰亚胺对苯甲酰)n-羟基琥珀酰亚胺酯、(马来酰亚胺间苯甲酰)n-羟基琥珀酰亚胺酯。作为向存在于载体表面的羟基、氨基导入卤代乙酰基的化合物,可例示出:氯代乙酸、溴代乙酸、碘代乙酸、氯代乙酰氯、溴代乙酰氯、溴代乙酰溴、氯代乙酸酐、溴代乙酸酐、碘代乙酸酐、2-(碘代乙酰胺)乙酸-n-羟基琥珀酰亚胺酯、3-(溴代乙酰胺)丙酸-n-羟基琥珀酰亚胺酯、4-(碘代乙酰基)氨基苯甲酸-n-羟基琥珀酰亚胺酯。需要说明的是,还可例示出使存在于载体表面的羟基、氨基与ω-烯基烷基缩水甘油醚反应之后,用卤化剂将ω-烯基部位卤化而进行活化的方法。作为ω-烯基烷基缩水甘油醚,可例示出烯丙基缩水甘油醚、3-丁烯基缩水甘油醚、4-戊烯基缩水甘油醚;作为卤化剂,可例示出n-氯代琥珀酰亚胺、n-溴代琥珀酰亚胺、n-碘代琥珀酰亚胺。作为向载体表面导入活性基团的方法的其它例子,有如下方法:对存在于载体表面的羧基使用缩合剂和添加剂而导入活化基团的方法。作为缩合剂,可例示出1-乙基-3-(3-二甲基氨基丙基)碳二酰亚胺(edc)、二环己基碳二酰亚胺、羰基二咪唑。另外,作为添加剂,可例示出n-羟基琥珀酰亚胺(nhs)、4-硝基苯酚、1-羟基苯并三唑。作为将本发明的fc结合性蛋白质固定于不溶性载体时使用的缓冲液,可列举:乙酸缓冲液、磷酸缓冲液、mes(2-吗啉乙磺酸)缓冲液、hepes(4-(2-羟基乙基)-1-哌嗪乙烷磺酸)缓冲液、tris缓冲液、硼酸缓冲液。关于固定时的反应温度,在考虑到活性基团的反应性、本发明的fc结合性蛋白质的稳定性的基础上在5℃至50℃的温度范围内适当设定即可,优选为10℃至35℃的范围。为了使用将本发明的fc结合性蛋白质固定于不溶性载体而得到的本发明的吸附剂分离抗体,可以通过使用泵等送液手段向填充有本发明的吸附剂的柱中添加包含抗体的缓冲液,从而使抗体特异性地吸附于本发明的吸附剂,之后向柱中添加适当的洗脱液而洗脱抗体。需要说明的是,若在向柱中添加包含抗体的缓冲液之前使用适当的缓冲液对柱进行平衡,则可以以更高纯度分离抗体,因此是优选的。作为缓冲液,可列举磷酸缓冲液等以无机盐为成分的缓冲液。需要说明的是,缓冲液的ph为ph3~10,优选为ph4~8。为了将吸附于本发明的吸附剂的抗体洗脱,弱化抗体与配体(本发明的fc结合性蛋白质)的相互作用即可,具体而言,可例示出由缓冲液带来的ph变化、抗衡肽(counterpeptide)、温度变化、盐浓度变化。作为用于洗脱吸附于本发明的吸附剂的抗体的洗脱液的具体例,可列举:比使抗体吸附于本发明的吸附剂时使用的溶液靠近酸性侧的缓冲液。作为缓冲液的种类,可例示出在酸性侧具有缓冲能力的柠檬酸缓冲液、甘氨酸盐酸缓冲液、乙酸缓冲液。缓冲液的ph在不破坏抗体所具有的功能的范围内设定即可,优选为ph2.5至6.0,更优选为ph3.0至5.0,进一步优选为ph3.0至4.0。在通过改变盐浓度来洗脱抗体的情况下,可以以一阶段用含高浓度的盐的缓冲液(洗脱液)进行洗脱,也可以任选阶段性地升高盐浓度(阶梯梯度),还可以按照线性浓度梯度升高盐浓度(线性梯度),优选按照线性梯度进行洗脱。例如,在使用氯化钠作为水溶性的盐的情况下,可以通过氯化钠浓度为0m至1m的线性梯度进行洗脱。另外,在通过改变ph来洗脱抗体的情况下,可以用ph低于平衡缓冲液的酸性缓冲液(洗脱液)以一阶段进行洗脱,也可以任选阶梯性地降低缓冲液的ph(阶梯梯度),还可以按照线性浓度梯度降低缓冲液的ph(线性梯度),优选按照线性梯度进行洗脱。例如,可以按照线性梯度从吸附抗体的中性至弱酸性的缓冲液向着洗脱抗体的酸性的缓冲液进行洗脱。通过分取用上述方法洗脱的含抗体的级分,可以得到该抗体。利用常规方法进行分取即可。具体可列举例如:每隔一定时间或每隔一定体积更换回收容器的方法;根据洗脱液的色谱图的形状更换回收容器的方法;以及利用自动级分收集器等进行级分的分取。需要说明的是,在使用本发明的吸附剂从含抗体的溶液中分离上述抗体时,本发明的fc结合性蛋白质识别键合于抗体的糖链结构的差异并根据上述抗体所具有的糖链结构的差异而依次洗脱抗体,优选使用作为其结果的、抗体的洗脱位置(洗脱级分)不同的洗脱液。因此,通过使用本发明的吸附剂分离抗体,可以识别抗体所具有的糖链结构的差异。可识别的糖链结构没有特别限定,作为一例,可列举:在以cho细胞之类的动物源细胞、毕赤酵母或酵母菌属酵母之类的酵母为宿主表达抗体时所添加的糖链;人抗体所具有的糖链;通过化学合成法添加在抗体上的糖链。另外,本发明的吸附剂可以基于抗体所具有的糖链结构的差异来分离抗体。发明的效果本发明的fc结合性蛋白质与天然型的fc结合性蛋白质相比,对碱具有优异的稳定性(耐碱性)。通过将本发明的fc结合性蛋白质作为抗体吸附剂中的亲和配体使用,可得到对碱洗涤的稳定性(耐性)高的吸附剂。因此,可以有助于降低抗体药物的工业化制造的成本。另外,就本发明的fc结合性蛋白质而言,通过将特定位置的氨基酸残基置换为其它的特定的氨基酸残基,从而可以提高利用基因重组体的生产率。附图说明图1为人fcγriiia的概要图。图中的数字表示序列号1记载的氨基酸序列的编号。图中的s表示信号序列,ec表示细胞外区域,tm表示细胞膜贯穿区域,c表示细胞内区域。图2为利用fcr36i固定凝胶分离单克隆抗体(利妥昔单抗)时的色谱图。使用20mm乙酸缓冲液(ph4.8)和10mm甘氨酸盐酸缓冲液(ph3.0)以10mm甘氨酸盐酸缓冲液(ph3.0)从0%至100%的方式进行线性梯度洗脱,从而洗脱利妥昔单抗。图3示出测定使用fcr36i固定凝胶通过线性梯度洗脱分取的单克隆抗体(利妥昔单抗)的adcc活性的结果。图4示出分析使用fcr36i固定凝胶通过线性梯度洗脱分取的单克隆抗体(利妥昔单抗)的糖链结构的结果。图5为利用fcr36i固定凝胶分离单克隆抗体(利妥昔单抗)时的色谱图。通过利用20mm乙酸缓冲液(ph5.2)、20mm乙酸缓冲液(ph4.8)和10mm甘氨酸盐酸缓冲液(ph3.0)进行阶梯梯度洗脱,从而洗脱利妥昔单抗。图6示出分析使用fcr36i固定凝胶通过阶梯梯度洗脱分取的单克隆抗体(利妥昔单抗)的糖链结构的结果。图7为利用fcr36i固定凝胶分离单克隆抗体(贝伐单抗)时的色谱图。通过利用20mm乙酸缓冲液(ph5.2)、20mm乙酸缓冲液(ph4.8)和10mm甘氨酸盐酸缓冲液(ph3.0)进行阶梯梯度洗脱,从而洗脱贝伐单抗。具体实施方式实施例以下使用实施例进一步详细说明本发明,但是本发明不受这些例子限定。实施例1向fc结合性蛋白质导入变异和文库的制作对于按照日本特开2017-118871号公报记载的方法制作的、编码包含fcr35c的fc结合性蛋白质(序列号5)的多核苷酸,利用易错pcr实施随机变异导入。需要说明的是,fcr35c(序列号5记载的氨基酸序列中的第33位至第208位为止的氨基酸残基)为如下多肽:其为相当于天然型人fcγriiia的细胞外区域(图1的ec区域)的、序列号4的第33位的甘氨酸至第208位的谷氨酰胺为止(序列号1中第17位的甘氨酸至第192位的谷氨酰胺为止)的氨基酸残基,其中,在该第33位至第208位为止的氨基酸残基中具有glu37gly(该表述表示序列号4的第37位的谷氨酸被置换为甘氨酸,以下同样)、leu39met、val43glu、phe45ile、gln49pro、tyr51asn、lys56gln、gln64arg、tyr67his、glu70asp、asn72asp、ser84pro、tyr90phe、phe91ile、ala94ser、thr96ser、asp98glu、asn108ser、asp114glu、gln117leu、val133glu、lys135val、glu137gly、asp138glu、lys148arg、thr156met、tyr157phe、gly163val、tyr174val、lys181glu、phe187ser、ser194arg、thr201ala、asn203glu、ile206val和gln208pro的氨基酸置换。(1)使用按照日本特开2017-118871号公报记载的方法制作的表达载体pet-fcr35c(将该表达载体中的编码序列号5记载的fc结合性蛋白质的多核苷酸的序列示于序列号6)作为模板,进行易错pcr。易错pcr如下进行:制备表1所示的组成的反应液,之后将该反应液在95℃下进行2分钟热处理,进行35次循环的、以95℃下30秒的第1步骤、60℃下30秒的第2步骤、72℃下90秒的第3步骤为1个循环的反应,最后在72℃下进行7分钟热处理。通过该反应,向编码fc结合性蛋白质的多核苷酸中良好地导入变异。[表1]表1组成体积模板dna(pet-fcr35c、浓度:12ng/μl)1μl10μmpcr引物(序列号2)4μl10μmpcr引物(序列号3)4μl2.5mmmgcl212μl10mmdatp2μl10mmdgtp2μl10mmdctp10μl10mmdttp10μl10mmmncl24μl10×extaq缓冲液(宝生物制)10μlgotaq聚合酶(普洛麦格制)1μlh2o添加到100μl(2)对(1)中得到的pcr产物进行纯化后,用限制性内切酶ncoi和hindiii消化,连接于预先用相同的限制性内切酶消化后的表达载体petmale(日本特开2011-206046号公报)。(3)连接反应结束后,将反应液通过电穿孔法导入到大肠杆菌bl21(de3)株中,用含50μg/ml卡那霉素的lb平板培养基培养后,将平板上形成的菌落作为随机变异文库。实施例2具有耐碱性的fc结合性蛋白质的筛选(1)将实施例1中制作的随机变异文库(转化体)接种于含有50μg/ml的卡那霉素的2yt液体培养基(蛋白胨16g/l、酵母提取物10g/l、氯化钠5g/l)200μl,使用96孔深孔板在30℃下振荡培养一晩。(2)培养后,将5μl的培养液转移到500μl的含有0.05mm的iptg(异丙基-β-d-硫代半乳糖苷)、0.3%(w/v)的甘氨酸和50μg/ml的卡那霉素的2yt液体培养基中,使用96孔深孔板进一步在20℃下振荡培养一晩。(3)培养后,将通过离心操作得到的含fc结合性蛋白质的培养上清用纯水稀释至25倍,与等量的500mm的氢氧化钠溶液混合后,在30℃下静置3小时而进行碱处理。碱处理后,用4倍量的1mtris缓冲液(ph7.0)使ph恢复到中性左右。(4)分别通过下述所示的elisa法测定进行了(3)记载的碱处理时的fc结合性蛋白质的抗体结合活性和未进行(3)所述的碱处理时的fc结合性蛋白质的抗体结合活性,将进行了碱处理时的fc结合性蛋白质的抗体结合活性除以未进行碱处理时的fc结合性蛋白质的抗体结合活性,从而算出残留活性。(4-1)将作为人抗体的γ球蛋白制剂(化学及血清疗法研究所制)以1μg/孔固定于96孔微孔板的孔(4℃下18小时),固定结束后,用含有2%(w/v)的skimmilk(bd制)和150mm的氯化钠的20mm的tris盐酸缓冲液(ph7.4)封闭。(4-2)用洗涤缓冲液(包含0.05%[w/v]的tween20、150mm的nacl的20mmtris-hcl缓冲液(ph7.4))洗涤后,添加包含待评价抗体结合活性的fc结合性蛋白质的溶液,使fc结合性蛋白质与所固定的γ球蛋白反应(30℃下1小时)。(4-3)反应结束后,用上述洗涤缓冲液进行洗涤,以100μl/孔添加稀释成100ng/ml的anti-6his抗体(bethyllaboratories制)。(4-4)在30℃下反应1小时,用上述洗涤缓冲液洗涤,之后以50μl/孔添加tmbperoxidasesubstrate(kpl制)。通过以50μl/孔添加1m的磷酸而终止显色,用酶标仪(tecan制)测定450nm的吸光度。(5)通过(4)的方法评价约2700株转化体,从其中选择表达与fcr35c相比稳定性提高的fc结合性蛋白质的转化体。将选择出的转化体用含有50μg/ml的卡那霉素的2yt液体培养基培养,使用qiaprepspinminiprepkit(qiagen制)制备表达载体。(6)将插入到所得到的表达载体中的编码fc结合性蛋白质的多核苷酸区域的序列供于基于链终止子法(chainterminatormethod)的使用bigdyeterminatorcyclesequencingfsreadreactionkit(thermofisherscientific制)的循环测序反应,利用全自动dna测序仪abiprism3700dnaanalyzer(thermofisherscientific制)分析核苷酸序列。需要说明的是,在进行该分析时,使用由序列号2(5’-taatacgactcactataggg-3’)或序列号3(5’-tatgctagttattgctcag-3’)记载的序列构成的寡核苷酸作为测序用引物。将通过(4)的方法评价转化体、并且与fcr35c进行比较的结果示于表2。将与fcr35c相比碱稳定性提高的多肽命名为fcr35d、fcr36i和fcr36a。将与fcr35c相比碱稳定性降低的多肽分别记作a、b、c和d而记载在表2中(未确认序列)。[表2]表2将包含fcr35d的fc结合性蛋白质的氨基酸序列示于序列号7中,将编码上述蛋白质的多核苷酸的序列示于序列号8。另外,将包含fcr36i的fc结合性蛋白质的氨基酸序列示于序列号9,将编码上述蛋白质的多核苷酸的序列示于序列号10。进一步地,将包含fcr36a的fc结合性蛋白质的氨基酸序列示于序列号11,将编码上述蛋白质的多核苷酸的序列示于序列号12。需要说明的是,在序列号7、9和11中,第1位的甲硫氨酸(met)至第26位的丙氨酸(ala)为止为male信号肽,第27位的赖氨酸(lys)至第32位的甲硫氨酸(met)为止为连接子序列,第33位的甘氨酸(gly)至第208位的谷氨酰胺(gln)为止为fcr35d(序列号7)、fcr36i(序列号9)或fcr36a(序列号11)的氨基酸序列,第209位至第210位为止的甘氨酸(gly)为连接子序列,第211位至第216位的组氨酸(his)为标签序列。通过(6)的方法分析编码fcr35d、fcr36i和fcr36a的多核苷酸的序列的结果是,fcr35d(序列号7)相对于fcr35c发生了ser81arg、asn196lys、glu200gly和glu203asp的新的氨基酸置换,另一方面,第98位、第114位、第117位和第208位的氨基酸残基恢复为天然型(序列号4)的氨基酸残基。另外,fcr36i(序列号9)相对于fcr35c发生了ser81arg、val192ile、asn196lys、glu200gly和glu203asp的新的氨基酸置换,另一方面,第98位、第114位、第117位和第208位的氨基酸残基与fcr35d同样地恢复为天然型(序列号4)的氨基酸残基。fcr36a(序列号11)相对于fcr35c发生了ser81arg、val192ala、asn196lys、glu200gly和glu203asp的新的氨基酸置换,另一方面,第98位、第114位、第117位和第208位的氨基酸残基与fcr35d和fcr36i同样地恢复为天然型(序列号4)的氨基酸残基。实施例3fc结合性蛋白质的碱稳定性评价(1)将表达包含fcr35c的fc结合性蛋白质(序列号5)、以及实施例2中获得的包含fcr35d的fc结合性蛋白质(序列号7)、包含fcr36i的fc结合性蛋白质(序列号9)和包含fcr36a的fc结合性蛋白质(序列号11)的转化体分别接种于含有50μg/ml的卡那霉素的100ml的2yt液体培养基,在37℃下好氧振荡培养一晩,从而进行预培养。(2)向添加了50μg/ml的卡那霉素的1000ml的2yt液体培养基(蛋白胨16g/l、酵母提取物10g/l、氯化钠5g/l)中接种预培养液10ml,在37℃下进行好氧振荡培养。(3)培养开始1.5小时后,将培养温度变更为20℃并振荡培养30分钟。然后,以终浓度0.01mm的方式添加iptg,接着在20℃下好氧振荡培养一晚。(4)培养结束后,通过离心分离收集菌体,用缓冲液(包含150mm的nacl的20mmtris-hcl缓冲液(ph7.4))悬浮,进行超声波破碎。然后,通过离心分离回收上清。(5)将回收的上清通入填充有nisepharose6fastflow(gehealthcare制)的柱中,用洗涤缓冲液(包含150mm的nacl的20mmtris-hcl缓冲液(ph7.4))进行充分洗涤后,用洗脱缓冲液(包含150mm的nacl和500mm的咪唑的20mmtris-hcl缓冲液(ph7.4))进行洗脱,回收该洗脱级分。(6)将(5)中回收的洗脱级分通入填充有iggsepharose6fastflow(gehealthcare制)的柱中,用洗涤缓冲液(包含150mm的nacl的20mmtris-hcl缓冲液(ph7.4))进行充分洗涤后,用洗脱缓冲液(100mm甘氨酸缓冲液(ph3.0))进行洗脱,回收该洗脱级分后,加入1/4倍量1mtris盐酸缓冲液(ph8.0)进行中和,从而制备纯化后的各fc结合性蛋白质。(7)按照各fc结合性蛋白质的浓度为10μg/ml的方式用纯水稀释后,将上述稀释后的溶液50μl与200mm的氢氧化钠溶液50μl混合,在25℃下静置96小时,从而进行碱处理。然后,加入4倍量的1mtris盐酸缓冲液(ph7.0)而进行中和。(8)通过实施例2的(4)记载的elisa法分别测定进行了(7)记载的碱处理时的fc结合性蛋白质的抗体结合活性和未进行(7)记载的碱处理时的fc结合性蛋白质的抗体结合活性。然后,将进行了碱处理时的fc结合性蛋白质的抗体结合活性除以未进行碱处理时的fc结合性蛋白质的抗体结合活性,从而算出残留活性。将结果示于表3。包含fcr35d的fc结合性蛋白质(序列号7)、包含fcr36i的fc结合性蛋白质(序列号9)和包含fcr36a的fc结合性蛋白质(序列号11)与包含fcr35c的fc结合性蛋白质(序列号5)相比残留活性高,由此确认实施例2中获得的fcr35d、fcr36i和fcr36a与fcr35c相比碱稳定性(耐碱性)提高。[表3]表3实施例4fc结合性蛋白质对igg的结合活性的测定作为转化体,使用表达包含fcr35d的fc结合性蛋白质(序列号7)、包含fcr36i的fc结合性蛋白质(序列号9)、包含fcr36a的fc结合性蛋白质(序列号11)或包含fcr35c的fc结合性蛋白质(序列号5)的转化体,通过下述方法进行测定。(1)将表达上述包含fcr35d的fc结合性蛋白质(序列号7)或包含fcr36i的fc结合性蛋白质(序列号9)的转化体分别接种于含有50μg/ml的卡那霉素的2ml的2yt液体培养基,37℃下好氧振荡培养一晚,从而进行预培养。(2)向添加了50μg/ml的卡那霉素的20ml的2yt液体培养基(蛋白胨16g/l、酵母提取物10g/l、氯化钠5g/l)中接种预培养液0.2ml。在37℃下进行好氧振荡培养。(3)培养开始1.5小时后,将培养温度变更为20℃并振荡培养30分钟。然后,按照终浓度为0.01mm的方式添加iptg(异丙基-β-硫代半乳糖苷),接着在20℃下好氧振荡培养一晚。(4)培养结束后,通过离心分离收集菌体,使用bugbusterproteinextractionkit(默克密理博制)制备蛋白质提取液。(5)通过实施例2的(4)所示的elisa法测定fc结合性蛋白质的抗体结合活性。由得到的fc结合性蛋白质对igg的结合活性算出fc结合性蛋白质的表达量。将结果示于表4。每1l培养液的fc结合性蛋白质fcr35d和fcr36i的表达量分别为443.5mg和495.6mg。[表4]表4(6)将上述表达包含fcr35d的fc结合性蛋白质(序列号7)、包含fcr36i的fc结合性蛋白质(序列号9)、包含fcr36a的fc结合性蛋白质(序列号11)或包含fcr35c的fc结合性蛋白质(序列号5)的转化体分别接种于含有50μg/ml的卡那霉素的2ml的2yt液体培养基,37℃下好氧振荡培养一晚,从而进行预培养。(7)与(2)同样地进行振荡培养。(8)将(3)记载的方法中的培养时间设为12小时,除此以外通过同样的方法进行振荡培养。(9)与(4)同样地制备蛋白质提取液。(10)与(5)同样地算出表达量。将结果示于表5。每1l培养液的fc结合性蛋白质fcr35d、fcr36i、fcr36a和fcr35c的表达量分别为226mg、248mg、307mg和211mg。[表5]表5实施例5fc结合性蛋白质与igg1的结合亲和性的评价(1)通过与实施例3的(1)至(6)同样的方法实施培养和纯化,制备各fc结合性蛋白质。(2)通过表面等离子共振法进行作为(1)的洗脱级分而回收的fc结合性蛋白质与igg1的结合亲和性的评价。在使用表面等离子共振法的结合亲和性的测定中,分别地,作为测定装置使用biacoret100(gehealthcare制);作为传感器芯片使用sensorchipcm5(gehealthcare制);作为分析软件使用biacoret100evaluationsoftware(gehealthcare制)。(3)对于使用aminecouplingkit(gehealthcare制)而固定了fc结合性蛋白质的传感器芯片,流通用hbs-ep(gehealthcare制)稀释igg1(sigma-aldrich制)而成的溶液,从而得到传感图。以该传感图为基础进行曲线拟合,从而算出对igg1的结合亲和性。将算出对igg1的结合亲和性的结果示于表6。需要说明的是,在表6中,kd值(解离常数)越低则越具有高亲和(结合亲和性)。包含fcr35d的fc结合性蛋白质(序列号7)、包含fcr36i的fc结合性蛋白质(序列号9)和包含fcr36a的fc结合性蛋白质(序列号11)的kd值分别为3.9×10-8m、4.3×10-8m和9.5×10-8m,结合亲和性与包含fcr35c的fc结合性蛋白质(序列号5)的kd值(4.0×10-8m)同等。[表6]表6由以上的结果可知,实施例2中获得的fcr35d、fcr36i和fcr36a具有与可与抗体的fc区结合的已知多肽(fcr35c、日本特开2017-11887号公报)同等的对抗体的结合亲和性,并且耐碱性提高。实施例6添加了半胱氨酸标签的fcr36i的制作(1)以实施例2中制作的编码fcr36i的多核苷酸(序列号10)为模板而实施pcr。该pcr中的引物使用由序列号13(5’-catatgaaaataaaaacaggtgcacgcatcctcgcattatccgcattaacgac-3’)和序列号14(5’-cccaagcttatccgcaggtatcgttgcggcacccttgggtaacggtaatgtccacggccccgctg-3’)记载的序列构成的寡核苷酸。pcr如下实施:制备表7所示的组成的反应液,之后将该反应液在98℃下进行5分钟热处理,重复进行30次循环以98℃下10秒的第1步骤、55℃下5秒的第2步骤、72℃下1分钟的第3步骤为1个循环的反应。[表7]表7组成体积模板dna(浓度:1ng/μl)1μl10μmpcr引物(序列号13)1.5μl10μmpcr引物(序列号14)1.5μl5×primestar缓冲液(宝生物制)10μl2.5mmdntps4μl2.5u/μlprimestarhs(宝生物制)0.5μlh2o添加至50μl(2)对(1)中得到的多核苷酸进行纯化后,用限制性内切酶ncoi和hindiii消化后,连接于预先用限制性内切酶ncoi和hindiii消化的按照wo2015/199154号中记载的方法制作的表达载体ptrc-pelb,使用该连接产物转化大肠杆菌w3110株。(3)将得到的转化体用含100μg/ml的羧苄青霉素的lb培养基进行培养后,用qiaprepspinminiprepkit(qiagen制)提取表达载体ptrc-fcr36i_cys。(4)使用由序列号15(5’-tgtggtatggctgtgcagg-3’)或序列号16(5’-tcggcatggggtcaggtg-3’)记载的序列构成的寡核苷酸进行ptrc-fcr36i_cys的核苷酸序列分析。分别地,将用表达载体ptrc-fcr36i_cys表达的多肽的氨基酸序列示于序列号17,将编码该多肽的多核苷酸的序列示于序列号18。需要说明的是,在序列号17中,第1位的甲硫氨酸(met)至第22位的丙氨酸(ala)为止为改良pelb信号肽(uniprotno.p0c1c1的第1位至第22位为止的氨基酸残基所构成的寡肽,其中包含1个氨基酸置换),第24位的甘氨酸(gly)至第199位的谷氨酰胺(gln)为止为fc结合性蛋白质fcr36i的氨基酸序列(序列号9的第33位至第208位为止的区域),第200位的甘氨酸(gly)至第207位的甘氨酸(gly)为止为半胱氨酸标签序列。实施例7fcr36i_cys的制备(1)将实施例6中制作的表达fcr36i_cys的转化体接种于装在2l挡板烧瓶(baffleflask)中的含100μg/ml的羧苄青霉素的400ml2yt液体培养基(蛋白胨16g/l、酵母提取物10g/l、氯化钠5g/l),37℃下好氧振荡培养一晚,从而进行预培养。(2)向包含葡萄糖10g/l、酵母提取物20g/l、磷酸三钠十二水合物3g/l、磷酸氢二钠十二水合物9g/l、氯化铵1g/l和羧苄青霉素100mg/l的液体培养基1.8l中接种(1)的培养液180ml,用3l发酵槽(biott制)进行主培养。设定为温度30℃、ph6.9至7.1、通气量1vvm、溶解氧浓度30%饱和浓度的条件,开始主培养。为了控制ph,作为酸使用50%磷酸,作为碱使用14%氨水,关于溶解氧的控制,通过改变搅拌速度而进行控制,搅拌转速的下限设为500rpm、上限设为1000rpm。培养开始后,在测不到葡萄糖浓度的时刻一边通过溶解氧(do)进行控制一边加入流加培养基(葡萄糖248.9g/l、酵母提取物83.3g/l、硫酸镁七水合物7.2g/l)。(3)在作为菌体量的指标的、600nm的吸光度(od600nm)达到约150时,将培养温度降至25℃,在确认达到设定温度后,按照终浓度为0.5mm的方式添加iptg(异丙基-β-d-硫代半乳糖苷),接着继续在25℃下培养。(4)在培养开始起约48小时后停止培养,对于培养液,通过在4℃下以8000rpm离心分离20分钟而回收菌体。(5)以成为5ml/1g(菌体)的方式将回收的菌体悬浮于20mm的磷酸缓冲液(ph7.0),使用超声波发生装置(insonator201m(商品名)、久保田商事制)在4℃下以约150w的输出功率进行约10分钟的菌体破碎。对于菌体破碎液,在4℃、8000rpm、20分钟的条件下进行2次离心分离,回收上清。(6)将(5)中得到的上清以流速10ml/分钟上样到预先用20mm的磷酸缓冲液(ph7.0)平衡的填充有140ml的toyopearlcm-650m(东曹制)的vl32×250柱(默克密理博制)。以用于平衡的缓冲液洗涤后,用含0.8m的氯化钠的20mm的磷酸缓冲液(ph7.0)进行洗脱。通过上述纯化,得到fcr36i_cys。实施例8fcr36i固定凝胶的制作和通过线性梯度洗脱来分离抗体(1)将用作分离剂的亲水性乙烯基聚合物(东曹制)表面的羟基用碘代乙酰基活化后,使实施例7中制备的fcr36i_cys与其反应,从而得到fcr36i固定凝胶。(2)将(1)中制备的fcr36i固定凝胶1.0ml填充到tricorn柱(gehealthcare制、内径5mm)。(3)将填充有fcr36i固定凝胶的柱连接于aktaavant(gehealthcare制),用ph4.8的20mm的乙酸缓冲液(缓冲液a)进行平衡。(4)用ph4.8的20mm的乙酸缓冲液(缓冲液a)以流速0.2ml/分钟上样0.5ml的10mg/ml的单克隆抗体(利妥昔单抗、全药工业制)。(5)在流速0.2ml/分钟的状态下用平衡缓冲液洗涤66分钟后,通过利用ph3.0的10mm的甘氨酸盐酸缓冲液(缓冲液b)的线性梯度(在75分钟时ph3.0的10mm的甘氨酸盐酸缓冲液(缓冲液b)达到100%的线性梯度)洗脱所吸附的单克隆抗体。将结果(洗脱曲线的色谱图)示于图2。单克隆抗体由于与fcr36i发生相互作用,从而不是如凝胶过滤色谱那样的单峰、而是分离为2个峰。即,与fcr36i显示弱结合的抗体的洗脱时间较早,显示强结合的抗体的洗脱时间较晚,从而分离为2个峰。实施例9使用fcr36i固定凝胶通过线性梯度洗脱而分离的抗体的adcc(抗体依赖性细胞毒性作用)活性测定(1)按照实施例8记载的洗脱条件分离单克隆抗体,分取图2所记载的洗脱曲线的色谱图中的级分a(fra)和级分b(frb)的级分。(2)通过280nm的吸光度测定包含于fra和frb的抗体、以及分离前的单克隆抗体的浓度。(3)通过以下所示的方法测定包含于fra和frb的抗体、以及分离前的单克隆抗体所具有的adcc活性。(3-1)使用将1.4ml的lowiggserum和33.6ml的rpmi1640培养基混合而制备的adcc分析缓冲液,将包含于fra和frb的抗体以及分离前的单克隆抗体从1ng/ml起进行1/3稀释,制备9级稀释系列。(3-2)将raji细胞用adcc分析缓冲液制备成约5×105个细胞/ml,以25μl/孔加入到96孔板(3917:康宁公司)。(3-3)向加入了raji细胞的孔中,以25μl/孔加入(3-1)中制备的fra、frb、分离前的单克隆抗体、空白(仅adcc分析缓冲液)。(3-4)将效应细胞(普洛麦格制)用adcc分析缓冲液制备为约3.0×105个细胞/ml,以25μl/孔加入到加入了raji细胞和抗体的孔中。然后,在co2培养箱(5%co2、37℃)中静置6小时。(3-5)将96孔板在室温下从5分钟起静置30分钟后,以75μl/孔加入luciferaseassayreagent(普洛麦格制)。在室温下反应30分钟后,用glomaxmultidetectionsystem(普洛麦格制)测定发光。将比较按照实施例8记载的洗脱条件分取的fra和frb所分别包含的抗体以及分离前的单克隆抗体的发光强度的结果示于图3。需要说明的是,图3的结果示出从测定的发光强度减去空白的发光强度而得的值,发光强度越高则意味着adcc活性越高。用fcr36i固定凝胶分取的洗脱时间较早的fra中所含的抗体与分离前的单克隆抗体的发光强度几乎为同等程度,因此可以说adcc活性几乎为同等。另一方面,洗脱时间较晚的frb中所含的抗体与分离前的单克隆抗体相比,adcc活性为约1.4倍,与fra中所含的抗体相比提高到约1.5倍。即可知,frb中所含的抗体与分离前的单克隆抗体和fra中所含的抗体相比adcc活性高。实施例10使用fcr36i固定凝胶通过线性梯度洗脱而分离的抗体的糖链结构分析(1)通过100℃、10分钟的热处理将实施例9的(1)中分取的fra和frb中分别包含的抗体变性后,依次用葡萄糖酰胺酶a/胃蛋白酶和链霉蛋白酶进行处理,经过利用凝胶过滤法的纯化操作而获得糖链级分。(2)将(1)中得到的糖链用蒸发器进行浓缩·干燥后,在乙酸溶剂下依次使2-氨基吡啶、接着使二甲胺硼烷进行作用而制成荧光标签化糖链,通过凝胶过滤法进行纯化。(3)用阴离子交换柱(tskgeldeae-5pw、东曹制)将(2)中得到的荧光标签化糖链分离为中性糖链级分和单唾液酸化糖链级分。(4)将(3)中得到的中性糖链级分和单唾液酸化糖链级分用ods柱分离为各糖链。通过maldi-tof-ms分析获得分离后的糖链的分子量信息后,对照ods柱色谱的保留时间归属糖链结构。将归属后的糖链结构的结果示于图4和表8,将糖链结构的概要图示于表9。与fra中所含的抗体相比,frb中所含的抗体中的、具有在末端包含半乳糖的糖链结构(g1fa和g2f)的抗体的比例高,具有在末端不含半乳糖的糖链结构(g0f)的抗体的比例低。由此可知:具有在末端包含半乳糖的糖链结构的抗体与fcr36i强结合,在用fc36i固定凝胶分离时在较晚的洗脱时间时被洗脱(即,在低ph下被洗脱),具有在末端不含半乳糖的糖链结构的抗体与fcr36i的结合弱,在用fc36i固定凝胶分离时较早被洗脱(即,在高ph下被洗脱)。[表8]表8[表9]表9neuac:n-乙酰基神经氨酸、gal:半乳糖、glcnac:n-乙酰基葡糖胺、man:甘露糖、fuc:岩藻糖、pa:2-氨基吡啶(荧光标记)实施例11fcr36i固定凝胶的制作和利用阶梯梯度洗脱分离抗体(1)通过与实施例8的(1)同样的方法得到fcr36i固定凝胶。(2)通过与实施例8的(2)同样的方法将fcr36i固定凝胶填充到柱中。(3)将填充有fcr36i固定凝胶的柱连接于aktaavant(gehealthcare制),用20mm的乙酸缓冲液(ph5.2)进行平衡。(4)用20mm的乙酸缓冲液(ph5.2)以流速0.2ml/分钟上样1.5ml的10mg/ml的单克隆抗体(利妥昔单抗、全药工业制)。(5)在流速0.2ml/分钟的状态下输送20mm的乙酸缓冲液(ph5.2)120分钟后,以流速0.2ml/分钟输送20mm的乙酸缓冲液(ph4.8)100分钟,洗脱单克隆抗体。(6)在流速0.2ml/分钟的状态下输送10mm的甘氨酸盐酸缓冲液(ph3.0)50分钟,从而洗脱所吸附的单克隆抗体。将结果(洗脱曲线的色谱图)示于图5。通过将ph不同的缓冲液输送到柱中,从而用各缓冲液洗脱抗体,单克隆抗体被分离为3个峰。单克隆抗体与fcr36i发生相互作用,因此可知:在高ph下较早洗脱的抗体为与fcr36i显示弱亲和性的抗体,在低ph下较晚洗脱的抗体为与fcr36i显示强亲和性的抗体。实施例12用fcr36i固定凝胶分离的抗体的糖链分析(1)按照实施例11记载的洗脱条件分离单克隆抗体,分取图5记载的洗脱曲线的色谱图中的级分c(frc)、级分d(frd)和级分e(fre)的级分。(2)使用上述所分取的frc、frd和fre中分别包含的抗体,除此以外通过与实施例10同样的方法归属糖链结构。将归属后的糖链结构的结果示于图6和表10,将糖链结构的概要图示于表9。比较frc(用20mm的乙酸缓冲液(ph5.2)洗脱)、frd(用20mm的乙酸缓冲液(ph4.8)洗脱)和fre(用10mm的甘氨酸盐酸缓冲液(ph3.0)洗脱)中所含的各抗体的糖链结构,在高ph下被洗脱的级分中所含的抗体中,具有在末端不含半乳糖的糖链结构(g0f)的抗体的比例高;在低ph下被洗脱的级分中所含的抗体中,具有在末端包含半乳糖的糖链结构(g1fa和g2f)的抗体的比例高。由此可知,具有在末端包含半乳糖的糖链结构的抗体与fcr36i强结合,在用fc36i固定凝胶分离时在低ph下被洗脱,具有在末端不含半乳糖的糖链结构的抗体与fcr36i的结合弱,以及在用fc36i固定凝胶分离时在高ph下被洗脱。[表10]表10实施例13使用fcr36i固定凝胶的利用阶梯梯度洗脱分离抗体(之2)(1)通过与实施例8的(1)同样的方法得到fcr36i固定凝胶。(2)将凝胶量设为0.2ml,除此以外通过与实施例8的(2)同样的方法将fcr36i固定凝胶填充到柱中。(3)将填充有fcr36i固定凝胶的柱连接于aktaavant(gehealthcare制),用20mm的乙酸缓冲液(ph5.2)进行平衡。(4)用20mm的乙酸缓冲液(ph5.2)以流速0.04ml/分钟上样0.3ml10mg/ml的单克隆抗体(贝伐单抗、roche制)。(5)在流速0.04ml/分钟的状态下输送20mm的乙酸缓冲液(ph5.2)180分钟后,以流速0.04ml/分钟输送20mm的乙酸缓冲液(ph4.8)150分钟而洗脱单克隆抗体。(6)在流速0.04ml/分钟的状态下输送10mm的甘氨酸盐酸缓冲液(ph3.0)100分钟,从而洗脱所吸附的单克隆抗体。将结果(洗脱曲线的色谱图)示于图7。可知:单克隆抗体被分离为3个峰,由于为与实施例11不同种类的抗体而得到不同的洗脱曲线。参考例1fcr9氨基酸置换体的制作为了确认对于按照日本特开2016-169197号公报(专利文献3)记载的方法制作的fc结合性蛋白质fcr9(序列号20)、将第192位(相当于序列号1中的第176位)的氨基酸残基置换为其它的氨基酸时的有用性,进行以下所示的氨基酸置换。具体而言,对于包含编码fcr9的多核苷酸(序列号21)的质粒pet-fcr9(日本特开2016-169197号公报),使用pcr进行氨基酸置换,制作将fcr9(序列号20)中的第192位的缬氨酸置换为其它的氨基酸的fc结合性蛋白质。需要说明的是,fcr9(序列号20)为下述fc结合性蛋白质:在序列号4所示的包含人fcγriii细胞外区域的fc结合性蛋白质中将第43位(相当于序列号1中的27位)的缬氨酸置换为谷氨酸、将第45位(相当于序列号1中的29位)的苯丙氨酸置换为异亮氨酸、将第51位(相当于序列号1中的35位)的酪氨酸置换为天冬酰胺、将第64位(相当于序列号1中的48位)的谷氨酰胺置换为精氨酸、将第91位(相当于序列号1中的75位)的苯丙氨酸置换为亮氨酸、将第108位(相当于序列号1中的92位)的天冬酰胺置换为丝氨酸、将第133位(相当于序列号1中的117位)的缬氨酸置换为谷氨酸、将第137位(相当于序列号1中的121位)的谷氨酸置换为甘氨酸、和将第187位(相当于序列号1中的171位)的苯丙氨酸置换为丝氨酸的fc结合性蛋白质。(1)分别地,作为模板dna使用按照日本特开2016-169197号公报记载的方法制作的包含编码fcr9(序列号20)的多核苷酸(序列号21)的质粒pet-fcr9(日本特开2016-169197号公报),作为正向引物使用由序列号2(5’-taatacgactcactataggg-3’)记载的序列构成的寡核苷酸,作为反向引物使用由序列号22(5’-catttttgctgccmnncagcccacggcagg-3’)记载的序列构成的寡核苷酸,制备由表11所示的组成构成的反应液后,将该反应液在95℃下进行2分钟热处理,进行30次循环以95℃下30秒的第1步骤、50℃下30秒的第2步骤、72℃下90秒的第3步骤为1个循环的反应,最后在72℃下进行7分钟热处理,由此进行pcr。将得到的pcr产物作为v192p1。[表11]表11组成体积模板dna2μl10μm正向引物1μl10μm反向引物1μl5×primestar缓冲液(宝生物制)4μl2.5mmdntps2μl2.5u/μlprimestarhs(宝生物制)0.5μlh2o添加到20μl(2)分别地,作为正向引物使用由序列号23(5’-cctgccgtgggctgnnkggcagcaaaaatg-3’)记载的序列构成的寡核苷酸,作为反向引物使用由序列号3(5’-tatgctagttattgctcag-3’)记载的序列构成的寡核苷酸,除此以外通过与(1)同样的方法进行pcr,将得到的pcr产物作为v192p2。(3)使用作为pcr产物的(1)中得到的v192p1和(2)中得到的v192p2的混合物制备由表12所示的组成构成的反应液后,将该反应液在98℃下进行5分钟热处理后,进行5次循环以98℃下10秒的第1步骤、55℃下5秒的第2步骤、72℃下1分钟的第3步骤为1个循环的反应,由此进行pcr,得到将v192p1和v192p2连结而成的pcr产物v192p。[表12]表12组成体积pcr产物各1μl2.5u/μlprimestarhs(宝生物制)0.5μl5×primestar缓冲液(宝生物制)4μl2.5mmdntps2μlh2o添加到20μl(4)分别地,作为pcr产物使用(3)中得到的v192p,作为正向引物使用由序列号2记载的序列构成的寡核苷酸,作为反向引物使用由序列号3记载的序列构成的寡核苷酸,在制备由表13所示的组成构成的反应液后,将该反应液在98℃下进行5分钟热处理,进行30次循环以98℃下10秒的第1步骤、55℃下5秒的第2步骤、72℃下1分钟的第3步骤为1个循环的反应,由此进行pcr,得到编码将fcr9(序列号20)的第192位的缬氨酸置换为任意的氨基酸的fc结合性蛋白质的多核苷酸。将得到的多核苷酸设为v192p3。[表13]表13组成体积pcr产物2μl10μm正向引物2μl10μm反向引物2μl5×primestar缓冲液(宝生物制)10μl2.5mmdntps4μl2.5u/μlprimestarhs(宝生物制)1μlh2o添加到50μl(5)对(4)中得到的v192p3进行纯化后,用限制性内切酶ncoi和hindiii消化,连接于预先用限制性内切酶ncoi和hindiii消化的表达载体petmale(日本特开2011-206046号公报),用其转化大肠杆菌bl21(de3)株。(6)用添加了50μg/ml的卡那霉素的lb培养基培养所得到的转化体。从回收的菌体(转化体)中提取质粒。(7)对于得到的质粒中的编码fc结合性蛋白质的多核苷酸和其周边区域,使用基于链终止子法的bigdyeterminatorv3.1cyclesequencingkit(lifetechnologies制)供于循环测序反应,用全自动dna测序仪appliedbiosystems3130geneticanalyzer(lifetechnologies制)分析核苷酸序列。需要说明的是,在进行该分析时,使用由序列号2或序列号3记载的序列构成的寡核苷酸作为测序用引物。序列分析的结果是,得到了表达fc结合性蛋白质fcr9(序列号20)的第192位的缬氨酸被置换为丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸中的任一者的fc结合性蛋白质的转化体。参考例2fc结合性蛋白质对igg的结合活性测定(1)将参考例1所得到的转化体中的、表达将fcr9(序列号20)的第192位(相当于序列号1中的176位)的氨基酸残基置换为异亮氨酸(以下也记作val192ile)、丙氨酸(以下也记作val192ala)或酪氨酸(以下也记作val192tyr)的fc结合性蛋白质的转化体分别接种于含有50μg/ml的卡那霉素的2ml的2yt液体培养基,在37℃下好氧振荡培养一晚,从而进行预培养。(2)向添加了50μg/ml的卡那霉素的20ml的2yt液体培养基(蛋白胨16g/l、酵母提取物10g/l、氯化钠5g/l)中接种预培养液0.2ml,在37℃下进行好氧振荡培养。(3)培养开始1.5小时后,将培养温度变更为20℃并振荡培养30分钟。然后,按照终浓度为0.01mm的方式添加iptg(异丙基-β-硫代半乳糖苷),接着在20℃下好氧振荡培养一晚。(4)培养结束后,通过离心分离收集菌体,使用bugbusterproteinextractionkit(宝生物制)制备蛋白质提取液。(5)通过下述所示的elisa法测定fc结合性蛋白质的抗体结合活性。(5-1)将作为人抗体的γ球蛋白制剂(化学及血清疗法研究所制)以1μg/孔添加到96孔微孔板的孔而进行固定(4℃下一晩)后,将包含2%(w/v)的skimmilk(bd制)和150mm的氯化钠的20mm的tris盐酸缓冲液(ph7.4)添加到孔中而进行封闭。(5-2)用洗涤缓冲液(包含0.05%(w/v)的tween20、150mm的nacl的20mmtris-hcl缓冲液(ph7.4))洗涤后,添加包含评价抗体结合活性的fc结合性蛋白质的溶液,使fc结合性蛋白质和所固定的γ球蛋白反应(30℃下1小时)。(5-3)反应结束后,用上述洗涤缓冲液洗涤,以100μl/孔添加稀释为100ng/ml的anti-6his抗体(bethyllaboratories制)。(5-4)在30℃下反应1小时,用上述洗涤缓冲液洗涤后,以50μl/孔添加tmbperoxidasesubstrate(kpl制)。以50μl/孔添加1m的磷酸而停止显色,用酶标仪(tecan制)测定450nm的吸光度。(6)由通过(5)的方法得到的fc结合性蛋白质对igg的结合活性算出fc结合性蛋白质的表达量。将结果示于表14。表达作为包含val192ile的氨基酸置换的fc结合性蛋白质的fcr9_i(序列号24)、作为包含val192ala的氨基酸置换的fc结合性蛋白质的fcr9_a(序列号26)、和作为包含val192tyr的氨基酸置换的fc结合性蛋白质的fcr9_y(序列号28)的转化体的每1l培养液的fc结合性蛋白质表达量分别为130.6mg、21.7mg和14.6mg。分别地,将本参考例中研究的作为fc结合性蛋白质的fcr9_i的氨基酸序列示于序列号24,将编码上述fcr9_i的多核苷酸的序列示于序列号25。需要说明的是,在序列号24中,第1位的甲硫氨酸(met)至第26位的丙氨酸(ala)为止为male信号肽,第27位的赖氨酸(lys)至第32位的甲硫氨酸(met)为止为连接子序列,第33位的甘氨酸(gly)至第208位的谷氨酰胺(gln)为止为在fcr9(序列号20)的第33位的甘氨酸(gly)至第208位的谷氨酰胺(gln)为止的氨基酸序列中发生了val192ile的氨基酸置换的多肽,第209位至第210位为止的甘氨酸(gly)为连接子序列,第211位至第216位的组氨酸(his)为标签序列。另外,val192ile的异亮氨酸在序列号24中存在于第192位的位置。将本参考例中研究的作为fc结合性蛋白质的fcr9_a的氨基酸序列示于序列号26,将编码上述fcr9_a的多核苷酸的序列示于序列号27。需要说明的是,序列号26为下述序列:第33位的甘氨酸(gly)至第208位的谷氨酰胺(gln)为止为在fcr9(序列号20)的第33位的甘氨酸(gly)至第208位的谷氨酰胺(gln)为止的氨基酸序列中发生了val192ala的氨基酸置换的多肽,除此以外与序列号24相同。另外,val192ala的丙氨酸在序列号26中存在于第192位的位置。将本参考例中研究的作为fc结合性蛋白质的fcr9_y的氨基酸序列示于序列号28,将编码上述fcr9_y的多核苷酸的序列示于序列号29。需要说明的是,序列号28为:第33位的甘氨酸(gly)至第208位的谷氨酰胺(gln)为止为在fcr9(序列号20)的第33位的甘氨酸(gly)至第208位的谷氨酰胺(gln)为止的氨基酸序列中发生了val192tyr的氨基酸置换的多肽,此外的序列与序列号24相同。另外,val192tyr的酪氨酸在序列号28中存在于第192位的位置。[表14]表14参考例3作为转化体,使用日本特开2016-169197号公报(专利文献3)中公开的表达fc结合性蛋白质fcr9(序列号20)的转化体,除此以外与参考例2同样地进行。将结果示于表14。每1l培养液的fc结合性蛋白质的表达量为1.4mg。由以上的结果可知,表达向fcr9中导入了val192ile、val192ile、val192tyr中的任意氨基酸置换的fc结合性蛋白质的转化体与表达fcr9的转化体相比,表达量大幅提高。参考例4作为转化体,使用表达将fcr9(序列号20)的第192位(相当于序列号1中的第176位)的氨基酸残基置换为苯丙氨酸(以下也记作val192phe)、精氨酸(以下也记作val192arg)、亮氨酸(以下也记作val192leu)、天冬酰胺(以下也记作val192asn)、天冬氨酸(以下也记作val192asp)、半胱氨酸(以下也记作val192cys)、谷氨酰胺(以下也记作val192gln)、谷氨酸(以下也记作val192glu)、甘氨酸(以下也记作val192gly)、组氨酸(以下也记作val192his)、赖氨酸(以下也记作val192lys)、甲硫氨酸(以下也记作val192met)、脯氨酸(以下也记作val192pro)、丝氨酸(以下也记作val192ser)、苏氨酸(以下也记作val192thr)或色氨酸(以下也记作val192trp)的fc结合性蛋白质的转化体,除此以外与参考例2同样地进行。将结果示于表14。任一者的每1l培养液的fc结合性蛋白质的表达量均为零或小于1mg。参考例5fc结合性蛋白质与igg1的结合亲和性评价(1)将参考例1所得到的转化体中的表达fcr9_i(序列号24)或fcr_a(序列号26)的转化体分别接种于含有50μg/ml的卡那霉素的100ml的2yt液体培养基,在37℃下好氧振荡培养一晚,从而进行预培养。(2)向添加了50μg/ml的卡那霉素的1000ml的2yt液体培养基(蛋白胨16g/l、酵母提取物10g/l、氯化钠5g/l)中接种预培养液10ml,在37℃下进行好氧振荡培养。(3)培养开始1.5小时后,将培养温度变更为20℃并振荡培养30分钟。然后,以终浓度0.01mm的方式添加iptg,接着在20℃下好氧振荡培养一晚。(4)培养结束后,通过离心分离收集菌体,用缓冲液(包含150mm的nacl的20mmtris-hcl缓冲液(ph7.4))悬浮,进行超声波破碎。然后,通过离心分离回收上清。(5)将回收的上清通入填充有nisepharose6fastflow(gehealthcare制)的柱中,用洗涤缓冲液(包含150mm的nacl的20mmtris-hcl缓冲液(ph7.4))进行充分洗涤后,用洗脱缓冲液(包含150mm的nacl和500mm的咪唑的20mmtris-hcl缓冲液(ph7.4))进行洗脱,回收该洗脱级分。(6)将(5)中回收的洗脱级分通入填充有iggsepharose6fastflow(gehealthcare制)的柱中,用洗涤缓冲液(包含150mm的nacl的20mmtris-hcl缓冲液(ph7.4))进行充分洗涤后,用洗脱缓冲液(100mm甘氨酸缓冲液(ph3.0))进行洗脱,回收该洗脱级分。(7)使用表面等离子共振法进行作为(6)的洗脱级分而回收的fc结合性蛋白质与igg1的结合性的评价。在使用表面等离子共振法的结合性测定中,作为测定装置使用biacoret100(gehealthcare制),作为传感器芯片使用sensorchipcm5(gehealthcare制),作为分析软件使用biacoret100evaluationsoftware(gehealthcare制)。(8)对于使用aminecouplingkit(gehealthcare制)固定fc结合性蛋白质而得的传感器芯片,流通用hbs-ep(gehealthcare制)稀释igg1(sigma-aldrich制)而成的溶液,从而得到传感图。以该传感图为基础进行曲线拟合,由此算出对igg1的结合性。将算出对igg1的亲和性的结果示于表15。需要说明的是,在表15中,kd值(解离常数)越低越具有高亲和力(亲和性)。fcr9_i(序列号24)和fcr9_a(序列号26)的kd值分别为6.0×10-8m和3.6×10-8m。参考例6作为转化体,使用日本特开2016-169197号公报(专利文献3)中公开的表达fc结合性蛋白质fcr9(序列号20)的转化体,除此以外与参考例5同样地进行。将算出对igg1的亲和性的结果示于表15。fcr9的kd值为7.7×10-8m,亲和性与fcr9_i(序列号24)和fcr9_a(序列号26)为同等。这表明,作为本发明的fc结合性蛋白质的一方式的fcr9_i和fcr9_a,与fcr9同样地可通过固定于不溶性载体而作为用于抗体药物制造中的工序分析和分取的抗体吸附剂使用。[表15]表15参考例7作为转化体,使用表达将fcr9(序列号20)的第192位(相当于序列号1中的第176位)的缬氨酸置换为苯丙氨酸的fc结合性蛋白质(fcr_f)的转化体,除此以外与参考例5同样地进行。将算出对igg1的亲和性的结果示于表15。fcr9_f的kd值为3.3×10-6m,确认作为本发明的fc结合性蛋白质的fcr9_i(序列号24)和fcr_a(序列号26)与fcr9(序列号20)相比,亲和性低。序列表<110>东曹株式会社(tosohcorporation)<120>耐碱性提高的fc结合性蛋白、该蛋白的制造方法、使用该蛋白的抗体吸附剂和使用该抗体吸附剂分离抗体的方法<130>p180531wo<150>jp2017-207810<151>2017-10-27<150>jp2018-002868<151>2018-01-11<150>jp2018-111357<151>2018-06-11<160>29<170>patentinversion3.5<210>1<211>254<212>prt<213>智人(homosapiens)<300><308>uniprotp08637<309>1990-08-01<313>(1)..(254)<400>1mettrpglnleuleuleuprothralaleuleuleuleuvalserala151015glymetargthrgluaspleuprolysalavalvalpheleuglupro202530glntrptyrargvalleuglulysaspservalthrleulyscysgln354045glyalatyrserprogluaspasnserthrglntrpphehisasnglu505560serleuileserserglnalasersertyrpheileaspalaalathr65707580valaspaspserglyglutyrargcysglnthrasnleuserthrleu859095seraspprovalglnleugluvalhisileglytrpleuleuleugln100105110alaproargtrpvalphelysglugluaspproilehisleuargcys115120125hissertrplysasnthralaleuhislysvalthrtyrleuglnasn130135140glylysglyarglystyrphehishisasnseraspphetyrilepro145150155160lysalathrleulysaspserglysertyrphecysargglyleuphe165170175glyserlysasnvalsersergluthrvalasnilethrilethrgln180185190glyleualavalserthrileserserphepheproproglytyrgln195200205valserphecysleuvalmetvalleuleuphealavalaspthrgly210215220leutyrpheservallysthrasnileargserserthrargasptrp225230235240lysasphislysphelystrparglysaspproglnasplys245250<210>2<211>20<212>dna<213>人工序列(artificialsequence)<220><223>寡核苷酸<400>2taatacgactcactataggg20<210>3<211>19<212>dna<213>人工序列(artificialsequence)<220><223>寡核苷酸<400>3tatgctagttattgctcag19<210>4<211>216<212>prt<213>人工序列(artificialsequence)<220><223>male-cd16a-6his<400>4metlysilelysthrglyalaargileleualaleuseralaleuthr151015thrmetmetpheseralaseralaleualalysilegluglualamet202530glymetargthrgluaspleuprolysalavalvalpheleuglupro354045glntrptyrargvalleuglulysaspservalthrleulyscysgln505560glyalatyrserprogluaspasnserthrglntrpphehisasnglu65707580serleuileserserglnalasersertyrpheileaspalaalathr859095valaspaspserglyglutyrargcysglnthrasnleuserthrleu100105110seraspprovalglnleugluvalhisileglytrpleuleuleugln115120125alaproargtrpvalphelysglugluaspproilehisleuargcys130135140hissertrplysasnthralaleuhislysvalthrtyrleuglnasn145150155160glylysglyarglystyrphehishisasnseraspphetyrilepro165170175lysalathrleulysaspserglysertyrphecysargglyleuval180185190glyserlysasnvalsersergluthrvalasnilethrilethrgln195200205glyglyhishishishishishis210215<210>5<211>216<212>prt<213>人工序列(artificialsequence)<220><223>fcr35c<400>5metlysilelysthrglyalaargileleualaleuseralaleuthr151015thrmetmetpheseralaseralaleualalysilegluglualamet202530glymetargthrglyaspmetprolysalagluvalileleuglupro354045protrpasnargvalleugluglnaspservalthrleulyscysarg505560glyalahisserproaspaspaspserthrglntrpphehisasnglu65707580serleuileproserglnalaserserpheileileaspseralaser859095valgluaspserglyglutyrargcysglnthrserleuserthrleu100105110sergluprovalleuleugluvalhisileglytrpleuleuleugln115120125alaproargtrpgluphevalgluglygluproilehisleuargcys130135140hissertrpargasnthralaleuhislysvalmetpheleuglnasn145150155160glylysvalarglystyrphehishisasnseraspphevalilepro165170175lysalathrleugluaspserglysertyrsercysargglyleuval180185190glyarglysasnvalserserglualavalgluilethrvalthrpro195200205glyglyhishishishishishis210215<210>6<211>648<212>dna<213>人工序列(artificialsequence)<220><223>编码fcr35c的多核苷酸<400>6atgaaaataaaaacaggtgcacgcatcctcgcattatccgcattaacgacgatgatgttt60tccgcctcggctctcgccaaaatcgaagaagccatgggcatgcgtaccggagatatgccg120aaagcggaggtgattctggaaccgccgtggaatcgcgtgctggagcaagattcagtgacc180cttaaatgccggggcgcgcatagcccggatgatgacagcacccagtggttccacaatgaa240agcctgattcccagccaggcgagcagcttcattattgattcggcgtcggtggaagatagc300ggcgaatatcgttgccagaccagcctgagcaccctgagcgaaccggtgctgctggaggtg360cacatcgggtggcttctgttacaggctccacggtgggagttcgtagagggggaaccgatt420catctgcggtgtcactcctggaggaataccgccctgcataaagtgatgttcctgcaaaac480ggcaaggtccgcaagtatttccaccacaactccgacttcgttattcccaaagcgacgctg540gaggacagcggcagctattcctgccgtgggctggtgggcagaaaaaatgtgagcagcgag600gccgtggaaattaccgttaccccagggggccatcatcatcatcatcat648<210>7<211>216<212>prt<213>人工序列(artificialsequence)<220><223>fcr35d<400>7metlysilelysthrglyalaargileleualaleuseralaleuthr151015thrmetmetpheseralaseralaleualalysilegluglualamet202530glymetargthrglyaspmetprolysalagluvalileleuglupro354045protrpasnargvalleugluglnaspservalthrleulyscysarg505560glyalahisserproaspaspaspserthrglntrpphehisasnglu65707580argleuileproserglnalaserserpheileileaspseralaser859095valaspaspserglyglutyrargcysglnthrserleuserthrleu100105110seraspprovalglnleugluvalhisileglytrpleuleuleugln115120125alaproargtrpgluphevalgluglygluproilehisleuargcys130135140hissertrpargasnthralaleuhislysvalmetpheleuglnasn145150155160glylysvalarglystyrphehishisasnseraspphevalilepro165170175lysalathrleugluaspserglysertyrsercysargglyleuval180185190glyarglyslysvalserserglyalavalaspilethrvalthrgln195200205glyglyhishishishishishis210215<210>8<211>648<212>dna<213>人工序列(artificialsequence)<220><223>编码fcr35d的多核苷酸<400>8atgaaaataaaaacaggtgcacgcatcctcgcattatccgcattaacgacgatgatgttt60tccgcctcggctctcgccaaaatcgaagaagccatgggcatgcgtaccggagatatgccg120aaagcggaggtgattctggaaccgccgtggaatcgcgtgctggagcaagattcagtgacc180cttaaatgccggggcgcgcatagcccggatgatgacagcacccagtggttccacaatgaa240cgcctgattcccagccaggcgagcagcttcattattgattcggcgtcggtggatgatagc300ggcgaatatcgttgccagaccagcctgagcaccctgagcgatccggtgcagctggaggtg360cacatcgggtggcttctgttacaggctccacggtgggagttcgtagagggggaaccgatt420catctgcggtgtcactcctggaggaataccgccctgcataaagtgatgttcctgcaaaac480ggcaaggtccgcaagtatttccaccacaactccgacttcgttattcccaaagcgacgctg540gaggacagcggcagctattcctgccgtgggctggtgggcagaaaaaaggtgagcagcggg600gccgtggacattaccgttacccaagggggccatcatcatcatcatcat648<210>9<211>216<212>prt<213>人工序列(artificialsequence)<220><223>fcr36i<400>9metlysilelysthrglyalaargileleualaleuseralaleuthr151015thrmetmetpheseralaseralaleualalysilegluglualamet202530glymetargthrglyaspmetprolysalagluvalileleuglupro354045protrpasnargvalleugluglnaspservalthrleulyscysarg505560glyalahisserproaspaspaspserthrglntrpphehisasnglu65707580argleuileproserglnalaserserpheileileaspseralaser859095valaspaspserglyglutyrargcysglnthrserleuserthrleu100105110seraspprovalglnleugluvalhisileglytrpleuleuleugln115120125alaproargtrpgluphevalgluglygluproilehisleuargcys130135140hissertrpargasnthralaleuhislysvalmetpheleuglnasn145150155160glylysvalarglystyrphehishisasnseraspphevalilepro165170175lysalathrleugluaspserglysertyrsercysargglyleuile180185190glyarglyslysvalserserglyalavalaspilethrvalthrgln195200205glyglyhishishishishishis210215<210>10<211>648<212>dna<213>人工序列(artificialsequence)<220><223>编码fcr36i的多核苷酸<400>10atgaaaataaaaacaggtgcacgcatcctcgcattatccgcattaacgacgatgatgttt60tccgcctcggctctcgccaaaatcgaagaagccatgggcatgcgtaccggagatatgccg120aaagcggaggtgattctggaaccgccgtggaatcgcgtgctggagcaagattcagtgacc180cttaaatgccggggcgcgcatagcccggatgatgacagcacccagtggttccacaatgaa240cgcctgattcccagccaggcgagcagcttcattattgattcggcgtcggtggatgatagc300ggcgaatatcgttgccagaccagcctgagcaccctgagcgatccggtgcagctggaggtg360cacatcgggtggcttctgttacaggctccacggtgggagttcgtagagggggaaccgatt420catctgcggtgtcactcctggaggaataccgccctgcataaagtgatgttcctgcaaaac480ggcaaggtccgcaagtatttccaccacaactccgacttcgttattcccaaagcgacgctg540gaggacagcggcagctattcctgccgtgggctgattggcagaaaaaaggtgagcagcggg600gccgtggacattaccgttacccaagggggccatcatcatcatcatcat648<210>11<211>216<212>prt<213>人工序列(artificialsequence)<220><223>fcr36a<400>11metlysilelysthrglyalaargileleualaleuseralaleuthr151015thrmetmetpheseralaseralaleualalysilegluglualamet202530glymetargthrglyaspmetprolysalagluvalileleuglupro354045protrpasnargvalleugluglnaspservalthrleulyscysarg505560glyalahisserproaspaspaspserthrglntrpphehisasnglu65707580argleuileproserglnalaserserpheileileaspseralaser859095valaspaspserglyglutyrargcysglnthrserleuserthrleu100105110seraspprovalglnleugluvalhisileglytrpleuleuleugln115120125alaproargtrpgluphevalgluglygluproilehisleuargcys130135140hissertrpargasnthralaleuhislysvalmetpheleuglnasn145150155160glylysvalarglystyrphehishisasnseraspphevalilepro165170175lysalathrleugluaspserglysertyrsercysargglyleuala180185190glyarglyslysvalserserglyalavalaspilethrvalthrgln195200205glyglyhishishishishishis210215<210>12<211>648<212>dna<213>人工序列(artificialsequence)<220><223>编码fcr36a的多核苷酸<400>12atgaaaataaaaacaggtgcacgcatcctcgcattatccgcattaacgacgatgatgttt60tccgcctcggctctcgccaaaatcgaagaagccatgggcatgcgtaccggagatatgccg120aaagcggaggtgattctggaaccgccgtggaatcgcgtgctggagcaagattcagtgacc180cttaaatgccggggcgcgcatagcccggatgatgacagcacccagtggttccacaatgaa240cgcctgattcccagccaggcgagcagcttcattattgattcggcgtcggtggatgatagc300ggcgaatatcgttgccagaccagcctgagcaccctgagcgatccggtgcagctggaggtg360cacatcgggtggcttctgttacaggctccacggtgggagttcgtagagggggaaccgatt420catctgcggtgtcactcctggaggaataccgccctgcataaagtgatgttcctgcaaaac480ggcaaggtccgcaagtatttccaccacaactccgacttcgttattcccaaagcgacgctg540gaggacagcggcagctattcctgccgtgggctggcgggcagaaaaaaggtgagcagcggg600gccgtggacattaccgttacccaagggggccatcatcatcatcatcat648<210>13<211>53<212>dna<213>人工序列(artificialsequence)<220><223>寡核苷酸<400>13catatgaaaataaaaacaggtgcacgcatcctcgcattatccgcattaacgac53<210>14<211>65<212>dna<213>人工序列(artificialsequence)<220><223>寡核苷酸<400>14cccaagcttatccgcaggtatcgttgcggcacccttgggtaacggtaatgtccacggccc60cgctg65<210>15<211>19<212>dna<213>人工序列(artificialsequence)<220><223>寡核苷酸<400>15tgtggtatggctgtgcagg19<210>16<211>18<212>dna<213>人工序列(artificialsequence)<220><223>寡核苷酸<400>16tcggcatggggtcaggtg18<210>17<211>207<212>prt<213>人工序列(artificialsequence)<220><223>fcr36i_cys<400>17metlystyrleuleuserthralaalaalaglyleuleuleuleuala151015alaglnproalametalametglymetargthrglyaspmetprolys202530alagluvalileleugluproprotrpasnargvalleugluglnasp354045servalthrleulyscysargglyalahisserproaspaspaspser505560thrglntrpphehisasngluargleuileproserglnalaserser65707580pheileileaspseralaservalaspaspserglyglutyrargcys859095glnthrserleuserthrleuseraspprovalglnleugluvalhis100105110ileglytrpleuleuleuglnalaproargtrpgluphevalglugly115120125gluproilehisleuargcyshissertrpargasnthralaleuhis130135140lysvalmetpheleuglnasnglylysvalarglystyrphehishis145150155160asnseraspphevalileprolysalathrleugluaspserglyser165170175tyrsercysargglyleuileglyarglyslysvalserserglyala180185190valaspilethrvalthrglnglycysargasnaspthrcysgly195200205<210>18<211>621<212>dna<213>人工序列(artificialsequence)<220><223>编码fcr36i_cys的多核苷酸<400>18atgaaatacctgctgtcgaccgctgctgctggtctgctgctcctcgctgcccagccggcg60atggccatgggcatgcgtaccggagatatgccgaaagcggaggtgattctggaaccgccg120tggaatcgcgtgctggagcaagattcagtgacccttaaatgccggggcgcgcatagcccg180gatgatgacagcacccagtggttccacaatgaacgcctgattcccagccaggcgagcagc240ttcattattgattcggcgtcggtggatgatagcggcgaatatcgttgccagaccagcctg300agcaccctgagcgatccggtgcagctggaggtgcacatcgggtggcttctgttacaggct360ccacggtgggagttcgtagagggggaaccgattcatctgcggtgtcactcctggaggaat420accgccctgcataaagtgatgttcctgcaaaacggcaaggtccgcaagtatttccaccac480aactccgacttcgttattcccaaagcgacgctggaggacagcggcagctattcctgccgt540gggctgattggcagaaaaaaggtgagcagcggggccgtggacattaccgttacccaaggg600tgccgcaacgatacctgcgga621<210>19<211>254<212>prt<213>智人(homosapiens)<300><308>genbankaah17865.1<400>19mettrpglnleuleuleuprothralaleuleuleuleuvalserala151015glymetargthrgluaspleuprolysalavalvalpheleuglupro202530glntrptyrargvalleuglulysaspservalthrleulyscysgln354045glyalatyrserprogluaspasnserthrglntrpphehisasnglu505560serleuileserserglnalasersertyrpheileaspalaalathr65707580valaspaspserglyglutyrargcysglnthrasnleuserthrleu859095seraspprovalglnleugluvalhisileglytrpleuleuleugln100105110alaproargtrpvalphelysglugluaspproilehisleuargcys115120125hissertrplysasnthralaleuhislysvalthrtyrleuglnasn130135140glylysglyarglystyrphehishisasnseraspphetyrilepro145150155160lysalathrleulysaspserglysertyrphecysargglyleuval165170175glyserlysasnvalsersergluthrvalasnilethrilethrgln180185190glyleualavalserthrileserserphepheproproglytyrgln195200205valserphecysleuvalmetvalleuleuphealavalaspthrgly210215220leutyrpheservallysthrasnileargserserthrargasptrp225230235240lysasphislysphelystrparglysaspproglnasplys245250<210>20<211>216<212>prt<213>人工序列(artificialsequence)<220><223>fcr9<400>20metlysilelysthrglyalaargileleualaleuseralaleuthr151015thrmetmetpheseralaseralaleualalysilegluglualamet202530glymetargthrgluaspleuprolysalagluvalileleuglupro354045glntrpasnargvalleuglulysaspservalthrleulyscysarg505560glyalatyrserprogluaspasnserthrglntrpphehisasnglu65707580serleuileserserglnalasersertyrleuileaspalaalathr859095valaspaspserglyglutyrargcysglnthrserleuserthrleu100105110seraspprovalglnleugluvalhisileglytrpleuleuleugln115120125alaproargtrpgluphelysgluglyaspproilehisleuargcys130135140hissertrplysasnthralaleuhislysvalthrtyrleuglnasn145150155160glylysglyarglystyrphehishisasnseraspphetyrilepro165170175lysalathrleulysaspserglysertyrsercysargglyleuval180185190glyserlysasnvalsersergluthrvalasnilethrilethrgln195200205glyglyhishishishishishis210215<210>21<211>648<212>dna<213>人工序列(artificialsequence)<220><223>编码fcr9的多核苷酸<400>21atgaaaataaaaacaggtgcacgcatcctcgcattatccgcattaacgacgatgatgttt60tccgcctcggctctcgccaaaatcgaagaagccatgggcatgcgtaccgaagatctgccg120aaagcggaggtgattctggaaccgcagtggaatcgcgtgctggagaaagattctgtgacc180cttaaatgccggggcgcgtatagcccggaagataacagcacccagtggttccacaatgaa240agcctgatttccagccaggcgagcagctaccttattgatgcggcgacggtggatgatagc300ggcgaatatcgttgccagaccagcctgagcaccctgagcgatccggtgcagctggaggtg360cacatcgggtggcttctgttacaggctccacggtgggagttcaaagagggggatccgatt420catctgcggtgtcactcctggaagaataccgccctgcataaagtgacctacctgcaaaac480ggcaagggccgcaagtatttccaccacaactccgacttctatattcccaaagcgacgctg540aaggacagcggcagctattcctgccgtgggctggtgggcagcaaaaatgtgagcagcgag600accgtgaatattaccattacccaagggggccatcatcatcatcatcat648<210>22<211>30<212>dna<213>人工序列(artificialsequence)<220><223>寡核苷酸<220><221>misc_feature<222>(15)..(16)<223>n是a,c,g,或t<400>22catttttgctgccmnncagcccacggcagg30<210>23<211>30<212>dna<213>人工序列(artificialsequence)<220><223>人工序列(artificialsequence)<220><221>misc_feature<222>(15)..(16)<223>n是a,c,g,或t<400>23cctgccgtgggctgnnkggcagcaaaaatg30<210>24<211>216<212>prt<213>人工序列(artificialsequence)<220><223>fcr9_i<400>24metlysilelysthrglyalaargileleualaleuseralaleuthr151015thrmetmetpheseralaseralaleualalysilegluglualamet202530glymetargthrgluaspleuprolysalagluvalileleuglupro354045glntrpasnargvalleuglulysaspservalthrleulyscysarg505560glyalatyrserprogluaspasnserthrglntrpphehisasnglu65707580serleuileserserglnalasersertyrleuileaspalaalathr859095valaspaspserglyglutyrargcysglnthrserleuserthrleu100105110seraspprovalglnleugluvalhisileglytrpleuleuleugln115120125alaproargtrpgluphelysgluglyaspproilehisleuargcys130135140hissertrplysasnthralaleuhislysvalthrtyrleuglnasn145150155160glylysglyarglystyrphehishisasnseraspphetyrilepro165170175lysalathrleulysaspserglysertyrsercysargglyleuile180185190glyserlysasnvalsersergluthrvalasnilethrilethrgln195200205glyglyhishishishishishis210215<210>25<211>648<212>dna<213>人工序列(artificialsequence)<220><223>编码fcr9_i的多核苷酸<400>25atgaaaataaaaacaggtgcacgcatcctcgcattatccgcattaacgacgatgatgttt60tccgcctcggctctcgccaaaatcgaagaagccatgggcatgcgtaccgaagatctgccg120aaagcggaggtgattctggaaccgcagtggaatcgcgtgctggagaaagattctgtgacc180cttaaatgccggggcgcgtatagcccggaagataacagcacccagtggttccacaatgaa240agcctgatttccagccaggcgagcagctaccttattgatgcggcgacggtggatgatagc300ggcgaatatcgttgccagaccagcctgagcaccctgagcgatccggtgcagctggaggtg360cacatcgggtggcttctgttacaggctccacggtgggagttcaaagagggggatccgatt420catctgcggtgtcactcctggaagaataccgccctgcataaagtgacctacctgcaaaac480ggcaagggccgcaagtatttccaccacaactccgacttctatattcccaaagcgacgctg540aaggacagcggcagctattcctgccgtgggctgattggcagcaaaaatgtgagcagcgag600accgtgaatattaccattacccaagggggccatcatcatcatcatcat648<210>26<211>216<212>prt<213>人工序列(artificialsequence)<220><223>fcr9_a<400>26metlysilelysthrglyalaargileleualaleuseralaleuthr151015thrmetmetpheseralaseralaleualalysilegluglualamet202530glymetargthrgluaspleuprolysalagluvalileleuglupro354045glntrpasnargvalleuglulysaspservalthrleulyscysarg505560glyalatyrserprogluaspasnserthrglntrpphehisasnglu65707580serleuileserserglnalasersertyrleuileaspalaalathr859095valaspaspserglyglutyrargcysglnthrserleuserthrleu100105110seraspprovalglnleugluvalhisileglytrpleuleuleugln115120125alaproargtrpgluphelysgluglyaspproilehisleuargcys130135140hissertrplysasnthralaleuhislysvalthrtyrleuglnasn145150155160glylysglyarglystyrphehishisasnseraspphetyrilepro165170175lysalathrleulysaspserglysertyrsercysargglyleuala180185190glyserlysasnvalsersergluthrvalasnilethrilethrgln195200205glyglyhishishishishishis210215<210>27<211>648<212>dna<213>人工序列(artificialsequence)<220><223>编码fcr9_a的多核苷酸<400>27atgaaaataaaaacaggtgcacgcatcctcgcattatccgcattaacgacgatgatgttt60tccgcctcggctctcgccaaaatcgaagaagccatgggcatgcgtaccgaagatctgccg120aaagcggaggtgattctggaaccgcagtggaatcgcgtgctggagaaagattctgtgacc180cttaaatgccggggcgcgtatagcccggaagataacagcacccagtggttccacaatgaa240agcctgatttccagccaggcgagcagctaccttattgatgcggcgacggtggatgatagc300ggcgaatatcgttgccagaccagcctgagcaccctgagcgatccggtgcagctggaggtg360cacatcgggtggcttctgttacaggctccacggtgggagttcaaagagggggatccgatt420catctgcggtgtcactcctggaagaataccgccctgcataaagtgacctacctgcaaaac480ggcaagggccgcaagtatttccaccacaactccgacttctatattcccaaagcgacgctg540aaggacagcggcagctattcctgccgtgggctggcgggcagcaaaaatgtgagcagcgag600accgtgaatattaccattacccaagggggccatcatcatcatcatcat648<210>28<211>216<212>prt<213>人工序列(artificialsequence)<220><223>fcr9_y<400>28metlysilelysthrglyalaargileleualaleuseralaleuthr151015thrmetmetpheseralaseralaleualalysilegluglualamet202530glymetargthrgluaspleuprolysalagluvalileleuglupro354045glntrpasnargvalleuglulysaspservalthrleulyscysarg505560glyalatyrserprogluaspasnserthrglntrpphehisasnglu65707580serleuileserserglnalasersertyrleuileaspalaalathr859095valaspaspserglyglutyrargcysglnthrserleuserthrleu100105110seraspprovalglnleugluvalhisileglytrpleuleuleugln115120125alaproargtrpgluphelysgluglyaspproilehisleuargcys130135140hissertrplysasnthralaleuhislysvalthrtyrleuglnasn145150155160glylysglyarglystyrphehishisasnseraspphetyrilepro165170175lysalathrleulysaspserglysertyrsercysargglyleutyr180185190glyserlysasnvalsersergluthrvalasnilethrilethrgln195200205glyglyhishishishishishis210215<210>29<211>648<212>dna<213>人工序列(artificialsequence)<220><223>编码fcr9_y的多核苷酸<400>29atgaaaataaaaacaggtgcacgcatcctcgcattatccgcattaacgacgatgatgttt60tccgcctcggctctcgccaaaatcgaagaagccatgggcatgcgtaccgaagatctgccg120aaagcggaggtgattctggaaccgcagtggaatcgcgtgctggagaaagattctgtgacc180cttaaatgccggggcgcgtatagcccggaagataacagcacccagtggttccacaatgaa240agcctgatttccagccaggcgagcagctaccttattgatgcggcgacggtggatgatagc300ggcgaatatcgttgccagaccagcctgagcaccctgagcgatccggtgcagctggaggtg360cacatcgggtggcttctgttacaggctccacggtgggagttcaaagagggggatccgatt420catctgcggtgtcactcctggaagaataccgccctgcataaagtgacctacctgcaaaac480ggcaagggccgcaagtatttccaccacaactccgacttctatattcccaaagcgacgctg540aaggacagcggcagctattcctgccgtgggctgtatggcagcaaaaatgtgagcagcgag600accgtgaatattaccattacccaagggggccatcatcatcatcatcat648当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1