具有增加的对于表皮生长因子受体的亲和力的抗体及其衍生片段的制作方法
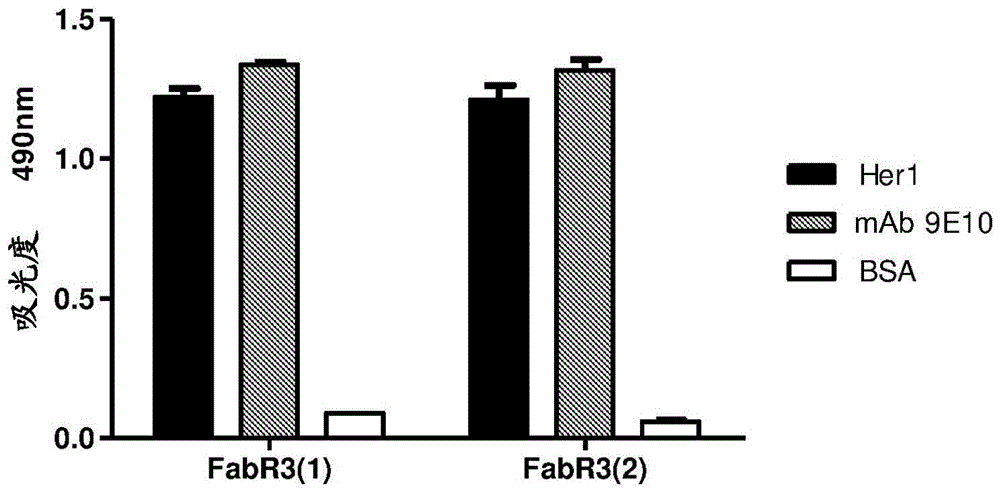
本发明涉及生物技术和医学领域,特别地涉及单克隆抗体(mab)尼妥珠单抗的变体和衍生自其的抗原结合片段,其在重链可变区的cdr1和cdr2中具有突变并且以更高的亲和力识别人表皮生长因子受体(egfr)的胞外区;以及其诊断和治疗应用。现有技术egfr是一种跨膜糖蛋白,其具有与配体相结合的胞外区和有着酪氨酸激酶活性的胞内区。其配体包括:表皮生长因子(egf)、双调蛋白、转化生长因子、β-动物纤维素(betacellulin)、表皮调节蛋白(epiregulin)和具有肝素结合位点的egf样生长因子(olayioye,m.等人,theembojournal.19:3159-3167,2000;yarden,y.和sliwkowski,m.,naturereviews.2:127-137,2001)。配体与受体的结合诱导在该受体的胞外区中的构象变化和安排,其引起该受体的二聚化和激活(ogiso,h.等人,cell.110:775-787,2002)。该受体牵涉对于上皮细胞的维持和存活做出贡献的各种不同的细胞过程。但是,由于过表达或组成性激活而导致的egfr/egf途径的失调促进肿瘤细胞增殖、侵入,并且这与许多恶性肿瘤的差的预后相关联(yarden,y.和sliwkowski,m.,naturereviews.2:127-137,2001)。由于这样的原因,egfr被认为是对于开发抗肿瘤疗法来说非常重要的肿瘤相关抗原(ag)。目前,市场上存在三种特异于egfr的mab:西妥昔单抗(erbitux)、帕尼单抗(vectibix)和尼妥珠单抗(theracim)(reichert,j.,mabs.4:413-415,2012),而其他七种处于i-iii期临床试验中(reichert,j.和dhimolea,e.,drugdiscoverytoday.17:954-963,2012)。它们特别地被设计成用于识别egfr的胞外区,竞争性地抑制配体的结合和受体的二聚化,这将会抑制导致受体激活的自身磷酸化和信号传导级联(burgess,a.等人,molecularcell,12:541-552,2003)。尼妥珠单抗(mabr3)是识别人egfr的igg1同种型的人源化mab,其通过克隆ioregf/r3小鼠的mab的高变区以及人来源的重链和轻链的可变区和恒定区的构架(分别rei和newn)的dna来获得(mateo,c.等人,immunotechnology.3:71-81,1997)。mabr3以与其小鼠前驱物相似的亲和力识别egfr并且具有相同的抑制egf与受体结合的能力。该变体的免疫原性比嵌合形式的mabioregf/r3小(mateo,c.等人,immunotechnology.3:71-81,1997)。尼妥珠单抗识别在egfr的胞外区的结构域iii中的表位,其与在该结构域中的配体结合位点相叠盖,这解释了其阻断配体结合和随后的受体激活的能力(tundidor,y.等人,mabs.6:1013-1025,2014)。在临床试验中,在具有头颈肿瘤(crombet,t.等人,jclinoncol22:1646-1654,2004)、神经胶质瘤(ramos,t.等人.cancerbiolther.5:375-379,2006;mabdonald,t.等人,neurooncol.13:1049-1058,2011)和食管肿瘤(ramos-suzarte,m.等人,cancerbiology&therapy13:600-605,2012)的患者中已经证明了尼妥珠单抗的功效。该抗体(ab)处于对于鼻咽癌、局部晚期食管癌和食管鳞状细胞癌的iii期临床试验中(galluzzi,l.等人,oncoimmunology.1:28-37,2012)。与其他针对egfr的ab不同,无论在绿长尾猴(cercopithecusaethiopssabaeus)中的临床前研究中(arteaga,m.等人,cancerbiology&therapy.6:1390-1395,2007),还是在临床研究中(crombet,t.等人,jclinoncol22:1646-1654,2004;ramos,t.等人.cancerbiolther.5:375-379,2006;ramos-suzarte,m.等人,cancerbiology&therapy13:600-605,2012;strumberg,d.等人,investnewdrugs.30:1138-1143,2010),尼妥珠单抗都未显示出通常与针对该ag的药物相关联的严重毒性的迹象。这些证据使它成为唯一的可以长期使用的抗-egfr试剂(allan,d.,theoncologist.10:760-761,2005)。该mab的低毒性特性谱(但具有抗肿瘤效应)可能归因于其中等程度的亲和力(10-8)(crombet,t.等人,jclinoncol22:1646-1654,2004)。作者预测,具有中等程度的亲和力的mab应当具有高的抗肿瘤效应和低的毒性,因为有利于ab被肿瘤组织(egfr的高表达)结合,超过被正常组织(egfr的低表达)结合。另一方面,具有高亲和力的mab(例如西妥昔单抗)可能既被肿瘤细胞也被正常细胞所捕获;和具有低亲和力的mab由于在肿瘤中的低掺入而可能具有低的效应(crombet,t.等人,jclinoncol22:1646-1654,2004)。但是,已经描述了,尼妥珠单抗的抗肿瘤效应取决于egfr的表达,因为在具有该受体的中等或低表达的肿瘤中其功效降低(akashi,y.等人,britishjournalofcancer.98:749-755,2008)。因此,获得具有其对于该受体的亲和力的中等增加的尼妥珠单抗的变体可能转变为具有更大抗肿瘤效应并且保持低毒性的抗体(ab)。从尼妥珠单抗开始获得该具有中等程度的亲和力的变体,同时保持其精细表位特异性(其在针对egfr的治疗性ab中是独特的)(tundidor,y.等人,mabs.6:1013-1025,2014),将会对于保存原始抗体的有价值的特性做出贡献。ab的亲和力成熟是以自然形式发生的过程;并且随着组合生物学的发展,已在实验室中再现了该现象。这些定向进化技术需要各种不同的步骤:突变、展示、选择和扩增(wark,k.和hudson,p.,advanceddrugdeliveryreviews.58:657-670,2006)。噬菌体展示技术提供了用于产生新型人ab和用于在体外改善其亲和力的强有力的平台(hoogenboom,h.,natbiotechnol.23:1105-1116,2005)。本发明的发明人发现了在噬菌体上展示的尼妥珠单抗的突变型变体,其具有在其结合人egfr的胞外区的能力方面的增加。所述变体所具有的一整套突变以前未曾描述过,也不是从尼妥珠单抗的fab的晶体结构的分析开始可预测的。因此,本发明的新颖性在于提供了以更高的亲和力(3至4倍)识别人egfr的新型片段和mab,因此可以以比尼妥珠单抗更高的效率识别具有中等egfr表达的细胞系。同样地,这些mab具有相比于尼妥珠单抗而言更大的抑制由配体介导的egfr磷酸化的能力,这表明它们具有比尼妥珠单抗更大的抗肿瘤效应。所有上述这些允许在诊断或治疗具有中等egfr表达的肿瘤中使用这些片段和mab。发明简述本发明涉及重组mab,其识别人egfrher1的胞外区并且相对于抗体尼妥珠单抗而言具有大于95%的同一性。在一个实施方案中,本发明涉及mab,其中重链可变区的cdr2的互补性决定区(cdr)的序列选自包括下列各项的组:-seqidno.20,和-seqidno.21,重链的cdr1和cdr3的序列分别为seqidno.9和seqidno.3,并且轻链可变区的cdr的序列为:-cdr1seqidno.22,-cdr2seqidno.23,-cdr3seqidno.24。在另一个实施方案中,本发明的重组mab的特征在于,重链可变区的cdr2的序列选自包括下列各项的组:-seqidno.10,-seqidno.11,-seqidno.12,-seqidno.17,-seqidno.18,和-seqidno.29,在所述重链中cdr1的序列为seqidno.9且cdr3的序列为seqidno.3,并且轻链可变区的cdr的序列为:-cdr1seqidno.22,-cdr2seqidno.23,-cdr3seqidno.24。本发明的另一个实施方案涉及mab,其中重链可变区的cdr2的序列选自包括下列各项的组:-seqidno.2,和-seqidno.8,重链的cdr1和cdr3的序列分别为seqidno.1和seqidno.3,并且轻链可变区的cdr的序列为:-cdr1seqidno.22,-cdr2seqidno.23,-cdr3seqidno.24。在一个另外的实施方案中,本发明的mab的特征在于,重链可变区的cdr1的序列选自包括下列各项的组:-seqidno.13,和-seqidno.19,重链的cdr2和cdr3的序列分别为seqidno.14和seqidno.3,并且轻链可变区的cdr的序列为:-cdr1seqidno.22,-cdr2seqidno.23,-cdr3seqidno.24。特别地,本发明涉及mab,其特征在于,其具有下列的重链和轻链可变区序列:重链-cdr1seqidno.15,-cdr2seqidno.16,-cdr3seqidno.3;轻链-cdr1seqidno.22,-cdr2seqidno.23,-cdr3seqidno.24。本发明包括所有上述的mab,其中重链和轻链可变区的构架区(fw)具有下列序列:重链-fw1seqidno.4,-fw2seqidno.5,-fw3seqidno.6,-fw4seqidno.7;轻链-fw1seqidno.25,-fw2seqidno.26,-fw3seqidno.27,-fw4seqidno.28。另外,所公开的ab包含人igg1恒定区(对于重链)和人κ链(对于轻链)。在一个特别的实施方案中,本发明涉及衍生自上述ab的片段,其中所述片段可以是fab、(fab)2类型的,和单链可变区片段。在另一个实施方案中,本发明涉及在治疗癌症中有用的药用组合物,其具有在50-400mg范围内的所公开的mab或片段作为活性成分,以及在药学上可接受的载料。另外,本发明涉及在诊断肿瘤中有用的药用组合物,其具有在1-9mg范围内的所公开的mab或片段作为活性成分,以及在药学上可接受的载料。在另一个实施方案中,本发明涉及所公开的mab和片段在治疗表达egfr的肿瘤中的用途;以及在诊断携带egfr的肿瘤中的用途,当与合适的标记物相缀合时。本发明还涉及这些mab和片段用于引导免疫应答针对egfr阳性肿瘤的用途,当与具有免疫学意义的蛋白质或蛋白质结构域相缀合时。发明详述具有增加的与人egfr的胞外区结合的能力的衍生自尼妥珠单抗的片段的获得本发明涉及13种衍生自尼妥珠单抗的片段,其与尼妥珠单抗的氨基酸序列具有大于97%的同一性并且具有增加的与人egfr的胞外区结合的能力。在本发明中所描述的变体的突变导致获得尼妥珠单抗的变体,其具有相比于尼妥珠单抗的原始fab而言识别更多数目的具有中等egfr表达的人细胞的能力。在本发明中所描述的片段可以通过下述方式来获得:从在丝状噬菌体上展示的多于107个分子的文库开始,依靠其与人egfr的胞外区结合的能力来选择尼妥珠单抗的fab的突变型变体。可以将相应于所述变体的基因插入到噬菌粒类型的表达载体中(与编码丝状噬菌体的衣壳蛋白的基因之一相融合),并且用于产生在其表面上表达蛋白质变体的病毒颗粒。起始文库可以在互补性决定区(cdr)的一整套位置处包括不同程度的多样化,这将会允许详尽探查对于ag-ab相互作用来说在功能上重要的该区域。在这些位置处的原始残基中的每一个可以被20种氨基酸的混合物替代,被预先确定的一整套的共享某种(某些)物理化学特性例如疏水性、芳香特征、净电荷和/或大小的残基替代,或者经历通过在相应密码子的每一个位置处引入较小比例的随机核苷酸混合物来进行的温和随机化(这将会保留原始序列的优势)。所选择的位置可以同时地在同一个文库中或在几个分开的文库中进行多样化。这些文库可以包含可变比例的相对于原始尼妥珠单抗的fab而言具有一个或几个突变(保守或非保守的)的分子。具有增加的与人egfr的胞外区结合的能力的尼妥珠单抗的类似的片段和mab的选择展示出具有增加的与人egfr的胞外区结合的能力的变体的噬菌体的选择可以基于下列步骤:与固定在固体表面上的ag人egfr相接触地温育来源于文库的噬菌体混合物,通过洗涤来去除未结合的噬菌体,并且在干扰蛋白质相互作用的条件下洗脱出经结合的噬菌体。可以在相似的条件下进行连续的几轮选择。对插入到经选择的噬菌粒中的dna序列的分析可以揭示出这样的规律性,其导致鉴定出那些最丰富并且可能与egfr结合能力的增加相关的置换。所发现的频发突变,无论是独个修饰还是直接从文库中选择的变化的组合,都可以相互组合为新型变体以获得egfr结合能力的额外增加。直接从文库中选择的或者后来设计和构建的变体中的每一种变体的与人egfr结合的能力可以通过免疫化学技术来进行评价,其中利用允许同时表征多个变体的噬菌体展示形式。备选地,本发明的片段可以通过利用其他的组合生物学平台来获得,例如展示在核糖体或酵母上。另外,可以将编码新型可变区的基因克隆到哺乳动物细胞表达载体中,并且以重组方式产生包含新突变的完整mab。同样地,可以证实,以这种形式,所获得的mab保留了相比于尼妥珠单抗而言更多地识别人egfr的胞外区的能力,通过基于表面等离子体共振(biacore)的亲和力测量。衍生自尼妥珠单抗的新型mab和片段的功能优越性的证明可以在体外或体内测定法中证明直接从文库中选择的或者后来构建的片段变体中的每一种(以片段或完整ab的形式)的功能优越性。对于每一种变体,可以通过流式细胞术来评价对于具有各种不同的egfr表达的细胞系的识别,其中证实了新型变体识别更高百分比的阳性细胞并且具有更高的平均荧光强度;并且该效应在具有中等或低的egfr表达的细胞系中更明显。为此,可以使用下列细胞系,其:-具有高的egfr表达:人来源的表皮样癌a431、人来源的具有胸膜液转移的乳房腺癌mda-mb-468,但不局限于这些;-具有中等的egfr表达:人来源的肺腺癌h125和h292,但不局限于这些;-具有低的egfr表达:人来源的小细胞肺癌u1906、人来源的乳房腺癌mda-mb-231、卵巢癌skov3、乳腺癌skbr3,但不局限于这些。对于每种mab或片段,还可以评价抑制由其配体(egf)介导的egfr磷酸化的能力,以各种不同的浓度和在具有各种不同的egfr表达的细胞系中。还可以在具有各种不同的受体表达的细胞系中进行用阿尔玛蓝(alamarblue)的增殖抑制测定法。另外,可以在具有各种不同的受体表达的细胞系中测定每种mab诱导抗体依赖性细胞毒性的能力。在所有情况下,可以预期具有较高亲和力的变体具有更好的效应并且其在具有中等或低的egfr表达的细胞系中将会更加明显。另一方面,可以在携带具有各种不同的egfr表达的人肿瘤的无胸腺小鼠中测量所述mab或片段的抗肿瘤效应,其中测量肿瘤生长的延迟。另外,可以用放射性同位素或用荧光团标记所述片段或mab,并且接种在携带具有各种不同的egfr表达的人肿瘤的无胸腺小鼠中。这使得能够评价所述片段在体内检测肿瘤识别的能力,这确证了其作为用于通过获得图像来诊断癌症的工具的用途。新型mab和衍生片段的治疗应用和治疗方法本发明中所获得的新型mab和片段具有比尼妥珠单抗更高的亲和力,这使得在其中尼妥珠单抗具有局限的场景中使用它们成为可能,例如具有低或中等的egfr表达的细胞的情况。所述mab可以应用于治疗具有头颈肿瘤、神经胶质瘤、食管肿瘤、肺肿瘤和胰腺肿瘤的患者。对于其治疗用途,所述mab和片段应当以独立的或者与用于治疗癌症的常规疗法例如放射性疗法或化学疗法相组合的形式施用给携带疾病的受试者,以增强其治疗作用。施用途径可以为在现有技术中对于药物的肠胃外施用所描述的那些中的任何一种,优选地通过静脉内或皮下途径。为了获得所希望的治疗效果,本发明的mab和片段应当以在对于其来说具有抗肿瘤效应而无毒性表现的浓度范围内的剂量进行施用。待使用的剂量范围可以在6个周治疗周期中在50mg-400mg/患者之间变动。可以将用具有更高亲和力的新型变体进行的治疗调整至较低剂量并且保持与尼妥珠单抗相似的效果,或者可以使用显示出更大的抗肿瘤效应的对于尼妥珠单抗所推荐的剂量(200mg),这将会取决于新型mab和片段的毒性特性谱。本发明的mab和片段,在与放射性同位素或荧光团相缀合时,可以具有用于诊断egfr阳性肿瘤的应用;由于其具有更高的亲和力和识别具有中等或低的egfr表达的细胞的能力,因而在诊断具有该特征的肿瘤中相对于尼妥珠单抗而言具有优点。为了使用它们作为检测工具,在携带肿瘤的患者中施用这些mab和片段,以通过影像学来鉴定肿瘤位置或可能的egfr阳性转移。与放射性同位素或荧光团相缀合的mab和片段应当以在这样的浓度范围内的剂量来进行施用,对于所述浓度来说,在组织中分布和其消除的动力学使得高质量影像的快速获得成为可能。该范围可以为0.5mg-9mg/患者,优选地3mg。另外,可以将在本发明中所描述的片段与具有免疫学意义的蛋白质或蛋白质结构域相融合,目的是将免疫应答引导向egfr阳性肿瘤细胞。该应用具有这样的优点,即通过将应答集中在肿瘤位点处来组合分开的两种疗法的潜力;fab片段提供对于表达该ag的肿瘤细胞的特异性,而融合的蛋白质或蛋白质结构域发挥其免疫学作用,这可以具有优于单一疗法的效应。药用组合物将在本发明中所描述的mab和片段作为在治疗癌症中有用的药用组合物的一部分来进行施用。优选地,本发明包括药用组合物,其包含在药学上可接受的载料。在药学上可接受的载料包括但不限于:盐水溶液、磷酸盐缓冲盐水等。其他适合于向患者施用的缓冲试剂、分散剂和非毒性惰性物质也可以包括在本发明的组合物中。所述组合物通常是无菌的并且没有不希望的颗粒。将会用下面的实施例和附图来进一步阐述本发明。但是,这些实施例不应当被解释为对本发明的范围的限制。附图简述图1.通过elisa来评价在丝状噬菌体上展示的fabr3的识别。将经纯化的噬菌体的不同制备物调整至1012个病毒颗粒/ml的等价浓度。在490nm处测量吸光度。图2.通过elisa来评价在针对人egfr的胞外区进行三轮选择后fabr3文库的噬菌体混合物的反应性。将经纯化的噬菌体的不同制备物调整至1011个病毒颗粒/ml的等价浓度。在490nm处测量吸光度。图3.尼妥珠单抗以及在针对人egfr的胞外区进行三轮文库选择后具有独特序列的11种fabr3变体的重链可变区(vh)的三个cdr的氨基酸序列的比对。连字符表明,在该位置处保留了原始氨基酸。在括号中指明了序列重复的次数。图4.通过elisa来评价在针对人egfr的胞外区进行三轮选择后从温和随机化文库开始获得的具有独特序列的在噬菌体上的fabr3变体的识别。事先按照所展示的蛋白质的量来使噬菌体制备物标准化。(a)包括在组1中的变体,其仅在vh的cdr2中具有突变。(b)组2的变体,其在vh的cdr1和cdr2中具有突变。在490nm处测量吸光度。图5.从将cdr1的最频发的突变与组1的最佳fabr3变体的cdr2的突变相组合开始构建的在噬菌体上的fabr3变体。(a)原始尼妥珠单抗以及所构建的两种变体的vh的三个cdr的氨基酸序列的比对。(b)通过elisa来评价所构建的变体的识别。在490nm处测量吸光度。图6.细胞系h125的细胞被衍生自尼妥珠单抗的fab以及mabk4和k5的识别。(a)散点图,其中显示了所识别的egfr阳性细胞的百分比。(b)平均荧光强度的直方图(egfr阳性细胞)。图7.通过尼妥珠单抗以及mabk4和k5所诱导的对于由egf介导的egfr磷酸化的抑制。(a)细胞系h125,其具有中等的egfr表达。(b)细胞系mda-mb-468,其具有高的egfr表达。实施例实施例1:在丝状噬菌体m13上尼妥珠单抗的抗原结合片段(fabr3)的成功展示通过pcr来扩增侧翼分别为限制酶切位点apali/xhoi和sfii/bsteii的编码尼妥珠单抗的轻链可变区(vl)和重链可变区(vh)的基因。将这两个基因片段vl和vh都克隆到载体pces1中(dehaard,h.,methodsinmolecularbiology.178:87-100,2002),随后分别为编码κ轻链恒定区(ck)和重链恒定区(ch1)的基因。将编码ch1区的基因连接至编码标签肽c-myc的基因,和随后为iii基因。该遗传构建物编码衍生自尼妥珠单抗的抗原结合片段(fabr3)。用所得的遗传构建物转化大肠杆菌(escherichiacoli)这一物种的tg1菌株的感受态细菌,并且用于以50ml的规模产生和纯化展示出与病毒衣壳的p3蛋白相融合的fabr3的噬菌体(marks,j.等人,j.mol.biol.222:581-597,1991)。通过elisa来评价在经纯化的噬菌体上展示的分子的特异性识别(图1)。为此,用尼妥珠单抗的抗原即人egfr(her1)的胞外区(ramirez,b.等人,int.j.cancer.119:2190-2199,2006)、抗标签c-myc的mab9e10(centerofgeneticengineeringandbiotechnologyofsanctispiritus,cuba)和bsa(作为无关分子)包被聚苯乙烯平板(maxisorp,usa)。用与辣根过氧化物酶相缀合的抗-m13mab(gehealthcare,usa)和相应的酶底物来检测经结合的噬菌体。如在图1中所观察到的,fabr3以经正确折叠的方式展示在噬菌体上,这通过检测展示水平的mab9e10的识别来测量并且因为其保留了尼妥珠单抗特异性地识别her1的能力。实施例2:展示出具有更高的对于人egfr的胞外区的反应性的fabr3变体片段的丝状噬菌体的选择和表征设计了位于尼妥珠单抗的重链的三个cdr(根据mab定义)的突出区段中的25个残基的温和随机化策略。将它们中的大多数(24/25)用潜在地包含20种氨基酸(但是在文库的大部分分子中保留了原始残基)的混合物进行替代。为此目的,引入简并密码子,其在每个位置处以90%保持原始核苷酸,而其余的10%相应于其他三种核苷酸的等摩尔混合物。另一个残基(f29)仅用其他疏水残基(i、l、m、v)替代,虽然在文库的大多数分子中原始残基占优势。为此,在三联体的位置1和3处使用简并密码子,其以90%保持原始核苷酸(分别为t和c),而其余的10%相应于其他三种核苷酸的等摩尔混合物,三联体的第二个位置(t)不进行修饰。通过将可变区克隆到载体pces-1中来以fab形式构建所设计的文库。以这种方式构建了由1.5×107个成员组成的尼妥珠单抗的fab变体的文库。将从文库开始所产生的噬菌体根据以前所建立的程序通过用聚乙二醇进行沉淀来进行纯化(marks,j等人,j.mol.biol.222:581-597,1991)。为了分离具有更大的与其抗原结合的能力的在噬菌体上展示的fabr3的功能性突变型变体,在用her1包被的免疫试管(nunc,denmark)上温育所述病毒颗粒。在进行洗涤以去除未结合的噬菌体后,通过与三乙胺碱性溶液一起进行温育来洗脱经结合的噬菌体。用所选择的噬菌体(其用辅助噬菌体m13ko7进行扩增,并且用作新一轮选择的起始材料)感染tg1菌株的细菌。进行三轮噬菌体选择,其中显示了随着轮数增加噬菌体混合物对于her1的反应性增加(图2)。在来自第三轮选择的所选择的噬菌粒中所插入的基因的测序揭示了11个独特的序列,其被分入两个组(图3)。由其中仅cdr2被随机化的变体构成的第一组,和其中在cdr1和cdr2中出现了突变的第二组。实施例3:在丝状噬菌体上的fabr3的新型变体对于人egfr的胞外区的反应性增加的证明用包含不同于原始尼妥珠单抗的独特序列的从三轮选择得到的遗传构建物转化大肠杆菌这一物种的tg1菌株的感受态细菌。从这些开始,产生并纯化了展示出fabr3变体的噬菌体。为了测定这些新型变体对于her1的反应性,通过elisa来测定处于各种不同的病毒颗粒浓度的噬菌体制备物的识别。在所评价的不同浓度下,所评价的所有变体,6个仅在cdr2中具有突变(图4a)和5个在cdr1和cdr2中具有突变(图4b),都比原始fabr3具有更高的对于her1的反应性。另外,通过kunkel诱变构建了两种新型变体,其组合了引起反应性的最大增加的cdr2的突变与cdr1的最频发的突变(图5a)。通过elisa来评价这些新型变体的识别。所述突变的组合是相容的,因为这两种变体都显示出比在噬菌体上的原始fabr3更高的对于her1的反应性(图5b)。实施例4:以在高等细胞中所产生的可溶性蛋白质的形式的尼妥珠单抗的新型变体的亲和力增加的证明将编码尼妥珠单抗(mabr3)的原始vh的基因和编码在cdr1和cdr2中具有突变的尼妥珠单抗的两个构建变体的vh(其被命名为k4和k5)(如在实施例3中所描述的(图5a))的基因,以及编码尼妥珠单抗的原始κ轻链可变区(vk)的基因分别克隆到哺乳动物细胞表达载体psv-gpt和psv-hyg中(orlandi,r.等人,pnas.86:3833-3837,1989)。用pvui酶使掺入有目的基因的载体线性化,并且在乙醇存在下进行沉淀。将在磷酸盐缓冲盐水溶液中重构的dna用于对ns0细胞进行电穿孔。为了获得产生mabr3和两种变体mabk4和mabk5的克隆,共转染4μg的具有相应的vh的载体psv-gpt(表1)和8μg的原始尼妥珠单抗的载体psv-hyg-vk。用黄嘌呤、次黄嘌呤和霉酚酸作为选择药物来实施用于获得稳定克隆的程序。该方法使得能够获得三种目的分子,例如igg1同种型和κ轻链的ab。通过a蛋白亲和色谱法从上清液中纯化所产生的ab。表1.用于共转染ns0细胞以产生mabr3、k4和k5的vh和vl基因的描述psv-gpt-vhpsv-hyg-vkmabr3原始原始mabk4突变3as4+3as22原始mabk5突变3as4+3as30原始为了确定在噬菌体上获得的突变(其以该形式显示出更高的对于her1的反应性)是否在完整ab中引起相同的效应,决定通过biacore来测量亲和力。首先,通过用木瓜蛋白酶进行酶促消化和然后用a蛋白进行分离来获得衍生自mabr3、mabk4和mabk5的fab。如在表2中所显示的,新型mabk4和k5分别相对于mabr3而言显示出3和3.6倍的亲和力增加。表2.相对于尼妥珠单抗而言,mabk4和k5的亲和力的增加ka(1/ms)kd(1/s)kd(m)增加mabr31.879*10412.483*10-46.643*10-8-mabk42.743*1046.019*10-42.194*10-83xmabk53.305*1046.098*10-41.845*10-83.6x实施例5:衍生自在哺乳动物细胞中所产生的mabk4和k5的fab显示出比衍生自尼妥珠单抗的fab更高的对于肺腺癌人细胞系h125的识别测定衍生自mabk4和k5的fab识别her1分子的能力。在该情况下,在细胞系中(其天然情景)通过流式细胞术来评价her1的识别。为此,将1.25μg/ml的衍生自mabr3、mabk4和mabk5的fab与具有中等的受体表达的人来源的肺腺癌细胞h125一起进行温育。用与藻红蛋白相缀合的小鼠抗人κ轻链mab来检测与在细胞膜中的her1相结合的fab。如在图6a中所显示的,相比于衍生自mabr3的fab而言,衍生自mabk4和k5的fab识别更高百分比的her1阳性细胞并且具有更高的平均荧光强度(imf)(图6b)。实施例6:mabk4和k5的亲和力的增加转变成这些ab的更高的抑制由egf介导的egfr磷酸化的能力为了测定新型mab抑制由egf介导的磷酸化的能力,进行western印迹测定法。采用了两个细胞系:-人来源的肺腺癌h125,其具有中等的egfr表达,-人来源的具有胸膜液转移的乳房腺癌mda-mb-468,其具有高的egfr表达。用10μg/ml、5μg/ml和2.5μg/ml的mabr3、k4和k5处理细胞2小时。然后,撤走培养基以去除未与细胞结合的mab,添加具有人egf的新鲜培养基10分钟以诱导受体的磷酸化。接着,从这些经历了不同处理的细胞开始在ripa缓冲液中进行裂解。按照二辛可宁酸反应试剂盒(pierce)的说明书来定量蛋白质的浓度。在9%sds-page凝胶中施加25μg的裂解物蛋白质,并且将蛋白质转移至硝酸纤维素膜。为了检测经磷酸化的egfr(phospho-egfr),使用在兔中产生的抗-pegfr的一抗(y1068)。用与荧光团hrp相结合的抗兔二抗和随后的化学发光底物(pierce)来使蛋白质含量可视化。所述图显示了用phospho-egfr获得的信号,其指明了在细胞裂解物中该蛋白质的量。如在图7中所显示的,在所评价的所有浓度下,mabk4和k5在两个细胞系中都显示出相比于尼妥珠单抗而言更高的抑制由egf介导的egfr磷酸化的能力。甚至,在所评价的最低浓度下的这两种mab都具有比在所评价的最高浓度(4倍更浓)下的尼妥珠单抗更高或相同的效应。虽然对于所有mab,在具有更高的受体表达的细胞系mda-mb-468中抑制是更大的(图7b),但重要的是强调,mabk4和k5的抑制效应在具有较低的受体表达的细胞系中没有丧失(图7a),就像用尼妥珠单抗时所出现的。上面这些对于使用这些从在尼妥珠单抗的可变区中掺入突变(这转变为更高的对于其配体的亲和力和更高的生物学活性)开始而获得的新型mab提供了优点。序列表<110>centrodeinmunologiamolecular<120>具有增加的对于表皮生长因子受体的亲和力的抗体及其衍生片段<130>572017cu00<160>29<170>patentinversion3.5<210>1<211>10<212>prt<213>人工序列<220><223>通过dna重组技术<400>1glytyrthrphethrasptyrtyriletyr1510<210>2<211>18<212>prt<213>人工序列<220><223>通过dna重组技术<400>2glyglyileasnprothrserglyglyserasnpheasnglulysphe151015lysthr<210>3<211>14<212>prt<213>人工序列<220><223>通过dna重组技术<400>3thrargglnglyleutrppheaspseraspglyargglyphe1510<210>4<211>25<212>prt<213>人工序列<220><223>通过dna重组技术<400>4glnvalglnleuglnglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaser2025<210>5<211>13<212>prt<213>人工序列<220><223>通过dna重组技术<400>5trpvalargglnalaproglyglnglyleuglutrpile1510<210>6<211>30<212>prt<213>人工序列<220><223>通过dna重组技术<400>6argvalthrilethralaaspgluserserthrthralatyrmetglu151015leuserserleuargsergluaspthralaphetyrphecys202530<210>7<211>12<212>prt<213>人工序列<220><223>通过dna重组技术<400>7phetrpglyglnglythrthrvalthrvalserser1510<210>8<211>18<212>prt<213>人工序列<220><223>dna重组技术<400>8glyglyileasnprothrthrglyglyserasnpheasnglulysphe151015lysthr<210>9<211>10<212>prt<213>人工序列<220><223>通过dna重组技术<400>9glytyrthrphethrasntyrtyriletyr1510<210>10<211>18<212>prt<213>人工序列<220><223>通过dna重组技术<400>10glyglyileasnprothrthrhisalaglnalapheasnglulysphe151015lysthr<210>11<211>18<212>prt<213>人工序列<220><223>通过dna重组技术<400>11glyglyileasnproleuargglyglnalavalpheasnglulysphe151015lysthr<210>12<211>18<212>prt<213>人工序列<220><223>通过dna重组技术<400>12glyglyileasnproglnthrserglnasnhispheasnglulysphe151015lysthr<210>13<211>10<212>prt<213>人工序列<220><223>通过dna重组技术<400>13glytyrpropheserasntyrtyriletyr1510<210>14<211>18<212>prt<213>人工序列<220><223>通过dna重组技术<400>14glyglyileasnprothrserglyvalserasnpheasnglulysphe151015lysthr<210>15<211>10<212>prt<213>人工序列<220><223>通过dna重组技术<400>15glytyrasnphethrasptyrtyriletyr1510<210>16<211>18<212>prt<213>人工序列<220><223>通过dna重组技术<400>16glyglyileasnprothrserglyglyserhispheasnglulysphe151015lysthr<210>17<211>18<212>prt<213>人工序列<220><223>通过dna重组技术<400>17glyglyileasnproasnasnglnglnserhispheasnglulysphe151015lysthr<210>18<211>18<212>prt<213>人工序列<220><223>通过dna重组技术<400>18glyglyileasnprovalthrglnargprovalpheasnglulysphe151015lysthr<210>19<211>10<212>prt<213>人工序列<220><223>通过dna重组技术<400>19glytyrprophethrasntyrtyriletyr1510<210>20<211>18<212>prt<213>人工序列<220><223>通过dna重组技术<400>20glyglyileasnproasnasnglnglnserhispheasnglulysphe151015lysthr<210>21<211>18<212>prt<213>人工序列<220><223>通过dna重组技术<400>21glyglyileasnprovalthrglnargprovalpheasnglulysphe151015lysthr<210>22<211>16<212>prt<213>人工序列<220><223>通过dna重组技术<400>22argserserglnasnilevalhisserasnglyasnthrtyrleuasp151015<210>23<211>7<212>prt<213>人工序列<220><223>通过dna重组技术<400>23lysvalserasnargpheser15<210>24<211>9<212>prt<213>人工序列<220><223>通过dna重组技术<400>24pheglntyrserhisvalprotrpthr15<210>25<211>25<212>prt<213>人工序列<220><223>通过dna重组技术<400>25glnvalglnleuglnglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaser2025<210>26<211>13<212>prt<213>人工序列<220><223>通过dna重组技术<400>26trpvalargglnalaproglyglnglyleuglutrpile1510<210>27<211>59<212>prt<213>人工序列<220><223>通过dna重组技术<400>27argglnalaproglyglnglyleuglutrpileglyglyileasnpro151015thrserglyglyserasnpheasnglulysphelysthrargvalthr202530ilethralaaspgluserserthrthralatyrmetgluleuserser354045leuargsergluaspthralaphetyrphecys5055<210>28<211>11<212>prt<213>人工序列<220><223>通过dna重组技术<400>28pheglyglnglythrlysleugluilelysarg1510<210>29<211>18<212>prt<213>人工序列<220><223>通过dna重组技术<400>29glyglyileasnprothrserglyglyserilepheasnglulysphe151015lysthr当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1