化合物的盐和晶型的制作方法
本发明涉及2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈(化合物i,见下文)的特殊的固体形式,优选结晶形式或无定形形式,尤其是结晶形式,它的水合物和溶剂合物,它的盐和它的盐的水合物和溶剂合物,制备它们的某些方法,包含这些固体形式的药物组合物,以及它们在诊断方法上的应用或优选地用于温血动物,尤其是人的治疗性治疗中的应用,以及它们作为中间体的用途或用于制备在诊断方法或优选地用于温血动物,尤其是人的治疗性治疗中的药物制剂的用途。
发明背景
2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈,它对脂激酶诸如pi3-激酶和/或诸如dna蛋白激酶的pi3-激酶相关蛋白激酶家族成员(也称为pikk且包括dna-pk、atm、atr、hsmg-1和mtor)活性的抑制;以及它的用途,尤其是作为抗肿瘤剂的用途在wo2006/122806中描述。其中举例说明了游离形式的该化合物(例如参阅实施例7)和作为1:1的化学计量比的4-甲苯磺酸盐。也在实验部分作为实施例1描述了2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈的合成。
现在令人惊讶地发现在特定的条件下可以发现新的特殊结晶形式的2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈、它的水合物和溶剂合物,它的盐和它的盐的水合物和溶剂合物,它们在下文中描述且它们具有有利的用途和性质。它们显示出新的物理性质,其在某些药学性质方面可有实质性差异,且其可用在药物物质和药物产品的开发中;例如用于药物物质的溶解和/或生产/纯化的便利途径。
发明详述
在下文中在附图的帮助与其它帮助下对本发明作更加详细的叙述。
本发明尤其涉及基本上纯的结晶形式的式i的2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈(化合物i),
式i的化合物的水合物或溶剂合物,或式i的化合物的盐,或式i的化合物的盐的水合物或溶剂合物。
附图描述
在下面讨论的x射线图谱中,衍射角2θ绘图在水平轴(x轴)上且强度(计数)绘图在垂直轴(y轴)上。
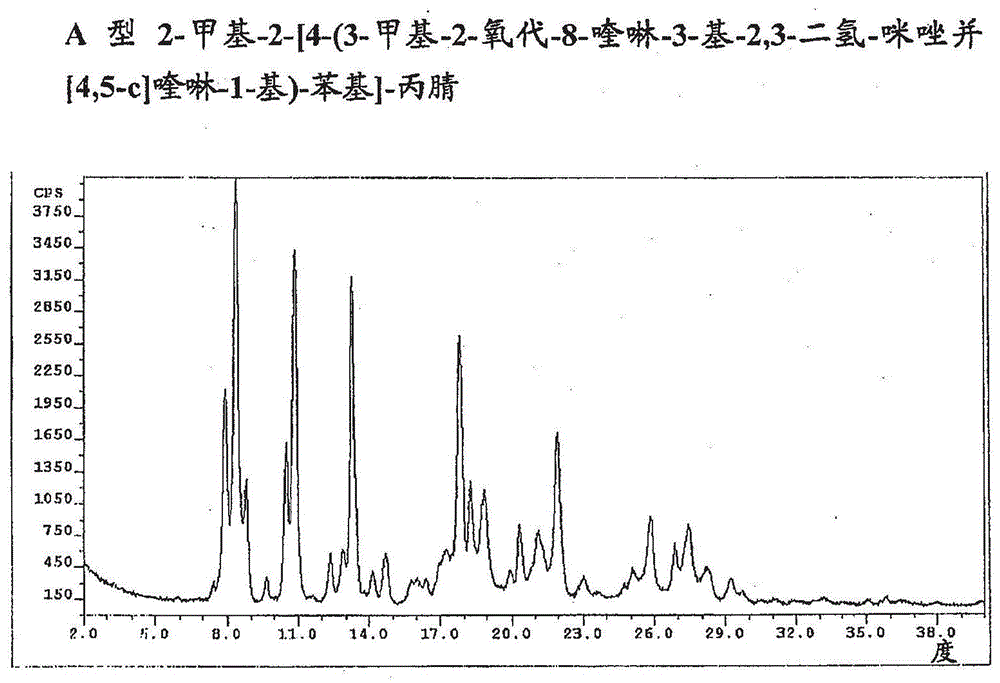
图1:a型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈
在8.4°的衍射角2θ观察到在x射线衍射图谱中具有100%的相对强度的最强的线。在7.9°和10.5°观察到具有大于10%的相对强度的另两条线。更宽地,通过在7.9°、8.4°、10.5°、10.9°、13.3°、17.9°、22.0°的衍射角2θ处的衍射峰表征了这一晶型。用带有cukα辐射源的scintaginstrument测量x射线粉末数据;步进0.020°,范围2.00-40.00(deg.),恒定扫描速率0.50deg/min(所有的2θ值+/-0.3)。
图2:b型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈
在6.9°的衍射角2θ观察到在x射线衍射图谱中具有100%的相对强度的最强的线。在14.2°和17.7°观察到具有大于10%的相对强度的另两条线。更宽地,通过在6.9°、8.7°、10.1°、14.2°、17.7°、20.5°、21.1°的衍射角2θ处的衍射峰表征这一晶型。用带有cukα辐射源的scintaginstrument测量x射线粉末数据;步进0.020°,范围2.00-40.00(deg.),恒定扫描速率0.50deg/min(所有的2θ值+/-0.3)。
图3:c型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈的模拟x射线粉末图
在14.7°的衍射角2θ观察到在x射线衍射图谱中具有100%的相对强度的最强的线。在11.4°和18.6°观察到具有大于10%的相对强度的另两条线。更宽地,通过在6.6°、11.4°、14.7°、15.6°、18.3°、18.6°、19.8°、22.7°、24.5°的衍射角2θ处的衍射峰表征这一晶型(所有的2θ值+/-0.3)。
图4:d型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈
在23.9°的衍射角2θ观察到在x射线衍射图谱中具有100%的相对强度的最强的线。在20.6°和22.1°观察到具有大于10%的相对强度的另两条线。更宽地,通过在8.5°、19.9°、20.2°、20.6°、22.1°、23.9°、26.1°、27.2°的衍射角2θ处的衍射峰表征这一晶型。用带有cukα1辐射源的stoestadipcombiinstrument测量x射线粉末数据;狭缝4mm/2mm;在聚酰亚胺薄膜薄片间透射;monochrom.:弯曲的锗(111),辐射
图5:ha型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈一水合物
在17.6°的衍射角2θ观察到在x射线衍射图谱中具有100%的相对强度的最强的线。在18.8°和22.5°观察到具有大于10%的相对强度的另两条线。更宽地,通过在5.6°、6.9°、8.5°、9.2°、13.8°、17.6°、18.8°、22.5°、24.0°的衍射角2θ处的衍射峰表征这一晶型。用brukerd8discovergadds在反射几何中测量x射线粉末数据(所有的2θ值+/-0.3)。
图6:a型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈单甲苯磺酸盐
在5.7°的衍射角2θ观察到在x射线衍射图谱中具有100%的相对强度的最强的线。在5.4°和17.2°观察到具有大于10%的相对强度的另两条线。更宽地,通过在5.4°、5.7°、16.4°、17.2°、18.3°、19.0°、22.0°、23.1°、23.4°、27.5°的衍射角2θ处的衍射峰表征这一晶型。用带有cukα辐射源的scintaginstrument测量x射线粉末数据;步进0.020°,范围2.00-40.00(deg.),恒定扫描速率0.50deg/min(所有的2θ值+/-0.3)。
图7:b型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈单甲苯磺酸盐
在5.8°的衍射角2θ观察到在x射线衍射图谱中具有100%的相对强度的最强的线。在17.8°和18.7°观察到具有大于10%的相对强度的另两条线。更宽地,通过在5.8°、16.4°、17.2°、17.8°、18.4°、18.7°、22.1°、22.7°、23.7°的衍射角2θ处的衍射峰表征这一晶型。用带有cukα1辐射源的stoestadipcombiinstrument测量x射线粉末数据;狭缝4mm/2mm;在聚酰亚胺薄膜薄片间透射;monochrom.:弯曲的锗(111),辐射
图8:ha型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈单甲苯磺酸盐一水合物的模拟x射线粉末图(从相应的单晶结构计算)
化合物i单甲苯磺酸盐一水合物的结晶学数据:
在6.5°的衍射角2θ观察到在x射线衍射图谱中具有100%的相对强度的最强的线。在7.8°、19.6°、23.1°和26.2°观察到具有大于50%的相对强度的四条进一步的线。更宽地,通过在6.5°、7.8°、9.0°、11.4°、14.9°、19.3°、19.6°、23.1°、26.2°的衍射角2θ处的衍射峰表征这一晶型(所有的2θ值+/-0.3)。
图9:hb型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈单甲苯磺酸盐二水合物的模拟x射线粉末图(从相应的单晶结构计算)
化合物i单甲苯磺酸盐二水合物的结晶学数据:
在6.9°的衍射角2θ观察到在x射线衍射图谱中具有100%的相对强度的最强的线。在19.5°和26.6°观察到具有大于10%的相对强度的另两条线。更宽地,通过在6.9°、10.2°、13.4°、13.8°、16.4°、16.9°、19.5°、21.1°、26.6°的衍射角2θ处的衍射峰表征这一晶型(所有的2θ值+/-0.3)。
图10:sa型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈单甲苯磺酸盐二甲酸溶剂合物的模拟x射线粉末图(从相应的单晶结构计算)
化合物i单甲苯磺酸盐甲酸溶剂合物的结晶学数据:
在5.8°的衍射角2θ观察到在x射线衍射图谱中具有100%的相对强度的最强的线。在7.6°和20.9°观察到具有大于10%的相对强度的另两条线。更宽地,通过在5.8°、7.9°、11.7°、13.1°、13.6°、14.5°、17.3°、20.9°、22.6°、24.5°的衍射角2θ处的衍射峰表征这一晶型(所有的2θ值+/-0.3)。
图11:a型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈二甲苯磺酸盐
化合物i二甲苯磺酸盐的结晶学数据:
在22.4°的衍射角2θ观察到在x射线衍射图谱中具有100%的相对强度的最强的线。在21.5°和25.0°观察到具有大于10%的相对强度的另两条线。更宽地,通过在5.6°、7.7°、15.8°、16.8°、18.6°、19.1°、21.5°、22.4°、25.0°的衍射角2θ处的衍射峰表征这一晶型。用带有cukα辐射源的brukerd8advanceinstrument测量x射线粉末数据;步进0.017°,恒定时间0.3s,范围2.00-40.00(deg.),可变发散狭缝12mm;vantecpsd检测器(所有的2θ值+/-0.3)。
图12:ha型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈二甲苯磺酸盐三水合物的模拟x射线粉末图(从相应的单晶结构计算)
化合物i二甲苯磺酸盐三水合物的结晶学数据:
在4.7°的衍射角2θ观察到在x射线衍射图谱中具有100%的相对强度的最强的线。在9.4°和12.6°观察到具有大于10%的相对强度的另两条线。更宽地,通过在4.7°、7.4°、8.4°、9.4°、12.6°、13.7°、14.7°、18.3°、20.8°、24.1°的衍射角2θ处的衍射峰表征这一晶型(所有的2θ值+/-0.3)。
图13:无定形2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈单甲苯磺酸盐
用带有cukα辐射源的brukerd8advanceinstrument测量x射线粉末数据;步进0.017°,恒定时间0.3s,范围2.00-40.00(deg.),可变发散狭缝12mm;vantecpsd检测器。
图14:无定形2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈单甲苯磺酸盐的拉曼光谱
通过带有1064nm激光激发源(brukerrfs100)的色散拉曼光谱仪测量样品的拉曼光谱。光谱中的重要带以倒数的波数(cm-1)表示。
图15:无定形2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈单甲苯磺酸盐的ft-ir光谱
利用傅立叶变换红外光显微镜(brukervertex70)得到样品的红外吸收光谱。光谱中的重要带以倒数的波数表示。
图16:sc型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈单甲苯磺酸盐二甲酸溶剂合物一水合物的模拟x射线粉末图(从相应的单晶结构计算)
化合物i单甲苯磺酸盐甲酸溶剂合物一水合物的结晶学数据:
在5.6°的衍射角2θ观察到在x射线衍射图谱中具有100%的相对强度的最强的线。在20.7°和22.2°观察到具有大于10%的相对强度的另两条线。更宽地,通过在5.6°、7.6°、12.9°、13.3°、14.3°、20.7°、22.2°、24.5°、25.2°、26.2°、29.3的衍射角2θ处的衍射峰表征这一晶型(所有的2θ值+/-0.3)。
图17:sb型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈单甲苯磺酸盐二乙酸盐溶剂合物的模拟x射线粉末图(从相应的单晶结构计算)
化合物i单甲苯磺酸盐乙酸溶剂合物的结晶学数据:
在5.7°的衍射角2θ观察到在x射线衍射图谱中具有100%的相对强度的最强的线。在7.7°和22.3°观察到具有大于10%的相对强度的另两条线。更宽地,通过在5.7°、7.7°、12.7°、13.4°、14.3°、14.6°、20.1°、20.5°、20.7°、22.3°、23.7°、24.0°、24.2°、24.9°、26.0°的衍射角2θ处的衍射峰表征这一晶型(所有的2θ值+/-0.3)。
术语“基本上纯”在本发明的上下文中理解为表示根据本发明的式i的化合物、它的水合物或溶剂合物,它的盐或它的盐的水合物或溶剂合物的晶体的重量百分比的尤其是至少90%,优选至少95%,最优选至少99%以特定的晶型存在。
术语“固体形式”根据本发明包括晶体形式和无定形形式,优选的固体形式为结晶形式。
在上下文中通过陈述,式i的化合物、它的水合物或溶剂合物、它的盐或它的盐的水合物或溶剂合物的晶体形式显示基本上如图之一中概述的x射线衍射图谱,术语“基本上”表示至少在所述的图中描述的图谱的主线应当存在,主线即那些与图谱中最大强度线相比具有大于20%的相对线强度,尤其是大于30%的相对线强度的线。
在一种优选的实施方案中,式i的化合物、它的水合物或溶剂合物、它的盐或它的盐的水合物或溶剂合物的晶体形式显示基本上如图之一中概述的x射线衍射图谱。
特别高度优选的是如实施例中所述得到的固体形式,优选晶体形式的式i的化合物、它的水合物和溶剂合物、它的盐或它的盐的水合物或溶剂合物。
使用不同晶型的式i的化合物、它的水合物或溶剂合物、它的盐或它的盐的水合物或溶剂合物的优点之一是结晶中不同的晶型倾向于掺入不同的杂质,即掺入晶型aa的杂质也不必然掺入晶型bb或晶型cc。换句话说,连续制备相同原料的不同晶型增加最终所得物质的纯度。此外,不同的晶型显示不同的物理性质,诸如熔点、吸湿性、溶解度、流动性或热力学稳定性,并因此不同的晶型允许对于某些用途或方面选择最适宜的形式,例如在药品生产过程中作为中间体的用途或在像片剂、胶囊剂、软膏剂或溶液剂的不同的施用形式中的用途。
固体形式,优选结晶形式的式i的化合物、它的水合物或溶剂合物、它的盐或它的盐的水合物或溶剂合物具有有价值的药理学性质并可以例如用于治疗由p13激酶的活化介导的病症,诸如增殖病症、炎性病症或过敏性病症或通常与移植有关而发生的障碍。
固体形式、无定形或结晶形式,优选结晶形式的式i的化合物,它的水合物或溶剂合物,它的盐和它的盐的水合物或溶剂合物可优选用在治疗增殖性疾病中,增值性疾病选自良性或恶性肿瘤、脑癌、肾癌、肝癌、肾上腺癌、膀胱癌、乳腺癌、胃癌、胃肿瘤、卵巢癌、结肠癌、直肠癌、前列腺癌、胰癌、肺癌、阴道或甲状腺癌、肉瘤、胶质母细胞瘤、多发性骨髓瘤或胃肠癌,尤其是结肠癌或结肠直肠腺瘤或颈部和头部肿瘤、表皮增生过度、银屑病、前列腺增生、瘤形成、上皮性瘤形成、淋巴瘤、乳房癌或白血病。其它的疾病包括考登综合征、莱尔米-杜伯斯(lhermitte-dudos)疾病和bannayan-zonana综合征或其中pi3k/pkb通路被异常激活的疾病。
本发明尤其涉及a型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈单甲苯磺酸盐在本文提及的一种所述疾病中的治疗或用于制备其治疗的药理活性剂。
本发明还涉及治疗患有所述疾病的温血动物的方法,其中将对有关疾病有效的固体形式,优选结晶形式的式i的化合物、它的水合物或溶剂化物、它的盐或它的盐的水合物或溶剂化物的量,尤其是抗增殖有效的量施用于有这种治疗需求的温血动物。本发明进一步涉及固体形式、优选结晶形式的式i的化合物、它的水合物或溶剂化物、它的盐或它的盐的水合物或溶剂化物用于制备用于治疗人类或动物机体,尤其是用于治疗增值性疾病的药物组合物的用途。所述增值性疾病诸如为良性或恶性肿瘤、脑癌、肾癌、肝癌、肾上腺癌、膀胱癌、乳腺癌、胃癌、胃肿瘤、卵巢癌、结肠癌、直肠癌、前列腺癌、胰癌、肺癌、阴道或甲状腺癌、肉瘤、胶质母细胞瘤、多发性骨髓瘤或胃肠癌,尤其是结肠癌或结肠直肠腺瘤或颈部和头部肿瘤、表皮增生过度、银屑病、前列腺增生、瘤形成、上皮性瘤形成、淋巴瘤、乳房癌或白血病。
本文叙述的固体形式,优选结晶形式的式i的化合物、它的水合物或溶剂化物,它的盐或它的盐的水合物或溶剂化物可用于制备稳定的药物剂型。因此,本发明还涉及含有与药学上可接受的载体在一起的,用于预防或治疗一种本文提及的疾病的量的,尤其是治疗有效量的固体形式,优选结晶形式的式i的化合物、它的水合物或溶剂化物、它的盐或它的盐的水合物或溶剂化物的药物制剂,药学上可接受的载体适于局部、肠道施用,例如口服或直肠或肠胃外施用,并可以是无机的或有机的、固体的或液体的。
如果需要,可包含更多的药理活性物质的本药物制剂可以本领域技术人员已知的方式制备,例如通过常规的混合、造粒、包衣、溶解或冻干过程制备,且含有大约1%至100%,尤其是大约1%至20%的活性物质或物质。
本发明还涉及制备药物组合物的方法,其包括将本发明的固体形式,优选结晶形式的式i的化合物、它的水合物或溶剂化物、它的盐或它的盐的水合物或溶剂化物与至少一种药学上可接受的载体或赋形剂一起混合。
术语“药物组合物”意图包括包含活性成分、构成载体的药学上可接受的赋形剂的产品,以及任何直接或间接源于任何两种或多种成分的组合、络合或聚集,或源于一种或多种成分的解离,或源于一种或多种成分的其它类型的反应或相互作用的产品。因此,本发明的药物组合物包括通过混合活性成分、任选另外的活性成分和药学上可接受的赋形剂制造的任何组合物。
术语“赋形剂”表示不是活性成分的药物产品的组分,诸如填充剂、稀释剂和载体。在制备药物组合物方面有用的赋形剂优选一般安全、无毒和在生物学上和其它方面都不是不可取的,且除人体药物使用外也被兽医使用所接受。如在说明书和权利要求书中所使用的“药学上可接受的赋形剂”既包括一种也包括多于一种这样的赋形剂。
“治疗有效量”表示当施用化合物用于治疗或预防疾病时,化合物的量足以实现这样的对疾病的治疗或预防。“治疗有效量”将依化合物、疾病和它的严重性和所治疗患者的年龄、体重等而异。
本发明还涉及制备固体形式,优选结晶形的式i的化合物、它的水合物或溶剂化物、它的盐和它的盐的水合物或溶剂合物的方法。晶体形成的精确的条件现在可以经验为主地确定且在实践中许多方法适用,包括如实施例3至17所述的结晶条件。
诱导结晶条件通常涉及使用适宜的结晶诱导溶剂,例如叔-丁基甲基醚(tbme)、甲醇、乙醇、异丙醇或水或其混合物。常规地,将无定形的化合物在一般至少10℃的温度溶解在该溶剂中。通过将任何一种或多种无定形的化合物和其溶剂合物,诸如水合物、甲醇合物、乙醇合物、异丙醇合物或甲酸酯溶解在溶剂中可产生溶液。然后可通过溶液转换,在大约0℃和溶剂的沸点之间的温度发生的结晶形成晶体。可以以不同的常规方式实现溶解和结晶。例如,可以将无定形化合物溶解在化合物在其中在提高的温度易溶但在其中在较低的温度仅仅略溶的溶剂中或溶剂的混合物中。在提高的温度溶解,接着进行冷却,在冷却期间所需的晶体从溶液中结晶析出。冷却和再加热步骤可以进行几次,例如至少一次、至少两次、至少3次、至少5次。冷却和再加热温度例如是至少5℃、至少10℃或至少15℃。冷却/加热周期的低温例如可是低于15℃、低于10℃、低于5℃或低于0℃,反之高温例如可是至少15℃、至少20℃、至少25℃或至少30℃。
假如在降低的温度(一般至少大约0℃)利用所选择的溶剂混合物能从混合物中结晶,也可以使用混合溶剂,该混合溶剂包含在其中化合物易溶,优选在30℃至少1%重量百分比的量的可溶的良性溶剂和在其中化合物更略溶,优选在30℃至多约0.01%重量百分比的量可溶的不良溶剂。
或者,可以利用在不同溶剂中晶体的溶解度的差异。例如,无定形的化合物可溶解在其高度可溶的良性溶剂中,良性溶剂例如在大约30℃化合物以在其中至少1%重量百分比的量可溶,随后将该溶液同该化合物在其中更加略溶的不良溶剂混合,不良溶剂诸如在大约30℃化合物以在其中不多于0.01%重量百分比的量可溶。因此,可以在一般地保持超过大约0℃的温度下,将在良性溶剂中的化合物的溶液加入到不良溶剂中,或者还可以在一般地保持超过大约0℃的温度下,将不良溶剂加入到在良性溶剂中的化合物的溶液中。良性溶剂的实例可包括低级醇、诸如甲醇、乙醇和异丙醇、甲酸、乙酸或丙酮。不良溶剂的实例例如是水。优选在大约0℃到大约40℃的温度范围内完成结晶。
在本发明方法的替代实施方式中,将固体无定形化合物在一般地至少大约0℃的温度悬浮在其不完全溶解的溶剂中,优选在那一温度其仅仅略溶的溶剂中。悬浮导致固体颗粒分散,且保持在溶剂中不完全溶解。优选通过搅动,例如通过振摇或搅拌将固体保持在悬浮的状态。为了实现起始固体转化为晶体,将悬浮物保持在一般大约0℃或更高的温度。悬浮在适宜的溶剂中的无定形固体化合物可以是溶剂合物,例如水合物、甲醇合物、乙醇合物、乙酸酯或甲酸酯。可以通过干燥溶剂合物得到无定形粉末。
为了诱导结晶,优选加入结晶原料的“晶种”到所述溶液中。
按照本发明优选的实施方式,晶体形式的式i、它的水合物和溶剂化物、它的盐和它的盐的水合物或溶剂化物具有高结晶度。在本文中晶型定义为当它含有至多大约0.5%(w/w),例如至多大约0.1%(w/w)的其它型时,具有“高结晶度”或为“结晶学上纯”。因此“结晶学上纯的aa型”含有大约0.5%(w/w)或更少的,例如大约0.1%(w/w)或更少的bb型和/或另一种晶型。关于无定形的含量,“结晶学上纯”的型含有少于大约5%的无定形或低于检测限度的量(即检测不到的量)的无定形。
下述实施例举例说明本发明但不限制其范围。温度以摄氏度(℃)的形式给出。
实施例
实施例1
2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈
在适宜的实验室玻璃反应器中将45.0g的原料2[4-(8-溴-3-甲基-2-氧代-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]2-甲基-丙腈与在445ml的n,n-二甲基甲酰胺中的2.25g的二三苯基膦钯二氯化物放在一起。将混合物加热到95℃,然后加入在225mldmf、300mlh2o和60gkhco3的混合物中的22.2g的3-喹啉硼酸的溶液。将混合物在95℃加热2小时。然后加入1080mlh2o。产物2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]丙腈沉淀。在1.5小时内冷却混合物至0–5℃。在那一温度搅拌2小时后将粗产物过滤并用300mlh2o洗涤。将产物在60℃真空干燥18小时,以得到粗产品。
将40g的粗产品在60℃溶解在200ml甲酸中。加入8g活性炭和smopex234。将混合物在60℃搅拌1小时,过滤炭,用80ml甲酸洗涤残留物,然后在真空中蒸馏去175ml的甲酸。然后加入320ml甲醇并在回流下加热混合物3小时。从反应混合物沉淀出纯化的产物。在1小时内将混合物冷却到0–5℃,然后在此温度下搅拌2小时,最后过滤并用80ml冷甲醇洗涤。再次重复这一重结晶过程。最后将两次重结晶的原料在60℃在真空中干燥以提供纯化的2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]丙腈。
实施例1a5-溴-2-(2-硝基-乙烯基氨基)-苯甲酸
将在h2o-hcl(37%)(10:1)中的25g(16mmol)2-氨基-5-溴-苯甲酸(fluka,buchs,switzerland)的悬浮液搅拌8小时并然后过滤(溶液a)。将8.17g(255mmol)的硝基甲烷(fluka,buchs,switzerland)用10分钟的时间加入到冰浴冷却的35g冰和15.3g(382mmol)naoh的混合物中。在0℃搅拌1小时和在室温搅拌1小时以后,将溶液在0℃加入到28g的冰和42ml的hcl(37%)(溶液b)中。合并溶液a和b并将反应混合物在室温搅拌18小时。将黄色沉淀滤去,用水洗涤并在40℃在真空中干燥以提供标题化合物。es-ms:287,289(m+h)+,br模式;1hnmr(dmso-d6):δ13.7-14.6/brs(1h),12.94/d(1h),8.07/d(1h),8.03/dd(1h),7.83/dd(1h),7.71/d(1h),6.76/d(1h)。
实施例1b
6-溴-3-硝基-喹啉-4-醇
将在129ml(152mmol)乙酸酐中的29g(101mmol)5-溴-2-(2-硝基-乙烯基氨基)-苯甲酸(实施例1a)和11.9g(121mmol)乙酸钾在120℃搅拌1.5小时。将沉淀滤去并用乙酸洗涤直到滤液无色,然后用水洗涤并在真空中干燥以提供标题化合物。es-ms:269,271(m+h)+,br模式;分析型hplc:tret=2.70min(梯度1)。
实施例1c
6-溴-4-氯-3-硝基-喹啉
将在150ml(1.63mol)的pocl3中的20g(74.3mmol)6-溴-3-硝基-喹啉-4-醇(实施例1b)在120℃搅拌45分钟。将混合物冷却到室温并缓慢倒入到冰-水中。将沉淀滤去,用冰-冷水洗涤,并溶解在ch2cl2中。将有机相用冷盐水洗涤并弃去水相。在用mgso4干燥后将有机相蒸发至干以提供标题化合物。1hnmr(cdcl3):δ9.20/s(1h),8.54/d(1h),8.04/d(1h),7.96/dd(1h);分析型hplc:tret=4.32min(梯度1)。
实施例1d
2-甲基-2-(4-硝基-苯基)-丙腈
向在125mlch2cl2中的15g(92.5mmol)(4-硝基-苯基)-乙腈(fluka,buchs,switzerland)、1.64mg(5.09mmol)四丁基铵溴化物(fluka,buchs,switzerland)和43.3g(305mmol)碘甲烷中加入在125ml水中的10g(250mmol)naoh。将反应混合物在室温搅拌20小时。此后分离有机层,用mgso4干燥,并蒸发至干。将残留物溶解在二乙基醚中并用黑碳处理30分钟,用硅藻土过滤并在真空中干燥以提供淡黄色固体状的标题化合物。分析型hplc:tret=3.60min(梯度1)。
实施例1e
(2-(4-氨基-苯基)-2-甲基-丙腈
在室温下在1.1bar的h2下将16g(84.1mmol)的2-甲基-2-(4-硝基-苯基)-丙腈(实施例1d)和4.16g的raney-ni在160ml的thf-meoh(1:1)中振摇(shack)12小时。在反应完成后,将催化剂滤去并将滤液蒸发至干。将残留物通过快速色谱在硅胶上纯化(己烷-etoac3:1至1:2)以提供油状的标题化合物。es-ms:161(m+h)+;分析型hplc:tret=2.13min(梯度1)。
实施例1f
2-[4-(6-溴-3-硝基-喹啉-4-基氨基)-苯基]-2-甲基-丙腈
将18g(62.6mmol)的6-溴-4-氯-3-硝基-喹啉(实施例1c)和11g(68.9mmol)的(2-(4-氨基-苯基)-2-甲基-丙腈(实施例1e)溶解在350ml乙酸中并搅拌2小时。此后,加入水并滤去黄色沉淀并用水洗涤。将固体溶解在etoac-thf(1:1)中,用饱和nahco3水溶液洗涤并用mgso4干燥。将有机相蒸发至干以提供黄色固体状的标题化合物。es-ms:411,413(m+h)+,br模式;分析型hplc:tret=3.69min(梯度1)。
实施例1g
2-[4-(3-氨基-6-溴-喹啉-4-基氨基)-苯基]-2-甲基-丙腈
在8.35g的raney-ni存在下在1.1bar的h2下将24g(58.4mmol)的2-[4-(6-溴-3-硝基-喹啉-4-基氨基)-苯基]-2-甲基-丙腈(实施例1e)在300ml的meoh-thf(1:1)中振摇1小时。在反应完成后,将催化剂滤去并将滤液蒸发至干以提供黄色泡沫状的标题化合物。es-ms:381,383(m+h)+,br模式;分析型hplc:tret=3.21min(梯度1)。
实施例1h2-[4-(8-溴-2-氧代-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-2-甲基-丙腈
在0℃用冰浴将在120mlch2cl2中的5g(13.1mmol)2-[4-(3-氨基-6-溴-喹啉-4-基氨基)-苯基]-2-甲基-丙腈(实施例1g)和1.59g(15.7mmol)三乙基胺的溶液用40分钟加入到在80mlch2cl2中的2.85g(14.4mmol)三氯甲基氯甲酸酯(fluka,buchs,switzerland)的溶液中。将反应混合物在此温度搅拌20分钟,然后用饱和nahco3溶液终止反应,搅拌5分钟并用ch2cl2萃取。将有机层用na2so4干燥,过滤并在真空中干燥以提供褐色固体状的粗品标题化合物。es-ms:407,409(m+h)+,br模式;分析型hplc:tret=3.05min(梯度1)。
实施例1i
2-[4-(8-溴-3-甲基-2-氧代-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-2-甲基-丙腈
向在170mlch2cl2中的3.45g(8.47mmol)2-[4-(8-溴-2-氧代-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-2-甲基-丙腈(实施例1h)、1.8g(12.7mmol)碘甲烷(fluka,buchs,switzerland)和273mg(0.847mmol)四丁基胺溴化物(fluka,buchs,switzerland)的溶液中加入在85ml水中的508mg(12.7mmol)的naoh(fluka,buchs,switzerland)溶液。将反应混合物搅拌2天并加入在5ml水中的900mg(6.35mmol)的碘甲烷和254mg(6.35mmol)的naoh。将反应混合物在室温下搅拌1天。此后,将反应物用水停止反应并用ch2cl2(2×)萃取。将有机层用盐水洗涤,用na2so4干燥,过滤并在真空中蒸发以提供米黄色固体状的标题化合物。es-ms:421,423(m+h)+,br模式;分析型hplc:tret=3.15min(梯度1)。
实施例2
2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]丙腈对-甲苯磺酸盐
将26.5g的2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]丙腈与55ml甲酸一起置于玻璃反应器中。将混合物加热到60℃以得到澄清溶液。将该溶液澄清过滤并用36ml甲酸洗涤。然后将甲酸蒸去直到残留溶液的体积为55ml。然后在50℃加入在228ml丙酮中的11.3g的对-苯甲磺酸,接着在30分钟内进一步加入822ml丙酮。从反应混合物中沉淀出盐。在2小时内将混合物冷却到0℃,在那一温度搅拌3小时,然后过滤并用84ml丙酮洗涤。将产物在60℃在真空中干燥18小时以提供29.8g(82.4%)的2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]丙腈对-甲苯磺酸盐(晶型a)。
按照下述实施例合成本发明的晶型,这些实施例是说明性的,并不限制本发明的范围。
实施例3:
a型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈的制备
a型化合物i可用下述方式生产:在50℃将241g游离碱溶解在2.4l乙酸中。将溶液澄清过滤,用250ml乙酸洗涤,然后在50℃加入7.2l的水。游离碱开始沉淀。将混合物在1小时内冷却到25℃,然后过滤并用10l水洗涤。然后在50℃将游离碱在真空中干燥过夜以提供204g的游离碱。
实施例4:
b型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈的制备
将0.47g的游离碱(化合物i)与2ml甲酸一起置于反应器中。将混合物加热到60℃以得到澄清溶液。然后加入5.2ml的甲醇。将混合物在65℃加热2小时。化合物i开始沉淀(在这些条件下甲酸酯化为相应的甲酯)。将混合物冷却到室温并在室温进一步搅拌2小时。然后过滤沉淀,用2ml甲醇洗涤并在60℃真空中干燥17小时以提供b型的化合物i。
实施例5:
c型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈的制备
在平衡后在不同的溶剂中化合物i改变它的多晶形(在25℃用大约20mg样品和0.5ml溶剂进行24小时平衡时间(在搅动下)的浆料实验)。在甲醇、甲醇/水、dmf、乙醇、乙酸乙酯和thf中可观察到新晶型c。
将化合物i(0.94g)加入到14ml乙醇中并加热到62℃。然后加入3ml的甲酸以得到澄清的溶液。将混合物在62℃搅拌2小时,借此游离碱开始沉淀。将混合物冷却到室温,在室温搅拌2.5小时,然后滤去。然后将滤饼用5ml冰冷乙醇洗涤并然后在60℃在真空中干燥过夜,以得到c型的化合物i。
或者,在60℃将化合物i溶解在甲酸中,澄清过滤并然后加入甲醇。在65℃搅拌2小时后,将混合物冷却到室温,将盐滤去并用冰冷甲醇洗涤以提供c型的化合物i。
实施例6:
d型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈的制备
在平衡后在不同的溶剂中化合物i改变它的多晶形(在25℃用大约20mg样品和0.5ml溶剂进行24小时平衡时间(在搅动下)浆料试验)。在作为溶剂的异丙醇中可观察到新晶型d。
实施例7:
ha型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈一水合物的制备
在室温下通过从dmf溶液中缓慢溶剂蒸发,在结晶后得到此化合物。
实施例8:
a型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈单甲苯磺酸盐的制备
在56℃将2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈(式i的化合物)溶解在甲酸中并澄清过滤所得溶液。然后将滤液浓缩并在30分钟内加入在丙酮中的对-甲苯磺酸(1.05eq)溶液。在加入25%和50%的体积后,混合物引入晶种并开始结晶。加入更多量的丙酮并将悬浮液冷却到0℃。通过离心收集结晶产品(a型化合物i的单甲苯磺酸盐)并在真空下在60℃干燥。
实施例9:
b型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈单甲苯磺酸盐的制备
可以在高于70℃的温度观察到根据实施例8制备的a型向另一晶型(进一步被称为b型)的相变(也能在相应的dsc中检测到这一相变)。如通过dsc试验所发现的那样,这一相变是可逆的。a型和b型有互变的关系。
实施例10:
ha型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈单甲苯磺酸盐一水合物的制备
在25℃可将在乙醇/丙酮(1:1)中的化合物i的二甲苯磺酸盐的饱和溶液用于缓慢溶剂蒸发试验中。已经观察到化合物i单甲苯磺酸盐一水合物的单晶(ha型)的形成且能够计算单晶结构。
实施例11:
hb型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈单甲苯磺酸盐二水合物的制备
在25℃通过在水中的化合物i的二甲苯磺酸盐的平衡试验,可观察到单晶的形成(在3天时间后)。晶体结构可以得到确定,并计算为化合物i的单甲苯磺酸盐二水合物(hb型)。
实施例12:
sa型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈单甲苯磺酸盐二甲酸溶剂合物的制备
通过x射线衍射确定化合物i的单甲苯磺酸二甲酸盐溶剂合物的单晶结构(修饰sa)。在冷却到室温后通过在50℃平衡在丙酮/甲酸(1:1(v/v))中的式i的单甲苯磺酸盐得到适宜的单晶。可以确定这一盐的化学计量为1:1.7(化合物i对-甲苯磺酸盐/甲酸)。计算了化学计量为1:1.7,但是由于一种溶剂合物分子为混乱的,1:2的化学计量似乎很可能。由于甲酸离开结构的可能性,观察到低于1:2的化学计量比。
实施例13:
a型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈二甲苯磺酸盐的制备
当在甲酸中的化合物i的溶液用对-甲苯磺酸(1.25eq)的丙酮溶液处理时,可以在滤去单甲苯磺酸盐后从母液中从结晶分离出作为第二收获的化合物i的二甲苯磺酸盐。
化合物i的二甲苯磺酸盐具有0.4%的起始干燥失重(高至140℃)。dsc数据表明在大约262℃熔化,具有大约93j/g的熔化焓。
实施例14:
ha型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈二甲苯磺酸盐三水合物的制备
从在二氯甲烷/甲醇(1:1(v/v))混合物中的化合物i二甲苯磺酸盐的饱和溶液可以观察到化合物i二甲苯磺酸盐的三水合物形式(修饰ha)并发现单晶。
实施例15:
无定形2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈单甲苯磺酸盐的制备
通过喷雾干燥化合物i单甲苯磺酸盐产生无定形原料。通过dsc在大约128℃观察到玻璃化转变tg。在大约175℃重结晶后该物质在大约279℃熔化,具有大约65j/g的溶化焓。
实施例16:
sc型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈单甲苯磺酸盐二甲酸溶剂合物一水合物的制备
通过x射线衍射确定化合物i单甲苯磺酸盐二甲酸溶剂合物一水合物的单晶结构(修饰sc)。在冷却到室温后通过在50℃在甲基异丁基酮/甲酸(1:1(v/v))溶剂混合物中平衡化合物i的单甲苯磺酸盐得到适宜的单晶。
实施例17:
sb型2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈单甲苯磺酸盐二乙酸溶剂合物的制备
通过x射线衍射确定化合物i单甲苯磺酸盐二乙酸溶剂合物的单晶结构(修饰sc)。在冷却到室温后通过在50℃在甲基异丁基酮/甲酸(1:1(v/v))溶剂混合物中平衡化合物i的单甲苯磺酸盐得到适宜的单晶。
- 还没有人留言评论。精彩留言会获得点赞!