一种与脓毒症发生发展相关的分子标志物及其应用的制作方法
本发明属于生物医药领域,涉及一种与脓毒症发生发展相关的分子标志物及其应用,具体地该分子标志物为loc101929707。
背景技术:
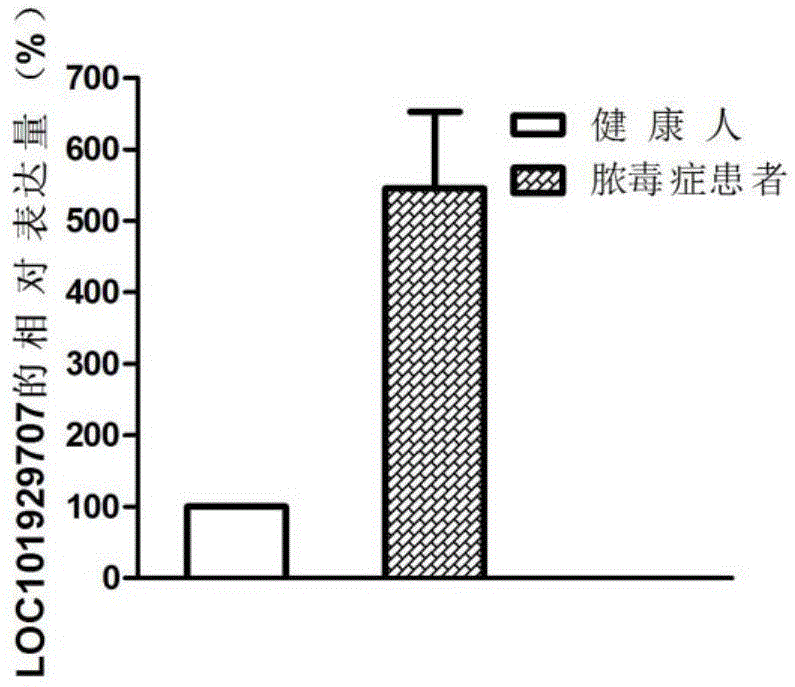
:脓毒症是严重威胁人类健康的疾病,不仅在欧美等人口老龄化的发达国家发病率较高,在新生人口较多的发展中国家亦是如此。在过去几十年里,虽然对脓毒症的研究取得了长足进步,但面临的形势依然严峻。尽管有抗生素治疗、复苏策略、呼吸机及连续肾脏替代疗法等医疗手段的进步,脓毒症仍然是重症监护病房(icu)中患者死亡的主要原因。而且在欧美等发达国家由脓毒症和脓毒症休克引起的死亡患者数量大于急性心肌梗死的死亡数,并继续增加。此外,脓毒症相关医疗及护理的费用也在逐年上升,美国每年约为170亿美元。随着医疗技术的进步,虽然脓毒症的死亡率有所下降,但据不完全统计其发病率却在不断增加。而在我国则面临着人口老龄化与全面实施二胎政策后新生儿潮的国情,加之中国既是发展中国家又为人口大国,面临的挑战可能尤为突出。随着脓毒症概念变迁,其诊断也在相应的发生变化。随着对脓毒症病理机制的研究深入,既往定义的不足也愈发明显。据统计2003-2011年基于sepsis1.0版诊断标准,脓毒症诊断率上升1.7倍,同期肺炎诊断率却下降至78%。sepsis1.0版诊断既缺乏特异性又缺乏敏感性,也因此出现不少对符合“脓毒症”标准的患者过度医疗。而sepsis2.0版则是在1.0版本的基础上加上21项诊断指标,情况虽较1.0版改善,但仍然无法全面客观反应出心血管、神经内分泌、免疫、代谢、凝血、基因等多因素参与发病的病理特征。为此,sepsis3.0工作组在最新脓毒症发病机制知识背景下以循证学、大数据为工具制定了新标准,以更适应于实际临床、病理生理学、检验学和流行病学。尽管脓毒症诊断不断修正更新,但其具体诊断指标目前仍依赖于非特异性生理指标和基于病原体的培养检测。血培养仍是当前脓毒症患者感染诊断的金标准,但其临床检验耗时长(48-72h),常产生假阴性及假阳性结果,并且有时出现微生物污染等因素严重影响其诊断价值。而脓毒症的特征是病情危急、发展迅速、死亡率高,这势必导致诊断延误、不当的治疗等情况。对脓毒症早期检测的生物标志物的研究是目前的一个重要领域。随着人类全基因组测序的完成,人们发现,人类基因组中虽然有超过80%的基因组具有转录本活性,然而超过98%的序列不能编码蛋白质,能够编码蛋白的基因组序列不足总量的2%。这些不能编码蛋白质的基因以往被认为是基因组的“垃圾dna"或“暗物质”,是基因表达翻译过程中的被丢弃的部分。然而近期研究表明,这些以往长期被忽视的数量庞大的“荒漠”区也能产生大量的转录本,并具有生物学功能,而不再仅仅是转录“噪音”,它们与疾病的关系尤为密切。长链非编码rna(longnon-codingrna,lncrna)是长度大于200nt的非编码rna,在细胞的发生、发育、增殖、分化、代谢等多个方面发挥重要作用,包括dna甲基化、x染色体沉默、基因组印记、染色质修饰、核内运输、表观遗传调控、转录的激活调控和干扰等重要过程。研究脓毒症的lncrna表达谱,为脓毒症的发病机理以及诊断和治疗提供了新的方向和思路。技术实现要素:为了弥补现有技术的不足,本发明的目的之一,提供一种与脓毒症相关的分子标志物;本发明的目的之二,提供一种产品,用以在脓毒症的早期进行诊断。为了实现上述目的,本发明采用如下技术方案:本发明提供了检测loc101929707的试剂在制备诊断脓毒症的产品中的应用。进一步,所述产品通过检测样品中loc101929707表达水平来诊断脓毒症,当loc101929707表达水平显著上调时,受试者患有脓毒症或存在患脓毒症的风险。其中,“样品”可以是血液、组织、尿液、血清、血浆、羊水、脑脊液、胎盘细胞或者组织、内皮细胞、白细胞或单核细胞。样品可以得自受试者或对象直接使用,或者进行预处理,如通过过滤、蒸馏、提取、浓缩、离心、失活干扰成分、加入试剂等方式处理,以如本文所述或者本领域已知的一些方式修饰样品的特性。在本发明的具体实施方式中,所述样品为血液。进一步,检测loc101929707表达水平的方法包括:反转录pcr、实时定量pcr、原位杂交或微阵列芯片。进一步,所述用rt-pcr诊断脓毒症至少包括一对特异扩增loc101929707基因的引物;所述用实时定量pcr诊断脓毒症至少包括一对特异扩增loc101929707基因的引物;所述用原位杂交诊断脓毒症包括:与loc101929707基因的核酸序列杂交的探针;所述用微阵列芯片诊断脓毒症包括:与loc101929707基因的核酸序列杂交的探针。进一步,所述产品包括芯片和/或试剂盒。进一步,所述试剂盒至少包括一对特异性扩增loc101929707基因的引物。在本发明的一个具体实施方式中,所述用实时定量pcr特异扩增loc101929707基因的引物序列如seqidno.1和seqidno.2所示。本发明提供了一种诊断脓毒症的产品,所述产品包括检测loc101929707的试剂。进一步,所述产品包括芯片、试剂盒。其中,所述芯片包括固相载体以及固定在固相载体上的寡核苷酸探针,所述寡核苷酸探针包括用于检测loc101929707基因转录水平的针对loc101929707基因的寡核苷酸探针;所述试剂盒包括用于检测loc101929707基因转录水平的试剂;所述芯片或试剂盒可用于检测包括loc101929707基因在内的多个基因(例如,与脓毒症相关的多个基因)的表达水平。通过将多个与脓毒症相关的标志物同时进行检测,可大大提高脓毒症诊断的准确率。进一步,所述基因检测试剂盒包含sybrgreen聚合酶链式反应体系、用于扩增管家基因和loc101929707基因的引物对。进一步,所述管家基因为gapdh,扩增gapdh的引物对序列如seqidno.3和seqidno.4所示。本发明提供了loc101929707在构建预测脓毒症的计算模型中的应用。在本发明中,可以以不同方式实施和实现将标志物水平与某种可能性或风险关联起来的步骤。优选地,在数学上组合标志物和一种或多种其它标志物的测定浓度,并将组合值与根本的诊断问题关联起来。可以通过任何适宜的现有技术数学方法将标志物值的测定组合。优选地,在标志物组合中应用的数学算法是一种对数函数。优选地,应用此类数学算法或此类对数函数的结果是单一值。根据根本的诊断问题,能容易地将此类值与例如个体关于脓毒症的风险或与有助于评估脓毒症患者的其它有意诊断用途关联起来。以一种优选的方式,此类对数函数是如下获得的:a)将个体分类入组,例如正常人、有脓毒症风险的个体、具有脓毒症的患者等等,b)通过单变量分析来鉴定在这些组之间差异显著的标志物,c)对数回归分析以评估标志物的可用于评估这些不同组的独立差别值,并d)构建对数函数来组合独立差别值。在这种类型的分析中,标志物不再是独立的,而是代表一个标志物组合。用于将标志物组合与疾病关联起来的对数函数优选采用通过应用统计方法开发和获得的算法。例如,适宜的统计方法是判别分析(da)(即线性、二次、规则da)、kernel方法(即svm)、非参数方法(即k-最近邻居分类器)、pls(部分最小二乘)、基于树的方法(即逻辑回归、cart、随机森林方法、助推/装袋方法)、广义线性模型(即对数回归)、基于主分量的方法(即simca)、广义叠加模型、基于模糊逻辑的方法、基于神经网络和遗传算法的方法。熟练技术人员在选择适宜的统计方法来评估本发明的标志物组合并由此获得适宜的数学算法方面不会有问题。在一个实施方案中,用于获得评估脓毒症中使用的数学算法的统计方法选自da(即线性、二次、规则判别分析)、kernel方法(即svm)、非参数方法(即k-最近邻居分类器)、pls(部分最小二乘)、基于树的方法(即逻辑回归、cart、随机森林方法、助推方法)、或广义线性模型(即对数回归)。在本发明中,术语“芯片”也称为“阵列”,指包含连接的核酸或肽探针的固体支持物。阵列通常包含按照不同的已知位置连接至基底表面的多种不同的核酸或肽探针。这些阵列,也称为“微阵列”,通常可以利用机械合成方法或光引导合成方法来产生这些阵列,所述光引导合成方法合并了光刻方法和固相合成方法的组合。阵列可以包含平坦的表面,或者可以是珠子、凝胶、聚合物表面、诸如光纤的纤维、玻璃或任何其它合适的基底上的核酸或肽。可以以一定的方式来包装阵列,从而允许进行全功能装置的诊断或其它方式的操纵。在本发明中,术语“探针”指能与另一分子的特定序列或亚序列或其它部分结合的分子。除非另有指出,术语“探针”通常指能通过互补碱基配对与另一多核苷酸(往往称为“靶多核苷酸”)结合的多核苷酸探针。根据杂交条件的严谨性,探针能和与该探针缺乏完全序列互补性的靶多核苷酸结合。探针可作直接或间接的标记,其范围包括引物。杂交方式,包括,但不限于:溶液相、固相、混合相或原位杂交测定法。作为探针,可以使用荧光标记、放射标记、生物素标记等对疾病检测用多核苷酸进行了标记的标记探针。多核苷酸的标记方法本身是公知的。可通过如下方法检查试样中是否存在受试核酸:固定受试核酸或者其扩增物,与标记探针进行杂交,洗涤,以及然后测定与固相结合的标记。备选地,还可固定疾病检测用多核苷酸,使受试核酸与其杂交,然后应用标记探针等检测结合于固相上的受试核酸。在这种情况下,结合于固相上的疾病检测用多核苷酸也称为探针。使用多核苷酸探针测定受试核酸的方法在本领域也是公知的。可以如下进行该方法:在缓冲液中使多核苷酸探针与受试核酸在tm或者其附近(优选在±4℃以内)接触用于杂交,洗涤,然后测定杂交的标记探针或者与固相探针结合的模板核酸。在作为探针使用的多核苷酸的大小优选为18个或更多个核苷酸、更优选为20个或更多个核苷酸,以及编码区域的全长或更少。作为引物使用时,该多核苷酸大小优选为18个或更多个核苷酸,以及50个或更少核苷酸。这些探针具有与靶点基因的特定的碱基序列互补的碱基序列。这里,所谓“互补”,只要是杂交即可,可以不是完全互补。这些多核苷酸通常相对于该特定的碱基序列具有80%以上、优选90%以上、更优选95%以上、特别优选100%的同源性。这些探针可以是dna,也可以是rna,另外,可以为在其一部分或全部中核苷酸通过pna、lna、ena、gna、tna等人工核酸置换得到的多核苷酸。本发明的引物或探针可以使用磷酰亚胺固相支持法或其他熟知方法化学合成。也可以使用本领域已知的许多手段修饰所述核酸序列。这些修饰的非限制性实例是甲基化、加帽、用天然核苷酸的一种或多种类似物进行的置换和在核苷酸之间的修饰,例如,修饰不带电荷的连接体(例如,磷酸甲酯、磷酸三酯、磷酰亚胺、氨基甲酸酯等),或修饰带电荷的连接体(例如,硫代磷酸酯、二硫代磷酸酯等)。在本发明的上下文中,“loc101929707基因”包括人loc101929707基因序列及其变体。所述序列的“变体”是生物活性的序列,其因为在天然序列中一个或多个核苷酸的插入、缺失、修饰和/或替换具有与天然序列或野生型序列(或其补体)不同的核苷酸序列。loc101929707,基因id:101929707,位于20号染色体上,目前genebank中loc101929707存在八个转录产物,序列分别如xr_001754543.1、xr_937352.1、xr_001754540.1、xr_001754541.1、xr_001754538.1、xr_001754542.1、xr_001754539.1、xr_937362.1所示。本领域技术人员了解,在对测序结果进行生物信息学分析时,会将测序数据比对到参考基因组上,即只要所测数据同属于一个基因id,就属于该基因,因此loc101929707的不同的转录产物包括在本发明中。在本发明中,一种代表性的loc101929707具有与xr_001754543.1相同的序列。本发明的loc101929707基因可以是天然的或是人工合成的,或者使用可以表达loc101929707的dna片段的载体转染细胞获得。所述载体所述载体包括病毒载体、真核表达载体。病毒载体可以是任何适当的载体,包括但不限于逆转录病毒载体、腺病毒载体、腺病毒相关病毒载体、疱疹病毒(例如单纯疱疹病毒、痘苗病毒及eb病毒)载体、甲病毒载体。真核表达载体可以是任何适当的表达载体,包括但不限于pcmv-myc表达载体、pcdna3.0表达载体、pcdna3.1表达载体、pegfp表达载体、pefbos表达载体、ptet表达载体、ptre表达载体、或者在公知表达载体的基础上经改造的载体,比如pbin438、pcambia1301等。在本发明的上下文中,“诊断脓毒症”既包括判断受试者是否已经患有脓毒症、也包括判断受试者是否存在患有脓毒症的风险。本发明的优点和有益效果:本发明首次发现了与脓毒症相关的分子标志物loc101929707基因,对于研究脓毒症的发病机制具有重要的意义。本发明提供了一种早期诊断产品和手段,通过检测loc101929707的表达水平,来判断受试者是否患有脓毒症,从而降低脓毒症的恶化风险,控制患者病情。附图说明图1是利用qpcr检测loc101929707基因在脓毒症患者中的表达情况图。具体的实施方式下面结合附图和实施例对本发明作进一步详细的说明。以下实施例仅用于说明本发明而不用于限制本发明的范围。实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。实施例1筛选与脓毒症相关的基因标志物1、样品收集各收集3例正常人血液和脓毒症患者血液样本,上述所有标本的取得均通过伦理委员会的同意。实验组:脓毒症患者,符合2016年制定的脓毒症3.0诊断标准。排除标准:1)年龄<18周岁;2)妊娠期妇女;3)合并恶性肿瘤、严重肝脏、血液系统及免疫缺陷疾病者;4)正在使用抗凝素或激素的患者;5)入院前使用抗生素及透析治疗者。2、rna样品的制备及质量分析使用promega公司的rna提取试剂盒提取总rna。具体步骤如下:1)取1ml收集在肝素或edta处理过的试管中的全血,放进无菌离心管中;2)收集血细胞:3000rpm离心5min,小心地从样品顶部吸走上清;3)加1ml血细胞裂解液,小心吸放4-5次,重悬沉淀物,3000rpm离心5min,重复该步骤两次(共三次);4)避开细胞沉淀物,小心吸走几乎所有上清,只保留100μl上清液;然后加175μlrna裂解液到细胞中,吸放重悬并裂解细胞;5)加350μlrna稀释液,颠倒混合3-4次;6)置于70℃水浴中3min;7)室温下13000g离心10min,将清亮裂解物转移到一支无菌离心管中;8)向澄清裂解液中加入200μl95%乙醇,用移液枪吸放3-4次以混合;将此混合物转移到离心柱装配体中,13000g离心1min;9)从离心柱装配体上拿下离心柱,弃去收集管中的液体,将离心柱装回到收集管上,确认一下rnawashsolution已用乙醇稀释,加600μlrna洗涤液于离心柱装配体,13000g离心1min;10)弃去收集管中的液体,将离心柱装回到收集管上,将50μl新鲜制备的dnase孵育混合物直接加到离心柱内的膜上;11)室温下孵育15min,向离心柱中加入200μldna酶终止缓冲液,13000g离心1min;12)加入600μlrna洗涤液,13000g,离心1min;13)清空收集管,向离心柱内加入250μlrna洗涤液(已加入乙醇),高速离心2min;14)将离心柱从收集管上转移到洗脱管上,向膜上加100μl无核酸酶水,将离心柱装配体放进离心机并使洗脱管的盖子朝外,13000g离心1min,丢弃离心柱,盖好盛有rna的洗脱管,存于-70℃。15)检测rna的浓度,鉴定rna的产量和纯度,建立cdna文库的要求为rna总量5μg,浓度≥200ng/μl,od260/280介于1.8~2.2之间。3、构建cdna文库1)去除rrna2)片段化rna利用金属离子,将rna随机断裂成200bp左右的小片段。3)反转录合成cdna在逆转录酶的作用下,利用随机引物,以rna为模板反转合成一链cdna,进行二链合成时,dntps试剂中用dutp代替dttp,使cdna第二链中碱基包含a/u/c/g。4)连接adaptor双链的cdna结构为粘性末端,加入endrepairmix将其补成平末端,随后在3’末端加上一个a碱基,用于连接y字形的接头。5)ung酶消化cdna二链使用ung酶将cdna第二链消化,使文库中仅包含cdna第一链。4、上机测序使用illuminax-ten测序平台,进行2*150bp测序。5、生物信息学分析1)用cutadapt对reads的5’和3’段进行修剪,修剪掉质量<20的碱基,并且删掉n大于10%的reads;2)tophat比对到参考基因组上。所用的参考基因组版本为grch38.p7,fasta和gff文件下载自ncbi;3)cuffquant定量mrna的表达量并标准化输出;cuffquant定量lncrna的表达量并标准化输出;4)cuffdiff比较对照组跟疾病组lncrna的表达差异,显著差异lncrna筛选条件为:fdr<0.01。6、结果rna-seq结果显示,loc101929707基因在脓毒症患者血液中的表达水平显著高于正常人中的表达水平。实施例2qpcr测序验证loc101929707基因的差异表达1、根据高通量测序的检测结果选择loc101929707基因进行大样本qpcr验证。按照实施例1中的样本收集方式选择脓毒症患者血液和正常人血液各35例。2、rna提取提取过程实施例1。3、逆转录采用tiangen公司的fastqμantcdna第一链合成试剂盒(货号:kr106)进行反转录。首先去除基因组dna反应,在试管中加入5×gdnabμffer2.0μl,总rna1μg,加rnasefreeddh2o使总体积至10μl,水浴锅中42℃加热3min,然后置于冰上放置。再将10×fastrtbμffer2.0μl,rtenzymemix1.0μl,fq-rtprimermix2.0μl,rnasefreeddh2o5.0μl,混合后加入上述试管中一起混合共20μl,水浴锅中42℃加热15min,95℃加热3min之后放于冰上。4、qpcr扩增检验1)引物设计根据loc101929707和gadph的基因序列设计引物,其中,选择loc101929707的不同转录本之间的共同区域进行引物设计,即,所设计的引物可以检测到loc101929707的不同的转录本,具体引物序列如下:loc101929707基因:正向引物为5’-aagcaagcataagtaatcct-3’(seqidno.1);反向引物为5’-agagtgtcaaggtcagat-3’(seqidno.2)。gapdh基因:正向引物为5’-aatcccatcaccatcttccag-3’(seqidno.3);反向引物为5’-gagccccagccttctccat-3’(seqidno.4)。2)扩增用superrealpremixplus(sybrgreen)(货号:fp205),进行扩增,实验操作按产品说明书进行。每个样本设置3个平行管,所有扩增反应均重复三次以上以保证结果的可靠性。表1pcr反应体系试剂体积2×superrealpremixplus10μl正向引物0.6μl反向引物0.6μl5×roxreferencedye△2μldna模板2μl灭菌蒸馏水4.8μl扩增程序为:95℃15min,(95℃10s,55℃30s,72℃32s)×40个循环。在60-95℃进行融解曲线分析,温度升高速度0.5℃/5s,通过融解曲线分析和电泳确定目的条带,2-δδct法进行相对定量。5、结果结果如图1所示,与正常人的血液相比,loc101929707基因在脓毒症患者血液中的表达水平显著上调,差异具有统计学意义(p<0.05),同rna-sep结果一致,其中,显著上调的脓毒症患者有33个,非差异表达的患者有2个,提示loc101929707可作为分子标志物应用于脓毒症的诊断。上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。序列表<110>泰山医学院泰山医学院附属医院<120>一种与脓毒症发生发展相关的分子标志物及其应用<160>4<170>siposequencelisting1.0<210>1<211>20<212>dna<213>人工序列(artificialsequence)<400>1aagcaagcataagtaatcct20<210>2<211>18<212>dna<213>人工序列(artificialsequence)<400>2agagtgtcaaggtcagat18<210>3<211>21<212>dna<213>人工序列(artificialsequence)<400>3aatcccatcaccatcttccag21<210>4<211>19<212>dna<213>人工序列(artificialsequence)<400>4gagccccagccttctccat19当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1