一种融合蛋白及其制备利拉鲁肽中间体多肽的方法与流程
本发明涉及基因工程及多肽制备方法技术领域,具体涉及一种融合蛋白及其制备利拉鲁肽中间体多肽的方法。
背景技术:
糖尿病是由于遗传和环境因素相互作用,引起胰岛素绝对或相对分泌不足以及靶组织细胞对胰岛素敏感性降低,引起蛋白质、脂肪、水和电解质等一系列代谢紊乱综合征,其中以高血糖为主要标志。临床典型病例可出现多尿、多饮、多食、消瘦等表现,即“三多一少”症状。而近年来,随着生活水平的提高,饮食结构变化,大多数人动少坐多等因素,导致全球糖尿病发病率增长迅速。其中,1型糖尿病患者占10%,2型糖尿病患者占90%。
利拉鲁肽(liraglutide)是一种通过基因重组技术生产的胰高血糖素样肽(glp-1)类似物,与天然人glp-1(7-37)具有97%的序列同源性,与天然的glp-1不同的是,利拉鲁肽在人体中的药代动力学和药效动力学特性更适用于每天1次的给药方案。皮下注射给药后,其主要通过如下机理延长作用时间:一是通过自联作用使吸收减慢,二是与白蛋白结合,三是对dpp-ⅳ和nep具有更高的酶稳定性,从而具有较长的血浆半衰期。在2型糖尿病患者中,单次给予利拉鲁肽可以观察到胰岛素分泌率以葡萄糖浓度依赖的模式增加。目前国内利拉鲁肽完全依赖进口,价格昂贵,因此迫切需要提供一种利拉鲁肽的制备方法,为广大糖尿病患者带来福音。
利拉鲁肽作为胰高血糖素肽(glp-1)类似物的代表药物之一,在美国和欧洲地区,它作为2型糖尿病患者经二甲双胍单药或其他抗糖尿病口服药物治疗失败后的二三线药物使用。2013年版中国2型糖尿病防治指南中规定将胰高血糖素(glp-1)类似物作为三线治疗药物使用。利拉鲁肽的多个临床试验研究已经证明联合不同的口服降糖药可以有效控制血糖,并能够使患者减轻体重、减少收缩压及改善胰岛β细胞功能。
利拉鲁肽结构式如下:
nh2-his-ala-glu-gly-thr-phe-thr-ser-asp-val-ser-ser-tyr-leu-glu-gly-gln-ala-ala-lys-(n-ε-(n-α-palmitoyl-l-γ-glutamyl))-glu-phe-ile-ala-trp-leu-val-arg-gly-arg-gly-cooh
由以上结构式可知:利拉鲁肽分子式为c172h265n43o51,分子量为3751.20,是在天然glp-1分子结构上将第34位的赖氨酸lys改为精氨酸arg,并在26位增加了1条16碳棕榈脂肪酸(n-ε-(γ-glu(n-α-十六酰基)))侧链而得到的衍生物。
利拉鲁肽最早由诺和诺德公司开发研制,通过基因重组技术,利用酵母生产获得。现有技术中中间体多肽glp-1(7-37)的合成方法主要采用化学合成,如专利cn104045706b公开了使用多种大量有机溶剂,对于环境不友好,且步骤繁琐不利于大规模工业放大;工艺杂质多;总收率仅18%。
另外涉及生物制备方法的专利cn104745597a中公开了表达方式为胞内可溶性表达,表达量较低,不利于工业化放大。专利cn104592381a中公开了包涵体溶解耗时过长,体积过大,使用大量的尿素;包涵体需要长时间复性并且复性蛋白浓度0.2g/l,复性所需体积过大,不利于工业放大。
技术实现要素:
本发明的目的在于提供一种融合蛋白和制备利拉鲁肽中间体多肽glp-1(7-37)的方法,通过基因重组技术,利用大肠杆菌发酵诱导表达获得leadingpeptide-ddddk-glp-1(7-37)融合蛋白,其中leadingpeptide作为融合蛋白的前导肽,有助于融合蛋白的高水平表达和利拉鲁肽中间体多肽的复性;ddddk表示天冬氨酸-天冬氨酸-天冬氨酸-天冬氨酸-赖氨酸,作为肠激酶识别位点,用于切除融合蛋白的leadingpeptide;glp-1(7-37)表示人胰高血糖素样肽的7位-37位氨基酸序列片段(第34位氨基酸由lys突变为arg),是目的蛋白序列。上述融合蛋白经过溶解、变复性、酶切、分离等操作获得高收率和高纯度的多肽glp-1(7-37),解决了现有技术中存在的杂质多、收率低、使用大量有机试剂对环境不友好,胞内可溶性表达导致表达量低,包涵体溶解和变复性时间长,蛋白浓度低导致变复性体积过大,不适合大规模生产,并限制了产能提升的问题。
为了实现上述目的,本发明提供如下的技术方案,一种用于合成利拉鲁肽中间体多肽glp-1(7-37)的融合蛋白leadingpeptide-ddddk-glp-1(7-37),包含seqidno.1所示的氨基酸序列,采用如下前导肽:
mathavsvlkgdgx1vqgiinfeqhesngx2vkvwgsihglx3eglhgfhvhkfvnqhlcgx4hlvalx5lv,
其中x1,x2:为p和y中的任何一个氨基酸;
x3,x4和x5:为s,t和y中的任何一个氨基酸。
本发明还提供了一种重组表达载体,包含编码所述融合蛋白的编码基因。
作为优选,所述重组表达载体,通过将所述编码基因克隆插入质粒载体pet-24a(+)、pet-28a(+)、pet-29a(+)、pet-39b(+)中获得重组表达载体pet-24a(+)-leadingpeptide-ddddk-glp-1(7-37)、pet-28a(+)-leadingpeptide-ddddk-glp-1(7-37)、pet-29a(+)-leadingpeptide-ddddk-glp-1(7-37)或pet-39b(+)-leadingpeptide-ddddk-glp-1(7-37)。
本发明还提供了一种包含所述重组表达载体的重组工程菌,采用所述的重组表达载体转入到大肠杆菌中得到,所述大肠杆菌包括jm109(de3)、hms174(de3)、bl21(de3)和rostta2(de3)等。
本发明还提供了一种所述重组工程菌在重组利拉鲁肽中间体glp-1(7-37)表达方面的应用。
本发明还提供了一种利用所述编码基因合成利拉鲁肽中间体多肽glp-1(7-37)的方法,具体包括以下步骤:1)、合成编码上述融合蛋白leadingpeptide-ddddk-glp-1(7-37)的编码基因;2)、将编码基因连接到表达载体中;3)、将带有编码基因的重组表达载体转化到大肠杆菌中,构建重组工程菌;4)、利用抗性平板筛选含有目的基因质粒的重组工程菌;5)、重组工程菌发酵,诱导胞内不溶性包涵体形式的融合蛋白的表达,表达量高;所述融合蛋白包含seqidno.1所示的氨基酸序列;6)、将收集后的菌体进行细胞高压均质破碎,收集包涵体、然后将包涵体经过洗涤和变复性;7)、酶切转化、分离纯化获得中间体多肽glp-1(7-37)。
作为本发明的进一步改进,所述的步骤2)中编码基因与表达载体的连接方式为:通过hindiii/xhoi、hindiii/ncoi、xhoi/eagi或者saci/sali等酶切位点插入到质粒载体pet-24a(+)、pet-28a(+)、pet-29a(+)或pet-39b(+)相应酶切位点中。
作为本发明的进一步改进,所述步骤5)中重组工程菌进行发酵培养,诱导表达所用的诱导剂为异丙基硫代半乳糖苷(iptg)。
作为本发明的进一步改进,所述步骤6)中将洗涤后的包涵体在ph为7.5-14的碱性条件下,按照蛋白浓度为5-40g/l加入包涵体溶解缓冲液,进行溶解变复性,缩小操作体积,降低试剂成本;溶解后就可以进行酶切,变复性时间很短不超过1h,缩短工艺时间,提高glp-1(7-37)的收率。
作为本发明的进一步改进,所述步骤7)中所述酶切转化、分离纯化的具体方式为:步骤6)变复性后的融合蛋白经肠激酶在37℃下酶解8-12h后即可得到中间体多肽、标签和连接肽的混合液,混合液使用离子交换分离即可获得纯度符合要求的中间体多肽样品。
纯化后的利拉鲁肽中间体多肽hplc纯度可以达到92%以上,用于侧链的修饰。纯化后的多肽经hplc-mass鉴定分子量为3383da,为正确的利拉鲁肽中间体多肽的分子量。
本发明相对现有技术,具有以下优势:(1)通过改变前导肽序列,构建leadingpeptide-ddddk-glp-1(7-37)融合蛋白,表达方式变为胞内不溶性包涵体表达,表达量显著增加;(2)洗涤后的包涵体采用碱溶,无需使用大量的变性剂,按照蛋白浓度为5-40g/l的高浓度加入包涵体溶解缓冲液,变复性时间大大缩短不超过1h,溶解后既可以酶切,肠激酶酶解时间大大缩短;减少复性工序,缩小酶切体系,降低化学试剂成本,有利于工业化放大;(3)采用离子交换分离纯化,分离度高,纯化效果好,杂质少,操作简单。本发明制备的利拉鲁肽中间体多肽纯度达到92%以上,收率大于87%。
附图说明
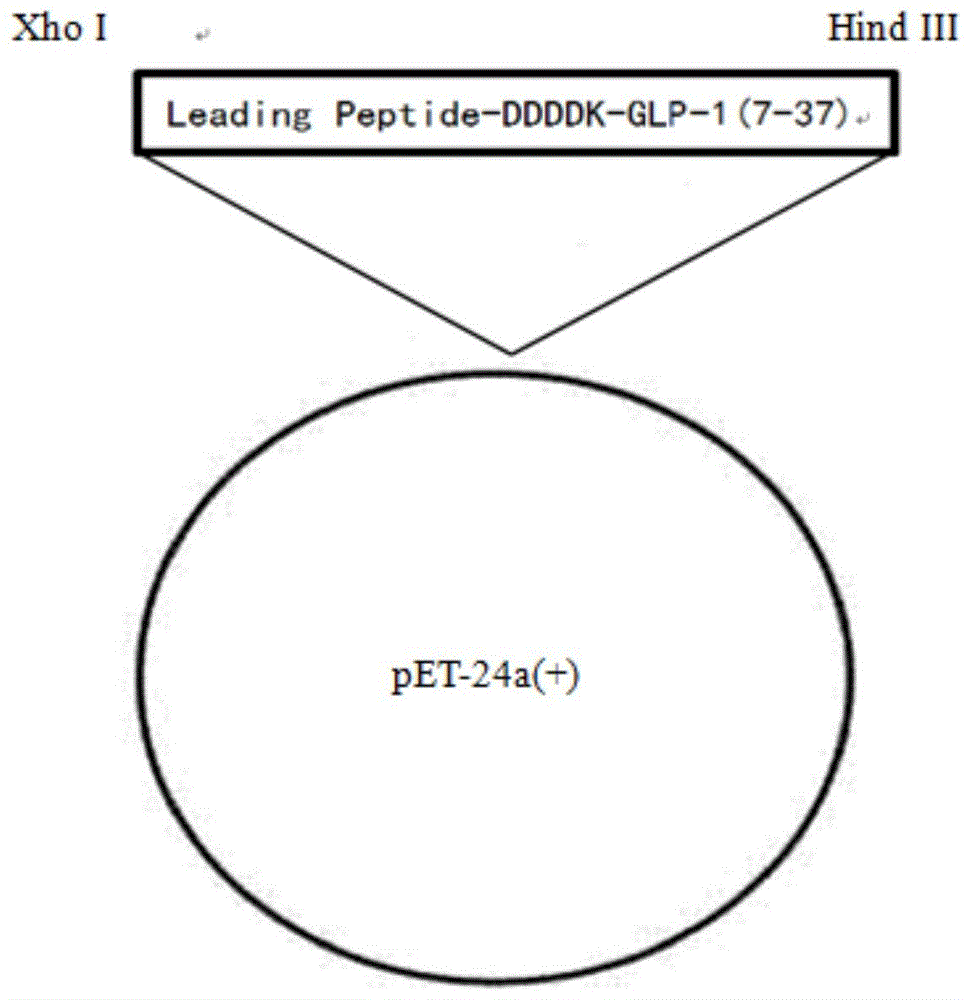
图1是实施例1中重组质粒的构建图。
图2是实施例2中发酵过程中菌体生长曲线图。
图3是实施例3中酶切后混合液阳离子纯化图。
图4是实施例3中离子交换洗脱峰的hplc谱图。
图5是实施例3中中间体多肽质谱图。
具体实施方式
为便于本领域技术人员理解本发明内容,下面将结合具体实施例进一步描述本发明的技术方案,但以下内容不应以任何方式限制本发明权利要求书请求保护的范围。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1重组工程菌的构建
利用常规的化学合成方法合成leadingpeptide-ddddk-glp-1(7-37)融合蛋白的基因,将获得的序列cdna通过hindiii/xhoi酶切位点插入到质粒pet-24a(+)相应酶切位点中,构建成的重组质粒如图1所示,插入编码leadingpeptide-ddddk-glp-1(7-37)融合蛋白基因的重组质粒通过常规的化学转化法转入到宿主大肠杆菌jm109(de3)中。
实施例2工程菌发酵培养
接种实施例1所得的重组工程菌阳性克隆于lb培养基中,在37℃振荡培养至od600值达到2时作为种子液,接入6l的发酵培养基中进行培养。当发酵液od600值达到50时加入iptg进行诱导,诱导10h后放罐。放罐后离心收集菌体。发酵过程中菌体生长曲线图如图2所示。
实施例3中间体多肽的纯化
将实施例2所得的发酵液放罐后离心收集菌体,按照重量体积比1:10加入破碎缓冲液,通过高压均质机破碎菌体,离心收集包涵体沉淀。将沉淀按重量体积比1:10加入洗涤缓冲液,洗涤后离心收集的沉淀用洗涤液洗涤3次。将洗涤后的包涵体按照蛋白浓度为20g/l加入包涵体溶解缓冲液,调节ph为碱性溶解1h进行变复性。溶解后的包涵体溶液加入肠激酶,在37℃下酶解12h后即可得到中间体多肽、标签和连接肽的混合液。取含27.6g目的蛋白的混合液,使用离子交换纯化后获得纯度为93.2%的中间体多肽样品。如图3所示,离子交换纯化依次得到洗杂峰1、洗杂峰2、目的峰和洗杂峰3。取目的峰样品进行hplc和质谱检测,hplc检测洗脱时间为11.96min的目的蛋白的纯度为93.2%,hplc图谱如图4所示,收集到的目的蛋白为24.1g,收率为87.3%;质谱检测出目的蛋白的分子量为3383.62da,和利拉鲁肽多肽中间体分子量一致,如图5所示。
实施例4中间体多肽的纯化
将实施例2所得的发酵液放罐后离心收集菌体,按照重量体积比1:10加入破碎缓冲液,通过高压均质破碎菌体,离心收集包涵体沉淀。将沉淀按重量体积比1:10加入洗涤缓冲液,洗涤后离心收集的沉淀用洗涤液洗涤3次。将洗涤后的包涵体按照蛋白浓度为40g/l加入包涵体溶解缓冲液,调节ph为碱性溶解1h进行变复性。溶解后的包涵体溶液加入肠激酶,在37℃下酶解8h后即可得到中间体多肽、标签和连接肽的混合液。取含25.4g目的蛋白的混合液进行离子交换层析纯化,取洗脱峰样品进行hplc和质谱检测,hplc检测目的蛋白的纯度为92.8%和收集到的目的蛋白为22.4g,收率为88.2%;质谱检测出目的蛋白的分子量和利拉鲁肽多肽中间体分子量一致。
实施例5中间体多肽的纯化
将实施例2所得的发酵液放罐后离心收集菌体,按照重量体积比1:10加入破碎缓冲液,通过高压均质机破碎菌体,离心收集包涵体沉淀。将沉淀按重量体积比1:10加入洗涤缓冲液,离心收集的沉淀用洗涤液洗涤3次。将洗涤后的包涵体按照蛋白浓度为5g/l加入包涵体溶解缓冲液,调节ph为碱性溶解1h进行变复性。溶解后的包涵体溶液加入肠激酶,在37℃下酶解12h后即可得到中间体多肽、标签和连接肽的混合液。取含26.8g目的蛋白的混合液进行离子交换层析纯化,取洗脱峰样品进行hplc和质谱检测,目的蛋白的纯度为92.3%,收集到的目的蛋白为23.5g,收率为87.7%;质谱检测出目的蛋白的分子量与利拉鲁肽多肽中间体分子量一致。
序列表
<110>美药星(南京)制药有限公司
南京汉欣医药科技有限公司
<120>一种融合蛋白及其制备利拉鲁肽中间体多肽的方法
<160>1
<170>siposequencelisting1.0
<210>1
<211>103
<212>prt
<213>人工序列(artificialsequence)
<400>1
metalathrhisalavalservalleulysglyaspglyxaavalgln
151015
glyileileasnphegluglnhisgluserasnglyxaavallysval
202530
trpglyserilehisglyleuxaagluglyleuhisglyphehisval
354045
hislysphevalasnglnhisleucysglyxaahisleuvalalaleu
505560
xaaleuvalaspaspaspasplyshisalagluglythrphethrser
65707580
aspvalsersertyrleugluglyglnalaalalysglupheileala
859095
trpleuvalargglyarggly
100
- 还没有人留言评论。精彩留言会获得点赞!