人工组织前体及制备其的方法与流程
本发明涉及组织工程领域和3d打印领域。具体而言,本发明涉及一种人工组织前体,其包含固体支持物和多个微囊,其中,至少一个微囊与固体支持物贴合,所述微囊包含细胞和包裹细胞的生物相容性材料;制备所述人工组织前体的方法;用于制备人工组织前体的试剂盒和套盒;由所述人工组织前体培养得到的人工组织,例如人工管腔;包含所述人工组织前体或人工管腔的管腔植入体或管腔模型;人工组织前体用于制备人工组织、管腔植入体或管腔模型的用途;以及,人工组织用于制备管腔植入体或管腔模型的用途。
背景技术:
血管移植术和血管补片修补术可用于对狭窄、闭塞、扩张、损伤或畸形的血管进行替换、重建或修补。常见的血管移植物或血管补片的来源为患者自体的动脉或静脉,但是,在患者自体的脉管供给不足的情况下(例如患者患有脉管疾病或先前已实施过血管移植术),需要使用人工血管(补片)或异源血管(补片)作为替代物。
人工血管的研制开始于20世纪初,用于制造人工血管的材料包括金属、玻璃、聚乙烯、硅橡胶等。大量动物实验发现,这些材料制备的人工血管在短期内会出现腔内血栓,因此无法用于临床。
1952年,voorhees将用维尼纶制造的人工血管应用到动物试验中并获得成功(参见voorheesabjr,jaretzkia3rd,blakemoreah.theuseoftubesconstructedfromvinyon“n”clothinbridgingarterialdefects.j.annalsofsurgery,1952,135(3):332-336)。20世纪50-70年代,管壁带有网孔的人工血管陆续出现,采用的材料包括涤纶、真丝、膨体聚四氟乙烯等。但是,单纯通过材料的改进还无法解决由血栓和新生内膜增厚所引起的血管再狭窄或堵塞的问题。研究人员进一步尝试了优化人工血管的材料,包括:从1980年开始对人工血管内表面添加材料涂层,如碳涂层、纳米颗粒涂层、蛋白涂层等;从1982年开始使用复合型材料制备人工血管;从1984年开始对人工血管内表面进行材料的改性,如材料内添加肝素或尿激酶等抗凝剂,对内壁材料磺酸化、等离子体化;从1992年开始研发新型生物相容性抗凝材料,如聚氨酯;从1998年开始使用天然生物材料,如脱细胞血管基质材料支架。这些方法在一定程度上确实对人工血管的性能有所改善,但这些人工血管植入体内后,依然会出现血栓和再狭窄的情况,无法达到与正常血管一致的功能。相关文献也报道了这些现象,例如macleoddc,straussbh,dejongm,escanedj,umansva,vansuylenrj,verkerka,defeyterpj,serruyspw.proliferationandextracellularmatrixsynthesisofsmoothmusclecellsculturedfromhumancoronaryatheroscleroticandrestenoticlesions.jamcollcardiol.1994,23(1):59-65;以及baumgartneri,schainfeldr,grazianil.managementofperipheralvasculardisease.annualreviewofmedicine.2005,56(1):249-272。
正常的血管之所以不出现血栓,是因为其管腔内壁有一层内皮细胞层。因此,要想人工血管达到和正常血管一样的功能,最根本的解决办法就是使人工血管内皮化,也就是在人工血管的内壁表面形成一层完整的内皮细胞层。
1978年,herring等人首先报道了使用自体内皮细胞种植技术对人工血管进行内皮化的实验研究(参见herringm,gardnera,gloverj.asingle-stagedtechniqueforseedingvasculargraftswithautogenousendothelium.surgery.1978,84(4):498-504)。该技术将自体来源的内皮细胞在体外培养扩增后,直接种植到人工血管内壁表面,希望经过体外短时间培养并植入体内后,这些内皮细胞能够形成完整的内皮细胞层。该研究为临床内皮细胞种植研究开创了先河。但是,内皮细胞体外培养生长缓慢,难以获得足够数量的细胞,且传代5-8代后迅速发生衰老,直接影响细胞种植后的功能体现。大量的体内外实验证明,这种将内皮细胞直接种植在人工血管内壁的方法,细胞抗血流冲击能力弱,容易脱落,无法形成内皮细胞层,与没有种植内皮细胞的人工血管相比,在抗血栓方面没有明显差异(参见herringm,smithj,dalsingm,gloverj,comptonr,etchbergerk,zollingert.endothelialseedingofpolytetrafluoroethylenefemoralpoplitealbypasses:thefailureoflow-densityseedingtoimprovepatency.jvascsurg,1994;20(4):650-655;以及jensenn,lindbladb,bergqvistd.endothelialcellseededdacronaortobifurcatedgrafts:plateletdepositionandlong-termfollow-up.jcardiovascsurg(torino),1994;35(5):425-429)。
1986年,研究人员开始了组织工程血管的研究,随后将干细胞作为种子细胞进行人工血管的构建。干细胞的来源主要包括胚胎干细胞、造血干细胞、间充质干细胞和诱导性多能干细胞(ips)。将干细胞作为种子细胞构建人工血管的方法包括:制造血管支架材料,将干细胞在体外诱导为血管细胞(包括内皮细胞,平滑肌细胞和成纤维细胞)后,种植在支架材料中,进行体内植入;或者直接将干细胞种植到血管支架材料中。后者的具体过程是:先制备血管支架,再将培养好的种子细胞以细胞悬液的方式滴加在血管支架表面,经过体外培养,使细胞粘附在支架表面,再植入体内。细胞要进入支架内部,需要经过迁移过程。因此,这两种方法制造的人工血管往往在支架表面有大量的细胞聚集,而内部只有很少量的细胞存在,或者细胞分布不均匀,从而使制造的人工血管难以形成完整的结构和功能。如果是多种细胞种植在支架中,更会出现细胞分布紊乱的现象。因此,使用这两种方法制造的人工血管,其内部血管细胞排列紊乱,难以形成完整的内皮细胞层以及结构规整的平滑肌细胞层,依然无法应用于临床。
发明概述
为了解决上述技术问题,本申请发明人开发了新的用于制备人工组织前体的方法。在某些优选的实施方案中,所述人工组织前体是人工管腔前体,其可以形成人工管腔(例如人工血管)。
在一个方面,本发明涉及一种人工组织前体,其包含固体支持物和多个微囊,其中,至少一个微囊与固体支持物贴合,所述微囊包含细胞和包裹细胞的生物相容性材料。
在某些优选的实施方案中,所述人工组织前体为管腔(例如循环管腔、消化管腔、呼吸管腔、泌尿管腔或生殖管腔)前体。
在某些优选的实施方案中,所述管腔为包含上皮细胞的管腔(例如血管,食管,气管,胃,胆管,肠道(包括小肠和大肠,例如十二指肠、空肠、回肠、盲肠(包括阑尾)、升结肠、结肠右曲、横结肠、结肠左曲、降结肠、乙状结肠、直肠),输卵管,输精管,输尿管,膀胱或淋巴管)。
在某些优选的实施方案中,所述人工组织前体为管状或片状。
在某些优选的实施方案中,多个所述微囊构成一个或多个生物构建体。
在某些优选的实施方案中,一个或多个生物构建体与固体支持物贴合。
在一个方面,本发明涉及一种制备所述人工组织前体的方法,所述人工组织前体为管状;其包含以下步骤:
(i)制备管状(例如圆形管状;例如侧壁开口或不开口的管状)生物构建体;
(ii)将管状生物构建体与管状固体支持物的内壁进行贴合。
在某些优选的实施方案中,制备管状生物构建体通过包含以下步骤的方法进行:
(1)提供一种或多种微囊,其全部或者部分表面附着有第一组分;优选地,所述第一组分包含于第一试剂中;
(2)在临时支持物表面的预设区域上涂布含有第二组分的第二试剂,其中,当所述第一组分与第二组分接触时,能够产生粘连效果,实现粘合作用;所述临时支持物为管状或柱状(例如侧壁不开口的圆形管状、侧壁开口的圆形管状、圆柱状或沿部分圆周设置的柱状)物,所述预设区域位于临时支持物的曲面;任选地,在涂布第二试剂之前,将衬底材料涂布在临时支持物表面的预设区域上;
(3)将步骤(1)中的全部或者部分表面附着有第一组分的微囊放置于涂布了第二试剂的预设区域,使所述微囊表面上的第一组分与预设区域上的第二组分接触,产生粘连效果,从而将所述微囊组装(粘合)成第一层结构,所述第一层结构为管状结构;
任选地,所述方法还包括以下步骤:
(4)在前一步骤产生的结构上涂布第二试剂;
(5)将步骤(1)中的全部或者部分表面附着有第一组分的微囊放置于前一步骤产生的结构上,使所述微囊表面上的第一组分与前一步骤产生的结构上的第二组分接触,产生粘连效果,从而在前一步骤产生的结构上,将所述微囊组装(粘合)成另一层结构;
(6)任选地,重复步骤(4)和(5)一次或多次;
从而得到管状生物构建体。
在一个方面,本发明涉及另一种制备所述人工组织前体的方法,所述人工组织前体为管状,其包含以下步骤:
(i)制备管状(例如圆形管状;例如侧壁开口或不开口的管状)生物构建体;
(ii)将管状生物构建体与管状固体支持物的内壁进行贴合。
在某些优选的实施方案中,制备管状生物构建体通过包含以下步骤的方法进行:
(1)提供一种或多种微囊,其全部或者部分表面附着有第一组分;优选地,所述第一组分包含于第一试剂中;
(2)在临时支持物的表面上,用含有第二组分的第二试剂绘制预设的环形(例如圆环或扇环)图案,其中,当所述第一组分与第二组分接触时,能够产生粘连效果,实现粘合作用;所述临时支持物具有至少一个平面,所述环形图案位于临时支持物的平面;
(3)将步骤(1)中的全部或者部分表面附着有第一组分的微囊放置于第二试剂绘制的预设的环形图案上,使所述微囊表面上的第一组分与所述环形图案上的第二组分接触,产生粘连效果,从而将所述微囊组装(粘合)成第一层结构,所述第一层结构为环形结构;
(4)在环形结构上涂布第二试剂;
(5)将步骤(1)中的全部或者部分表面附着有第一组分的微囊放置于前一步骤产生的结构上,使所述微囊表面上的第一组分与前一步骤产生的结构上的第二组分接触,产生粘连效果,从而在前一步骤产生的结构上,将所述微囊组装(粘合)成另一层结构;
(6)任选地,重复步骤(4)和(5)一次或多次;
从而得到管状生物构建体。
在一个方面,本发明涉及另一种制备所述人工组织前体的方法,所述人工组织前体为片状,其包含以下步骤:
(i)制备片状(例如平面的片状或弯曲的片状)生物构建体;
(ii)将片状生物构建体与片状固体支持物进行贴合。
在某些优选的实施方案中,制备片状生物构建体通过包含以下步骤的方法进行:
(1)提供一种或多种微囊,其全部或者部分表面附着有第一组分;优选地,所述第一组分包含于第一试剂中;
(2)在临时支持物表面的预设区域上涂布含有第二组分的第二试剂,其中,当所述第一组分与第二组分接触时,能够产生粘连效果,实现粘合作用;所述临时支持物具有至少一个平面,所述预设的图案位于临时支持物的平面;
(3)将步骤(1)中的全部或者部分表面附着有第一组分的微囊放置于涂布了第二试剂的预设区域,使所述微囊表面上的第一组分与预设区域上的第二组分接触,产生粘连效果,从而将所述微囊组装(粘合)成第一层结构,所述第一层结构为平面的片状结构;
任选地,所述方法还包括以下步骤:
(4)在前一步骤产生的结构上涂布第二试剂;
(5)将步骤(1)中的全部或者部分表面附着有第一组分的微囊放置于前一步骤产生的结构上,使所述微囊表面上的第一组分与前一步骤产生的结构上的第二组分接触,产生粘连效果,从而在前一步骤产生的结构上,将所述微囊组装(粘合)成另一层结构;
(6)任选地,重复步骤(4)和(5)一次或多次,得到平面的片状生物构建体;
任选地,所述方法还包括,对平面的片状生物构建体进行弯折,得到弯曲的片状生物构建体。
在一个方面,本发明涉及另一种制备所述人工组织前体的方法,所述人工组织前体为片状,其包含以下步骤:
(i)由上述制备片状生物构建体的方法,制备片状生物构建体;
(ii)提供制备固体支持物的材料(例如生物相容性材料),在片状生物构建体上,制备片状固体支持物。
在某些优选的实施方案中,通过3d打印或喷涂的方法制备片状固体支持物。
在一个方面,本发明涉及另一种制备所述人工组织前体的方法,所述人工组织前体为管状,其包含以下步骤:
(i)通过上述制备片状生物构建体的方法,制备片状生物构建体;
(ii)将步骤(i)制得的片状生物构建体进行弯折,和/或将片状生物构建体的边缘进行粘合,得到管状生物构建体;
(iii)将管状生物构建体与管状固体支持物的内壁进行贴合。
在一个方面,本发明涉及另一种制备所述人工组织前体的方法,所述人工组织前体为管状,其包含以下步骤:
(i)由上述任一项定义的制备管状生物构建体的方法,制备管状生物构建体;
或者,由如上定义的制备片状生物构建体的方法,制备片状生物构建体;之后,对制得的片状生物构建体进行弯折,和/或将片状生物构建体的边缘进行粘合,得到管状生物构建体;
(ii)提供制备固体支持物的材料(例如生物相容性材料),在管状生物构建体的外壁上,制备管状固体支持物。
在某些优选的实施方案中,通过3d打印或喷涂的方法制备管状固体支持物。
在一个方面,本发明涉及另一种制备所述人工组织前体的方法,其包含以下步骤:
(1)提供一种或多种微囊,其全部或者部分表面附着有第一组分;优选地,所述第一组分包含于第一试剂中;
(2)提供固体支持物,在所述固体支持物表面的预设区域上涂布含有第二组分的第二试剂,其中,当所述第一组分与第二组分接触时,能够产生粘连效果,实现粘合作用;
(3)将步骤(1)中的全部或者部分表面附着有第一组分的微囊放置于涂布了第二试剂的预设区域,使所述微囊表面上的第一组分与预设区域上的第二组分接触,产生粘连效果,从而在固体支持物表面,将所述微囊组装(粘合)成第一层结构;
任选地,所述方法还包括以下步骤:
(4)在前一步骤产生的结构上涂布第二试剂;
(5)将步骤(1)中的全部或者部分表面附着有第一组分的微囊放置于前一步骤产生的结构上,使所述微囊表面上的第一组分与前一步骤产生的结构上的第二组分接触,产生粘连效果,从而在前一步骤产生的结构上,将所述微囊组装(粘合)成另一层结构;
(6)任选地,重复步骤(4)和(5)一次或多次;
从而得到人工组织前体。
在某些优选的实施方案中,所述固体支持物为管状或片状。
在某些优选的实施方案中,所述固体支持物为管状固体支持物,所述预设区域位于固体支持物的内壁。
在本发明的制备人工组织前体的方法中,优选地,所述第一组分和/或第二组分为生物相容性材料,为来源于生物的材料,和/或为生物可降解材料。
在某些优选的实施方案中,所述第一组分与第二组分接触而产生的粘连效果可用于将两个微囊粘合在一起,形成生物构建体;并且由此所获得的生物构建体的拉伸模量不低于10pa,例如不低于20pa,不低于30pa,不低于40pa,不低于50pa,不低于60pa,不低于70pa,不低于80pa,不低于90pa,不低于100pa,不低于200pa,不低于300pa,不低于400pa,不低于500pa,不低于600pa,不低于700pa,不低于800pa,不低于900pa或不低于1000pa。
在某些优选的实施方案中,所述第一组分和第二组分是选自下列的组合:
(1)纤维蛋白原和凝血酶;
(2)海藻酸盐(例如海藻酸钠)或氧化的海藻酸盐(例如氧化的海藻酸钠)和含有ca2+、mg2+、ba2+、sr2+、或fe3+的物质(例如含有ca2+、mg2+、ba2+、sr2+、或fe3+的溶液或半固体(例如凝胶));
(3)含马来酰亚胺基团的分子(例如含有马来酰亚胺基团的聚乙二醇(mal-peg))和含自由巯基的分子(例如含有自由巯基的聚乙二醇(peg-sh));
(4)含有阴离子的物质(例如含有阴离子的溶液或半固体(例如凝胶))和α-氰基丙烯酸酯(例如α-氰基丙烯酸甲酯,α-氰基丙烯酸乙酯,α-氰基丙烯酸异丁酯,α-氰基丙烯酸异己酯,α-氰基丙烯酸正辛酯);
(5)纤维蛋白原和α-氰基丙烯酸酯(例如α-氰基丙烯酸甲酯,α-氰基丙烯酸乙酯,α-氰基丙烯酸异丁酯,α-氰基丙烯酸异己酯,α-氰基丙烯酸正辛酯);
(6)血清白蛋白(例如,牛血清白蛋白)和戊二醛;
(7)含氨基甲酸酯基团(-nhcoo-)或异氰酸酯基团(-nco)的分子(例如含氨基甲酸酯基团的聚乙二醇或含异氰酸酯基团的聚乙二醇)和含活泼氢的分子(例如含羧基的聚乙二醇);
(8)明胶-间苯二酚和戊二醛;
(9)碳化二亚胺交联明胶和聚l-谷氨酸(plga);和
(10)胺基化明胶和醛基化多糖。
在一个方面,本发明涉及一种生物构建体,由如上任一项定义的制备生物构建体的方法得到。
在一个方面,本发明涉及一种用于制备人工组织前体的试剂盒,所述试剂盒包含微囊,以及彼此分离的第一试剂和第二试剂,其中,所述微囊包含细胞和包裹细胞的生物相容性材料,所述第一试剂含有第一组分,所述第二试剂含有第二组分,并且当所述第一组分与第二组分接触时,能够产生粘连效果,实现粘合作用。
在某些优选的实施方案中,所述第一组分与第二组分接触而产生的粘连效果可用于将两个微囊粘合在一起,形成生物构建体;并且由此所获得的生物构建体的拉伸模量不低于10pa(例如不低于100pa)。
在某些优选的实施方案中,所述第一组分和/或第二组分为生物相容性材料;为来源于生物的材料;和/或,为生物可降解材料。
在某些优选的实施方案中,所述第一组分和第二组分是选自下列的组合:
(1)纤维蛋白原和凝血酶;
(2)海藻酸盐(例如海藻酸钠)或氧化的海藻酸盐(例如氧化的海藻酸钠)和含有ca2+、mg2+、ba2+、sr2+、或fe3+的物质(例如含有ca2+、mg2+、ba2+、sr2+、或fe3+的溶液或半固体(例如凝胶));
(3)含马来酰亚胺基团的分子(例如含有马来酰亚胺基团的聚乙二醇(mal-peg))和含自由巯基的分子(例如含有自由巯基的聚乙二醇(peg-sh));
(4)含有阴离子的物质(例如含有阴离子的溶液或半固体(例如凝胶))和α-氰基丙烯酸酯(例如α-氰基丙烯酸甲酯,α-氰基丙烯酸乙酯,α-氰基丙烯酸异丁酯,α-氰基丙烯酸异己酯,α-氰基丙烯酸正辛酯);
(5)纤维蛋白原和α-氰基丙烯酸酯(例如α-氰基丙烯酸甲酯,α-氰基丙烯酸乙酯,α-氰基丙烯酸异丁酯,α-氰基丙烯酸异己酯,α-氰基丙烯酸正辛酯);
(6)血清白蛋白(例如,牛血清白蛋白)和戊二醛;
(7)含氨基甲酸酯基团(-nhcoo-)或异氰酸酯基团(-nco)的分子(例如含氨基甲酸酯基团的聚乙二醇或含异氰酸酯基团的聚乙二醇)和含活泼氢的分子(例如含羧基的聚乙二醇);
(8)明胶-间苯二酚和戊二醛;
(9)碳化二亚胺交联明胶和聚l-谷氨酸(plga);和
(10)胺基化明胶和醛基化多糖。
在一个方面,本申请涉及一种用于制备人工组织前体的套盒,其包含一个或多个本发明的试剂盒。
在一个方面,本申请涉及一种人工组织,所述人工组织通过对本发明的人工组织前体进行培养(例如体外培养或体内培养)得到。
在某些优选的实施方案中,所述人工组织为人工管腔。
在某些优选的实施方案中,所述管腔为包含上皮细胞的管腔(例如血管,食管,气管,胃,胆管,肠道(包括小肠和大肠,例如十二指肠、空肠、回肠、盲肠(包括阑尾)、升结肠、结肠右曲、横结肠、结肠左曲、降结肠、乙状结肠、直肠),输卵管,输精管,输尿管,膀胱或淋巴管)。
在某些优选的实施方案中,所述人工管腔为管状人工管腔或片状人工管腔。
在某些优选的实施方案中,所述人工管腔为人工血管或血管补片。
在一个方面,本申请涉及一种管腔植入体,所述管腔植入体包含本发明的人工组织前体(例如管状人工组织前体或片状人工组织前体)或人工管腔。
在某些优选的实施方案中,所述管腔植入体包含一个或多个本发明的人工组织前体(例如管状人工组织前体或片状人工组织前体),或一个或多个本发明的人工管腔(例如管状人工管腔或片状人工管腔)。
在某些优选的实施方案中,所述管腔植入体为线性的管状结构,或者为枝化的管状结构。
在某些优选的实施方案中,所述管腔植入体为x形管状、y形管状或t形管状。
在某些优选的实施方案中,所述管腔为包含上皮细胞的管腔,例如血管。
在某些优选的实施方案中,所述管腔植入体为血管植入体,其包含本发明的人工血管或血管补片。
在一个方面,本申请涉及一种管腔(例如血管)模型,所述管腔模型包含本发明的人工管腔(例如人工血管)。
在某些优选的实施方案中,所述管腔模型包含一个或多个本发明的人工管腔(例如人工血管)。
在一个方面,本申请涉及本发明的人工组织前体用于制备人工组织、管腔植入体或管腔模型的用途。
在一个方面,本申请涉及本发明的人工组织用于制备管腔植入体或管腔模型的用途。
下面将结合附图和发明详述来对本发明的实施方案进行详细阐释。但是,本领域技术人员将理解,下列附图和发明详述仅用于说明本发明,而不是对本发明的范围的限定。根据附图和发明详述的详细公开内容,本发明的各种目的和有利方面对于本领域技术人员来说将变得显然。
附图说明
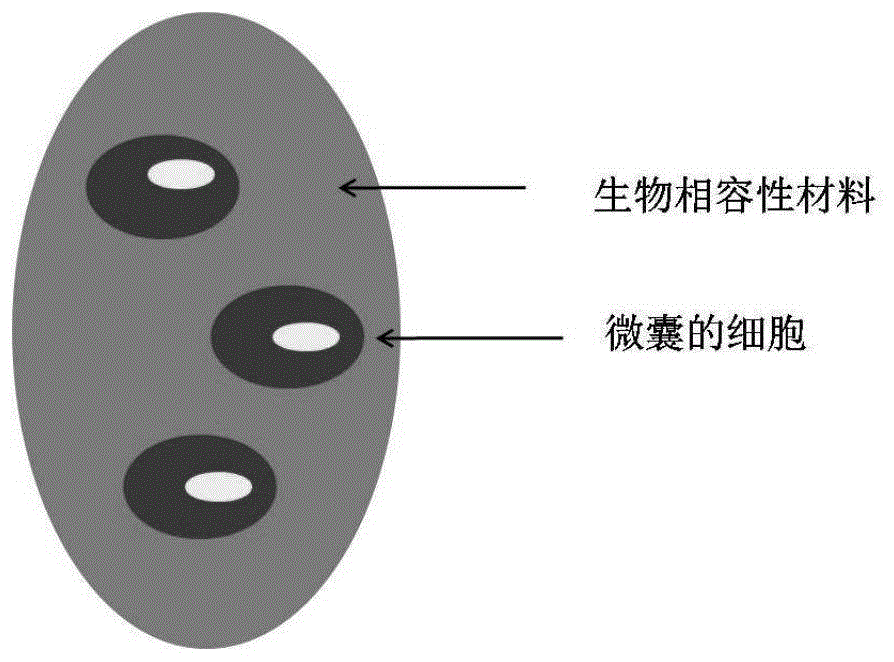
图1示意性描述了本发明的微囊的示例性结构,其包括:细胞和包裹细胞的生物相容性材料;在优选的实施方案中,细胞可均匀分散于微囊中,或者可以聚集在一起,位于微囊内部。
图2a-e示意性描述了本发明的生物砖的示例性结构,其包括:细胞,包裹细胞的核层和封装核层的壳层。
特别地,图2a示意性描述了本发明生物砖的一种结构,其包括一个核层和一个壳层,其中,所述核层包裹有细胞,并且所述壳层位于核层外侧,且封装核层。
图2b示意性描述了本发明生物砖的一种结构,其由内到外依次包含:包裹细胞的核层、封装所述核层的第一壳层、和围绕第一壳层的第二壳层。
图2c示意性描述了本发明生物砖的一种结构,其由内到外依次包含:包裹细胞的第一核层、位于第一核层外侧的包裹细胞的第二核层、和封装所述第一核层和第二核层的第一壳层。
图2d示意性描述了本发明生物砖的一种结构,其由内到外依次包含:包裹细胞的第一核层、位于第一核层外侧的包裹细胞的第二核层、封装所述第一核层和第二核层的第一壳层、和围绕第一壳层的第二壳层。
图2e示意性描述了本发明生物砖的一种结构,其由内到外依次包含:包裹细胞的第一核层、封装所述第一核层的第一壳层、包裹细胞的第二核层、和封装所述第二核层的第二壳层。
图3a-e示例性描述了本发明的包含多个管状生物构建体的管状人工组织前体的结构。
图3a为一种管状人工组织前体的侧视图,所述人工组织前体包含管状固体支持物和多个侧壁不开口的管状生物构建体,所述多个侧壁不开口的管状生物构建体在所述管状固体支持物的内部,并沿管状固体支持物的轴向排列,并且所述多个侧壁不开口的管状生物构建体的外壁均与所述管状固体支持物的内壁贴合。
图3b为一种管状人工组织前体的俯视图,所述人工组织前体包含管状固体支持物和多个侧壁不开口的管状生物构建体,所述多个侧壁不开口的管状生物构建体在所述管状固体支持物的内部,与管状固体支持物同轴设置,并且仅最外侧的侧壁不开口的管状生物构建体的外壁与所述管状固体支持物的内壁贴合。
图3c为一种管状人工组织前体的侧视图,所述人工组织前体包含管状固体支持物和多个侧壁开口的管状生物构建体,所述多个侧壁开口的管状生物构建体在所述管状固体支持物的内部,并沿管状固体支持物的轴向排列,并且所述多个侧壁开口的管状生物构建体的外壁均与所述管状固体支持物的内壁贴合。
图3d为一种管状人工组织前体的俯视图,所述人工组织前体包含管状固体支持物和多个侧壁开口的管状生物构建体,所述多个侧壁开口的管状生物构建体在所述管状固体支持物内部,与管状固体支持物同轴设置并沿径向排列,并且位于仅最外侧的侧壁开口的管状生物构建体的外壁与所述管状支持物的内壁贴合。
图3e为一种管状人工组织前体的俯视图,所述人工组织前体包含管状固体支持物和多个侧壁开口的管状生物构建体,所述多个侧壁开口的管状生物构建体在所述管状固体支持物内部,并与管状固体支持物同轴设置,并且所述多个侧壁开口的管状生物构建体的外壁均与所述管状固体支持物的内壁贴合。
图4a-e示例性描述了本发明的制备管状生物构建体的方法中,作为临时支持物的柱状物,柱状物的展开的侧面和侧面上的预设区域。
图4a示例性描述了本发明的制备管状生物构建体的方法中,作为临时支持物的圆柱状物。
图4b示例性描述了图4a的圆柱状物的展开的侧面和侧面上的预设区域,其中,所述预设区域为圆柱状物的整个侧面。
图4c示例性描述了图4a的圆柱状物的展开的侧面和侧面上的预设区域,其中,所述预设区域在展开的圆柱状物的侧面上为一矩形,并且所述预设区域沿圆柱状物的轴向贯通圆柱状物的侧面。
图4d示例性描述了图4a的圆柱状物的展开的侧面和侧面上的预设区域,其中,所述预设区域在展开的圆柱状物的侧面上为一矩形,并且所述预设区域沿圆柱状物的圆周方向贯通圆柱状物的侧面。
图4e示例性描述了图4a的圆柱状物的展开的侧面和侧面上的预设区域,其中,所述预设区域在展开的圆柱状物侧面上为一矩形,并且未沿圆柱状物的圆周方向和轴向贯通圆柱状物的侧面。
图5a示例性描述了本发明的制备人工组织前体的方法2中,作为预设区域的圆环图案和扇环图案。
图5b示例性地显示了本发明的管腔植入体或管腔模型的形状。
图6为实施例1中,原代培养第四代的脂肪间充质干细胞的显微照片。从图中可见,细胞形态均一,生长状态良好。
图7为实施例1中,包含恒河猴脂肪间充质干细胞的生物砖的形态。
图8为实施例1中,激光共聚焦显微镜拍摄的包含恒河猴脂肪间充质干细胞的生物砖的照片,其中绿色荧光为微囊的壳,红色荧光为脂肪间充质干细胞。
图9为实施例2得到的人工血管前体的照片。
图10a-c为将实施例2制得的人工血管前体植入恒河猴,术后5天得到的人工血管。图10a为人工血管的整体形态。图10b为去除管状支持物得到的组织,图10c为将组织纵向剖开后的形态。从图可以看出,管状支持物的表面已经形成了内皮组织。
图11为实施例2中,人工血管组织的he染色结果,图11a为正常血管,图11b为人工血管。如图所示,人工血管与正常血管有相似的细胞排列、内皮细胞层(细箭头所指)和平滑肌细胞层(粗箭头所指)。
图12为实施例2中,人工血管组织的α-sma染色结果,α-sma阳性细胞为平滑肌细胞。图12a为正常血管,图12b为人工血管。如图所示,构成人工血管的脂肪间充质干细胞向平滑肌细胞分化,并出现与正常血管相似的细胞形态、排列及方向性。
图13为实施例2中,人工血管组织的cd31染色结果,cd31阳性细胞为内皮细胞。图13a为正常血管,图13b为人工血管。如图所示,在与血液接触面,构成人工血管的脂肪间充质干细胞向内皮细胞分化,并出现与正常血管相似的细胞形态及排列。
图14显示了实施例3的人工血管的形态和血流方向。图14a为超声检测结果,从图中可以看出,人工血管的管腔通畅。图14b为彩色多普勒检测结果,结果显示,人工血管两侧血流方向一致,证明血管通畅。
图15a和15b为实施例3的人工血管的免疫组化法染色结果。图15a显示了α-sma染色结果,如图中粗箭头所指,人工血管中,脂肪间充质干细胞向平滑肌细胞进行分化。图15b显示了cd31染色结果,如图中细箭头所指,人工血管血管中,脂肪间充质干细胞向内皮细胞进行分化。图15c为天狼星红染色结果,如图所示,人工血管形成与正常血管相似的胶原结构。
图16a和16b为实施例4中,将人工血管前体植入恒河猴体内14天后取材,使用免疫组化染色进行检测的结果。
图16a为α-sma染色结果,如图中粗箭头所指,人工血管中有脂肪间充质干细胞向平滑肌细胞进行分化。
图16b为cd31染色结果,如图中细箭头所指,人工血管中有脂肪间充质干细胞向内皮细胞进行分化。
图17a-17c分别为实施例6中,将人工血管前体植入恒河猴体内14天后,得到的人工血管的剖面图,和对人工血管进行免疫组化染色的检测结果。
图17a为将人工血管前体植入恒河猴体内14天后,得到的人工血管的剖面图。
图17b为α-sma染色结果,如图中粗箭头所指,人工血管中有脂肪间充质干细胞向平滑肌细胞进行分化。
图17c为cd31染色结果,如图中细箭头所指,人工血管中有脂肪间充质干细胞向内皮细胞进行分化。
图18显示了实施例7的制备人工血管前体的过程。图18a:将生物砖打印在旋转杆上,形成管状生物构建体;图18b和18c:将人工血管由左至右,套在管状生物构建体上;图18d:将人工血管与管状生物构建体粘合在一起,形成人工血管前体。
图19描述了实施例8中,使用可降解的聚乳酸管状支持物,以及实施例1制得的生物砖,制备人工血管前体的过程。
图19a和19b显示了以聚乳酸为基本材料,采用电纺丝的方法制造出的管状固体支持物。
图19c显示了以下操作:将聚乳酸管状支持物剪开,然后在管状支持物的一面滴加医用胶,另一面对应位置放置生物砖。
图19d显示了,医用胶可以渗透通过管壁,使得生物砖与内壁相粘合在一起,得到人工血管前体。
上述操作仅为了方便观察和拍照。在实际制备中,是在聚乳酸管状固体支持物的外壁滴加医用胶,使医用胶渗透至内壁。由于医用胶可以渗透过电纺聚乳酸管壁,从而将生物砖固定。上述结果一方面说明,聚乳酸可以作为固体支持物使用,另一方面说明,电纺得到的固体支持物,由于其孔结构具有渗透性,医用胶可以渗透通过管壁,可以在固体支持物的一面滴加医用胶,在另一面放置生物砖,从而固定生物砖,得到人工组织前体。图20展示了实施例9中,利用生物砖、纤维蛋白原和凝血酶来制备管状三维构建体的实验步骤和实验结果;其中,图20a显示的是,在生物砖表面附着/组装纤维蛋白原;图20b显示的是,用辅助材料构建环状辅助结构(任选的步骤);图20c显示的是,沿环状辅助结构滴加第二试剂,绘制圆环图案;图20d显示的是,将组装单元沿圆环图案放置形成环状结构;图20e显示的是,在环状结构的上表面用第二试剂绘制圆环图案,然后将组装单元沿圆环图案放置(任选地,可以重复该步骤一次或多次,以构建含有多层结构的构建体);图20f显示的是,构建得到的管状结构;图20g显示的是,去除辅助结构(任选的步骤)。实验结果显示,本发明的方法可用于快速、多向、精确地构建管状三维构建体。
图21展示了实施例9中刚刚制备获得的管状结构(图21a)以及经培养的管状结构(图21b)的显微镜观察结果。结果显示,在刚刚制备获得的管状结构中,生物砖尚未发生相互融合,细胞在各自的生物砖中均匀分布;而在经培养的管状结构中,生物砖已完全相互融合,紧密连接在一起,形成了完整的生物构建体。
图22显示了实施例10中,使用he染色法对血管植入体的组织结构进行观察和检测的结果,图中的标尺均为200μm。结果显示:植入4小时后,生物砖之间仍存在缝隙,彼此独立不相连;植入8小时-24小时h后,生物砖逐渐相互融合成一体;随着植入时间的增加,生物砖融合成的人工血管逐渐形成与正常血管相类似的组织学结构。
图23和图24显示了实施例10中,使用免疫组化染色方法对血管植入体中cd31的表达进行检测的结果。图23为放大100倍的结果,图中的标尺均为200μm。图24为放大400倍的结果,图中的标尺均为50μm。结果显示:植入5天后,血管植入体与血液接触的腔面出现内皮细胞;随着植入时间的增加,内皮细胞不断增加,在28天时,形成与正常血管相似的较完整的内皮细胞层。
图25显示了实施例10中,使用免疫组化染色方法对血管植入体中,α-sma的表达进行检测的结果,图中的标尺均为200μm。结果显示:植入8小时后,生物砖内包裹的脂肪间充质干细胞开始向平滑肌细胞进行分化并表达α-sma;植入3天后,脂肪间充质干细胞的形态逐渐向平滑肌细胞转变且α-sma的表达进一步增加;随着植入时间的增加,平滑肌细胞量逐渐增加并形成与正常血管相似的平滑肌细胞层。
图26显示了实施例11中,使用he染色法对恒河猴自体血管与血管植入体连接处的组织结构进行观察的结果,以及使用免疫组织化学染色法分别对cd31和α-sma的表达进行检测的结果。
第一行图片为he染色法的检测结果,图中的标尺为200μm;第二行图片为cd31的检测结果,图中的标尺为50μm;第三行图片为α-sma的检测结果,图中的标尺为200μm。图中的粗箭头表示自体血管,细箭头表示血管植入体。
结果显示:在植入7天时,血管植入体与恒河猴自体血管相互连接,但彼此组织结构有显著差别,内皮细胞层连续但不完整,平滑肌细胞层不连续;随着植入时间的增加,血管植入体与恒河猴自体血管不断相互融合;在植入28天时,血管植入体与恒河猴自体血管融合成一体,内皮细胞层及平滑肌细胞层连续完整,形成与正常血管相似的组织结构。
图27为实施例12中,使用天狼猩红染色法对血管胶原进行染色的结果,图中的标尺为100μm。结果显示:血管植入体植入5天后,开始出现胶原的表达;随着植入时间的增加,表达的胶原逐渐增多并开始分层,形成与正常血管相似的胶原结构。
图28显示了实施例13中,对血管植入体进行超声检测的结果(第一行图片)和彩色多普勒检测结果(第二行图片)。结果显示,血管植入体内血管通畅,血流连续,管腔内表面光滑无血栓形成,无异常增生,与正常血管连接处无狭窄。
图29显示了实施例14中,对血管植入体进行增强ct的结果。结果显示,血管植入体血流通畅,无堵塞。
图30a和30b分别显示了实施例15中,膨体聚四氟乙烯片状固体支持物,以及用生物砖通过3d打印在其上形成的血管补片前体。
图30c和30d分别显示了实施例16中,聚己内酯片状固体支持物,以及用微囊通过3d打印在其上形成的血管补片前体。
图31a和31b分别显示了实施例17中,在恒河猴腹主动脉上制造血管缺损,以及将血管补片前体与缺损部位进行缝合。图31b图中,粗箭头所指为实施例15制得的包含生物砖的血管补片前体,细箭头所指为实施例16制得的包含微囊的血管补片前体。
图32a和32b分别显示了实施例17中,植入7天后,由包含生物砖的血管补片前体和包含微囊的血管补片前体形成的血管组织。如图所示,补片内生物砖或微囊融合成一体,形成完整的内膜。
图33显示了实施例17中,对血管组织进行cd31和α-sma免疫组化染色的结果。
图33a和33b显示了由包含生物砖的血管补片前体形成的血管组织的检测结果。结果显示,体内植入7天后,生物砖内脂肪间充质干细胞向内皮细胞(图33a)和平滑肌细胞(图33b)分化。
图33c和33d显示了由包含微囊的血管补片前体形成的血管组织的检测结果。结果显示,体内植入7天后,微囊内脂肪间充质干细胞向内皮细胞(图33c)和平滑肌细胞(图33d)分化。
图34显示了实施例18中,生物砖在进行弹性模量测试时的状态。
图35为实施例18制得的生物砖的应力应变曲线,生物砖的有效杨氏模量数值为24.77kpa。
图36示意性地展示了实施例19所使用的3d生物打印机的主要结构。
图37显示了实施例19中,在旋生仪的旋转杆上形成的管状生物构建体,其长度为20mm,厚度约1mm。
图38显示了实施例19制得的人工血管前体。
图39显示了实施例19中,植入恒河猴体内的人工血管前体。
图40为实施例19中血管植入体的荧光显微照片,其中,使用绿色荧光对血管内皮细胞进行荧光标记,图中标尺为200μm。如图所示,血管植入体形成了完整的内皮细胞层。
图41为实施例19中血管植入体的荧光显微照片,其中,使用红色荧光对血管平滑肌细胞进行荧光标记,图中标尺为200μm。如图所示,血管植入体形成了完整的平滑肌细胞层。
发明详述
在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的细胞培养、分子遗传学、核酸化学、免疫学实验室操作步骤均为相应领域内广泛使用的常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
如本说明书和所附权利要求书中使用的,单数形式“一个”、“一种”和“该/所述”包括复数的指示物,除非上下文另有明确规定。此外,本文中任何提及的“或”意在包括“和/或”,除非另有说明。
如本文中所使用的,术语“微囊”是指,含有细胞和生物相容性材料的微结构(例如,微米级至毫米级的结构),其中,细胞被包裹在所述生物相容性材料内。本发明的微囊在生理环境下(例如4-37℃,例如ph在6-8之间,例如在生理环境的流体剪切力下)具有稳定的结构。在某些优选的实施方案中,微囊具有在吸取或挤压中不会造成微囊破碎的力学强度。
如本文中使用的,术语“组织”是指由形态相同或类似、机能相同的细胞群构成的细胞集合体,并且通常还包含非细胞形态的物质(称为细胞间质,例如基质、纤维等)。组织可包括一种或多种细胞。
如本文中使用的,术语“器官”是指由不同的细胞和组织构成的、用于实现某一或某些特定功能的结构。器官可包括一种或多种组织。
如本文中使用的,术语“人工组织”是指,不是通过天然组织生成或发育过程而形成的组织。人工组织可以是人为制造的组织,例如是对人工组织前体进行培养得到的组织。
如本文中使用的,术语“人工组织前体”是指包含固体支持物以及多个本发明的微囊的物体,其中,至少一个微囊与固体支持物贴合。在某些实施方案中,人工组织前体包含固体支持物以及由微囊构建的生物构建体。在某些实施方案中,本发明的人工组织前体在培养、诱导等操作步骤后,能够形成人工组织。
在本发明中,术语“生物构建体”是指使用本发明的微囊构建的物体,其可以具有二维或三维的结构,可以用于制备人工组织前体。
如本文中使用的,术语“贴合”是指不发生相对位移。在某些实施方案中,微囊或生物构建体与固体支持物贴合,是指微囊或生物构建体结合在固体支持物上。
如本文中使用的,术语“固体支持物”是指本发明的人工组织前体中,与微囊或由微囊构成的生物构建体贴合的,具有一定形状的物体。固体支持物能够提供相应的区域,使生物构建体完全贴合在其上。
如本文中使用的,术语“管腔”是指形状为管状、具有中空内腔的器官,例如循环管腔、消化管腔、呼吸管腔、泌尿管腔或生殖管腔,例如血管,食管,气管,胃,胆管,肠道(包括小肠和大肠,例如十二指肠、空肠、回肠、盲肠(包括阑尾)、升结肠、结肠右曲、横结肠、结肠左曲、降结肠、乙状结肠、直肠),输卵管,输精管,输尿管,膀胱或淋巴管)。
如本文中使用的,术语“人工管腔”包括不是通过天然组织生成或发育过程而形成的管腔,也包括能够与天然组织共同形成管腔的片状人工组织。人工管腔可以是对本发明的人工组织前体进行培养得到的。
如本文中使用的,术语“人工血管”是指人为制造的血管替代物,其通常是管状。在某些实施方案中,人工血管用于对狭窄、闭塞、扩张、损伤或畸形的血管进行重建或修补。在某些实施方案中,人工血管是对本发明的管状人工组织前体进行培养(例如体外培养,或植入体内培养)得到的。
如本文中使用的,术语“血管补片”是指用于对破损血管进行修补的物体,其通常是片状。血管补片可以用来修补由于血管瘤、血管狭窄等原因造成的血管的瘘口,在主动脉等大血管上的运用较多。通常,血管补片要求易于缝合和止血。血管补片可适用于血管壁有缺损,但无需整个血管切除的患者。在某些实施方案中,血管补片是对本发明的片状人工组织前体进行培养(例如体外培养,或植入体内培养)得到的。
如本文中使用的,术语“管腔植入体”是指可以植入受试者体内,用于对受试者的管腔进行替换、重建或修补的物体,其包含一个或多个本发明的人工组织前体(例如管状人工组织前体或片状人工组织前体)或一个或多个人工管腔。在某些实施方案中,本发明的管腔植入体包括多个管状人工组织前体(或人工管腔),这些管状人工组织前体(或人工管腔)之间流体连通。本发明的管腔植入体可以是线性的管状结构,也可以是枝化的管状结构,例如为x形管状、y形管状或t形管状。在某些实施方案中,所述管腔植入体为血管植入体。在某些实施方案中,管腔植入体还包含药物活性成分、感应装置和/或调节装置。如本文中所使用的,术语“力学保护”是指,微囊具有一定的力学强度(例如,在吸取或挤压中不会造成微囊破碎的力学强度),从而能够减少或避免其内封装的细胞遭受外界的机械损伤/力学损伤。此外,当微囊用于制备用于管腔移植或修补的人工组织前体时,微囊可以使其包裹的细胞不被管腔内的流体冲走,有利于人工组织前体向正常组织的转化。
如本文中所使用的,术语“力学保护”是指,微囊(例如生物砖)可以保护其内包裹的细胞在操作中(例如3d生物打印过程中),不受到机械力的损伤(包括剪切力和挤压力)。使用微囊构建人工组织前体(例如人工血管前体),在植入体内后,可以保护微囊内包裹的细胞不被流动的体液(例如血流)冲走,有利于人工组织向正常组织的转化。
如本文中所使用的,术语“生物相容性材料”是指这样的材料,其(以及其降解产物)对于细胞是无毒性的,并且在植入宿主(例如人体)后与宿主相容,不会造成显著的或者严重的副作用,例如,不会对宿主(例如人体组织)造成毒害作用,不会引起宿主的免疫排斥反应、过敏反应或炎症反应等等。
如本文中所使用的,术语“生物可降解材料”是指这样的材料,其能够被细胞或生物体降解和吸收,并且其降解产物是生物相容性的。此类材料可以是天然来源的(例如来源于动植物),也可以是人工合成的。
如本文中所使用的,术语“生物材料(bio-material)”是指能够用于人体组织和器官的诊断、修复或增进其功能的天然或人造材料,其可以用于取代、修复活组织,能够执行、增进或替换组织因疾病、损伤等失去的某种功能。生物材料主要包括金属材料(例如碱金属及其合金等)、无机材料(例如生物活性陶瓷,羟基磷灰石等)和有机材料三大类,有机材料主要包含高分子材料。根据材料的用途,生物材料又可以分为生物惰性(bioinert)、生物活性(bioactive)或生物可降解(biodegradable)材料。
如本文中使用的,“粘度”是指流体粘滞性的一种量度,是流体流动力对其内部摩擦现象的一种表示。将两块面积为1㎡的板浸于液体中,两板距离为1米,若在某一块板上加1n的切应力,使两板之间的相对速率为1m/s,则此液体的粘度为1pas。
如本文中使用的,术语“生物打印”是指:利用生物材料(包括但不限于,生物分子例如蛋白质,脂质,核酸和代谢产物;细胞例如细胞溶液、含细胞的凝胶、细胞悬浮液、细胞浓缩物、多细胞聚集体和多细胞体;亚细胞结构例如细胞器和细胞膜;与生物分子相关的分子例如合成的生物分子或生物分子的类似物)的打印。如本文中使用的,术语“打印”是指,按照预定的模式沉积材料的过程。在某些优选的实施方案中,通过挤出式打印法或模块化打印法来对微囊进行打印。优选地,使用模块化打印法来对微囊进行打印。如本文中所使用的,“模块化打印法”是指,通过吸取/抓取模块(例如本发明的微囊,例如生物砖),并将其精确定位/排布来进行打印的方法。由于本发明所使用的微囊包含细胞,因此,在本文中,此类模块化打印法也被称为“模块化生物打印法”。在本发明中,生物打印优选地通过与自动的或半自动的、计算机辅助的三维原型装置(例如生物打印机)相匹配的方法来实现。然而,在本发明中,“打印”(例如生物打印)可通过各种方法来进行,包括但不限于,使用打印机(例如3d打印机或生物打印机)进行打印;使用自动化或非自动化机械过程(而非打印机)进行打印;通过手工放置或手工沉积(例如使用移液器)进行打印。
如本文中使用的,“海藻酸”是指一类由褐藻提取的多糖,其为β-1,4-d-甘露糖醛酸(m单元)和α-1,4-l-古洛糖醛酸(g单元)的无规嵌段共聚物。通常,海藻酸中的m和g单元以m-m,g-g或m-g的组合方式通过1,4糖苷键相连成为嵌段共聚物。海藻酸的实验式为(c6h8o6)n,其分子量通常为4kda-1500kda。如本文中使用的,“海藻酸盐”是指由海藻酸形成的盐,包括但不限于,海藻酸钠,海藻酸钙,海藻酸锶,海藻酸钡等。
如本文中使用的,“氧化的海藻酸盐”是指,对海藻酸盐(例如海藻酸钠)进行氧化反应后形成的产物。通常情况下,氧化反应将使得海藻酸盐(例如海藻酸钠)中的部分糖醛酸单元的羟基被氧化为醛基。
如本文中使用的,“氧化度”是指被氧化的糖醛酸单元占海藻酸或海藻酸盐的总糖醛酸单元的摩尔分数。
如本文中使用的,“粘性剂”是指用于调节液体或半固体(例如凝胶)的粘度的试剂。如本文中所描述的,本发明的第二试剂优选地具有适于绘制图案或进行涂布的粘度。因此,在某些优选实施方案中,可通过使用粘性剂来方便地调节第二试剂的粘度。
如本文中使用的,“生物砖”是指一种可用于生物打印等用途的基础单元,其包括:细胞,包裹细胞的核层,和,封装核层的壳层,其中,所述核层和壳层各自独立地由生物可降解材料制成。在本发明的某些优选实施方案中,所述核层和壳层中的生物可降解材料能够减少或避免生物砖内的细胞在操作过程中遭受机械损伤,并且能够提供物质(例如营养物质,细胞外基质,细胞因子,药物活性成分等)的可控释放,以促进细胞活性和功能(增殖、分化、迁移、分泌或新陈代谢)或维持细胞的干性。在本发明的某些优选实施方案中,所述生物砖或生物砖的壳层具有一定的力学强度,从而能够实现立体堆积。在本发明中,特别优选地,生物砖及其壳层具有适当的力学保护性能(例如,具有合适的硬度和/或弹性模量)。在某些优选的实施方案中,所述壳层也能够为细胞的生命活动提供微环境,例如营养物质。
如本文中使用的,“生物墨汁”是指,包含一种或多种本发明的微囊(例如生物砖)的液体,半固体(例如凝胶)或固体组合物。例如,本发明的生物墨汁可以是包含微囊(例如生物砖)的溶液,悬浮液,凝胶,或浓缩物。在本发明中,生物墨汁能够被用于生物打印,以产生特定的几何形状;并且优选地,所产生的几何形状能够进一步堆叠,从而形成具有特定形状和结构的生物构建体。此外,在生物打印之前,期间和/或之后,生物墨汁中的微囊(例如生物砖)内的细胞能够进行各种期望的生命活动。在优选的实施方案中,微囊(例如生物砖)内的细胞在生物打印之前处于休眠状态,而在生物打印之后进行生长和增殖,从而形成稳固的生物构建体。在优选的实施方案中,生物墨汁是可挤出的组合物。如本文中所使用的,“可挤出的”是指,组合物能够通过被迫(例如在压力下)穿过喷嘴或孔口而成形。
在一个方面,本申请涉及一种人工组织前体,其包含固体支持物和多个微囊,其中,至少一个微囊与固体支持物贴合,所述微囊包含细胞和包裹细胞的生物相容性材料。图1示意性描述了本发明的微囊的示例性结构。在某些优选的实施方案中,细胞可均匀分散于微囊中,或者可以聚集在一起,位于微囊内部。
在某些优选的实施方案中,所述人工组织前体为管腔(例如循环管腔、消化管腔、呼吸管腔、泌尿管腔或生殖管腔)前体。
在某些优选的实施方案中,所述管腔为包含上皮细胞的管腔(例如血管,食管,气管,胃,胆管,肠道(包括小肠和大肠,例如十二指肠、空肠、回肠、盲肠(包括阑尾)、升结肠、结肠右曲、横结肠、结肠左曲、降结肠、乙状结肠、直肠),输卵管,输精管,输尿管,膀胱或淋巴管)。
在某些优选的实施方案中,所述人工组织前体为管状(例如侧壁开口或不开口的管状)。侧壁不开口的管状人工组织前体可用于对狭窄、闭塞、扩张、损伤或畸形的管腔进行替换,或用于构建管腔旁路(例如血管旁路)。侧壁开口的管状人工组织前体可用于对破损的管腔进行修补。
在某些优选的实施方案中,所述人工组织前体为片状(例如平面的片状或弯曲的片状)。片状人工组织前体可用于对破损的管腔进行修补。
在某些优选的实施方案中,多个所述微囊构成一个或多个生物构建体。
在某些优选的实施方案中,一个或多个生物构建体与固体支持物贴合。
在某些优选的实施方案中,所述微囊在生理环境下(例如4-37℃,例如ph在6-8之间,例如在生理环境的流体剪切力下)具有稳定的结构。在某些优选的实施方案中,所述微囊具有在吸取或挤压中不会造成微囊破碎的力学强度。在某些优选的实施方案中,所述微囊为包裹的细胞提供了力学保护。
在本发明的某些优选实施方案中,所述微囊能够减少或避免微囊内的细胞在操作(例如生物打印)过程中遭受机械损伤。在某些优选的实施方案中,本发明的微囊能够减少细胞在生物打印过程中受到的机械损伤。例如,在某些优选的实施方案中,在使用相同生物打印机和相同打印条件的情况下,与将细胞直接用于生物打印相比,本发明的微囊能够减少细胞受到的机械损伤至少5%、10%、15%、20%、25%、30%、40%、50%、70%、80%、或90%。在某些优选的实施方案中,本发明的微囊能够在生物打印过程中保留微囊内的细胞的生物活性(例如,增殖、分化、迁移、分泌和/或新陈代谢)。在某些优选的实施方案中,微囊内至少80%、85%、87.5%、90%、92.5%、95%、或98%的细胞在生物打印后存活至少24小时。在某些优选的实施方案中,微囊内至少90%的细胞在生物打印后存活至少3小时、6小时、12小时、1天、2天、4天、或7天。在某些优选的实施方案中,微囊内至少80%、85%、87.5%、90%、92.5%、95%、或98%的细胞在生物打印24小时后能够增殖和/或分化。在某些优选的实施方案中,微囊内至少80%、85%、87.5%、90%、92.5%、95%、或98%的细胞在生物打印24小时后具有正常的新陈代谢。在某些优选的实施方案中,微囊内至少80%、85%、87.5%、90%、92.5%、95%、或98%的细胞在生物打印24小时后能够迁移。在某些优选的实施方案中,微囊内至少80%、85%、87.5%、90%、92.5%、95%、或98%的细胞在生物打印24小时后能够分泌。
在某些优选的实施方案中,所述微囊为细胞的生命活动提供微环境。在某些优选的实施方案中,所述微囊提供了适合细胞粘附和伸展的空间结构和微环境,从而细胞在该结构内能够正常进行增殖、分化、迁移、分泌或新陈代谢。所述微环境指细胞所生长的环境,其包含的要素包括物理因素,比如空间结构、力学强度、温度、湿度、渗透压等;化学因素,比如酸碱度、离子浓度等;生物因素,包括细胞、细胞因子等。这些要素共同构成细胞生命活动的环境,并对在这个环境中生长的细胞的增殖、分化、迁移、分泌和新陈代谢进行动态调控。在某些优选的实施方案中,所述微囊能够为细胞的生命活动提供营养物质。
在本发明的某些实施方案中,所述微囊为生物砖。
本发明的生物砖包括:细胞,包裹细胞的核层,和,封装核层的壳层,其中所述核层和壳层各自独立地由生物可降解材料制成。在本发明的某些优选实施方案中,所述核层和壳层中的生物可降解材料能够减少或避免生物砖内的细胞在操作过程中遭受机械损伤,并且能够提供物质(例如营养物质,细胞外基质,细胞因子,药物活性成分等)的可控释放,以促进细胞活性和功能(增殖、分化、迁移、分泌或新陈代谢)或维持细胞的干性。
在某些优选的实施方案中,生物砖的核层提供了适合细胞粘附和伸展的空间结构和微环境,从而细胞在该结构内能够正常进行增殖、分化、迁移、分泌或新陈代谢。所述微环境指细胞所生长的环境,其包含的要素包括物理因素,比如空间结构、力学强度、温度、湿度、渗透压等;化学因素,比如酸碱度、离子浓度等;生物因素,包括细胞、细胞因子等。这些要素共同构成细胞生命活动的环境,并对在这个环境中生长的细胞的增殖、分化、迁移、分泌和新陈代谢进行动态调控。在某些实施方案中,所述核层能够为细胞的生命活动提供微环境,例如空间结构、营养物质等。
在某些优选的实施方案中,生物砖的壳层为包裹的细胞提供了力学保护。在某些优选的实施方案中,所述生物砖或生物砖的壳层具有一定的力学强度,从而能够实现立体堆积。在本发明中,特别优选地,生物砖及其壳层具有适当的力学保护性能(例如,具有合适的硬度和/或弹性模量)。一方面,生物砖内的细胞在操作过程中易于因外界压力或剪切力的伤害而受损或死亡。因此,如果生物砖及其壳层的硬度和/或弹性模量太低,那么将导致生物砖内的细胞存活率在人工操作后显著下降,进而导致生物砖的应用受到限制,或者需要使用大量的细胞。另一方面,如果生物砖及其壳层的硬度和/或弹性模量太高,那么将导致生物砖内的细胞的伸展、迁移受到限制,并且阻碍不同生物砖的细胞之间建立细胞连接,不利于构建有机的整体(例如,人工组织)。因此,适当的力学保护性能不仅使得能够对本发明的生物砖进行各种操作,而且有利于生物砖内的细胞伸展、迁移、建立细胞连接,并形成有机的构建体(例如人工组织),因此,是特别优选的。
图2a-e示意性描述了本发明的生物砖的示例性结构,其包括:细胞,包裹细胞的核层和封装核层的壳层。
图2a-2e特别地,图2a示意性描述了本发明生物砖的一种结构,其包括一个核层和一个壳层,其中,所述核层包裹有细胞,并且所述壳层位于核层外侧,且封装核层。
图2b示意性描述了本发明生物砖的一种结构,其由内到外依次包含:包裹细胞的核层、封装所述核层的第一壳层、和围绕第一壳层的第二壳层。
图2c示意性描述了本发明生物砖的一种结构,其由内到外依次包含:包裹细胞的第一核层、位于第一核层外侧的包裹细胞的第二核层、和封装所述第一核层和第二核层的第一壳层。
图2d示意性描述了本发明生物砖的一种结构,其由内到外依次包含:包裹细胞的第一核层、位于第一核层外侧的包裹细胞的第二核层、封装所述第一核层和第二核层的第一壳层、和围绕第一壳层的第二壳层。
图2e示意性描述了本发明生物砖的一种结构,其由内到外依次包含:包裹细胞的第一核层、封装所述第一核层的第一壳层、包裹细胞的第二核层、和封装所述第二核层的第二壳层。
有关生物砖的详细描述可参见例如,中国专利申请201610211570.4和pct国际申请pct/cn2016/078678,其各自以其全文通过引用并入本文。
本发明的微囊的尺寸可以根据实际需要进行选择,而不受特别限制。球形微囊的尺寸通常可以通过其直径来进行明确定义。在严格定义的情况下,术语“直径”不能用于描述非球形的结构。然而,在本发明中,也使用术语“直径”来描述非球形的微囊的尺寸。在此情况下,术语“直径”表示,与非球形的微囊具有相同体积的球形微囊的直径。换言之,在本发明中,使用球形微囊的直径来描述具有相同体积的非球形的微囊的尺寸。因此,在某些优选的实施方案中,本发明微囊的尺寸(即,本文所定义的直径)可以为20-2000μm,例如30-1900μm,40-1800μm,50-1700μm,60-1600μm,70-1500μm,80-1400μm,90-1300μm,100-1200μm,200-1000μm,300-800μm,400-600μm,100-500μm。在某些优选的实施方案中,本发明微囊的尺寸(即,本文所定义的直径)可以为20-30、30-50、50-100、100-150、150-200、200-250、250-300、300-350、350-400、400-450、450-500、500-600、600-700、700-800、800-900、900-1000、1000-1500、1500-2000、20-50、20-100、100-200、200-400、500-600、600-800、800-1000、或1000-2000μm。在某些优选的实施方案中,本发明微囊的尺寸(即,本文所定义的直径)为至少20、30、50、100、120、150、200、250、300、350、400、450、500、600、700、800、900、1000、1500、或2000μm。
本发明的微囊的形状可以根据实际需要进行选择,而不受特别限制。例如,本发明微囊可以是球形,或者任何期望的形状(例如立方体,矩形棱柱,六棱柱,圆柱,或不规则的形状)。例如,一些形状(例如球形,立方体,矩形棱柱,六棱柱)可用于实现微囊在构建体中的紧密堆积。
在某些优选的实施方案中,本发明的微囊为固体或半固体。在某些优选的实施方案中,本发明的微囊为凝胶态。例如,本发明的微囊的核层和/或壳层可以为凝胶态。在某些优选的实施方案中,本发明的微囊包含水凝胶。在某些优选的实施方案中,所述水凝胶包含海藻酸盐,琼脂糖,明胶,壳聚糖,或其它水溶性或亲水性聚合物。
在某些优选的实施方案中,本发明的微囊以混合物的形式存在。在此类实施方案中,微囊可以与混合物中的另一微囊接触或融合。在某些优选的实施方案中,本发明的微囊是分离的微囊。例如,在某些实施方案中,微囊不与其他的微囊直接接触。在某些优选的实施方案中,本发明的分离的微囊提供于容器中。
本发明的微囊可使用各种方法来制备。例如,在某些优选的实施方案中,可使用用于制造微球体的方法来制备本发明的微囊,例如使用造粒仪来进行制备。在某些优选的实施方案中,本发明的微囊是在无菌条件下制备的。某些优选的实施方案中,本发明的微囊是在gmp工作间中制备的。在某些优选的实施方案中,本发明的微囊在即将使用前被制备。在某些优选的实施方案中,本发明的微囊在制备后贮存于4℃,例如贮存3小时、6小时、12小时、1天、2天、或3天。
本发明微囊包含的细胞的种类可以根据实际需要进行选择,而不受特别限制。在某些优选的实施方案中,所述微囊中包含上皮细胞,例如内皮细胞(例如血管内皮细胞)、平滑肌细胞(例如血管平滑肌细胞)和/或未分化的细胞。
在某些优选的实施方案中,所述微囊中的细胞为未分化的细胞,例如干细胞(例如脂肪间充质干细胞、骨髓间充质干细胞、诱导多能干细胞和胚胎干细胞)。
在某些优选的实施方案中,所述未分化的细胞能够分化为上皮细胞(例如内皮细胞)和/或平滑肌细胞。
在某些优选的实施方案中,所述未分化的细胞选自干细胞(例如脂肪间充质干细胞、骨髓间充质干细胞、诱导多能干细胞和胚胎干细胞)和祖细胞(例如内皮祖细胞)中的一种或多种。
本发明微囊包含的细胞的来源可以根据实际需要进行选择,而不受特别限制。在某些优选的实施方案中,所述细胞获自动物,例如哺乳动物,例如人、猿、猴、大猩猩、牛、猪、犬、绵羊和山羊。
在某些优选的实施方案中,所述细胞来源于选自下述的组织:结缔组织(例如,疏松结缔组织、致密结缔组织、弹性组织、网状结缔组织和脂肪组织)、肌肉组织(例如,骨骼肌、平滑肌和心肌)、泌尿生殖组织、胃肠组织、肺组织、骨组织、神经组织和上皮组织(例如,单层上皮和复层上皮)、内胚层来源的组织、中胚层来源的组织和外胚层来源的组织。
本发明微囊包含的细胞的数量可以根据实际需要进行选择,而不受特别限制。例如,本发明微囊的核层可以包含1-106个细胞,例如10-900、20-800、30-700、40-600、50-500、60-400、70-300、80-200、10-100个、10-103个、10-104个、10-105个、10-106个细胞。在某些优选的实施方案中,本发明微囊包含至少1、2、4、6、8、10、15、20、25、30、40、50、60、70、80、90、100、150、200、300、400、500、600、700、800、900、1000、2000、3000、4000、5000、6000、7000、8000、9000、104、2x104、3x104、4x104、5x104、6x104、7x104、8x104、9x104、105、2x105、3x105、4x105、5x105、6x105、7x105、8x105、9x105、或106个细胞。在某些优选的实施方案中,本发明微囊包含1-2、2-4、4-6、6-8、8-10、10-15、15-20、20-25、25-30、30-40、40-50、50-60、60-70、70-80、80-90、90-100、100-150、150-200、200-300、300-400、400-500、500-1000、1000-2000、2000-3000、3000-4000、4000-5000、5000-104、104-2x104、2x104-3x104、3x104-4x104、4x104-5x104、5x104-105、105-2x105、2x105-3x105、3x105-4x105、4x105-5x105、5x105-106、1-10、2-10、2-5、5-10、10-20、20-30、30-50、2-25、25-50、2-50、50-100、100-200、50-250、250-500、500-2000、2-100、2-500、或2-2000个细胞。
在某些优选的实施方案中,除了如上描述的上皮细胞(例如内皮细胞)、平滑肌细胞和/或未分化的细胞之外,所述微囊包裹的细胞还包括额外细胞。在某些优选的实施方案中,所述额外细胞来源于选自下述的组织:结缔组织(例如,疏松结缔组织、致密结缔组织、弹性组织、网状结缔组织和脂肪组织)、肌肉组织(例如,骨骼肌、平滑肌和心肌)、泌尿生殖组织、胃肠组织、肺组织、骨组织、神经组织和上皮组织(例如,单层上皮和复层上皮)、内胚层来源的组织、中胚层来源的组织和外胚层来源的组织。在某些优选的实施方案中,所述额外细胞选自肌肉细胞(例如,骨骼肌细胞、心肌细胞、平滑肌细胞和成肌细胞)、结缔组织细胞(例如,骨细胞、软骨细胞、成纤维细胞以及分化为成骨细胞、软骨细胞或淋巴组织的细胞)、骨髓细胞、皮肤细胞、上皮细胞、乳腺细胞、血管细胞、血细胞、淋巴细胞、神经细胞、许旺细胞、胃肠细胞、肝细胞、胰细胞、肺细胞、气管细胞、角膜细胞、泌尿生殖细胞、肾细胞、脂肪细胞、实质细胞、周细胞、间皮细胞、基质细胞、内胚层来源的细胞、中胚层来源的细胞、外胚层来源的细胞、癌来源的细胞、细胞系、或其任何组合。
在某些优选的实施方案中,本发明的微囊包含细胞和包裹所述细胞的核层。在某些优选的实施方案中,所述核层能够为细胞的生命活动提供微环境。在某些优选的实施方案中,微囊提供了适合细胞粘附和伸展的空间结构和微环境,从而细胞在该结构内能够正常进行增殖、分化、迁移、分泌或新陈代谢,或维持干性。所述微环境指细胞所生长的环境,其包含的要素包括物理因素,比如空间结构、力学强度、温度、湿度、渗透压等;化学因素,比如酸碱度、离子浓度等;生物因素,包括细胞、细胞因子等。这些要素共同构成细胞生命活动的环境,并对在这个环境中生长的细胞的增殖、分化、迁移、分泌和新陈代谢进行动态调控,或维持细胞的干性。在某些优选的实施方案中,所述核层能够为细胞的生命活动提供营养物质。
在某些优选的实施方案中,所述核层地由生物相容性材料制成。
在某些优选的实施方案中,所述微囊还包含封装所述核层的壳层。
在某些优选的实施方案中,微囊的壳层为包裹的细胞提供了力学保护。在某些优选的实施方案中,所述微囊或微囊的壳层具有一定的力学强度,从而能够实现立体堆积。在本发明中,特别优选地,微囊及其壳层具有适当的力学保护性能(例如,具有合适的硬度和/或弹性模量)。一方面,微囊内的细胞在操作过程中(例如,在3d打印过程中)易于因外界压力或剪切力的伤害而受损或死亡。因此,如果微囊及其壳层的硬度和/或弹性模量太低,那么将导致微囊内的细胞存活率在人工操作后显著下降,进而导致微囊的应用受到限制,或者需要使用大量的细胞。另一方面,如果微囊及其壳层的硬度和/或弹性模量太高,那么将导致微囊内的细胞的伸展、迁移受到限制,并且阻碍不同微囊的细胞之间建立细胞连接,不利于构建有机的整体(例如,人工组织)。因此,适当的力学保护性能不仅使得能够对本发明的微囊进行各种操作(例如进行3d生物打印,进行微囊的精确排布等),而且有利于微囊内的细胞伸展、迁移、建立细胞连接,并形成有机的构建体(例如人工组织),因此,是特别优选的。
在某些优选的实施方案中,本发明微囊的核层和/或壳层各自任选地经过处理(例如使用核层固定液或壳层固定液进行处理,例如,以改善核层或壳层的力学性能)。
在某些优选的实施方案中,所述微囊、微囊的核层或微囊的壳层各自独立地具有约0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.15、0.2、0.3、或0.4gpa的硬度。在某些优选的实施方案中,所述微囊、微囊的核层或微囊的壳层各自独立地具有0.01-0.02、0.02-0.03、0.03-0.04、0.04-0.05、0.05-0.06、0.06-0.07、0.07-0.08、0.08-0.09、0.09-0.1、0.1-0.15、0.15-0.2、0.2-0.3、0.3-0.4、0.01-0.4、0.01-0.05、0.05-0.1、0.1-0.2、0.2-0.4、0.05-0.15、或0.06-0.1gpa的硬度。在某些优选的实施方案中,所述微囊、微囊的核层或微囊的壳层各自独立地具有0.01-0.1gpa或0.01-0.4gpa的硬度。在某些优选的实施方案中,所述微囊、微囊的核层或微囊的壳层具有约0.083gpa的硬度。在某些优选的实施方案中,所述微囊、微囊的核层或微囊的壳层各自独立地具有约0.01、0.05、0.1、0.5、0.8、1、1.2、1.4、1.6、1.8、2、2.4、2.8、3.2、4、10、20、30、40、50、80、或100mpa的弹性模量。在某些优选的实施方案中,所述微囊、微囊的核层或微囊的壳层各自独立地具有0.01-0.05、0.05-0.1、0.1-0.5、0.5-0.8、0.8-1、1-1.2、1.2-1.4、1.4-1.6、1.6-1.8、1.8-2、2-2.4、2.4-2.8、2.8-3.2、3.2-4、4-10、10-20、20-30、30-40、40-50、50-80、80-100、0.5-4、0.5-1、1-1.5、1.5-2、2-3、0.8-1.6、1.4-2.4、0.8-3.2、0.01-100、1-100、10-100、或0.5-50mpa的弹性模量。在某些优选的实施方案中,所述微囊、微囊的核层或微囊的壳层各自独立地具有0.01-1、0.01-10或0.01-100mpa的弹性模量。核层或壳层的力学保护作用(例如,硬度和弹性模量)可通过对核层或壳层的组分和/或含量的配置来控制。
在某些优选的实施方案中,所述壳层也能够为细胞的生命活动提供微环境,例如营养物质。在某些优选的实施方案中,所述壳层由生物相容性材料制成。
在某些优选的实施方案中,用于制备核层和壳层的生物相容性材料可以是相同的或不同的。然而,特别优选地,根据其预期的目的,核层和壳层具有不同的组成。不拘于理论限制,通常认为,壳层提供了主要的力学保护作用,而核层则提供了细胞生命活动所需的主要的营养成分和微环境。因此,在某些优选的实施方案中,与壳层相比,核层具有更多的营养物质。在某些优选的实施方案中,与核层相比,壳层具有较低的降解速率,但具有更高的硬度和/或弹性模量。在某些优选的实施方案中,壳层中不包含细胞。
在某些优选的实施方案中,核层和壳层分别以不同的重量比包含相同的生物相容性材料。换言之,核层和壳层可以由相同的生物相容性材料制成,但以不同的重量比包含生物可降解材料。
在某些优选的实施方案中,所述壳层是通透性的。例如,所述壳层对于水,氧气,和营养物质(糖类例如葡萄糖,脂肪,蛋白质,氨基酸,短肽,矿物质,维生素、细胞因子、核苷酸等)是通透性的。
一般认为,半通透的(即,选择通透的)壳层的使用可能是有利的,因为其能够使得水,氧气,葡萄糖,矿物质,和氨基酸等营养物质透过壳层,进入核层,并提供给细胞,并且能够阻止对细胞有害的物质(例如来自宿主免疫系统的抗体蛋白)进入核层。然而,在本发明的微囊中,通透性壳层的使用是优选的和有利的。特别地,通透性的壳层使得各种营养物质(包括大分子和小分子营养物质,例如葡萄糖,脂肪,蛋白质,氨基酸,短肽,矿物质,维生素、细胞因子、核苷酸等)能够更加容易、顺畅地进行交换,避免局部区域的细胞无法获得充足的营养物质。例如,当使用本发明的微囊构建大尺寸的人工组织时,通透性的壳层将能够促进各种营养物质的交换,促进人工组织内部/核心区域的微囊内的细胞获得充足的营养物质。此外,通透性的壳层有利于不同微囊之间的细胞进行信号传递和建立细胞连接。特别地,细胞在生长过程中会分泌多种物质(包括细胞外基质的某些组分和多种信号分子),与邻近的、甚至远端的细胞进行信号传递和/或物质交流,并由此对细胞自身的生命活动以及邻近的、甚至远端的细胞的生命活动产生影响或进行调控。因此,如果使用选择通透性的壳层的话,那么细胞之间的信号传递和/或物质交流将有可能受到影响/阻碍,例如细胞分泌的某些大分子信号物质(例如细胞因子蛋白)可能无法透过壳层,从而可能阻碍不同微囊之间的细胞信号的传递和细胞连接的建立,不利于构建有机的整体(例如,人工组织)。因此,通透性壳层的使用对于本发明的微囊而言是优选的。在本发明中,表述“通透性壳层”意指,各种小分子和大分子物质(例如蛋白质)能够自由通过壳层。例如,在某些优选的实施方案中,所述壳层对于分子量在5000kda以下的分子是通透的。例如,在某些实施方案中,所述壳层对于分子量在200kda以下或分子量在200kda-300kda、300kda-400kda、400kda-500kda、500kda-800kda、800kda-1000kda、1000kda-1500kda、1500kda-2000kda、2000kda-3000kda、3000kda-4000kda或4000kda-5000kda范围内的分子是通透的。在某些实施方案中,所述壳层对于免疫球蛋白(例如igg、igm、iga、igd、ige)是通透的。
在某些优选的实施方案中,所述壳层具有用于微囊内外物质交换的通道或孔。在某些优选的实施方案中,营养物质(糖类例如葡萄糖,脂肪,蛋白质,氨基酸,短肽,矿物质,维生素、细胞因子、核苷酸等)通过所述通道或孔扩散进入所述微囊内。在某些优选的实施方案中,所述通道的直径为至少10、20、50、100、150、200、250、300、350、400、或500nm。在某些优选的实施方案中,所述通道的直径为例如1nm-5μm;10nm-2μm;100nm-1μm;200-800nm等。在某些优选的实施方案中,所述孔的直径为至少100、200、400、600、800、1000、1500、2000、4000、或5000nm。
本发明的微囊的壳层的厚度可以根据实际需要进行选择,而不受特别限制。例如,本发明微囊的壳层的厚度可以为1-20μm,例如5-15μm,例如8-12μm。在某些优选的实施方案中,本发明的微囊的壳层的厚度可以为约0.1、0.5、1、2、5、10、15、20、25、30、或50μm。在某些优选的实施方案中,本发明的微囊的壳层的厚度可以为0.1-0.5、0.5-1、1-2、2-5、5-10、10-15、15-20、20-25、25-30、30-50、50-100、100-200、200-300、300-400、400-500、0.1-1、1-5、1-10、5-10、10-20、10-30、5-20、或1-20μm。
在某些优选的实施方案中,本发明的微囊的壳层不包含细胞。
在某些优选的实施方案中,本发明所述的生物相容性材料包含生物可降解材料。
在本发明中,使用生物可降解材料来制备微囊是特别优选的。特别地,对于微囊在制备人工组织前体中的用途而言,无法降解的材料的使用是不利的。这是因为,一方面,这些无法降解的材料将被保留在所获得的人工组织中,从而限制人工组织的应用;另一方面,这些无法降解的材料将阻碍不同微囊的细胞之间建立细胞连接,不利于构建有机的整体(例如,人工组织)。因此,生物可降解材料在壳层中的使用对于利用微囊来制备人工组织前体是特别有利的和优选的。
在某些优选的实施方案中,所述生物可降解材料为具有可降解性的生物材料。
在本发明的实施方案中,用于制备微囊的生物可降解材料可以是天然存在的(例如来源于动植物的天然存在的生物可降解材料,例如胶原蛋白,纤维蛋白,壳聚糖,海藻酸盐,淀粉,透明质酸,层粘连蛋白,琼脂糖,明胶,葡聚糖,以及其任意组合),人工合成的,重组产生的,经过改性的,或者其任何组合。
在某些优选的实施方案中,用于制备微囊的所述生物可降解材料是天然存在的生物可降解材料。在某些优选的实施方案中,所述天然存在的生物可降解材料,选自胶原蛋白,纤维蛋白,壳聚糖,海藻酸盐(例如海藻酸钠或海藻酸钙),淀粉,透明质酸,层粘连蛋白,琼脂糖,明胶,葡聚糖,甲壳素,纤维素(例如细菌纤维素),蚕丝蛋白,硫酸软骨素,肝素,纤维蛋白原,纤连蛋白,粘多糖,粘液素,以及其任意组合。在某些优选的实施方案中,用于制备微囊的所述生物可降解材料是经过改性的生物可降解材料,例如经过改性的海藻酸盐,例如氧化海藻酸盐(例如氧化海藻酸钠),改性明胶(如双醛淀粉das交联改性明胶),改性纤维素(例如羧甲基纤维素,氧化再生纤维素),以及其任意组合。
在某些优选的实施方案中,用于制备微囊的所述生物可降解材料是人工合成的生物可降解材料,例如聚磷腈,聚丙烯酸及其衍生物(例如聚甲基丙烯酸,丙烯酸和甲基丙烯酸的共聚物),聚乳酸(pla),聚羟基乙酸(pga),聚乳酸-乙醇酸共聚物(plga),聚原酸酯(poe),聚己内酯(pcl),聚羟基丁酸酯(phb),聚氨基酸(例如聚赖氨酸),可降解性聚氨酯(如淀粉改性聚氨酯),聚羟基烷酸酯(phas),聚羟基戊酸酯(phv),聚丁二酸丁二醇酯(pbs),聚乙烯醇,聚对二氧环己酮,聚对二氧杂环己酮,聚二氧杂环己烷酮,聚碳酸丁二醇酯,以及其任何组合。
在某些优选的实施方案中,用于制备微囊的所述生物可降解材料能够被酶(例如细胞分泌的酶)所降解。不同的生物可降解材料的降解速率差异很大,其范围可以为一个月到数年。然而在本发明中,特别优选地,用于制备壳层的生物可降解材料在不超过1个月的时间内降解,例如在不超过30天、不超过25天、不超过20天、不超过15天、不超过10天、不超过5天、不超过4天、不超过3天、不超过2天、或不超过1天的时间内降解。例如,用于制备微囊的生物可降解材料可以在1-2天,2-3天,3-4天,4-5天,5-10天,10-15天,15-20天,20-25天,或25-30天的时间内降解。特别优选地,用于制备微囊的生物可降解材料在不超过10天的时间内降解。降解速率与生物可降解材料的分子组成、分子量大小和分子排列(例如,直链或支链)密切相关。一般情况下,分子量越高、分子排列越紧密,降解时间越长。因此,微囊的降解速率可通过对壳层的组分和/或含量的配置来控制。例如,为了获得更快的降解速率,可使用低含量(例如低于0.5%、1%、2%、3%、4%、或5%)的生物可降解材料、低分子量(例如低于500da、1kda、2kda、3kda、5kda、或10kda)的生物可降解材料,和/或具有疏松分子排布的生物可降解材料。为了获得更慢的降解速率,可使用高含量(例如高于0.5%、1%、2%、3%、4%、或5%)的生物可降解材料、高分子量(例如高于500da、1kda、2kda、3kda、5kda、或10kda)的生物可降解材料,和/或具有紧密分子排布的生物可降解材料。另外,还可通过改变微囊的结构(如:多层包裹、表面多孔、孔隙率大小、比表面积等)来调节生物可降解材料的降解速率。此外,生物可降解材料的降解速率还可以通过改变合成该材料的聚合方式和共聚物比例来进行调节;或者,可通过对该材料的交联来进行调节。此外,用于制备微囊的生物可降解材料的降解速率还可受细胞生命活动的影响。
在本发明中,特别优选的是,微囊内的细胞能够生长、伸展、增殖、迁移,并与其他微囊内的细胞建立细胞连接,形成有机的构建体(例如人工组织)。因此,在某些优选的实施方案中,所述微囊在相对短的时间(例如不超过30天的时间内,例如不超过10天的时间内)降解,以促进不同微囊之间的细胞连接的建立,避免阻碍或影响不同微囊之间的细胞建立相互的细胞连接。在某些优选的实施方案中,所述微囊在不超过30天、不超过25天、不超过20天、不超过15天、不超过10天、不超过5天、不超过4天、不超过3天、不超过2天、或不超过1天的时间内降解。例如,所述微囊可以在1-2天,2-3天,3-4天,4-5天,5-10天,10-15天,15-20天,20-25天,或25-30天的时间内降解。
各种生物可降解材料是本领域技术人员已知的,并且其降解性能已被进行了广泛研究。参见例如,alexanderd.augst,hyunjoonkong,davidj.mooney,alginatehydrogelsasbiomaterials,macromol.biosci.2006,6,623-633,其通过引用并入本文。
在某些优选的实施方案中,所述微囊的降解能够提供维持或促进所述细胞的生命活动的微环境,例如营养物质。在某些优选的实施方案中,壳层的降解产物为小分子化合物,例如有机酸、单糖(例如葡萄糖)、寡糖、氨基酸、脂质等。此类降解产物可参与到细胞的新陈代谢活动中,用于合成细胞外基质或转化为活动所需的能量。
在某些优选的实施方案中,用于制备微囊的生物可降解材料及其降解产物对于细胞是无毒的,和/或对于宿主是非免疫原性的。
在某些优选的实施方案中,用于制备微囊的生物可降解材料含有细胞外基质或其类似物(例如弹性蛋白)。细胞外基质或其类似物(例如弹性蛋白)的使用能够为微囊内的细胞的生命活动(特别是细胞的生长、粘附、伸展,以及细胞间连接的建立)提供类似于体内的有利的微环境,从而是优选的。
在某些优选的实施方案中,用于制备微囊的生物可降解材料选自胶原蛋白(例如i型,ii型,iii型胶原蛋白)、纤维蛋白、壳聚糖、海藻酸盐(例如海藻酸钠或海藻酸钙)、氧化海藻酸盐(例如氧化海藻酸钠)、淀粉、透明质酸,层粘连蛋白,弹性蛋白,明胶、葡聚糖、聚氨基酸(例如聚赖氨酸)、琼脂糖,或其任何组合。在某些优选的实施方案中,所述微囊包含海藻酸盐(例如海藻酸钠或海藻酸钙),例如包含海藻酸钙和明胶,任选地还包含弹性蛋白。
在某些优选的实施方案中,所述微囊包含海藻酸盐(例如海藻酸钠或海藻酸钙)和明胶。
在某些优选的实施方案中,所述微囊包含海藻酸盐(例如海藻酸钠或海藻酸钙),例如包含海藻酸钙和明胶,任选地还包含弹性蛋白。在某些优选的实施方案中,所述微囊包含氧化海藻酸盐(例如氧化海藻酸钠)。在某些优选的实施方案中,所述微囊包含海藻酸盐(例如海藻酸钠或海藻酸钙)和琼脂糖。
在某些优选的实施方案中,可使用氧化的海藻酸盐(例如氧化的海藻酸钠和氧化的海藻酸钙)来制备微囊,并且可通过控制海藻酸盐的氧化度来调节其降解速度,从而使微囊的降解速度与包裹在其中的细胞生长速度相匹配。
在某些优选的实施方案中,所述微囊包含核层和一个或多个壳层(例如2个、3个、4个或5个)。
在某些优选的实施方案中,用于制备微囊核层的所述生物可降解材料选自:胶原蛋白(例如i型,ii型,iii型胶原蛋白),纤维蛋白,壳聚糖,海藻酸盐(例如海藻酸钠或海藻酸钙),透明质酸,琼脂糖,明胶,淀粉,葡聚糖,聚磷腈,聚丙烯酸及其衍生物,聚乳酸(pla),聚氨基酸(例如聚赖氨酸),可降解性聚氨酯,以及其任意组合。
在某些优选的实施方案中,用于制备微囊壳层的所述生物可降解材料选自:海藻酸盐(例如海藻酸钠或海藻酸钙),弹性蛋白,聚氨基酸(例如聚赖氨酸),氧化海藻酸盐,明胶,壳聚糖,以及其任意组合。
在某些优选的实施方案中,用于制备微囊核层的所述生物可降解材料包括胶原蛋白(例如i型,ii型,iii型胶原蛋白)。
在某些优选的实施方案中,用于制备微囊壳层的所述生物可降解材料选自聚氨基酸(例如聚赖氨酸)和海藻酸盐(例如海藻酸钠或海藻酸钙)。
在某些优选的实施方案中,所述微囊还包含额外的试剂,例如,营养物质、细胞外基质、细胞因子和/或药物活性成分。
在某些优选的实施方案中,所述额外的试剂能够调控(例如促进)细胞的增殖、分化、迁移、分泌和/或新陈代谢,或者,所述额外的试剂能够维持细胞的干性。在某些优选的实施方案中,所述微囊包含至少一种(例如1、2、3、4、5或更多种)能够调控(例如促进)细胞的增殖、分化、迁移、分泌和/或新陈代谢的额外的试剂,或者能够维持细胞干性的额外的试剂。在某些优选的实施方案中,所述微囊能够以受控的方式释放所述额外的试剂。
在某些优选的实施方案中,所述营养物质包括但不限于,核苷酸,氨基酸,多肽,碳水化合物(例如单糖,寡糖,多糖),脂质,维生素等。
在某些优选的实施方案中,细胞外基质选自多糖,例如糖胺聚糖、蛋白聚糖;结构蛋白,例如胶原和弹性蛋白;粘着蛋白,例如纤粘连蛋白和层粘连蛋白。
在某些优选的实施方案中,所述细胞因子可以是用于调控细胞的增殖、分化、迁移、分泌和/或新陈代谢的细胞因子,包括但不限于:
-与细胞生长相关的细胞因子,例如胰岛素、类胰岛素生长因子(如igf-ⅰ、igf-ⅱ)、转化生长因子(如tgfα和tgfβ)、血管内皮生长因子、表皮生长因子、成纤细胞生长因子、血小板来源生长因子、骨肉瘤来源生长因子、生长激素释放抑制因子、神经生长因子、白细胞介素(如il-1、il-11、il-3)、红细胞生长素、集落刺激因子、皮质醇、甲状腺素,或其任何组合;
-与细胞分化相关的细胞因子,例如oct3/4,sox2,klf4,c-myc,gata4,tsp1,β-甘油磷酸钠,地塞米松,维生素c,胰岛素,ibmx,吲哚美锌,血小板衍生生长因子bb(pdgf-bb),5-氮杂胞苷,或其任何组合;
-与细胞迁移相关的细胞因子,例如环磷酸腺苷,三磷酸磷脂酰肌醇,基质细胞衍生因子-1、n-钙粘蛋白,核因子κb,骨连接素,血栓素a2,ras,或其任何组合;和/或
-与细胞新陈代谢相关的细胞因子,例如胰岛素生长因子1、trip-br2、dkk-1、srankl、opg、tracp-5b、alp、sirt1(2-7)、pgc-1α,pgc-1β、opg、il-3、il-4、il-6、tgf-β、pge2、g-csf、tnf-α,或其任何组合。
在某些优选的实施方案中,所述药物活性成分为能够调控(例如促进)细胞的增殖、分化、迁移、分泌和/或新陈代谢的试剂,或者为能够维持细胞干性的试剂。在某些优选的实施方案中,所述药物活性成分选自rhil-2、rhil-11、rhepo、ifn-α、ifn-β、ifn-γ、g-csf、gm-csf、rhuepo、stnf-r1、和rhtnf-α。
在某些优选的实施方案中,所述微囊包含能够诱导未分化的细胞向平滑肌细胞或内皮细胞分化的细胞因子,例如tgf-α1、pdgf-bb、vegf或b-fgf。
在某些优选的实施方案中,所述微囊包括:脂肪间充质干细胞和包裹所述脂肪间充质干细胞的核层,优选地,所述核层由生物可降解材料制成;优选地,所述核层提供维持脂肪间充质干细胞干性的微环境(例如,所述核层包含维持脂肪间充质干细胞干性的额外试剂);优选地,所述核层提供诱导脂肪间充质干细胞向内皮细胞细胞或平滑肌细胞分化的微环境(例如,所述核层包含诱导脂肪间充质干细胞向内皮细胞或平滑肌细胞分化的诱导因子)。在某些优选实施方案中,所述诱导脂肪间充质干细胞向平滑肌细胞分化的诱导因子选自tgf-α1和pdgf-bb。在某些优选实施方案中,所述诱导脂肪间充质干细胞向内皮细胞分化的诱导因子选自vegf和b-fgf。
在某些优选的实施方案中,所述微囊包括:脂肪间充质干细胞,包裹所述脂肪间充质干细胞细胞的核层,和,封装所述核层的壳层;优选地,所述核层和壳层各自独立地由生物可降解材料制成;优选地,所述核层提供维持脂肪间充质干细胞干性的微环境(例如,所述核层包含维持脂肪间充质干细胞干性的额外试剂);优选地,所述核层提供诱导脂肪间充质干细胞向内皮细胞细胞或平滑肌细胞分化的微环境(例如,所述核层包含诱导脂肪间充质干细胞向内皮细胞或平滑肌细胞分化的诱导因子)。在某些优选实施方案中,此类微囊的壳层也提供诱导脂肪间充质干细胞向内皮细胞或平滑肌细胞分化的微环境(例如,所述壳层包含诱导脂肪间充质干细胞向内皮细胞或平滑肌分化的诱导因子)。在某些优选实施方案中,所述诱导脂肪间充质干细胞向平滑肌细胞分化的诱导因子选自tgf-α1和pdgf-bb。在某些优选实施方案中,所述诱导脂肪间充质干细胞向内皮细胞分化的诱导因子选自vegf和b-fgf。
在本发明的人工组织前体中,优选地,固体支持物由生物相容性材料制得。
在某些优选的实施方案中,所述生物相容性材料包含生物可降解材料。本发明中,使用生物可降解材料制备固体支持物,可以使得人工组织前体在植入受试者体内后的不断生长过程中,固体支持物逐步降解,最终使得人工组织与被植入者的自体组织完全融合成一体。
在某些优选的实施方案中,所述生物可降解材料为具有可降解性的生物材料。
在某些优选的实施方案中,所述生物可降解材料选自天然存在的生物可降解材料(例如胶原,明胶,壳聚糖,聚羟基丁酸酯(phb),甲壳素,海藻酸盐(例如海藻酸钠),淀粉基生物材料(例如多聚糖淀粉),纤维素(例如细菌纤维素),蚕丝蛋白,以及其任意组合)。
在某些优选的实施方案中,所述天然存在的生物可降解材料为淀粉。
在某些优选的实施方案中,所述生物可降解材料选自经过改性的生物可降解材料(例如经过改性的海藻酸盐,例如氧化海藻酸盐(例如氧化海藻酸钠),改性明胶(例如双醛淀粉das交联改性明胶),改性纤维素(例如羧甲基纤维素,氧化再生纤维素),以及其任意组合。
在某些优选的实施方案中,所述生物可降解材料选自人工合成的可降解材料(例如脂肪族聚酯(例如聚乳酸(pla),聚己内酯(pcl),聚羟基烷酸酯(phas),聚羟基戊酸酯(phv),聚羟基丁酸酯(phb),聚丁二酸丁二醇酯(pbs)),聚羟基乙酸(pga),聚乳酸-乙醇酸共聚物(plga),聚原酸酯(poe),可降解性聚氨酯(例如淀粉改性聚氨酯),聚乙烯醇,聚对二氧环己酮,聚对二氧杂环己酮,聚二氧杂环己烷酮,聚碳酸丁二醇酯,聚磷腈,以及其任何组合)。
在某些优选的实施方案中,所述人工合成的可降解材料选自聚己内酯(pcl),聚乳酸(pla),聚乳酸-羟基乙酸共聚物(plga),聚乙醇酸(pga),可降解聚氨酯。
在某些优选的实施方案中,所述生物可降解材料能够被酶(例如细胞分泌的酶)所降解;
在某些优选的实施方案中,所述生物可降解材料在体内的降解时间为1-12个月。
在某些优选的实施方案中,所述生物相容性材料还包含生物不可降解材料(例如尼龙,涤纶,聚丙烯,聚乙烯,聚四氟乙烯,硅橡胶,氟硅橡胶,天然橡胶,聚丙烯酸酯,芳香族聚酯(例如聚对苯二甲酸乙二醇酯(pet)),非降解性聚氨酯,聚醚醚酮,聚丙烯腈,聚硅氧烷,聚甲醛,聚氯乙烯,以及其任何组合)。
在某些优选的实施方案中,所述生物相容性材料包含生物不可降解材料(例如尼龙,涤纶,聚丙烯,聚乙烯,聚四氟乙烯,硅橡胶,氟硅橡胶,天然橡胶,聚丙烯酸酯,芳香族聚酯(例如聚对苯二甲酸乙二醇酯(pet)),非降解性聚氨酯,聚醚醚酮,聚丙烯腈,聚硅氧烷,聚甲醛,聚氯乙烯,以及其任何组合)。
在某些优选的实施方案中,所述生物不可降解材料是生物惰性的。
在某些优选的实施方案中,所述固体支持物为管状固体支持物或片状固体支持物。
在某些优选的实施方案中,所述固体支持物通过模具浸渍、静电纺丝、挤压锻造、3d打印或喷涂制得。
在某些优选的实施方案中,所述固体支持物通过模具浸渍的方法得到。在某些优选的实施方案中,所述模具浸渍法包含以下步骤:
(1)将用于制备固体支持物的材料(例如生物可降解材料)溶于合适的溶剂(例如有机溶剂,例如氯仿,四氢呋喃或n,n-二甲基乙酰胺)中,配制成制备溶液;
(2)将模具浸入所述制备液中,取出模具,使模具上的溶剂挥发;
(3)重复步骤(2)多次,得到固体支持物;
任选地,所述方法还包括以下步骤:
对固体支持物进行干燥、剪切和/或灭菌。
在某些优选的实施方案中,所述制备溶液中,用于制备固体支持物的材料的浓度为0.5wt%-5wt%,例如0.5wt%-1wt%、1wt%-1.5wt%、1.5wt%-2wt%、2wt%-2.5wt%、2.5wt%-3wt%、3wt%-3.5wt%、3.5wt%-4wt%、4wt%-4.5wt%或4.5wt%-5wt%,例如0.5wt%、1wt%、1.5wt%、2wt%、2.5wt%、3wt%、3.5wt%、4wt%、4.5wt%或5wt%。
在某些优选的实施方案中,所述固体支持物通过静电纺丝的方法制得。
在某些优选的实施方案中,所述静电纺丝的方法包含以下步骤:
(1)将用于制备固体支持物的材料(例如生物可降解材料)溶于合适的溶剂(例如有机溶剂,例如氯仿)中,配制成制备溶液;
(2)用制备溶液在静电纺丝设备上纺丝,形成固体支持物;
(3)待溶剂挥发后从静电纺丝设备上分离固体支持物。
在某些优选的实施方案中,所述固体支持物在生物构建体的表面制得。
在某些优选的实施方案中,所述固体支持物通过在生物构建体的表面进行3d打印或喷涂制得。
本发明中,可以根据需要将人工组织前体制成任意的形状。在某些优选的实施方案中,使用微囊制备任意形状的生物构建体,与任意形状的固体支持物相结合。在某些优选的实施方案中,在任意形状的固体支持物上,使用微囊制备任意形状的生物构建体。在某些优选的实施方案中,使用微囊制备任意形状的生物构建体,在生物构建体上制备任意形状的固体支持物。
在某些优选的实施方案中,所述人工组织前体包含一个或多个任意形状的生物构建体。
在某些优选的实施方案中,所述人工组织前体为管状(例如圆形管状,例如侧壁开口或不开口的管状),所述固体支持物为管状(例如圆形管状,例如侧壁开口或不开口的管状)固体支持物,多个所述微囊构成一个或多个管状(例如圆形管状,例如侧壁开口或不开口的管状)生物构建体,并且至少一个管状生物构建体的外壁与所述固体支持物的内壁贴合。
在某些优选的实施方案中,所述人工组织前体包含管状固体支持物和一个侧壁不开口的管状生物构建体,所述管状生物构建体的外壁与所述管状固体支持物的内壁贴合。
在某些优选的实施方案中,所述人工组织前体包含多个管状生物构建体。
图3a-e示例性描述了包含多个管状生物构建体的管状人工组织前体的结构。
图3a为一种管状人工组织前体的侧视图,所述人工组织前体包含管状固体支持物和多个侧壁不开口的管状生物构建体,所述多个侧壁不开口的管状生物构建体在所述管状固体支持物的内部,并沿管状固体支持物的轴向排列,并且所述多个侧壁不开口的管状生物构建体的外壁均与所述管状固体支持物的内壁贴合。
图3b为一种管状人工组织前体的俯视图,所述人工组织前体包含管状固体支持物和多个侧壁不开口的管状生物构建体,所述多个侧壁不开口的管状生物构建体在所述管状固体支持物的内部,与管状固体支持物同轴设置,并且仅最外侧的侧壁不开口的管状生物构建体的外壁与所述管状固体支持物的内壁贴合。
图3c为一种管状人工组织前体的侧视图,所述人工组织前体包含管状固体支持物和多个侧壁开口的管状生物构建体,所述多个侧壁开口的管状生物构建体在所述管状固体支持物的内部,并沿管状固体支持物的轴向排列,并且所述多个侧壁开口的管状生物构建体的外壁均与所述管状固体支持物的内壁贴合;
图3d为一种管状人工组织前体的俯视图,所述人工组织前体包含管状固体支持物和多个侧壁开口的管状生物构建体,所述多个侧壁开口的管状生物构建体在所述管状固体支持物内部,与管状固体支持物同轴设置并沿径向排列,并且位于仅最外侧的侧壁开口的管状生物构建体的外壁与所述管状支持物的内壁贴合;
图3e为一种管状人工组织前体的俯视图,所述人工组织前体包含管状固体支持物和多个侧壁开口的管状生物构建体,所述多个侧壁开口的管状生物构建体在所述管状固体支持物内部,并与管状固体支持物同轴设置,并且所述多个侧壁开口的管状生物构建体的外壁均与所述管状固体支持物的内壁贴合。
在某些优选的实施方案中,所述人工组织前体包含管状固体支持物、侧壁开口的管状生物构建体和侧壁不开口的管状生物构建体。
本发明中,根据需要对管状人工组织前体及其包含的管状生物构建体和管状固体支持物的尺寸进行设置。
在某些优选的实施方案中,所述人工组织前体的长度为1cm-40cm。
在某些优选的实施方案中,所述人工组织前体的内径为1mm-3cm(例如1-6mm、6-8mm、8-10mm、10-12mm、12mm-3cm)。
在某些优选的实施方案中,所述人工组织前体具有均一或不均一的厚度。例如,所述管状固体支持物内壁的某一部分贴合有管状生物构建体,而其他部分没有贴合管状生物构建体。例如,所述管状固体支持物内壁的不同部分贴合有不同的管状生物构建体。
在某些优选的实施方案中,所述管状固体支持物的长度为1cm-40cm(例如1-10cm、10-20cm、20-30cm或30-40cm)。
在某些优选的实施方案中,所述管状固体支持物的内径为1mm-3cm(例如1-6mm、6-8mm、8-10mm、10-12mm、12mm-3cm)。
在某些优选的实施方案中,所述管状固体支持物的厚度为200μm-1mm(例如200μm-400μm、400μm-600μm、600μm-800μm或800μm-1mm)。
在某些优选的实施方案中,所述管状固体支持物为侧壁开口的圆形管状,所述开口沿轴线方向贯通管状固体支持物的两端,所述管状固体支持物沿径向的切面为扇环;在某些优选的实施方案中,所述扇环的圆心角大于0并且小于360°,例如大于0并且小于30°、30°-60°、60°-90°、90°-120°、120°-150°、150°-180°、180°-210°、210°-240°、240°-270°、270°-300°、300°-330°,或大于330°并且小于360°。
在某些优选的实施方案中,所述管状生物构建体的长度为1cm-40cm(例如1-10cm、10-20cm、20-30cm或30-40cm)。
在某些优选的实施方案中,所述管状生物构建体的内径为1mm-3cm(例如1-6mm、6-8mm、8-10mm、10-12mm、12mm-3cm)。
在某些优选的实施方案中,所述管状生物构建体的厚度为200μm-1mm(例如200μm-400μm、400μm-600μm、600μm-800μm或800μm-1mm)。
在某些优选的实施方案中,所述管状生物构建体为侧壁开口的圆形管状,所述开口沿轴线方向贯通管状生物构建体的两端,所述管状生物构建体沿径向的切面为扇环;在某些优选的实施方案中,所述扇环的圆心角大于0并且小于360°。
在某些优选的实施方案中,所述人工组织前体为片状,所述固体支持物为片状固体支持物,多个所述微囊构成一个或多个片状生物构建体,并且至少一个片状生物构建体与片状固体支持物贴合。
在某些优选的实施方案中,所述片状固体支持物为平面的片状或者弯曲的片状。
在某些优选的实施方案中,所述片状生物构建体为平面的片状或者弯曲的片状。
在某些优选的实施方案中,所述人工组织前体包含片状固体支持物和一个片状生物构建体,所述片状生物构建体的一面与片状固体支持物的一面贴合。
在某些优选的实施方案中,所述人工组织前体包含片状固体支持物和多个片状生物构建体,多个所述片状生物构建体位于片状固体支持物的一侧,并且各个片状生物构建体的一面均与片状固体支持物的一面贴合。
在某些优选的实施方案中,所述人工组织前体包含片状固体支持物和多个片状生物构建体,多个所述片状生物构建体在片状固体支持物的一侧层叠排布,并且至少一个片状生物构建体的一面与片状固体支持物的一面贴合。
本发明中,根据需要对片状人工组织前体及其包含的片状生物构建体和片状固体支持物的尺寸进行设置。
在某些优选的实施方案中,所述人工组织前体为圆形片状、椭圆形片状、平行四边形(例如矩形)片状、扇形片状或不规则片状。
在某些优选的实施方案中,所述人工组织前体的厚度为0.5mm-3mm(例如0.5mm-1mm、1mm-2mm或2mm-3mm)。
在某些优选的实施方案中,所述人工组织前体的面积为0.5cm2-5cm2(例如0.5cm2-1cm2、1cm2-1.5cm2、1.5cm2-2.5cm2、2.5cm2-2.5cm2或3.5cm2-5cm2)。
在某些优选的实施方案中,所述人工组织前体具有均一或不均一的厚度。例如,所述片状固体支持物的某一部分贴合有片状生物构建体,而其他部分没有贴合片状生物构建体。例如,所述片状固体支持物的不同部分贴合有不同的片状生物构建体。
在某些优选的实施方案中,所述片状固体支持物为圆形片状、椭圆形片状、平行四边形(例如矩形)片状、扇形片状或不规则片状,或近似于圆形、椭圆形、平行四边形(例如矩形)或扇形的片状。
在某些优选的实施方案中,所述片状固体支持物的厚度为0.5mm-3mm(例如0.5mm-1mm、1mm-2mm或2mm-3mm)。
在某些优选的实施方案中,所述片状固体支持物的面积为0.5cm2-5cm2(例如0.5cm2-1cm2、1cm2-1.5cm2、1.5cm2-2.5cm2、2.5cm2-2.5cm2或3.5cm2-5cm2)。
所述片状生物构建体为圆形片状、椭圆形片状、平行四边形(例如矩形)片状、扇形片状或不规则片状,或近似于圆形、椭圆形、平行四边形(例如矩形)或扇形的片状。
在某些优选的实施方案中,所述片状生物构建体的厚度为20μm-3mm(例如20μm-100μm、100μm-500μm、500μm-1mm、1mm-2mm或2mm-3mm)。
在某些优选的实施方案中,所述片状生物构建体的面积为0.5cm2-5cm2(例如0.5cm2-1cm2、1cm2-1.5cm2、1.5cm2-2.5cm2、2.5cm2-2.5cm2或3.5cm2-5cm2)。
在某些优选的实施方案中,本发明的人工组织前体中,至少一个微囊或者至少一个生物构建体与所述固体支持物固定在一起。
在某些优选的实施方案中,至少一个微囊或者至少一个生物构建体与所述固体支持物通过化学方式贴合。
在某些优选的实施方案中,至少一个生物构建体与所述固体支持物通过粘合剂粘合;
更优选地,所述粘合剂为医用胶。
可用于本发明的医用胶包括但不限于:
软组织类医用粘合剂,例如:以2-氰基丙烯酸辛酯为主体的组织粘合剂;纤维蛋白粘合剂(fs,主要包含纤维蛋白原+凝血酶、ca2+、viii因子);
硬组织类医用粘合剂,例如:用于牙科的合成树脂胶黏剂,例如(1)甲基丙烯酸酯系:4-emta(4-甲基丙烯酰氧乙基偏苯三酸酐酯)、phenyp(甲基丙烯酰氧乙基苯基磷酸酯)、配合磷酸酯的bis-gma(双甲基丙烯酸缩水甘油酯)等,多用于龋齿填充和牙质粘接,(2)聚羧酸系,例如聚丙烯酸酯+氧化锌或特殊玻璃填料,多用于填充齿洞及粘接有机玻璃补修;骨粘固剂(俗称骨水泥,成分主要为丙烯酸粘固剂(acryliccement)、聚甲基丙烯酸甲酯(polymethylmethacrylic,pmma)等。
优选地,所述医用胶包含α-氰基丙烯酸酯(例如α-氰基丙烯酸甲酯,α-氰基丙烯酸乙酯,α-氰基丙烯酸异丁酯,α-氰基丙烯酸异己酯,α-氰基丙烯酸辛酯,例如α-氰基丙烯酸正辛酯)。
在某些优选的实施方案中,所述粘合剂存在于市售的医用胶中,例如白云医用胶ec型(主要成分:α-氰基丙烯酸正辛酯(508)为主体胶,添加附加剂(医用级聚甲基丙烯酸甲酯));或者福爱乐医用胶(成分:99%的α-氰基丙烯酸正丁酯(nbca/504)和1%的α-氰基丙烯酸正辛酯(noca/508))。
在某些优选的实施方案中,可以调整医用胶的浓度以调整医用胶的凝固时间,以达到良好的粘合效果。可以用适当的溶剂稀释医用胶,例如将医用胶用乙酸乙酯稀释。溶剂可以选择医用级酯类溶剂,如医用级乙酸乙酯,医用级聚甲基丙烯酸甲酯。
另一方面,本申请提供了以下多种制备如上所述的人工组织前体的方法。
方法1:人工组织前体为管状,制备所述人工组织前体的方法包含以下步骤:
(i)制备管状(例如圆形管状;例如侧壁开口或不开口的管状)生物构建体;
(ii)将管状生物构建体与管状固体支持物的内壁进行贴合;
在某些优选的实施方案中,制备管状生物构建体通过包含以下步骤的方法进行:
(1)提供一种或多种微囊,其全部或者部分表面附着有第一组分;优选地,所述第一组分包含于第一试剂中;
(2)在临时支持物表面的预设区域上涂布含有第二组分的第二试剂,其中,当所述第一组分与第二组分接触时,能够产生粘连效果,实现粘合作用;所述临时支持物为管状或柱状(例如侧壁不开口的圆形管状、侧壁开口的圆形管状、圆柱状或沿部分圆周设置的柱状)物,所述预设区域位于临时支持物的曲面;任选地,在涂布第二试剂之前,将衬底材料涂布在临时支持物表面的预设区域上;
(3)将步骤(1)中的全部或者部分表面附着有第一组分的微囊放置于涂布了第二试剂的预设区域,使所述微囊表面上的第一组分与预设区域上的第二组分接触,产生粘连效果,从而将所述微囊组装(粘合)成第一层结构,所述第一层结构为管状结构;
任选地,所述方法还包括以下步骤:
(4)在前一步骤产生的结构上涂布第二试剂;
(5)将步骤(1)中的全部或者部分表面附着有第一组分的微囊放置于前一步骤产生的结构上,使所述微囊表面上的第一组分与前一步骤产生的结构上的第二组分接触,产生粘连效果,从而在前一步骤产生的结构上,将所述微囊组装(粘合)成另一层结构;
(6)任选地,重复步骤(4)和(5)一次或多次;例如至少1次,至少2次,至少3次,至少4次,至少5次,至少10次,至少15次,至少20次,至少30次,至少40次,至少50次,至少100次,至少200次,至少500次,或更多次;
从而得到管状生物构建体。
任选地,所述方法还包括:将侧壁开口的圆形管状生物构建体进行粘合,得到侧壁不开口的圆形管状生物构建体。
任选地,所述方法还包括:将管状生物构建体从临时支持物上分离。
在某些优选的实施方案中,所述临时支持物为具有曲面的打印平台,例如3d打印机的旋转杆。
在某些优选的实施方案中,所述衬底材料是由温敏性材料,例如明胶、聚n-异丙基丙烯酰胺、聚n-异丙基丙烯酰胺—聚乙二醇嵌段共聚物、聚乙二醇共聚物(例如聚乙烯醇-聚乙二醇共聚物),聚羟乙基丙烯酸酯、琼脂糖、matrigel、壳聚糖/甘油磷酸钠体系或pluronicf127。
在某些优选的实施方案中,所述临时支持物为温敏性材料(例如明胶、聚n-异丙基丙烯酰胺、聚n-异丙基丙烯酰胺—聚乙二醇嵌段共聚物、聚乙二醇共聚物,聚羟乙基丙烯酸酯、琼脂糖、matrigel、壳聚糖/甘油磷酸钠体系或pluronicf127)制成的圆柱状物或圆管状物。
在某些优选的实施方案中,所述临时支持物为圆柱状物。图4a示例性描述了作为临时支持物的圆柱状物。
在某些优选的实施方案中,所述临时支持物为圆柱状物,所述预设区域为圆柱状物的整个侧面,如图4b所示,从而,步骤(3)得到的第一层结构为侧壁不开口的圆形管状结构。
在某些优选的实施方案中,所述临时支持物为圆柱状物,所述预设区域在展开的圆柱状物的侧面上为一矩形,并且所述预设区域沿圆柱状物的轴向贯通圆柱状物的侧面,如图4c所示,从而,步骤(3)得到的第一层结构为侧壁不开口的圆形管状结构。
在某些优选的实施方案中,所述临时支持物为圆柱状物,所述预设区域在展开的圆柱状物的侧面上为一矩形,并且所述预设区域沿圆柱状物的圆周方向贯通柱状物侧面,如图4d所示,从而,步骤(3)得到的第一层结构为侧壁不开口的圆形管状结构。
在某些优选的实施方案中,所述临时支持物为圆柱状物,所述预设区域在展开的圆柱状物的侧面上为一矩形,并且未沿圆柱状物的圆周方向和轴向贯通圆柱状物侧面,如图4e所示,从而,步骤(3)得到的第一层结构为侧壁开口的圆形管状结构。
在某些优选的实施方案中,步骤(3)中,在将全部或部分表面附着有第一组分的微囊放置于步骤(2)的涂布了第二试剂的预设区域之后,静置0.1-60s;(例如0.1-1s,1-5s,5-10s,10-15s,15-20s,20-25s,25-30s,30-35s,35-40s,40-45s,45-50s,50-55s,或55-60s)。该静置步骤有利于所述微囊表面上的第一组分与预设区域上的第二组分充分接触,并发生相互作用,从而将所述微囊组装(粘合)成第一层结构。
在某些优选的实施方案中,通过生物打印法来实施制备管状生物构建体的方法。
在某些优选的实施方案中,使用打印机(例如3d生物打印机)来进行生物打印法;或者,使用自动化或非自动化机械过程来进行生物打印法;或者,通过使用手工放置或手工沉积法(例如使用移液器)来进行生物打印法。
在某些优选的实施方案中,通过挤出式打印法或模块化打印法来对微囊进行打印。
在某些优选的实施方案中,使用模块化打印法,挤出式打印法,或喷墨式打印法来对所述第二试剂进行打印。
在某些优选的实施方案中,使用模块化打印法,挤出式打印法,或喷墨式打印法来对所述辅助材料进行打印。
在某些优选的实施方案中,使用3d生物打印机来制备生物构建体。
在某些优选的实施方案中,所述3d生物打印机包含:第一墨盒,其用于提供微囊;第二墨盒,其用于提供第二试剂;第一打印喷头;以及,连接至第二墨盒的第二打印喷头。
在某些优选的实施方案中,所述3d生物打印机还包含:第三墨盒,其用于提供衬底材料;以及,第三打印喷头。
在某些优选的实施方案中,所述3d生物打印机还包含:用于提供第一试剂的第四墨盒。
在某些优选的实施方案中,所述方法包括下述步骤:
(1)在3d生物打印机的第一墨盒中提供微囊,其全部或者部分表面附着有第一组分,并且在3d生物打印机的第二墨盒中提供含有第二组分的第二试剂;其中,当所述第一组分与第二组分接触时,能够产生粘连效果,实现粘合作用;
(2)通过3d生物打印机的连接至第二墨盒的第二打印喷头,在旋转杆曲面的预设区域上打印第二试剂;任选地,在打印第二试剂之前,将衬底材料打印在预设区域上;
(3)通过3d生物打印机的第一打印喷头,将步骤(1)中的微囊打印至步骤(2)的打印了第二试剂的预设区域上,使所述微囊表面上的第一组分与所述预设区域上的第二组分接触,产生粘连效果,从而将所述微囊组装(粘合)成第一层结构;
任选地,所述方法还包括下述步骤:
(4)通过所述第二打印喷头,在前一步骤获得的结构上打印第二试剂;
(5)通过所述第一打印喷头,将步骤(1)中的微囊打印至前一步骤产生的结构上,使所述微囊表面上的第一组分与所述结构上的第二组分接触,产生粘连效果,从而在前一步骤产生的结构上,将所述微囊组装(粘合)成另一层结构;
(6)任选地,重复步骤(4)和(5)一次或多次;例如至少1次,至少2次,至少3次,至少4次,至少5次,至少10次,至少15次,至少20次,至少30次,至少40次,至少50次,至少100次,至少200次,至少500次,或更多次;
从而,制备得到管状生物构建体。
方法2:人工组织前体为管状,制备所述人工组织前体的方法包含以下步骤:
(i)制备管状(例如圆形管状;例如侧壁开口或不开口的管状)生物构建体;
(ii)将管状生物构建体与管状固体支持物的内壁进行贴合。
在某些优选的实施方案中,制备管状生物构建体通过包含以下步骤的方法进行:
(1)提供一种或多种微囊,其全部或者部分表面附着有第一组分;优选地,所述第一组分包含于第一试剂中;
(2)在临时支持物的表面上,用含有第二组分的第二试剂绘制预设的环形(例如圆环或扇环)图案,其中,当所述第一组分与第二组分接触时,能够产生粘连效果,实现粘合作用;所述临时支持物具有至少一个平面,所述环形图案位于临时支持物的平面;
(3)将步骤(1)中的全部或者部分表面附着有第一组分的微囊放置于第二试剂绘制的预设的环形图案上,使所述微囊表面上的第一组分与所述环形图案上的第二组分接触,产生粘连效果,从而将所述微囊组装(粘合)成第一层结构,所述第一层结构为环形结构;
(4)在环形结构上涂布第二试剂;
(5)将步骤(1)中的全部或者部分表面附着有第一组分的微囊放置于前一步骤产生的结构上,使所述微囊表面上的第一组分与前一步骤产生的结构上的第二组分接触,产生粘连效果,从而在前一步骤产生的结构上,将所述微囊组装(粘合)成另一层结构;
(6)任选地,重复步骤(4)和(5)一次或多次;例如至少1次,至少2次,至少3次,至少4次,至少5次,至少10次,至少15次,至少20次,至少30次,至少40次,至少50次,至少100次,至少200次,至少500次,或更多次;
从而得到管状生物构建体;
任选地,所述方法还包括:将侧壁开口的圆形管状生物构建体进行粘合,得到侧壁不开口的圆形管状生物构建体;
在某些优选的实施方案中,所述临时支持物为3d打印机的打印平台;
在某些优选的实施方案中,步骤(3)中,在将全部或部分表面附着有第一组分的微囊放置于步骤(2)的绘制的预设的环形图案上之后,静置0.1-60s;(例如0.1-1s,1-5s,5-10s,10-15s,15-20s,20-25s,25-30s,30-35s,35-40s,40-45s,45-50s,50-55s,或55-60s)。该静置步骤有利于所述微囊表面上的第一组分与预设区域上的第二组分充分接触,并发生相互作用,从而将所述微囊组装(粘合)成第一层结构。
在某些优选的实施方案中,通过生物打印法来实施制备管状生物构建体的方法。
在某些优选的实施方案中,使用打印机(例如3d生物打印机)来进行生物打印法;或者,使用自动化或非自动化机械过程来进行生物打印法;或者,通过使用手工放置或手工沉积法(例如使用移液器)来进行生物打印法。
在某些优选的实施方案中,通过挤出式打印法或模块化打印法来对微囊进行打印。
在某些优选的实施方案中,使用模块化打印法,挤出式打印法,或喷墨式打印法来对所述第二试剂进行打印。
在某些优选的实施方案中,使用模块化打印法,挤出式打印法,或喷墨式打印法来对所述辅助材料进行打印。
其中,使用3d生物打印机来制备生物构建体;
在某些优选的实施方案中,所述3d生物打印机包含:第一墨盒,其用于提供微囊;第二墨盒,其用于提供第二试剂;第一打印喷头;以及,连接至第二墨盒的第二打印喷头。
在某些优选的实施方案中,所述3d生物打印机还包含:第三墨盒,其用于提供辅助材料;以及,第三打印喷头。
在某些优选的实施方案中,所述3d生物打印机还包含:用于提供第一试剂的第四墨盒。
在某些优选的实施方案中,所述方法包括下述步骤:
(1)在3d生物打印机的第一墨盒中提供微囊,其全部或者部分表面附着有第一组分,并且在3d生物打印机的第二墨盒中提供含有第二组分的第二试剂;其中,当所述第一组分与第二组分接触时,能够产生粘连效果,实现粘合作用;
(2)通过3d生物打印机的连接至第二墨盒的第二打印喷头,在打印平台上用所述第二试剂绘制环形(例如圆环或扇环)图案;
(3)通过3d生物打印机的第一打印喷头,将步骤(1)中的微囊打印至步骤(2)绘制的环形图案上,使所述微囊表面上的第一组分与所述环形图案上的第二组分接触,产生粘连效果,从而将所述微囊组装(粘合)成第一层结构;
任选地,所述方法还包括下述步骤:
(4)通过所述第二打印喷头,在前一步骤获得的结构上打印第二试剂;
(5)通过所述第一打印喷头,将步骤(1)中的微囊打印至前一步骤产生的结构上,使所述微囊表面上的第一组分与所述结构上的第二组分接触,产生粘连效果,从而在前一步骤产生的结构上,将所述微囊组装(粘合)成另一层结构;
(6)任选地,重复步骤(4)和(5)一次或多次;例如至少1次,至少2次,至少3次,至少4次,至少5次,至少10次,至少15次,至少20次,至少30次,至少40次,至少50次,至少100次,至少200次,至少500次,或更多次;
从而,制备得到管状生物构建体。
示例性的圆环和扇环图案如图5a所示。
方法3:人工组织前体为片状,制备所述人工组织前体的方法包含以下步骤:
(i)制备片状(例如平面的片状或弯曲的片状)生物构建体;
(ii)将片状生物构建体与片状固体支持物进行贴合。
在某些优选的实施方案中,制备片状生物构建体通过包含以下步骤的方法进行:
(1)提供一种或多种微囊,其全部或者部分表面附着有第一组分;优选地,所述第一组分包含于第一试剂中;
(2)在临时支持物表面的预设区域上涂布含有第二组分的第二试剂,其中,当所述第一组分与第二组分接触时,能够产生粘连效果,实现粘合作用;所述临时支持物具有至少一个平面,所述预设的图案位于临时支持物的平面;
(3)将步骤(1)中的全部或者部分表面附着有第一组分的微囊放置于涂布了第二试剂的预设区域,使所述微囊表面上的第一组分与预设区域上的第二组分接触,产生粘连效果,从而将所述微囊组装(粘合)成第一层结构,所述第一层结构为平面的片状结构;
任选地,所述方法还包括以下步骤:
(4)在前一步骤产生的结构上涂布第二试剂;
(5)将步骤(1)中的全部或者部分表面附着有第一组分的微囊放置于前一步骤产生的结构上,使所述微囊表面上的第一组分与前一步骤产生的结构上的第二组分接触,产生粘连效果,从而在前一步骤产生的结构上,将所述微囊组装(粘合)成另一层结构;
(6)任选地,重复步骤(4)和(5)一次或多次;例如至少1次,至少2次,至少3次,至少4次,至少5次,至少10次,至少15次,至少20次,至少30次,至少40次,至少50次,至少100次,至少200次,至少500次,或更多次;
从而得到平面的片状生物构建体。
任选地,所述方法还包括,对平面的片状生物构建体进行弯折,得到弯曲的片状生物构建体。
在某些优选的实施方案中,所述预设区域为平行四边形(例如矩形)区域、圆形区域、椭圆形区域、扇形区域或不规则形区域。
在某些优选的实施方案中,所述临时支持物为3d打印机的打印平台。
在某些优选的实施方案中,步骤(3)中,在将全部或部分表面附着有第一组分的微囊放置于步骤(2)的涂布了第二试剂的预设区域之后,静置0.1-60s。
在某些优选的实施方案中,步骤(3)中,在将全部或部分表面附着有第一组分的微囊放置于步骤(2)的涂布了第二试剂的预设区域之后,静置0.1-60s;(例如0.1-1s,1-5s,5-10s,10-15s,15-20s,20-25s,25-30s,30-35s,35-40s,40-45s,45-50s,50-55s,或55-60s)。该静置步骤有利于所述微囊表面上的第一组分与预设区域上的第二组分充分接触,并发生相互作用,从而将所述微囊组装(粘合)成第一层结构。
在某些优选的实施方案中,通过生物打印法来实施制备管状生物构建体的方法。
在某些优选的实施方案中,使用打印机(例如3d生物打印机)来进行生物打印法;或者,使用自动化或非自动化机械过程来进行生物打印法;或者,通过使用手工放置或手工沉积法(例如使用移液器)来进行生物打印法。
在某些优选的实施方案中,通过挤出式打印法或模块化打印法来对微囊进行打印。
在某些优选的实施方案中,使用模块化打印法,挤出式打印法,或喷墨式打印法来对所述第二试剂进行打印。
在某些优选的实施方案中,使用模块化打印法,挤出式打印法,或喷墨式打印法来对所述辅助材料进行打印。
在某些优选的实施方案中,使用3d生物打印机来制备生物构建体;
在某些优选的实施方案中,所述3d生物打印机包含:第一墨盒,其用于提供微囊;第二墨盒,其用于提供第二试剂;第一打印喷头;以及,连接至第二墨盒的第二打印喷头。
在某些优选的实施方案中,所述3d生物打印机还包含:用于提供第一试剂的第三墨盒。
在某些优选的实施方案中,所述方法包括下述步骤:
(1)在3d生物打印机的第一墨盒中提供微囊,其全部或者部分表面附着有第一组分,并且在3d生物打印机的第二墨盒中提供含有第二组分的第二试剂;其中,当所述第一组分与第二组分接触时,能够产生粘连效果,实现粘合作用;
(2)通过3d生物打印机的连接至第二墨盒的第二打印喷头,在打印平台的预设区域上打印第二试剂;
(3)通过3d生物打印机的第一打印喷头,将步骤(1)中的微囊打印至步骤(2)的打印了第二试剂的预设区域上,使所述微囊表面上的第一组分与所述预设区域上的第二组分接触,产生粘连效果,从而将所述微囊组装(粘合)成第一层结构;
任选地,所述方法还包括下述步骤:
(4)通过所述第二打印喷头,在前一步骤获得的结构上打印第二试剂;
(5)通过所述第一打印喷头,将步骤(1)中的微囊打印至前一步骤产生的结构上,使所述微囊表面上的第一组分与所述结构上的第二组分接触,产生粘连效果,从而在前一步骤产生的结构上,将所述微囊组装(粘合)成另一层结构;
(6)任选地,重复步骤(4)和(5)一次或多次;例如至少1次,至少2次,至少3次,至少4次,至少5次,至少10次,至少15次,至少20次,至少30次,至少40次,至少50次,至少100次,至少200次,至少500次,或更多次;
从而,制备得到片状生物构建体。
任选地,所述方法还包括,对平面的片状生物构建体进行弯折,得到弯曲的片状生物构建体;
在某些优选的实施方案中,所述预设区域为平行四边形(例如矩形)区域、圆形区域或椭圆形区域。
在某些优选的实施方案中,所述临时支持物为3d打印机的打印平台。
在某些优选的实施方案中,步骤(3)中,在将全部或部分表面附着有第一组分的微囊放置于步骤(2)的涂布了第二试剂的预设区域之后,静置0.1-60s。
在某些优选的实施方案中,使用3d生物打印机来制备片状生物构建体。
在某些优选的实施方案中,所述3d生物打印机包含:第一墨盒,其用于提供微囊;第二墨盒,其用于提供第二试剂;第一打印喷头;以及,连接至第二墨盒的第二打印喷头。
在某些优选的实施方案中,所述3d生物打印机还包含:用于提供第一试剂的第三墨盒。
在某些优选的实施方案中,所述方法包括下述步骤:
(1)在3d生物打印机的第一墨盒中提供微囊,其全部或者部分表面附着有第一组分,并且在3d生物打印机的第二墨盒中提供含有第二组分的第二试剂;其中,当所述第一组分与第二组分接触时,能够产生粘连效果,实现粘合作用;
(2)通过3d生物打印机的连接至第二墨盒的第二打印喷头,在打印平台的预设区域上打印第二试剂;
(3)通过3d生物打印机的第一打印喷头,将步骤(1)中的微囊打印至步骤(2)的打印了第二试剂的预设区域上,使所述微囊表面上的第一组分与所述预设区域上的第二组分接触,产生粘连效果,从而将所述微囊组装(粘合)成第一层结构;
任选地,所述方法还包括下述步骤:
(4)通过所述第二打印喷头,在前一步骤获得的结构上打印第二试剂;
(5)通过所述第一打印喷头,将步骤(1)中的微囊打印至前一步骤产生的结构上,使所述微囊表面上的第一组分与所述结构上的第二组分接触,产生粘连效果,从而在前一步骤产生的结构上,将所述微囊组装(粘合)成另一层结构;
(6)任选地,重复步骤(4)和(5)一次或多次;例如至少1次,至少2次,至少3次,至少4次,至少5次,至少10次,至少15次,至少20次,至少30次,至少40次,至少50次,至少100次,至少200次,至少500次,或更多次;
从而,制备得到片状生物构建体。
方法4:人工组织前体为片状,制备所述人工组织前体的方法包含以下步骤:
(i)由方法3中制备片状生物构建体的方法,制备片状生物构建体;
(ii)提供制备固体支持物的材料(例如生物相容性材料),在片状生物构建体上,制备片状固体支持物。
在某些优选的实施方案中,通过3d打印或喷涂的方法制备片状固体支持物。
方法5:人工组织前体为管状,制备所述人工组织前体的方法包含以下步骤:
(i)通过方法3中制备片状生物构建体方法,制备片状生物构建体;
(ii)将步骤(i)制得的片状生物构建体进行弯折,和/或将片状生物构建体的边缘进行粘合,得到管状生物构建体;
(iii)将管状生物构建体与管状固体支持物的内壁进行贴合。
方法6:人工组织前体为管状,制备所述人工组织前体的方法包含以下步骤:
(i)由方法1或方法2任一项中的制备管状生物构建体的方法,制备管状生物构建体;
或者,由方法3中的制备片状生物构建体的方法,制备片状生物构建体;之后,对制得的片状生物构建体进行弯折,和/或将片状生物构建体的边缘进行粘合,得到管状生物构建体;
(ii)提供制备固体支持物的材料(例如生物相容性材料),在管状生物构建体的外壁上,制备管状固体支持物;
在某些优选的实施方案中,通过3d打印或喷涂的方法制备管状固体支持物。
方法1-6任一项定义的制备人工组织前体的方法,还包括对生物构建体进行定型。
在某些优选的实施方案中,可以根据生物构建体的结构稳定性及厚度的需要,在生物构建体上喷涂定型剂(例如市售的含α-氰基丙烯酸酯的医用胶)。喷涂定型剂的层数越多,则生物构建体的结构越稳定,和/或具有更大的厚度。
在某些优选的实施方案中,对生物构建体进行定型的方法包括以下步骤:
1)在生物构建体的表面喷涂一层医用胶,待医用胶凝固;
2)在喷涂了医用胶的生物构建体的表面滴加并均匀涂抹细胞培养基;
3)再次喷涂医用胶,在培养基中阴离子的作用下,医用胶快速凝固;
4)任选地,重复步骤2)和3)。
可通过上述方法在生物构建体的表面形成医用胶层,使生物构建体稳定坚固。该方法还可用于调节生物构建体的厚度,方便与固体支持物相匹配。
方法7:人工组织前体为管状或片状,制备所述人工组织前体的方法包含以下步骤:
(1)提供一种或多种微囊,其全部或者部分表面附着有第一组分;在某些优选的实施方案中,所述第一组分包含于第一试剂中;
(2)提供固体支持物,在所述固体支持物表面的预设区域上涂布含有第二组分的第二试剂,其中,当所述第一组分与第二组分接触时,能够产生粘连效果,实现粘合作用;
(3)将步骤(1)中的全部或者部分表面附着有第一组分的微囊放置于涂布了第二试剂的预设区域,使所述微囊表面上的第一组分与预设区域上的第二组分接触,产生粘连效果,从而在固体支持物表面,将所述微囊组装(粘合)成第一层结构;
任选地,所述方法还包括以下步骤:
(4)在前一步骤产生的结构上涂布第二试剂;
(5)将步骤(1)中的全部或者部分表面附着有第一组分的微囊放置于前一步骤产生的结构上,使所述微囊表面上的第一组分与前一步骤产生的结构上的第二组分接触,产生粘连效果,从而在前一步骤产生的结构上,将所述微囊组装(粘合)成另一层结构;
(6)任选地,重复步骤(4)和(5)一次或多次;例如至少1次,至少2次,至少3次,至少4次,至少5次,至少10次,至少15次,至少20次,至少30次,至少40次,至少50次,至少100次,至少200次,至少500次,或更多次;
从而得到人工组织前体;
在某些优选的实施方案中,所述固体支持物为管状或片状;
在某些优选的实施方案中,所述固体支持物为管状固体支持物,所述预设区域位于固体支持物的内壁;
在某些优选的实施方案中,步骤(3)中,在将全部或部分表面附着有第一组分的微囊放置于步骤(2)的涂布了第二试剂的预设区域之后,静置0.1-60s;(例如0.1-1s,1-5s,5-10s,10-15s,15-20s,20-25s,25-30s,30-35s,35-40s,40-45s,45-50s,50-55s,或55-60s)。该静置步骤有利于所述微囊表面上的第一组分与预设区域上的第二组分充分接触,并发生相互作用,从而将所述微囊组装(粘合)成第一层结构。
在某些优选的实施方案中,使用3d生物打印机来制备人工组织前体。
在某些优选的实施方案中,所述3d生物打印机包含:第一墨盒,其用于提供微囊;第二墨盒,其用于提供第二试剂;第一打印喷头;以及,连接至第二墨盒的第二打印喷头。
在某些优选的实施方案中,所述3d生物打印机还包含:用于提供第一试剂的第三墨盒。
在某些优选的实施方案中,所述方法包括下述步骤:
(1)在3d生物打印机的第一墨盒中提供微囊,其全部或者部分表面附着有第一组分,并且在3d生物打印机的第二墨盒中提供含有第二组分的第二试剂;其中,当所述第一组分与第二组分接触时,能够产生粘连效果,实现粘合作用;
(2)通过3d生物打印机的连接至第二墨盒的第二打印喷头,在固体支持物的预设区域上打印第二试剂;
(3)通过3d生物打印机的第一打印喷头,将步骤(1)中的微囊打印至步骤(2)的打印了第二试剂的预设区域上,使所述微囊表面上的第一组分与所述预设区域上的第二组分接触,产生粘连效果,从而将所述微囊组装(粘合)成第一层结构;
任选地,所述方法还包括下述步骤:
(4)通过所述第二打印喷头,在前一步骤获得的结构上打印第二试剂;
(5)通过所述第一打印喷头,将步骤(1)中的微囊打印至前一步骤产生的结构上,使所述微囊表面上的第一组分与所述结构上的第二组分接触,产生粘连效果,从而在前一步骤产生的结构上,将所述微囊组装(粘合)成另一层结构;
(6)任选地,重复步骤(4)和(5)一次或多次;例如至少1次,至少2次,至少3次,至少4次,至少5次,至少10次,至少15次,至少20次,至少30次,至少40次,至少50次,至少100次,至少200次,至少500次,或更多次;
从而,制备得到人工组织前体。
在本发明的制备的人工组织前体的方法中,优选地,所述第一组分和/或第二组分为生物相容性材料。在某些优选的实施方案中,所述第一组分和/或第二组分为来源于生物的材料。在某些优选的实施方案中,所述第一组分和/或第二组分为生物可降解材料。
在某些优选的实施方案中,所述第一组分与第二组分在接触时能够发生强烈相互作用(例如,能够发生化学反应),并产生粘连效果,实现粘合作用。此类粘合作用不仅能够实现细胞与细胞之间、细胞与组织之间、组织与组织之间的粘合,而且能够实现细胞/组织与外部物质之间的粘合。特别优选地,此类粘合作用具备至少一种选自以下的性质:(1)其是安全、可靠、无毒性、不致癌、不致畸、不致突变的;(2)其具有良好的生物相容性,不妨碍机体组织的自身愈合;(3)其能够在有血液和组织液的条件下使用;(4)其能够在常温、常压下实现快速粘合;(5)其具有良好的粘合强度及持久性,粘合部分具有一定的弹性和韧性;(6)其在使用过程中对机体组织无刺激性;(7)在达到粘合效果后,相关的组分能够逐渐被降解和吸收;和,(8)粘合部位能够被细胞迁移通过。
在某些优选实施方案中,所述第一组分与第二组分接触而产生的粘连效果可用于将两个微囊粘合在一起,形成生物构建体;并且由此所获得的生物构建体的拉伸模量不低于10pa,例如不低于20pa,不低于30pa,不低于40pa,不低于50pa,不低于60pa,不低于70pa,不低于80pa,不低于90pa,不低于100pa,不低于200pa,不低于300pa,不低于400pa,不低于500pa,不低于600pa,不低于700pa,不低于800pa,不低于900pa或不低于1000pa。在某些优选实施方案中,所获得的构建体的拉伸模量可达到1kpa-10mpa,例如1-5kpa,5-10kpa,10-50kpa,50-100kpa,100-500kpa,500-1000kpa,1-5mpa,或5-10mpa。在某些优选实施方案中,微囊中的细胞能够迁移通过粘合部位,进入邻近的微囊中或者更远端的微囊中。由此,微囊中的细胞能够在整个构建体内的生长、迁移、分化和增殖。
在某些优选的实施方案中,所述第一组分和第二组分是选自下列的组合:
(1)纤维蛋白原和凝血酶;
(2)海藻酸盐(例如海藻酸钠)或氧化的海藻酸盐(例如氧化的海藻酸钠)和含有ca2+、mg2+、ba2+、sr2+、或fe3+的物质(例如含有ca2+、mg2+、ba2+、sr2+、或fe3+的溶液或半固体(例如凝胶));
(3)含马来酰亚胺基团的分子(例如含有马来酰亚胺基团的聚乙二醇(mal-peg))和含自由巯基的分子(例如含有自由巯基的聚乙二醇(peg-sh));
(4)含有阴离子的物质(例如含有阴离子的溶液或半固体(例如凝胶))和α-氰基丙烯酸酯(例如α-氰基丙烯酸甲酯,α-氰基丙烯酸乙酯,α-氰基丙烯酸异丁酯,α-氰基丙烯酸异己酯,α-氰基丙烯酸正辛酯);
(5)纤维蛋白原和α-氰基丙烯酸酯(例如α-氰基丙烯酸甲酯,α-氰基丙烯酸乙酯,α-氰基丙烯酸异丁酯,α-氰基丙烯酸异己酯,α-氰基丙烯酸正辛酯);
(6)血清白蛋白(例如,牛血清白蛋白)和戊二醛;
(7)含氨基甲酸酯基团(-nhcoo-)或异氰酸酯基团(-nco)的分子(例如含氨基甲酸酯基团的聚乙二醇或含异氰酸酯基团的聚乙二醇)和含活泼氢的分子(例如含羧基的聚乙二醇);
(8)明胶-间苯二酚和戊二醛;
(9)碳化二亚胺交联明胶和聚l-谷氨酸(plga);和
(10)胺基化明胶和醛基化多糖。
应当特别指出的是,只要所述第一组分与第二组分接触时,能够产生粘连效果,实现粘合作用,即可用于实施本发明的实施方案。本发明的第一组分与第二组分并不局限于上述特定的组合。此外,当将某一组合用作第一组分和第二组分时,第一组分可以是该组合的任一成员,且第二组分是该组合的另一成员。例如,当使用纤维蛋白原和凝血酶这个组合时,第一组分可以是纤维蛋白原(此时第二组分为凝血酶),或者可以是凝血酶(此时第二组分为纤维蛋白原)。
在某些优选的实施方案中,所述第一组分为纤维蛋白原,且第二组分为凝血酶。在某些优选的实施方案中,所述第一组分为海藻酸盐(例如海藻酸钠)或氧化的海藻酸盐(例如氧化的海藻酸钠),且第二组分为含有ca2+、mg2+、ba2+、sr2+、或fe3+的物质,例如含有ca2+、mg2+、ba2+、sr2+、或fe3+的溶液或半固体(例如凝胶)。在某些优选的实施方案中,所述第一组分为含马来酰亚胺基团的分子(例如含有马来酰亚胺基团的聚乙二醇(mal-peg)),且第二组分为含自由巯基的分子(例如含有自由巯基的聚乙二醇(peg-sh))。在某些优选的实施方案中,所述第一组分为含有阴离子的物质,例如含有阴离子的溶液或半固体(例如凝胶),且第二组分为α-氰基丙烯酸酯(例如α-氰基丙烯酸甲酯,α-氰基丙烯酸乙酯,α-氰基丙烯酸异丁酯,α-氰基丙烯酸异己酯,α-氰基丙烯酸正辛酯)。在某些优选的实施方案中,所述第一组分为纤维蛋白原,且第二组分为α-氰基丙烯酸酯(例如α-氰基丙烯酸甲酯,α-氰基丙烯酸乙酯,α-氰基丙烯酸异丁酯,α-氰基丙烯酸异己酯,α-氰基丙烯酸正辛酯)。在某些优选的实施方案中,所述第一组分为血清白蛋白(例如,牛血清白蛋白),且第二组分为戊二醛。在某些优选的实施方案中,所述第一组分为含氨基甲酸酯基团(-nhcoo-)或异氰酸酯基团(-nco)的分子(例如含氨基甲酸酯基团的聚乙二醇或含异氰酸酯基团的聚乙二醇),且第二组分为含活泼氢的分子(例如含羧基的聚乙二醇)。在某些优选的实施方案中,所述第一组分为明胶-间苯二酚,且第二组分为戊二醛。在某些优选的实施方案中,所述第一组分为碳化二亚胺交联明胶,且第二组分为聚l-谷氨酸(plga)。在某些优选的实施方案中,所述第一组分为胺基化明胶,且第二组分为醛基化多糖。
在某些优选的实施方案中,在所述第一试剂中,第一组分的浓度为0.01-50wt%。例如,在某些优选的实施方案中,所述第一组分的浓度为0.01-0.05wt%,0.05-0.1wt%,0.1-0.5wt%,0.5-1wt%,1-5wt%,5-10wt%,10-15wt%,15-20wt%,20-25wt%,25-30wt%,30-35wt%,35-40wt%,40-45wt%,或者45-50wt%。
在某些优选的实施方案中,在所述第二试剂中,第二组分的浓度为0.01-50wt%。例如,在某些优选的实施方案中,所述第二组分的浓度为0.01-0.05wt%,0.05-0.1wt%,0.1-0.5wt%,0.5-1wt%,1-5wt%,5-10wt%,10-15wt%,15-20wt%,20-25wt%,25-30wt%,30-35wt%,35-40wt%,40-45wt%,或者45-50wt%。
在某些优选的实施方案中,可通过选择第一组分和第二组分的类别和/或浓度来控制粘合作用的强度和/或持续时间。例如,当纤维蛋白原和凝血酶接触时,二者能够发生相互作用并产生力学强度较弱的纤维蛋白。因此,在某些优选的实施方案中,可将纤维蛋白原和凝血酶用作第一组分和第二组分,并且,此类试剂特别适合用于构建力学强度较小的组织,如弹性模量小于10mpa的组织。例如,α-氰基丙烯酸酯能够与含有阴离子的溶液发生强烈的聚合反应,生成力学强度较大的聚合物。因此,在某些优选的实施方案中,可将含有阴离子的物质和α-氰基丙烯酸酯用作第一组分和第二组分,并且,此类试剂盒特别适合用于构建力学强度较大的组织,如弹性模量大于10mpa的组织。
在某些优选的实施方案中,所述第二试剂为液体或半固体(例如凝胶)。在某些优选的实施方案中,第二试剂用于绘制预设的图案或涂布在预设的区域。因此,特别优选地,所述第二试剂具有适当的粘度,以便其在用于绘制图案时,能够稳定维持图案或区域的形状/模式/轮廓,而不任意流动。因此,在某些优选的实施方案中,所述第二试剂的粘度为1-1000pa·s,例如30-160pa·s。在某些优选的实施方案中,所述第二试剂的粘度为约1、2、3、4、5、6、7、8、9、10、12、14、16、18、20、25、30、50、80、100、200、300、400、500、800、或1000pa·s。在某些优选的实施方案中,所述第二试剂的粘度为1-2、2-3、3-4、4-5、5-6、6-7、7-8、8-9、9-10、10-12、12-14、14-16、16-18、18-20、20-25、25-30、30-50、50-80、80-100、100-200、200-300、300-400、400-500、500-800、或800-1000、1-3、3-8、8-16、3-10、10-20、20-50、50-160pa·s、或30-160pa·s。
在某些优选的实施方案中,所述第二试剂还含有第三组分,所述第三组分为粘性剂。可通过调整第三组分(粘性剂)的含量来方便地调整第二试剂的粘度,以便第二试剂能够维持特定的形状,从而适合用于绘制图案或进行涂布。在某些优选的实施方案中,所述第三组分为生物相容性材料。在某些优选的实施方案中,所述第三组分为来源于生物的材料。在某些优选的实施方案中,所述第三组分为生物可降解材料。在某些优选的实施方案中,所述第三组分为温敏性材料。在某些优选的实施方案中,所述温敏性材料在不同的温度下具有不同的形态。例如,所述温敏性材料(例如明胶)在较低的温度下呈固态或半固态,而在较高的温度下呈液态。在某些优选的实施方案中,所述温敏性材料的相变温度在5-40℃之间,例如5-10℃,10-15℃,15-20℃,20-25℃,25-30℃,30-35℃,35-40℃。在某些优选的实施方案中,所述温敏性材料选自明胶,聚n-异丙基丙烯酰胺-聚乙二醇嵌段共聚物,聚乙二醇共聚物(例如聚乙烯醇-聚乙二醇共聚物),琼脂糖,matrigel,壳聚糖/甘油磷酸钠体系,pluronicf127,和聚n-异丙基丙烯酰胺(pnipaam)水凝胶。在某些优选的实施方案中,所述第三组分(粘性剂)选自明胶、嵌段聚合物f-127、琼脂糖、聚乙二醇、瓜尔胶、聚乙烯醇、壳聚糖、胶原、透明质酸、甲壳素、纤维素及其衍生物(例如羟丙基纤维素)、聚氨基酸、聚n-异丙基丙烯酰胺-聚乙二醇嵌段共聚物、聚乙二醇共聚物(例如聚乙烯醇-聚乙二醇共聚物)、海藻酸盐(例如海藻酸钠)、改性的海藻酸盐(例如氧化的海藻酸盐,例如氧化的海藻酸钠)、matrigel、壳聚糖/甘油磷酸钠体系、和聚n-异丙基丙烯酰胺(pnipaam)水凝胶。
在某些优选的实施方案中,所述第三组分(粘性剂)为明胶。
在某些优选的实施方案中,在所述第二试剂中,第三组分的浓度为0.01-50wt%。例如,在某些优选的实施方案中,所述第三组分的浓度为0.01-0.05wt%,0.05-0.1wt%,0.1-0.5wt%,0.5-1wt%,1-5wt%,5-10wt%,10-15wt%,15-20wt%,20-25wt%,25-30wt%,30-35wt%,35-40wt%,40-45wt%,或者45-50wt%。
在某些优选实施方案中,在步骤(1)中,全部或部分表面附着有第一组分的微囊是通过将包含所述第一组分的第一试剂涂布于所述微囊的表面而获得的。因此,在某些优选实施方案中,步骤(1)包括,将所述第一组分涂布于所述微囊的全部或部分表面,从而提供全部或部分表面附着有所述第一试剂的微囊。
在某些优选实施方案中,在步骤(1)中,全部或者部分表面附着有第一组分的微囊是通过将所述微囊在包含所述第一组分的第一试剂中浸渍而获得的。
在某些优选实施方案中,将所述微囊在第一试剂中浸渍1-30min,例如1-5min,5-10min,10-15min,15-20min,20-25min,或25-30min。在某些优选实施方案中,在步骤(1)中,在摇晃或振荡的条件下,将所述微囊在第一试剂中浸渍。摇晃或振荡条件可用于促进第一试剂附着至微囊表面。在某些优选实施方案中,步骤(1)是在室温条件(例如15-37℃)下进行的。在某些优选实施方案中,步骤(1)是在低温条件(例如4-15℃)下进行的。
在某些优选实施方案中,步骤(1)还包括,在浸渍于第一试剂中后,洗涤所述微囊。在某些优选实施方案中,使用缓冲液(例如生理缓冲溶液)或培养基溶液来洗涤所述微囊。在某些优选实施方案中,在浸渍于第一试剂中后,通过将所述微囊浸于缓冲液(例如生理缓冲溶液)或培养基溶液中来洗涤所述微囊。洗涤步骤可以用于去除微囊表面所附着的过量第一试剂。在某些优选实施方案中,洗涤步骤可进行1-5min或5-10min。在某些优选实施方案中,洗涤步骤可在室温条件(例如15-37℃)下或低温条件(例如4-15℃)下进行。
在某些优选实施方案中,步骤(3)是在室温条件(例如15-37℃)下或者在低温条件(例如4-15℃)下进行的。
在某些优选实施方案中,在步骤(5)中,在将全部或部分表面附着有第一组分的微囊放置于前一步骤产生的结构上后,静置0.1-60s(例如0.1-1s,1-5s,5-10s,10-15s,15-20s,20-25s,25-30s,30-35s,35-40s,40-45s,45-50s,50-55s,或55-60s)。该静置步骤有利于所述微囊表面上的第一试剂与所述结构上的第二试剂充分接触,并发生相互作用,从而在前一步骤产生的结构上,将所述微囊组装(粘合)成新的结构层。在某些优选实施方案中,步骤(6)是在室温条件(例如15-37℃)下或者在低温条件(例如4-15℃)下进行的。
在某些优选实施方案中,在进行步骤(2)-(6)期间,还在所产生的结构内部或外周添加辅助材料(例如用于形成支架的辅助材料)。(例如用于支撑的辅助材料)。在某些优选实施方案中,所述辅助材料不包含细胞。优选地,此类辅助材料的添加/使用能够帮助限定所产生的人工组织前体的形状,和/或帮助维持或增强所产生的人工组织前体的稳定性。在某些优选实施方案中,所述辅助材料包含于本发明方法所制备的人工组织前体中。在某些优选实施方案中,所述辅助材料包含于本发明方法所制备的人工组织前体中,并且其随后能够被降解。在此类情况下,所述辅助材料仅仅是暂时性地构成了人工组织前体的一部分。在某些优选实施方案中,所述辅助材料包含于本发明方法所制备的人工组织前体中,并且其是不可降解的。在此类情况下,所述辅助材料直接(稳定地)构成了人工组织前体的一部分。在某些优选实施方案中,此类辅助材料是生物相容性和/或生物可降解的。在某些优选实施方案中,所述辅助材料是为温敏性材料。在某些优选的实施方案中,所述温敏性材料在不同的温度下具有不同的形态。例如,所述温敏性材料(例如明胶)在较低的温度下呈固态或半固态,而在较高的温度下呈液态。在某些优选的实施方案中,所述温敏性材料的相变温度在5-40℃之间,例如5-10℃,10-15℃,15-20℃,20-25℃,25-30℃,30-35℃,35-40℃。在某些优选实施方案中,所述温敏性材料选自明胶,聚n-异丙基丙烯酰胺-聚乙二醇嵌段共聚物,聚乙二醇共聚物(例如聚乙烯醇-聚乙二醇共聚物),聚羟乙基丙烯酸酯,琼脂糖,matrigel,壳聚糖/甘油磷酸钠体系,pluronicf127,和聚n-异丙基丙烯酰胺(pnipaam)水凝胶。
在某些优选的实施方案中,所述辅助材料可以具有任何想要的尺寸。在某些优选的实施方案中,所述辅助材料具有微米至厘米级别的尺寸,例如1μm-10cm,例如,1μm-2μm,2μm-3μm,3μm-4μm,4μm-5μm,5μm-6μm,6μm-7μm,7μm-8μm,8μm-9μm,9μm-10μm,10μm-20μm,20μm-30μm,30μm-40μm,40μm-50μm,50μm-60μm,60μm-70μm,70μm-80μm,80μm-90μm,90μm-100μm,100μm-200μm,200μm-300μm,300μm-400μm,400μm-500μm,500μm-600μm,600μm-700μm,700μm-800μm,800μm-900μm,900μm-1mm,1mm-2mm,2mm-3mm,3mm-4mm,4mm-5mm,5mm-6mm,6mm-7mm,7mm-8mm,8mm-9mm,9mm-10mm,10mm-20mm,20mm-30mm,30mm-40mm,40mm-50mm,50mm-60mm,60mm-70mm,70mm-80mm,80mm-90mm,90mm-100mm,100μm-5mm,500μm-1mm,100μm-800μm,300μm-600μm。
在某些优选的实施方案中,所述辅助材料可以具有任何想要的形状。例如,所述辅助材料可以是片状结构(例如长方形,正方形,圆形,椭圆形,六角形或不规则形状的片状结构),或中空管状结构,或中空三维结构(例如中空立方体,中空球体,中空的矩形棱柱体,中空圆柱体,或中空的不规则形状的三维结构),或实心三维结构(例如实心立方体,实心球体,实心矩形棱柱体,实心圆柱体,或实心不规则形状的三维结构),或其任何组合。在某些优选的实施方案中,所述辅助材料的形状模拟天然组织或器官的形状。
在某些优选的实施方案中,用于制备生物构建体的微囊存在于生物墨汁中。在某些优选的实施方案中,所述生物墨汁还包含载体。
在某些优选的实施方案中,所述载体及其降解产物对于细胞是无毒的,和/或对于宿主是非免疫原性的。在某些优选的实施方案中,所述载体包含生物可降解材料。在某些优选的实施方案中,所述载体中的生物可降解材料是生物相容性的。
在某些优选的实施方案中,所述载体中的生物可降解材料的降解能够提供维持或促进微囊(例如生物砖)内的细胞的生命活动的微环境,例如营养物质。在某些优选的实施方案中,降解产物为小分子化合物,例如有机酸、单糖(例如葡萄糖)、寡糖、氨基酸、脂质等。此类降解产物可参与到细胞的新陈代谢活动中(例如用于合成细胞外基质),用于合成细胞外基质或转化为活动所需的能量。
在某些优选的实施方案中,所述载体中的生物可降解材料是天然存在的(例如来源于动植物的天然存在的生物可降解材料,例如胶原蛋白,纤维蛋白,壳聚糖,海藻酸盐,淀粉,透明质酸,层粘连蛋白,琼脂糖,明胶,葡聚糖,以及其任意组合),人工合成的,重组产生的,经过改性的,或者其任何组合。
在某些优选的实施方案中,所述载体中的生物可降解材料是天然存在的可降解聚合物。优选地,所述可降解聚合物选自胶原蛋白,纤维蛋白,壳聚糖,海藻酸盐,淀粉,透明质酸,层粘连蛋白,明胶,葡聚糖,弹性蛋白,以及其任意组合。
在某些优选的实施方案中,所述载体中的生物可降解材料是经过改性的可降解聚合物,例如经过改性的海藻酸盐,例如氧化海藻酸盐(例如氧化海藻酸钠)。
在某些优选的实施方案中,所述载体中的生物可降解材料是合成的可降解聚合物。此类可降解聚合物包括但不限于,聚磷腈,聚丙烯酸及其衍生物(例如聚甲基丙烯酸,丙烯酸和甲基丙烯酸的共聚物),聚乳酸(pla),聚羟基乙酸(pga),聚乳酸-乙醇酸共聚物(plga),聚原酸酯(poe),聚己内酯(pcl),聚羟基丁酸酯(phb),聚氨基酸(例如聚赖氨酸),可降解性聚氨酯,以及其任何组合。
在某些优选的实施方案中,所述载体还包含水,无机盐,ph缓冲剂,稳定剂,防腐剂,或其任何组合。
在某些优选的实施方案中,所述载体促进微囊(例如生物砖)在构建体上的安置,和/或将生物砖固定在构建体上。
在某些优选的实施方案中,载体为液体或半液体(例如凝胶)。在某些优选的实施方案中,所述载体的粘度为1-1000pas,例如30-160pas。在某些优选的实施方案中,所述载体的粘度为约1、2、3、4、5、6、7、8、9、10、12、14、16、18、20、25、30、50、80、100、200、300、400、500、800、或1000pas。在某些优选的实施方案中,所述载体的粘度为1-2、2-3、3-4、4-5、5-6、6-7、7-8、8-9、9-10、10-12、12-14、14-16、16-18、18-20、20-25、25-30、30-50、50-80、80-100、100-200、200-300、300-400、400-500、500-800、或800-1000、1-3、3-8、8-16、3-10、10-20、20-50、50-160pas、或30-160pas。
在某些优选的实施方案中,步骤(3)中使用的全部或部分表面附着有第一组分的微囊与步骤(5)中使用的全部或部分表面附着有第一组分的微囊可以是相同或不同的。在步骤(5)使用与步骤(3)不同的全部或部分表面附着有第一组分微囊的情况下,可在进行步骤(5)之前,提供所述不同的微囊并使微囊的全部或部分表面附着有第一组分,从而提供与步骤(3)不同的全部或部分表面附着有第一组分的微囊。
在通常情况下,根据想要制备的人工组织前体的细胞分布模式来选择步骤(3)和步骤(5)中使用的微囊(特别是,微囊中包含的细胞)。例如,当想要制备的管状生物构建体仅包含一种细胞时,可在步骤(3)和步骤(5)中使用包含相同细胞的微囊。当想要制备的管状生物构建体仅包含两种或更多种细胞时,可在步骤(3)和步骤(5)中使用两种或更多种的微囊,其各自包含不同的细胞或细胞组合;或者可在步骤(3)和步骤(5)中使用两种或更多种的微囊,其包含相同的未分化的细胞,但包含可将未分化的细胞诱导为不同成体细胞的诱导因子。
如上文中所详细描述的,本发明的第一组分和第二组分不局限于特定的组合。相应地,本发明的方法也不限于特定的第一组分和第二组分的组合。此外,对于每一轮的绘制/涂布,和微囊组装(例如,步骤(2)和(3)构成一轮的绘制/涂布,和微囊组装,且步骤(4)和(5)构成另一轮的绘制/涂布,和微囊组装),可使用相同或不同的第一组分和第二组分的组合。例如,本发明方法的步骤(2)和(3)可以使用第一组分和第二组分的第一种组合,而步骤(4)和(5)可以使用相同的组合或者不同的组合(即,第一组分和第二组分的另一种组合)。
在某些实施方案中,例如方法7的某些实施方案中,步骤(2)和(3)使用的是第一组分和第二组分的第一种组合(例如含有阴离子的物质和α-氰基丙烯酸酯的组合);而步骤(4)和(5)使用与步骤(2)和(3)不同的组合(例如与含有阴离子的物质和α-氰基丙烯酸酯的组合不同的组合,例如纤维蛋白原和凝血酶的组合)。
如上文所描述的,每一次的步骤(4)和(5)的重复各自构成了一轮的微囊组装。对于每一轮的微囊单元组装,可使用相同或不同的微囊;和/或,相同或不同的第一组分和第二组分的组合。在某些优选的实施方案中,对于每一轮的微囊组装,可通过更换相应墨盒中的墨汁,或者,可通过提供额外的墨盒,来实现微囊、包含第一组分的第一试剂和包含第二组分的第二试剂的更替。
在某些优选的实施方案中,本发明方法中的生物打印步骤(例如步骤(2)-(6))是连续的和/或基本连续的。在某些优选的实施方案中,在本发明方法的步骤(2)-(6)中,连续地生物打印多层结构,以获得具有预定模式的、包含多层结构的生物构建体或人工组织前体。在某些优选的实施方案中,在本发明方法的步骤(2)-(6)中,对于每一层结构,可使用相同或不同的微囊来进行打印。在某些优选的实施方案中,根据预定的模式,使用一种或多种微囊来打印多层结构。在某些优选的实施方案中,在本发明方法的步骤(2)-(6)中,连续地生物打印多个区段,以获得具有预定模式的、包含多个区段的生物构建体或人工组织前体。在某些优选的实施方案中,在本发明方法的步骤(2)-(6)中,对于每一个区段,可使用相同或不同的微囊来进行打印。在某些优选的实施方案中,根据预定的模式,使用一种或多种微囊来打印多个区段。
在某些优选的实施方案中,本发明的人工组织前体,用于组织移植(例如管腔移植,例如血管移植)。在某些优选的实施方案中,在实施本发明的方法之前,获得组织或组织损伤位点的细胞分布信息。在某些优选的实施方案中,本发明的方法还包括,获得组织或组织损伤位点的细胞分布信息,然后根据所述细胞分布信息制备人工组织前体。在某些优选的实施方案中,本发明方法所使用的微囊中的细胞来源于受试者。在某些优选的实施方案中,本发明方法所使用的微囊中的细胞来源于与所述受试者具有相似或相同特征(例如,物种,年龄,性别,遗传信息等)的其他受试者。在某些优选的实施方案中,本发明方法所使用的微囊中的细胞来源于同种异体。在某些优选的实施方案中,本发明方法所使用的微囊中的细胞来源于细胞系。在某些优选的实施方案中,本发明的制备人工组织前体的方法在体外进行。
在本发明的某些实施方案中(例如方法1-3或方法5的某些实施方案中),包括将生物构建体与固体支持物固定在一起。
在某些优选的实施方案中,将生物构建体与固体支持物通过化学方式贴合。
在某些优选的实施方案中,将生物构建体与固体支持物通过粘合剂粘合。
在某些优选的实施方案中,所述粘合剂为α-氰基丙烯酸酯(例如α-氰基丙烯酸甲酯,α-氰基丙烯酸乙酯,α-氰基丙烯酸异丁酯,α-氰基丙烯酸异己酯,α-氰基丙烯酸辛酯)。
在另一个方面,本申请还涉及一种生物构建体,其通过方法1、2或3中任一项定义的制备的生物构建体的方法制得。
在另一个方面,本申请还涉及一种用于制备人工组织前体的试剂盒,所述试剂盒包含微囊,以及彼此分离的第一试剂和第二试剂,其中,所述微囊包含细胞和包裹细胞的生物相容性材料,所述第一试剂含有第一组分,所述第二试剂含有第二组分,并且当所述第一组分与第二组分接触时,能够产生粘连效果,实现粘合作用。
在某些优选的实施方案中,所述第一组分与第二组分在接触时能够发生强烈相互作用(例如,能够发生化学反应),并产生粘连效果,实现粘合作用。此类粘合作用不仅能够实现细胞与细胞之间、细胞与组织之间、组织与组织之间的粘合,而且能够实现细胞/组织与外部物质之间的粘合。特别优选地,此类粘合作用具备至少一种选自以下的性质:(1)其是安全、可靠、无毒性、不致癌、不致畸、不致突变的;(2)其具有良好的生物相容性,不妨碍机体组织的自身愈合;(3)其能够在有血液和组织液的条件下使用;(4)其能够在常温、常压下实现快速粘合;(5)其具有良好的粘合强度及持久性,粘合部分具有一定的弹性和韧性;(6)其在使用过程中对机体组织无刺激性;(7)在达到粘合效果后,相关的组分能够逐渐被降解和吸收;和,(8)粘合部位能够被细胞迁移通过。
在某些优选实施方案中,所述第一组分与第二组分接触而产生的粘连效果可用于将两个微囊粘合在一起,形成构建体;并且由此所获得的构建体的拉伸模量不低于10pa,例如不低于20pa,不低于30pa,不低于40pa,不低于50pa,不低于60pa,不低于70pa,不低于80pa,不低于90pa,不低于100pa,不低于200pa,不低于300pa,不低于400pa,不低于500pa,不低于600pa,不低于700pa,不低于800pa,不低于900pa,不低于1000pa。在某些优选实施方案中,所获得的构建体的拉伸模量可达到1kpa-10mpa,例如1-5kpa,5-10kpa,10-50kpa,50-100kpa,100-500kpa,500-1000kpa,1-5mpa,或5-10mpa。在某些优选实施方案中,微囊中的细胞能够迁移通过粘合部位,进入邻近的微囊中或者更远端的微囊中。由此,微囊中的细胞能够在整个构建体内的生长、迁移、分化和增殖。
在某些优选的实施方案中,所述第一组分和第二组分是选自下列的组合:
(1)纤维蛋白原和凝血酶;
(2)海藻酸盐(例如海藻酸钠)或氧化的海藻酸盐(例如氧化的海藻酸钠)和含有ca2+、mg2+、ba2+、sr2+、或fe3+的物质(例如含有ca2+、mg2+、ba2+、sr2+、或fe3+的溶液或半固体(例如凝胶));
(3)含马来酰亚胺基团的分子(例如含有马来酰亚胺基团的聚乙二醇(mal-peg))和含自由巯基的分子(例如含有自由巯基的聚乙二醇(peg-sh));
(4)含有阴离子的物质(例如含有阴离子的溶液或半固体(例如凝胶))和α-氰基丙烯酸酯(例如α-氰基丙烯酸甲酯,α-氰基丙烯酸乙酯,α-氰基丙烯酸异丁酯,α-氰基丙烯酸异己酯,α-氰基丙烯酸正辛酯);
(5)纤维蛋白原和α-氰基丙烯酸酯(例如α-氰基丙烯酸甲酯,α-氰基丙烯酸乙酯,α-氰基丙烯酸异丁酯,α-氰基丙烯酸异己酯,α-氰基丙烯酸正辛酯);
(6)血清白蛋白(例如,牛血清白蛋白)和戊二醛;
(7)含氨基甲酸酯基团(-nhcoo-)或异氰酸酯基团(-nco)的分子(例如含氨基甲酸酯基团的聚乙二醇或含异氰酸酯基团的聚乙二醇)和含活泼氢的分子(例如含羧基的聚乙二醇);
(8)明胶-间苯二酚和戊二醛;
(9)碳化二亚胺交联明胶和聚l-谷氨酸(plga);和
(10)胺基化明胶和醛基化多糖。
应当特别指出的是,只要所述第一组分与第二组分接触时,能够产生粘连效果,实现粘合作用,即可用于实施本发明的实施方案。本发明的第一组分与第二组分并不局限于上述特定的组合。此外,当将某一组合用作第一组分和第二组分时,第一组分可以是该组合的任一成员,且第二组分是该组合的另一成员。例如,当使用纤维蛋白原和凝血酶这个组合时,第一组分可以是纤维蛋白原(此时第二组分为凝血酶),或者可以是凝血酶(此时第二组分为纤维蛋白原)。
在某些优选的实施方案中,所述第一组分为纤维蛋白原,且第二组分为凝血酶。在某些优选的实施方案中,所述第一组分为海藻酸盐(例如海藻酸钠)或氧化的海藻酸盐(例如氧化的海藻酸钠),且第二组分为含有ca2+、mg2+、ba2+、sr2+、或fe3+的物质,例如含有ca2+、mg2+、ba2+、sr2+、或fe3+的溶液或半固体(例如凝胶)。在某些优选的实施方案中,所述第一组分为含马来酰亚胺基团的分子(例如含有马来酰亚胺基团的聚乙二醇(mal-peg)),且第二组分为含自由巯基的分子(例如含有自由巯基的聚乙二醇(peg-sh))。在某些优选的实施方案中,所述第一组分为含有阴离子的物质,例如含有阴离子的溶液或半固体(例如凝胶),且第二组分为α-氰基丙烯酸酯(例如α-氰基丙烯酸甲酯,α-氰基丙烯酸乙酯,α-氰基丙烯酸异丁酯,α-氰基丙烯酸异己酯,α-氰基丙烯酸正辛酯)。在某些优选的实施方案中,所述第一组分为纤维蛋白原,且第二组分为α-氰基丙烯酸酯(例如α-氰基丙烯酸甲酯,α-氰基丙烯酸乙酯,α-氰基丙烯酸异丁酯,α-氰基丙烯酸异己酯,α-氰基丙烯酸正辛酯)。在某些优选的实施方案中,所述第一组分为血清白蛋白(例如,牛血清白蛋白),且第二组分为戊二醛。在某些优选的实施方案中,所述第一组分为含氨基甲酸酯基团(-nhcoo-)或异氰酸酯基团(-nco)的分子(例如含氨基甲酸酯基团的聚乙二醇或含异氰酸酯基团的聚乙二醇),且第二组分为含活泼氢的分子(例如含羧基的聚乙二醇)。在某些优选的实施方案中,所述第一组分为明胶-间苯二酚,且第二组分为戊二醛。在某些优选的实施方案中,所述第一组分为碳化二亚胺交联明胶,且第二组分为聚l-谷氨酸(plga)。在某些优选的实施方案中,所述第一组分为胺基化明胶,且第二组分为醛基化多糖。
在某些优选的实施方案中,在所述第一试剂中,第一组分的浓度为0.01-50wt%。例如,在某些优选的实施方案中,所述第一组分的浓度为0.01-0.05wt%,0.05-0.1wt%,0.1-0.5wt%,0.5-1wt%,1-5wt%,5-10wt%,10-15wt%,15-20wt%,20-25wt%,25-30wt%,30-35wt%,35-40wt%,40-45wt%,或者45-50wt%。
在某些优选的实施方案中,在所述第二试剂中,第二组分的浓度为0.01-50wt%。例如,在某些优选的实施方案中,所述第二组分的浓度为0.01-0.05wt%,0.05-0.1wt%,0.1-0.5wt%,0.5-1wt%,1-5wt%,5-10wt%,10-15wt%,15-20wt%,20-25wt%,25-30wt%,30-35wt%,35-40wt%,40-45wt%,或者45-50wt%。
在某些优选的实施方案中,所述第二试剂还含有第三组分,所述第三组分为粘性剂。可通过调整第三组分(粘性剂)的含量来方便地调整第二试剂的粘度,以便第二试剂能够维持特定的形状,从而适合用于绘制图案或进行涂布。在某些优选的实施方案中,所述第三组分为生物相容性材料。在某些优选的实施方案中,所述第三组分为来源于生物的材料。在某些优选的实施方案中,所述第三组分为生物可降解材料。在某些优选的实施方案中,所述第三组分为温敏性材料。在某些优选的实施方案中,所述温敏性材料在不同的温度下具有不同的形态。例如,所述温敏性材料(例如明胶)在较低的温度下呈固态或半固态,而在较高的温度下呈液态。在某些优选的实施方案中,所述温敏性材料的相变温度在5-40℃之间,例如5-10℃,10-15℃,15-20℃,20-25℃,25-30℃,30-35℃,35-40℃。在某些优选的实施方案中,所述温敏性材料选自明胶,聚n-异丙基丙烯酰胺-聚乙二醇嵌段共聚物,聚乙二醇共聚物(例如聚乙烯醇-聚乙二醇共聚物),琼脂糖,matrigel,壳聚糖/甘油磷酸钠体系,pluronicf127,和聚n-异丙基丙烯酰胺(pnipaam)水凝胶。在某些优选的实施方案中,所述第三组分(粘性剂)选自明胶、嵌段聚合物f-127、琼脂糖、聚乙二醇、瓜尔胶、聚乙烯醇、壳聚糖、胶原、透明质酸、甲壳素、纤维素及其衍生物(例如羟丙基纤维素)、聚氨基酸、聚n-异丙基丙烯酰胺-聚乙二醇嵌段共聚物、聚乙二醇共聚物(例如聚乙烯醇-聚乙二醇共聚物)、海藻酸盐(例如海藻酸钠)、改性的海藻酸盐(例如氧化的海藻酸盐,例如氧化的海藻酸钠)、matrigel、壳聚糖/甘油磷酸钠体系、和聚n-异丙基丙烯酰胺(pnipaam)水凝胶。在某些优选的实施方案中,所述第三组分(粘性剂)为明胶。
在某些优选的实施方案中,在所述第二试剂中,第三组分的浓度为0.01-50wt%。例如,在某些优选的实施方案中,所述第三组分的浓度为0.01-0.05wt%,0.05-0.1wt%,0.1-0.5wt%,0.5-1wt%,1-5wt%,5-10wt%,10-15wt%,15-20wt%,20-25wt%,25-30wt%,30-35wt%,35-40wt%,40-45wt%,或者45-50wt%。
在某些优选的实施方案中,所述试剂盒中包含的微囊为上述任一项定义的微囊。
在另一个方面,本发明提供了一种用于制备管状生物构建体的套盒(package),其包含一个或多个如上所定义的试剂盒。在某些优选的实施方案中,不同的试剂盒使用相同的第一试剂和第二试剂的组合。在某些优选的实施方案中,不同的试剂盒使用不同的第一试剂和第二试剂的组合。
在某些优选的实施方案中,本发明的人工组织前体可进行进一步的培养。因此,本申请还涉及一种人工组织,所述人工组织通过对本发明的人工组织前体进行培养(例如体外培养或体内培养)得到。
在某些优选的实施方案中,所述人工组织为人工管腔。
在某些优选的实施方案中,所述管腔为包含上皮细胞的管腔(例如血管,食管,气管,胃,胆管,肠道(包括小肠和大肠,例如十二指肠、空肠、回肠、盲肠(包括阑尾)、升结肠、结肠右曲、横结肠、结肠左曲、降结肠、乙状结肠、直肠),输卵管,输精管,输尿管,膀胱或淋巴管)。
在某些优选的实施方案中,所述人工管腔为管状人工管腔或片状人工管腔。
在某些优选的实施方案中,所述人工管腔为人工血管或血管补片。
在某些优选的实施方案中,在允许微囊内的细胞增殖、分化、迁移、分泌和/或新陈代谢的条件下,培养所述人工组织前体。培养条件取决于微囊内的细胞类型,所使用的微囊的类型,人工组织前体的结构和形状,培养的目的等等。本领域技术人员能够选择合适的培养条件,例如培养基,ph,温度,co2水平和持续时间。一般的组织和细胞培养条件可参见例如,doyle,alan,andj.bryangriffiths,eds.cellandtissueculture:laboratoryproceduresinbiotechnology.newyork:wiley,1998。在某些优选的实施方案中,培养人工组织前体至少0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、25、或30天。在某些优选的实施方案中,培养人工组织前体1-3、3-5、5-7、7-10、10-14、14-21、21-28、1-7、7-14、1-14、或14-28天。在某些优选的实施方案中,在3d培养箱中培养所获得的人工组织前体。在某些优选的实施方案中,在生物反应器中培养所获得的人工组织前体。在某些优选的实施方案中,在37℃,5%co2的条件下培养所获得的人工组织前体。在某些优选的实施方案中,在培养过程中对人工组织前体施加物理刺激(例如压力,剪切力,光照,加热等)。在某些优选的实施方案中,在培养过程中对人工组织前体施加化学刺激(例如激素,细胞因子,化学试剂等)。
在某些优选的实施方案中,在培养过程中,微囊中的生物可降解材料至少一部分被降解。在某些优选的实施方案中,此类生物可降解材料的降解产物为微囊中的细胞提供了营养物质和/或细胞外基质。在某些优选的实施方案中,微囊中的生物可降解材料被降解至少10%、20%、30%、40%、50%、60%、70%、80%、或90%。
在某些优选的实施方案中,人工组织前体中的细胞在培养过程中分泌分泌物,并且这些分泌物整合入人工组织前体中。在某些优选的实施方案中,微囊内的细胞在培养过程中彼此连接。在某些优选的实施方案中,微囊之间的细胞在培养过程中彼此连接。在某些优选的实施方案中,所述生物构建体在培养后具有高细胞密度(例如至少100、200、500、1000、2000、5000、10000、20000、50000、或100000细胞/mm3)。在某些优选的实施方案中,微囊内的细胞在培养后增殖至少2、5、10、20、50、100、200、500、1000、2000、5000、10000、20000、50000、或100000倍。
在某些优选的实施方案中,将所述人工组织前体植入非人受试者体内,并在所述非人受试者体内进行培养。
在某些优选的实施方案中,所述非人受试者为哺乳动物,例如牛科动物、马科动物、羊科动物、猪科动物、犬科动物、猫科动物、啮齿类动物、灵长类动物。
在又一方面,本发明提供了一种管腔植入体,所述管腔植入体包含本发明的人工组织前体(例如管状人工组织前体或片状人工组织前体)或人工管腔。
在某些优选的实施方案中,所述管腔植入体包含一个或多个(例如2个、3个、4个或5个)本发明的人工组织前体(例如管状人工组织前体或片状人工组织前体),或一个或多个(例如2个、3个、4个或5个)本发明的人工管腔(例如管状人工管腔或片状人工管腔)。
在某些优选的实施方案中,所述管腔植入体包含多个(例如2个、3个、4个或5个)本发明的管状人工组织前体,多个所述管状人工组织前体之间流体连通。
在某些优选的实施方案中,所述管腔植入体包含多个(例如2个、3个、4个或5个)本发明的管状人工管腔,多个所述管状人工管腔之间流体连通。
在某些优选的实施方案中,所述管腔植入体为线性的管状结构,或者为枝化的管状结构。
在某些优选的实施方案中,所述管腔植入体为x形管状、y形管状或t形管状。
在某些优选的实施方案中,所述管腔为包含上皮细胞的管腔(例如血管,食管,气管,胃,胆管,肠道(包括小肠和大肠,例如十二指肠、空肠、回肠、盲肠(包括阑尾)、升结肠、结肠右曲、横结肠、结肠左曲、降结肠、乙状结肠、直肠),输卵管,输精管,输尿管,膀胱或淋巴管)。
在某些优选的实施方案中,所述包含上皮细胞的管腔为血管。
在某些优选的实施方案中,所述管腔植入体为血管植入体,其包含本发明的人工血管或血管补片。
在某些优选的实施方案中,所述管腔植入体还包含药物活性成分,例如用于防止血栓、钙化、感染和/或排异反应的药物活性成分。
在某些优选的实施方案中,所述管腔植入体还包含感应装置,所述感应装置用于检测管腔内的流体参数。
在某些优选的实施方案中,所述管腔植入体还包含调节装置,所述调节装置用于调节管腔内的流体参数。
在某些优选的实施方案中,所述管腔植入体被植入受试者的体内。
在某些优选的实施方案中,所述受试者患有以下疾病中的一种或多种:心血管疾病、脑血管疾病、周围血管疾病、骨科疾病、泌尿系统疾病或肿瘤疾病;
在某些优选的实施方案中,所述受试者具有以下疾病中的一种或多种:冠心病、脑缺血性卒中、血管瘤、恶性肿瘤侵犯血管、血栓闭塞性脉管炎、血液运输受阻引起的骨科疾病、慢性肾功能衰竭;
在某些优选的实施方案中,所述受试者为哺乳动物,例如牛科动物、马科动物、羊科动物、猪科动物、犬科动物、猫科动物、啮齿类动物、灵长类动物;其中,特别优选的受试者为人。
本发明的管腔植入体,例如血管植入体,可用于替换受试者的狭窄、闭塞、扩张、损伤或畸形的管腔(例如血管),或用于构建管腔旁路,从功能上取代狭窄、闭塞、扩张、损伤或畸形的管腔。在受试者自体的管腔供给不足的情况下,本发明的管腔植入体可被用做管腔替代品。例如本发明的血管植入体可用于冠状动脉旁路移植术(cabg),施用于患有冠心病的受试者,或用于动静脉造瘘术,施用于患有慢性肾功能衰竭的受试者。
在又一方面,本申请提供了一种替换或修补受试者的管腔(例如血管)的方法,包括将本发明的管腔植入体植入受试者体内。
在某些优选的实施方案中,所述方法被用于治疗目的。例如,用本发明的管腔植入体替代受试者的狭窄、闭塞、扩张、损伤或畸形的管腔。
在某些优选的实施方案中,所述方法被用于非治疗目的。例如,用本发明的管腔植入体替换非人受试者的正常管腔,以用于医学研究。
在某些优选的实施方案中,所述受试者为哺乳动物,例如牛科动物、马科动物、羊科动物、猪科动物、犬科动物、猫科动物、啮齿类动物、灵长类动物;例如,所述受试者为人。
在又一方面,本发明提供了一种管腔模型,所述管腔模型包含本发明的人工管腔。
在某些优选的实施方案中,所述管腔模型包含一个或多个(例如2个、3个、4个或5个)本发明的人工管腔(例如管状人工管腔,例如人工血管)。
在某些优选的实施方案中,,所述管腔模型包含多个(例如2个、3个、4个或5个)本发明的管状人工管腔,多个所述管状人工管腔之间流体连通。
在某些优选的实施方案中,所述管腔模型为线性的管状结构,或者为枝化的管状结构。
在某些优选的实施方案中,所述管腔模型为x形管状、y形管状或t形管状。
在某些优选的实施方案中,所述管腔模型还包含感应装置,所述感应装置用于检测管腔内的流体参数。
在某些优选的实施方案中,所述管腔模型还包含调节装置,所述调节装置用于调节管腔内的流体参数。
在某些优选的实施方案中,所述管腔模型用于医学教学演示、药物(例如用于预防和/或治疗血管疾病的药物,例如药物的有效成分)的筛选、生物研究或医学研究(例如血管流体力学的研究)。
图5b示例性地显示了本发明的管腔植入体或管腔模型的形状。可已通过对线性的管状人工组织前体(或管状人工管腔)进行连接(例如粘接或缝合),得到枝化的管状人工组织前体(或管状人工管腔),进而得到枝化的管腔植入体或管腔模型。
在又一方面,本发明提供了本发明的人工组织前体用于制备人工组织、管腔植入体或管腔模型的用途。
在某些优选的实施方案中,所述人工组织为如上任一项所述的人工组织(例如人工管腔)。
在某些优选的实施方案中,所述管腔植入体为如上任一项所述的管腔植入体。
在某些优选的实施方案中,所述管腔模型为如上任一项所述的管腔模型。
在又一方面,本发明提供了本发明的人工组织用于制备管腔植入体或管腔模型的用途。
在某些优选的实施方案中,所述管腔植入体为如上任一项所述的管腔植入体。
在某些优选的实施方案中,所述管腔模型为如上任一项所述的管腔模型。
发明的有益效果
与现有技术相比,本发明的技术方案具有以下有益效果中的一个或多个:
1、本发明的人工组织前体中,微囊中的细胞数量总体上是一致的,微囊为细胞的分化和/或生长提供了合适的微环境,有利于细胞保持干性,维持其分化能力,构建出的组织内细胞分布比较均匀,有利于形成结构和功能完整的组织。
2、本发明的人工组织前体,能够形成稳固的结构,使包裹在其中的细胞能够停留在特定的位置。微囊可以为细胞提供力学保护,使其在制备人工组织前体过程中,以及在植入体内后,能够经受管腔内体液的冲击过程,而不易受到损伤或造成脱落。
3、本发明的人工组织中,细胞分布均匀,人工组织容易形成完整的结构和功能。
4、在某些优选的实施方案中,使用脂肪间充质干细胞制备人工组织前体。脂肪间充质干细胞容易获取,细胞安全性高,自从脂肪间充质干细胞用于体内外研究后,还未见关于脂肪间充质干细胞成瘤性的报道。
5、本发明的人工组织前体可以根据病人的需求进行个性化定制,实现个性化制备。
6、本发明的人工组织前体中,固体支持物与微囊或由微囊构成的生物构建体紧密贴合,不发生相对移动。
具体实施方式
现参照下列意在举例说明本发明(而非限定本发明)的实施例来描述本发明。
实施例中未指明其来源的试剂、试剂盒或仪器均为市场上商购可得的常规产品。本领域技术人员知晓,实施例以举例方式描述本发明,且不意欲限制本发明所要求保护的范围。
实施例1包含恒河猴脂肪间充质干细胞的生物砖的制备
1、脂肪间充质干细胞的收集和培养
(1)收集脂肪间充质干细胞:以恒河猴为动物模型,从腹股沟处剪取脂肪组织置于50ml离心管中;使用胰酶对脂肪组织进行消化,离心收集脂肪间充质干细胞。
(2)使用无血清lonza培养基对脂肪间充质干细胞进行扩增培养。原代培养第四代的细胞的显微照片如图6所示。从图中可见,细胞形态均一,生长状态良好。离心收集细胞。
2、胶原溶液的配制
使用牛i型胶原进行配制。
(1)高温灭菌处理100ml烧杯和搅拌磁子;
(2)将溶液容器外表面消毒后,放入生物安全柜内;
(3)取co60辐照灭菌处理的胶原固体0.5g置于烧杯中,加入25ml无菌去离子水(经0.22μm滤器过滤处理);
(4)使用磁力搅拌器搅拌,使胶原固体浸入水中;
(5)滴加醋酸溶液(经0.22μm滤器过滤处理)至ph=3;
(6)搅拌溶液直至胶原固体完全溶解;4℃保存。
注:如原料为胶原固体,可以按照如上操作;如原料为胶原溶液,可以直接使用或稀释后使用。
根据实际使用的浓度,可以使用超纯水(经0.22μm滤器过滤处理)对胶原溶液进行稀释。
3、含有脂肪间充质干细胞的生物砖的制备
(1)制备u型底超疏水孔板:在超净室内将u型底孔板用酒精清洗干净后,将u型底孔板置入过氧化氢/浓硫酸溶液(30%(v/v),h2o2:h2so4=1:3)中,80℃反应1小时,以进行羟基化处理。将羟基化的u型底孔板放入浓度为1%的1h,1h,2h,2h-全氟癸基三乙氧基硅烷(购自sigma)溶液中12小时,再在100℃烘箱中加热4h,以进行硅化处理。最后,清洗u型底孔板并风干。
(2)制备含种子细胞的胶原溶液:将45μlnaoh溶液(4mol/l)与1mli型胶原(4mg/ml)混合,配制成ph=7的胶原溶液。使用该溶液与恒河猴脂肪间充质干细胞混合形成细胞悬液(细胞总浓度为2×107/ml)。
(3)制备聚赖氨酸溶液:将聚赖氨酸(购自sigma,数均分子量(mn)为150,000-300,000)溶于ph7.2的dmem高糖培养基,得到浓度为1wt%的聚赖氨酸溶液。
(4)胶原滴加(形成核层结构):采用能够吸取和排出纳升级液体的电子式吸取装置精密吸取0.1μl含种子细胞的胶原溶液,滴入步骤1制备的u型底超疏水孔板中,形成液滴,在37℃恒温保持30min,使其成型。
可选的电子式吸取装置为eppendorfxplorer0.5-10ul或transferpetteelectronic0.5-10ul,借助他们的分液功能,每分液量最低可达到0.1μl;或者采用sge自动进样器1μl或0.5μl,可分别实现10次和5次的0.1μl液体滴定;特殊地,可选用锥形特制针头进行滴定,提高精确度。
(5)滴加聚赖氨酸溶液(形成壳层结构):更换吸头后,精密吸取0.5μl步骤(3)制备的聚赖氨酸溶液,在超疏水孔板中央位置将其滴入步骤(4)中成型的核层表面,反应10min,以形成包含恒河猴脂肪间充质干细胞的生物砖,其形态如图7所示。图8为激光共聚焦显微镜拍摄的生物砖照片,其中绿色荧光为生物砖的壳,红色荧光为脂肪间充质干细胞。
实施例2使用3d生物打印机制备生物砖-膨体聚四氟乙烯人工血管前体,以及人工血管前体的体内应用和评价
1、制备过程:
(1)配制纤维蛋白原溶液(5wt%),用作第一试剂:称取纤维蛋白原0.1g,将其溶解于2ml生理盐水中(如果需要,可以在37℃水浴中充分溶解);随后,将纤维蛋白原溶液通过0.22μm滤器,进行过滤灭菌;将经过滤的纤维蛋白原溶液保存,备用。
(2)配制凝血酶溶液(2000u/ml),用作第二试剂:称取0.0011gcacl2,加入2000u凝血酶中(ca2+浓度为10mmol/ml),然后加入1ml生理盐水充分溶解;随后,将凝血酶溶液通过0.22μm滤器,进行过滤灭菌;保存,备用。
(3)将实施例1制得的含有恒河猴脂肪间充质干细胞的生物砖浸泡于5%的纤维蛋白原溶液(用作第一试剂)中5分钟,以在其表面附着/组装纤维蛋白原分子(如果需要,可以进行温和摇晃,以便于组装)。加入h-dmem培养基继续浸泡5分钟,以洗去其表面未组装的纤维蛋白原分子,从而得到经浸渍的生物砖。
(4)使用蓝光英诺血管生物打印机,在4℃条件下,在旋转杆上打印一层明胶,明胶的厚度为1mm,待明胶凝固后,将凝血酶溶液(用作第二试剂)喷涂于明胶表面。
(5)将生物砖打印在明胶表面,在凝血酶的作用下,生物砖表面的纤维蛋白原相互交联,使生物砖连接成一体,形成侧壁无开口的圆形管状生物构建体,其长度为20mm,直径为6mm,壁厚为1mm。
(6)加热旋转杆至37℃,然后从旋转杆上取下管状构建体。
(7)管状生物构建体的外壁喷涂一层医用胶(白云医用胶医用ec型)。将膨体聚四氟乙烯管状固体支持物套在管状生物构建体的外侧,通过医用胶将生物构建体的外壁与膨体聚四氟乙烯管状固体支持物的内壁进行粘合,得到人工血管前体,其形态如图9所示。
2、体内植入
步骤(1)对恒河猴进行开腹,暴露腹主动脉。
步骤(2)切断腹主动脉,将两个断端分别与得到的人工血管前体进行缝合。
步骤(3)对动物腹部的伤口进行缝合。
3、取材及病理检测
术后5天将人工血管取出。图10a显示了人工血管的形态,图10b为去除管状支持物得到的血管组织,图10c为将组织纵向剖开后的形态。对组织进行he染色及免疫组化染色,并与正常血管进行对比,结果如图11-13所示。
图11为he染色结果,图11a为正常血管,图11b为人工血管。如图所示,人工血管与正常血管有相似的细胞排列、内皮细胞层(细箭头所指)和平滑肌细胞层(粗箭头所指)。
图12为α-sma染色结果,α-sma阳性细胞为平滑肌细胞。图12a为正常血管,图12b为人工血管。如图所示,构成人工血管的脂肪间充质干细胞向平滑肌细胞分化,并出现与正常血管相似的细胞形态、排列及方向性。
图13为cd31染色结果,cd31阳性细胞为内皮细胞。图13a为正常血管,图13b为人工血管。如图所示,在与血液接触面,构成人工血管的脂肪间充质干细胞向内皮细胞分化,并出现与正常血管相似的细胞形态及排列。
实施例3使用3d生物打印机制备生物砖-聚己内酯人工血管前体,以及人工血管前体的体内应用和评价
1、聚己内酯管状固体支持物的制备
步骤(1)称取一定量聚己内酯溶于四氢呋喃中,配制成浓度为2wt%的制备溶液。
步骤(2)将人工血管模具浸入制备溶液中,缓慢取出,待溶剂挥发后重复操作,直至得到管壁厚度为0.5mm的聚己内酯管状固体支持物。
步骤(3)将聚己内酯管状固体支持物从模具上取下,放入超纯水清洗。
步骤(4)将聚己内酯管状固体支持物干燥并剪切成所需长度,进行环氧乙烷灭菌后备用。
2、使用3d打印机制备生物砖-聚己内酯人工血管前体
使用实施例1制得的含有恒河猴脂肪间充质干细胞的生物砖和聚己内酯管状固体支持物,按照实施例2的步骤,使用3d打印机制备侧壁无开口的圆形管状生物构建体,并使用医用胶(白云医用胶医用ec型),将聚己内酯管状固体支持物套在管状生物构建体的外侧)将生物构建体的外壁与聚己内酯管状固体支持物的内壁进行粘合,得到人工血管前体。
3、人工血管前体的体内应用和评价
将实施例3制得的人工血管前体植入恒河猴体内,术后6天对所形成的人工血管的形态和血流方向进行检测,结果如图14所示。
图14a为超声检测结果,从图中可以看出,人工血管的管腔通畅。
图14b为彩色多普勒检测结果,结果显示,人工血管两侧血流方向一致,证明血管通畅。
术后20天将人工血管取出,使用免疫组化法对人工血管进行检测,结果如图15a和15b所示(图中的标尺均为200μm)。
图15a显示了α-sma染色结果,如图中粗箭头所指,人工血管中,脂肪间充质干细胞向平滑肌细胞进行分化。图15b显示了cd31染色结果,如图中细箭头所指,人工血管血管中,脂肪间充质干细胞向内皮细胞进行分化。
图15c为天狼星红染色结果,如图所示,人工血管形成与正常血管相似的胶原结构。
实施例4手工构建生物砖-膨体聚四氟乙烯人工血管前体,以及人工血管前体的体内应用和评价
1、制备过程
(1)将实施例1的生物砖浸泡于5%的纤维蛋白原溶液中5分钟,随后去除纤维蛋白原溶液,加入h-dmem培养基继续浸泡5分钟。
(2)截取长度为1cm的膨体聚四氟乙烯人工血管(戈尔人工血管,型号:s0604,流水号:3425),作为管状固体支持物,吸取8μl医用胶(白云医用胶医用ec型),均匀涂抹于膨体聚四氟乙烯人工血管的内壁。
(3)将生物砖逐一贴附于膨体聚四氟乙烯人工血管内壁,在医用胶的作用下,生物砖与膨体聚四氟乙烯人工血管牢固粘合在一起,形人工血管前体。
2、体内应用和评价
将人工血管前体植入恒河猴体内14天后取材,使用免疫组化染色进行检测,结果如图16a和16b所示(图中的标尺均为50μm)。
图16a为α-sma染色结果,如图中粗箭头所指,人工血管中有脂肪间充质干细胞向平滑肌细胞进行分化。
图16b为cd31染色结果,如图中细箭头所指,人工血管中有脂肪间充质干细胞向内皮细胞进行分化。
实施例5包含恒河猴脂肪间充质干细胞的微囊的制备
(1)制备u型底超疏水孔板:在超净室内将u型底孔板用酒精清洗干净后,将u型底孔板置入过氧化氢/浓硫酸溶液(30%(v/v),h2o2:h2so4=1:3)中,80℃反应1小时,以进行羟基化处理。将羟基化的u型底孔板放入浓度为1%的1h,1h,2h,2h-全氟癸基三乙氧基硅烷(购自sigma)溶液中12小时,再在100℃烘箱中加热4h,以进行硅化处理。最后,清洗u型底孔板并风干。
(2)制备含种子细胞的胶原溶液:将45μlnaoh溶液(4mol/l)与1mli型胶原(4mg/ml)混合,配制成ph=7的胶原溶液。使用该溶液与实施例1中收集的恒河猴脂肪间充质干细胞混合形成细胞悬液(细胞总浓度为2×107/ml)。
(3)胶原滴加(形成核层结构):采用能够吸取和排出纳升级液体的电子式吸取装置精密吸取0.1μl含种子细胞的胶原溶液,滴入步骤1制备的u型底超疏水孔板中,形成液滴,在37℃恒温保持30min,使其成型,得到含有恒河猴脂肪间充质干细胞的微囊。
实施例6手工构建微囊-膨体聚四氟乙烯人工组织前体,以及人工血管前体的体内应用和评价
1、制备过程
(1)将实施例5的微囊浸泡于5%的纤维蛋白原溶液中5分钟,随后去除纤维蛋白原溶液,加入h-dmem培养基继续浸泡5分钟。
(2)截取长度1cm的膨体聚四氟乙烯人工血管(戈尔人工血管,型号:s0604,流水号:3425),吸取8μl医用胶(白云医用胶医用ec型),均匀涂抹于膨体聚四氟乙烯人工血管的内壁。
(3)将微囊逐一贴附于膨体聚四氟乙烯人工血管内壁,在医用胶的作用下,微囊与膨体聚四氟乙烯人工血管牢固粘合在一起,形人工血管前体。
2、体内应用和评价
将人工血管前体植入恒河猴体内14天后取材,图17a为得到的人工血管的剖面图。使用免疫组化法进行检测,结果如图17b和17c所示(图中的标尺均为50μm)。
图17b为α-sma染色结果,如图中粗箭头所指,人工血管中有脂肪间充质干细胞向平滑肌细胞进行分化。
图17c为cd31染色结果,如图中细箭头所指,人工血管中有脂肪间充质干细胞向内皮细胞进行分化。
实施例7使用3d生物打印机制备加强型生物砖-膨体聚四氟乙烯人工血管前体
(1)将实施例1的生物砖浸泡于5%的纤维蛋白原溶液中5分钟,随后去除纤维蛋白原溶液,加入h-dmem培养基继续浸泡5分钟。
(2)制备外径为4mm的旋转杆,将步骤(1)中制备好的生物砖逐一打印在旋转杆上,形成管状生物构建体。
(3)吸取8μl医用胶均匀涂抹在管状生物构建体的外壁;
(4)准备长度为1cm、内径为6mm的膨体聚四氟乙烯人工血管,吸取8μl医用胶均匀涂抹在人工血管的内壁。由左至右,将人工血管套在管状生物构建体上。涂抹于人工血管内壁的医用胶在阴离子作用下固化,使得人工血管与管状生物构建体粘合在一起,形成人工血管前体。
图18显示了上述制备过程。图18a:将生物砖打印在旋转杆上,形成管状生物构建体;图18b和18c:将人工血管由左至右,套在管状生物构建体上;图18d:将人工血管与管状生物构建体粘合在一起,形成人工血管前体。
实施例8手工构建生物砖-聚乳酸人工血管前体
使用可降解的聚乳酸管状支持物,以及实施例1制得的生物砖,制备人工血管前体。图19描述了制备的过程。
图19a和19b显示了以聚乳酸为基本材料,采用电纺丝的方法制造出的管状固体支持物。
图19c显示了以下操作:将聚乳酸管状支持物剪开,然后在管状支持物的一面滴加医用胶,另一面对应位置放置生物砖。
图19d显示了,医用胶可以渗透通过管壁,使得生物砖与内壁相粘合在一起,得到人工血管前体。
上述操作仅为了方便观察和拍照。在实际制备中,是在聚乳酸管状固体支持物的外壁滴加医用胶,使医用胶渗透至内壁。由于医用胶可以渗透过电纺聚乳酸管壁,从而将生物砖固定。上述结果一方面说明,聚乳酸可以作为固体支持物使用,另一方面说明,电纺得到的固体支持物,由于其孔结构具有渗透性,医用胶可以渗透通过管壁,可以在固体支持物的一面滴加医用胶,在另一面放置生物砖,从而固定生物砖,得到人工组织前体。
实施例9.利用生物砖、纤维蛋白原和凝血酶来制备管状生物构建体
1、含有鼠骨髓间充质干细胞的生物砖的制备
制备生物砖,其包含鼠骨髓间充质干细胞,且其核层包含胶原,壳层包含海藻酸钠;并且其制备方法如中国申请201610211570.4中所述。
实验材料:生物砖(根据中国专利申请201610211570.4中描述的方法制备)、纤维蛋白原(牛源)、凝血酶(牛源)、生理盐水(医用级)、cacl2、无菌水、和明胶(猪源);
2、管状生物构建体的制备
(1)配制纤维蛋白原溶液(5wt%):称取纤维蛋白原0.1g,将其溶解于2ml生理盐水中(如果需要,可以在37℃水浴中充分溶解);随后,将纤维蛋白原溶液通过0.22μm滤器,进行过滤灭菌;将经过滤的纤维蛋白原溶液(用作第一试剂)保存,备用。
(2)配制凝血酶溶液(2000u/ml):称取0.0011gcacl2,加入2000u凝血酶中(ca2+浓度为10mmol/ml),然后加入1ml生理盐水充分溶解;随后,将凝血酶溶液通过0.22μm滤器,进行过滤灭菌;保存,备用。
(3)配制明胶溶液(10wt%):称取1g明胶,加入10ml无菌水,于37℃水浴中充分溶解;随后,将明胶溶液通过0.22μm滤器,进行过滤灭菌;保存,备用。
(4)将1ml凝血酶溶液和1ml明胶溶液均匀混合,然后置于37℃水浴中备用,即第二试剂。
(5)将生物砖浸入第一试剂10min,以在其表面附着/组装纤维蛋白原分子(如果需要,可以进行温和摇晃,以便于组装)。然后将生物砖浸于细胞培养基5min,以洗去其表面未组装的纤维蛋白原分子,从而得到经浸渍的生物砖。
(6)利用纤维蛋白原和凝血酶的凝血反应来连接和组装生物砖,以形成预设的三维结构。构建步骤如下:
a.在0℃冰浴条件下,在玻璃平皿中用第二试剂绘制圆环图案(如果需要,可以在圆环外填充明胶溶液,作为构建管状结构的辅助材料);
b.将生物砖沿圆环图案放置并静置3s,形成由生物砖构成的圆环状结构(第一层);
c.在圆环状结构的上表面滴加第二试剂,绘制圆环图案;
d.将生物砖沿圆环图案放置并静置3s,形成由生物砖构成的圆环状结构(第二层);
e.根据需要,重复步骤c-d,形成不同层数的由生物砖构成的圆环状结构,即侧壁无开口的圆形管状结构(如果需要,可以将含有辅助材料的管状结构置于37℃环境中,并洗去辅助材料)。
图20展示了利用生物砖、纤维蛋白原和凝血酶来制备管状三维构建体的实验步骤和实验结果;其中,图20a显示的是,在生物砖表面附着/组装纤维蛋白原;图20b显示的是,用辅助材料构建环状辅助结构(任选的步骤);图20c显示的是,沿环状辅助结构滴加第二试剂,绘制圆环图案;图20d显示的是,将组装单元沿圆环图案放置形成环状结构;图20e显示的是,在环状结构的上表面用第二试剂绘制圆环图案,然后将组装单元沿圆环图案放置(任选地,可以重复该步骤一次或多次,以构建含有多层结构的构建体);图20f显示的是,构建得到的管状结构;图20g显示的是,去除辅助结构(任选的步骤)。
此外,参考gb/t228.1-2010,在电子拉力测试仪(model5967,instron)上测试所获得的生物构建体的拉伸模量,其中,载荷为10n,拉伸速度为20mm/min,温度为25℃,并且在测试过程中,保持样品润湿状态。测量结果显示,所获得的管状结构的拉伸模量为1.25kpa。
还使用olympusix83显微镜来观察刚刚制备获得的管状结构。观察结果示于图21a(bar,200μm)。结果显示,在刚刚制备获得的管状结构中,生物砖尚未发生相互融合,细胞在各自的生物砖中均匀分布。将该管状结构在dmem高糖培养基中培养3天,随后再次使用olympusix83显微镜进行观察。观察结果示于图21b(bar,200μm)。结果显示,在经培养的管状结构中,生物砖已完全相互融合,紧密连接在一起,形成了完整的生物构建体。这些结果表明,管状结构中的细胞能够正常生长,并且可以迁移通过生物砖之间的粘合部位,并最终实现生物砖的融合。
人工血管前体的体内应用和评价
实施例10-14中,以恒河猴为动物模型,将实施例2制得的包含生物砖和膨体聚四氟乙烯的人工血管前体植入恒河猴体内(即,用作血管植入体),并对植入后的情况进行评价。
实施例10-14中,将人工血管前体与恒河猴自体腹主动脉进行血管吻合的步骤均参照实施例2的步骤进行。
实施例10
将11只恒河猴分别编号为no.1-no.11,其中no.11为对照组。将人工血管前体与no.1-no.10恒河猴的自体腹主动脉进行血管吻合。
按照下表所示的植入后的时间,对各恒河猴体内的血管植入体进行取材和检测。
(1)使用he染色法对血管植入体的组织结构进行观察,图22显示了检测结果,图中的标尺均为200μm。结果显示:植入4小时后,生物砖之间仍存在缝隙,彼此独立不相连;植入8小时-24小时后,生物砖逐渐相互融合成一体;随着植入时间的增加,生物砖融合成的人工血管逐渐形成与正常血管相类似的组织学结构。
(2)使用免疫组化染色方法对cd31的表达进行检测,图23和图24显示了检测结果。图23为放大100倍的结果,图中的标尺均为200μm。图24为放大400倍的结果,图中的标尺均为50μm。结果显示:植入5天后,血管植入体与血液接触的腔面出现内皮细胞;随着植入时间的增加,内皮细胞不断增加,在28天时,形成与正常血管相似的较完整的内皮细胞层。
(3)使用免疫组化染色方法对α-sma的表达进行检测,图25显示了检测结果,图中的标尺均为200μm。结果显示:植入8小时后,生物砖内包裹的脂肪间充质干细胞开始向平滑肌细胞进行分化并表达α-sma;植入3天后,脂肪间充质干细胞的形态逐渐向平滑肌细胞转变且α-sma的表达进一步增加;随着植入时间的增加,平滑肌细胞量逐渐增加并形成与正常血管相似的平滑肌细胞层。
实施例11
将人工血管前体与恒河猴自体腹主动脉进行血管吻合。将恒河猴分为4组,分别在植入后的7天、14天、21天和28天,对血管植入体与恒河猴自体血管连接处进行取材。使用he染色法对连接处的组织结构进行观察,使用免疫组织化学染色法分别对cd31和α-sma的表达进行检测。另以不实施植入的恒河猴作为对照组,取正常血管进行检测。
图26显示了检测结果。第一行图片为he染色法的检测结果,图中的标尺为200μm;第二行图片为cd31的检测结果,图中的标尺为50μm;第三行图片为α-sma的检测结果,图中的标尺为200μm。图中的粗箭头表示自体血管,细箭头表示血管植入体。
结果显示:在植入7天时,血管植入体与恒河猴自体血管相互连接,但彼此组织结构有显著差别,内皮细胞层连续但不完整,平滑肌细胞层不连续;随着植入时间的增加,血管植入体与恒河猴自体血管不断相互融合;在植入28天时,血管植入体与恒河猴自体血管融合成一体,内皮细胞层及平滑肌细胞层连续完整,形成与正常血管相似的组织结构。
实施例12
将人工血管前体与恒河猴自体腹主动脉进行血管吻合。将恒河猴分为4组,分别在植入后的5天、7天、21天和28天,对血管植入体进行取材。使用天狼猩红染色法对血管胶原进行染色,结果如图27所示,图中的标尺为100μm。结果显示:血管植入体植入5天后,开始出现胶原的表达;随着植入时间的增加,表达的胶原逐渐增多并开始分层,形成与正常血管相似的胶原结构。
实施例13
将人工血管前体与恒河猴自体腹主动脉进行血管吻合。使用超声分别于术后的5天、18天和61天对血管植入体进行检测,结果如图28所示,第一行图片为超声检测结果,第二行图片为彩色多普勒检测结果。结果显示,血管植入体内血管通畅,血流连续,管腔内表面光滑无血栓形成,无异常增生,与正常血管连接处无狭窄。
实施例14
将人工血管前体与恒河猴自体腹主动脉进行血管吻合。使用增强ct分别于植入后的19天和62天进行检测,结果如图29所示。结果显示,血管植入体血流通畅,无堵塞。
实施例15使用3d生物打印机制备生物砖-膨体聚四氟乙烯血管补片前体
(1)将市售的膨体聚四氟乙烯人工血管(管壁厚度:0.56mm,内径:8mm)裁剪成长4cm、宽1cm、具有一定弧度的近似矩形片状,得到片状固体支持物,如图30a所示;
(2)在片状固体支持物上喷涂一层医用胶(白云医用胶医用ec型);
(3)将实施例1制得的包含恒河猴脂肪间充质干细胞的生物砖浸泡于5%的纤维蛋白原溶液中5分钟,随后去除纤维蛋白原溶液,加入h-dmem培养基继续浸泡5分钟。
(4)使用3d生物打印机,将浸泡后的生物砖逐一打印在医用胶表面,铺满片状固体支持物,形成血管补片前体,如图30b所示。
实施例16使用3d生物打印机制备微囊-聚己内酯血管补片前体
(1)参照实施例3的方法,制备厚度为0.5mm的平整的聚己内酯片状固体支持物,将其裁剪为长3.5cm、宽1cm的近似矩形片状,如图30c所示;
(2)在片状固体支持物上喷涂一层医用胶(白云医用胶医用ec型);
(3)使用3d生物打印机,将实施例5制得的包含恒河猴脂肪间充质干细胞的微囊逐一打印在医用胶表面,铺满片状固体支持物,形成血管补片前体,如图30d所示。
实施例17血管补片前体的体内应用和评价
以恒河猴为动物模型,将实施例15和16制得的血管补片前体进行体内植入。在恒河猴腹主动脉上制造血管缺损后,根据具体的血管缺损情况,将血管补片前体修剪成合适的长椭圆形,并将血管补片前体与缺损部位进行缝合。
图31a显示了在恒河猴腹主动脉上制造血管缺损,图31b显示了将血管补片前体与缺损部位进行缝合。图31b图中,粗箭头所指为实施例15制得的包含生物砖的血管补片前体,细箭头所指为实施例16制得的包含微囊的血管补片前体。
植入7天后,将血管补片取出。图32a和32b分别显示了由包含生物砖的血管补片前体和包含微囊的血管补片前体形成的血管组织。如图所示,补片内生物砖或微囊融合成一体,形成完整的内膜。
对血管组织进行cd31和α-sma免疫组化染色,结果如图33所示。
图33a和33b显示了由包含生物砖的血管补片前体形成的血管组织的检测结果。结果显示,体内植入7天后,生物砖内脂肪间充质干细胞向内皮细胞(图33a)和平滑肌细胞(图33b)分化。
图33c和33d显示了由包含微囊的血管补片前体形成的血管组织的检测结果。结果显示,体内植入7天后,微囊内脂肪间充质干细胞向内皮细胞(图33c)和平滑肌细胞(图33d)分化。
实施例18双壳层生物砖的制备和力学性能测定
1、生物砖的制备
(1)制备u型底超疏水孔板:在超净室内将u型底孔板用酒精清洗干净后,将u型底孔板置入过氧化氢/浓硫酸溶液(30%(v/v),h2o2:h2so4=1:3)中,80℃反应1h,以进行羟基化处理。将羟基化的u型底孔板放入浓度为1%的1h,1h,2h,2h-全氟癸基三乙氧基硅烷(sigma)溶液中12h,再在100℃烘箱中加热4h,以进行硅化处理。最后,清洗u型底孔板并风干。
(2)制备含种子细胞的胶原溶液:将45μlnaoh溶液(4mol/l)与1mli型胶原(4mg/ml)混合,配制成ph=7的胶原溶液。使用该溶液与离心获得的恒河猴脂肪干细胞混合形成细胞悬液(细胞总浓度为2x107/ml)。
(3)制备聚赖氨酸溶液:将聚赖氨酸(sigma,数均分子量mn为150,000-300,000)溶于ph7.2的h-dmem培养基,得到浓度为1wt%的聚赖氨酸溶液。
(4)制备海藻酸钠溶液:将海藻酸钠(sigma)溶于ph7.2的h-dmem培养基中,得到浓度为1wt%的海藻酸钠溶液
(5)胶原滴加(形成核层结构):采用能够吸取和排出纳升级液体的电子式吸取装置精密吸取0.1μl步骤2制备的i型胶原溶液,滴入步骤1制备的u型底超疏水孔板中,形成液滴,在37℃恒温保持30min,使其成型。
可选的电子式吸取装置为eppendorfxplorer0.5-10ul或transferpetteelectronic0.5-10ul,借助他们的分液功能,每分液量最低可达到0.1μl;或者采用sge自动进样器1μl或0.5μl,可分别实现10次和5次的0.1μl液体滴定;特殊地,可选用锥形特制针头进行滴定,提高精确度。
(6)滴加聚赖氨酸溶液:更换吸头后,精密吸取0.5μl步骤3制备的聚赖氨酸溶液,在超疏水孔板中央位置将其滴入步骤5中成型的核层表面,反应10min,以形成生物砖壳的第1层。
(7)使用h-dmem培养基对步骤6的产物冲洗2次。
(8)滴加海藻酸钠溶液:更换吸头后,精密吸取0.5μl步骤4制备的聚赖氨酸溶液,在超疏水孔板中央位置将其滴入步骤6中成型的壳层表面,反应10min,以形成生物砖壳的第2层,获得壳为2层的生物砖;制备的生物砖直径约300μm。
任选地,将制备好的生物砖置于pbs中,形成生物砖悬液。
3、弹性模量检测:
使用piumananoindenter纳米压痕仪对生物砖的弹性模量进行检测。
3.1受检样品制备:
(1)吸管取1ml生物砖悬液,滴加在塑料培养皿中间;
(2)静置10min后,吸干液体,可见生物砖吸附于培养皿底部;
(3)使用纳米压痕仪移动平台使探头逐步逼近生物砖表面,在接近生物砖时,使用吸管取一滴水滴于探头与生物砖之间,保证生物砖处于正常生理状态。
(4)此时生物砖吸附于底部,不会移动,可以进行检测(参见图34)。
3.2样品测试:
测试条件:
测试结果:
图35为本实施例的生物砖的应力应变曲线。本实施例的生物砖的有效杨氏模量数值为24.77kpa。
实施例19使用3d生物打印机制备包含双壳层生物砖的人工血管前体,以及人工血管前体的体内应用和评价
1、胶原溶液(溶液a)的配制
使用牛i型胶原配制胶原溶液,作为生物墨汁的载体。
(1)高温灭菌处理100ml烧杯和搅拌磁子;
(2)将溶液容器外表面消毒后,放入生物安全柜内;
(3)取co60辐照灭菌处理的胶原固体0.5g置于烧杯中,加入25ml无菌去离子水(经0.22μm滤器过滤处理);
(4)使用磁力搅拌器搅拌,使胶原固体浸入水中;
(5)滴加醋酸溶液(经0.22μm滤器过滤处理)至ph=3;
(6)搅拌溶液直至胶原固体完全溶解;
(7)根据打印环节需要,调控胶原溶液浓度。如无特殊要求,胶原溶液浓度为约2wt%。标记,命名为溶液a,4℃保存。
2、人工血管前体的制备
2.1准备
(1)将溶液a与生物砖按1:1的体积比共混,制备成墨汁a(生物墨汁),并填装于打印墨盒a中,保持墨盒温度为4℃;
(2)将市售的白云医用胶作为墨汁b填装于打印墨盒b中,保持墨盒温度为室温;
(3)将墨盒a、b分别与相对应的打印喷头相连接;
(4)根据患者影像学检测结果,确定所需血管内径,选择相对应的旋生仪并安装;
(5)启动3d生物打印机,运行自检程序,测量喷头高度,确定3d生物打印机各部分正常;
(6)在电脑工作站中进行参数设置,包括:直径,长度,打印顺序,打印厚度,旋生仪温度,喷头温度。
图36示意性地展示了本实施例所使用的3d生物打印机。
2.2打印生物构建体并与管状固体支持物组装
(1)启动3d生物打印机制备程序;
(2)运行喷头a,打印墨汁a,使其在旋生仪的旋转杆上形成长度为20mm的管状生物构建体,厚度约1mm(如图37所示);
(3)运行b喷头,在墨汁a形成的生物构建体上均匀喷涂墨汁b;
(4)将尺寸相匹配的gore膨体聚四氟乙烯人工血管作为管状固体支持物,套在管状生物构建体的外表面,进行组装,通过墨汁b(医用胶)将两者粘合成一体,形成人工血管前体(如图38所示),并从旋转杆上取出。
3、将人工血管前体植入恒河猴体内,进行体内应用和评价
3.1手术流程
(1)沿腹部中线做5-7cm的纵向皮肤切口,推荐使用高频电刀,因为它既可切割,又可止血。分离皮下组织及肌肉层直至腹膜,进入腹腔,打开腹腔后,将小肠轻柔的外翻出来,使用生理盐水浸湿的纱布包裹避免脱水,暴露腹主动脉;
(2)经静脉注射0.5mgkg-1肝素钠进行抗凝;
(3)在动脉下方穿过两根0-0缝合丝线,一根靠近肠系膜动脉下部,另一根靠近髂总动脉分支处,在需要时用于结扎阻断血流;
(4)使用动脉夹阻断肾下腹主动脉血流,两个动脉夹之间的距离约为3cm,从中间切除约2cm的腹主动脉;
(5)使用7-0聚乙烯缝合线,采用端端吻合法将2cm长的人工血管前体与恒河猴自体腹主动脉相缝合;
(6)松开动脉远心端动脉夹,使人工血管前体内的空气排空;
(7)松开动脉近心端动脉夹,使用消毒纱布按压血管缝合处数分钟,防止渗血直至缝合口无血液渗出;
(8)检测动脉远心端搏动情况,如搏动正常,则植入成功。图39显示了植入后的人工血管前体。
3.2组织学检测
体内植入170天后,对血管植入体进行取材。使用免疫荧光法检测植入体的内皮细胞及平滑肌细胞形成情况。
使用绿色荧光对血管内皮细胞进行荧光标记,结果显示,血管植入体形成了完整的内皮细胞层,荧光显微照片如图40所示,图中标尺为200μm。
使用红色荧光对血管平滑肌细胞进行荧光标记,结果显示,血管植入体形成了完整的平滑肌细胞层,荧光显微照片如图41所示,图中标尺为200μm。
尽管本发明的具体实施方式已经得到详细的描述,但本领域技术人员将理解:根据已经公开的所有教导,可以对细节进行各种修改和变动,并且这些改变均在本发明的保护范围之内。本发明的全部范围由所附权利要求及其任何等同物给出。
- 还没有人留言评论。精彩留言会获得点赞!