一种猪细小病毒病毒样颗粒的纯化方法及其应用与流程
本发明涉及一种猪细小病毒病毒样颗粒的纯化方法及其应用,属于生物制品分离纯化技术领域。
背景技术:
猪细小病毒(porcineparvovirus,ppv)属于细小病毒科细小病毒属,是一种自主复制型病毒,临床常以妊娠母猪流产、死胎、畸形胎、胎儿木乃伊化及弱仔等一系列症状为特征。猪细小病毒病常与其他导致母猪繁殖障碍的病原混合感染而致病,给养猪业带来了严重的损失。
迄今为止,国内普遍应用的疫苗主要为全病毒灭活疫苗和杆状病毒表达的重组亚单位疫苗,相对于全病毒灭活疫苗而言,亚单位疫苗具有抗原表达量高的优点,但杆状病毒表达的重组亚单位疫苗在临床应用中存在一些过敏反应(如呕吐、震颤等),这些副反应的产生主要是由于亚单位疫苗未经纯化而引起的。对于重组病毒样颗粒抗原的纯化,通常包括细胞裂解、粗提、浓缩和精制等步骤。但从产业化生产的角度来看,在保证vlp的纯度和质量的前提下,亟需一种简单、省时、经济、高产和可控的重组病毒样颗粒抗原的纯化方法。特别对于兽用疫苗而言,其产品附加值本身较低,如果采用步骤繁琐的纯化工艺,其生产成本必然会大大增加。
目前,还未有针对猪细小病毒病毒样颗粒产业化纯化应用的技术。
技术实现要素:
本发明的第一个目的是提供一种猪细小病毒病毒样颗粒的纯化方法,包括如下步骤:
(1)将表达猪细小病毒病毒样颗粒的培养物进行澄清,收集上清液并进行灭活,以得到半成品;
(2)调节半成品的ph值至5.5~6.0;
(3)将调节ph值后的半成品加入到弱阴离子交换柱中,洗脱弱阴离子交换柱,收集各个出峰组分。
进一步地,步骤(3)中所述的弱阴离子交换柱为deae-阴离子交换柱。
进一步地,步骤(1)中用的病毒灭活剂为二乙烯亚胺。
进一步地,表达猪细小病毒病毒样颗粒的培养物的获取包括如下步骤:用嵌合有编码猪细小病毒vp2蛋白基因的杆状病毒感染昆虫细胞,培养昆虫细胞,以得到表达猪细小病毒病毒样颗粒的培养物。
进一步地,培养昆虫细胞时采用无血清培养基,培养温度为25℃~30℃,转速为130rpm~150rpm,培养时间为96h~144h。
进一步地,培养昆虫细胞时采用无血清培养基,培养温度为27℃,转速为140rpm,培养时间为96h~120h。
进一步地,在步骤(3)中,使用第一缓冲液平衡弱阴离子交换柱,第一缓冲液包括18~20mm的乙酸钠和0.1~0.3m的nacl,第一冲液的ph为5.0~5.5。
进一步地,在步骤(3)中,使用第二缓冲液洗脱弱阴离子交换柱,第二缓冲液包括18~20mm乙酸钠和1.0~1.2mnacl,第二缓冲液的ph为5.0~5.5。
进一步地,在步骤(3)中,第二缓冲液的体积为弱阴离子交换柱体积的3~5倍。
本发明的另一目的在于保护一种含有通过上述的一种猪细小病毒病毒样颗粒的纯化方法得到的猪细小病毒病毒样颗粒的疫苗。
本发明提供了一种猪细小病毒病毒样颗粒的纯化方法及其应用,是将表达的猪细小病毒病毒样颗粒的培养物进行澄清,收集上清液并用二乙烯亚胺灭活,以得到半成品;调节半成品的ph值酸性;将调节ph值后的半成品加入到弱阴离子交换柱中,洗脱后,收集各个出峰组分;用聚丙烯酰胺凝胶电泳确定的各个峰的活性蛋白组分。根据本发明的纯化方法得到的猪细小病毒病毒样颗粒纯度高达90%,回收率高达99%,且该纯化方法利于生产操作,为猪细小病毒杆状病毒载体灭活疫苗的制备提供了更加安全可靠的途径。
附图说明
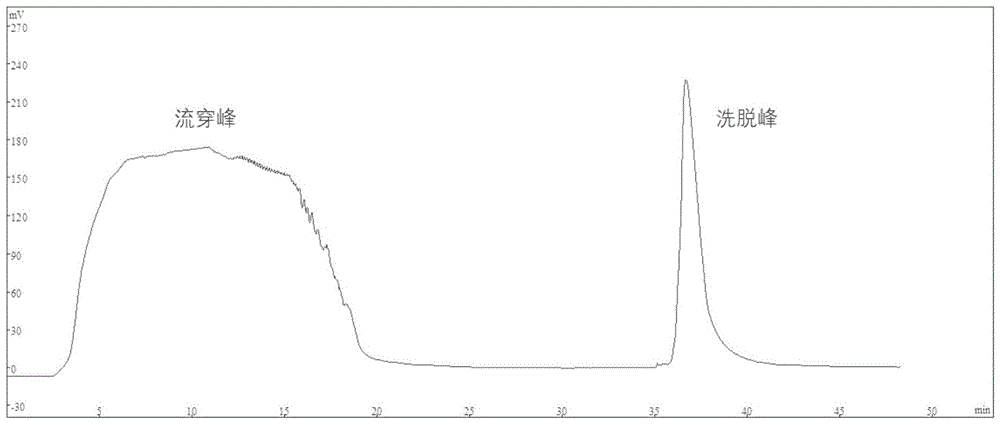
图1是根据本发明提供的纯化方法得到的的离子交换层析色谱。
图2是根据本发明提供的纯化方法得到的各组分的聚丙烯酰胺凝胶电泳图,其中,泳道m:蛋白分子marker;泳道1:猪细小病毒病毒样颗粒培养液;泳道2:猪细小病毒病毒样颗粒纯化样品;泳道3:猪细小病毒病毒样颗粒纯化流穿样品。
具体实施方式
下面详细描述本发明的实施例。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
实施例1猪细小病毒半成品的制备过程
将编码猪细小病毒病毒样颗粒基因的核苷酸序列连接到杆状病毒,构建重组杆状病毒毒种,毒种感染昆虫细胞(sf9细胞),sf9细胞培养条件为27℃、140rpm、96h~120h。当细胞裂解释放病毒后,收集毒液并由二乙烯亚胺(bei)灭活后获得的猪细小病毒病毒样颗粒。
实施例2猪细小病毒病毒样颗粒的纯化
将灭活后的毒液澄清去除沉淀,用2%乙酸调节半成品ph在5.5~6.0,得猪细小病毒病毒样颗粒纯化前半成品。
1)弱阴离子交换层析
将经过预处理的半成品加入到用乙酸钠缓冲液a(20mm乙酸钠,0.1mnacl,ph=5.5)平衡好的弱阴离子交换柱(deaefocurose6xl,武汉汇研生物科技股份有限公司)中,用乙酸钠缓冲液b(20mm乙酸钠,1.0mnacl,ph=5.5)进行洗脱,洗脱体积为3个柱体积,流速为2.0ml/min,并收集各出峰组分,弱阴离子交换层析谱图如图1所示。
2)聚丙烯酰氨凝胶电泳(sds-page)确定活性蛋白组分取各个阶段样品80μl于1.5mlep管中,再加入20μl5×sds-page上样缓冲液,混匀。各个ep管置于沸水浴中5min,4000rpm离心3min,得到sds-page样品,各组分sds-page如图2所示。
3)猪细小病毒病毒样颗粒纯化回收率
利用猪细小病毒病毒样颗粒定量检测试剂盒检测各个纯化组分的猪细小病毒病毒样颗粒含量(参照扬州优邦生物药品有限公司猪细小病毒病毒样颗粒样颗粒含量elisa检测试剂盒,货号:yb20190221),bca法测定总蛋白含量(参照南京诺唯赞生物科技有限公司bca蛋白浓度测定试剂盒,货号:e112-01)。半成品中的猪细小病毒病毒样颗粒含量为83.1μg/ml(体积为100ml);上样流穿液中的猪细小病毒病毒样颗粒含量为0.49μg/ml(体积为100ml);洗脱液中猪细小病毒病毒样颗粒含量为356.52μg/ml(体积为23ml)。结果显示,猪细小病毒病毒样颗粒半成品经过一步弱阴离子交换层析后,纯化倍数为34,病毒纯度达90.91%,回收率高达99%,具体结果见表1。
表1猪细小病毒病毒样颗粒纯化效果分析
对比例1纯化介质选择
将灭活后的毒液澄清去除沉淀,得猪细小病毒病毒样颗粒纯化前半成品,该样品ph值6.8。
1)弱阴离子交换层析
将经过预处理的半成品加入到乙酸钠缓冲液a(20mm乙酸钠,0.1mnacl,ph=6.8)平衡好的弱阴离子交换柱(deaefocurose6xl,武汉汇研生物科技股份有限公司)中,用乙酸钠缓冲液b(20mm乙酸钠,1.0mnacl,ph=6.8)进行洗脱,洗脱体积为3个柱体积,流速为2.0ml/min,并收集各出峰组分。
2)强阴离子交换层析
将经过预处理的半成品加入到用乙酸钠缓冲液a(20mm乙酸钠,0.1mnacl,ph=6.8)平衡好的强阴离子交换柱(qfocurose6xl,武汉汇研生物科技股份有限公司)中,用乙酸钠缓冲液b(20mm乙酸钠,1.0mnacl,ph=6.8)进行洗脱,洗脱体积为3个柱体积,流速为2.0ml/min,并收集各出峰组分。
3)弱阳离子交换层析
将经过预处理的半成品加入到用乙酸钠缓冲液a(20mm乙酸钠,0.1mnacl,ph=6.8)平衡好的弱阳离子交换柱(cmfocurose6xl,武汉汇研生物科技股份有限公司)中,用乙酸钠缓冲液b(20mm乙酸钠,1.0mnacl,ph=6.8)进行洗脱,洗脱体积为3个柱体积,流速为2.0ml/min,并收集各出峰组分。
4)强阳离子交换层析
将经过预处理的半成品加入到用乙酸钠缓冲液a(20mm乙酸钠,0.1mnacl,ph=6.8)平衡好的强阳离子交换柱(spfocurose6xl,武汉汇研生物科技股份有限公司)中,乙酸钠缓冲液b(20mm乙酸钠,1.0mnacl,ph=6.8)进行洗脱,洗脱体积为3个柱体积,流速为2.0ml/min,并收集各出峰组分。纯化效果如表2所示。
表2猪细小病毒病毒样颗粒不同纯化介质纯化效果分析
对比例2ph选择
将灭活后的毒液澄清去除沉淀,用2%乙酸调节半成品ph在5.0、5.5、6.0,得猪细小病毒病毒样颗粒纯化前半成品,其余步骤同实施例2。具体结果见表3。
表3调节半成品ph所得效果分析
实施例3含有猪细小病毒病毒样颗粒的疫苗的安全性检验
1、实验疫苗猪细小病毒病毒样颗粒纯化前、后样品加入同样的适量的佐剂制备疫苗,纯化前疫苗批次定义为vp2-01,纯化后疫苗批次定义为vp2-02。
2、试验猪仔猪购自镇江市丹徒区云立牧业有限公司,经检测猪细小病毒抗原抗体均为阴性。
3、实验方法
3.1单剂量接种安全性实验
3.1.1仔猪的安全性试验
3~5周龄断奶仔猪20头,每批疫苗5头,颈部肌肉注射,2ml/头,其余5头做对照,接种生理盐水,注射后仔细观察猪的反应情况,观察21天。
3.1.2后备猪的安全性试验
用5~6月龄青年后备猪16头,每批疫苗4头,颈部肌肉注射,2ml/头,其余4头做对照,接种生理盐水,注射后仔细观察猪的反应情况,观察21天。
3.2加倍剂量接种安全性试验
3.2.1仔猪安全性试验
用3~5周龄仔猪15只,分别接种2批疫苗,每批疫苗5头,颈部肌肉注射4ml/只,同时设5头阴性对照,接种生理盐水,相同环境下饲养。注射后,仔细观察仔猪的反应情况,观察21天。
3.2.2后备猪的安全性试验
用5~6月龄青年后备猪16头,每批疫苗4头,颈部肌肉注射,4ml/头,其余4头做对照,接种生理盐水,注射后仔细观察猪的反应情况,观察21天。
3.2.3怀孕母猪安全性试验
怀孕母猪12头,每批疫苗3头,颈部肌肉注射,4ml/头,其余3头做对照,接种生理盐水,注射后仔细观察猪的反应情况,观察21天,并跟踪母猪产仔情况。
3.2.44~6月龄公猪安全性试验
用青年后备公猪16头,每批疫苗4头,颈部肌肉注射,4ml/头,其余4头做对照,接种生理盐水,注射后仔细观察猪的反应情况,观察21天。
3.3单剂量重复接种安全性试验
3.3.1仔猪的安全性试验
用3~5周龄断奶仔猪20头,每批疫苗5头,颈部肌肉注射,2ml/头,其余5头做对照,接种生理盐水,14天后再重复接种1次,注射后仔细观察猪的反应情况,观察21天。
3.3.2后备猪的安全性试验
用5~6月龄青年后备猪16头,每批疫苗4头,颈部肌肉注射,2ml/头,其余4头做对照,接种生理盐水,14天后再重复接种1次,注射后仔细观察猪的反应情况,观察21天。
3.3.3怀孕母猪安全性试验
怀孕母猪(30~45日龄)12头,分每批疫苗3头,颈部肌肉注射,2ml/头,其余3头做对照,接种生理盐水,14天后再重复接种1次,注射后仔细观察猪的反应情况,观察21天,并跟踪母猪产仔情况。
3.3.44~6月龄公猪安全性试验
用4~6月龄公猪16头,每批疫苗4头,颈部肌肉注射,2ml/头,其余4头做对照,接种生理盐水,14天后再重复接种1次,注射后仔细观察猪的反应情况,观察21天。
4、结果
4.1仔猪安全性试验结果
仔猪安全性试验结果表明(表4),所用单倍剂量、单倍剂量重复接种,3批疫苗对仔猪均安全。
表4仔猪安全性试验
4.2后备猪安全性试验结果
后备猪安全性试验结果表明(表5),所用单倍剂量、超倍剂量和单倍剂量重复接种,2批疫苗对后备猪均安全。
表5后备猪安全性试验
4.3怀孕母猪安全性试验
怀孕母猪安全性试验结果(表6),超剂量一次注射的vp2-01批出现1头母猪接种6天后流产;单倍剂量重复注射的vp2-01批第3天亦出现一头母猪流产,其它试验猪均无异常反应。
表6怀孕母猪安全性试验
4.44~6月龄公猪安全性试验
4~6月龄公猪安全性试验结果表明(表7),该疫苗倍单剂量、超倍剂量和单倍剂量重复接种,2批疫苗对种公猪均安全。
表74~6月龄公猪安全性试验结果
通过以上试验结果可见,应用弱阴离子交换层析(deaefocurose6xl,武汉汇研生物科技股份有限公司)纯化猪细小病毒病毒样颗粒与适量佐剂混合制备的疫苗,对靶动物安全可靠更高,可以显著提高现有猪细小病毒杆状病毒载体灭活疫苗的安全性,且成本较低。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!