来源于病原真菌具有抗微生物功能拟肽及其制备方法,组合物和应用与流程
本发明属于生物医药领域,具体涉及一种来源于病原真菌具有抗微生物功能拟肽及其制备方法,组合物和应用,即来源于病原真菌具有抗微生物功能的拟肽,和该拟肽的制备方法以及含有该拟肽的药物或/和组合物,并作为抗微生物剂的应用。
背景技术:
病原微生物对药物抗性的增加已成为严重的问题。在全球范围内,每年约有700000人死于耐药微生物感染。流行病学调查结果表明,多药耐药的细菌,例如大肠埃希氏菌,肺炎克雷伯菌,鲍曼不动杆菌,耐甲氧西林金黄色葡萄球菌(mrsa),耐万古霉素的mrsa,耐青霉素的肺炎链球菌(prsp),耐万古霉素肠球菌(vre)和广泛耐药(xdr)结核分枝杆菌等细菌的耐药性日益普遍。与人畜共患病和粪便中含有的细菌(沙门氏菌属,弯曲杆菌属,大肠杆菌和肠球菌属)的耐药性也越来越严重。
目前公认的细菌的耐药机制主要有:①产生能灭活抗微生物药物的酶。该类酶是一类水解酶超家族,主要水解含有β-内酰胺环结构的抗生素而使其失活,包括临床治疗中常用的青霉素类、头孢菌素类、单环β-内酰胺类以及碳青霉烯类抗生素。编码耐药酶的基因可天然存在于菌株染色体内(称为固有耐药,如存在于肠道内的革兰氏阴性杆菌对青霉素具有天然抗性);也可在抗微生物药物的诱导下由质粒介导或整合进菌株染色体中(称为获得性耐药)。②修饰抗微生物药物作用的靶标。抗微生物药物靶位的改变是一种较为常见的耐药机制。通常情况下,靶位的改变来源于菌株获得相关基因或者基因的自发突变以及在抗微生物药物存在下的选择性突变。例如rna聚合酶的突变以及dna促旋酶的突变可分别导致菌株获得对利福霉素以及喹诺酮类抗微生物剂的抗性。③产生外排泵将抗微生物药物泵出。由革兰氏阴性菌引起的感染难以治疗,因为它们对许多抗生素具有内在抗性。而其抗性的获得不依赖于水平基因转移和突变。革兰氏阴性菌的双膜结构和产生的外排泵可将抗微生物药物泵出,从而降低细胞内药物的浓度。革兰氏阴性菌在其膜中可表达许多外排泵,它们运输各种各样的分子排出细菌细胞,这些泵中的一部分可以运输抗生素。从细菌中泵出抗生素会降低细胞内的药物浓度,使细菌在更高的外部浓度的抗微生物药物中存活,从而导致其对抗微生物药物的耐药。④改变细菌胞浆膜通透性。革兰氏阴性细菌外细胞壁的低渗透性已被证明在低剂量的抗生素浓度下能有效阻止抗微生物药物发挥作用。抗生素通过外膜进入菌体的关键机制包括负责亲水性抗生素扩散的孔蛋白(omps)和用于疏水性抗生素的脂质介导途径,许多菌株由于外膜的脂质或蛋白质组成的改变而耐药,表明外膜屏障在菌株对抗生素是否敏感中起重要作用,外膜蛋白的任何结构变化都可以显著地影响其对抗生素的抗性。此外,当渗透屏障与周质空间中的β-内酰胺酶具有协同作用时,菌株的耐药将变得更加严重,可能导致病原菌对第三代头孢菌素产生抗性。
除了细菌外,以往被忽视的病原真菌的耐药性也日益严重并开始被关注(science2018,360:739-742)。多重耐药病原真菌的迅速出现和对抗真菌药物耐药菌株的广泛传播对人类健康亦构成了相当大的威胁。目前真菌对人类健康的影响正在不断上升,真菌疾病的全球死亡率现已超过疟疾或乳腺癌,并且与结核病和艾滋病的死亡率相当(scitranslmed2012,4(165):165rv13)。尽管它们无处不在,但真菌感染相对于其他类型的传染病以往被大大忽视。
人类首先使用抗真菌药,制霉菌素和多烯类抗真菌药,于20世纪50年代被发现。今天,全身性真菌抑菌剂和杀真菌剂被用作人类治疗真菌感染相关疾病的一线治疗用药。然而,由于真菌对药物抗性的快速发展,现有的许多药物只能短暂的抑制其增值。真菌的基因具有高度可塑性并可迅速繁殖。这些属性使其在药物选择性压力下可快速生成突变体。
目前可用于治疗人类真菌感染的一线药物主要有四类:1、多烯烃类。如两性霉素b)通过抑制真菌膜固醇(麦角甾醇)破坏细胞膜的结构;2、嘧啶类似物。如5-氟胞嘧啶(5-fc)阻断嘧啶代谢和dna合成;3、唑类,也是最广泛使用的杀菌剂。通过抑制羊毛甾醇14-α-去甲基化酶来阻断麦角甾醇的生物合成;4、棘白菌素,为最新一类的抗真菌药。通过抑制(1-3)-β-d-葡聚糖合成酶并破坏细胞壁的生物合成。
随着上述药品在临床抗真菌治疗中长期广泛的使用,出现了新的多药耐药病原真菌。2009年多药耐药的念珠菌(candidaauris)首次在一位来自日本耳部感染的患者中被发现,其对所有临床抗真菌药都耐药(clininfectdis2017,64(2):134-140.)并且对重症监护病房构成威胁,因为可以在正常的去污剂无法将其抑制杀死。有研究表明主要的真菌血症病原体光滑念珠菌(candidaglabrata)的抗药性出现,也主要是因为频繁使用棘白菌素类和唑类抗真菌药作为预防性用药的使用所致(clininfectdis2013,56(12):1724-1732.)。
鉴于上述细菌、真菌耐药的情况,有必要避开现有药物的作用机制来开发新的候选抗真菌活性分子,通过新的作用机制来抑制或杀死病原真菌。抗微生物肽(anti-microbialpeptides,amps)为一类具有序列和结构多样性的分子,且具有广泛的抗微生物活性,如抗细菌、抗真菌和抗病毒作用。目前已经发现超过3000余种抗微生物多肽,但由于天然多肽性质上的缺陷(如溶血、高盐浓度环境不稳定等),许多活性较好的多肽并不具有作为药物开发的价值。
技术实现要素:
针对现有技术的缺点与不足,本发明提供一种来源于病原真菌具有抗微生物功能拟肽及其制备方法,组合物和应用。本发明所述的多肽在μg/ml浓度水平具有抗革兰氏阳性细菌标准菌株、临床耐药细菌及真菌标准菌株的活性。
为实现上述目的,本发明一方面提供的一种来源于病原真菌具有抗微生物功能拟肽,本发明所涉及的拟肽来源于人病原真菌指间毛癣菌t.interdigitale的蛋白(genbank号:ezf36158.1),序列如下:
将上述全长蛋白中的肽段iiggrc(方框中的氨基酸序列)通过羧基端半胱氨酸侧链的巯基与小分子化合物3-巯基-5-甲基-1,2,4-三氮唑的巯基形成共价二硫键相连接,即以二硫键为linker,拼接成为全新结构的分子,其分子结构如下:
经反相高效液相色谱(reversephase-highperformanceliquidchromatography,rp-hplc)分离纯化可获得该拟肽分子,其理论分子量为730.34,具有抗细菌和真菌的活性,对临床分离的耐药菌亦有效。上述拟肽具有制备方法技术路线简单,稳定性强,产物质量容易控制等优点。
本发明另一方面提供一种来源于病原真菌具有抗微生物功能拟肽的制备方法,其特征在于:首先通过常规的多肽固相合成技术制备肽段iiggrc,再通过羧基端半胱氨酸侧链的巯基与小分子化合物3-巯基-5-甲基-1,2,4-三氮唑的巯基形成共价二硫键,最后通过半制备反向高效液相色谱纯化,最终获得完整的拟肽分子。
本发明另一方面还提供一种来源于病原真菌具有抗微生物功能拟肽在抗微生物药物或/和日用品中的应用,其特征在于:所述抗微生物药物为注射剂、片剂、注射用无菌粉末、粉剂、颗粒剂、胶囊剂、口服液、膏剂或霜剂;所述药物通过注射、口服、滴鼻、滴眼、物理或化学介导的方法导入肌肉、内皮、皮下、静脉或粘膜组织;所述日用品为洗手液、洗面奶、洗发水、沐浴液、女性护理洗液、卫生巾、卫生护垫、尿不湿、成人护理尿垫、漱口水、牙膏、香皂、洗衣液、消毒液、洁厕液、消毒纸巾、敷料、绷带或饲料。
进一步地,所述微生物为临床分离的革兰氏阳性细菌菌株和/或临床分离的真菌菌株。
进一步地,所述真菌为念珠菌属和隐球菌属。
本发明另一方面还提供一种组合物,其特征在于:它包含上述的来源于病原真菌具有抗微生物功能拟肽或者还包含所述拟肽可接受的盐和/或水合物和/或溶剂化物和/或可接受的载体。
本发明另一方面还提供一种上述的组合物在制备抗菌药物和/或日用品中的应用,其特征在于:所述抗菌药物为注射剂、片剂、注射用无菌粉末、注射用无菌粉末、粉剂、颗粒剂、胶囊剂、口服液、膏剂或霜剂;所述抗菌药物或组合物通过注射、口服、滴鼻、滴眼、物理或化学介导的方法导入肌肉、内皮、皮下、静脉或粘膜组织;所述日用品为洗手液、洗面奶、洗发水、沐浴液、女性护理洗液、卫生巾、卫生护垫、尿不湿、成人护理尿垫、漱口水、牙膏、香皂、洗衣液、消毒液、洁厕液、消毒纸巾、敷料、绷带或饲料。
溶血实验结果表明,所述的具有抗微生物功能的拟肽在浓度高达64μg/ml时溶血率<5%(图5),具有较高的安全性。
上述具有抗微生物功能的拟肽或/和组合物可以根据常规制剂方法制备成注射剂、片剂、注射用无菌粉末、粉剂、颗粒剂、胶囊剂、口服液、膏剂、霜剂等多种剂型。该具有抗微生物功能的拟肽或组合物可以通过注射、口服、滴鼻、滴眼、物理或化学介导的方法导入肌肉、内皮、皮下、静脉或粘膜组织,或是被其他物质混合或包裹后导入肌体。
本发明具有如下优点与效果:本发明所涉及的具有抗微生物(细菌和真菌)功能的拟肽具有良好的抗革兰氏阳性菌作用(包括临床分离的耐药菌),同时亦能抑制念珠菌属和隐球菌属的真菌,且安全性高;该拟肽人工制备方便,生产成本低,适合工业化大规模生产;因此在治疗细菌及真菌感染领域具有良好的开发前景;本发明所述的具有抗微生物功能的拟肽可为开发新的抗细菌、抗真菌活性物质及其复方制剂提供新的选择。
附图说明
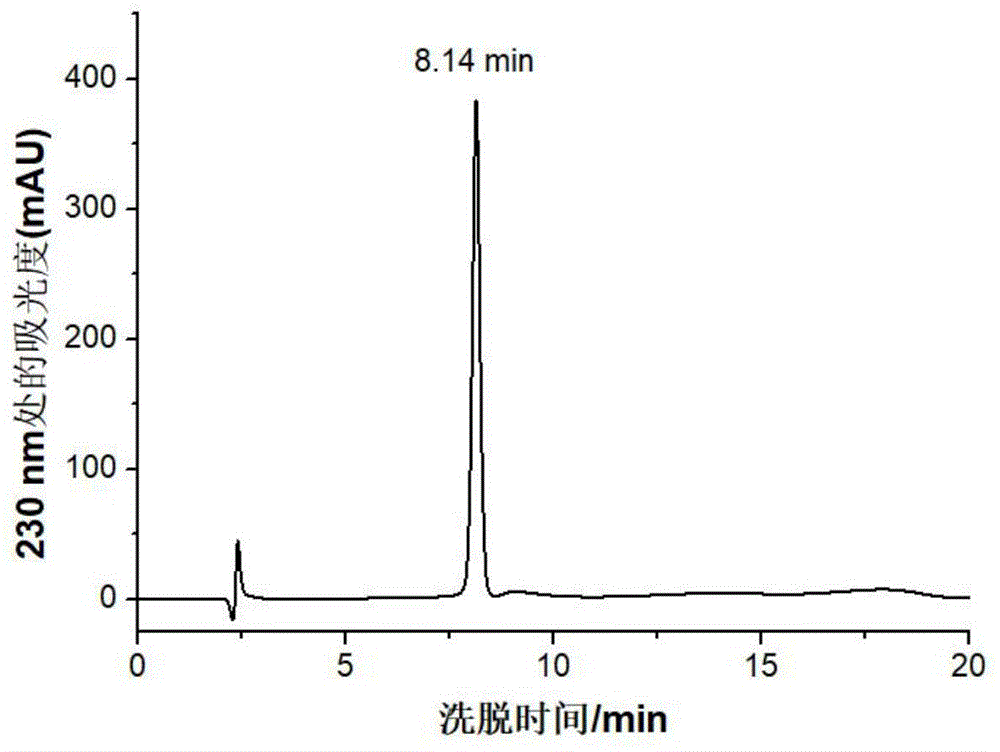
图1是本发明制备的天然多肽肽段中间体iiggrc的hplc图。
图2是本发明制备的天然多肽肽段中间体iiggrc的质谱图。
图3是本发明制备的具有抗微生物功能拟肽的hplc图。
图4是本发明制备的具有抗微生物功能拟肽的质谱图。
图5是本发明具有抗微生物功能拟肽的溶血活性结果。
图6是本发明具有抗微生物功能拟肽在不同浓度盐环境中的活性结果。
图7是本发明具有抗微生物功能拟肽在不同温度环境中的活性结果。
图8是本发明具有抗微生物功能拟肽在不同ph环境中的活性结果。
具体实施方式
以下结合附图和具体实施例来对本发明作进一步地详细说明。
实施例一天然多肽肽段中间体iiggrc的制备
在该多肽肽段中间体的合成中,运用9-芴甲氧羰基(fmoc)保护氨基端基团,选用4-甲基二苯基甲胺树脂(4-methyl-benzhydrylamineresin·hcl,mbharesin)为固相载体,hobt/dcc为缩合剂,由羧基末端向氨基末端延长肽链。用94%三氟乙酸、3%水和3%三异丙甲硅烷(tia)的混合液(均为质量百分比)将其从mbha树脂上裂解。乙醚反复多次沉淀后,经制备型rp-hplc纯化。使用c18反相制备柱(20mm×250mm,5μm);流动相:1.5‰三氟乙酸,0%~50%(体积百分比)乙腈为流动相,0.5ml/min的流速进行梯度洗脱。经rp-hplc检测,保留时间(retentiontime,rt)为8.14min,其纯度>95%(图1),冻干后备用。经esi-qtof-ms鉴定,其分子量与拟制备多肽中间体相应的理论分子量一致,m/z618.6[m+h]+,m/z309.8[m+2h]2+(图2)。
实施例二来源于病原真菌具有抗微生物功能拟肽的制备
以上述实施例1中制备的中间体肽段iiggrc以及小分子化合物3-巯基-5-甲基-1,2,4-三氮唑为原料。取1mg中间体肽段iiggrc和0.2mg3-巯基-5-甲基-1,2,4-三氮唑,用1ml浓度为0.15m(ph值为8.4)的tris-hcl缓冲液溶解,用移液枪轻柔吹吸溶液加速中间体肽段及小分子化合物溶解。将盛有多肽溶液的ep管放入恒温摇床中于30±2℃,80rpm孵育约36h。于室温10000rmp高速离心4min,取上清液。经制备型rp-hplc纯化。使用c18反相制备柱(20mm×250mm,5μm);流动相:0.15%三氟乙酸,0%~55%(体积百分比)乙腈为流动相,0.5ml/min的流速进行梯度洗脱。经rp-hplc检测,rt为10.24min,其纯度>95%(图3),冻干后备用。经esi-qtof-ms鉴定,其分子量与拟制备拟肽相应的理论分子量一致,m/z731.2[m+h]+,m/z366.4[m+2h]2+(图4)。
实施例三来源于病原真菌拟肽的抗微生物活性测定
对革兰氏阳性菌标准菌株(如金黄色葡萄球菌staphylococcusaureusatcc25922、淋病奈瑟菌neissriagonorrhoeaeatcc49226)及临床分离的耐甲氧西林金黄色葡萄球菌methicillin-resistants.aureus均有良好的抑制作用。除细菌外,其对真菌标准菌株candidaalbicansatcc10231、c.kruseiatcc6258和cryptococcusneoformansatcc34877亦具有较强的抑制活性。
使用的标准菌株:staphylococcusaureusatcc25922、neissriagonorrhoeaeatcc49226、candidaalbicansatcc10231、c.kruseiatcc6258和cryptococcusneoformansatcc34877购自中国典型培养物保藏中心(chinacenteroftypeculturecollection,cctcc)。临床分离的菌株:s.aureus、methicillin-resistants.aureus、candidaalbicans由武汉大学人民医院检验医学中心提供。采用倍比稀释法测定最小抑菌浓度(minimuminhibitoryconcentration,mic),通过mic值表征该来源于病原真菌拟肽的抗微生物活性。
具体方法如下:
将待测细菌用三区划线法分别接种于灭菌的luria-bertani(lb)固体培养基平板中;将待测真菌用三区划线法分别接种于灭菌的yeastextractpeptonedextrose(ypd)固体培养基平板中。细菌于37℃恒温培养箱中倒置培养14小时;真菌于30℃恒温培养箱中倒置培养48~96小时。用接种环挑取单菌落分别转接到灭菌的液体培养基中(细菌用lb液体培养基;真菌用ypd液体培养基),于37℃(细菌)或30℃(真菌)、150rpm条件下在震荡培养至对数生长期。用紫外分光光度计测定600nm波长处菌液的吸光度值(od600),根据1od=1×109cfu/ml的换算关系,分别将标准菌株以及临床耐药菌株培养基稀释至(1~2)×105cfu/ml。
首先在无菌96孔板中先加入100μl灭菌的液体lb培养基(细菌)或液体ypd培养基(真菌)培养基;接下来将用灭菌的lb培养基溶解的浓度为256μg/ml的拟肽溶液100μl加入到第1孔中,混合均匀后取100μl加入第2孔中,最后从第9孔吸出100μl弃去,依次二倍稀释;最后向各孔中加入浓度为(1~2)×105cfu/ml稀释好的菌液100μl,混合均匀,各孔中拟肽终浓度为128μg/ml、64μg/ml、32μg/ml、16μg/ml、8μg/ml、4μg/ml、2μg/ml、1μg/ml、0.5μg/ml。未加入拟肽的各孔作为阴性对照。
以上各组于37℃震荡培养12~14小时(细菌);于30℃震荡培养24~48小时,测定波长为600nm处的吸光度值。最小抑菌浓度(mic)取检测不到细菌或真菌生长(od600≤0.05)的孔中多肽的终浓度的最低值。阴性对照孔中菌液均浑浊,且在600nm处的吸光度od600>2.5。本专利所述该具有抗微生物及免疫调节双功能多肽的抗微生物活性结果如表1。
表1具有抗微生物及免疫调节双功能多肽的抗微生物活性
从表1中的结果可以看出,本发明所涉及的来源于病原真菌的拟肽具有较理想的抗细菌和抗真菌的活性。对于包括细菌和真菌在内的所有标准菌株,其mic≤16μg/ml。对于临床耐药菌mrsa亦具有很强的抑制作用mic值为32μg/ml,对临床分离的念珠菌属真菌c.albicans的抑制作用相对较弱mic值为64μg/ml。
实施例四来源于病原真菌具有抗微生物功能拟肽的溶血活性测定
从健康供体获得新鲜血液,分离人红细胞后制成悬液,以灭菌生理盐水为阴性对照、以1%的tritonx-100为阳性对照,测定该双功能多肽的溶血活性。
具体步骤如下:用edta抗凝管收集全血,轻轻颠倒使血液充分抗凝,于室温600rpm离心4min,弃去上层血浆保留下层红细胞;加入4倍体积的灭菌生理盐水,轻轻颠倒使离心管使底部的红细胞悬浮,于室温下600rpm离心4min,弃去上清保留沉淀下来的红细胞,重复操作3次,至上清液无色为止;用灭菌生理盐水将红细胞制成2%(v/v)浓度的细胞悬液;用灭菌生理盐水将该拟肽溶解并配成128μg/ml、64μg/ml、32μg/ml、16μg/ml、8μg/ml、4μg/ml、2μg/ml和1μg/ml浓度的溶液;将100μl该双功能多肽溶液和100μl红细胞悬浮液混合并加入至96孔板中,多肽的终浓度分别为64μg/ml、32μg/ml、16μg/ml、8μg/ml、4μg/ml、2μg/ml、1μg/ml和0.5μg/ml;阴性对照组为用灭菌生理盐悬浮的红细胞,阳性对照为用含1%tritonx-100的灭菌生理盐悬浮的红细胞;将样品放入恒温摇床中,于37℃下100rpm孵育60min;于室温将样品以3000rpm离心5min,每孔中取100μl上清液转移至另一96孔板中;用全波长酶标仪测定490nm波长处的吸光度,并通过以下公式计算溶血百分率,公式中h为490nm波长处的吸光度:溶血率(%)=(hsample-hnegative)/(hpositive-hnegative)×100%,如图5所示。
结果表明,本发明所述的具有抗微生物及免疫调节双功能多肽在终浓度高达64μg/ml时仍未出现明显的溶血作用(溶血率<5%)。
实施例五具有抗微生物功能拟肽在不同浓度盐环境中的活性
将本发明所述的来源于病原真菌具有抗微生物功能的拟肽分别用0mm、75mm、150mm、300mm、450mm和600mm灭菌的nacl溶液溶解,并配成浓度为128μg/ml的拟肽溶液。按照实施例1中的方法,选取n.gonorrhoeaeatcc49226和c.albicansatcc10231测定本发明所述来源于病原真菌具有抗微生物功能拟肽在不同浓度的抗细菌及抗真菌的活性,结果如图6所示。
图6中的数据表明,随着盐浓度的升高,本发明所述来源于病原真菌拟肽的抗微生物活性降低,但总体变化不大。在生理条件下的盐浓度环境中(约为150mm),其对所测定的两种标准菌株的mic值与实施例1中的结果无变化,说明生理盐浓度条件下该拟肽抗微生物活性稳定。
实施例六具有抗微生物功能拟肽在不同高温环境中的活性
将本发明所述的来源于病原真菌具有抗微生物功能的拟肽用灭菌pbs溶液溶解,并配成浓度为128μg/ml的拟肽溶液,分别在25℃、35℃、45℃、55℃、65℃和75℃恒温环境中孵育2小时。按照实施例1中的方法,选取n.gonorrhoeaeatcc49226和c.albicansatcc10231测定本发明所述来源于病原真菌具有抗微生物功能拟肽在不同温度环境下孵育后的抗细菌及抗真菌的活性,结果如图7所示。
图7中的数据表明,在25℃~55℃范围内该拟肽对所测定的两种标准菌株的mic值与实施例1中的结果无变化。但随着温度继续升高,本发明所述来源于病原真菌拟肽的抗微生物活性有所降低。在65℃环境中孵育2小时后该拟肽对抑制上述两株菌的mic值分别比实施例1中的mic值分别升高了的2倍和2倍;在75℃环境中孵育1小时后该拟肽对抑制上述两株菌的mic值分别比实施例1中的mic值分别升高了的4倍和2倍。上述结果表明,本发明所涉及的拟肽在较高温度的环境仍具有较强的抗微生物活性。
实施例七具有抗微生物功能拟肽在不同ph环境中的活性
将本发明所述的来源于病原真菌具有抗微生物功能的拟肽分别用hcl或naoh调节酸碱度,配成ph值分别为3、5、7、9、11的灭菌pbs溶液,用不同酸碱度的灭菌pbs溶液溶解,并配成浓度为128μg/ml的拟肽溶液。按照实施例1中的方法,选取n.gonorrhoeaeatcc49226和c.albicansatcc10231测定本发明所述来源于病原真菌具有抗微生物功能拟肽在不同酸碱度ph环境下的抗细菌及抗真菌的活性,结果如图8所示。
图8中的数据表明,在生理ph±2范围内(生理ph约为7.4)其对所测定的两种标准菌株的mic值与实施例1中的结果无变化。但随着ph值的降低(ph=3)或升高(ph=11),本发明所述来源于病原真菌拟肽的抗微生物活性有所降低。其中该拟肽对酸性环境更敏感,ph=3时抑制上述两株菌的mic值分别比ph=7时值的8倍和4倍,ph=11时抑制上述两株菌的mic值分别比ph=7时值的4倍和2倍。上述结果表明,本发明所涉及的拟肽在酸性和碱性环境中具有一定的稳定性。
实施例八片剂
取本发明所述的来源于病原真菌具有抗微生物功能的拟肽0.15g、淀粉3g、糊精3g混合,质量浓度为35%的药用级聚乙烯吡咯烷酮(pvp)为粘合剂,制粒,压片,既得片剂。
实施例九注射用冻干粉
取本发明所述的来源于病原真菌具有抗微生物功能的拟肽1.5g、甘露醇22.5g,置于容器中,加适量pbs缓冲液(0.1m,ph7.4)溶解,加注射用水至400ml,摇匀,加8~10g针用活性炭,室温搅拌30~60分钟,粗滤,用0.22μm滤膜过滤除菌,分装,每瓶1ml,采用速冻的方法,每分钟降温10~15℃,降温至-45℃,维持2.5h,抽真空,在真空状态下缓慢升温,升温速度每小时2~10℃,温度升至30℃时停止升温,待温度接近室温后取出,加盖密封,既得冻干粉针剂。
- 还没有人留言评论。精彩留言会获得点赞!