siRNA修饰物及其在抑制血管新生中的应用的制作方法
本发明涉及生物技术和治疗领域中,sirna修饰物及其在抑制血管新生中的应用。
背景技术:
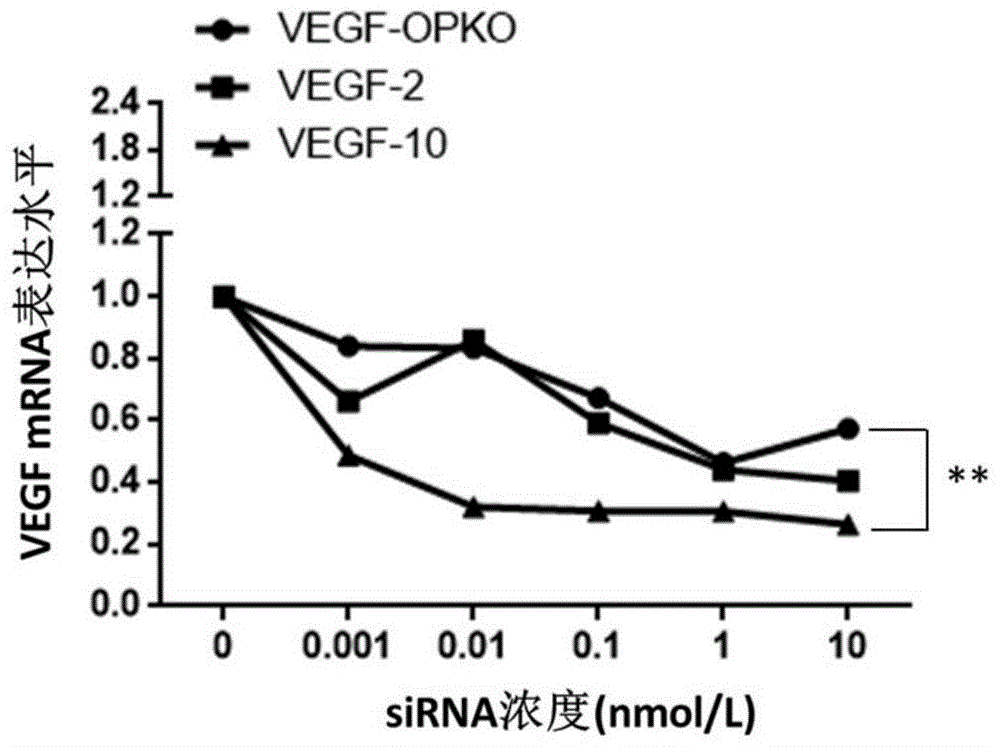
:血管内皮生长因子(vegf)是血管内皮细胞特异性的生长因子,人vegf基因定位于6号染色体,全长14kb,经过转录后剪切可形成5种异构体,vegf可以诱导机体内的血管新生。具体机制为vegf可以跟多种相应的受体结合,包括vegfr家族,pdgfr家族和其他酪氨酸蛋白激酶等,vegf和其受体结合后,使其受体胞内段的酪氨酸残基被磷酸化,活化胞内下游的信号通路,促进内皮细胞和肿瘤细胞的增殖,增加内皮细胞或肿瘤细胞的迁移,诱导肿瘤组织中血管生成,促进肿瘤细胞的生长等;此外,在多种与眼科相关的疾病中,尤其是老年性黄斑病变及糖尿病视网膜病变等疾病发生过程中,vegf表达量会上升,进一步促进眼球内的血管新生。血管内皮生长因子受体1(vegfr1,又称为flt1)作为vegfa,vegfb及pgf的主要受体,调控组织内血管生成,细胞生存,细胞迁移及侵袭等,当vegfr1与相应配体结合时,通过自身胞内段的磷酸化,激活mapk/akt/erk等信号通路。sirna是一类小rna序列,通常是20-25nt的双链rna。sirna可以通过结合靶基因的编码区(cds),引起mrna水平的降解,导致蛋白翻译受阻。大量的研究表明,sirna可以作用于多种靶基因,从而治疗该基因引起的各类疾病。外泌体是一类包含了小rna,dna和蛋白质的膜泡结构(30-150nm)。外泌体存在于大多数的生物体液中,包括血液、唾液、尿液等,并且大多数培养的细胞也会分泌外泌体。外泌体一直被视为特异性分泌的膜泡,能够参与细胞间通讯,细胞的微环境等众多生物学功能调控。技术实现要素:本发明的目的是提供sirna修饰物及其在抑制血管新生中的应用。本发明提供了的sirna修饰物,为对sirna进行修饰得到的物质,所述sirna由正义链和反义链组成,所述正义链为如下a1)或a2):a1)序列表中序列1的第1-19位所示的单链核酸分子;a2)将序列表中序列1的第1-19位经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列1的第1-19位具有相同功能的单链核酸分子;所述反义链为如下b1)或b2):b1)序列表中序列2的第1-19位所示的单链核酸分子;b2)将序列表中序列2的第1-19位经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列2的第1-19位具有相同功能的单链核酸分子;所述修饰为2'氟代修饰、硫代磷酸酯键修饰、2'-o-甲基化修饰、锁核苷酸修饰和/或胆固醇修饰;所述2'氟代修饰是将核苷酸核糖或脱氧核糖2’位置上的羟基替换为氟原子;所述硫代磷酸酯键修饰为将连接两个相邻核苷酸的磷酸二酯键中的氧原子替换为硫原子;所述2'-o-甲氧基化修饰是将核苷酸核糖或脱氧核糖2’位置上的羟基替换为甲氧基;所述锁核苷酸修饰是将核苷酸核糖或脱氧核糖2’位置和4’位置的碳原子相连,是一种特殊的双环状核苷酸衍生物;所述胆固醇修饰是将胆固醇分子连接在单链核酸分子的5’端或3’端。所述单链核酸分子由核糖核苷酸或脱氧核糖核苷酸与核糖核苷酸连接得到。序列1和序列2中a、u、c和g均为核糖核苷酸,t为脱氧核糖核苷酸。所述修饰均可为对所述sirna的正义链进行的修饰。所述sirna修饰物中,所述2'氟代修饰可对所述正义链5’端和/或3’端核苷酸进行。所述硫代磷酸酯键修饰可对所述正义链5’端和/或3’端核苷酸间的磷酸二酯键进行。所述2'-o-甲基化修饰可对所述正义链5’端和/或3’端核苷酸进行。所述锁核苷酸修饰可对所述正义链中的尿嘧啶核苷酸进行。所述胆固醇修饰可对所述正义链5’末端核苷酸进行。所述2'氟代修饰可对所述正义链5’端3个核苷酸和/或3’端3个核苷酸进行。所述硫代磷酸酯键修饰可对所述正义链5’端3个核苷酸间和/或3’端3个核苷酸间的磷酸二酯键进行。所述2'-o-甲基化修饰可对所述正义链5’端3个核苷酸和/或3’端3个核苷酸进行。所述sirna修饰物具体可为名称分别为vegf-1、vegf-2、vegf-3、vegf-4、vegf-5、vegf-6或vegf-10的sirna修饰物;所述vegf-1、所述vegf-2、所述vegf-3、所述vegf-4、所述vegf-5和所述vegf-6的正义链均为序列表中序列1所示的单链rna,反义链均为序列表中序列2所示的单链rna;所述vegf-1为对所述正义链5’端3个核苷酸和3’端3个核苷酸进行2'氟代修饰、并对所述正义链5’端3个核苷酸间和3’端3个核苷酸间的磷酸二酯键进行硫代磷酸酯键修饰得到的物质;所述vegf-2为对所述正义链5’端3个核苷酸和3’端3个核苷酸进行2'-o-甲基化修饰、并对所述正义链5’端3个核苷酸间和3’端3个核苷酸间的磷酸二酯键进行硫代磷酸酯键修饰得到的物质;所述vegf-3为对所述正义链中的尿嘧啶核苷酸进行锁核苷酸修饰得到的物质;所述vegf-4为对所述正义链5’末端核苷酸进行胆固醇修饰得到的物质;所述vegf-5为对所述正义链5’端3个核苷酸和3’端3个核苷酸进行2'氟代修饰、并对所述正义链5’端3个核苷酸间和3’端3个核苷酸间的磷酸二酯键进行硫代磷酸酯键修饰、并对所述正义链5’末端核苷酸进行胆固醇修饰得到的物质;所述vegf-6为对所述正义链5’端3个核苷酸和3’端3个核苷酸进行2'-o-甲基化修饰、并对所述正义链5’端3个核苷酸间和3’端3个核苷酸间的磷酸二酯键进行硫代磷酸酯键修饰、并对所述正义链5’末端核苷酸进行胆固醇修饰得到的物质;所述vegf-10的正义链为序列表中序列3所示的单链rna,反义链为序列表中序列4所示的单链rna;所述vegf-10为对所述正义链5’端起的第7、9、10和11位以及所述反义链5’端起的第2、6、8、9、14和16位进行2'氟代修饰、并对所述正义链以及反义链的5’端3个核苷酸间和3’端3个核苷酸间的磷酸二酯键进行硫代磷酸酯键修饰、并对所述正义链和所述反义链中未进行2'氟代修饰的核苷酸进行2'-o-甲基化修饰得到的物质。所述sirna,也属于本发明的保护范围。本发明还提供了一种成套物质,所述成套物质包括所述sirna修饰物和外泌体。所述成套物质可由所述sirna修饰物和所述外泌体组成。所述成套物质具有如下任一用途:x1)抑制老年性黄斑病变;x2)抑制糖尿病视网膜病变;x3)抑制血管新生;x4)抑制眼球血管新生;x5)抑制内皮细胞或肿瘤细胞的增殖;x6)抑制内皮细胞或肿瘤细胞的迁移;x7)抑制肿瘤的血管生成;x8)抑制肿瘤细胞的生长;x9)制备抑制老年性黄斑病变产品;x10)制备抑制糖尿病视网膜病变产品;x11)制备抑制血管新生产品;x12)制备抑制眼球血管新生产品;x13)制备抑制内皮细胞或肿瘤细胞的增殖产品;x14)制备抑制内皮细胞或肿瘤细胞的迁移产品;x15)制备抑制肿瘤的血管生成产品;x16)制备抑制肿瘤细胞的生长产品。本发明还提供了一种外泌体包裹的sirna,所述外泌体包裹的sirna由外泌体包裹所述sirna修饰物得到。所述外泌体包裹的sirna具体可将所述sirna修饰物和所述外泌体的混合物进行电转获得。所述电转可在120v下进行。所述混合物中所述sirna修饰物和所述外泌体的质量比可为1:2。上文中,所述外泌体可为如下m1)或m2)或m3)的细胞分泌的外泌体:m1)干细胞;m2)多能干细胞;m3)间充质干细胞。本发明还提供了所述sirna、所述sirna修饰物、或所述成套物质、或所述外泌体包裹的sirna的下述任一应用:x1)抑制老年性黄斑病变;x2)抑制糖尿病视网膜病变;x3)抑制血管新生;x4)抑制眼球血管新生;x5)抑制内皮细胞或肿瘤细胞的增殖;x6)抑制内皮细胞或肿瘤细胞的迁移;x7)抑制肿瘤的血管生成;x8)抑制肿瘤细胞的生长;x9)制备抑制老年性黄斑病变产品;x10)制备抑制糖尿病视网膜病变产品;x11)制备抑制血管新生产品;x12)制备抑制眼球血管新生产品;x13)制备抑制内皮细胞或肿瘤细胞的增殖产品;x14)制备抑制内皮细胞或肿瘤细胞的迁移产品;x15)制备抑制肿瘤的血管生成产品;x16)制备抑制肿瘤细胞的生长产品。所述产物可为药物。本发明中的血管新生是指病变性的血管新生。实验证明,本发明的sirna修饰物在抑制血管新生中具有比未修饰的sirna更好的效果,具有很高的应用价值。附图说明图1为si-vegf对vegfmrna的抑制作用。(**,p<0.0001)图2为外泌体包裹的sirna对小鼠血管新生模型的治疗作用。具体实施方式下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。下述实施例中,如无特殊说明,序列表中各核苷酸序列的第1位均为相应dna/rna的5′末端核苷酸,末位均为相应dna/rna的3′末端核苷酸。实施例1、靶向vegf基因的sirna(记为si-vegf)的制备按照表1和表2制备各si-vegf。设计随机序列作为阴性对照。表1中各序列3'端的两个核苷酸tt均用于保护sirna稳定性。表1、si-vegf序列信息注:表1中带下划线的加粗核苷酸均为2'氟代核糖核苷酸,即相应核苷酸均带有2'氟代修饰;“s”表示相邻的两个核苷酸间均由硫代磷酸酯键相连,即相邻两个核苷酸间的磷酸酯键均为硫代磷酸酯键;加粗核苷酸且不带下划线均为2'-o-甲基核糖核苷酸,即相应的核苷酸均带有2'-o-甲基化(2’ome)修饰;带下划线的加粗斜体核苷酸为锁核苷酸;“*”表示胆固醇修饰,即vegf-4正义链的5'末端核苷酸带有胆固醇修饰,vegf-5正义链的5'末端核苷酸带有胆固醇修饰。表2、si-vegf序列信息注:表2中带下划线的加粗核苷酸均为2'氟代核糖核苷酸,即相应核苷酸均带有2'氟代修饰;“s”表示相邻的两个核苷酸间均由硫代磷酸酯键相连,即相邻两个核苷酸间的磷酸酯键均为硫代磷酸酯键;无下划线非加粗核苷酸均为2'-o-甲基核糖核苷酸,即相应的核苷酸均带有2'-o-甲基化(2’ome)修饰。实施例2、双荧光素酶试验(试验一)重组vegf质粒的构建:将psicheck2质粒(promega)的xhoi和noti识别序列间的dna片段替换为序列表的序列5所示的dna分子(即部分vegf的基因片段),构建重组载体,得到的序列正确的重组载体即为重组vegf质粒。该重组vegf质粒中t7启动子能驱动序列表中序列5所示的dna分子的表达。将实施例1的各si-vegf作为待测sirna,检测各sirna对vegf的抑制效果,步骤如下:1、在10cm直径的细胞盘中采用dmem培养液培养293a细胞至80-90%融合,弃除培养上清,在细胞盘中用pbs缓冲液洗涤细胞。2、完成步骤1后,在所述细胞盘中加入1mltrypsin-edta溶液(thermofisher25200056),混匀后,小心吸弃上清,37℃静置1分钟。3、完成步骤2后,在所述细胞盘中加入2ml完全培养基,吹打细胞,得到单细胞悬液。完全培养基:含10%胎牛血清的dmem培养液。4、取步骤3得到的细胞悬液,接种至24孔板(每孔1×105个细胞),37℃培养12小时。5、将各待测sirna分别用depc-h2o(即经depc处理的h2o)溶解,得到sirna浓度均为20μm的各sirna溶液。6、在一个1.5mlep管中分别加入上述重组野生质粒、步骤5得到的sirna溶液和dmem培养液,混匀,得到100μl混合液甲(混合液甲中,含40ng重组野生质粒,sirna浓度为1nm);在另一个ep管中加入99μldmem培养液和1μl转染试剂lipo2000(即lipofectamine2000),混匀并静置5min,得到100μl混合液乙;将上述混合液甲和混合液乙混匀,得到200μl混合液,室温静置20min,即为转染混合物。每种sirna均得到一种转染混合物。7、取完成步骤4的24孔板,吸弃上清,每孔加入300μldmem培养液,静置20min后每孔加入200μl步骤6制备的转染混合物,37℃培养5小时。每孔加入一种sirna的转染混合物。每种sirna设置3个复孔。8、取完成步骤7的24孔板,吸弃上清,用pbs缓冲液漂洗,然后加入dmem培养液,37℃培养24小时。9、采用dual-luciferasereporterassaysystem(promega,e1960)检测双荧光素酶:(1)取完成步骤8的24孔板,吸弃上清,用pbs缓冲液清洗细胞。(2)完成步骤(1)后,每孔加入125μl1×plb裂解缓冲液,室温轻缓晃动培养板,裂解15min,得到裂解产物。(3)将步骤(2)得到的裂解产物转移至离心管中,3000rpm离心3min,收集上清液。(4)取30μl步骤(3)得到的上清液,加至白色96孔板中,加入底物,在荧光显微镜下进行检测(promega)。1×plb裂解缓冲液与底物均为dual-luciferasereporterassaysystem中试剂。将阴性对照的检测结果定为1,各si-vegf的双荧光素酶活性检测结果如表3所示(结果为三次重复实验的均值,荧光酶活性值小于1,说明该si-vegf有抑制效果,数值越小,表示抑制效果越好)。结果显示,vegf-1、vegf-2、vegf-3、vegf-4、vegf-5、vegf-6、vegf-10对vegf的抑制效果明显,且抑制效果显著优于vegf-opko。表3、双荧光酶活性结果(试验一)名称荧光素酶活性值vegf-opko0.68vegf-10.17vegf-20.36vegf-30.48vegf-40.63vegf-50.46vegf-60.59阴性对照1.00vegf-70.83vegf-81.57vegf-91.56vegf-100.41vegf-110.78实施例3、hep3b细胞中vegfmrna水平受si-vegf抑制将实施例1的vegf-opko、vegf-2和vegf-10作为待测sirna,检测各sirna对vegf基因表达的抑制,结果请参考图1,步骤如下:1、在10cm直径的细胞盘中采用dmem培养液培养hep3b细胞至80-90%融合,弃除培养上清,在细胞盘中用pbs缓冲液洗涤细胞。2、完成步骤1后,在所述细胞盘中加入1mltrypsin-edta溶液,混匀后,小心吸弃上清,37℃静置1分钟。3、完成步骤2后,在所述细胞盘中加入2ml完全培养基,吹打细胞,得到单细胞悬液。完全培养基:含10%胎牛血清的dmem培养液。4、取步骤3得到的细胞悬液,接种至24孔板(每孔1×105个细胞),37℃培养12小时。5、将各待测sirna分别用depc-h2o溶解,得到sirna溶液。6、在一个1.5mlep管中加入步骤5得到的sirna溶液和dmem培养液,混匀,得到100μl混合液甲(混合液甲中,sirna浓度分别为0、0.001、0.01、0.1、1或10nm);在另一个ep管中加入99μldmem培养液和1μl转染试剂lipo2000,混匀并静置5min,得到100μl混合液乙;将上述混合液甲和混合液乙混匀,得到200μl混合液,室温静置20min,即为转染混合物(sirna终浓度为0.001、0.01、0.1、1或10nmol/l)。每种sirna均得到六种sirna浓度的转染混合物。7、取完成步骤4的24孔板,吸弃上清,每孔加入300μldmem培养液,静置20min后每孔加入200μl步骤6制备的转染混合物,37℃培养5小时。每孔加入一种浓度的sirna的转染混合物。每种sirna、每种浓度设置3个复孔。8、取完成步骤7的24孔板,吸弃上清,用pbs缓冲液漂洗,然后加入dmem培养液,37℃培养24小时。9、取完成步骤8的24孔板,收集细胞,提取总rna。总rna进行反转录得到cdna。以cdna为模板,采用gapdh基因为内参基因,通过实时定量pcr检测vegf基因的相对表达量。用于检测vegf基因的引物如下:homo-vegf-f1:ggaggagggcagaatcatca;homo-vegf-r1:cttggtgaggtttgatccgc。用于检测gapdh基因的引物如下:gapdh-f:catgagaagtatgacaacagcct;gapdh-r:agtccttccacgataccaaagt。结果见图1和表4,结果为三次重复实验的均值,将无添加sirna时内源vegf基因相对于gapdh基因的表达水平归一化为1。待测sirna对于hep3b细胞的内源vegf基因表达均具有显著抑制作用:vegf-opko、vegf-2和vegf-10转染细胞后,hep3b细胞的内源vegf基因表达均有不同程度的下降,vegf-10对vegf基因表达的抑制作用随浓度的增加而加强,在vegf-10的浓度达到0.01nm后,抑制作用不再有明显的变化。表4、待测sirna对于hep3b细胞的内源vegf基因相对表达量sirna浓度(nm)vegf-opkovegf-2vegf-1001.0000001.0000001.0000000.0010.8399450.6621350.4876030.010.8328550.8591790.3209840.10.6721400.5907420.30778910.4623740.4416590.306703100.5730960.4049410.263688实施例4、外泌体包裹的si-vegf用于小鼠血管新生疾病模型的治疗将实施例1的vegf-opko、vegf-1、vegf-2、vegf-3、vegf-4、vegf-5、vegf-6、vegf-10作为待测sirna,利用外泌体包裹后,检测其对小鼠血管新生疾病模型的治疗效果。一、间充质干细胞(msc)上清外泌体的提取及检测外泌体提取:msc细胞(中国科学院典型培养物保藏委员会细胞库)用无外泌体的血清(fbs)培养液培养至80%-90%的细胞密度,然后更换新的相同培养液后继续培养48小时,收取培养上清液,将所得培养上清液按照如下步骤提取外泌体:将所得培养上清液约600毫升经0.22μm过滤器过滤后分离到6个干净的离心管中,进行第一次离心,离心条件为100000g,离心60min,收集上清液;将第一次离心所得上清液进行第二次离心,离心条件为4℃,135000g,离心90min,收集上清液;沉淀即为外泌体。取一部分外泌体沉淀用pbs(ph7.5)重悬,得到外泌体悬液用于检测外泌体特征,其余放置在-80℃冰箱保存。通过micro-bca法测得外泌体的蛋白浓度为10μg/ml,并通过粒度仪检测颗粒直径,结果显示所得外泌体的颗粒直径大多处于30-200nm之间。二、外泌体包裹的sirna(sirna-exo)的制备取6600ng待测sirna与步骤一得到的13200ng外泌体混匀,并用电解缓冲液补齐至200ul,得到混合液;将混合液转移到电极杯中电转,电转仪中电转,电转条件:120v,电转结束后,所得混合液即为外泌体包裹的sirna的液体,记为sirna-exo液体,放置冰上,备用。所用电转仪为苏州壹达生物电转仪ebxp-h1,所用电解缓冲液为苏州壹达生物电转仪ebxp-h1配套电解缓冲液。三、小鼠血管新生动物模型激光造膜实验使用科医人医疗设备生产的量子芯片多波长激光器照射c57bj/6小鼠(北京维通利华实验动物技术有限公司)眼球,波长659nm,曝光时间0.05s,直径50um,能量250mw。在造影后(海德堡的显微镜(hraspectralis)),在小鼠新生血管模型的眼球中能看到2-3个白色光斑,即表明造模成功。四、外泌体包裹的sirna用于小鼠血管新生疾病模型的治疗步骤三造膜成功后,将小鼠随机分为10组,即阴性对照组、雷珠单抗组、vegf-opko实验组、vegf-1实验组、vegf-2实验组、vegf-3实验组、vegf-4实验组、vegf-5实验组、vegf-6实验组和vegf-10实验组,每组三只。在造模后第三天进行眼底的药物注射:将各实验组小鼠腹腔注射麻醉剂,深度麻醉以后,小鼠侧卧于体式显微镜上,暴露眼球,取微量注射器将本实施例上述sirna-exo液体注射到小鼠眼底,每只小鼠注射1μl(即含有33μgsirna),注射结束,待小鼠苏醒后,将小鼠放回鼠笼中,继续观察。vegf-opko实验组、vegf-1实验组、vegf-2实验组、vegf-3实验组、vegf-4实验组、vegf-5实验组、vegf-6实验组和vegf-10实验组小鼠分别注射利用vegf-opko、vegf-1、vegf-2、vegf-3、vegf-4、vegf-5、vegf-6和vegf-10得到的sirna-exo液体。按照上述方法,将sirna-exo液体替换为雷珠单抗注射雷珠单抗组小鼠,注射量为1μl。雷珠单抗为罗氏公司产品(lucentis)。按照上述方法,将sirna-exo液体替换为pbs注射阴性对照组小鼠,注射量为1μl。激光造膜后第7天,血管造影拍摄,所用仪器:海德堡的显微镜(hraspectralis)。所用试剂:散瞳剂--托吡卡胺滴眼液(需提前注射,确认散瞳后再进行后续实验);造影剂-荧光素钠注射液(历设得)拍摄前一分钟腹腔注射,原液稀释三倍。造影结束2天后,散瞳后取材(n=3)。造影结果如图2,图中左中右三幅图分别表示三只不同的小鼠模型,眼球中白色圆形光斑越大,治疗效果越差,反之治疗效果越好。结果表明,vegf-1实验组、vegf-2实验组、vegf-3实验组、vegf-4实验组、vegf-5实验组、vegf-6实验组和vegf-10实验组小鼠的治疗效果显著好于阴性对照组以及vegf-opko实验组。<110>苏州吉玛基因股份有限公司、苏州吉诺瑞生物科技有限公司<120>sirna修饰物及其在抑制血管新生中的应用<160>5<170>patentinversion3.5<210>1<211>21<212>rna<213>人工序列(artificialsequence)<400>1accucaccaaggccagcactt21<210>2<211>21<212>rna<213>人工序列(artificialsequence)<400>2gugcuggccuuggugaggutt21<210>3<211>23<212>rna<213>人工序列(artificialsequence)<400>3aaccucaccaaggccagcacaua23<210>4<211>23<212>rna<213>人工序列(artificialsequence)<400>4ugugcuggccuuggugagguuug23<210>5<211>54<212>dna<213>人工序列(artificialsequence)<400>5gcagattatgcggatcaaacctcaccaaggccagcacataggagagatgagctt54当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1