促进血管生成的骨髓间充质干细胞外泌体及其制备方法和应用与流程
本发明涉及生物医学技术领域,具体涉及一种促进血管生成的骨髓间充质干细胞(bmsc)外泌体(exo)及其制备方法和应用。
背景技术:
间充质干细胞(msc)具有重要的组织修复和再生的生物学特性,其具有促进血管新生的能力,已被广泛应用于缺血性疾病等的治疗。msc促进血管新生的机制与促血管生长因子分泌及外泌体的生成有关。外泌体(exosome)是细胞经“内吞-融合-外泌”等一系列调控行为分泌到细胞外环境中的直径为40-150nm的膜性小囊泡,由源自多泡体的磷脂双层或真核细胞的质膜组成,在细胞的旁分泌作用中扮演极为重要的角色,越来越多的研究表明,间充质干细胞可通过旁分泌外泌体而发挥对组织损伤的修复作用。
hu等人(hugw,liq,niux,etal.exosomessecretedbyhuman-inducedpluripotentstemcell-derivedmesenchymalstemcellsattenuatelimbischemiabypromotingangiogenesisinmice[j].stemcellresther,2015,6(1):10)将人诱导多能干细胞(ipsc)来源的间充质干细胞外泌体移植到下肢缺血的小鼠体内,发现小鼠缺血后肢的毛细血管密度和血流灌注增加,肌肉坏死程度显著减轻,且有明显的肌组织再生;进一步研究显示,该外泌体能显著增强血管内皮细胞的增殖、迁移和成血管能力,并促进其表达一系列与血管生成密切相关的基因。血管生成是组织器官损伤后修复的前提条件,损伤的组织器官内血管生成的速度和数量决定创面愈合和组织器官修复的效果。以上研究结果充分表明,细胞旁分泌的外泌体可独立地作为一种生物活性成分应用于组织再生和修复治疗。
磁性fe3o4或γ-fe2o3纳米粒子具有超顺磁性和高饱和磁化强度,是一种磁性强、制备相对简单、生物相容性较好的磁性材料,其在磁共振成像、药物靶向载体等生物医学领域具有广阔的应用前景。具备超顺磁性的纳米粒子,在无外加磁场时,材料没有磁效应,在外加静磁场存在时,则可以展现出良好的磁性效应。同时磁性纳米粒子在降解过程中会产生fe3+,fe3+可以促进人脐静脉内皮细胞(humanumbilicalveinendothelialcells,huvec)中血管生成因子的表达,可以促进血管的形成。
因此,获得具有更好的促进成血管功能的骨髓间充质干细胞外泌体,提高组织再生和修复治疗能力以及缺血性疾病的治疗效果是人们当前的迫切愿望。
技术实现要素:
本发明的目的在于提供一种促进血管生成的骨髓间充质干细胞外泌体,其中所述外泌体为超顺磁性fe3o4或γ-fe2o3纳米颗粒或者超顺磁性fe3o4或γ-fe2o3纳米颗粒联合静磁场诱导骨髓间充质干细胞分泌的外泌体。
在本发明外泌体的一些实施方案中,所述外泌体为超顺磁性fe3o4或γ-fe2o3纳米颗粒诱导骨髓间充质干细胞分泌的外泌体,并且所述超顺磁性fe3o4或γ-fe2o3纳米颗粒的刺激浓度为25-50μg/ml,优选50μg/ml。
在本发明外泌体的一些实施方案中,所述外泌体为超顺磁性fe3o4或γ-fe2o3纳米颗粒联合静磁场诱导骨髓间充质干细胞分泌的外泌体,并且所述超顺磁性fe3o4或γ-fe2o3纳米颗粒的刺激浓度为25-50μg/ml,优选50μg/ml;所述静磁场的刺激强度为50-100mt,优选100mt。
在本发明外泌体的上述实施方案中,所述骨髓间充质干细胞为人骨髓间充质干细胞。
本发明另一个方面还提供上述外泌体的制备方法,其包括如下步骤:
1)培养骨髓间充质干细胞;
2)用上述超顺磁性纳米颗粒或上述超顺磁性纳米颗粒联合静磁场处理上述骨髓间充质干细胞;
3)骨髓间充质干细胞外泌体的提取、纯化。
在本发明上述方法的一些实施方案中,步骤1)中细胞培养的具体操作是:取第3-5代生长良好的bmsc按1×104至1×105细胞/ml,优选1×105细胞/ml密度接种于容纳有含10%fbs、1%青链霉素的α-mem完全培养基的细胞培养容器,置于5%体积co2、37℃培养箱中培养。
在本发明上述方法的一些实施方案中,步骤2)中处理细胞的具体操作是:所述培养细胞生长融合率达到70%以上时,将所述超顺磁性纳米颗粒以25-50μg/ml,优选50μg/ml浓度溶于上述α-mem完全培养基中,对细胞进行培养;或者将所述超顺磁性纳米颗粒以25-50μg/ml,优选50μg/ml浓度溶于上述α-mem完全培养基中后用50-100mt,优选100mt静磁场(smf)刺激,对细胞进行培养。
在本发明上述方法的一些实施方案中,步骤3)中外泌体提取、纯化的具体操作是:上述培养细胞生长融合率达到80%以上时,更换无血清α-mem培养液,饥饿处理24h后收集上清,按照超速离心法提取外泌体:4℃下1000×g离心30min去除细胞碎片后,吸取上清液;0.22μm滤器过滤;4℃下100000×g离心2h,弃去上清;pbs重悬,再次4℃下100000×g离心2h,弃去上清;将提取的外泌体加入pbs重悬,于-80℃冻存备用。
在本发明上述方法的一些实施方案中,所述骨髓间充质干细胞为人骨髓间充质干细胞。
本发明一个方面还提供上述外泌体在制备促进血管生成的制剂中的应用。
本发明另一个方面还提供上述外泌体在制备治疗缺血性疾病的药物中的应用。
本发明又一个方面还提供上述外泌体在制备修复患病或受损组织的药物中的应用。
有益效果
相比未经处理的骨髓间充质干细胞的外泌体,本发明提供的由骨髓间充质干细胞在超顺磁性fe3o4或γ-fe2o3纳米颗粒或者超顺磁性fe3o4或γ-fe2o3纳米颗粒联合静磁场诱导下分泌的外泌体具有显著增强血管内皮细胞增殖、迁移和成血管的能力,尤其是其中超顺磁性fe3o4或γ-fe2o3纳米颗粒联合静磁场诱导下分泌的外泌体比单纯超顺磁性fe3o4或γ-fe2o3纳米颗粒诱导下分泌的外泌体具有更好的增强血管内皮细胞增殖、迁移和成血管的能力。本发明还提供了所述骨髓间充质干细胞外泌体的制备方法,所述外泌体可用于制备促进血管生成的制剂、治疗缺血性疾病的药物和修复患病或受损组织的药物,在组织再生和修复治疗以及缺血性疾病治疗方面具有很大的应用潜力。
附图说明
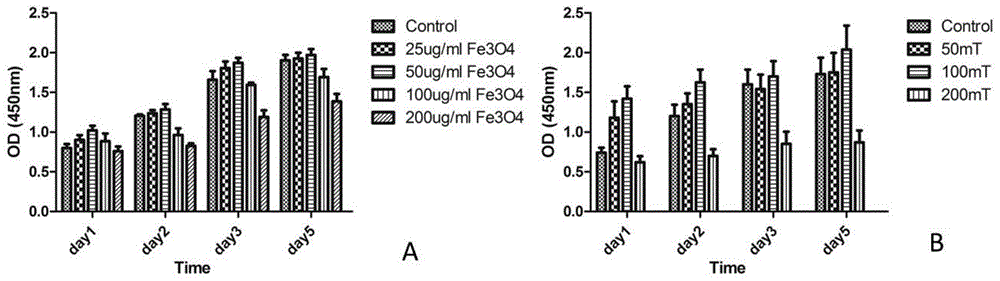
图1a所示为与对照(control)相比,不同浓度(25μg/ml、50μg/ml、100μg/ml、200μg/ml)的超顺磁性fe3o4纳米颗粒处理1-5d对人骨髓间充质干细胞(bmsc)增殖的影响。图1b所示为与对照(control,0mtsmf)相比,经50μg/ml超顺磁性fe3o4纳米颗粒处理的人骨髓间充质干细胞,进一步用不同强度的静磁场(50mt、100mt、200mtsmf)处理1-5d后,对人骨髓间充质干细胞增殖的影响。
图2a所示为透射电镜下观察到的三种外泌体bmsc-exo、bmsc-fe3o4-exo和bmsc-fe3o4-smf-exo的形态,图中外泌体呈圆形或椭圆形结构,直径约50-100nm,有完整的包膜结构(箭头所示为外泌体),内含低密度物质。图2b所示为纳米颗粒跟踪分析(nta)检测的三种外泌体bmsc-exo、bmsc-fe3o4-exo和bmsc-fe3o4-smf-exo的粒径及浓度分布,其中外泌体直径主要集中在80-120nm,极少数大于150nm。
图3所示为对照组(control,无外泌体添加的pbs对照)以及三种外泌体(bmsc-exo、bmsc-fe3o4-exo和bmsc-fe3o4-smf-exo)分别与人脐静脉内皮细胞(huvec)共培养,进行不同的人骨髓间充质干细胞外泌体的性能比较。其中,图3a所示为细胞划痕实验,划痕后24h,相对于对照组(control)的huvec,bmsc-exo组huvec已发生明显迁移,且bmsc-fe3o4-exo组和bmsc-fe3o4-smf-exo组的促迁移作用更为显著,而对照组huvec迁移较为缓慢,划痕面积较大。图3b所示为transwell侵袭实验,结果表明相对于对照组,bmsc-exo组、bmsc-fe3o4-exo组和bmsc-fe3o4-smf-exo组的促侵袭作用更强且依次增加,而对照组huvec侵袭量则较少。图3c所示为小管形成实验,结果显示huvec在这4组实验中均能形成毛细血管样结构,但在对照组中生成的管样结构较少;而且相对于对照组,在8h时bmsc-exo组、bmsc-fe3o4-exo组和bmsc-fe3o4-smf-exo组成管的长度和分支数量明显更多且依次递增。
图4a所示为细胞迁移率比较,其中bmsc-exo组的迁移率明显高于对照组(p<0.01),bmsc-fe3o4-exo组和bmsc-fe3o4-smf-exo组的迁移率也显著高于对照组,其差异具有统计学意义(p<0.001),并且bmsc-exo组、bmsc-fe3o4-exo组和bmsc-fe3o4-smf-exo组迁移率依次升高。图4b所示为细胞侵袭率比较,其中相对于对照组,bmsc-exo组、bmsc-fe3o4-smf-exo组和bmsc-fe3o4-exo组的侵袭率明显更高且依次递增,其差异具有统计学意义(p<0.05)。图4c所示为成管的平均长度比较,其中相对于对照组,8h时bmsc-exo组、bmsc-fe3o4-exo组和bmsc-fe3o4-smf-exo组成管的平均长度明显更多且依次递增,其差异有统计学意义(p<0.001)。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
本发明将人bmsc(购自americantypeculturecollection,atcc)用含10%fbs、1%青链霉素的α-mem完全培养基按1:3比例传代培养,得到第一代骨髓间充质干细胞,继续传代培养至第3代骨髓间充质干细胞。本申请实施例选用第3-5代的骨髓间充质干细胞开展实验。本发明使用商购的超顺磁性fe3o4或γ-fe2o3纳米颗粒(100nm,南京晓劢生物科技有限公司),静磁场(smf)(钕铁硼永磁材料,北京鑫昌利功能材料有限责任公司)。以下实施例中数据采用spss17.0软件系统进行处理,所得数据均值±标准差表示,两组间比较采用t检验,当p<0.05,差异有统计学意义。
实施例1:不同浓度的超顺磁性fe3o4纳米颗粒对骨髓间充质干细胞(bmsc)增殖的影响
取生长良好的第3-5代的人bmsc接种于容纳有含10%胎牛血清(fbs)、1%青链霉素的α-mem完全培养基的96孔板中,置于5%体积co2、37℃培养箱中培养,细胞的种植密度为1×104细胞/孔;相对于对照组(control),培养2d后将处理组更换含有超顺磁性fe3o4纳米颗粒的培养基,即分别加入浓度为25μg/ml、50μg/ml、100μg/ml、200μg/ml超顺磁性fe3o4纳米颗粒(100nm,南京晓劢生物科技有限公司),处理5d;然后,使用cck8法对对照组和超顺磁性fe3o4纳米颗粒处理1d、2d、3d和5d的细胞进行毒性检测。每孔加入10μl的cck8溶液和90μl的α-mem完全培养基,使用酶标仪测量各孔吸光度,cck8溶液吸收波长为450nm。
cck8细胞毒性实验发现,相对于对照组(control),使用25、50μg/ml浓度梯度的超顺磁性fe3o4纳米颗粒对bmsc未见明显毒性作用,细胞明显增殖,并且在50μg/mlfe3o4浓度下细胞增殖数目进一步增大;而100、200μg/ml浓度下的超顺磁性fe3o4纳米颗粒对细胞增殖存在抑制作用,并且在200μg/mlfe3o4浓度下细胞数目明显进一步降低(图1a),因此50μg/ml被确定为超顺磁性fe3o4纳米颗粒的最佳刺激浓度。
实施例2:不同浓度的超顺磁性γ-fe2o3纳米颗粒对骨髓间充质干细胞(bmsc)增殖的影响
本实施例的操作同实施例1,不同之处在于用超顺磁性γ-fe2o3纳米颗粒替换超顺磁性fe3o4纳米颗粒。
cck8细胞毒性实验发现,相对于对照组(control),使用25、50μg/ml浓度梯度的超顺磁性γ-fe2o3纳米颗粒对bmsc未见明显毒性作用,细胞明显增殖,并且在50μg/mlγ-fe2o3浓度下细胞增殖数目进一步增大;而100、200μg/ml浓度下的超顺磁性γ-fe2o3纳米颗粒对细胞增殖存在抑制作用,并且在200μg/mlγ-fe2o3浓度下细胞数目明显进一步降低,因此50μg/ml被确定为超顺磁性γ-fe2o3纳米颗粒的最佳刺激浓度。
实施例3:不同强度的静磁场(smf)对经超顺磁性fe3o4纳米颗粒处理的骨髓间充质干细胞增殖的影响
取生长良好的第3-5代的人bmsc接种于容纳有含10%胎牛血清、1%青链霉素的α-mem完全培养基的96孔板中,置于5%体积co2、37℃培养箱中培养,细胞的种植密度为1×104细胞/孔;培养2d后更换含有fe3o4的培养基,即加入浓度为50μg/ml的超顺磁性fe3o4纳米颗粒(100nm,南京晓劢生物科技有限公司),并分别用0mt(control)、50mt、100mt、200mt静磁场(smf)(钕铁硼永磁材料,北京鑫昌利功能材料有限责任公司)处理5d;然后,使用cck8法对smf处理1d、2d、3d和5d的细胞进行毒性检测。每孔加入10μl的cck8溶液和90μl的上述α-mem完全培养基,使用酶标仪测量各孔吸光度,cck8溶液吸收波长为450nm。
cck8细胞毒性实验发现,相对于对照组(control,0mt),经fe3o4处理后使用50、100mt静磁场(smf)对bmsc未见明显毒性作用,细胞明显增殖,并且在100mt的smf下细胞增殖数目进一步增大;而经fe3o4处理后使用200mt静磁场(smf)则对细胞增殖存在明显抑制作用(图1b)。
实施例4:不同强度的静磁场(smf)对经超顺磁性γ-fe2o3纳米颗粒处理的骨髓间充质干细胞增殖的影响
本实施例的操作同实施例3,不同之处在于用超顺磁性γ-fe2o3纳米颗粒替换超顺磁性fe3o4纳米颗粒。
cck8细胞毒性实验发现,相对于对照组(control,0mt),经γ-fe2o3处理后使用50、100mt静磁场(smf)对bmsc未见明显毒性作用,细胞明显增殖,并且在100mt的smf下细胞增殖数目进一步增大;而经γ-fe2o3处理后使用200mt静磁场(smf)则对细胞增殖存在明显抑制作用。
实施例5:骨髓间充质干细胞外泌体的制备与检测
1)骨髓间充质干细胞处理和培养
取生长良好的第3-5代的人bmsc按1×105/ml密度接种于容纳有含10%胎牛血清、1%青链霉素的α-mem完全培养基的6孔板中,置于5%体积co2、37℃培养箱中培养。待细胞生长融合率达到70-80%以上时,将细胞分为3组:对照组、fe3o4处理组、fe3o4联合静磁场(smf)处理组;对照组:用10%胎牛血清、1%青链霉素的α-mem完全培养基培养;fe3o4处理组:将超顺磁性fe3o4纳米颗粒(100nm,南京晓劢生物科技有限公司)以50μg/ml浓度溶于含体积浓度为10%胎牛血清、1%青链霉素的α-mem完全培养基中,对细胞进行培养;fe3o4联合smf处理组:将所述fe3o4超顺磁性纳米颗粒以50μg/ml浓度溶于含体积浓度为10%胎牛血清、1%青链霉素的α-mem完全培养基中,并用100mt静磁场(smf)(钕铁硼永磁材料,北京鑫昌利功能材料有限责任公司)处理5d,对细胞进行培养。
2)外泌体的制备和形态观察
上述三组bmsc细胞分别培养至达到80%融合时,更换无血清α-mem培养液,饥饿处理24h后收集上清,采用超速离心法(xnp-100,beckman,usa)提取外泌体:4℃下1000×g离心30min去除细胞碎片后,吸取上清液;0.22μm滤器过滤;4℃下100000×g离心2h,弃去上清;pbs重悬,再次4℃下100000×g离心2h,弃去上清;将提取的外泌体加入100μlpbs重悬,-80℃冻存用于后续实验。
电镜鉴定外泌体形态:取上述分离纯化外泌体悬液10μl,加入等体积平衡盐pbs溶液稀释,滴加于直径2mm载样铜网上,于室温静置1分钟后,用滤纸将多余液体轻轻吸去;用3%磷钨酸钠溶液(ph6.8)室温负染5min,用双蒸水轻轻洗一遍后室温晾干2min;于透射电镜观察并照相。
在透射电镜下观察,外泌体呈圆形或椭圆形结构,直径约50-100nm,有完整的包膜结构(箭头所示为外泌体),内含低密度物质(图2a)。
3)纳米颗粒跟踪分析(nanoparticletrackinganalysis,nta)
取各组分离纯化外泌体悬液1μl,加入等体积平衡盐pbs溶液稀释至nta画面中粒子束不超过100个。根据nanosight-ns500(zetaview,德国)记录的颗粒数,按仪器测量结束后,收集并分析报告。
nta检测外泌体的粒径及浓度分布,结果如图2b所示,外泌体直径主要集中在80-120nm,极少数大于150nm。nta结果显示bmsc-exo、bmsc-fe3o4-exo和bmsc-fe3o4-smf-exo的浓度分别为6.8×1010particles/ml、9.1×1010particles/ml和1.1×1011particles/ml。
上述结果表明,相对于对照组,fe3o4刺激和fe3o4联合smf刺激能诱导bmsc分泌更多外泌体,fe3o4处理组和fe3o4联合smf处理组分别是正常对照组分泌的外泌体(bmsc-exo)浓度的1.32和1.59倍。
实施例6:骨髓间充质干细胞外泌体的制备与检测
本实施例的操作同实施例5,不同之处在于,在超顺磁性纳米颗粒处理组和超顺磁性纳米颗粒联合静磁场(smf)处理组中,用超顺磁性γ-fe2o3纳米颗粒替换超顺磁性fe3o4纳米颗粒。
结果表明,外泌体的粒径及浓度分布与实施例5的结果类似。相对于对照组,γ-fe2o3刺激和γ-fe2o3联合smf刺激能诱导bmsc分泌更多外泌体,γ-fe2o3处理组和γ-fe2o3联合smf处理组分别是正常对照组分泌的外泌体浓度的1.26倍和1.64倍。
实施例7:不同骨髓间充质干细胞外泌体的性能比较
分别将按照实施例5方法制备的三种外泌体(bmsc-exo,bmsc-fe3o4-exo和bmsc-fe3o4-smf-exo)与人脐静脉内皮细胞(huvec)共培养。
1)细胞划痕实验:检测细胞迁移(修复)能力
取生长良好的huvec,消化离心,通过细胞计数,以3×105/ml密度接种于6孔板上,置于37℃的co2培养箱中培养;培养达到培养皿底面积的95%时,用200μl枪头在每个孔内相同位置均匀划过2道划痕,pbs冲洗3次;加入去外泌体的dmem/f12培养基后各孔分别加入100μlbmsc-exo、bmsc-fe3o4-exo、bmsc-fe3o4-smf-exo以及相同体积pbs,置于37℃的co2培养箱中培养;在0h、24h时,置于显微镜下观察拍照,细胞迁移率=(0h划痕的面积-24h划痕的面积)/0h划痕的面积×100%。
细胞划痕实验结果显示:划痕后24h,bmsc-exo组huvec已发生明显迁移,且bmsc-fe3o4-exo组和bmsc-fe3o4-smf-exo组的促迁移作用更为显著,而对照组huvec迁移较为缓慢,划痕面积较大(图3a)。定量数据显示,bmsc-exo组的迁移率明显高于对照组(p<0.01),bmsc-fe3o4-exo组和bmsc-fe3o4-smf-exo组的迁移率也显著高于对照组,其差异具有统计学意义(p<0.001),且bmsc-exo组、bmsc-fe3o4-exo组和bmsc-fe3o4-smf-exo组迁移率依次升高(图4a)。
上述结果表明,相比普通的骨髓间充质干细胞分泌的外泌体(bmsc-exo),fe3o4超顺磁性纳米颗粒以及fe3o4超顺磁性纳米颗粒联合静磁场诱导骨髓间充质干细胞分泌的外泌体(bmsc-fe3o4-exo和bmsc-fe3o4-smf-exo)具有更佳的增强血管内皮细胞的迁移修复能力,尤其是bmsc-fe3o4-smf-exo的效果最好。
2)transwell侵袭实验
将冻存于-80℃的基质胶matrigel(356234,bd)4℃过夜(24h),变成胶冻状。用无血清培养基稀释matrigel胶20倍,按每孔400ul的量将稀释好的matrigel胶铺于transwell小室内(8um孔径),铺好胶后,小室置于24孔板中,放入细胞孵箱中过夜,使基质胶完全风干。消化huvec细胞,无血清培养基洗3次,计数,配成细胞悬液。每孔加入500μl细胞悬液后,分别加入50μlbmsc-exo、bmsc-fe3o4-exo、bmsc-fe3o4-smf-exo以及相同体积pbs。下腔室中加入500μl含有20%去外泌体fbs条件培养基。37℃培养箱中孵育24h。取出transwell用pbs洗2次,5%戊二醛4℃固定。加入0.1%结晶紫染色,室温染色10min,pbs洗2次,用棉球擦去上表面细胞,显微镜下每个小室取5个随机视野计数,统计结果。
transwell侵袭实验结果显示:相对于对照组,bmsc-exo组、bmsc-fe3o4-exo组和bmsc-fe3o4-smf-exo组的促侵袭作用更强且依次增加,而对照组huvec侵袭量较少(图3b)。定量数据显示,bmsc-exo组、bmsc-fe3o4-smf-exo组和bmsc-fe3o4-exo组的侵袭率明显高于对照组,其差异具有统计学意义(p<0.05),且bmsc-fe3o4-smf-exo组侵袭迁移率最高(图4b)。
上述结果表明,相比普通的骨髓间充质干细胞分泌的外泌体(bmsc-exo),fe3o4超顺磁性纳米颗粒以及fe3o4超顺磁性纳米颗粒联合静磁场诱导骨髓间充质干细胞分泌的外泌体(bmsc-fe3o4-exo和bmsc-fe3o4-smf-exo)具有更佳的增强血管内皮细胞的迁移能力,尤其是bmsc-fe3o4-smf-exo的效果最好。
3)小管形成实验
将冻存于-80℃的基质胶matrigel(356234,bd)置于4℃冰箱中过夜,使其成为胶冻状。将胶冻状的matrigel胶铺入96孔板的孔中,每孔50μl,使其成为一小丘的形状,然后置于37℃孵箱中2h使其固化。消化huvec细胞,无血清培养基洗3次,计数,配成细胞悬液。以50μl/孔的细胞悬液滴加至matrigel胶的表面,每孔再分别加入5μlbmsc-exo、bmsc-fe3o4-exo、bmsc-fe3o4-smf-exo以及相同体积pbs,置于37℃孵箱继续培养,8h后取出细胞培养板,拍照,采用image-proplus图像分析软件计算每孔的形成小管长度(*p<0.05;**p<0.01;***p<0.001)。
小管形成实验结果显示:huvec在4组实验中均能形成毛细血管样结构,但在对照组中生成的管样结构较少。定量数据显示,相对于对照组,8h时bmsc-exo组、bmsc-fe3o4-exo组和bmsc-fe3o4-smf-exo组成管的长度和分支数量明显更多且依次递增,其差异有统计学意义(p<0.001),其中bmsc-fe3o4-smf-exo组生成的管样结构最多(图3c,图4c)。
上述结果表明,相比普通的骨髓间充质干细胞分泌的外泌体(bmsc-exo),超顺磁性fe3o4纳米颗粒以及超顺磁性fe3o4纳米颗粒联合静磁场诱导骨髓间充质干细胞分泌的外泌体(bmsc-fe3o4-exo和bmsc-fe3o4-smf-exo)具有更佳的增强血管内皮细胞的成管能力,尤其是bmsc-fe3o4-smf-exo的效果最好。
实施例8:不同骨髓间充质干细胞外泌体的性能比较
本实施例的操作同实施例7,不同之处在于,分别将实施例6制备的三种外泌体(bmsc-exo,bmsc-γ-fe2o3-exo和bmsc-γ-fe2o3-smf-exo)与人脐静脉内皮细胞(huvec)共培养。然后,参照实施例7的第1)、2)和3)部分进行实验和分析。
结果表明,相比普通的骨髓间充质干细胞分泌的外泌体(bmsc-exo),超顺磁性γ-fe2o3纳米颗粒以及超顺磁性γ-fe2o3纳米颗粒联合静磁场诱导骨髓间充质干细胞分泌的外泌体(bmsc-γ-fe2o3-exo和bmsc-γ-fe2o3-smf-exo)具有更佳的增强血管内皮细胞的增殖、迁移和成血管能力,尤其是bmsc-γ-fe2o3-smf-exo的效果最好。
实施例7-8的结果表明,相比未经处理的骨髓间充质干细胞分泌的外泌体,本发明提供的由骨髓间充质干细胞在超顺磁性fe3o4或γ-fe2o3纳米颗粒或者超顺磁性fe3o4或γ-fe2o3纳米颗粒联合静磁场诱导下分泌外泌体,具有显著增强血管内皮细胞增殖、迁移和成血管的能力;尤其是其中超顺磁性fe3o4或γ-fe2o3纳米颗粒联合静磁场诱导下分泌的外泌体,比单纯超顺磁性fe3o4或γ-fe2o3纳米颗粒诱导下分泌的外泌体具有更好的增强血管内皮细胞增殖、迁移和成血管的能力。本发明的外泌体可用于制备促进血管生成的制剂、治疗缺血性疾病的药物和修复患病或受损组织的药物,在组织再生和修复治疗以及缺血性疾病治疗方面具有很大的应用潜力。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!