一株类球红细菌及其发酵产氢方法和应用与流程
本发明属于微生物技术领域,涉及一种类球红细菌变种,特别涉及一株发酵产氢的类球红细菌及其应用。
背景技术:
随着社会的快速发展,对能源的需求日益增加,化石能源储量有限,且使用过程产生严重的污染,使得各国开始关注清洁可再生能源,其中,氢能因具有燃烧只产生水且热值高等优点备受关注。制约氢大规模使用的一个重要问题是制氢成本较高,在众多制氢方法中,微生物制氢因反应条件温和、底物广泛且廉价而备受关注。微生物制氢技术中制氢细菌可以利用纤维素类生物质的水解液来产生氢气,这使得制氢成本大大降低。花生种植面积广,产生的花生壳部分被用于肥料及饲料,部分被丢弃或燃烧,这既造成环境污染同时也浪费了资源,寻找高效的花生壳回收利用显得非常重要。如将废弃的花生壳用于微生物制氢,在解决花生壳资源回收的同时还产生清洁能源,实现变废为宝,无论对于环境还是能源安全都具有重要意义。
目前,针对花生壳高效回收能源化的研究尚处于起步阶段,提高花生壳转化为氢气的研究主要集中在以下几个方面:(1)优化花生壳水解工艺,获得高的还原糖得率;(2)分离高效光合细菌;(3)分离高效暗细菌;(4)设计及优化反应器;(5)光合细菌或暗细菌的基因改造等。其中制氢菌种产氢效率低下这一问题对花生壳水解液转化为氢气影响很大,这也成为生物制氢中的限制因素。生物发酵制氢的过程中许多因素,如碳源、氮源利用情况、产氢初始ph、产氢液的氯化钠浓度及磷酸盐用量等均会对制氢过程产生影响。因此,为了有效的利用花生壳水解液中的糖转化为氢气,获得高效的产氢细菌,特别是获得高效利用花生壳水解液等复杂底物产氢的细菌是亟待解决的问题。
类球红细菌是一种单细胞光合细菌,菌体干物质中蛋白质含量高达到60%以上,其蛋白质氨基酸组成比较齐全,细胞中还含有多种维生素,尤其是b族维生素极为丰富,vb2、叶酸、泛酸、生物素的含量也较高,同时还含有大量的类胡萝卜素、辅酶q等生理活性物质。其可以在富糖环境生长、兼性厌氧,在厌氧环境中可将单体糖类转化为氢气和二氧化碳。目前利用类球红细菌发酵产氢的不足之处在于,其产氢量和效率仍有待提高。
技术实现要素:
本发明的目的在于提供一株类球红细菌及其发酵产氢方法和应用,该类球红细菌可利用多种碳源和氮源为底物制氢,同时可以得到单细胞蛋白,具有广泛的应用价值。
为达到上述目的,本发明采用了以下技术方案:
一种用于发酵产氢的类球红细菌,该类球红细菌(rhodobactersphaeroides)的保藏编号为cgmccno.18237。
该类球红细菌能够利用多种碳源和氮源进行生长并发酵产生氢气。
所述碳源选自单糖、二糖或花生壳水解液;其中单糖选自葡萄糖、果糖、半乳糖或木糖;二糖选自蔗糖;所述氮源选自鱼粉蛋白胨、酵母浸膏、l-谷氨酸、硫酸铵或氯化铵。
该类球红细菌能够利用花生壳水解液进行生长并发酵产生氢气。
一种用于发酵产氢的类球红细菌的发酵方法,包括以下步骤:
1)将该类球红细菌(rhodobactersphaeroides)划线于meda琼脂培养基平板上,然后在20~40℃的光照培养箱中培养30~55h,得到单菌落,所述类球红细菌的保藏编号为cgmccno.18237;
2)挑取meda琼脂培养基平板上长出的单菌落,无菌操作下将单菌落移入装有meda液体培养基的培养容器中,在20~40℃的光照培养箱中培养30~55h,得到对数生长期的用于发酵产氢的类球红细菌培养菌液;
3)将用于发酵产氢的类球红细菌培养菌液分装到离心管中,在3000~6000rpm的转速下离心5~10min,倒掉上清液,得到菌体沉淀;
4)向含有菌体沉淀的离心管中加入产氢培养液并将菌体重悬,再次在3000~6000rpm的转速下离心5~10min,弃去上清液;
5)重复步骤4)1~3次,然后向含有菌体沉淀的离心管中加入产氢培养液并重悬菌体,得到作为进行产氢发酵的光合细菌菌源的重悬菌液;
6)在产氢反应器中加入产氢培养液,然后接入所述重悬菌液,使菌体终浓度以od600计达0.4~0.6;
7)将产氢反应器置于25~45℃的光照培养箱中进行发酵,直至产氢结束。
所述产氢培养液含有以下物质:单糖5~20g/l,l-谷氨酸0.1~2g/l,l-天冬氨酸0.01~0.08g/l,氯化钠0.2~2g/l,ph6.5~7.2的磷酸盐缓冲液5~20ml/l,微量元素溶液10~30ml/l,及维生素浓缩溶液0.5~3ml/l,溶剂为水;其中,单糖可用花生壳水解液替换,花生壳水解液用量按照其所含还原糖计算为2.0~6.0g/l;
磷酸盐缓冲液含有以下物质:kh2po450.0~70.0g/l,及k2hpo480.0~120.0g/l,溶剂为水,ph值6.5-7.2;
微量元素溶液含有以下物质:氨三乙酸5~15g/l,mgso4·7h2o20~35g/l,feso4·7h2o0.01~1.2g/l,(nh4)6mo7o24·4h2o0.001~0.015g/l,cacl2·2h2o1~4g/l,及母液30~60ml/l,溶剂为水;
每100ml母液中含有以下物质:znso4·7h2o0.5~1.5g,edta180~350mg,feso4·7h2o300~700mg,h3bo35~15mg,mnso4·h2o80~200mg,cuso4·5h2o20~50mg,及co(no3)2·6h2o10~30mg,溶剂为水;
每250ml维生素浓缩溶液中含有以下物质:盐酸硫胺5.0~15.0mg,烟酸15~30mg,及生物素0.1~1.0μg,溶剂为水。
与现有技术相比,本发明具有以下有益的技术效果:
本发明分离获得的一株高效分解生物质产生氢气的菌株(ldq10),其菌落具有颜色为红色、边缘整齐、中间凸起、肥厚湿润及不透明等特点;菌体形状为长杆状,以二分裂方式繁殖。序列比对分析发现该新型菌株与已知的类球红细菌的相应序列的相似性为99.0%,初步认定其属于类球红细菌(rhodobactersphaeroides)变种。
本发明提供的用于发酵产氢的类球红细菌(ldq10),能以多种无机及有机碳源和氮源作为能源进行生长且产生高浓度氢气和低浓度的二氧化碳。将其用于生物质水解液及工业废水产氢发酵,较之于只能发酵生物质水解液中的葡萄糖的光合细菌,可以降低生物质水解液及工业废水发酵制氢的成本,利于增加生物制氢的竞争性及市场推广力。
本发明提供的用于发酵产氢的类球红细菌(ldq10),具有利用多种有机及无机氮源快速生长的能力,这一特点用于单细胞蛋白生产,较之于普通细菌,无需添加有机氮源,从而能够降低生产成本,生产得到的单细胞蛋白可作为家禽饲料等应用。
本发明提供的用于发酵产氢的类球红细菌的发酵方法,具有成本低廉、操作简单、菌体生长快、氢气产量高、产速快等优点,并可同时得到价值较高的单细胞蛋白,而且适用于工业化规模生产。
进一步的,使用产氢培养液进行菌株(ldq10)的发酵培养能够很好的满足菌体对各种营养物质的需求,使得产氢量和产氢效率都大幅度提升。
附图说明
图1为类球红细菌(rhodobactersphaeroides)ldq10在meda琼脂培养基上的菌落形态图。
图2为类球红细菌(rhodobactersphaeroides)ldq10在meda琼脂培养基上的菌体的显微图片。
图3为类球红细菌(rhodobactersphaeroides)ldq10在meda培液体养基中培养的图片。
图4为类球红细菌(rhodobactersphaeroides)ldq10在培养管离心后菌体的图片。
图5为基于mega5.016srrna序列的系统进化树。
图6为本发明使用的发酵制氢反应实验装置。
图7为不同碳源对类球红细菌(rhodobactersphaeroides)ldq10产氢影响的测试结果图,其中(a)为产氢量与碳源的关系图,(b)为生物量、底物转化率和发酵结束ph值与碳源的关系图;1.纤维素;2.葡聚糖;3.纤维二糖;4.蔗糖;5.α-乳糖;6.d-果糖;7.d-半乳糖;8.鼠李糖;9.麦芽糖;10.葡萄糖;11.d-木糖。
图8为不同氮源对类球红细菌(rhodobactersphaeroides)ldq10产氢影响的测试结果图;其中(a)为产氢量与氮源的关系图,(b)为生物量、底物转化率和发酵结束ph值与氮源的关系图。
图9为产氢液不同初始ph对类球红细菌(rhodobactersphaeroides)ldq10产氢影响的测试结果图;其中(a)为产氢量与初始ph的关系图,(b)为生物量、底物转化率和发酵结束ph值与初始ph的关系图。
图10为产氢液不同盐度对类球红细菌(rhodobactersphaeroides)ldq10产氢影响的测试结果图;其中(a)为产氢量与产氢液盐度的关系图,(b)为生物量、底物转化率和发酵结束ph值与产氢液盐度的关系图。
图11为产氢液不同磷酸盐用量对类球红细菌(rhodobactersphaeroides)ldq10产氢影响的测试结果图,其中(a)为产氢量与磷酸盐用量的关系图,(b)为生物量、底物转化率和发酵结束ph值与磷酸盐用量的关系图。
图12为类球红细菌以花生壳水解液(提供还原糖)为碳源的产氢测试结果,产氢液中不同还原糖浓度对类球红细菌(rhodobactersphaeroides)ldq10产氢影响的测试结果图,其中(a)为产氢量与还原糖浓度的关系图,(b)为生物量、底物转化率和发酵结束ph值与还原糖浓度的关系图。
具体实施方式
下面结合附图和实施例对本发明做进一步的详细说明,所述实施例是对本发明的解释,而不是对本发明保护范围的限制。
1.培养基及产氢培养液配方:
本实验中所用培养基及产氢培养液中的水均为双蒸水,共用溶液包括:
磷酸盐缓冲液(1l):kh2po450.0~70.0g/l,及k2hpo480.0~120.0g/l,溶剂为水,ph值6.5-7.2。
微量元素溶液(1l):氨三乙酸5~15g/l,mgso4·7h2o20~35g/l,feso4·7h2o0.01~1.2g/l,(nh4)6mo7o24·4h2o0.001~0.015g/l,cacl2·2h2o1~4g/l,及母液30~60ml/l,溶剂为水;
母液(100ml):znso4·7h2o0.5~1.5g,edta180~350mg,feso4·7h2o300~700mg,h3bo35~15mg,mnso4·h2o80~200mg,cuso4·5h2o20~50mg,及co(no3)2·6h2o10~30mg,溶剂为水;
维生素浓缩溶液(250ml)中含有以下物质:盐酸硫胺5.0~15.0mg,烟酸15~30mg,及生物素0.1~1.0μg,溶剂为水。
1)产氢培养液,其组成为:单糖5~20g/l,l-谷氨酸0.1~2g/l,l-天冬氨酸0.01~0.08g/l,氯化钠0.2~2g/l,kh2po4-k2hpo45~20ml/l,微量元素溶液10~30ml/l,维生素浓缩溶液0.5~3ml/l,溶剂为水。
2)meda液体培养基:丁二酸钠2.0g,硫酸铵0.5g,l-谷氨酸0.1g,l-天冬氨酸0.04g,氯化钠1g,水960ml,ph值7.2,121℃湿热灭菌30min,过滤加入kh2po4-k2hpo45~20ml/l,微量元素溶液10~30ml/l,维生素浓缩溶液0.5~3ml/l。
3)meda琼脂培养基:丁二酸钠2.0g,硫酸铵0.5g,l-谷氨酸0.1g,l-天冬氨酸0.04g,氯化钠1g,水960ml,琼脂20g,ph值7.2,121℃湿热灭菌30min,过滤加入kh2po4-k2hpo45~20ml/l,微量元素溶液10~30ml/l,维生素浓缩溶液0.5~3ml/l。
2.菌源采集和富集培养:
在陕西科技大学科大湖荷花池、陕西科技大学南门排水沟、陕西科技大学后街排水沟、西安工业大学荷花池、西安工业大学湖、西安医学院湖、陕西科技大学污水处理站进水口、陕西科技大学污水处理站厌氧池、陕西科技大学污水处理站曝气池采集水样,这些水样为分离细菌的混合菌源。
配制菌源富集培养基(meda液体培养基)分装入80ml/100ml血清瓶,冷却至室温,之后在无菌工作台上向每个80ml的培养基中加入20ml的水样,拧紧瓶盖放于光照培养箱中富集培养。
所得到的富集培养物中包含了富集得到的混合菌源。
3.用于发酵产氢的类球红细菌的初筛:
将富集培养物以不同的梯度稀释并涂布在meda琼脂培养基的平板上,放于光照培养箱中30℃恒温培养,不定时观察平板上菌落的生长情况。
挑取菌落形态不同的单菌落在meda琼脂培养基上进行划线纯化,同时依据形态进行编号。划线纯化三次之后,获得的纯菌种在meda液体培养基中进行富集培养,48h后以培养物为菌源,离心后采用产氢培养液洗涤,洗涤后在od600nm处测吸光度,计算接种量,控制终接种物od600nm=0.5进行产氢测试。所获得的23株纯细菌中有一株菌株产氢效果最佳,该菌株编号为ldq10(首次分离时间2018年11月)。
4.菌株ldq10的形态学鉴定:
为了对该菌株进行分类,首先对分离的菌株ldq10进行了基本的形态学(菌落形态和细胞形态)鉴定。具体方法和结果如下:
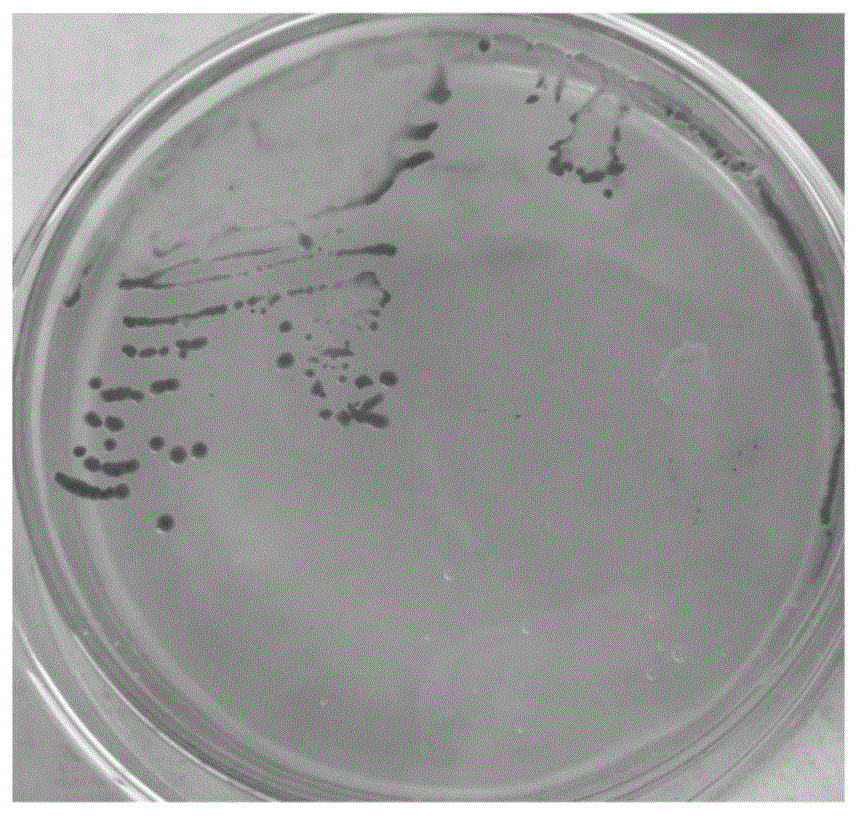
按照规范操作,稀释涂布法接种菌株ldq10于meda琼脂培养基上,30℃培养2天后观察单菌落形态,如图1所示,可见菌落呈红色,菌落边缘整齐,湿润、菌落中央凸起不透明。显微镜下观察培养物的形态,如图2所示,可见该菌株细胞呈杆状,可以进行二分裂繁殖。菌株ldq10在meda液体培养基中的培养物如图3所示,可以看到在管子中存在大量的红色菌体,细菌培养物经离心后的菌体沉淀如图4所示,可以看到大量红色菌体沉淀,结合图3和图4,发现菌株ldq10的菌体生长速度很快。
5.菌株ldq10的分子生物学分类鉴定:mega5.016srrna序列分析。
16srrna基因是细菌上编码rrna相对应的dna序列,存在于所有细菌的基因组中。16srna即16sribosomalrna,是原核核糖体30s小亚基的组成部分。16srrna具有高度的保守性和特异性并且该基因序列足够长(包含约50个功能域)。
将菌株ldq10采用通用引物27f(5'-agagtttgatcctggctcag-3')和1492r(5'-tacggttaccttgttacgactt-3')进行pcr扩增,获得1401bp的16srrna的片段并送上海生工进行pcr产物的测序,获得序列如seq.id.no.1所示。
用ncbi的blast分析工具,将序列与genbank数据库中的其他dna序列进行序列比对分析,发现该序列与多株已知的类球红细菌对应序列相似性达99%。用mega5.0软件构建依赖于序列的系统进化树,并计算菌株间的序列遗传距离,结果如图5所示。经比对后发现,菌株ldq10,即图5中命名为rhodobactersphaeroidesldq10的比对菌株,与已知的rhodobactersphaeroideshj的16srrna序列相似性高达99.0%,并未找到与该菌株完全一致的细菌,而图5中涉及的菌株全部属于光合细菌。由此推定菌株ldq10是光合细菌中类球红细菌(rhodobactersphaeroides)的一个新变种。
以上菌株ldq10已于2019年7月16日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址:北京市朝阳区北辰西路1号院3号),保藏编号为cgmccno.18237,分类命名为类球红细菌(rhodobactersphaeroides)。
6.类球红细菌菌株ldq10的发酵方法:
具体步骤为:
1)取保存于-80℃冰箱中的类球红细菌菌株ldq10(cgmccno.18237)冻存液,取少量划线于meda琼脂培养基平板上,在20~40℃的光照培养箱中培养30~55h;
2)挑取meda琼脂培养基上长出来的单菌落,于装有50ml的meda液体培养基的100ml血清瓶中,在20~40℃的光照培养箱中培养30~55h,得到培养好的用于发酵产氢的类球红细菌培养液;
3)取培养好的用于发酵产氢的类球红细菌培养液,将其放入50ml离心管中,在3000~6000rpm的转速下离心5~10min,倒掉上清液;
4)然后向离心管中加入25ml的产氢培养液并将菌体重悬,之后于3000~6000rpm的转速下离心5~10min,弃去上清液;
5)重复步骤4)1~3次,然后向每支弃上清的离心管中加入产氢培养液10~40ml并重悬菌体,得到重悬菌液(od600=0.6~1.0),将重悬菌液作为接种菌源;
6)在体积为20ml的产氢反应器(图6)中加入4.0ml的产氢培养液,之后加入步骤5)中所获得的接种菌源,控制所得产氢液中菌体终浓度od600nm=0.5;
7)在产氢反应器的顶部套入4cm长的无菌硅胶管并加上止水夹。
8)然后将产氢反应器放于恒温光照培养箱中,在25~45℃的温度下光照培养,直至产氢结束,整个产氢周期最大为168h。
7.类球红细菌菌株ldq10利用多种碳源发酵产氢能力的测试:
对于产氢菌株来说,底物的利用类型很重要,特别是对于复杂的碳源的利用能力。因此,测试了单糖(葡萄糖、果糖、半乳糖、鼠李糖、木糖)、二糖(纤维二塘、乳糖、麦芽糖、蔗糖),多糖(葡聚糖、纤维素),无机氮源(硫酸铵、氯化铵)和有机氮源(鱼粉蛋白胨、酵母浸膏、l-谷氨酸)对类球红细菌菌株ldq10(cgmccno.18237)产氢的影响。在产氢液初始ph为7.2、温度为30℃,碳源浓度为10g/l的条件下,不同碳源对类球红细菌菌株ldq10(cgmccno.18237)产氢影响的测试结果如图7所示,结果表明,d-果糖产氢量最大,为2954.06±102.89ml/l,最大产氢速率为41.73±5.71ml/(l·h),延迟时间为10.48h。葡萄糖产氢量次之,为2717.05±18.20ml/l,最大产氢速率为55.02±2.33ml/(l·h),延迟时间为5.88h。d-木糖作为碳源的产氢量为2584.72±10.89ml/l,最大产氢速率为78.47±2.80ml/(l·h),延迟时间为13.51h。蔗糖的产氢量位居第四位,其他糖类产氢量很少或不产生氢气,但菌体仍存活及生长。由于废弃物和废水的组成中有很多均为上述测试物质,因此,以上结果表明类球红细菌菌株ldq10(cgmccno.18237)在利用生物废弃物和废水进行发酵产氢时具有很好的潜力。
为了验证类球红细菌菌株ldq10(cgmccno.18237)降解葡萄糖发酵产氢能力及最适合条件,以下采用图6所示的发酵制氢反应装置进行产氢测试,通过注射器上塞子所在的刻度来获得产生气体的体积。通过气相色谱仪对产氢反应器的气体进行分析获得氢气的浓度,从而获得产生氢气的总体积。发酵产氢结束,从注射器中采集样品,测试菌体干重、发酵液最终ph值及底物转化率。
8.氮源对类球红细菌菌株ldq10发酵产氢的影响:
在产氢培养液中的氮源采用无机氮源和有机氮源时分别进行了测试(以葡萄糖为碳源),结果如图8所示。结果表明,氮源对于类球红细菌菌株ldq10(cgmccno.18237)的产氢有很大的影响。氮源为l-谷氨酸时,类球红细菌菌株ldq10(cgmccno.18237)的产氢量最大为2717.05±18.20ml/l,最大产氢速率为55.02±2.33ml/(l·h),延迟时间为5.88h。鱼粉蛋白胨为氮源时,类球红细菌菌株ldq10(cgmccno.18237)的产氢量最大为2086.77±62.78ml/l,最大产氢速率为23.77±2.15ml/(l·h),延迟时间为7.69h。酵母浸膏为氮源时,类球红细菌菌株ldq10(cgmccno.18237)产氢量最大为1894.58±38.66ml/l,最大产氢速率为23.65±1.64ml/(l·h),延迟时间为8.79h。硫酸铵和氯化铵为氮源时,类球红细菌菌株ldq10(cgmccno.18237)不产生氢气,但菌体仍可存活且生长。通过实验发现类球红细菌菌株ldq10(cgmccno.18237)以l-谷氨酸为氮源时的产氢量最高,产氢速率最大,延迟时间最短,因此,l-谷氨酸是最适合类球红细菌菌株ldq10(cgmccno.18237)发酵制氢的氮源。此外,l-谷氨酸、鱼粉蛋白胨和酵母浸膏均属于有机氮源,但产氢效果均优于硫酸铵和氯化铵这两种无机氮源。这些结果也显示了类球红细菌菌株ldq10(cgmccno.18237)可以利用多种氮源产氢,具有很大的工业化应用潜能。
9.ph值对类球红细菌菌株ldq10发酵产氢的影响:
产氢液的初始ph值调节(用盐酸或氢氧化钠调节)范围为5.0~10.0(以葡萄糖为碳源,l-谷氨酸为氮源)。结果如图9所示。结果表明,ph值对于类球红细菌菌株ldq10(cgmccno.18237)发酵制氢有很大的影响,当产氢液的初始ph从5.0增加到8.0时,产氢量也逐渐增加,产氢液初始ph为8.0的产氢量为4536.66±46.45ml/l,获得最大的产氢量(后续实验产氢液初始ph均选取8.0)。当初始ph从8.0继续增加至10.0时,产氢量呈现降低趋势,当初始ph为10.0时,产氢量为3992.12±29.05ml/l,与初始ph为8.0时的产氢量相比降低12.0%,过低或过高的产氢液初始ph不仅对产氢酶系,而且对类球红细菌菌株ldq10(cgmccno.18237)的生长产生了抑制作用。
10.盐度(nacl)对类球红细菌菌株ldq10发酵产氢的影响:
如图10所示(以葡萄糖为碳源,l-谷氨酸为氮源),当产氢培养液的盐度从0.0g/l增加到0.5g/l时,利用类球红细菌菌株ldq10(cgmccno.18237)发酵产氢的产氢量从3874.16±75.01ml/l增加到4536.66±46.45ml/l,当盐度为0.5g/l时,获得最大的产氢量(后续实验产氢液盐度选取0.5g/l)。当盐度继续增加时,产氢量呈现降低趋势,当盐度为12.0g/l时,产氢量为2115.97±82.82ml/l,与盐度为0.5g/l时的产氢量相比降低了53.36%,过低或过高的盐度会对细菌的渗透压产生影响,进而影响菌体正常形态,对发酵产氢产生抑制。
11.磷酸盐用量对类球红细菌菌株ldq10发酵产氢的影响:
如图11所示(以葡萄糖为碳源,l-谷氨酸为氮源),当产氢培养液中的磷酸盐用量从0.0ml/l增加到20.0ml/l时,利用类球红细菌菌株ldq10(cgmccno.18237)发酵产氢的产氢量从1534.17±6.49ml/l增加到4829.05±30.29ml/l,当磷酸盐用量为20.0ml/l时,获得最大的产氢量(后续实验产氢液磷酸盐用量选取20.0ml/l)。当磷酸盐用量继续增加时,产氢量呈现降低趋势,当磷酸盐用量为60.0ml/l时,产氢量为3403.93±48.15ml/l,与磷酸盐用量为20.0ml/l时的产氢量相比降低了29.51%,过低或过高的磷酸盐用量对菌体的渗透压产生影响,进而影响菌体正常形态、生长,对发酵产氢产生抑制。
12.还原糖浓度对类球红细菌菌株ldq10发酵产氢的影响:
利用花生壳水解液发酵制氢时,花生壳水解液作为碳源(替换产氢培养液的单糖成分),花生壳水解液用量按照其所含还原糖计算为2.0~6.0g/l。如图12所示,当产氢培养液中的还原糖浓度从2.0g/l增加到6.0g/l时,利用类球红细菌菌株ldq10(cgmccno.18237)发酵产氢的产氢量从0.00±0.00ml/l增加到2765.43±19.19ml/l,当还原糖浓度为6.0g/l时,获得最大的产氢量。当还原糖浓度继续增加时,产氢量呈现降低趋势,当还原糖浓度为8.0g/l时,产氢量为1313.46±5.45ml/l,与还原糖浓度为6.0g/l时的产氢量相比降低了52.50%,过低或过高的还原糖浓度对菌体的渗透压产生影响,进而影响菌体正常形态、生长,对菌体发酵产氢产生抑制。
本发明分离的产氢菌株ldq10(cgmccno.18237),是一株嗜温的、兼性厌氧的类球红细菌,并且,能够利用许多碳源和氮源产氢,属于类球红细菌的一个新变种。其最优化的产氢条件是:碳源为葡萄糖,氮源为l-谷氨酸,产氢液初始ph为8.0,盐度为0.5g/l,磷酸盐用量为20ml/l,此时可获得最大产氢量为4829.05±30.29ml/l。以花生壳水解液为底物制氢的最优化产氢条件是:还原糖为6.0g/l,氮源为l-谷氨酸,产氢液初始ph为8.0,盐度为0.5g/l及磷酸盐用量为20ml/l,此时可获得最大产氢量为2765.43±19.19ml/l。
上述类球红细菌菌株ldq10能够应用于以下几个方面,且比现有菌株具有更显著的优势:首先,该菌株能利用多种自然界中常见并且难以被多数菌株利用的碳源进行菌体生长和发酵制氢,可以更加充分的降解纤维素生物质水解液中的还原糖(主要成分葡萄糖和木糖),使得底物利用率更高,氢气产率更高,因此显著地降低发酵成本。其次,该菌株在耗氧条件下能够高效降解葡萄糖产生氢气和二氧化碳,同时产生单细胞蛋白,因此,可以作为单细胞蛋白的生产菌株。再次,该菌株在耗氧条件下能够高效降解花生壳水解液产生氢气和二氧化碳,同时产生单细胞蛋白。因此,可以作为利用花生壳水解液的生产菌株。
总之,本发明分离的产氢菌株ldq10(cgmccno.18237)不仅可利用葡萄糖高效发酵制氢,还可利用自然界常见且难以被大多数微生物利用的碳源及氮源发酵制氢,在发酵制氢的同时会产生可作为饲料的单细胞蛋白。该菌株为多功能型类球红细菌菌株,可以应用于生物质产氢发酵、单细胞蛋白的生产,可以将在自然界大量存在的废弃生物质,如农作物秸秆、树叶通过发酵制氢得到有效转化和利用,具有很高的工业应用价值。
<110>陕西科技大学
<120>一株类球红细菌及其发酵产氢方法和应用
<160>3
<210>1
<211>1401
<212>dna
<213>rhodobactersphaeroides
<400>1
ggctcagaatgaacgctggcggcaggcctaacacatgcaagtcgagcgaagtcttcggac60
ttagcggcggacgggtgagtaacgcgtgggaacgtgccctttgcttcggaatagccccgg120
gaaactgggagtaataccgaatgtgccctgcgggggaaagatttatcggcaaaggatcgg180
cccgcgttggattaggtagttggtggggtaatggcctaccaagccgacgatccatagctg240
gtttgagaggatgatcagccacactgggactgagacacggcccagactcctacgggaggc300
agcagtggggaatcttagacaatgggcgcaagcctgatctagccatgccgcgtgatcgat360
gaaggccttagggttgtaaagatctttcaggtgggaagataatgacggtaccaccagaag420
aagccccggctaactccgtgccagcagccgcggtaatacggagggggctagcgttattcg480
gaattactgggcgtaaagcgcacgtaggcggatcggaaagtcagaggtgaaatcccaggg540
ctcaaccctggaactgcctttgaaactcccgatcttgaggtcgagagaggtgagtggaat600
tccgagtgtagaggtgaaattcgtagatattcggaggaacaccagtggcgaaggcggctc660
actggctcgatactgacgctgaggtgcgaaagcgtggggagcaaacaggattagataccc720
tggtagtccacgccgtaaacgatgaatgccagtcgtcgggcagcatgctgttcggtgaca780
cacctaacggattaagcattccgcctggggagtacggccgcaaggttaaaactcaaagga840
attgacgggggcccgcacaagcggtggagcatgtggtttaattcgaagcaacgcgcagaa900
ccttaccaacccttgacatggcgatcgcggttccagagatggttccttcagttcggctgg960
atcgcacacaggtgctgcatggctgtcgtcagctcgtgtcgtgagatgttcggttaagtc1020
cggcaacgagcgcaacccacgtccttagttgccagcattcagttgggcactctagggaaa1080
ctgccggtgataagccggaggaaggtgtggatgacgtcaagtcctcatggcccttacggg1140
ttgggctacacacgtgctacaatggcagtgacaatgggttaatcccaaaaagctgtctca1200
gttcggattggggtctgcaactcgaccccatgaagtcggaatcgctagtaatcgcgtaac1260
agcatgacgcggtgaatacgttcccgggccttgtacacaccgcccgtcacaccatgggaa1320
ttggttctacccgaaggcggtgcgccaacctcgcaagaggaggcagccgaccacggtagg1380
atcagtgactggggtgaagtc1401
<210>2
<211>20
<212>dna
<213>人工序列
<400>2
agagtttgatcctggctcag20
<210>3
<211>22
<212>dna
<213>人工序列
<400>3
tacggttaccttgttacgactt22
- 还没有人留言评论。精彩留言会获得点赞!