非对称结构5-烷氧基-2,3′-联噻吩及溴代衍生物的制备方法与流程
本发明涉及有机化合物的制备领域,具体涉及一种非对称结构5-烷氧基-2,3′-联噻吩及溴代衍生物的制备方法。
背景技术:
近年来,联噻吩作为一种重要的合成中间体,由于在有机电致发光材料、合成医药、光敏性农药和染料等领域的广泛应用而备受关注。联噻吩共有三种同分异构体:2,2′-联噻吩、3,3′-联噻吩和2,3′-联噻吩,它们的结构式如下:
其中,2,2′-联噻吩,3,3′-联噻吩均具有对称结构,易于合成及后续衍生化,因而相关研究报道较多。如申请号为200810060165.2、专利名称为一种5,5′-二溴-2,2′-联噻吩的合成方法,利用2-溴噻吩为原料,以pd/c为催化剂,以agno3和kf为添加剂,在水和二甲亚砜体系溶剂中,于30~100℃反应4~20h,反应结束后反应液经分离纯化得式(i)所示的5,5′-二溴-2,2′-联噻吩,该专利制备的溴代联噻吩为对称结构,且催化剂为贵金属催化剂,成本高。
2,3′-联二噻吩作为唯一一种具有非对称结构的联噻吩,以其为单体进行衍生化或聚合可以得到多种主链噻吩连接方式不同、功能特异的噻吩衍生物。但是到目前为止,以2,3′-联噻吩为结构单元的噻吩衍生物报道很少,究其原因在于2,3′-联噻吩含有3个α位和3个β位,活性位点较多,并且α位活性大于β位活性,因而选择性的对α位和β位进行修饰在合成上具有较大的挑战性。目前已报道的极少量2,3′-联噻吩衍生物产品价格极其昂贵,如aldrich公司的3-溴-2,3′-联噻吩产品,价格为3310元/25mg;百灵威科技有限公司的5-羧基-2,3′-联二噻吩价格为9350元/1g,极大限制的2,3′-联噻吩衍生物在有机功能材料方面的应用。
技术实现要素:
本发明提出了一种非对称结构5-烷氧基-2,3′-联噻吩及其溴代衍生物的制备方法,该方法产率高、选择性好,所合成的产物均未见报道,为2,3′-联噻吩及其衍生物在有机功能材料方面的应用提供了重要的合成中间体。
实现本发明的技术方案是:
非对称结构5-烷氧基-2,3′-联噻吩的制备方法,步骤如下:将2-溴-5-烷氧基噻吩与3-噻吩硼酸在催化剂和碱的作用下,通过suzuki偶联反应制得非对称结构5-烷氧基-2,3′-联噻吩。
所述催化剂为四三苯基膦钯,四三苯基膦钯溶于四氢呋喃和水中,所述碱为无水碳酸钾或无水碳酸钠;所述2-溴-5-烷氧基噻吩、3-噻吩硼酸、催化剂和碱的物质的量之比为1:(1~3):(0.02~0.05):(1.5~3);反应温度为80~100℃,反应时间为9~15h;2-溴-5-烷氧基噻吩结构中,烷氧基c原子个数不超过12个。
制备的非对称结构5-烷氧基-2,3′-联噻吩,结构式如下:
将非对称结构5-烷氧基-2,3′-联噻吩溶于氯仿与乙酸的混合溶剂中,缓慢加入n-溴代丁二酰亚胺,制得2′,4-二溴-5-烷氧基-2,3′-联噻吩或2′-溴-5-烷氧基-2,3′-联噻吩。
所述非对称结构5-烷氧基-2,3′-联噻吩和n-溴代丁二酰亚胺的摩尔比为1:(2~3),氯仿与乙酸的体积比为(3~8):1,反应温度为0~25℃,反应时间为1~3h,制备得到2′,4-二溴-5-烷氧基-2,3′-联噻吩。
制备的溴代衍生物的结构,结构式如下:
所述非对称结构5-烷氧基-2,3′-联噻吩和n-溴代丁二酰亚胺的摩尔比为1:(1~1.5),氯仿与乙酸的体积比为(3~8):1,在-25℃下反应1~4h,制备得到2′-溴-5-烷氧基-2,3′-联噻吩。
制备的溴代衍生物的结构,结构式如下:
将2′,4-二溴-5-烷氧基-2,3′-联噻吩在惰性气体保护及有机溶剂存在的条件下,加入甲基溴化镁在70℃~80℃反应2~4h,制备得到4-溴-5-烷氧基-2,3′-联噻吩,所述4-溴-5-烷氧基-2,3′-联噻吩的结构式如下:
所述2′,4-二溴-5-烷氧基-2,3′-联噻吩和甲基溴化镁的摩尔比为1:(1~3),有机溶剂为无水四氢呋喃,反应先在室温反应0.5h,然后升温至70℃~80℃反应2~4h。
本发明的有益效果是:2,3′-联噻吩是一种具有非对称结构的联噻吩,含有3个α位和3个β位,活性位点较多,并且α位活性大于β位活性,因而选择性的对α位和β位进行修饰在合成上具有较大的挑战性。本发明以2-溴-5-烷氧基噻吩为原料,与3-噻吩硼酸通过suzuki反应,高产率的得到一种2,3′-联噻吩衍生物—5-烷氧基-2,3′-联噻吩。烷氧基的引入,使得5-烷氧基-2,3′-联噻吩分子中剩余的2个α位和3个β位的活性有了明显的差异,通过控制n-溴代丁二酰亚胺用量和反应温度,可高选择性、高产率的制备其单溴代和双溴代衍生物。此外,5-烷氧基-2,3′-联噻吩的双溴代衍生物在甲基溴化镁的作用下,可高选择性、高产率的得到另外一种单溴代产物。需要特别指出的是,所合成的5-烷氧基-2,3′-联噻吩溴代衍生物中溴原子易于参与后续衍生化反应,从而可制备出一系列结构新颖,功能各异的2,3′-联噻吩类有机功能材料。本发明所合成的一系列2,3′-联噻吩衍生物均未见报道,为2,3′-联噻吩及其衍生物在有机功能材料方面的应用提供了重要的合成中间体。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
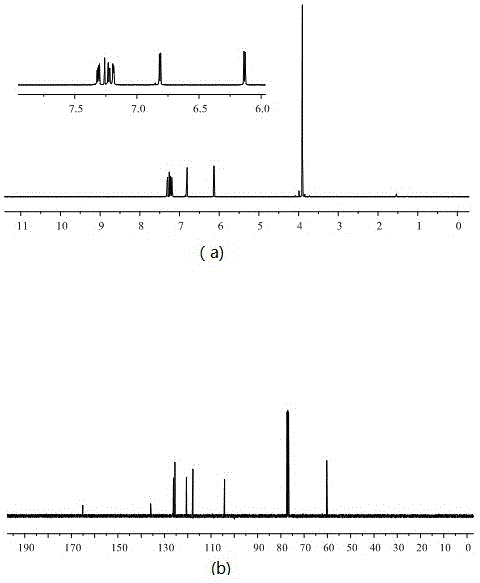
图1为实施例1制备的5-甲氧基-2,3′-联噻吩的1h谱图(a)、13c谱图(b)。
图2为实施例1制备的2′,4-二溴-5-甲氧基-2,3′-联噻吩的1h谱图(a)、13c谱图(b)。
图3为实施例1制备的2′-溴-5-甲氧基-2,3′-联噻吩的1h谱图(a)、13c谱图(b)。
图4为实施例1制备的4-溴-5-甲氧基-2,3′-联噻吩的1h谱图(a)、13c谱图(b)。
图5为实施例2制备的2′,4-二溴-5-(3-溴丙基)-2,3′-联噻吩的1h谱图(a)、13c谱图(b)。
图6为实施例2制备的2′-溴-5-(3-溴丙基)-2,3′-联噻吩的1h谱图(a)、13c谱图(b)。
图7为实施例2制备的4-溴-5-(3-溴丙基)-2,3′-联噻吩的1h谱图(a)、13c谱图(b)。
具体实施方式
下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有付出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
非对称结构5-甲氧基-2,3′-联噻吩的制备,步骤如下:
(1)5-甲氧基-2,3′-联噻吩的制备
在50mlschlenk中依次加入2-溴-5-甲氧基噻吩、(0.3573g,1.85mmol),3-噻吩硼酸(0.2845g,2.22mmol,1.2eq),无水碳酸钾(0.6395g,4.63mmol,2.5eq),四三苯基膦钯(0.1069g,0.09mmol,0.05eq),抽真空置换三次氩气后,向体系中加入5ml四氢呋喃,2ml水(经过除氧处理)置于油浴中缓慢升温至85℃,搅拌下回流反应9h。降至室温,点板,无原料2-溴-5-甲氧基噻吩,将反应液转移入分液漏斗中,用二氯甲烷萃取,合并有机相,用水洗涤,加无水mgso4干燥,过滤,浓缩得粗品。将粗品进行柱层析,得纯品5-甲氧基-2,3′-联噻吩,0.3052g,产率:84%。
1hnmr(cdcl3,400mhz):δ7.31(dd,j=5.04hz,2.29hz,1h),7.22(dd,j=5.04hz,1.24hz,1h),7.19(dd,j=2.29hz,1.24hz,1h),6.81(d,j=3.92hz,1h),6.13(d,j=3.92hz,1h);13cnmr(cdcl3,100mhz):δ165.10,135.96,126.14,125.51,120.57,117.78,117.77,104.21,60.27。
(2)2′,4-二溴-5-甲氧基-2,3′-联噻吩的制备
将5-甲氧基-2,3′-联噻吩(0.1330g,0.68mmol)溶于30ml氯仿/冰醋酸(v/v=8/1)的混合溶剂中,搅拌下分批加入n-溴代丁二酰亚胺(0.2424g,1.36mmol,2.0eq),0℃反应4h。加入35ml水将反应猝灭,分液,水相用二氯甲烷萃取,有机相依次用水,饱和碳酸氢钠溶液和水洗涤,无水硫酸镁干燥,过滤,除去溶剂,柱层析分离得白色固体化合物2,0.2184g,产率91%。
1hnmr(cdcl3,400mhz):δ7.26(d,j=4.0hz,1h),7.11(s,1h),7.03(d,j=4.0hz,1h),4.01(s,3h);13cnmr(cdcl3,100mhz):δ158.49,133.21,127.48,126.37,123.28,107.29,91.60,62.24。
(3)2′-溴-5-甲氧基-2,3′-联噻吩
将5-甲氧基-2,3′-联噻吩(0.2002g,1.02mmol)溶于30ml氯仿/冰醋酸(v/v=5/1)的混合溶剂中,搅拌下分批加入n-溴代丁二酰亚胺(0.1815g,1.02mmol,1.0eq),-25℃反应4h。加入35ml水将反应猝灭,分液,水相用二氯甲烷萃取,有机相依次用水,饱和碳酸氢钠溶液和水洗涤,无水硫酸镁干燥,过滤,除去溶剂,柱层析分离得2′-溴-5-甲氧基-2,3′-联噻吩0.2609g(94%)。
1hnmr(cdcl3,400mhz):δ7.24(d,j=5.6hz,1h),7.09(d,j=4.0hz,1h),7.05(d,j=5.6hz,1h),6.20(d,j=4.0hz,1h);13cnmr(cdcl3,100mhz):δ166.36,134.27,127.77,125.92,123.91,122.90,106.16,103.88,60.18。
(4)4-溴-5-甲氧基-2,3′-联噻吩
在50mlschlenk中加入2′,4-二溴-5-甲氧基-2,3′-联噻吩(0.2443g,0.69mmol),抽真空干燥,氮气保护下加入无水四氢呋喃6ml,搅拌使之溶解,室温下将甲基溴化镁(2.0eq)滴加到schlenk中,升至75℃反应3h。将体系温度降至0℃,向体系中加水淬灭反应,将反应液转移至分液漏斗中,用二氯甲烷萃取,合并有机相,用水洗涤三次,加无水mgso4干燥,浓缩得粗品。将粗品进行柱层析分离得4-溴-5-甲氧基-2,3′-联噻吩0.1692g,产率:89.5%。
1hnmr(cdcl3,400mhz):δ7.34(dd,j=4.96hz,1.0hz,1h),7.23(d,j=1.0hz,1h),7.20(d,j=4.96hz,1h),6.85(s,1h),3.99(s,3h);13cnmr(cdcl3,100mhz):δ157.19,134.96,125.99,123.29,118.76,91.82,62.32。
实施例2
非对称结构5-(3-溴丙基)-2,3′-联噻吩的制备,步骤如下:
(1)5-(3-溴丙氧基)-2,3′-联噻吩的制备
在50mlschlenk中依次加入2-溴-5-(3-溴丙氧基)-噻吩、(0.1780g,0.59mmol),3-噻吩硼酸(0.0906g,0.71mmol,1.2eq),无水碳酸钾(0.2039g,1.48mmol,2.5eq),四三苯基膦钯(34.1mg,0.03mmol,0.05eq),抽真空置换三次氩气后,向体系中加入5ml四氢呋喃,2ml水(经过除氧处理)置于油浴中缓慢升温至80℃,搅拌下回流反应12h。降至室温,点板,无原料2-溴-5-(3-溴丙氧基)-噻吩,将反应液转移入分液漏斗中,用二氯甲烷萃取,合并有机相,用水洗涤,加无水mgso4干燥,过滤,浓缩得粗品。将粗品进行柱层析,得纯品5-(3-溴丙氧基)-2,3′-联噻吩,0.1639g,产率:87%。
(2)2′,4-二溴-5-(3-溴丙氧基)-2,3′-联噻吩的制备
将5-(3-溴丙氧基)-2,3′-联噻吩(0.1942g,0.61mmol)溶于18ml氯仿/冰醋酸(v/v=5/1)的混合溶剂中,搅拌下分批加入n-溴代丁二酰亚胺(0.2273g,1.28mmol,2.0eq),0℃反应2h。加入35ml水将反应猝灭,分液,水相用二氯甲烷萃取,有机相依次用水,饱和碳酸氢钠溶液和水洗涤,无水硫酸镁干燥,过滤,除去溶剂,柱层析分离得2′,4-二溴-5-(3-溴丙氧基)-2,3′-联噻吩0.2873g(98%)。
1hnmr(cdcl3,400mhz):δ7.25(d,j=6.0hz,1h),7.09(s,1h),7.03(d,j=6.0hz,1h),4.29(t,j=5.6hz,2h),3.64(t,j=6.4hz,2h),2.36(m,2h);13cnmr(cdcl3,100mhz):δ156.97,133.10,127.46,126.39,126.04,124.39,107.52,93.51,73.32,32.34,29.30。
(3)2′-溴-5-(3-溴丙氧基)-2,3′-联噻吩
将5-(3-溴丙氧基)-2,3′-联噻吩(0.1801g,0.63mmol)溶于30ml氯仿/冰醋酸(v/v=5/1)的混合溶剂中,搅拌下分批加入n-溴代丁二酰亚胺(0.1116g,0.63mmol,1.0eq),-25℃反应4h。加入35ml水将反应猝灭,分液,水相用二氯甲烷萃取,有机相依次用水,饱和碳酸氢钠溶液和水洗涤,无水硫酸镁干燥,过滤,除去溶剂,柱层析分离得2′-溴-5-(3-溴丙氧基)-2,3′-联噻吩0.2227g(97%)。
1hnmr(cdcl3,400mhz):δ7.23(d,j=6hz,1h),7.07(d,j=4.0hz,1h),7.04(d,j=6hz,1h),6.23(d,j=4.0hz,1h),4.22(t,j=6hz,2h),3.59(t,j=6.4hz,2h),2.33(m,2h);13cnmr(cdcl3,100mhz):δ164.89,134.23,127.81,123.87,123.38,106.37,105.23,71.00,32.18,29.43。
(4)4-溴-5-(3-溴丙氧基)-2,3′-联噻吩
在50mlschlenk中加入2′,4-二溴-5-(3-溴丙氧基)-2,3′-联噻吩(0.2563g,0.54mmol),抽真空干燥,氮气保护下加入无水四氢呋喃8ml,搅拌使之溶解,室温下将甲基溴化镁(2.0eq)滴加到schlenk中,升至75℃反应3h。将体系温度降至0℃,向体系中加水淬灭反应,将反应液转移至分液漏斗中,用二氯甲烷萃取,合并有机相,用水洗涤三次,加无水mgso4干燥,浓缩得粗品。将粗品进行柱层析分离得4-溴-5-(3-溴丙氧基)-2,3′-联噻吩0.1822g,产率:85%。
1hnmr(cdcl3,400mhz):δ7.33(dd,j=5.0hz,2.96hz,1h),7.24(dd,j=2.96hz,1.28hz,1h),7.20(dd,j=5.0hz,1.28hz,1h),6.84(s,1h),4.26(t,j=5.76hz,2h),3.64(t,j=4.0hz,2h),2.35(m,2h);13cnmr(cdcl3,100mhz):δ155.56,134.84,127.11,126.62,125.27,122.97,119.00,93.80,73.43,32.32,29.35。
实施例3
(1)5-丙氧基-2,3′-联噻吩的制备
在50mlschlenk中依次加入2-溴-5-丙氧基噻吩(0.2054g,0.93mmol)、3-噻吩硼酸(0.1426g,1.11mmol,1.2eq)、无水碳酸钾(0.3213g,2.33mmol,2.5eq)、四三苯基膦钯(0.0537g,0.05mmol,0.05eq),抽真空置换三次氩气后,向体系中加入5ml四氢呋喃,2ml水(经过除氧处理)置于油浴中缓慢升温至80℃,搅拌下回流反应15h。降至室温,点板,无原料2-溴-5-丙氧基噻吩,将反应液转移入分液漏斗中,用二氯甲烷萃取,合并有机相,用水洗涤,加无水mgso4干燥,过滤,浓缩得粗品。将粗品进行柱层析,得纯品5-丙氧基-2,3′-联噻吩,0.1709g,产率:82%。
(2)2′,4-二溴-5-丙氧基-2,3′-联噻吩的制备
将5-丙氧基-2,3′-联噻吩(0.1840g,0.82mmol)溶于18ml氯仿/冰醋酸(v/v=3/1)的混合溶剂中,搅拌下分批加入n-溴代丁二酰亚胺(0.2919g,1.64mmol,2.0eq),25℃反应2h。加入35ml水将反应猝灭,分液,水相用二氯甲烷萃取,有机相依次用水,饱和碳酸氢钠溶液和水洗涤,无水硫酸镁干燥,过滤,除去溶剂,柱层析分离得2′,4-二溴-5-丙氧基-2,3′-联噻吩0.2915g(93%)。
(3)2′-溴-5-丙氧基-2,3′-联噻吩
将5-丙氧基-2,3′-联噻吩(0.1250g,0.56mmol)溶于30ml氯仿/冰醋酸(v/v=5/1)的混合溶剂中,搅拌下分批加入n-溴代丁二酰亚胺(0.0992g,0.56mmol,1.0eq),-25℃反应4h。加入35ml水将反应猝灭,分液,水相用二氯甲烷萃取,有机相依次用水,饱和碳酸氢钠溶液和水洗涤,无水硫酸镁干燥,过滤,除去溶剂,柱层析分离得2′-溴-5-丙氧基-2,3′-联噻吩0.1504g(89%)。
(4)4-溴-5-丙氧基-2,3′-联噻吩
在50mlschlenk中加入2′,4-二溴-5-丙氧基-2,3′-联噻吩(0.2005g,0.52mmol),抽真空干燥,氮气保护下加入无水四氢呋喃8ml,搅拌使之溶解,室温下将甲基溴化镁(1.0eq)滴加到schlenk中,升至70℃反应4h。将体系温度降至0℃,向体系中加水淬灭反应,将反应液转移至分液漏斗中,用二氯甲烷萃取,合并有机相,用水洗涤三次,加无水mgso4干燥,浓缩得粗品。将粗品进行柱层析分离得4-溴-5-丙氧基-2,3′-联噻吩0.1384g,产率:87%。
实施例4
(1)5-己氧基-2,3′-联噻吩的制备
在50mlschlenk中依次加入2-溴-5-己氧基噻吩(0.2054g,0.78mmol)、3-噻吩硼酸(0.1198g,0.94mmol,1.2eq)、无水碳酸钾(0.2695g,1.95mmol,2.5eq)、四三苯基膦钯(0.0451g,0.04mmol,0.05eq),抽真空置换三次氩气后,向体系中加入5ml四氢呋喃,2ml水(经过除氧处理)置于油浴中缓慢升温至100℃,搅拌下回流反应15h。降至室温,点板,无原料2-溴-5-己氧基噻吩,将反应液转移入分液漏斗中,用二氯甲烷萃取,合并有机相,用水洗涤,加无水mgso4干燥,过滤,浓缩得粗品。将粗品进行柱层析,得纯品5-己氧基-2,3′-联噻吩,0.1705g,产率:82%。
(2)2′,4-二溴-5-己氧基-2,3′-联噻吩的制备
将5-己氧基-2,3′-联噻吩(0.1100g,0.41mmol)溶于20ml氯仿/冰醋酸(v/v=4/1)的混合溶剂中,搅拌下分批加入n-溴代丁二酰亚胺(0.1470g,0.83mmol,2.0eq),0℃反应2h。加入35ml水将反应猝灭,分液,水相用二氯甲烷萃取,有机相依次用水,饱和碳酸氢钠溶液和水洗涤,无水硫酸镁干燥,过滤,除去溶剂,柱层析分离得2′,4-二溴-5-己氧基-2,3′-联噻吩0.1506g(86%)。
(3)2′-溴-5-己氧基-2,3′-联噻吩
将5-己氧基-2,3′-联噻吩(0.1206g,0.45mmol)溶于30ml氯仿/冰醋酸(v/v=5/1)的混合溶剂中,搅拌下分批加入n-溴代丁二酰亚胺(0.0806g,0.45mmol,1.0eq),-25℃反应4h。加入35ml水将反应猝灭,分液,水相用二氯甲烷萃取,有机相依次用水,饱和碳酸氢钠溶液和水洗涤,无水硫酸镁干燥,过滤,除去溶剂,柱层析分离得2′-溴-5-己氧基-2,3′-联噻吩0.1297g(83%)。
(4)4-溴-5-己氧基-2,3′-联噻吩
在50mlschlenk中加入2′,4-二溴-5-己氧基-2,3′-联噻吩(0.1000g,0.24mmol),抽真空干燥,氮气保护下加入无水四氢呋喃8ml,搅拌使之溶解,室温下将甲基溴化镁(3.0eq)滴加到schlenk中,升至80℃反应2h。将体系温度降至0℃,向体系中加水淬灭反应,将反应液转移至分液漏斗中,用二氯甲烷萃取,合并有机相,用水洗涤三次,加无水mgso4干燥,浓缩得粗品。将粗品进行柱层析分离得4-溴-5-己氧基-2,3′-联噻吩0.0741g,产率:91%。
实施例5
非对称结构5-十二烷氧基-2,3′-联噻吩的制备,步骤如下:
(1)5-十二烷氧基-2,3′-联噻吩的制备
在50mlschlenk中依次加入2-溴-5-十二烷氧基噻吩(1mmol),3-噻吩硼酸(1mmol),无水碳酸钾(1.5mmol),四三苯基膦钯(0.02mmol),抽真空置换三次氩气后,向体系中加入四氢呋喃和水(经过除氧处理)置于油浴中缓慢升温至80℃,搅拌下回流反应10h。降至室温,点板,无原料2-溴-5-十二烷氧基噻吩,将反应液转移入分液漏斗中,用二氯甲烷萃取,合并有机相,用水洗涤,加无水mgso4干燥,过滤,浓缩得粗品。将粗品进行柱层析,得纯品5-十二烷氧基-2,3′-联噻吩。
(2)2′,4-二溴-5-十二烷氧基-2,3′-联噻吩
将5-十二烷氧基-2,3′-联噻吩(0.1mmol)溶于18ml氯仿/冰醋酸(v/v=3/1)的混合溶剂中,搅拌下分批加入n-溴代丁二酰亚胺(0.2mmol),0℃反应1h。加入35ml水将反应猝灭,分液,水相用二氯甲烷萃取,有机相依次用水,饱和碳酸氢钠溶液和水洗涤,无水硫酸镁干燥,过滤,除去溶剂,柱层析分离得2′,4-二溴-5-十二烷氧基-2,3′-联噻吩。
(3)2′-溴-5-十二烷氧基-2,3′-联噻吩
将5-十二烷氧基-2,3′-联噻吩(0.56mmol)溶于30ml氯仿/冰醋酸(v/v=5/1)的混合溶剂中,搅拌下分批加入n-溴代丁二酰亚胺(0.56mmol),-25℃反应1h。加入35ml水将反应猝灭,分液,水相用二氯甲烷萃取,有机相依次用水,饱和碳酸氢钠溶液和水洗涤,无水硫酸镁干燥,过滤,除去溶剂,柱层析分离得2′-溴-5-十二烷氧基-2,3′-联噻吩。
(4)4-溴-5-十二烷氧基-2,3′-联噻吩
在50mlschlenk中加入2′,4-二溴-5-十二烷氧基-2,3′-联噻吩(0.52mmol),抽真空干燥,氮气保护下加入无水四氢呋喃8ml,搅拌使之溶解,室温下将甲基溴化镁(0.52mmol)滴加到schlenk中,升至70℃反应4h。将体系温度降至0℃,向体系中加水淬灭反应,将反应液转移至分液漏斗中,用二氯甲烷萃取,合并有机相,用水洗涤三次,加无水mgso4干燥,浓缩得粗品。将粗品进行柱层析分离得4-溴-5-十二烷氧基-2,3′-联噻吩。
实施例6
非对称结构5-溴丁氧基-2,3′-联噻吩的制备,步骤如下:
(1)5-溴丁氧基-2,3′-联噻吩的制备
在50mlschlenk中依次加入2-溴-5-溴丁氧基噻吩(1mmol),3-噻吩硼酸(3mmol),无水碳酸钾(3mmol),四三苯基膦钯(0.05mmol),抽真空置换三次氩气后,向体系中加入四氢呋喃和水(经过除氧处理)置于油浴中缓慢升温至100℃,搅拌下回流反应9h。降至室温,点板,无原料2-溴-5-溴丁氧基噻吩,将反应液转移入分液漏斗中,用二氯甲烷萃取,合并有机相,用水洗涤,加无水mgso4干燥,过滤,浓缩得粗品。将粗品进行柱层析,得纯品5-溴丁氧基-2,3′-联噻吩。
(2)2′,4-二溴-5-溴丁氧基-2,3′-联噻吩
将5-溴丁氧基-2,3′-联噻吩(0.1mmol)溶于18ml氯仿/冰醋酸(v/v=5/1)的混合溶剂中,搅拌下分批加入n-溴代丁二酰亚胺(0.25mmol),10℃反应2h。加入35ml水将反应猝灭,分液,水相用二氯甲烷萃取,有机相依次用水,饱和碳酸氢钠溶液和水洗涤,无水硫酸镁干燥,过滤,除去溶剂,柱层析分离得2′,4-二溴-5-溴丁氧基-2,3′-联噻吩。
(3)2′-溴-5-溴丁氧基-2,3′-联噻吩
将5-溴丁氧基-2,3′-联噻吩(0.56mmol)溶于30ml氯仿/冰醋酸(v/v=3/1)的混合溶剂中,搅拌下分批加入n-溴代丁二酰亚胺(0.672mmol),-25℃反应2h。加入35ml水将反应猝灭,分液,水相用二氯甲烷萃取,有机相依次用水,饱和碳酸氢钠溶液和水洗涤,无水硫酸镁干燥,过滤,除去溶剂,柱层析分离得2′-溴-5-溴丁氧基-2,3′-联噻吩。
(4)4-溴-5-溴丁氧基-2,3′-联噻吩
在50mlschlenk中加入2′,4-二溴-5-溴丁氧基-2,3′-联噻吩(0.52mmol),抽真空干燥,氮气保护下加入无水四氢呋喃8ml,搅拌使之溶解,室温下将甲基溴化镁(1.04mmol)滴加到schlenk中,升至75℃反应3h。将体系温度降至0℃,向体系中加水淬灭反应,将反应液转移至分液漏斗中,用二氯甲烷萃取,合并有机相,用水洗涤三次,加无水mgso4干燥,浓缩得粗品。将粗品进行柱层析分离得4-溴-5-溴丁氧基-2,3′-联噻吩。
实施例7
非对称结构5-溴丁氧基-2,3′-联噻吩的制备,步骤如下:
(1)5-丁氧基-2,3′-联噻吩的制备
在50mlschlenk中依次加入2-溴-5-丁氧基噻吩(1mmol),3-噻吩硼酸(2mmol),无水碳酸钾(2mmol),四三苯基膦钯(0.03mmol),抽真空置换三次氩气后,向体系中加入四氢呋喃和水(经过除氧处理)置于油浴中缓慢升温至90℃,搅拌下回流反应15h。降至室温,点板,无原料2-溴-5-丁氧基噻吩,将反应液转移入分液漏斗中,用二氯甲烷萃取,合并有机相,用水洗涤,加无水mgso4干燥,过滤,浓缩得粗品。将粗品进行柱层析,得纯品5-丁氧基-2,3′-联噻吩。
(2)2′,4-二溴-5-丁氧基-2,3′-联噻吩
将5-丁氧基-2,3′-联噻吩(0.1mmol)溶于18ml氯仿/冰醋酸(v/v=8/1)的混合溶剂中,搅拌下分批加入n-溴代丁二酰亚胺(0.3mmol,),25℃反应3h。加入35ml水将反应猝灭,分液,水相用二氯甲烷萃取,有机相依次用水,饱和碳酸氢钠溶液和水洗涤,无水硫酸镁干燥,过滤,除去溶剂,柱层析分离得2′,4-二溴-5-丁氧基-2,3′-联噻吩。
(3)2′-溴-5-丁氧基-2,3′-联噻吩
将5-丁氧基-2,3′-联噻吩(0.56mmol)溶于30ml氯仿/冰醋酸(v/v=3/1)的混合溶剂中,搅拌下分批加入n-溴代丁二酰亚胺(0.84mmol),-25℃反应1h。加入35ml水将反应猝灭,分液,水相用二氯甲烷萃取,有机相依次用水,饱和碳酸氢钠溶液和水洗涤,无水硫酸镁干燥,过滤,除去溶剂,柱层析分离得2′-溴-5-丁氧基-2,3′-联噻吩。
(4)4-溴-5-丁氧基-2,3′-联噻吩
在50mlschlenk中加入2′,4-二溴-5-丁氧基-2,3′-联噻吩(0.52mmol),抽真空干燥,氮气保护下加入无水四氢呋喃8ml,搅拌使之溶解,室温下将甲基溴化镁(1.56mmol)滴加到schlenk中,升至80℃反应4h。将体系温度降至0℃,向体系中加水淬灭反应,将反应液转移至分液漏斗中,用二氯甲烷萃取,合并有机相,用水洗涤三次,加无水mgso4干燥,浓缩得粗品。将粗品进行柱层析分离得4-溴-5-丁氧基-2,3′-联噻吩。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!