一种快速检测大肠杆菌的方法与流程
本发明涉及大肠杆菌检测技术领域,具体涉及一种快速检测大肠杆菌的方法。
背景技术:
大肠菌群是国际上公认的检测各种食品、医药、环境水质在流行病学上安全性的指示菌,它粪便污染的最佳指示菌。如何检测大肠杆菌,尤其针对低浓度大肠杆菌如何检出的意义重大。
传统的e.coli检测方法主要包括多管发酵、滤膜法和平板计数法(gb4789.3-2016替代gb/t4789.32-2002),这些方法都具有操作繁琐、耗时长和灵敏度低的缺点。近年来,科学工作者发展了很多快速检测方法,主要分为三类:分子生物学方法、免疫分析技术和代谢学技术。分子生物学方法基于遗传物质的检测,准确性有保障。但是该方法需要专业仪器和技术,不能实现在线监测;且检测信号基于遗传物质扩增(pcr等),检测限一般在103以上。免疫分析技术能够快速大肠杆菌检测,但只针对表面抗原抗体已知菌的检测,如大肠杆菌o157:h7试剂盒,不能完成水体中所有大肠杆菌的广谱检测。基于代谢学检测的技术中,目前最有效的是利用e.coli产生β-葡萄糖醛酸酶的特点,分解4-甲基伞形酮-β-d-葡萄糖醛酸苷(mug)生成具有荧光的4-甲基伞形酮(4-mu)进行检测,94-97%具有该代谢途径的大肠杆菌都可以被检出。
现有技术1国标hj1001-2018,该检测方法在特定温度下培养特定的时间,大肠埃希氏菌能产生β-葡萄糖醛酸酶,将选择性培养基中的4-甲基伞形酮-β-d-葡萄糖醛酸苷(mug)分解为4-甲基伞形酮,将封口后的97孔定量盘放入恒温培养箱中37℃±1℃下培养24h。在紫外灯照射下产生荧光统计阳性反应出现数量,查mpn表,计算样品中大肠埃希氏菌的浓度值。但是新版国标法给出的检测结果仍是最大可能数(mpn),而不是具体浓度数;培养时间为24h,只能隔天出检测结果。针对此弊端,部分工作人员利用4-mu最大生成量之前,其产量与大肠杆菌的浓度具有线性关系进行测量,缩短检测时间。如现有技术2申请号为200410051350.7的中国专利申请公开了一种快速测定大肠杆菌的检测方法,该方法将配制好的mug培养液,分装于试管,接种样品到培养液中,35-44℃下培养6-12h后用荧光分光光度计测定366nm处培养液的荧光强度,根据该条件下荧光强度与菌浓度的对应关系,测得样品中大肠杆菌数。但是现有技术2存在的缺点是:1、由于检测仪器和方法的限制,对于极低浓度的大肠杆菌难以检出。这是由于mug本底也具有荧光,当4-mu产量极低时,产物信号与本底信号分不开。2、对于大浓度区间,荧光强度与大肠杆菌浓度呈多项式相关,线性关系不好。
技术实现要素:
本发明要解决现有技术中采用366nm激发和450nm发射组合,由于mug本底经366nm激发后,在450nm也有一定荧光强度,当大肠杆菌浓度很低时,4-mu产量少,产物信号与本底信号分不开,导致对于水样中大肠杆菌浓度极低的样品现有方法无法检测的技术问题,提供一种快速检测大肠杆菌的方法。
为了解决上述技术问题,本发明的技术方案具体如下:
本发明提供一种快速检测大肠杆菌的方法,该方法是采用比率荧光法检测大肠杆菌。
在上述技术方案中,优选的是:所述快速检测大肠杆菌的方法,是利用320nm激发时,本底4-甲基伞形酮-β-d-葡萄糖醛酸苷(mug)的吸收峰在380nm,产物4-甲基伞形酮(4-mu)的吸收峰在450nm,根据两处发射峰峰值的比率与大肠杆菌浓度进行线性拟合,绘制标准曲线;对待测样品测量荧光强度,320nm激发,分别读取380nm处和450nm处的发射峰峰值,将两处的发射峰峰值的比率代入标准曲线,计算得出待测样品中大肠杆菌的浓度。
在上述技术方案中,进一步优选的是:所述快速检测大肠杆菌的方法的一种具体实施方式为:
步骤1、配制含mug成分的培养液;
步骤2、纯培养大肠杆菌,并将纯培养的大肠杆菌离心清洗后,稀释制备一系列浓度梯度作为样品制作标准曲线;
步骤3、将步骤2的菌液样品用标准平板计数法(cfu)定量,得到纯培养大肠杆菌的真实浓度;
步骤4、接种步骤2的稀释为系列浓度的各菌液于步骤1配制的含mug成分的培养液中,由步骤3的cfu定量结果计算各菌液中含有大肠杆菌数量;
步骤5、接种实际待测样品于步骤1配制的含mug成分的培养液中;
步骤6、将步骤4和步骤5的培养基分别进行温育后,调节ph值至酸性,测量荧光强度,320nm激发,分别读取380nm处和450nm处的发射峰峰值;
步骤7、根据步骤4计算的大肠杆菌浓度、及步骤6测得的步骤4的培养基在380nm处和450nm处的发射峰峰值的比率,绘制标准曲线;
步骤8、将步骤6测得的步骤5的培养基在380nm处和450nm处的发射峰峰值的比率代入标准曲线,计算得出待测样品中大肠杆菌的浓度。
在上述技术方案中,优选的是:步骤6中使用hcl或h2so4调节调节ph值至酸性,如ph值至5。
本发明的有益效果是:
本发明提供的一种快速检测大肠杆菌的方法,采用比率荧光方法,可以将底物mug的吸收峰的降低与产物4-mu的吸收峰的增加同时利用起来,通过以二者吸收峰峰值比率与大肠杆菌的浓度做进行线性拟合,与单纯利用366nm激发,450nm发射的方法相比,所拟合的线性更好,提高了检测的准确性。
本发明提供的一种快速检测大肠杆菌的方法,利用320nm激发时,本底mug的吸收峰在380nm,产物4-mu的吸收峰在450nm,通过比率计算,可以校正线性关系,使低浓度大肠杆菌的产物检测信号与本底信号能够区分开;该方法可以缩短大肠杆菌检测的温育时间,在4-mu的产生量达不到区分度的时候,通过比率荧光可以达到区分。
附图说明
下面结合附图和具体实施方式对本发明作进一步详细说明。
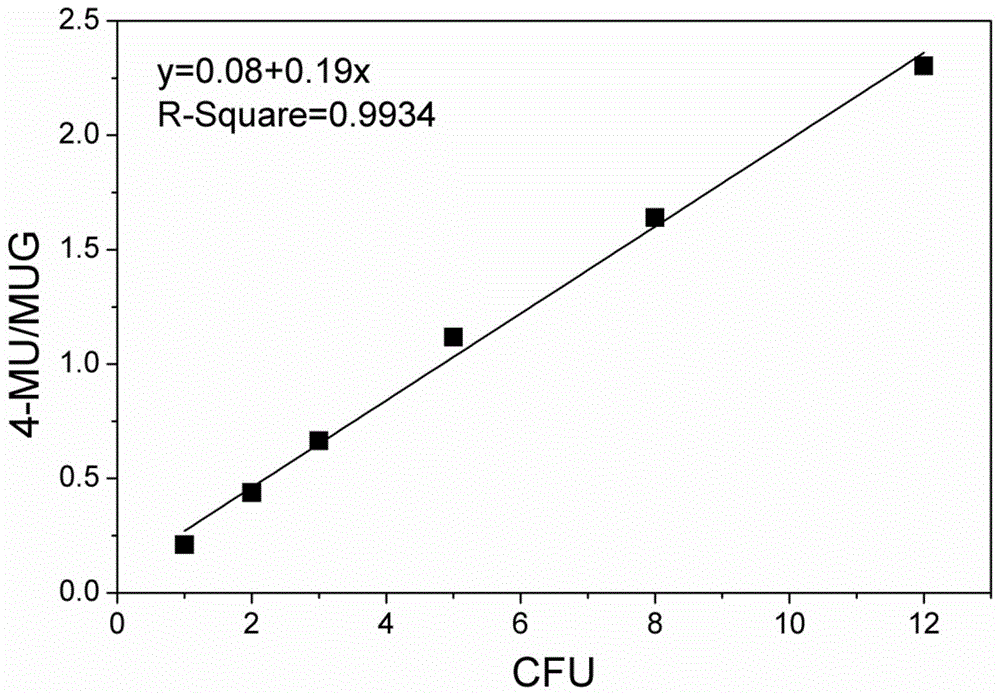
图1为实施例1用本发明的快速检测大肠杆菌的方法检测大肠杆菌的产物和底物吸收峰峰值比率与大肠杆菌的浓度的曲线图。
图2为实施例2用本发明的快速检测大肠杆菌的方法检测大肠杆菌的产物和底物吸收峰峰值比率与大肠杆菌的浓度的曲线图。
具体实施方式
下面结合附图对本发明做以详细说明。
实施例1
1、配制mug培养基
1l培养基,称取以下试剂:
4-甲基伞形酮-β-d-葡萄糖醛酸苷(mug)75.0mg;
胰蛋白胨10.0g;
硫酸铵[(nh4)2so4]5.0g;
硫酸锰(mnso4)0.5mg;
硫酸锌(znso4)0.5mg;
硫酸镁(mgso4)100.0mg;
氯化钠(nacl)10.0g;
氯化钙(cacl2)50.0mg;
亚硫酸钠(na2so3)40.0mg;
kh2po40.9g;
na2hpo46.2g;
然后取5ml到入10ml离心管中,离心管的数量根据实验需求而定,用记号笔在离心管上做好标记。
2、以无菌操作接种e.coliatcc25922于lb培养基中,培养至稳定期,37℃,220转/分钟条件下大约需要12h。将培养后的e.coli以无菌操作离心清洗3次,定量od600=0.2(菌液a),菌液a稀释102为菌液b,稀释104为菌液c,稀释105为菌液d,稀释106为菌液e。
3、将上述菌液用标准平板计数法(cfu)定量。本次实验定量结果为50μl菌液d的cfu计数33±1。
4、接种一定量的e.coli于mug培养基。本次实验分别接种菌液e15μl,30μl,45μl,75μl,120μl,180μl于5ml培养基中,由步骤4的cfu定量结果计算依次含有大肠杆菌1,2,3,5,8,12cfu;
5、接种实际待测样品于配制mug培养基,所述实际样品为实验室下水道水样和餐厅厨余废液样品;
6、分别将步骤4和5的培养基于37℃温育16h,然后用hcl调节ph5,测量荧光强度。激发320nm,分别读取380nm处和450nm处的发射峰峰值。
7、根据步骤4计算的大肠杆菌浓度、及步骤6测得的步骤4的培养基在380nm处和450nm处的发射峰峰值的比率,绘制标准曲线参见图1;
8、将步骤6测得的步骤5的培养基在380nm处和450nm处的发射峰峰值的比率代入标准曲线,计算得出待测样品实验室下水道水样和餐厅厨余废液样品中大肠杆菌的浓度分别为2.53±0.5个/ml和9.25±2.6个/ml。
实施例2
1、配制mug培养基
1l培养基,称取以下试剂:
4-甲基伞形酮-β-d-葡萄糖醛酸苷(mug)50.0mg;
胰蛋白胨10.0g;
氯化钠(nacl)5.0g;
然后取5ml到入10ml离心管中,离心管的数量根据实验需求而定,用记号笔在离心管上做好标记。
步骤2-4同实施例1的步骤2-4。
5、将步骤4的培养基于37℃温育18h,然后用h2so4调节ph6,测量荧光强度。激发320nm,分别读取380nm处和450nm处的发射峰峰值。
6、根据步骤4计算的大肠杆菌浓度、及步骤5测得的步骤4的培养基在380nm处和450nm处的发射峰峰值的比率,绘制标准曲线参见图2。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
- 还没有人留言评论。精彩留言会获得点赞!