癌特异的T细胞受体的制作方法
癌特异的t细胞受体
技术领域
[0001]
本公开涉及一种新的抗癌肽;编码其的载体;包含所述抗癌肽的药物组合物或免疫原性剂或双特异性剂或疫苗;所述抗癌肽、载体、药物组合物、免疫原性剂、双特异性剂或疫苗治疗癌症的用途;使用所述抗癌肽、载体、药物组合物、免疫原性剂、双特异性剂或疫苗治疗癌症的方法;以及包含所述抗癌肽、载体、药物组合物、免疫原性剂、双特异性剂或疫苗的用于治疗癌症的组合治疗剂。
背景技术:
[0002]
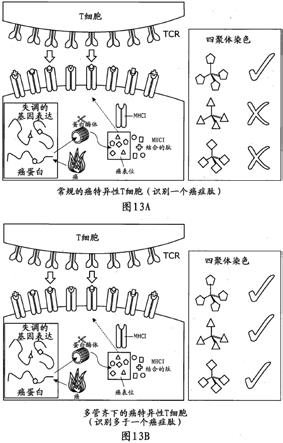
我们已经发现一个有效治疗癌症的新t细胞类别。
[0003]
已经确定认为t细胞通过它们的相应t细胞受体识别单个的癌症肽。因此,认为单个tcr识别通常在人白细胞抗原(hla)i类或ii类分子的背景下呈递在细胞表面的单个癌抗原肽。
[0004]
本文提出的这项新工作突出且显著地显示了一些t细胞使用相同的t细胞受体(tcr)识别(具有不同序列的)不同的癌抗原肽,从而表明单个tcr具有识别多种不同癌抗原的能力。这是一个独特的发现,与传统观念背道而驰,并且在治疗被认为是多方面疾病的癌症中具有显著有益的意义。
[0005]
我们的工作显示,这些t细胞能够识别在相同的人白细胞抗原(hla)i类分子的背景下呈递在细胞表面的衍生自不同癌抗原的多种不同肽。在大多数情况下,这些肽呈递在相同的癌细胞表面,这在以前没有描述过。
[0006]
因此,似乎一些稀有的t细胞能够通过它们相应的t细胞受体识别多种的单一癌抗原肽。这种新型的t细胞利用相同的t细胞受体(tcr)经由多种不同的癌症肽识别癌细胞。我们将这些t细胞称为“多管齐下的t细胞(multipronged t-cells)”,所述t细胞利用它们的相应tcr,可以经由多于一种抗原识别并攻击癌细胞,并因此大大减少了癌细胞免疫逃逸的机会。
[0007]
2015年,约九千五百万人患有癌症。一年出现约一千四百万新病例(不包括除黑素瘤之外的皮肤癌)。它造成约八百八十万人死亡(15.7%)。男性中最常见类型的癌症是肺癌、前列腺癌、结直肠癌和胃癌。女性中,最常见类型的癌症是乳腺癌、结直肠癌、肺癌和宫颈癌。如果除黑素瘤之外,皮肤癌纳入每年总的新发癌症中,它将占约40%病例。在儿童中,急性淋巴母细胞白血病和脑肿瘤最常见,非洲例外,在那里非霍奇金淋巴瘤最常发生。2012年,约165,000名15岁以下儿童经诊断患有癌症。癌症风险随年龄显著增加并且许多癌症在发达国家更常见。发病率随着更多的人长寿并且随着发展中国家中生活方式改变渐增。截至2010年,癌症的财务费用估计为每年1.16万亿美元。随之而来是需要提供治疗或根除这种疾病的更好和更安全方式。公认使用身体的天然防御系统杀伤异常组织的免疫疗法比化学干预更安全,但是,为了有效,免疫疗法必须能够清除疾病。另外,发现有效对抗任何类型癌症或许多癌症的免疫疗法将极为有益,因为它不仅可以施用于患有许多不同类型癌症的诸多个体(即它将具有泛群体适用性),还可以施用于患有多于一种类型癌症的单个个体。
[0008]
我们已经在本文鉴定的t细胞和它们的受体具有前述有利特征,因为它们有效对抗多于一种癌症类型,从而防止了逃避免疫系统有效性的癌症。此外,可以通过使用本文所述的新的抗癌肽来实现这些有利的t细胞和它们的受体的产生。
[0009]
发明描述
[0010]
根据本发明的第一方面,提供了一种分离的抗癌t细胞受体(tcr)或其片段,当多种癌症肽抗原被人白细胞抗原(hla)i类分子呈递在细胞表面且其中所述多种抗原彼此不同,且代表多于一种癌症类型时,所述分离的抗癌t细胞受体(tcr)或其片段识别所述多种抗原。
[0011]
根据本发明的又一方面,提供了识别多种癌抗原的抗癌tcr或癌特异性tcr或其片段,其中所述tcr具有选自包含以下的组或由以下组成的组的互补决定区:
[0012]
catsdrgqganwdeqff(seq id no:1);
[0013]
castlgggteaff(seq id no:2);
[0014]
csardllaetyeqyf(seq id no:3);
[0015]
cassssdtdtqyf(seq id no:4);
[0016]
csvegslgralraneqff(seq id no:5);
[0017]
cathggeklff(seq id no:6);
[0018]
cassyvglgsplhf(seq id no:7);
[0019]
csgqanteaff(seq id no:8);
[0020]
casspttglktrsgytf(seq id no:9);
[0021]
csegspyneqff(seq id no:10);
[0022]
cassngfhfntlyf(seq id no:11);
[0023]
casslgggdtqyf(seq id no:12);
[0024]
cassfagtdtqyf(seq id no:13);
[0025]
casslgegspgelff(seq id no:14);
[0026]
cassqepnwnteaff(seq id no:15);
[0027]
cassfqgpgygytf(seq id no:16);
[0028]
csardttwgleqyf(seq id no:17);
[0029]
catkpsgstdtqyf(seq id no:18);
[0030]
csardegigyeqyf(seq id no:19);
[0031]
casssgpgelff(seq id no:20);
[0032]
carrtlvivrrfysgntiyf(seq id no:21);
[0033]
csardligsqtyeqyf(seq id no:22);
[0034]
csardpigtesyeqyf(seq id no:23);
[0035]
csardragrsplhf(seq id no:24);
[0036]
csveessgiyeqyf(seq id no:25);
[0037]
csaredggqtyeqyf(seq id no:26);
[0038]
casswagpveqyf(seq id no:27);
[0039]
casssqgraeqyf(seq id no:28);
[0040]
casssrdslyeqyf(seq id no:29);
[0041]
casslgiisgqpqhf(seq id no:30);
[0042]
cassntggytqyf(seq id no:31);
[0043]
cassqgllldneqff(seq id no:32);
[0044]
cassspmdsgdtdtqyf(seq id no:33);
[0045]
cassprsgvpqhf(seq id no:34);
[0046]
cassfvreegstdtqyf(seq id no:35);
[0047]
csargtesyeqyf(seq id no:36);
[0048]
caswpgegfgetqyf(seq id no:37);
[0049]
csgwgqgdeklff(seq id no:38);
[0050]
casseytsgnqpqhf(seq id no:39);
[0051]
csardlwtgetyeqyf(seq id no:40);
[0052]
csatglaglgeqff(seq id no:41);
[0053]
catsdlgtgvgeqff(seq id no:42);
[0054]
csvgpgstgelff(seq id no:43);
[0055]
cassptgeklff(seq id no:44);
[0056]
cassqeggtwgdgytf(seq id no:45);
[0057]
catsdlllaggrssyneqff(seq id no:46);
[0058]
casseaasgrpqtf(seq id no:47);
[0059]
catsdatagtsgslyeqyf(seq id no:48);
[0060]
cassltglgqpqhf(seq id no:49);
[0061]
casspavlsyeqyf(seq id no:50);
[0062]
csareslaetyeqyf(seq id no:51);
[0063]
casspgltanvltf(seq id no:52);
[0064]
casslglagneqyf(seq id no:53);
[0065]
cassngfhfntqyf(seq id no:54);
[0066]
casslgiltdtqyf(seq id no:55);
[0067]
cassfqpvdtqyf(seq id no:56);
[0068]
csasegigqpqhf(seq id no:57);和
[0069]
cassvsggeqff(seq id no:58),
[0070]
或与任何一个或多个前述互补决定区具有至少85%同一性的互补决定区。
[0071]
在另一个优选的实施方案中,所述互补决定区与任何一个或多个前述互补决定区具有至少86、87、88、89、90、91、92、93、94、95、96、97、98或99%同一性。
[0072]
在本发明的一个优选实施方案中,所述多种抗原在人白细胞抗原(hla)i类分子的背景下呈递在细胞表面,并且更优选地,通过任何一个或多个以下活性,包括以下活性的任意组合,发生或显示发生所述识别:
[0073]
所述tcr或表达所述tcr的t细胞触发或引起表达任何一种或多种所述抗原的癌细胞的死亡;和/或
[0074]
所述tcr或表达所述tcr的t细胞触发产生或使得产生促炎细胞因子,例如tnf和ifnγ(该特征对于逆转免疫抑制性肿瘤微环境是有用的);和/或
[0075]
所述tcr或表达所述tcr的t细胞触发脱粒或经历脱粒;和/或
[0076]
所述tcr或表达所述tcr的t细胞上调cd107a、β趋化因子(mip 1β)和细胞因子如干扰素γ(ifnγ)和肿瘤坏死因子(tnf)中的任何一种或多种。
[0077]
在本发明的一个优选的实施方案中,所述tcr具有选自包含以下的组或由以下组成的组的互补决定区:
[0078]
catsdrgqganwdeqff(seq id no:59);
[0079]
castlgggteaff(seq id no:60);
[0080]
csardllaetyeqyf(seq id no:61);
[0081]
cassssdtdtqyf(seq id no:62);
[0082]
csvegslgralraneqff(seq id no:63);
[0083]
cathggeklff(seq id no:64);
[0084]
cassyvglgsplhf(seq id no:65);
[0085]
csgqanteaff(seq id no:66);
[0086]
casspttglktrsgytf(seq id no:67);
[0087]
csegspyneqff(seq id no:68);
[0088]
cassngfhfntlyf(seq id no:69);和
[0089]
casslgggdtqyf(seq id no:70);
[0090]
或与任何一个或多个前述互补决定区具有至少85%同一性的互补决定区。
[0091]
在另一个优选的实施方案中,所述互补决定区与任何一个或多个前述互补决定区具有至少86、87、88、89、90、91、92、93、94、95、96、97、98或99%同一性。
[0092]
在本发明的一个优选实施方案中,所述多于一种癌症类型选自包含以下的组或由以下组成的组:鼻咽部癌(nasopharyngeal cancer)、滑膜癌、肝细胞癌、肾癌、结缔组织癌、黑素瘤、肺癌、肠癌、结肠癌、直肠癌、结直肠癌、脑癌、喉癌、口腔癌(oral cancer)、肝癌、骨癌、胰腺癌、绒毛膜癌、胃泌素瘤、嗜铬细胞瘤、泌乳素瘤、t细胞白血病/淋巴瘤、血液癌、扁桃体癌、脾脏癌、神经瘤、希佩尔-林道综合征、卓-艾综合征、肾上腺癌、肛门癌、胆管癌、膀胱癌、输尿管癌、神经胶质瘤、少突胶质细胞瘤、神经母细胞瘤、脑膜瘤、脊髓肿瘤、骨癌、骨软骨瘤、软骨肉瘤、尤因氏肉瘤(ewing's sarcoma)、未知的原发部位癌、类癌瘤(carcinoid)、胃肠道类癌瘤、纤维肉瘤、乳腺癌、肌肉癌、佩吉特氏病、宫颈癌、卵巢癌、血液癌、结肠癌、直肠癌、食道癌、胆囊癌、胆管癌、头癌、眼癌、鼻咽癌(nasopharynx cancer)、颈癌、肾癌、威尔姆斯瘤、肝癌、卡波西肉瘤、前列腺癌、睾丸癌、霍奇金病、非霍奇金淋巴瘤、皮肤癌、间皮瘤、骨髓瘤、多发性骨髓瘤、卵巢癌、内分泌癌、胰高血糖素瘤、甲状旁腺癌、阴茎癌、垂体癌、软组织肉瘤、视网膜母细胞瘤、小肠癌、胃癌、胸腺癌、甲状腺癌、滋养细胞癌、葡萄胎、子宫癌、子宫内膜癌、阴道癌、外阴癌、听神经瘤、蕈样肉芽肿(mycosis fungoides)、胰岛素瘤、类癌瘤综合征(carcinoid syndrome)、生长抑素瘤、牙龈癌、心脏癌、唇癌、脑膜癌、口癌(mouth cancer)、神经癌、颚癌(palate cancer)、腮腺癌、腹膜癌、咽癌(pharynx cancer)、胸膜癌、唾液腺癌、舌癌和扁桃体癌。
[0093]
在本发明的另一个优选的实施方案中,所述多于一种癌症类型选自包含以下的组或由以下组成的组:胰腺癌,血液癌,卵巢癌,皮肤癌,乳腺癌,宫颈癌,前列腺癌,骨癌,肺癌,肝癌,结肠癌和肾癌。
[0094]
本文所指的彼此不同的癌抗原是指代表不同癌症类型的癌抗原,因此谈及的抗原是在它们所来源的序列结构或分子(通常是蛋白质)方面明显不同。
[0095]
然而,尽管抗原序列存在这种不同,本发明的tcr仍能够识别许多这些独特的或不同的癌抗原。本领域技术人员将理解,癌细胞要通过多于一种的不同癌抗原从靶向它们的t细胞逃逸是极其困难的,因为逃逸需要同时突变所有靶标,由此降低或消除所有相关肽的呈递。
[0096]
在本发明的一个优选实施方案中,所述人白细胞抗原(hla)i类分子是mhc i类(a,b或c)。更具体地,所述hla是hla a2或hla a24或hla a1或hla a3。
[0097]
mhc i类从细胞内部呈递肽。例如,在癌细胞的情况下,hla系统将癌表达的蛋白质的片段或肽带到细胞表面,从而使细胞可以被免疫系统识别为癌细胞并被破坏。这些肽自蛋白酶体中降解的被消化的蛋白质产生。通常,这些特定的肽是小的聚合物,长度约为7-20个氨基酸,通常但非排他地为9或10个氨基酸。由mhc i类系统呈递的癌抗原吸引摧毁癌细胞的杀伤性t细胞(也称为cd8阳性或细胞毒性t细胞)。
[0098]
在本发明的一个优选实施方案中,所述tcr是阿尔法贝塔(αβ)tcr.
[0099]
在再一个优选的实施方案中,所述tcr是可溶性tcr(stcr),并且从而缺少跨膜结构域及理想地还缺少胞内结构域。
[0100]
在本发明的又一个优选的实施方案中,所述tcr是嵌合受体的具有本文所述功能的部分。理想地,所述tcr与tcr恒定结构域或tcr信号传导结构域(signalling domain)融合。
[0101]
在备选的方案中,提供了所述tcr的片段,例如其单体部分,理想地为tcr的单链形式。
[0102]
在另一个备选的方案中,提供了所述tcr的片段,例如其互补决定区。
[0103]
根据本发明的又一个方面,提供了一种t细胞,其表达本发明的所述tcr,理想地,以可溶形式或膜相容性形式(即具有跨膜区和胞内区)表达。
[0104]
根据本发明的再一个方面,提供了一种t细胞克隆,其表达本发明的所述tcr,理想地,以可溶形式表达并因此缺乏跨膜结构域和理想地也缺乏胞内结构域;或以膜相容性形式表达,即具有跨膜区和理想地也具有胞内结构域。
[0105]
优选地,所述克隆是本文所述的t细胞克隆cr24,gd1,gd2,vb6g4.24,cr1或vb10。
[0106]
理想地,所述克隆是识别多种抗原性癌症肽的cr24,最优选地,克隆cr24识别选自包含以下的组或由以下组成的组的多种所述肽:来自melan a(残基26-35)的eaagigiltv(seq id no:71)、来自bst2(残基22-31)的lllgigilvl(seq id no:72)和来自imp2(残基367-376)的nlsalgifst(seq id no:73)。优选地,这种识别是在hla a2呈递的背景下进行的。
[0107]
理想地,所述克隆gd1或gd2识别多种抗原性癌症肽,最优选地,克隆gd1或gd2识别以下肽:来自人端粒酶逆转录酶(htert)(残基855-873)的rlvddfllv(seq id no:74)和来自黑素瘤相关抗原c2(mage c2)(残基336-344)的alkdveerv(seq id no:75)。克隆gd1能够杀伤乳腺癌、血液癌和黑素瘤的癌细胞系。
[0108]
理想地,所述克隆vb6g4.24、cr1和vb10识别melan a肽(eaagigiltv(seq id no:71))而不识别bst2(lllgigilvl(seq id no:72)或imp2(nlsalgifst(seq id no:73))肽
(既不是外源肽也不是molt3表达的转导蛋白)。由于来自vb6g4.24的βtcr链的cdr3序列出现在图2的所有十个癌细胞系的克隆分型数据中,因此该克隆应答多个癌细胞系,但不是通过识别imp2或bst2肽进行的。
[0109]
根据本发明的再一个方面,提供了一种载体,其编码本发明的所述tcr。
[0110]
根据本发明的再一个方面,提供了一种药物组合物或免疫原性剂或双特异性剂或疫苗,其包含本发明的所述tcr或t细胞或t细胞克隆或载体。
[0111]
在一个优选的实施方案中,所述药物组合物或免疫原性剂或双特异性剂或疫苗用来治疗癌症。
[0112]
根据本发明的再一个方面,提供了本文所公开的tcr或t细胞或t细胞克隆或载体用于治疗癌症。
[0113]
根据本发明的再另一个方面,提供了一种在患有或怀疑患有癌症的个体中治疗癌症的方法,包括将所述tcr或t细胞或t细胞克隆或载体或药物组合物或免疫原性剂或双特异性剂或疫苗施与待治疗的个体。
[0114]
理想地,所述癌症是属于任何类型的癌症。更理想地,所述癌症选自包含以下的组或由以下组成的组:鼻咽部癌(nasopharyngeal cancer)、滑膜癌、肝细胞癌、肾癌、结缔组织癌、黑素瘤、肺癌、肠癌、结肠癌、直肠癌、结直肠癌、脑癌、喉癌、口腔癌(oral cancer)、肝癌、骨癌、胰腺癌、绒毛膜癌、胃泌素瘤、嗜铬细胞瘤、泌乳素瘤、t细胞白血病/淋巴瘤、血液癌、扁桃体癌、脾脏癌、神经瘤、希佩尔-林道综合征、卓-艾综合征、肾上腺癌、肛门癌、胆管癌、膀胱癌、输尿管癌、神经胶质瘤、少突胶质细胞瘤、神经母细胞瘤、脑膜瘤、脊髓肿瘤、骨癌、骨软骨瘤、软骨肉瘤、尤因氏肉瘤(ewing's sarcoma)、未知的原发部位癌、类癌瘤(carcinoid)、胃肠道类癌瘤、纤维肉瘤、乳腺癌、肌肉癌、佩吉特氏病、宫颈癌、卵巢癌、血液癌、结肠癌、直肠癌、食道癌、胆囊癌、胆管癌、头癌、眼癌、鼻咽癌(nasopharynx cancer)、颈癌、肾癌、威尔姆斯瘤、肝癌、卡波西肉瘤、前列腺癌、睾丸癌、霍奇金病、非霍奇金淋巴瘤、皮肤癌、间皮瘤、骨髓瘤、多发性骨髓瘤、卵巢癌、内分泌癌、胰高血糖素瘤、甲状旁腺癌、阴茎癌、垂体癌、软组织肉瘤、视网膜母细胞瘤、小肠癌、胃癌、胸腺癌、甲状腺癌、滋养细胞癌、葡萄胎、子宫癌、子宫内膜癌、阴道癌、外阴癌、听神经瘤、蕈样肉芽肿(mycosis fungoides)、胰岛素瘤、类癌瘤综合征(carcinoid syndrome)、生长抑素瘤、牙龈癌、心脏癌、唇癌、脑膜癌、口癌(mouth cancer)、神经癌、颚癌(palate cancer)、腮腺癌、腹膜癌、咽癌(pharynx cancer)、胸膜癌、唾液腺癌、舌癌和扁桃体癌。
[0115]
最优选地,所述癌症是胰腺癌,血液癌,卵巢癌,皮肤癌,乳腺癌,骨癌,肾癌,结肠癌,宫颈癌,肝癌,前列腺癌或肺癌。
[0116]
在本发明的一个优选方法中,所述tcr、细胞、克隆或载体与抗癌剂(如,但不限于,双特异性抗体)组合施用。
[0117]
本文提及“双特异性剂”是指双特异性单克隆抗体(bsmab、bsab),所述抗体是可以与两种不同类型抗原同时结合的人工蛋白质。
[0118]
备选地,所述tcr还可以形成双特异性抗体的部分,其中所述双特异性剂包括所述tcr,目的是与其在癌细胞上的配体结合,并且还包括结合并且从而活化免疫细胞(如t杀伤细胞)的免疫细胞活化性组分或配体结合。
[0119]
根据本发明的再一个方面,提供所述tcr或细胞或克隆或载体在制造治疗癌症的
药物中的用途。
[0120]
根据本发明的再一个方面,提供一种用于治疗癌症的组合治疗剂,所述组合治疗剂包含:
[0121]
a)所述tcr或细胞或克隆或载体或免疫原性剂或双特异性剂或疫苗,和
[0122]
b)又一癌症治疗剂,的组合。
[0123]
根据本发明的再一个方面,提供了一种能够引发抗癌t细胞的抗癌肽或肽抗原,其理想地但非排他性地识别本发明的所述tcr或其一部分,并且当将其施与受试者时,引发产生抗癌t细胞,当多种癌抗原被人白细胞抗原(hla)i类分子呈递在细胞表面且其中所述多种癌抗原彼此不同,且代表多于一种癌症类型时,所述抗癌t细胞作为效应t细胞和/或识别所述多种癌抗原的t细胞发挥作用。
[0124]
根据另一个方面或在一个优选的实施方案中,一种/所述的抗癌肽选自包含以下的组或由以下组成的组:
[0125]
itsaigvlpv(seq id no:76);
[0126]
itsaigilpv(seq id no:77);
[0127]
mtsaigvlpv(seq id no:78);
[0128]
qtsaigvlpv(seq id no:79);
[0129]
mtsaigilpv(seq id no:80);
[0130]
ltsaigvlpv(seq id no:81);
[0131]
itsgigvlpv(seq id no:82);
[0132]
itsaigvlpi(seq id no:83);
[0133]
qtsaigilpv(seq id no:84);
[0134]
itsaigvlfv(seq id no:85)
[0135]
最理想地,所述抗癌肽是mtsaigilpv。更理想地,所述肽与前述肽之一具有80%或90%的同一性,因此包括一个或两个替代、缺失或添加。
[0136]
根据本发明的另一方面,提供了一种包含所述抗癌肽的疫苗。
[0137]
根据本发明的另一方面,提供了包含所述抗癌肽的药物组合物或免疫原性剂或双特异性剂。
[0138]
根据本发明的另一方面,提供了一种治疗癌症的方法,该方法包括以其本身形式或作为疫苗、药物组合物、免疫原性剂或双特异性剂向受试者施用抗癌肽。
[0139]
根据本发明的另一方面,提供了抗癌肽用于治疗癌症的用途。
[0140]
根据本发明的另一方面,提供了抗癌肽在制备用于制备治疗癌症的药物中的用途。
[0141]
在本发明的一个优选实施方案中,所述癌症选自本文公开的那些癌症,尤其是皮肤癌或黑素瘤。
[0142]
在本发明的后续权利要求及其之前的本发明描述中,除了其中因明确语言或必要提示而上下文另有要求之外,词“包含”或其变化形式如“包含”或“包含着”按包括的含义使用,即用来指定所述特征的存在,但不妨碍其他特征在本发明的多个实施方案中的存在或添加。
[0143]
全部参考文献,包括本说明书中援引的任何专利或专利申请,均通过引用的方式
并入。绝不承认任何参考文献构成现有技术。另外,绝不承认任何现有技术构成本领域通常公知常识的部分。
[0144]
本发明每个方面的优选特征可以是如联系任何其他方面时所描述那样。
[0145]
本发明的其他特征将从以下实施例变得显而易见。通常而言,本发明扩展至本说明书中公开的特征(包括随附权利要求和附图)的任何新特征或其任何新的组合。因此,除非与之相容,否则联系本发明具体方面、实施方案或实施例所述的特征、整数、特征、化合物或化学部分应理解为适用于本文所述的任何其他方面、实施方案或实施例。
[0146]
而且,除非另外声明,否则本文公开的任何特征可以由起到相同或相似目的的替代性特征替换。
[0147]
遍及说明书和本说明书的权利要求,除非上下文另外要求,否则单数涵盖复数。尤其,除非上下文另有要求,否则使用不定冠词的情况下,本说明书应理解为构思了复数以及单数。
[0148]
现在将仅以举例方式参考以下附图描述本发明的一个实施方案,其中:
[0149]
图1显示用于治疗转移性黑素瘤的hla a2+患者mm909.24的肿瘤浸润淋巴细胞(til)能够识别多种hla a2+癌细胞类型。(a)针对自体黑素瘤和不同组织来源的癌细胞系测试了til。(b)自体黑素瘤和所示的hla a2+癌细胞系的铬释放细胞毒性测定法。细胞系根据它们的来源组织(a)进行颜色标码。显示了孵育18小时后的特异性裂解。(c)tapi-0测定法,其中将til与所示的hla a2+癌细胞系孵育5小时,并通过用单克隆抗体检测tnf和cd107a评估活化。基于单独的til对照设定活化的门(tnf+和/或cd107a+)。通过流式细胞术对应答的t细胞进行分选,并用于t细胞受体(tcr)的α链和β链的下一代测序。
[0150]
图2显示了来自hla a2+患者mm909.24的til的功能性t细胞的t细胞受体(tcr)β链克隆型(clonotypes),能够对癌细胞系和自体黑素瘤(mm909.24)产生应答。与所示的hla a2+癌细胞系孵育5小时后,根据功能(使用cd107a抗体和tnf抗体的tapi-0测定法)对细胞进行分选(图1),并用于tcr链的高通量illumina测序。(a)tcrβ链cdr3显示在左侧,图表的每个蓝色阴影部分表明cdr3存在于对图表顶部所示的癌细胞系有应答的群体中。可以看到有五个tcr对所有癌症都有应答。(b)显示了识别癌细胞系数目的cdr3的比例,所述癌细胞系数目显示在每个区段旁边。例如;2种细胞系=自体黑素瘤+一种其它的癌细胞系;10种细胞系=自体黑素瘤+9种其它的癌细胞系。超过50%的对hla a2+自体黑素瘤有应答的克隆型也对4种或更多种其它癌症类型有应答。
[0151]
图3显示了癌表位发现流程。该图描述了用于发现被t细胞识别的肽的策略,所述t细胞对多种细胞类型应答。(a)通过有限稀释从til mm909.24克隆cd8 t细胞,然后筛选针对自体mm909.24黑素瘤的细胞毒性。在一些情况下,筛选过程中还使用了其它的癌细胞类型。扩增目的克隆并用于进一步的测定法。(b)对重要的cd8 t细胞克隆进行了组合肽文库筛选,以揭示在肽的每个位置处它们的氨基酸残基的偏好。示意图显示了cpl文库的设计,该文库包含肽子文库;每个子文库在肽的定义位置处都有一个固定的氨基酸残基(空心圆圈)(20个蛋白原性氨基酸之一),同一子文库的所有其他位置是残基的随机混合(灰色正方形)。(c)使用cpl数据(图5中所示的例子)筛选癌蛋白数据库(制备中的原稿),以筛选出预计被克隆识别的候选肽。(d)候选癌症肽的功能测试,以揭示那些被cd8克隆识别的肽。
[0152]
图4显示t细胞克隆cr24可以识别不同组织来源的多种hla a2+癌细胞系。使用
tapi-0测定法评估cr24对所示癌细胞系的反应性。显示了反应性百分数(cd107a+和/或tnf+)。(a)cr24识别hla a2+黑素瘤,但不识别hla a2阴性黑素瘤。(b)白血病细胞系cir当表达hla a2时被识别。(c)识别不同组织来源(见图释)的非黑素瘤hla a2+细胞系。
[0153]
图5显示了cd8 t细胞克隆cr24的组合肽文库(cpl)筛选。将10聚物cpl筛选的每个子文库与cr24一式两份孵育,并将tap(与抗原加工相关的转运蛋白)缺陷型细胞系t2用作抗原呈递细胞。已经使用尺寸扫描测定法(sizing scan assay)确定了cr24的肽长度(10mers)偏好(数据未显示)。过夜孵育后,收获上清液,并通过mip1-βelisa评估克隆活化。每幅图显示了cpl筛选的一个肽位置,其中x轴上显示的氨基酸(单字母代码)在该特定位置是固定不变的。绿色的柱显示了cr24识别的多种肽之一的氨基酸残基,为来自melan a的eaagigiltv(残基26-35)。cpl数据通过定制的癌抗原网络工具运行,以给出最有可能被cr24识别的候选肽(图6)。
[0154]
图6显示了t细胞克隆cr24识别衍生自不同癌蛋白的三种独特的肽。通过图4中进行的组合肽库筛选鉴定出的候选肽中,cr24识别了其中三种肽,为eaagigiltv(被t细胞识别的黑素瘤抗原1/黑色素细胞抗原(mart-1/melan a,残基26-35)http://www.iedb.org/epid/10987)、lllgigilvl(骨髓基质抗原2(bst2,残基22-31)、和nlsalgifst,来自胰岛素样生长因子2mrna结合蛋白2(imp2,残基367-376)。这三种肽共有的两个氨基酸残基在图释中以红色显示。melan a肽已充分描述为t细胞识别黑素瘤的靶。bst2肽的9个氨基酸长的形式以前已进行了描述(10:https://www.ncbi.nlm.nih.gov/pubmed/16569595)。imp2肽是以前没有描述过的新表位(制备中的手稿)。(a)用cr24进行活化测定法和每一肽的滴度,孵育过夜,并将上清液用于mip-1βelisa。(b)用每一肽的hla a2四聚体染色cr24证实相应的tcr可以与这些抗原结合。使用了优化的染色方案。对照四聚体是hla a2 alwgpdpaaa(前胰岛素原残基15-24)。(c)用cr24和抗原呈递细胞进行活化测定法,所述抗原呈递细胞表达三种癌症肽所衍生自的蛋白质。用基因转导细胞系molt3(天然为hla-a2阴性,melan a阴性,bst2阴性和imp2阴性)用于表达hla a2、melan a、bst2、imp2、iv型胶原蛋白的α2亚基和来自zika病毒的锚衣壳蛋白。胶原蛋白和zika蛋白充当转导/无关蛋白对照。将cr24与每种molt3细胞系孵育过夜,并收集上清液用于tnf elisa。
[0155]
图7显示了t细胞克隆cr24通过至少两种抗原识别自体黑素瘤。(a)使用向导(g)rna和crispr-cas9靶向自体mm909.24黑素瘤中的melan a基因进行切除。野生型melan a氨基酸序列以蓝色eaagigiltv(seq id no:71)肽显示。melan a基因座的测序证实了两个等位基因处的早期stop密码子(红色)造成的基因破坏,所述早期stop密码子下游是eaagigiltv(seq id no:71)序列。(b)用未缀合的抗melan a抗体和pe缀合的第二抗体对melan a进行的细胞内染色证实缺乏melan a蛋白。(c&d)用野生型和melan a敲除(ko)的自体黑素瘤的til mm909.24的活化测定法(c)和cr24的活化测定法(d)(tapi-0用tnf抗体和cd107a抗体)。将melan a肽eaagigiltv(seq id no:71)用作cr24的阳性对照。cr24仍然能够识别缺乏melan a表达并因此缺乏hla a2-eaagigiltv(seq id no:71)呈递的自体黑素瘤,表明cr24识别了至少一种其他肽,且最有可能衍生自bst2和/或imp2的那些肽。
[0156]
图8显示从健康供体可产生对(eaagigiltv(seq id no:71))、bst2(lllgigilvl(seq id no:72))和imp2(nlsalgifst(seq id no:73))肽交叉反应的t细胞。(a)来自两个hla a2+供体的cd8 t细胞(显示了来自一个供体的代表性数据)用melan a、bst2或imp2肽
作为单独的培养物引发(1)。引发后两周,将每种培养物用对照(来自前胰岛素原15-24的alwgpdpaaa(seq id no:86)、melan a、bst2和imp2四聚体染色(2)。显示了每个样品的细胞染色百分数。(b)将每种引发的t细胞系用于与癌细胞系进行过夜ifnγelispot测定法;所述癌细胞系是mda-mb-231(乳腺癌)、mm909.24(黑素瘤)和saos-2(骨癌)。也单独孵育了t细胞。显示了斑点形成细胞(sfc)数量/50,000个细胞。
[0157]
图9显示了与野生型肽相比,用于多管齐下的t细胞的超级激动剂肽引发更多的癌症肽特异的t细胞。使用cr24的cpl数据(图5)和预测算法(http://wsbc.warwick.ac.uk/wsbctoolswebpage/user_cases.php)设计了候选超级激动剂;其基于cpl数据揭示的氨基酸偏好(2:https://www.ncbi.nlm.nih.gov/pubmed/22952231)确定了最有可能充当超级激动剂的肽。所述肽具有与野生型肽不相似的序列,并称为改变的肽配体。前十个肽显示在(a)中,且与野生型肽eaagigiltv(seq id no:71)(melan a)、lllgigilvl(seq id no:72)(bst2)和nlsalgifst(seq id no:73)(imp2)在6位上(以粗体显示)共有甘氨酸(改变的肽配体(apl),1、3、4、6、7、8和10)或者在6位和7位上分别共有甘氨酸和异亮氨酸(apl肽2、5和9)。(b)为了测试apl的超级激动剂特性,使用每一wt和apl肽来引发来自hla a2+健康供体的cd8+t细胞。对hla a2-eaagigiltv(melan a)(seq id no:71),-lllgigilvl(seq id no:72)(bst2)或-nlsalgifst(seq id no:73)(imp2),通过用四聚体对t细胞染色来评估对每种肽的应答幅度。总之,在所有测试的三个供体中apl 5(mtsaigilpv)(seq id no:80)似乎是引发melan a、bst2和imp2 t细胞的最有效的超级激动剂,在每个供体中apl 2(itsaigilpv)(seq id no:77)也表现了有作用。
[0158]
图10显示5号超级激动剂肽(mtsaigilpv)(seq id no:80)引发来自转移性黑素瘤患者的更多能够识别wt eaagigiltv melan a肽(seq id no:71)的cd8 t细胞。由于可从患者37和12获得的pbmc数量有限,仅将melan a肽与5号肽进行比较。患者37现已死亡,其对常规或til治疗无反应。患者12正在接受治疗。(a)用eaagigiltv(wt)(seq id no:71)和mtsaigilpv(seq id no:80)(5号)肽引发cd8+t细胞后,hla a2-eaagigiltv(wt melan a)(seq id no:71)四聚体染色数据。无关的hla a2-alwgpdpaaa(前胰岛素原)(seq id no:86)四聚体用作无关的对照。(b)使用自体黑素瘤对来自患者37的t细胞系进行的铬释放细胞毒性测定法。显示的t细胞系与黑素瘤细胞之比是基于总t细胞数。可获得的来自患者12的细胞不足以执行杀伤测定法。(c)细胞毒性测定法,如b中所述,但是根据(a)中所示的eaagigiltv(seq id no:71)四聚体阳性对细胞数进行了调整,以给出对于eaagigiltv引发的t细胞系和mtsaigilpv引发的t细胞系这两者均为2个eaagigiltv四聚体
+
细胞每3个黑素瘤细胞。用未配对的单尾t检验显示p值。
[0159]
图11显示了来自其他潜在的多管齐下的t细胞的汇总初步数据。也从生长来自til患者mm909.24的t细胞克隆(vb6g4.24,cr1和vb10),其识别melan a肽(eaagigiltv)(seq id no:71),但不识别bst2(lllgigilvl)(seq id no:72)或imp2(nlsalgifst)(seq id no:73)肽(既不是外源肽,也不是来自molt3表达的转导蛋白)。来自vb6g4.24的βtcr链的cdr3序列出现在图2的所有十个癌细胞系的克隆分型数据中,表明该克隆对多种癌细胞系有应答,但不是通过imp2或bst2肽的识别。
[0160]
图12显示了其他多管齐下的t细胞的肽交叉反应性。克隆gd1和gd2识别与克隆cr24不同的肽。(a)生长来自不同供体的hla a2限制性克隆gd1和gd2表达不同的t细胞受
f12中培养为悬浮细胞。如atcc所述地维持其他癌细胞系:乳腺腺癌mda-mb-231(htb-26
tm
)和mcf-7(htb-22
tm
);前列腺腺癌lncap(crl-1740
tm
);结直肠癌colo 205(ccl-222
tm
)和hct116(ccl-247
tm
);肺癌h69(htb-119
tm
);肝脏肝细胞癌hepg2(hb-8065
tm
);宫颈癌ms751(htb-34tm);急性淋巴母细胞白血病molt3(crl-1552
tm
);慢性髓细胞性白血病k562(crl-3344
tm
);骨髓瘤/浆细胞瘤u266(tib-196
tm
);骨肉瘤u-2os(htb-96
tm
)saos-2(htb-85
tm
)和tk143(crl-8303
tm
);hek293t胚肾细胞(crl-1573
tm
);急性单核细胞白血病thp-1(tib-202
tm
);和肾癌a-498(htb-44
tm
)。
[0169]
黑素瘤肿瘤浸润淋巴细胞识别多种癌细胞类型
[0170]ⅳ期转移性黑素瘤患者mm909.24在哥本哈根herlev医院的癌症免疫治疗中心(ccit)进行了快速的肿瘤浸润治疗[1]。迄今为止,该患者经历了持久的缓解。铬释放细胞毒性测定法用于评估对癌细胞系的反应性:自体黑素瘤(mm909.24),mda-mb-231,mcf-7,lncap和rcc17。用30μci铬酸钠(51cr)(perkin elmer,waltham,ma,usa)标记细胞系(1x106个细胞)1小时,沥滤1小时,然后与til培养过夜。til与靶细胞的比例为10:1(每孔2000个细胞)。过夜孵育后,收集上清液,与闪烁剂混合,并使用microbeta读数仪读数,并计算特异性裂解[2]。使用tnf加工抑制剂-0(tapi-0)测定法测试了其他癌细胞系[3];从培养物中收获til,用ro洗并在r5培养基中静置过夜。在活化测定法的当天,收获细胞,然后计数,并将100,000个细胞与30μm tapi-0(sigma-aldrich)、抗tnf-pe-vio770tm(克隆ca2,miltenyi biotech)和抗cd107a-pe(克隆h4a3,bd biosciences)抗体在96u孔板的孔中孵育。加入癌细胞系以使til与靶细胞的比例为1:2。除上述癌细胞系外,也使用了以下细胞系:colo 205,h69,hepg2,ms751和saos-2。将细胞在37℃孵育4-5小时,然后在室温用已使用pbs以1:40稀释的2μl live/dead可固定死细胞染色剂vivid(life technologies)染色5分钟。用于检测表面标志物的抗体直接添加到每个没有清洗的样品中;抗cd8-apc(克隆bw135/80,miltenyi biotech)和抗cd3-多甲藻素叶绿素(percp)(克隆bw264/56,miltenyi biotech)。在bd facs canto ii(bd biosciences)上获取数据,并使用flowjo软件(treestar inc.,ashland,or,usa)进行分析。活化的til(cd107a+和/或tnf+)在bd facs aria(bd biosciences,san jose,ca,usa)上进行分选,并如先前所述进行t细胞受体(tcr)链的下一代测序[4]。
[0171]
鉴定被孤儿cd8克隆识别的肽的策略
[0172]
未知肽特异性的t细胞克隆(称为孤儿克隆)是通过在96u孔板中以0.5个细胞/孔在t细胞培养基中培养50,000个经辐射的(3000-3100cgy)来自3个供体的同种异体外周血单个核细胞(pbmc)和1-2μg/ml植物血凝素(pha)而产生的。通过标准密度梯度离心从血液中分离pbmc。如果需要,使用氯化铵溶液裂解红血细胞。血液是从welsh blood service(pontyclun,wales,uk)采购的“棕黄层(buffy coats)”。根据cardiff university的指南,获取并处理所有人体组织,以符合uk human tissue act 2004。针对自体黑素瘤(mm909.24)以及在某种情况下,针对不同组织来源的癌细胞系筛选了t细胞克隆。使用如上所述的pbmc和pha方法,将目的克隆在t25烧瓶中大量生长。进行了组合肽文库(cpl)和癌抗
原数据库筛选,以发现被孤儿克隆识别的肽。如之前所述[5,6],合成并使用了组合肽文库。简而言之,在20mm dmso储备液中用r0(与r10一样,但无血清)以1mm工作稀释液在可密封的(硅胶密封垫,axymattm,corning,new york,us)2ml深的圆孔板(corning)制备,于-80℃长期储存,在使用前于4℃储存,然后以1300rpm涡旋(德国汉堡)1分钟,然后离心(400g,5分钟)。每个子文库的使用浓度为总肽浓度100μm。通过数据库运行cpl数据,该数据库包含癌表达的蛋白质的氨基酸序列(准备中的手稿)。癌抗原数据库作为由warwick university系统生物学中心(http://wsbc.warwick.ac.uk/wsbctoolswebpage/user_cases.php)托管的pi cpl(肽鉴定组合肽文库)网络工具的一部分可在线获得。根据数据库中候选肽被克隆识别的可能性自动对候选肽排名,并在肽滴定测定法中测试前20种候选肽。
[0173]
cr24识别多种癌细胞类型
[0174]
hla a2+黑素瘤,mm909.24(自体的)、mel-526、mel-624和hla a2+非黑素瘤,cir-hla a2,mda-mb-231,saos-2,u2os,a498,tk143,hek293t,colo 205,hct116,hela,hepg2和thp1在上述tapi-0测定法中用作靶细胞。使用hla a2阴性黑素瘤fm-2和fm-56以及野生型c1rs(hla a2neg)作为对照。
[0175]
克隆cr24的组合肽文库(cpl)和癌抗原数据库筛选
[0176]
将cr24在r0中放置过夜,然后10聚物cpl筛选的每孔使用30000个细胞(详见上文)。cr24的肽段长度偏好先前已使用尺寸扫描测定法建立[7](数据未显示)。t2细胞(每孔60,000个细胞)用作抗原呈递细胞。根据制造商的说明书(r&d systems,minneapolis,mn,usa),在r5中进行该测定法,并收集上清液用于mip-1β酶联免疫吸附测定法(elisa)。
[0177]
cr24识别来自不同癌蛋白的三种hla a2限制性肽
[0178]
在r5中将cr24培养过夜,然后在96u孔板的每孔中使用30,000个细胞,并降低肽的浓度。过夜孵育后,使用上清液,根据制造商的说明书(r&d systems,minneapolis,mn,usa)进行mip-1βelisa。对于四聚体分析,将cr24(每个样品20,000-50,000个细胞)在适合流式细胞术的5ml聚丙烯管中染色。将细胞在含有50nm达沙替尼(一种蛋白激酶抑制剂)的100μl facs缓冲液(pbs+2%fbs)中于37℃处理30分钟,然后将藻红蛋白(pe)缀合的四聚体(0.5μg)直接加入样品中,然后移至冰上再进行30分钟[8]。用3ml facs缓冲液(700g,5分钟)洗四聚体,然后在冰上用0.5μg(10μg/ml)小鼠抗pe非缀合抗体(克隆pe001,biolegend,英国伦敦)再标记20分钟[8]。为了测试cr24是否可以识别内源表达的抗原,使用molt3细胞表达多种蛋白质。合成了密码子优化的全长人类hla a2(imgt/hla acc no:hla00005)、mlana(melan a)(uniprotkb q16655),bst2(uniprotkb q10589),igf2bp2(imp2)(uniprotkb q9y6m1),col6a2(vi型胶原蛋白α2亚基)(uniprotkb p12110)和zika病毒(rio-u1)ancc(genbank ku926309.2)基因(genewiz,south plainfield,nj,usa),并克隆入第三代慢病毒转移载体pelns中(由dr.james riley,宾夕法尼亚大学,美国宾夕法尼亚州友情提供)。pelns载体包含大鼠cd2(rcd2)标记基因,该基因通过自切割2a序列与目的基因分开。如之前所述进行了慢病毒颗粒的产生、氯化钙转染和基于rcd2的细胞纯化[9]。
[0179]
克隆cr24能够识别缺乏melan a表达的自体黑素瘤
[0180]
为了显示cr24可以通过多种抗原靶向自体黑素瘤,使用cripsr.mit.edu网络工具设计了使用crispr/cas9去除melan a表达的引导rna,应用并对melan a基因进行测序以确
认melan a破坏(数据未显示)。根据制造商的说明书(bd biosciences),使用cytofix/cytoperm
tm
试剂对melan a进行细胞内染色。使用未缀合的兔抗melan a第一抗体(克隆ep1422y)(abcam,cambridge,uk)与pe缀合的山羊抗兔第二抗体。如上所述,将野生型和melan a ko mm909.24黑素瘤与til和cr24一起用于tapi-0测定法中。
[0181]
健康的hla a2+供体中存在识别与cr24相同的三种肽的t细胞
[0182]
为了产生t细胞肽系,根据制造商的说明书(miltenyi biotech,bergisch gladbach,德国),使用cd8微珠从hla a2+供体的pbmc中纯化cd8 t细胞。将纯化的cd8细胞(3x106个)与自体cd8neg细胞(6-8x106个)在24孔板中于2ml t细胞培养基中共孵育,但不含il-15。每种肽使用25μm。将培养基进行50%的培养基更换,每周更换三次。如上进行四聚体染色,每管使用500,000个细胞。在ifnγ酶联免疫吸附斑点(elispot)测定法中使用每一t细胞系和细胞系mda-mb-231、黑素瘤mm909.24和saos-2。每孔使用50,000个t细胞和15,000个癌细胞。孵育48小时,并根据制造商的说明书(mabtech,nacka strand,瑞典)推进该测定法。
[0183]
超级激动剂肽引发多管齐下的t细胞改善的癌细胞识别
[0184]
如上所述进行cr24的cpl测定法。使用cr24 cpl和在线算法(http://wsbc.warwick.ac.uk/wsbctoolswebpage/user_cases.php)设计了候选肽激动剂。如上所述进行来自健康供体的cd8 t细胞的引发、四聚体染色和铬释放细胞毒性测定法。
[0185]
其他melan a克隆不识别被cr24看到的bst2肽和imp2肽
[0186]
如上文针对cr24所述那样,针对vb6g4.24,cr1和vb10实施tapi-0和活化测定法(elisa)。数据汇总在表格中。
[0187]
来自癌抗原htert和mage c2的肽的克隆识别
[0188]
生长来自不同的hla a2+健康供体的外周血的克隆gd1和gd2。在过夜活化测定法中使用所述克隆,使用降低浓度的各肽,并将上清液用于mip-1βelisa。用gd1和靶细胞进行过夜活化;所述靶细胞是k562,k562 hla a2,cir,cir hla a2,hek 293t,mcf-7,colo 205,u266,hct116,mel-526,mel-624,sk-mel-37,a375,im9和lncap。收获上清液并用于mip-1βelisa。如上所述,用细胞系mcf-7、u266和mel-624进行了铬释放细胞毒性测定法。孵育时间为4小时和过夜,并使用不同的t细胞与靶细胞比例。
[0189]
结果
[0190]
1.源自经过成功的免疫治疗的转移性黑素瘤患者的肿瘤浸润淋巴细胞(til)能够杀伤和识别自体黑素瘤和来源自多种癌症:乳腺癌,结肠癌,肺癌,肝癌,前列腺癌,宫颈癌,骨癌和肾癌的hla a2+癌细胞系(图1)。
[0191]
2.癌反应性til的t细胞受体克隆分型揭示了相同的t细胞识别多种hla a2+癌细胞系(图2)。50%的t细胞(tcr)识别多于4种癌细胞系,且8.6%(5个tcr)识别所有10种测试的细胞系。旨在理解泛癌细胞系识别的进一步实验导致发现单一t细胞可以识别来源自不同癌蛋白的多种肽。
[0192]
3.为了绘制来自til的t细胞的肽特异性,首先克隆了t细胞,然后筛选对多种癌细胞系的反应性。克隆cr24对自体黑素瘤和来自乳腺、骨、肾脏、血液、结肠、子宫颈和肝脏的癌细胞系表现出反应性(图4)。这种反应性是通过hla a2介导的,因为所述克隆cr24不识别hla a2neg黑素瘤和野生型cir细胞(hla a2neg)。
[0193]
4.cr24(图5)的组合肽文库和癌抗原数据库筛选(如图3所示)揭示了预测被cr24看到的多种肽(数据未显示),其中被识别的三种肽经测试是外源肽(图6)。还用含有这三种肽的hla a2四聚体染色cr24(图6)。所述肽是来自melan a(残基26-35)的eaagigiltv(seq id no:71)、来自bst2(残基22-31)的lllgigilvl(seq id no:72)和来自imp2(残基367-376)的nlsalgifst(seq id no:73)。这些数据表明,cr24对衍生自不同癌蛋白的不同肽是交叉反应的。
[0194]
5.被cr24识别的肽是从内源表达的蛋白质加工和呈递的,因为cr24能够识别制备为稳定表达melan a、bst2或imp2的抗原呈递细胞(molt3)(图6)。
[0195]
6.对于癌细胞而言,要通过多于一种的不同癌抗原从靶向它们的t细胞逃逸是极为困难的,因为逃逸需要同时突变所有靶标,由此降低或消除所有相应肽的呈递。为了显示这一点,我们靶向自体黑素瘤(mm909.24)来切除melan a基因,这通过抗体染色证实了缺乏melan a蛋白表达(melan a敲除(ko))(图7)。来自患者mm909.24的til和克隆cr24均识别melan a敲除的黑素瘤(图7)。对于cr24,针对野生型自体肿瘤的反应性是71%,对于melan a ko为55%。很可能cr24通过bst2肽和/或imp2肽识别melan a ko黑素瘤,并因此能够介导黑素瘤的破坏。
[0196]
7.能够识别被cr24看到的melan a肽、bst2肽和imp2肽的cd8 t细胞可以自健康的hla a2+供体的外周血产生(图8)。
[0197]
8.与用wt肽的平行引发相比,对多管齐下的t细胞设计的超级激动剂引发了更大比例的能够识别wt melan a(eaagigiltv)(seq id no:71),bst2(lllgigilvl)(seq id no:72)和imp2(nlsalgifst)(seq id no:73)肽的cd8 t细胞。超级激动剂mtsaigvlvp(seq id no;80)(5号肽)在引发上似乎是最有效的候选超级激动剂,引发了所有受试供体(n=3)的melan a、bst2和imp2反应性t细胞(图9b)。另外,与wt eaagigiltv肽相比,mtsaigilpv(seq id no;80)和itsaigilpv(seq id no;77)在引发来自转移性黑素瘤患者的melan a(eaagigiltv)t细胞上更好,并且mtsaigilpv(seq id no;80)还用于肾细胞癌(rcc)和慢性淋巴细胞性白血病(cll)患者(图14a)和急性髓细胞性白血病(aml)患者(图14b)。重要的是,mtsaigilpv(seq id no;80)超级激动剂肽引发的t细胞显示出比wt melan a肽引发的t细胞更优越的自体黑素瘤细胞裂解(图10b和10c)。
[0198]
9.生长来自两个健康的hla a2+供体的外周血的克隆(gd1和gd2),所述克隆与不同于cr24识别的肽交叉反应。这些肽来源于与cr24 t细胞克隆识别的蛋白质不同的蛋白质;来自人端粒酶逆转录酶(htert)的rlvddfllv(seq id no:74)(残基855-873)和来自黑素瘤相关抗原c2(mage c2)的alkdveerv(seq id no:75)(残基336-344)。gd1杀伤乳腺癌、血液癌和黑素瘤的癌细胞系(图9)。
[0199]
结论
[0200]
当前的共识观点是,癌特异性t细胞通过单一肽抗原识别癌细胞(图10a),所述单一肽抗原在细胞表面与hla缔合呈递为肽。我们已经发现,一些稀有的t细胞能够通过多种肽表位识别癌细胞,这些肽表位的序列相差两个或多个氨基酸,并且来源于不同的癌抗原(图10b)。癌要从这种类型的多管齐下的t细胞逃脱可能是非常困难的。
[0201]
参考文献
[0202]
[1]andersen r,donia m,ellebaek e,borch th,kongsted p,iversen tz等人,
用肿瘤浸润淋巴细胞和减毒il2方案进行过继细胞治疗后在转移性黑素瘤患者中的持久完全应答(long-lasting complete responses in patients with metastatic melanoma after adoptive cell therapy with tumor-infiltrating lymphocytes and an attenuated il2 regimen),clin cancer res 2016;22:3734
–
45.doi:10.1158/1078-0432.ccr-15-1879.
[0203]
[2]ekeruche-makinde j,clement m,cole dk,edwards esj,ladell k,miles jj等人,t细胞库中t细胞受体优化的肽偏斜可以增强抗原靶向(t-cell receptor-optimized peptide skewing of the t-cell repertoire can enhance antigen targeting),j biol chem 2012;287:37269
–
81.doi:10.1074/jbc.m112.386409.
[0204]
[3]haney d,quigley mf,asher te,ambrozak dr,gostick e,price da等人,基于膜结合肿瘤坏死因子(tnf)-α表达的活抗原特异性cd8+t细胞的分离(isolation of viable antigen-specific cd8+t cells based on membrane-bound tumor necrosis factor(tnf)-alpha expression).j immunol methods 2011;369:33
–
41.doi:10.1016/j.jim.2011.04.003.isolation.
[0205]
[4]donia m,kjeldsen jw,andersen r,westergaard mcw,bianchi v,legut m等人,肿瘤浸润淋巴细胞疗法治疗癌症后,pd-1+多功能t细胞占主导地位(pd-1+polyfunctional t cells dominate the periphery after tumor-infiltrating lymphocyte therapy for cancer).clin cancer res 2017:clincanres.1692.2016.doi:10.1158/1078-0432.ccr-16-1692.
[0206]
[5]wooldridge l,ekeruche-makinde j,van den berg ha,skowera a,miles jj,tan mp等人,单一自身免疫性t细胞受体识别超过一百万种不同的肽(a single autoimmune t cell receptor recognizes more than a million different peptides).j biol chem 2012;287:1168
–
77.
[0207]
[6]szomolay b,liu j,brown pe,miles jj,clement m,llewellyn-lacey s等人,mhc i限制性t细胞受体识别的人病毒蛋白衍生配体的鉴定(identification of human viral protein-derived ligands recognized by individual mhci-restricted t-cell receptors).immunol cell biol 2016;94:573
–
82.doi:10.1038/icb.2016.12.
[0208]
[7]ekeruche-makinde j,miles jj,van den berg ha,skowera a,cole dk,dolton g等人,肽长度决定了tcr/肽-mhc i结合的结果(peptide length determines the outcome of tcr/peptide-mhci engagement).blood 2013;121:1112
–
23.doi:10.1182/blood-2012-06-437202.
[0209]
[8]tungatt k,bianchi v,crowther md,powell we,schauenburg aj,trimby a等人,肽-mhc多聚体的抗体稳定作用揭示了具有极低亲和力tcr的功能性t细胞(antibody stabilization of peptide-mhc multimers reveals functional t cells bearing extremely low-affinity tcrs).j immunol 2015;194:463
–
74.
[0210]
[9]legut m,dolton g,mian aa,ottmann o,sewell a.crispr介导的tcr替代产生卓越的抗癌转基因t细胞(crispr-mediated tcrreplacement generates superior anticancer transgenic t-cells).blood 2017:blood-2017-05-787598.doi:10.1182/blood-2017-05-787598.
[0211]
[10]hundemer m,schmidt s,condomines m,lupu a,hose d,moos m等人,鉴定hm1.24内新的hla-a2限制性t细胞表位为多发性骨髓瘤的免疫治疗靶标(identification of a new hla-a2-restricted t-cell epitope within hm1.24 as immunotherapy target for multiple myeloma).exp hematol 2006;34:486
–
96.doi:10.1016/j.exphem.2006.01.008.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1