一种检测嵌合抗原受体T细胞对肝癌细胞抑制作用的模型和方法与流程
本发明涉及肿瘤的细胞免疫治疗领域,尤其涉及一种检测嵌合抗原受体T细胞对肝癌细胞抑制作用的模型和方法。
背景技术:
肝癌是亚洲死亡率最高的癌症之一。目前,肝癌有效的治疗方法是部分肝脏切除、肝脏移植、化疗、动脉化疗栓塞。尽管在肝癌诊断和治疗上都有许多的新发现,然而,肝癌的五年生存率仍然只有10%。目前,许多新的潜在免疫治疗手段都开展了临床试验,如CAR T细胞免疫治疗、免疫抑制检查点抗体。鉴于低生存率,严谨而有效模拟人体的临床前评估模型是目前肝癌治疗研发平台的紧急需求。
然而对于实体瘤而言,嵌合抗原受体(Chimeric Antigen Receptor,CAR)T细胞的临床前试验结果与临床试验结果存在着巨大的差异,导致目前通过临床审批、成为上市药物的实体瘤CAR T细胞治疗寥寥可数。而CAR T细胞的临床前和临床治疗结果差异巨大的原因还未知,但可能是多因素影响的。
通过对比血液肿瘤和实体瘤之间的差异,推测实体瘤体内微环境中可能存在的CAR T细胞阻碍:1)突破实体瘤组织物理屏障,肿瘤组织存在妨碍CAR T细胞浸润至肿瘤部位的物理屏障;2)肿瘤代谢微环境中相对酸性、缺乏氧和营养物质,阻碍CAR T细胞生存、增殖和杀伤作用;3)肿瘤抑制性分泌因子和细胞因子的免疫抑制作用;4)免疫抑制细胞,如调节性T细胞(Regulatory T cells,Tregs)、髓系来源的抑制性细胞(myeloid-derived suppressor cells,MDSCs)、肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)和嗜中性粒细胞(Neutrophils,TANs)。而以上列举的条件是常规实体瘤细胞系构建的异种移植小鼠模型无法重现的,导致实体瘤CAR T细胞疗效的临床前评估不准确,临床前和临床治疗结果差异悬殊。
现有技术中存在的都是将肝癌细胞系体外识别杀伤评估和肝癌细胞系体内识别杀伤评估,而肝癌细胞系的体内识别杀伤评估是现有的CAR T细胞临床前疗效评估方法。然而该方法无法有效模拟CAR T细胞对肝癌异质性、肿瘤组织物理屏障和代谢屏障、免疫抑制微环境等效应的疗效。对于CAR T细胞,原代肿瘤细胞异质性将可能是CAR T细胞治疗耐药的重要原因之一,而肿瘤细胞系构建的疗效评估模型却无法重现的肿瘤异质性对CAR T细胞的耐药作用。由此可见,实体瘤CAR T细胞的临床前评估方法并未成熟,亟需发现新的方法。
此外,肝癌又是实体瘤中的一个特殊例子。因为而肝脏组织是一个特殊的器官,参与人体造血过程。肝脏亦被称为免疫幸免器官,即肝脏移植发生移植物排斥宿主疾病的概率远远低于其它器官移植,但具体的作用机制并未见报道。但由此可推知,肝脏组织存在某种缓解免疫效应的作用机制。
CN 102178568 A公开了一种用于研究肝细胞肝癌上皮间质样变动态过程的动物模型的方法,取实验动物,在超声设备引导下肝脏原位接种肿瘤细胞,动态观察上皮间质样变相关指标变化以及肺转移情况。但其无法用来评估CAR T细胞在体内的疗效。CAR T细胞对人体肝癌的临床治疗则可能受到更强烈的免疫抑制作用,靶向肝癌的CAR T细胞对肝癌临床前评估模型的要求更高。
技术实现要素:
针对目前靶向肝癌CAR T细胞临床前评估手段无法有效模拟和评估肝癌CAR T细胞的体内疗效,本发明提供一种检测嵌合抗原受体T细胞对肝癌细胞抑制作用的模型和方法,通过在高度免疫缺陷小鼠体内移植肝癌病人来源的肿瘤组织块,并将肝癌CAR T细胞移植到免疫缺陷小鼠体内,构建原代肝癌异种移植模型,并利用该模型评估靶向肝癌CAR T细胞的临床前疗效。
为达此目的,本发明采用以下技术方案:
一方面,本发明提供一种检测嵌合抗原受体T细胞对肝癌细胞抑制作用的模型,所述模型为通过将所述原代肝癌组织移植到模型生物体内,再将嵌合抗原受体T细胞移植到模型生物体内而获得。
优选地,所述原代肝癌组织移植的体积为1-5mm3,例如可以是1mm3、2mm3、3mm3、4mm3、5mm3,优选为2-3mm3。
优选地,所述原代肝癌组织移植的数量为1-5块,例如可以是1块、2块、3块、4块、5块,优选为2-3块。
优选地,所述嵌合抗原受体T细胞移植的数量为(1-4)×10-6,例如可以是1×10-6、2×10-6、3×10-6、4×10-6,优选为2×10-6。
本发明中,所述模型用于非治疗目的的检测嵌合抗原受体T细胞对肝癌细胞抑制作用,通过将肝癌病人来源的肿瘤组织移植入免疫缺陷小鼠体内,并将肝癌CAR T细胞移植到免疫缺陷小鼠体内,构建可有效模拟肝癌病人体内病理微环境的人源化小鼠模型,并在该模型中模拟临床治疗模型多次移植CAR T细胞,确保CAR T细胞的稳定供给,CAR T细胞激活将高表达PD-1、CTLA-4、TIM3等免疫抑制检查点受体,拟靶向杀伤的肝癌细胞的免疫抑制检查点配体的表达与否,及其辅助免疫抑制微环境形成的因素,将极大程度决定CAR T细胞的体内肿瘤杀伤能力,并通过肿瘤监控评估CAR T细胞对肝癌的治疗作用。
根据本发明,所述原代肝癌组织为边缘淡黄色组织和/或中间白色组织,优选为边缘淡黄色组织,所述边缘淡黄色组织能够更好的与模型生物相容。
根据本发明,所述将所述原代肝癌组织移植到模型生物体内的移植方式为皮下移植、肾囊膜下移植或肝脏原位移植中的一种或至少两种的组合,优选为肝脏原位移植,所述肝脏原位移植通过肝脏微环境可有效促进肝癌细胞及肝癌相关细胞如MDSC、Treg、TAM、TAN等的生存,则可有效模拟肝癌相关细胞对肝癌肿瘤起始、扩增、迁移、耐药等的作用,更真实地模拟嵌合抗原受体T细胞在人体肝癌微环境中的细胞效应和抑制作用。
所述的皮下移植具体步骤如下:用剪刀将原代肿瘤组织样本剪成直径为3mm的肿瘤组织小块,每只受体小鼠移植2-3小块,将肝癌肿瘤组织小块用基质凝胶(Matrix Gel)包裹备用,用剪刀在小鼠下腹部一侧剪开小口,用镊子将Matrix Gel包裹的肿瘤组织块夹入小口中,用伤口夹将小口缝合;肿瘤监控:通过游标卡尺定时量取肿瘤体积监控肿瘤生长和对药物的反应;或通过荧光素酶-活体成像技术检测;或通过流式细胞技术和免疫组化技检测。
所述的肾囊膜下移植具体步骤如下:用剪刀将原代肿瘤组织样本剪成体积为2mm3的肿瘤组织小块备用,每只受体小鼠移植2-3小块;将小鼠麻醉,选取小鼠一侧肾脏,在肾包囊上开小口(开口大小与移植管口相当),用青霉素-生理盐水湿润肾包囊,以移植管吸取带一只的聚合卵巢并移植茹受体小鼠肾囊膜下(远离手术开口),将肾脏放回体腔中,并向体腔中注入适量青霉素-生理盐水,依次缝合腹膜和皮肤,于伤口涂抹碘酒消毒;肿瘤监控:通过荧光素酶-活体成像技术检测,或通过流式细胞技术和免疫组化技术检测。
所述的肝脏原位移植具体步骤如下:用剪刀将原代肿瘤组织样本剪成体积为2mm3的肿瘤组织小块备用,每只受体小鼠移植2-3小块;麻醉小鼠,沿腹中线剪开小鼠皮肤和腹膜,暴露肝叶,挤出肝脏左外叶,用眼科沙眼铲在肝左外叶中部戳一个3-5mm长孔,棉签局部止血后,用镊子将肿瘤组织块夹入小孔内,用激光笔闭合伤口并止血,用青霉素-生理盐水涂抹伤口,缝合腹膜和皮肤,用碘酒消毒伤口;肿瘤监控:通过荧光素酶-活体成像技术检测,或通过流式细胞技术和免疫组化技术检测。
优选地,所述嵌合抗原受体T细胞在所述原代肝癌组织移植到模型生物体内的5-10天后进行移植,例如可以是5天、6天、7天、8天、9天或10天,优选为6-8天进行移植,进一步优选为7天。
优选地,所述嵌合抗原受体T细胞进行多次移植,优选为进行2-4次移植,例如可以是2次、3次或4次,进一步优选为进行2次移植。
优选地,所述嵌合抗原受体T细胞进行多次移植,其中相邻两次移植的间隔时间为5-10天,例如可以是5天、6天、7天、8天、9天或10天,优选为6-8天,进一步优选为7天。
根据本发明,所述模型生物体为本领域常规的模型生物,本发明中选用兔、鼠、猫、狗或猴中的任意一种或至少两种组合的模型,优选为免疫缺陷型小鼠模型,进一步优选为NOD/SCID、Rag2-/-IL2rg-/-、Rag1/-IL2rg-/-、NOD/SCID IL2rg-/-小鼠模型,最优选为NOD/SCID IL2rg-/-小鼠模型。
根据本发明,所述嵌合抗原受体T细胞为特异性识别肝癌细胞的嵌合抗原受体T细胞。
所述嵌合抗原受体主要包括信号肽、抗原识别区、铰链区、跨膜区和胞内区串联构成,其中,所述胞内区主要包括人4-1BB胞内区。
本发明中,通过在GPC3 CAR分子中引入人4-1BB胞内信号域,构建成的GPC3 CAR T细胞,发现其分泌偏向于Th1类型,对肝癌细胞具有强烈的细胞杀伤效应,且高表达Th1细胞因子,极大程度刺激非CAR T细胞引起的肿瘤杀伤效应,可有效防止GPC3-肝癌细胞的逃逸和潜在复发威胁。
根据本发明,过表达特异性靶向GPC3的嵌合抗原受体(Chimeric Antigen Receptor,CAR)T细胞,可特异性识别GPC3+肿瘤抗原,杀伤肿瘤细胞,具有显著的体内外扩增和肿瘤杀伤作用,所述抗原识别区为抗GPC3抗体、CD133、MUC1(Mucin 1,cell surface associated)或CEA(Carcinoembryonic Antigen)中的任意一种或至少两种的组合,优选为抗GPC3抗体。
根据本发明,所述信号肽为能够指导嵌合抗原受体跨膜转移的信号肽都是可行的,本领域技术人员可以根据需要选择本领域常规的信号肽,所述信号肽为人IgM信号肽和/或人CD8α信号肽,优选为人IgM信号肽;
优选地,所述的跨膜区为人CD28跨膜区和/或人CD8跨膜区,优选为人CD28跨膜区。
根据本发明,所述胞内区除了含有人4-1BB胞内区以外,还包括人CD28胞内区、人CD3ζ胞内区或人4-1BB胞内区中的任意一种或至少两种的组合,所述组合例如可以是人CD28胞内区、人CD3ζ胞内区,人CD28胞内区、人4-1BB胞内区,人CD3ζ胞内区、人4-1BB胞内区或人CD28胞内区、人CD3ζ胞内区和人4-1BB胞内区,优选为人CD28胞内区和人CD3ζ胞内区的组合,在本发明中,所述完整的胞内区为人CD28胞内区、人4-1BB胞内区和人CD3ζ胞内区串联构成。
作为优选技术方案,所述嵌合抗原受体由人IgM信号肽、抗GPC3抗体、人CD28跨膜区和胞内区、人4-1BB胞内区和人CD3ζ胞内区串联构成,即IgM-GPC3-CD28-4-1BB-CD3ξ(CAR GPC3)。
发明人发现,所述嵌合抗原受体由人IgM信号肽、抗GPC3抗体、人CD28跨膜区和胞内区、人4-1BB胞内区和人CD3ζ胞内区串联构成,其对肿瘤的识别杀伤效果最好,可靶向GPC3-肿瘤细胞,有效抑制肝癌生长。
优选地,所述嵌合抗原受体的氨基酸序列为SEQ ID NO.1,核酸序列为SEQ ID NO.2。
所述嵌合抗原受体基因合成序列IgM-GPC3-CD28-4-1BB-CD3ξ的氨基酸序列(SEQ ID NO.1)如下:
MLLLVTSLLLCELPHPAFLLIPDVVMTQTPLSLPVSLGDQASISCRSSQSLVHSNGNTYLHWYLQKPGQSPKLLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDLGVYFCSQNTHVPPTFGSGTKLEIKGGGGSGGGGSGGGGSQVQLQQSGAELVRPGASVKLSCKASGYTFTDYEMHWVKQTPVHGLKWIGALDPKTGDTAYSQKFKGKATLTADKSSSTAYMELRSLTSEDSAVYYCTRFYSYTYWGQGTLVTVSAAAAIEVMYPPPYLDNEKSNGTIIHVKGKHLCPSPLFPGPSKPFWVLVVVGGVLACYSLLVTVAFIIFWVRSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRSKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR.
所述嵌合抗原受体基因合成序列IgM-GPC3-CD28-4-1BB-CD3ξ的核酸序列(SEQ ID NO.2)如下:
5-atgcttctcctggtgacaagccttctgctctgtgagttaccacacccagcattcctcctgatcccagatgttgtgatgacccaaactccactctccctgcctgtcagtcttggagatcaagcctccatctcttgcagatctagtcagagccttgtacacagtaatggaaacacctatttacattggtacctgcagaagccaggccagtctccaaagctcctgatctacaaagtttccaaccgattttctggggtcccagacaggttcagtggcagtggatcagggacagatttcacactcaagatcagcagagtggaggctgaggatctgggagtttatttctgctctcaaaatacacatgttcctcctacgttcggatcggggaccaagctggaaataaaaggtggaggcggttcaggcggaggtggcagcggcggtggcgggtcgcaggttcaactgcagcagtctggggctgagctggtgaggcctggggcttcagtgaagctgtcctgcaaggcttcgggctacacatttactgactatgaaatgcactgggtgaagcagacacctgtgcatggcctaaaatggattggagctcttgatcctaaaactggtgatactgcctacagtcagaagttcaagggcaaggccacactgactgcagacaaatcctccagcacagcctacatggagctccgcagcctgacatctgaggactctgccgtctattactgtacaagattctactcctatacttactggggccaagggactctggtcactgtctctgcagcggccgcaattgaagttatgtatcctcctccttacctagacaatgagaagagcaatggaaccattatccatgtgaaagggaaacacctttgtccaagtcccctatttcccggaccttctaagcccttttgggtgctggtggtggttgggggagtcctggcttgctatagcttgctagtaacagtggcctttattattttctgggtgaggagtaagaggagcaggctcctgcacagtgactacatgaacatgactccccgccgccccgggcccacccgcaagcattaccagccctatgccccaccacgcgacttcgcagcctatcgctccaaacggggcagaaagaaactcctgtatatattcaaacaaccatttatgagaccagtacaaactactcaagaggaagatggctgtagctgccgatttccagaagaagaagaaggaggatgtgaactgagagtgaagttcagcaggagcgcagacgcccccgcgtaccagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgc-3.
本发明中,是通过将所述原代肝癌组织的边缘淡黄色组织移植到模型生物体内,再通过多次将SEQ ID NO.2所示的核酸序列转染的T细胞移植到模型生物体内而获得,通过检测模型生物体内皮下肝癌肿瘤组织块来判断嵌合抗原受体T细胞对肝癌细胞抑制作用。
优选地,所述检测的方式为量取肝癌肿瘤组织块大小、称量肝癌肿瘤组织块重量、荧光素酶-活体成像技术或流式细胞仪和免疫组化技术中的任意一种或至少两种的组合,
根据本发明,所述量取肝癌肿瘤组织块大小、称量肝癌肿瘤组织块重量的方式为本领域常规的量取方法,本领域技术人员可以根据实际需要进行选择,在此不做特殊限定,本发明采用游标卡尺进行。
根据本发明,荧光素酶-活体成像技术的方式为本领域常规的量取方法,本领域技术人员可以根据实际需要进行选择,在此不做特殊限定。
根据本发明,流式细胞仪和免疫组化技术具体为:原代肝癌组织移植后60天,CO2处死小鼠,取小鼠外周血、肝脏、脾脏、肺、肾脏,通过流式细胞技术和免疫组化技术,检测肝癌细胞的比例和分布。
优选地,所述肿瘤组织块的检测时间为多次移植完嵌合抗原受体T细胞后进行,每2-5天,例如可以是2天、3天、4天或5天,优选3天量取一次。
第二方面,本发明提供一种检测嵌合抗原受体T细胞对肝癌细胞抑制作用的方法,包括如下步骤:通过检测权利要求1-7中任一项所述的模型生物体内皮下肝癌肿瘤组织块来判断嵌合抗原受体T细胞对肝癌细胞抑制作用。
优选地,所述检测的方式为量取肝癌肿瘤组织块大小、称量肝癌肿瘤组织块重量、荧光素酶-活体成像技术或流式细胞仪和免疫组化技术中的任意一种或至少两种的组合,
根据本发明,所述量取肝癌肿瘤组织块大小、称量肝癌肿瘤组织块重量、的方式为本领域常规的量取方法,本领域技术人员可以根据实际需要进行选择,在此不做特殊限定,本发明采用游标卡尺、
根据本发明,荧光素酶-活体成像技术的方式为本领域常规的量取方法,本领域技术人员可以根据实际需要进行选择,在此不做特殊限定。
根据本发明,流式细胞仪和免疫组化技术具体为:原代肝癌组织移植后60天,CO2处死小鼠,取小鼠外周血、肝脏、脾脏、肺、肾脏,通过流式细胞技术和免疫组化技术,检测肝癌细胞的比例和分布。
优选地,所述肿瘤组织块的检测时间为多次移植完嵌合抗原受体T细胞后进行,每2-5天,例如可以是2天、3天、4天或5天,优选3天量取一次。
第三方面,本发明提供一种如第一方面所述的模型或如第二方面所述的方法在评估CAR T细胞对肝癌细胞抑制效果中的应用。
与现有技术相比,本发明具有如下有益效果:
本发明的模型可有效模拟病人的肿瘤恶性程度,评估CAR T细胞对不同恶性程度的肝癌的抑制作用;本发明模型可有效评估原代肝癌细胞中的免疫抑制检查点分子的表达对CAR T细胞的抑制作用。
附图说明
图1为本发明嵌合抗原受体T细胞的感染比例;
图2为本发明激活后的嵌合抗原受体T细胞的免疫抑制检查点分子表达;
图3本发明通过免疫组化对比肝癌病人原代肿瘤组织和PDX模型肿瘤组织中GPC3和AFP的表达情况;
图4为本发明CAR-GPC3 T细胞体内抑制肝癌细胞系HepG2细胞生长;
图5为本发明CAR-GPC3 T细胞抑制1号肝癌病人PDX1模型中肿瘤生长;
图6为本发明CAR-GPC3 T细胞抑制2号肝癌病人PDX2模型中肿瘤生长;
图7为本发明CAR-GPC3 T细胞抑制3号肝癌病人PDX3模型中肿瘤生长。
具体实施方式
为更进一步阐述本发明所采取的技术手段及其效果,以下结合附图并通过具体实施方式来进一步说明本发明的技术方案,但本发明并非局限在实施例范围内。
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
实施例1:嵌合抗原受体T细胞的构建
(1)通过全基因合成人IgM信号肽、抗GPC3抗体、人CD28跨膜区和胞内区、人4-1BB胞内区和人CD3ζ胞内区,即CAR-GPC3-CD28-4-1BB-CD3ξ(CAR-GPC3),其序列如SEQ ID NO.4所示,再全基因合成CAR-CD19-CD28-4-1BB-CD3ξ(CAR CD19)核酸序列作为阴性对照,合成的基因C端含限制性内切酶Pme1酶切位点及其保护碱基和N端含限制性内切酶Spe1酶切位点及其保护碱基;
(2)通过酶切连接将合成基因连接入pWPXLd-EGFP慢病毒载体,分别获得CAR质粒转化载体pWPXLd-CAR-GPC3-2A-EGFP和pWPXLd-CAR-CD19-2A-EGFP;
(3)慢病毒包装:pWPXLd-CAR-GPC3-2A-EGFP、pWPXLd-CAR-CD19-2A-EGFP分别与慢病毒包装辅助质粒pMD2.G、psPAX2共同转导入293T细胞(处于生长高峰期,150mm培养皿丰度为80-90%),加入试剂及剂量如下:
(4)分别于转化后24、48和72小时,收集培养基上清,并加入新鲜培养基:DMEM高糖培养基+1%FBS+1%双抗,病毒溶解后,收集病毒溶液分装于PCR管,冻存于-80℃待用;
(5)人体T细胞的分离纯化:通过Ficoll密度梯度法分离出人体血液中的单个核细胞,经红细胞裂解液裂解去除红细胞后,再通过MACS Pan-T磁珠分选出T细胞;
(6)通过包被CD2、CD3、CD28抗体的磁珠刺激分选后的T细胞;
(7)在刺激后的T细胞中,分别加入表达CAR-GPC3、CAR-CD19慢病毒、8μg/mL的polybrene和300IU/mL IL-2;
(8)置于37℃,5%CO2培养箱培养24h后,300g离心5min,去上清,用含300IU/mL IL-2的新鲜培养基重悬,即得CAR-GPC3 T细胞和CAR–CD19T细胞;
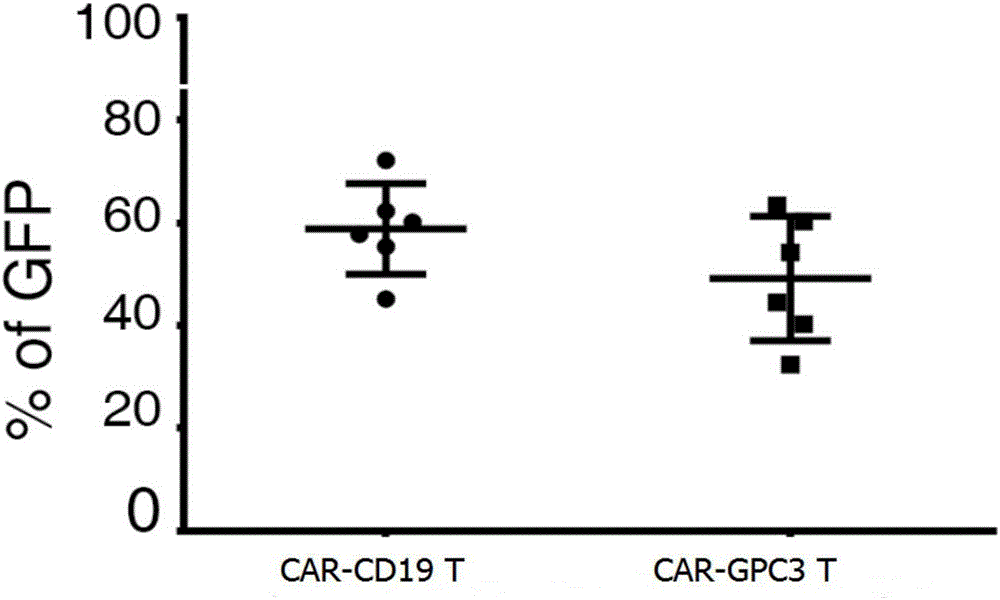
(9)通过流式细胞技术检测CAR-GPC3、CAR-CD19 T细胞的慢病毒感染效率(GFP阳性细胞比例),结果如图1所示;
(10)通过流式细胞技术CAR-GPC3 T细胞(以新鲜人体T细胞为阴性对照)中免疫抑制检查点分子PD-1、CTLA-4、TIM3的表达水平,结果如图2所示。
从图1和图2的结果可以看出,CAR GPC3和CAR CD19病毒感染人体T细胞分别约达到60%、50%;而肿瘤GPC3抗原激活后的CAR GPC3 T细胞高表达免疫抑制检查点分子PD-1、CTLA4、TIM3,显示CAR GPC3 T细胞的免疫杀伤作用会受到肿瘤微环境中高表达免疫抑制检查点分子配体的细胞抑制,表明可重建肿瘤相关细胞及其免疫抑制作用对嵌合抗原受体T细胞临床前评估的必要性。
实施例2:通过皮下移植肝癌PDX模型的构建
(1)原代肝癌样本处理:原代肝癌肿瘤组织样本来源于三甲医院的肿瘤组织样本库,肝癌样本需浸泡于RPMI 1640培养基并保存于冰上运输。获取肿瘤样本后,选择边缘淡黄色/肉色部分肿瘤组织肝癌样本,使用PBS(1%P/S)清洗2-3次,将样本分成三份,一份冻存保种;一份进行肿瘤组织切片和免疫组化分析;一份用于肿瘤移植备用;
(2)肝癌组织移植与监控:采用皮下移植的方式,具体包括:用剪刀将原代肿瘤组织样本剪成直径为3mm的肿瘤组织小块,每只受体小鼠移植2-3小块,将肝癌肿瘤组织小块用Matrix Gel包裹备用,用剪刀在小鼠下腹部一侧剪开小口,用镊子将Matrix Gel包裹的肿瘤组织块夹入小口中,用伤口夹将小口缝合;
(3)肝癌PDX小鼠模型传代:将肝癌PDX小鼠通过CO2处死小鼠,取小鼠肿瘤组织,剪取肿瘤组织外层淡黄色细胞,使用PBS(1%P/S)清洗2-3次,将样本分成三份,一份冻存保种;一份进行肿瘤组织切片和免疫组化分析;一份用于肿瘤移植;
(4)经过3次传代移植后,获取PDX模型肿瘤组织进行组织切片和(GPC3、AFP)免疫组化染色(以相对应的病人原代肝癌组织为对照),对比PDX模型对病人肿瘤样本组织结构、肿瘤标志物表达情况的模拟。
(5)肿瘤监控:于肿瘤移植后60天,CO2处死小鼠,取小鼠外周血、肝脏、脾脏、肺、肾脏,通过流式细胞技术和免疫组化技术,检测肝癌病人原代肿瘤组织和PDX模型肿瘤组织中GPC3和AFP的表达情况,结果如图3所示。
从图3可以看出,多次传代后的PDX模型仍可有效保留和模拟原代肝癌肿瘤组织结构特征和肿瘤标志物(GPC3和AFP)的表达,是抗原特异性靶向的嵌合抗原受体T细胞的疗效评估的必要前提条件。
实施例3:通过肝脏原位移植肝癌PDX模型的构建
(1)原代肝癌样本处理:原代肝癌肿瘤组织样本来源于三甲医院的肿瘤组织样本库,肝癌样本需浸泡于RPMI 1640培养基并保存于冰上运输。获取肿瘤样本后,选择边缘淡黄色/肉色部分肿瘤组织肝癌样本,使用PBS(1%P/S)清洗2-3次,将样本分成三份,一份冻存保种;一份进行肿瘤组织切片和免疫组化分析;一份用于肿瘤移植备用;
(2)肝癌组织移植与监控:采用肝脏原位移植的方式,具体包括:用剪刀将原代肿瘤组织样本剪成体积为2mm3的肿瘤组织小块备用,每只受体小鼠移植2-3小块;麻醉小鼠,沿腹中线剪开小鼠皮肤和腹膜,暴露肝叶,挤出肝脏左外叶,用眼科沙眼铲在肝左外叶中部戳一个3-5mm长孔,棉签局部止血后,用镊子将肿瘤组织块夹入小孔内,用激光笔闭合伤口并止血,用青霉素-生理盐水涂抹伤口,缝合腹膜和皮肤,用碘酒消毒伤口;
(3)肝癌PDX小鼠模型传代:将肝癌PDX小鼠通过CO2处死小鼠,取小鼠肿瘤组织,剪取肿瘤组织外层淡黄色细胞,使用PBS(1%P/S)清洗2-3次,将样本分成三份,一份冻存保种;一份进行肿瘤组织切片和免疫组化分析;一份用于肿瘤移植;
(4)经过3次传代移植后,获取PDX模型肿瘤组织进行组织切片和(GPC3、AFP)免疫组化染色(以相对应的病人原代肝癌组织为对照),对比PDX模型对病人肿瘤样本组织结构、肿瘤标志物表达情况的模拟。
(5)肿瘤监控:于肿瘤移植后60天,CO2处死小鼠,取小鼠外周血、肝脏、脾脏、肺、肾脏,通过流式细胞技术和免疫组化技术,检测肝癌病人原代肿瘤组织和PDX模型肿瘤组织中GPC3和AFP的表达情况。
其结果与实施例2结果类似,多次传代后的PDX模型仍可有效保留和模拟原代肝癌肿瘤组织结构特征和肿瘤标志物(GPC3和AFP)的表达。
实施例4:对比肝癌细胞系和原代肝癌组织异种移植模型评估CAR T细胞的区别
(1)将细胞数为1×106的HepG2-GL细胞系(GPC3+肝癌细胞系,GL为荧光素酶标记)皮下移植入NOD/SCID IL2rg-/-免疫缺陷小鼠体内,构建肝癌异种移植小鼠模型;
(2)通过游标卡尺每日量取皮下肝癌肿瘤组织块的大小,当肿瘤组织达到50-100mm3(肿瘤移植后7天),则通过尾静脉注射将2×106的CAR-GPC3 T、CAR-CD19 T细胞分别移植入肝癌小鼠体内;首次CAR T注射后7天(肿瘤移植后14天)再进行第二次同剂量注射;
(3)CAR T细胞移植后,每周两次通过游标卡尺量取两个实验组小鼠皮下肿瘤组织块大小(即肿瘤移植后第7、10、13、16、19、21、24、27、30天),并记录,绘制肿瘤生长曲线图,结果如图4所示;
从图4可以看出,肝癌细胞系在免疫缺陷小鼠体内的生长速度非常快,于第7天即达可检测到50-100mm3肿瘤块,而通过肝癌细胞系小鼠模型评估CAR T细胞的体内疗效可初步反映CAR T细胞具有一定的肿瘤抑制作用。
实施例5:对比PD-L1+/-原代肝癌组织异种移植模型评估CAR T细胞的区别
(1)通过实施例2-3的PDX模型构建的方法,分别构建了1、2、3号肝癌病人来源的异种移植模型;其中,#1和#2病人为PD-L1阴性,#3病人为PD-L1阳性;肝癌恶性程度:#3>#2>#1;
(2)移植了原代肝癌组织后,通过游标卡尺每日量取皮下肝癌肿瘤组织块的大小,当肿瘤组织达到50-100mm3,则通过尾静脉注射将2×106的CAR-GPC3 T、CAR-CD19 T细胞(对照组)分别移植入肝癌小鼠体内;首次CAR T注射后7天(肿瘤移植后14天)再进行第二次同剂量注射;
(3)注射了CAR T细胞后,每三天通过游标卡尺量取并记录皮下肝癌肿瘤组织块的大小,作CAR T细胞对肿瘤生长的抑制作用图,结果如图5-7所示。
由图5-7可知,PDX模型的增长速度PDX#3>PDX#2>PDX#1与病人的肿瘤恶性程度有关,即肝癌PDX模型可有效模拟病人的肿瘤恶性程度,并能评估CAR T细胞对不同恶性程度的肝癌的抑制作用;CAR GPC3 T细胞治疗在PD-L1阳性的肝癌PDX模型中会受到抑制,即肝癌PDX模型可有效评估原代肝癌细胞中的免疫抑制检查点分子的表达对CAR T细胞的抑制作用。
综上所述,本发明的模型可有效模拟病人的肿瘤恶性程度,评估CAR T细胞对不同恶性程度的肝癌的抑制作用;本发明模型可有效评估原代肝癌细胞中的免疫抑制检查点分子的表达对CAR T细胞的抑制作用。
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
SEQUENCE LISTING
<110> 中国科学院广州生物医药与健康研究院
<120> 一种检测嵌合抗原受体T细胞对肝癌细胞抑制作用的模型和方法
<130> 2016
<160> 2
<170> PatentIn version 3.3
<210> 1
<211> 528
<212> PRT
<213> 人工合成序列
<400> 1
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Asp Val Val Met Thr Gln Thr Pro Leu Ser
20 25 30
Leu Pro Val Ser Leu Gly Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser
35 40 45
Gln Ser Leu Val His Ser Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu
50 55 60
Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn
65 70 75 80
Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
85 90 95
Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Leu Gly Val
100 105 110
Tyr Phe Cys Ser Gln Asn Thr His Val Pro Pro Thr Phe Gly Ser Gly
115 120 125
Thr Lys Leu Glu Ile Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
130 135 140
Gly Gly Gly Gly Ser Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu
145 150 155 160
Val Arg Pro Gly Ala Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr
165 170 175
Thr Phe Thr Asp Tyr Glu Met His Trp Val Lys Gln Thr Pro Val His
180 185 190
Gly Leu Lys Trp Ile Gly Ala Leu Asp Pro Lys Thr Gly Asp Thr Ala
195 200 205
Tyr Ser Gln Lys Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser
210 215 220
Ser Ser Thr Ala Tyr Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser
225 230 235 240
Ala Val Tyr Tyr Cys Thr Arg Phe Tyr Ser Tyr Thr Tyr Trp Gly Gln
245 250 255
Gly Thr Leu Val Thr Val Ser Ala Ala Ala Ala Ile Glu Val Met Tyr
260 265 270
Pro Pro Pro Tyr Leu Asp Asn Glu Lys Ser Asn Gly Thr Ile Ile His
275 280 285
Val Lys Gly Lys His Leu Cys Pro Ser Pro Leu Phe Pro Gly Pro Ser
290 295 300
Lys Pro Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr
305 310 315 320
Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys
325 330 335
Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg
340 345 350
Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp
355 360 365
Phe Ala Ala Tyr Arg Ser Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile
370 375 380
Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp
385 390 395 400
Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
405 410 415
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
420 425 430
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
435 440 445
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
450 455 460
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
465 470 475 480
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
485 490 495
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
500 505 510
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
515 520 525
<210> 2
<211> 1584
<212> DNA
<213> 人工合成序列
<400> 2
atgcttctcc tggtgacaag ccttctgctc tgtgagttac cacacccagc attcctcctg 60
atcccagatg ttgtgatgac ccaaactcca ctctccctgc ctgtcagtct tggagatcaa 120
gcctccatct cttgcagatc tagtcagagc cttgtacaca gtaatggaaa cacctattta 180
cattggtacc tgcagaagcc aggccagtct ccaaagctcc tgatctacaa agtttccaac 240
cgattttctg gggtcccaga caggttcagt ggcagtggat cagggacaga tttcacactc 300
aagatcagca gagtggaggc tgaggatctg ggagtttatt tctgctctca aaatacacat 360
gttcctccta cgttcggatc ggggaccaag ctggaaataa aaggtggagg cggttcaggc 420
ggaggtggca gcggcggtgg cgggtcgcag gttcaactgc agcagtctgg ggctgagctg 480
gtgaggcctg gggcttcagt gaagctgtcc tgcaaggctt cgggctacac atttactgac 540
tatgaaatgc actgggtgaa gcagacacct gtgcatggcc taaaatggat tggagctctt 600
gatcctaaaa ctggtgatac tgcctacagt cagaagttca agggcaaggc cacactgact 660
gcagacaaat cctccagcac agcctacatg gagctccgca gcctgacatc tgaggactct 720
gccgtctatt actgtacaag attctactcc tatacttact ggggccaagg gactctggtc 780
actgtctctg cagcggccgc aattgaagtt atgtatcctc ctccttacct agacaatgag 840
aagagcaatg gaaccattat ccatgtgaaa gggaaacacc tttgtccaag tcccctattt 900
cccggacctt ctaagccctt ttgggtgctg gtggtggttg ggggagtcct ggcttgctat 960
agcttgctag taacagtggc ctttattatt ttctgggtga ggagtaagag gagcaggctc 1020
ctgcacagtg actacatgaa catgactccc cgccgccccg ggcccacccg caagcattac 1080
cagccctatg ccccaccacg cgacttcgca gcctatcgct ccaaacgggg cagaaagaaa 1140
ctcctgtata tattcaaaca accatttatg agaccagtac aaactactca agaggaagat 1200
ggctgtagct gccgatttcc agaagaagaa gaaggaggat gtgaactgag agtgaagttc 1260
agcaggagcg cagacgcccc cgcgtaccag cagggccaga accagctcta taacgagctc 1320
aatctaggac gaagagagga gtacgatgtt ttggacaaga gacgtggccg ggaccctgag 1380
atggggggaa agccgagaag gaagaaccct caggaaggcc tgtacaatga actgcagaaa 1440
gataagatgg cggaggccta cagtgagatt gggatgaaag gcgagcgccg gaggggcaag 1500
gggcacgatg gcctttacca gggtctcagt acagccacca aggacaccta cgacgccctt 1560
cacatgcagg ccctgccccc tcgc 1584
- 还没有人留言评论。精彩留言会获得点赞!
- 金黄色葡萄球菌肠毒素C2的核酸适配体C203及其筛选方法和应用与制造工艺
- 一种全人源化EGFRvIII嵌合抗原受体T细胞及其制备方法与制造工艺
- 嵌合抗原受体及制备方法与制造工艺
- 检测外周血CAR‑T细胞的TaqMan实时荧光定量PCR试剂盒的制造方法与工艺
- CD20特异性嵌合抗原受体及其应用的制造方法与工艺
- 一种用于辣根过氧化物酶染色的染色剂及其制备方法、染色组合、应用及标记酶染色试剂盒与制造工艺
- 对SSEA4抗原具有特异性的嵌合抗原受体的制造方法与工艺
- 具有针对CD79和CD22的特异性的分子的制造方法与工艺
- 具有针对CD45和CD79的特异性的分子的制造方法与工艺
- 一种检测嵌合抗原受体T细胞对肝癌细胞抑制作用的模型和方法与制造工艺