对SSEA4抗原具有特异性的嵌合抗原受体的制作方法
本发明涉及癌症治疗领域,特别地涉及使用抗原SSEA4作为靶标的癌症治疗。
背景技术:
癌症是涉及失调的细胞生长的一组广泛的疾病。在癌症中,细胞不受控地分裂并生长,从而形成恶性肿瘤,并且侵入身体的邻近部位。癌症还可通过淋巴系统或血流扩散到身体更远的部分。影响人类的有超过200种不同的已知癌症。虽然良好的治疗选择可用于许多癌症类型,但是其他的癌症类型仍然存在未被满足的医疗需求。特别是,卵巢癌、乳腺癌和三阴性乳腺癌(TNBC)是具有有限的治疗选择的恶性肿瘤。TNBC是与高转移风险和早期复发相关的侵袭性乳腺癌亚型。目前,TNBC患者全身性治疗的主要选择是总体效果较差且具有严重副作用的化疗。最初,大部分TNBC患者对新辅助化疗治疗有反应,但只有约20%达到预后良好的病理完全反应(pCR)。值得注意的是,大多数患者因为肿瘤对化疗具有较低的重新敏感性(de novo sensitivity)或者产生对化疗的抗性而没有达到pCR。在这些情况下,肿瘤由于化疗而退化,但残余癌细胞存留并在约40%患者中,在化疗后三年内导致肿瘤复发和转移。
唾液酸-糖脂阶段特异性胚胎抗原4(SSEA4)是唾液酸-糖脂表位,也称为单唾液酸红细胞戊糖神经酰胺(monosialosyl globopentaosylceramide)(MSGb5),最初在人畸胎癌细胞中识别到(Kannagi R等,EMBO J.1983;2(12):2355-61;Saito S等,J Biol Chem.2003Jul 18;278(29):26474-9)。SSEA4在未分化人胚胎干(ES)细胞、诱导多能(iPS)细胞、胚胎癌(EC)细胞和胚胎生殖(EG)细胞以及多种成体干细胞(如牙髓干细胞、脐带血来源的极小胚胎样干细胞(VSEL)和间质基质细胞(Gang EJ等,Blood.2007Feb 15;109(4):1743-51;Truong TT等,Invest Ophthalmol Vis Sci.2011Aug 11;52(9):6315-20)上发现。
在EP14305477.3中公开了SSEA4是标志化疗抗性癌细胞亚群的生物标志物。
SSEA4的功能仍然未知。
嵌合抗原受体(CAR)对于癌症的过继性细胞免疫治疗提供了有前景的途径。通常,CAR包含通过铰链和跨膜区连接到T-细胞信号传导分子的胞质结构域的对肿瘤相关抗原(TAA)特异性的抗体单链可变片段(scFv)。最常见的淋巴细胞激活部分包括与T-细胞触发(例如,CD3ζ)部分串联的T-细胞共刺激(例如,CD28、CD137、OX40、ICOS和CD27)结构域。CAR介导的过继性免疫治疗允许CAR移植细胞以非HLA限制方式直接识别靶肿瘤细胞上的TAA。
虽然少于25%的乳腺癌患者受益于化疗治疗(CLIFFORD A.HUDIS和LUCA GIANNI,The Oncologist 2011;16(suppl 1):1-11),但这种全身性方法仍然用作标准治疗。由于严重的副作用,鉴定可以用作癌症(如,人乳腺癌)治疗选择的标志物将是高度有益的。
技术实现要素:
SSEA4是癌细胞的细胞表面抗原,因此它可以用于表达SSEA4的癌细胞的靶向生物或免疫治疗,包括但不限于卵巢癌、肾细胞癌和TNBC。我们现在出人意料地发现,工程化细胞,优选表达对抗原SSEA4具有特异性的嵌合抗原受体的工程化T细胞,能够在体外和体内杀伤表达SSEA4的细胞。因此,本发明涉及经转导以表达嵌合抗原受体的细胞的过继性细胞转移策略,其中所述CAR靶向于SSEA4(“SSEA4-CAR”),导致识别表达SSEA4的癌细胞并与其结合。然后该遗传修饰细胞,即CAR表达细胞,执行其特定功能,例如杀伤靶细胞、分泌细胞因子和/或增殖。
附图说明
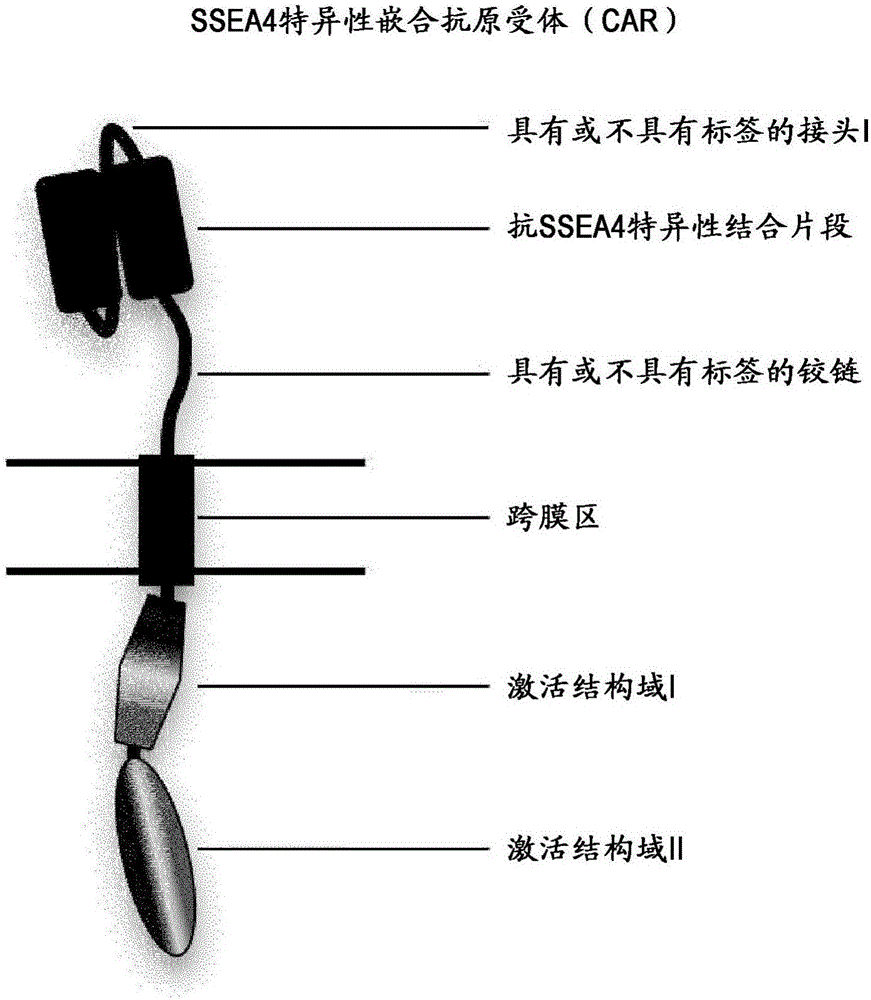
图1:识别SSEA4的CAR的结构。
图2:(A)全SSEA4-CAR VH-接头-VL的氨基酸序列(对应于SEQ ID NO:5)和(B)全SSEA4-CAR VL-接头-VH的氨基酸序列(对应于SEQ ID NO:6)。
图3:外周血T细胞的表面上嵌合抗原受体构建体“重_轻scFv定向”(SEQ ID NO:5)和“轻_重scFv定向”(SEQ ID NO:6)的表达。
图4A、B和C:用SSEA-4-阳性肿瘤细胞刺激后的SSEA-4-CAR依赖性T细胞激活,导致促炎性细胞因子IFNγ、IL-2和TNFα的分泌。
图5A和B:SSEA-4-阳性肿瘤细胞通过转导T细胞的SSEA-4-CAR依赖性杀伤。
发明详述
出人意料地,我们发现由表达对抗原SSEA4特异性的CAR的工程化免疫细胞直接靶向的SSEA4表达癌细胞以这些细胞未能生长和/或被促使死亡的方式而受到影响。
在第一方面,本发明提供了一种嵌合抗原受体(CAR),其包含对SSEA4具有特异性的抗原结合结构域(“SSEA4-CAR”)。
所述SSEA-CAR的抗原结合结构域可包含,例如,全长重链、Fab片段、单链Fv(scFv)片段、二价单链抗体或双链抗体,其各自对靶抗原SSEA4具有特异性。
所述CAR的抗原结合结构域可包含SEQ ID NO:1和SEQ ID NO:2的氨基酸序列。所述CAR的抗原结合结构域可包含scFv,所述scFv包含SEQ ID NO:3或SEQ ID NO:4的氨基酸序列。所述CAR可包含SEQ ID NO:5或SEQ ID NO:6的氨基酸序列。
所述CAR可包含跨膜结构域和细胞内信号传导结构域,其中所述跨膜结构域包含例如源自CD8α和/或CD28的跨膜结构域的序列;并且其中所述细胞内信号传导结构域包含例如源自CD28、CD137、OX40和CD3ζ中的一个或多个的细胞内信号传导结构域的序列。或者,CAR可由另外的部分(如接头和/或铰链)构成(参见图1)和/或可组成为如下所述的双链或多链CAR。
SSEA-CAR可包含SEQ ID NO:5或SEQ ID NO:6的氨基酸序列。
在本发明的一个方面,本发明的CAR用于治疗患有癌症的受试者的癌症,并且其中所述癌症的癌细胞的至少一个亚群表达SSEA4。
所述癌症可选自人乳腺癌、人肾细胞癌(RCC)和人卵巢癌。所述癌症可以是TNBC。
所述表达SSEA4的癌细胞的亚群可以包含患有所述癌症的受试者的所有癌细胞中的至少一个表达SSEA4的细胞。优选地,所述表达SSEA4的癌细胞的亚群可以包含患有所述癌症的受试者的所有癌细胞的至少1%、至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%或至少50%。
所述癌症治疗可以包括涉及作为靶分子的SSEA4的任何方法。这样的方法可以是例如使用结合分子SSEA4并影响表达SSEA4的癌细胞的活力,优选杀伤表达SSEA4的癌细胞的药剂的治疗。实例是溶瘤病毒、ADCC和免疫毒素。
溶瘤病毒是优先感染和杀伤癌细胞的病毒。随着被感染的癌细胞通过溶胞作用被破坏,它们释放出新的感染性病毒颗粒以帮助破坏剩余肿瘤。溶瘤病毒被认为不仅造成肿瘤细胞的直接破坏,而且还刺激宿主的抗肿瘤免疫反应。特异性靶向(例如,靶向SSEA4)包括修饰病毒外壳蛋白以靶向肿瘤细胞(例如,利用对SSEA4具有特异性的抗原结合结构域),同时减少进入非肿瘤细胞。
双特异性T细胞衔接体(engager)是研究用作抗癌药物的一类人工双特异性单克隆抗体。它们指导宿主的免疫系统(更具体地是T细胞的细胞毒性活性)对抗癌细胞。
BiTE是在约55千道尔顿的单肽链上由不同抗体的两个单链可变片段(scFv)或者来自四个不同基因的氨基酸序列组成的融合蛋白。scFv之一通过CD3受体结合T细胞,且其他通过肿瘤特异性分子(例如,SSEA4)结合肿瘤细胞。与其他双特异性抗体相同,且不同于普通的单克隆抗体,在T细胞和肿瘤细胞之间形成连接。这导致T细胞通过产生蛋白质如穿孔蛋白和颗粒酶对肿瘤细胞发挥细胞毒性活性,而不依赖于MHC I或共刺激分子的存在。这些蛋白质进入肿瘤细胞并启动细胞的凋亡。这种作用模拟在T细胞攻击肿瘤细胞过程中观察到的生理过程。抗体依赖性细胞介导的细胞毒性(ADCC)是需要存在与靶分子表面结合的抗体的免疫系统攻击机制。抗体由结合靶抗原(如SSEA4)的结合区(Fab)和可由免疫细胞通过其表面上的Fc受体检测到的Fc区形成。这些Fc受体在许多免疫系统细胞(包括自然杀伤细胞)的表面上发现。在自然杀伤细胞遭遇抗体包被的细胞时,Fc区与它们的Fc受体相互作用,导致穿孔蛋白和颗粒酶B的释放。这两种化学物质导致肿瘤细胞启动程序性细胞死亡(细胞凋亡)。已知诱导该细胞杀伤方法的抗体包括利妥昔单抗、奥法木单抗、曲妥珠单抗、西妥昔单抗和阿仑单抗。目前正在开发的第三代抗体具有改变的Fc区,其对特定类型的Fc受体(FcγRIIIA)具有更高的亲和性,这可以极大地提高ADCC率。
免疫毒素是由连接到毒素的靶向部分(例如,靶向于SSEA4)组成的人造蛋白。在该蛋白结合于细胞时,其通过胞吞作用被吸收,并且毒素杀伤该细胞。这些嵌合蛋白通常由连接到毒素片段的修饰抗体或抗体片段制成。“靶向部分”由特异性结合于通过细胞(优选特定细胞类型(例如,表达SSEA4的细胞))表达的抗原的抗体的Fv部分组成。毒素通常是来源于细菌或植物蛋白(已经从其移除天然结合结构域)的细胞毒性蛋白,使得Fv将毒素指引到靶细胞上的抗原。
在本发明的优选实施方式中,表达SSEA4的癌细胞被表达如本文公开的对SSEA4具有特异性的嵌合抗原受体的工程化细胞(优选T细胞)所靶向。该工程化(T)细胞可用于过继性(T)细胞治疗。
在一个方面,本发明提供了包含表达如本文公开的对抗原SSEA4具有特异性的嵌合抗原受体(SSEA-CAR)的遗传修饰细胞的细胞群体。优选地,所述包含表达对抗原SSEA4具有特异性的嵌合抗原受体(SSEA-CAR)的遗传修饰细胞的细胞群体是分离的细胞群体。
在一个方面,本发明提供了用于免疫治疗的表达如本文公开的SSEA-CAR的工程化细胞的群体或分离群体。该免疫治疗可用于治疗患有癌症的受试者的癌症,其中所述癌症的至少癌细胞的亚群表达SSEA4。
所述表达SSEA4的癌细胞的亚群可以包含患有所述癌症的受试者的所有癌细胞中的至少一个表达SSEA4的细胞。优选地,所述表达SSEA4的癌细胞的亚群可以包含患有所述癌症的受试者的所有癌细胞的至少1%、至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%或至少50%。
在需要的情况下,所述工程化细胞的群体或分离群体在用于所述免疫治疗之前扩增到细胞的治疗有效量。所述癌症可选自人乳腺癌、人肾细胞癌(RCC)和人卵巢癌。所述癌症可以是TNBC。所述细胞可以是免疫细胞或免疫细胞亚组,优选T细胞或T细胞亚组或者NK细胞或NK细胞亚组。
在一个方面,本发明提供一种治疗癌症的方法,其包括对有需要的受试者施用有效治疗所述癌症的量的富集的表达如本文公开的SSEA-CAR的工程化细胞。该癌症治疗可以是在患有癌症的受试者中,其中所述癌症的癌细胞的至少一个亚群表达SSEA4。
所述癌症可选自人乳腺癌、人肾细胞癌(RCC)和人卵巢癌。所述癌症可以是TNBC。所述细胞可以是免疫细胞或免疫细胞亚组,优选T细胞或T细胞亚组或者NK细胞或NK细胞亚组。
在一个方面,本发明提供了一种药物组合物,其包含表达如本文公开的对抗原SSEA4具有特异性的CAR的遗传修饰细胞和药学上可接受的载体。
所述药物组合物可用于治疗患有癌症的受试者的癌症。所述癌症可选自人乳腺癌、人肾细胞癌(RCC)和人卵巢癌。所述癌症可以是TNBC。所述细胞可以是免疫细胞或免疫细胞亚组,优选T细胞或T细胞亚组或者NK细胞或NK细胞亚组。
在一个方面,本发明提供了一种药物组合物,其包含表达如本文公开的SSEA-CAR的遗传修饰细胞和药学上可接受的载体及用于所述癌症的联合治疗的化疗剂。
在一个方面,本发明提供了核酸分子和核酸构建体(如载体),其编码如本文公开的本发明的SSEA-CAR。
过继性细胞转移利用基于免疫细胞(优选基于T细胞)的细胞毒性反应攻击癌细胞。对患者的癌症具有天然的或基因工程化的反应性的免疫细胞(优选T细胞)在体外产生,且然后转移返回到癌症患者体内。嵌合抗原受体为癌症的这种过继性细胞免疫治疗提供了有前景的途径。本发明的CAR可以被工程化以包含细胞外结构域,其具有与T细胞抗原受体复合体ζ链(例如,CD3ζ)的细胞内信号传导结构域融合的抗原结合结构域。细胞外和细胞内结构域可以通过跨膜结构域直接连接,或者细胞外结构域可以融合于跨膜结构域且细胞内结构域可以融合于另一个跨膜结构域。如果细胞外和细胞内结构域连接到单独的跨膜结构域,那么跨膜结构域相互作用以激活CAR(分割CAR或多链CAR)。本发明的工程化免疫细胞(优选T细胞)表达本发明的CAR,其能够基于CAR的抗原结合特异性重定向抗原识别。该CAR的特异性是对于发现在癌细胞(如,人乳腺癌、RCC和人卵巢癌)上表达的抗原SSEA4。
通常,CAR可包含含有抗原结合结构域的细胞外结构域、跨膜结构域和细胞内信号传导结构域。细胞外结构域可通过接头连接到跨膜结构域。细胞外结构域还可包含信号肽。
“信号肽”是指引导细胞内的蛋白质转运和定位例如到特定细胞器(如内质网)和/或细胞表面的肽序列。
“抗原结合结构域”是指特异性结合抗原(并由此能够靶向含有抗原的细胞)的CAR的区域。本发明的CAR可包含一个或多个抗原结合结构域。通常,CAR上的靶向区域是细胞外的。抗原结合结构域可包含抗体或其片段。抗原结合结构域可包含,例如,全长重链、Fab片段、单链Fv(scFv)片段、二价单链抗体或双链抗体。特异性地结合给定抗原的任何分子(如来自天然存在的受体的亲合体(affibodies)或配体结合结构域)均可用作抗原结合结构域。通常抗原结合结构域是scFv。一般地,在scFv中,免疫球蛋白重链和轻链的可变部分通过柔性接头融合以形成scFv。这样的接头可以是例如“(G4/S1)3-接头”。
在一些情况下,抗原结合结构域源自CAR将在其中使用的相同物种是有益的。例如,如果计划在人类中治疗性地使用,CAR的抗原结合结构域包含人或人源化抗体或其片段可能是有益的。人或人源化抗体或其片段可通过本领域熟知的多种方法制造。如本文所用,“间隔区”或“铰链”是指在抗原结合结构域和跨膜结构域之间的亲水性区域。本发明的CAR可包含细胞外间隔结构域,但也可能省略这样的间隔区。间隔区可包括抗体或其片段的Fc片段、抗体或其片段的铰链区、抗体的CH2或CH3区、辅助蛋白、人工间隔区序列或其组合。间隔的一个突出实例是CD8α铰链。
CAR的跨膜结构域可来源于这样的结构域的任何期望的天然或合成来源。如果该来源是天然的,则结构域可源自任何膜结合的或跨膜的蛋白质。跨膜结构域可来源于例如CD8α或CD28。
本发明的CAR的胞质结构域或细胞内信号传导结构域造成其中表达该CAR的免疫细胞的至少一种正常效应子功能的激活。"效应子功能"表示细胞的专门化功能,例如在T细胞中,效应子功能可以是细胞溶解活性或辅助细胞活性,包括细胞因子的分泌。细胞内信号传导结构域是指转导效应子功能信号并且指导表达本发明的CAR的细胞实施专门化功能的蛋白质部分。细胞内信号传导结构域可包括足以转导效应子功能信号的给定蛋白质的细胞内信号传导结构域的任何完整或截断部分。
用于CAR中的细胞内信号传导结构域的突出实例包括在抗原受体接合之后协同作用以启动信号转导的T细胞受体(TCR)和辅助受体的胞质序列。
通常,T细胞激活可以由两种不同类的胞质信号传导序列介导,第一是通过TCR启动抗原依赖性初级激活的那些(初级胞质信号传导序列),和第二是以非抗原依赖性方式起作用以提供次级或共刺激信号的那些(次级胞质信号传导序列)。
以刺激方式起作用的初级胞质信号传导序列可以含有ITAM(基于免疫受体酪氨酸的激活基序信号传导基序)。
经常用于CAR中的含ITAM的初级胞质信号传导序列的实例是来源于TCRζ,FcRγ,FcRβ,CD3γ,CD3δ,CD3ε,CD5,CD22,CD79a,CD79b和CD66d的那些。最突出的是来源于CD3ζ的序列。
CAR的胞质结构域可以被设计为包含CD3-ζ信号传导结构域本身或与任何其他所需的胞质结构域结合的CD3-ζ信号传导结构域。CAR的胞质结构域可以包含CD3ζ链部分和共刺激信号传导区。共刺激信号传导区是指包含共刺激分子的细胞内结构域的CAR的部分。共刺激分子是淋巴细胞对抗原的有效反应所需的抗原受体或其配体以外的细胞表面分子。共刺激分子的实例是CD27,CD28,4-1BB(CD137),OX40,CD30,CD40,PD-1,ICOS,淋巴细胞功能相关抗原-1(LFA-1),CD2,CD7,LIGHT,NKG2C,B7-H3。
CAR的胞质信号传导部分内的胞质信号传导序列可以以随机或指定的顺序彼此连接。长度优选为2至10个氨基酸的短的寡肽或多肽接头可以形成连接。突出的接头是甘氨酸-丝氨酸双重体(doublet)。
作为实例,胞质结构域可包含CD3-ζ的信号传导结构域和CD28的信号传导结构域。在另一个实例中,胞质结构域可包含CD3-ζ的信号传导结构域和CD27的信号传导结构域。在另一个实例中,胞质结构域可以包含CD3-ζ的信号传导结构域、CD28的信号传导结构域和CD27的信号传导结构域。
本发明的CAR可以设计为包含如本文所述的上述结构域的任何部分或部件。由抗原结合结构域介导的本发明CAR的特异性是对于抗原SSEA4,构建功能性CAR所必需的所有其他结构域都可以选自上文提到的或者本领域技术人员熟知的选择。本发明的示例性CAR可以具有SEQ ID NO:5或SEQ ID NO:6的氨基酸序列。
图3显示了外周血T细胞(包括非修饰T淋巴细胞)表面上的嵌合抗原受体构建体“重_轻scFv定向”(SEQ ID NO:5)和“轻_重scFv定向”(SEQ ID NO:6)的表达。天然Pan T细胞从外周血单核细胞(PBMC)分离,并在刺激基质(GMP TransAct CD3/CD28试剂盒;Miltenyi Biotec GmbH)以及IL-2的存在下培养。对于永久性受体表达,淋巴细胞以感染复数(MOI)2进行慢病毒转导。用针对IgG间隔结构域的抗体通过流式细胞术测定表面表达。
图4说明在用SSEA-4阳性肿瘤细胞(NTERA2)刺激后,CAR诱导的促炎性细胞因子IL-2(图4A)、TNFα(图4B)和IFNγ(图4C)的分泌。显示了携带轻_重scFv-和CH2CH3间隔结构域的受体构建体的实验结果。1×105个CAR+T细胞与肿瘤细胞以1:2的比率共培养24小时,随后使用MACSPlex技术(Miltenyi Biotec GmbH)测定IL-2、TNFα和IFNγ的细胞因子水平(MACSPlex Assays设计用于测定单一样品中可溶性分析物的浓度。该分析是基于MACSPlex(MPx)捕获珠,其显示规定的荧光性质并可以使用标准流式细胞技术识别。MACSPlex Cytokine 12试剂盒(人)和MACSPlex Cytokine 10试剂盒(小鼠)内的MPx捕获珠含有各种荧光标记的珠群体的混合物,各自涂布有与样品内的相应细胞因子之一反应的特异性抗体)。平行地,在不存在抗原刺激的情况下培养CAR+T细胞以测定嵌合受体的背景活性。分别具有和不具有肿瘤细胞的非修饰T细胞的对照培养物用于评估CAR介导的淋巴细胞反应的特异性。用两个供体且一式两份地进行实验,并测定平均值以及标准差。纵轴表示如在共培养物上清液中测定的相应细胞因子的浓度(以pg/mL计)。在抗原接触后,两个供体的转基因T细胞表现出IL-2(图4A)、TNFα(图4B)和IFNγ(图4C)分泌的至少10倍的增加,而具有非修饰T细胞的共培养物仅仅显示可忽略量的细胞因子产生。而且,在其中抗SSEA-4-CAR T细胞在没有肿瘤细胞的情况下培养的测试样品中,细胞因子产生是在“背景噪声”内。这些结果因此验证了所开发的嵌合受体以抗原依赖性和CAR特异性的方式激活T细胞的功能性。
图5显示了抗原刺激后,评估修饰CD8+T细胞的CAR诱导细胞溶解活性的细胞毒性试验结果。显示了携带轻_重scFv-和CH2CH3间隔结构域的受体构建体的实验结果。将效应细胞(CD8+CAR+T细胞)以10:1,5:1,2.5:1,1:1和0.5:1的比率与1×104个荧光标记的SSEA-4-阳性肿瘤细胞(NTERA2)一起涂板。共培养24小时后,通过流式细胞术测定活肿瘤细胞的量,并评估每个比率的细胞毒性效力。为了进行特异性比较,使用具有非修饰T细胞的共培养物。用两个供体(图5A:供体#7;图5B:供体#8)且一式四份地进行实验,测定平均值以及标准差。
数据显示为与在不存在T细胞(0%)的情况下孵育的NTERA2靶细胞相比的细胞毒性百分比。对于供体#7(图5A)和供体#8(图5B)两者,均可观察到CAR+T细胞的选择性肿瘤细胞杀伤,表明CAR激活不仅促进细胞因子分泌,而且还促进细胞毒性活性。
具体实施方式
本发明还包括核酸(DNA或RNA)构建体,其包含编码对SSEA4具有特异性的CAR的氨基酸序列的序列。
在本发明的一个实施方式中,产生编码对SSEA4具有特异性的CAR的DNA构建体(载体、质粒)。编码对SSEA4具有特异性的抗原结合结构域的核酸序列至少与编码跨膜结构域的核酸序列和后续的编码细胞内结构域的核酸序列融合。这种表达载体的构建可以通过本领域熟知的重组方法进行。或者,可以合成地产生该核酸序列。
在本发明的一个实施方式中,产生表达本发明的CAR的细胞。编码本发明的CAR的DNA构建体可以通过本领域熟知的方法(例如基于病毒的系统、物理方法、生物方法、化学方法)转染或转导到宿主细胞中。不管用于将编码本发明的CAR的核酸整合(优选稳定地整合)到宿主细胞中的方法如何,其结果是宿主细胞表达对SSEA4具有特异性的CAR。
在本发明的一个实施方式中,对抗原SSEA4具有特异性的CAR在免疫细胞或免疫细胞亚组中表达。
在本发明的一个实施方式中,对抗原SSEA4具有特异性的CAR在T细胞或T细胞亚组中表达。
在本发明的一个实施方式中,对抗原SSEA4具有特异性的CAR在NK细胞或NK细胞亚组中表达。
在本发明的一个实施方式中,在用于产生表达对SSEA4具有特异性的CAR(“SSEA-CAR”)的工程化细胞的转染/转导过程后,通过本领域熟知的方法,例如,基于荧光的分离技术(如)或磁性细胞分离方法(如),使这种工程化细胞从未转染/未转导的细胞分离(富集或分开)。
在本发明的一个实施方式中,免疫细胞(优选T细胞)的来源是获自受试者。免疫细胞(优选T细胞)可获自多种来源,例如外周血单核细胞(PMBC)、骨髓、淋巴结组织、脐带血或胸腺组织。对于这些细胞的富集,可以使用本领域熟知的方法,例如通过FicollTM或PERCOLLTM梯度的离心,或者阳性/阴性选择技术,如荧光分选(例如FCASsort)或磁性分选(例如)。
在一个实施方式中,受试者的血液样品的T细胞被磁性标记(例如用与分别对CD4和CD8具有特异性的抗体偶联的磁珠)、洗涤、磁力富集和收集。然后可以将这些T细胞工程化以在其细胞表面上表达SSEA4-CAR。
在本发明的一个实施方式中,在遗传修饰之前或之后,一般地可以使用本领域熟知的方法(例如使用抗CD3/抗CD28珠或者抗CD3/抗CD28纳米基质(EP2711418A1)的多克隆刺激)激活和扩增表达SSEA4-CAR的分离/富集的工程化T细胞以增加工程化T细胞的量。优选地,所述工程化T细胞的量提高到治疗有效量。
在本发明的一个实施方式中,产生表达本发明的CAR的细胞。编码本发明的CAR的RNA可以通过本领域熟知的方法(例如基于病毒的系统、物理方法、生物方法、化学方法)转染或转导到宿主细胞中。总体上,这种“RNA工程化细胞”在WO2013/040557中详细公开。不管用于将编码本发明的CAR的RNA整合到宿主细胞中的方法如何,其结果是宿主细胞表达对SSEA4具有特异性的CAR。使用“RNA工程化细胞”导致CAR在细胞中表达有限的时间(瞬时表达)的结果。
在本发明的一个实施方式中,表达SSEA4-CAR的遗传修饰细胞(优选T细胞)在封闭的细胞培养体系中自动产生。用于产生遗传修饰细胞(优选T细胞、T细胞亚组或T细胞祖细胞)的方法包括以下步骤:
a)提供细胞样品;
b)通过离心制备所述细胞样品;
c)磁性分离所述细胞(优选T细胞、T细胞亚组或T细胞祖细胞);
d)使用调节剂激活富集的细胞(优选T细胞、T细胞亚组或T细胞祖细胞);
e)遗传修饰所述细胞(优选T细胞、T细胞亚组或T细胞祖细胞)以表达SSEA4-CAR;
f)在培养室中扩增遗传修饰的T细胞、T细胞亚组或T细胞祖细胞;
g)洗涤经培养的细胞(优选T细胞、T细胞亚组或T细胞祖细胞)。所有这些步骤都可以在封闭且无菌的系统中进行。
该方法特别适用于制备基因修饰的细胞(优选T细胞、T细胞亚组或T细胞祖细胞),其中富集的细胞(优选T细胞、T细胞亚组或T细胞祖细胞)通过使用病毒和/或非病毒载体进行基因修饰。
这些步骤中的任一个可以重复、省略或者可以以不同的顺序发生。
在本发明的一个实施方式中,调节剂选自激动性抗体和/或细胞因子。
在本发明的一个实施方式中,在所述自动化过程中,在培养之前或之后,基因修饰的细胞(优选T细胞、T细胞亚组或T细胞祖细胞)通过对细胞进行磁性标记和磁性分离而富集以在最终细胞产物中获得更高频率的基因修饰的细胞,优选T细胞、T细胞亚组或T细胞祖细胞。
作为用于细胞修饰的封闭且无菌的系统,可以使用全自动细胞处理装置CliniMACS和相关联的管道组(Miltenyi Biotec GmbH,德国)(WO2009/072003)。该封闭系统满足几乎任何种类的细胞产品的GMP级处理的要求,并且可以允许降低洁净室要求、改善细胞制造过程的技术转移和协调。已经对于使细胞治疗剂的制造过程全自动化和标准化进行了开发。该仪器可以进行样品加载、细胞洗涤、基于密度的细胞分离(包括红细胞减少和血浆收获)、磁性分离、细胞激活、细胞修饰(转导)、细胞培养和最终产品配制。因此使得过程模块(“步骤”)能够灵活地整合在封闭的、自动化和安全的GMP符合工作流程中,重现复杂的所需生物学过程。
在本发明的一个实施方式中,本发明的SSEA4-CAR用于治疗患有与SSEA4的异常表达相关的疾病、紊乱或病症的受试者。
在本发明的一个实施方式中,本发明的SSEA4-CAR用于治疗患有癌症的受试者的癌症,其中所述癌症的至少癌细胞的亚群表达SSEA4,例如人乳腺癌、RCC和人卵巢癌。分离受试者的免疫细胞,例如T细胞。受试者可以患有所述癌症或者可以是健康受试者。这些细胞在体外或体内(?)进行遗传修饰以表达SSEA4-CAR。这些工程化细胞可以在体外或体内(?)激活和扩增。在细胞治疗中,这些工程化细胞被输注到有需要的受体中。这些细胞可以是药物组合物(所述细胞加上药学上可接受的载体)。输注的细胞能够杀伤受体中表达SSEA4的癌细胞(或至少阻止其生长)。受体可以是从其获得细胞的同一受试者(自体细胞疗法)或者可以来自相同物种的另一受试者(同种异基因细胞疗法)。
在本发明的一个实施方式中,患有癌症的受试者可以用本发明的药物组合物连同免疫调节剂(例如但不限于雷帕霉素或阻断PD-1/PD-L1或CTLA4信号传导的药剂)一起治疗。
在本发明的一个实施方式中,由于表达SSEA4的癌细胞可能仅仅是受试者的癌细胞的亚群,受试者可以另外用化疗进行治疗。适于治疗癌症的化疗剂是本领域熟知的。
在本发明的另一个实施方式中,患有所述癌症的受试者可以通过另外的靶向治疗(例如但不限于抗体介导的Her2靶向)而非化疗治疗来治疗。或者,受试者也可以通过化疗进行治疗。
EP14305477.3中公开了用于评估患有癌症的个体中与化疗抗性相关的预后的方法,所述方法包括以下步骤:a)提供待测试的样品,和b)检测测试样品中SSEA4的表达,其中所述测试样品中SSEA4的表达指示不良预后。因此,在本发明的一个实施方式中,在用本发明的工程化细胞治疗之前,分析患有癌症的受试者的癌症类型(进行诊断)。如果癌症分析表明癌症包含至少表达SSEA4的癌细胞亚群,则用SSEA4-CAR工程化细胞治疗患有所述癌症的受试者是有前景的和可取的。但是患有癌症的受试者(其中所述癌症不具有表达SSEA4的癌细胞)也可以在患有癌症的受试者的治疗(例如,化疗治疗)过程中,用如本文公开的本发明的SSEA4-CAR工程化细胞进行治疗作为预防和防止生成表达SSEA4的癌细胞的措施。
在本发明的一个实施方式中,将表达SSEA4-CAR的细胞施用于患有癌症的受试者作为如上文公开的细胞治疗,但还与同样在相同工程化细胞上表达的第二激活性CAR组合施用,从而识别另外的表位以提高表达两种CAR的工程化细胞的特异性。该表位可以是膜结合的、细胞外基质的部分或者可溶性组分。在本发明的一个实施方式中,将表达SSEA4-CAR的细胞施用于患有癌症的受试者作为如上文公开的细胞治疗,但还与同样在相同工程化细胞上表达的第二激活CAR组合施用,从而识别表达SSEA4的癌细胞上的另外的表位以提高表达两种CAR的工程化细胞的特异性。该表位可以是膜结合的、细胞外基质的部分或者可溶性组分。
在本发明的一个实施方式中,将表达SSEA4-CAR的细胞施用于患有癌症的受试者作为如上文公开的细胞治疗,但还与同样在相同工程化细胞上表达的第二抑制性CAR组合施用,从而识别另外的表位以提高表达两种CAR的工程化细胞的特异性。该表位可以是膜结合的、细胞外基质的部分或者可溶性组分。
被工程化以表达SSEA4-CAR的免疫细胞(优选T细胞)可以单独施用,或者与稀释剂和/或其它组分(如IL-2或其它细胞因子或细胞群体)组合作为药物组合物施用。简而言之,本发明的药物组合物可以包含与一种或多种药学上或生理学上可接受的载体、稀释剂或赋形剂组合的如本文所述的遗传修饰细胞的细胞群体。这样的组合物可以包含缓冲剂(如中性缓冲盐水、磷酸盐缓冲盐水等);碳水化合物(如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露醇);蛋白质;多肽或氨基酸(如甘氨酸);抗氧化剂;螯合剂(如EDTA或谷胱甘肽);佐剂(如氢氧化铝);和防腐剂。
优选地,配制本发明的组合物用于静脉内施用。向受试者施用细胞组合物可以以本领域已知的任何方便的方式进行。
本发明的药物组合物可以以适合于待治疗的疾病的方式施用。适合的剂量可以通过临床试验确定。但是施用的量和频率也将由例如患者的病情、患者疾病的类型和严重性等因素决定和影响。
包含本文公开的免疫细胞(优选T细胞)的药物组合物可以以104至109个细胞/kg体重,优选105至106个细胞/kg体重的剂量施用。细胞组合物也可以以这些剂量施用多次。细胞组合物可以直接注射到肿瘤、淋巴结或感染部位中。
可使用本领域已知的方法将细胞激活并扩增至治疗有效量。
本发明的细胞可以与例如化疗、放射、免疫抑制剂、抗体或抗体治疗组合使用。
定义
除非另有定义,本文使用的技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。
术语“化疗抗性”是指患有癌症的受试者的一些癌细胞(至少一个细胞)抵抗化疗治疗的预期效应。
术语“肿瘤”在医学上称为瘤(neoplasm)。不是所有的肿瘤都是癌性的;良性肿瘤不侵入邻近组织并且不扩散到整个身体。
术语“癌症”在医学上称为恶性肿瘤。癌症是涉及失调的细胞生长的一组广泛的疾病。在癌症中,细胞(癌细胞)不受控地分裂和生长,形成恶性肿瘤,并且侵入身体的邻近部分。癌症还可通过淋巴系统或血流扩散到身体的更远方的部分。有超过200种不同的已知癌症影响人类。
术语“化疗”或“化疗治疗”是指用作为标准化方案的部分的一种或多种细胞毒性抗肿瘤药物(“化疗剂”或“化疗药物”)治疗癌症(癌细胞)。化疗可以以治愈目的被给予,或者其可以以延长生命或缓解症状为目标。其通常与其它癌症治疗(例如放疗、手术和/或热疗法)联合使用。传统的化疗剂通过杀伤快速分裂(大多数癌细胞的主要特性之一)的细胞而起作用。这意味着化疗也伤害在正常情况下快速分裂的细胞:骨髓、消化道和毛囊中的细胞。这造成化疗的最常见副作用:骨髓抑制(血细胞产生减少,因此也是免疫抑制)、粘膜炎(消化道内层的炎症)和脱发(毛发损失)。
一些较新的抗癌药物(例如,各种单克隆抗体或类似本发明的工程化细胞的那些工程化细胞)不具有无差别的细胞毒性,而是靶向于在癌细胞中异常表达且是其生长所必需的蛋白。这样的治疗通常称为“靶向治疗”(与常规化疗不同),并且常常在抗肿瘤治疗方案中与传统化疗剂一起使用。
如本文所用的术语“化疗药物”和“化疗”所指的经典化疗药物的类型是:
烷化剂:烷化剂是目前使用的最老的一组化疗药物。它们这样命名是因为它们能够使许多分子(包括蛋白质、RNA和DNA)烷基化。这种通过其烷基与DNA或RNA共价结合的能力是其抗癌作用的主要原因。这导致称为细胞凋亡的程序性细胞死亡的形式。烷化剂在细胞周期中的任何时间点起作用,且因此被称为非细胞周期依赖性药物。由于这个原因,对细胞的作用是剂量依赖性的;死亡的细胞的分数直接与药物的剂量成正比。烷化剂的亚型是氮芥类、亚硝基脲类、四嗪类、氮丙啶类、顺铂类和衍生物,以及非经典的烷化剂。氮芥类包括氮芥、环磷酰胺、美法仑、苯丁酸氮芥、异环磷酰胺和白消安。亚硝基脲类包括N-亚硝基-N-甲基脲(MNU)、卡莫司汀(BCNU)、洛莫司汀(CCNU)和司莫司汀(MeCCNU)、福莫司汀和链脲霉素。四嗪类包括达卡巴嗪、米托唑胺和替莫唑胺。氮丙啶类包括噻替派、丝裂霉素(mytomycin)和亚胺醌(AZQ)。顺铂和衍生物包括顺铂、卡铂和奥沙利铂。它们通过与生物学重要的分子中的氨基、羧基、巯基和磷酸基团形成共价键而影响细胞功能。非经典的烷化剂包括丙卡巴肼和六甲三聚氰胺。马磷酰胺是作为化疗药物进行研究的氧氮磷环(oxazaphosphorine)(环磷酰胺样)烷化剂。
抗代谢物:如本文所用的术语“抗代谢物”和“DNA合成和转录抑制剂”具有可互换的含义,并且定义阻碍DNA和RNA合成的一组分子。它们中的许多具有与DNA和RNA的构建块类似的结构。抗代谢物类似于核碱基或核苷,但具有改变的化学基团。这些药物通过阻断DNA合成所需的酶或变成为合并到DNA或RNA中而发挥其作用。通过抑制参与DNA合成的酶,它们阻止有丝分裂,因为DNA不能自我复制。此外,在该分子错误并入到DNA中之后,可能发生DNA损伤并诱导程序性细胞死亡(细胞凋亡)。与烷化剂不同,抗代谢物是细胞周期依赖性的。这意味着它们仅在细胞周期的特定部分中起作用,在这种情况下是S期(DNA合成阶段)。由于这一原因,在某一剂量下,效应达到稳定期,且随剂量增加没有更多的细胞死亡成比例地发生。抗代谢物的亚型是抗叶酸类、氟嘧啶类、脱氧核苷类似物和硫代嘌呤类。抗叶酸类包括氨甲蝶呤和培美曲塞。氟嘧啶类包括氟尿嘧啶和卡培他滨。氟尿嘧啶是在细胞中代谢以形成至少两种活性产物(5-氟尿苷-单磷酸(FUMP)和5-氟-2'-脱氧尿苷5'-磷酸(fdUMP))的核碱基类似物。FUMP变成为并入RNA中,且fdUMP抑制酶(胸苷酸合成酶);这两者都导致细胞死亡。卡培他滨是5-氟尿嘧啶的前药,其在细胞中分解以产生活性药物。脱氧核苷类似物包括阿糖胞苷、吉西他滨、地西他滨、维达扎、氟达拉滨、奈拉滨、克拉屈滨、氯法拉滨和喷司他丁。硫代嘌呤类包括硫鸟嘌呤和巯基嘌呤。
抗微管剂:抗微管剂是通过阻止微管功能而阻断细胞分裂的植物来源的化学品。长春花生物碱类和紫杉烷类是抗微管剂的两个大组。长春花生物碱类阻止微管的形成,而紫杉烷类阻止微管解聚。通过这样做,它们阻止癌细胞完成有丝分裂。这之后,发生细胞周期停滞,其诱导程序性细胞死亡(细胞凋亡)。长春花生物碱类来自马达加斯加蔓长春花(Madagascar periwinkle),长春花(Catharanthus roseus)。紫杉烷类是天然和半合成的药物。该种类中的第一种药物(紫杉醇)最初提取自太平洋紫杉树,短叶红豆杉(Taxus brevifolia)。现在这种药物和该种类中的另一种药物(多西紫杉醇)是从在另一种紫杉树(欧洲红豆杉(Taxus baccata))的树皮中发现的化学物质半合成产生的。这些药物促进微管稳定性,阻止其解聚。多西紫杉醇在S期中发挥其作用。
拓扑异构酶抑制剂:拓扑异构酶抑制剂是影响两种酶(拓扑异构酶I和拓扑异构酶II)的活性的药物。当DNA双链螺旋解开时,例如在DNA复制或翻译期间,邻近的未打开的DNA更紧地卷绕(超螺旋),就像打开绞绳的中部。由这种作用引起的应力部分地得到拓扑异构酶援助。它们在DNA中产生单链或双链断裂,降低DNA链中的张力。这允许DNA的正常解旋在复制或翻译过程中发生。对拓扑异构酶I或II的抑制干扰这两种过程。两种拓扑异构酶I抑制剂(伊立替康和拓扑替康)是半合成地衍生自喜树碱(其获自中国观赏树喜树(Camptotheca acuminata))。靶向拓扑异构酶II的药物可以分为两组。拓扑异构酶II毒物造成结合于DNA的酶水平提高。这阻止DNA复制和翻译,造成DNA链断裂,并导致程序性细胞死亡(细胞凋亡)。这些药剂包括依托泊苷、多柔比星、米托蒽醌和替尼泊苷。第二组(催化抑制剂)是阻断拓扑异构酶II的活性并因此阻止DNA合成和翻译的药物,因为DNA不能正确解旋。该组包括新生霉素、美巴龙(merbarone)和阿柔比星。
细胞毒性抗生素:细胞毒性抗生素是具有各种作用机制的多样化的一组药物。该组包括蒽环类和其他药物,包括放线菌素、博来霉素、普卡霉素和丝裂霉素。多柔比星和柔红霉素是最初的两种蒽环类,并且获自细菌波赛链霉菌(Streptomyces peucetius)。这些化合物的衍生物包括表柔比星和伊达比星。蒽环组中的其他临床使用的药物是吡柔比星、阿柔比星和米托蒽醌。蒽环类的机制包括DNA嵌入(分子插入到DNA的两条链之间)、损伤细胞间分子的高反应性自由基的产生和拓扑异构酶抑制。放线菌素是嵌入DNA并阻止RNA合成的复杂分子。博来霉素(从轮枝链霉菌(Streptomyces verticillus)分离的糖肽)也嵌入DNA,但产生损伤DNA的自由基。这在博来霉素结合于金属离子、变成化学还原的并与氧反应时发生。丝裂霉素是具有烷基化DNA的能力的细胞毒性抗生素。
联合化疗涉及同时用多种不同药物治疗患者。药物的机制和副作用不同。最大的优势是使对任何一种药剂发生耐药性的可能性最小化。此外,药物通常可以以较低剂量使用,从而降低毒性。一个突出的实例是多柔比星与环磷酰胺的组合(A/C)。
当癌细胞不被治疗抑制或杀伤(至少在所施用的浓度下)时发生“化疗抗性”。换句话说,癌细胞抵抗化疗的作用。术语“化疗敏感性”具有相应的含义。
如本文所用术语“自体的”是指来源于受试者的任何物质,所述物质随后被重新引入到同一受试者。
如本文所用术语“同种异基因的”是指来源于不同受试者的任何物质,该受试者与重新引入所述物质的受试者的物种相同。
术语“治疗有效量”是指提供治疗益处的量。
术语“分离的”是指从天然状态改变或移除。例如,分离的细胞群体是指这样的细胞的富集和从在其天然存在状态下通常与所述分离的细胞相关联的其它细胞分开。分离的细胞群体是指基本上纯化的细胞群体,其是同源细胞群体。
关于抗体、其片段或CAR的抗原结合结构域的术语“特异性结合”或“对……特异性的”是指识别并结合特定抗原,但基本上不识别或结合样品中的其他分子的抗原结合结构域。特异性结合来自一个物种的抗原的抗原结合结构域也可能结合来自另一个物种的那种抗原。这种种间交叉反应性不违背该抗原结合结构域具有特异性的定义。特异性结合一抗原的抗原结合结构域还可能结合该抗原的不同等位基因形式(等位基因变体、剪接变体、异形体等)。这种交叉反应性不违背该抗原结合结构域具有特异性的定义。
如本文所用术语“工程化细胞”和“遗传修饰细胞”可互换使用。该术语是指含有和/或表达外源基因或核酸序列,这随后改变细胞或其后代的基因型或表型。特别地,该术语是指可通过本领域熟知的重组方法操作细胞(优选T细胞)以稳定或瞬时地表达在天然状态下不在这些细胞中表达的肽或蛋白质。例如,T细胞被工程化以在其细胞表面上表达人工构建体,例如嵌合抗原受体。例如,CAR序列可使用逆转录病毒或慢病毒载体递送到细胞中。
SSEA4VH,SSEA4VL,scFv VH-接头-VL,scFv VL-接头-VH,SSEA4-CAR VH-接头-VL和SSEA4-CAR VL-接头-VH的氨基酸序列分别在SEQ ID NO:1,SEQ ID NO:2,SEQ ID NO:3,SEQ ID NO:4,SEQ ID NO:5和SEQ ID NO:6中给出(以氨基酸的单字母代码方式)。如SEQ ID NO:1至SEQ ID NO:6中给出的氨基酸序列(蛋白质、多肽)是指保持如本文定义的相应氨基酸序列的预期功能的相应氨基酸序列的所有群集(constellation)。换句话说,分别朝向SEQ ID NO:1,SEQ ID NO:2,SEQ ID NO:3,SEQ ID NO:4,SEQ ID NO:5和SEQ ID NO:6的趋差性不应影响它们与抗原SSEA4特异性结合和/或是作为功能性CAR的潜能。因此,SEQ ID NO:1至SEQ ID NO:6的氨基酸序列可以分别是SEQ ID NO:1至SEQ ID NO:6的全长氨基酸序列。它也可以是具有一些氨基酸缺失、增加或替换,而仍保留如本文所述的预期功能的其变体。因此,本定义中包括分别在SEQ ID NO:1,SEQ ID NO:2,SEQ ID NO:3,SEQ ID NO:4,SEQ ID NO:5和SEQ ID NO:6中的氨基酸序列的变体,例如分别与SEQ ID NO:1,SEQ ID NO:2,SEQ ID NO:3,SEQ ID NO:4和SEQ ID NO:5基本上相似的氨基酸序列,其在氨基酸序列水平上具有至少70%、或至少75%、80%、85%、90%、95%、97%、98%或99%的序列一致性。在本发明的情况中,可以采用本领域熟知的氨基酸序列比对程序使用成对比对测定“序列一致性”。
T细胞或T淋巴细胞是在细胞介导免疫中起核心作用的淋巴细胞类型。通过在细胞表面上T细胞受体(TCR)的存在,它们可以与其它淋巴细胞如B细胞和天然杀伤细胞(NK细胞)区分开。存在多个T细胞亚组,各自具有不同的功能。
T辅助细胞(TH细胞)在免疫过程中辅助其它白细胞,包括B细胞成熟为浆细胞和记忆B细胞,以及激活细胞毒性T细胞和巨噬细胞。这些细胞也称为CD4+ T细胞,因为它们在其表面上表达CD4糖蛋白。当辅助T细胞通过在抗原提呈细胞(APC)表面上表达的MHC II类分子提呈肽抗原时,其变为激活的。一旦被激活,它们迅速分裂并分泌称为细胞因子的小蛋白质(其调节或辅助主动免疫应答)。这些细胞可以分化为分泌不同细胞因子的几种亚型(包括TH1,TH2,TH3,TH17,Th9或TFH)之一,以促进不同类型的免疫应答。来自APC的信号传导将T细胞导向特定亚型。
细胞毒性T细胞(TC细胞或CTL)破坏病毒感染细胞和肿瘤细胞,并且还参与移植排斥。这些细胞也称为CD8+ T细胞,因为它们在其表面表达CD8糖蛋白。这些细胞通过结合于在所有有核细胞的表面上存在的MHC I类分子相关的抗原而识别它们的靶标。
记忆T细胞是抗原特异性T细胞的亚组,其在感染消退后长期存在。它们在重新暴露于其同源抗原时快速扩增成大量的效应T细胞,从而为免疫系统提供针对过去的感染的“记忆”。记忆T细胞包括三种亚型:中央记忆T细胞(TCM细胞)和两种类型的效应记忆T细胞(TEM细胞和TEMRA细胞)。记忆细胞可以是CD4+或CD8+。记忆T细胞通常表达细胞表面蛋白CD45RO。以前称为抑制性T细胞的调节性T细胞(Treg细胞)对维持免疫耐受性至关重要。它们的主要作用是在免疫反应即将结束时关闭T细胞介导的免疫,并抑制逃避胸腺中的负选择过程的自身反应性T细胞。
已经描述了两种主要的CD4+ Treg细胞类别:Foxp3+ Treg细胞和Foxp3-Treg细胞。
天然杀伤T细胞(NKT细胞—不与先天免疫系统的天然杀伤细胞混淆)使适应性免疫系统与先天免疫系统桥接。不同于识别由主要组织相容性复合体(MHC)分子提呈的肽抗原的常规T细胞,NKT细胞识别由称为CD1d的分子提呈的糖脂抗原。一旦被激活,这些细胞可以执行归属于Th和Tc细胞二者的功能(即细胞因子产生和细胞溶解/细胞杀伤分子的释放)。
免疫治疗是定义为“通过诱导、增强或抑制免疫应答而治疗疾病”的医学术语。设计用于引发或放大免疫应答的免疫治疗被归类为激活免疫治疗,而减少或抑制免疫应答的免疫治疗被归类为抑制免疫治疗。作为激活性免疫治疗的癌症免疫治疗尝试刺激免疫系统以排斥和破坏肿瘤。过继性细胞转移使用基于细胞的(优选基于T细胞的)细胞毒性反应攻击癌细胞。对患者的癌症具有天然或遗传工程化反应性的T细胞在体外产生,和然后转移回到癌症患者体内。
如本文所用术语“治疗”是指降低疾病的至少一种体征或症状的频率或严重性。
术语“生物标志物”或“标志物”在本领域中是普遍的,并且可广泛地表示生物分子和/或其可检测部分(例如核酸、肽或脂质,如糖脂),其在个体中的定性和/或定量评估对于所述个体的表型和/或基因型的一个或多个方面(例如,对于所述个体的状态)是预测性的或提供信息(例如,预测性的,诊断性的和/或预后性的)。例如,生物标志物对于个体中癌症的化疗治疗的结果是预测性的或提供信息。如果生物标志物可用本领域已知的方法检测,则该生物标志物被表达(“生物标志物的表达”)。因此,生物标志物的表达不仅包括在核酸水平(DNA和/或RNA)和蛋白质水平的表达,而且包括在细胞上或细胞中的其它生物结构的表达(存在),如糖脂或者蛋白质活性。
如本文所用,术语“受试者”是指动物。优选地,受试者是哺乳动物,如小鼠、大鼠、牛、猪、山羊、鸡、狗、猴或人。更优选地,个体是人。受试者可以是患有疾病(如癌症)的受试者(患者),但受试者也可以是健康受试者。
如本文所用术语“靶标”是指与应由抗原结合结构域(例如,抗体的或CAR的抗原结合结构域)特异性识别的细胞相关的抗原或表位。该抗原或表位可以结合于细胞表面,但也可以是分泌的、细胞外膜的部分或从细胞脱落。
如本文所用术语“癌细胞的亚群”是指受试者的癌症的癌细胞可以是异质的。如EP14305477.3中所示,在一些癌症中,一些癌细胞在其细胞表面上表达SSEA4,而另一些不表达。因此,受试者的癌症的表达SSEA4的癌细胞是所述受试者的癌症中的癌细胞的亚群(或一部分)。亚群可以包含受试者的癌症的所有癌细胞内的至少一个细胞。亚群可以包含患有所述癌症的受试者的所有癌细胞的至少1%、至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%或至少50%。
如本文所用术语“抗体”是指多克隆或单克隆抗体及其片段,其可以通过本领域技术人员熟知的方法产生。抗体可以是任何物种的,例如,鼠科动物、大鼠、绵羊、人。出于治疗目的,如果要使用非人抗原结合片段,它们可以通过本领域已知的任何方法人源化。抗体还可以是修饰的抗体(例如,寡聚体、还原的抗体、氧化的抗体和标记的抗体)。
实施例
以下实施例旨在更详细地解释本发明,但不将本发明限制于这些实施例。
实施例1:SSEA4特异性抗体的氨基酸序列
所使用的特异性地结合SSEA4的抗体的免疫球蛋白重链和轻链的可变部分的氨基酸序列分别如SEQ ID NO:1和SEQ ID NO:2所给出。
这些序列或对SSEA4具有特异性的任何其衍生序列都可用于产生识别SSEA4的CAR。SEQ ID NO:1和SEQ ID NO:2中给出的序列仅仅是对抗原SSEA4具有特异性的序列的示例(序列以氨基酸的单字母代码给出)。其它序列可用于产生也对抗原SSEA4具有特异性的抗体的抗原结合结构域或CAR的抗原结合结构域。
实施例2:识别SSEA4的CAR的结构
所用接头可包含允许检测CAR的表位/标签,如图1所示。表位/标签的实例是YOL、cMYC或HIS。抗SSEA4特异性结合片段源自对SSEA4具有特异性的抗体。铰链区可来源于例如IgG结构域、CD8a或CD28,并且可以包含允许检测CAR的表位/标签。跨膜结构域可来源于例如CD8a或CD28,接着是一至三个信号传导结构域。这些结构域可来源于例如CD28、4-1BB、OX40或CD3ζ。
使用以下序列作为特异性序列。
对于SSEA4-CAR的抗原结合结构域,使用具有SEQ ID NO:3或SEQ ID NO:4的氨基酸序列(序列以氨基酸的单字母代码给出)的scFv。
SEQ ID NO:5和SEQ ID NO:6(也参见图2中的序列)表示对抗原SSEA4具有特异性的CAR的全氨基酸序列(序列以氨基酸的单字母代码给出)。
实施例3:慢病毒表达载体的产生
将SSEA4-CAR克隆到在人PGK启动子控制下的第三代SIN-慢病毒载体构建体中。用该表达质粒和编码结构蛋白gag-pol、rev和VSV-G包膜蛋白的其它质粒瞬时转染HEK 293T细胞导致病毒载体颗粒释放到上清液中。随后通过低速离心富集病毒载体颗粒并在-70℃下储存。
实施例4:T细胞分离和用SSEA4-CAR进行的遗传修饰
使用MicroBeads和MACS技术(Miltenyi Biotec GmbH,德国)从供体单采成分(apheresis)或血沉棕黄色层样品分离原代T细胞以达到超过90%的纯度(CD3+细胞)。洗涤磁力富集的细胞并重悬于补充200IU/mL人重组IL-2(Miltenyi Biotec GmbH,德国)的TexMACS培养基中。然后通过加入GMP TransAct CD3/CD28试剂(Miltenyi Biotec GmbH,德国)刺激T细胞。
24小时后,通过用CD25和CD69抗体对T细胞染色并在MACSQuant分析仪(Miltenyi Biotec GmbH,德国)中通过流式细胞术分析来证实成功的T细胞刺激。然后通过加入编码SSEA4-CAR的慢病毒载体以MOI=0.5-2转导经刺激的T细胞。静置培养4天后,洗涤细胞以除去过量的病毒载体和TransAct试剂,并再培养5-10天。通过使用抗人Fc荧光素染色活CD3+细胞中的SSEA4-CAR表面表达及流式细胞术测量病毒转导效率。取决于所用的MOI,基因标记的T细胞的数量范围在10和60%之间。
实施例5:SSEA4-CAR功能性
将表达SSEA4的靶细胞或不表达SSEA4的细胞以不同的效应细胞与靶细胞的比率与经扩增的表达SSEA4-CAR的T细胞一起或者,作为对照,与非转导T细胞一起孵育5小时。通过流式细胞术分析特异性靶细胞杀伤。
或者,用SSEA4阳性或阴性的细胞系再刺激效应细胞。通过流式细胞术分析细胞因子的产生(IFN-γ、IL-2、TNF-α)以及脱粒(CD107a)。只有携带SSEA4-CAR的T细胞能够杀伤靶细胞,显示细胞因子产生增加以及脱粒标志物上调。
- 还没有人留言评论。精彩留言会获得点赞!