含有与前列腺抗原特异性结合短肽的噬菌体及其应用的制作方法
本发明涉及生物技术和免疫分析技术领域,具体地说是含有与前列腺抗原特异性结合短肽的噬菌体及其应用。
背景技术:
前列腺疾病是男科最常见的疾病,包括前列腺炎、前列腺增生及前列腺癌等,其中前列腺癌是男性癌症患者中最常见的恶性肿瘤之一。随着生活水平的提高以及社会人口老龄化加重,前列腺癌的发病率逐年递增趋势更为明显。因此,前列腺癌早期快速、准确的检测具有十分重要的意义。
前列腺癌的主要诊断方法有前列腺特异性抗原系列检测,影像学检查,直肠指检,穿刺活体组织检查等。其中前列腺特异性抗原作为前列腺癌的肿瘤标记物已广泛应用于前列腺癌的早期诊断、疗效评估以及手术治疗的跟踪指标、预后判断等。前列腺抗原(PSA)具有高度组织来源特异性,正常状态下,PSA仅存在于前列腺组织、精液、前列腺液中,血液中PSA含量极低。当前列腺发生炎症或是癌变等病变时,前列腺组织会大量分泌PSA,并使其进入血液中,使血清中PSA含量升高。在血清中,PSA可以与含有丝氨酸蛋白酶抑制基团的的复合物共价结合形成复合物,因此血液中的PSA是以多种分子形态存在的。其中约10%~30%的前列腺特异性抗原以游离态的形式存在,即游离的PSA(free PSA,f-PSA);约70%~90%的前列腺特异性抗原与内源性蛋白酶抑制物α1-抗糜蛋白酶(α1-antichymotrypsin,ACT)结合形成前列腺特异性抗原-α1-抗糜蛋白酶复合物(PSA-ACT)。临床上通常以f-PSA与PSA-ACT的和作为总PSA(t-PSA),代表血清中的PSA水平。确定fPSA/tPSA比值,对前列腺癌的诊断、鉴别以及确定前列腺疾病性质具有非常重要的意义前列腺特异性抗原的传统检测方法主要有放射免疫检定法、免疫放射测定法、化学发光免疫分析法、金标免疫层析法、时间分辨荧光免疫分析法和酶联免疫分析法(ELISA)等。这些检测方法都是基于抗原与单克隆抗体之间的特异性免疫反应,借助于放射标记、化学发光、荧光分析等方法完成检测的。近些年来,为提高前列腺特异性抗原的检测灵敏度,加强前列腺癌的早期诊断,一些新型的PSA检测方法不断被科学家们研究探索,同样是基于抗原与单克隆抗体之间的特异性免疫反应,实现PSA的高灵敏检测。ELISA在免疫分析技术中表现出的高特异性和高灵敏度使其成为肿瘤标记物检测中非常实用的检测工具。基于ELISA试剂盒的PSA检测已经成为一种常规的检测手段。近二十年来,众多学者致力于前列腺抗原高特异性、高灵敏度单克隆抗体的筛选,并应用于ELISA试剂盒的研发。
噬菌体展示技术是将外源蛋白或多肽的DNA序列插入到噬菌体外壳结构蛋白基因的特定位置,使外源基因表达产物融合于结构蛋白的N端或C端,随噬菌体的组装而将外源蛋白或多肽展示到噬菌体表面的生物技术。噬菌体展示技术已广泛应用于生物科学技术的各个领域。丝状噬菌体是一类能够感染革兰阴性细菌的细菌病毒,主要包括M13、f1和fd噬菌体。基于噬菌体展示技术构建展示文库,可为诸多蛋白靶分子提供一个丰富的配体筛选资源,目前噬菌体展示文库主要有随机肽库和抗体文库。噬菌体展示随机多肽文库的构建是将特定长度的编码多肽的随机寡核苷酸序列插入到噬菌体基因的特定位点,使特定长度的不同序列的外源多肽展示于噬菌体表面。Petrenko与Smith等人以丝状噬菌体fd-tet为基础,构建出f8/8风景噬菌体文库。将编码随机八肽的寡核苷酸序列取代编码噬菌体pVIII蛋白N端Glu-Gly-Glu(E2-G3-E4)的核酸序列,将随机八肽展示于噬菌体表面。f8/8风景噬菌体文库中含有约3.0×109个展示有不同八肽序列的噬菌体克隆,而每种八肽序列在单一噬菌体的表面有近4000份相同的拷贝。f8/8风景噬菌体克隆应用于免疫分析检测具有很大的优势。噬菌体有极高的效价可以与靶标多价结合,噬菌体的制备简单、快速,特异性噬菌体克隆一经淘选获得后即可无限量培养扩增,成本廉价,噬菌体可经得起严酷的生存环境,在很宽的pH范围内稳定,能经得起核苷酶的处理,具有极好的耐温性,噬菌体在非水溶剂中稳定。鉴于上述众多优点,风景噬菌体作为一种新型的特异性探针应用于ELISA免疫分析领域中,必然具有良好的发展前景。
技术实现要素:
本发明的目的是提供含有与前列腺抗原特异性结合短肽的噬菌体及其应用。
为实现上述目的,本发明采用的技术方案为:
一种与前列腺抗原特异性结合的短肽,短肽的氨基酸序列F1为ERNSVSPS或F2为ATRSANGM。
所述短肽F1特异性识别f-PSA;F2同时识别f-PSA和PSA-ACT,即t-PSA。
一种与前列腺抗原特异性结合短肽的筛选方法,以游离态的前列腺抗原作为靶标对噬菌体文库进行生物淘选获得的噬菌体单克隆;而后以肿瘤标记物为靶标,通过噬菌体捕获实验进行特异性结合评价,确定特异性识别前列腺抗原的噬菌体单克隆,展示于该噬菌体单克隆表面的多肽即为前列腺抗原特异性结合的短肽。
所述前列腺抗原是游离态的前列腺特异性抗原(free PSA,f-PSA)和f-PSA与前列腺特异性抗原-α1-抗糜蛋白酶复合物(PSA-ACT)的和(总PSA,t-PSA)。
一种与前列腺抗原特异性结合短肽的应用,所述短肽作为前列腺抗原特异性配体探针。
所述特异性配体探针用于前列腺抗原的检测。
所述短肽作为特异性配体探针采用夹心ELISA法对f-PSA和t-PSA进行相应检测。
一种含有与前列腺抗原特异性结合的短肽的噬菌体,噬菌体为含有所述F1或F2短肽的噬菌体单克隆体。
所述的噬菌体单克隆是通过以游离态的前列腺抗原作为靶标对噬菌体文库进行生物淘选获得的噬菌体单克隆,具体方法是将f-PSA(Meridian Life Science)包被于96孔酶标板上,加入噬菌体文库,孵育;洗去没有靶标结合特性的噬菌体,保留具有靶标结合特性的噬菌体;再用弱酸洗脱具有靶标结合特性的噬菌体,感染饥饿细胞进行噬菌体滴度测定,结果作为第一轮淘选特异性噬菌体的输出量。按照上述淘选步骤依次进行第二轮、第三轮生物淘选,测定每一轮淘选的噬菌体文库的输入量、输出量,并计算每一轮淘选的回复率。以f-PSA为靶标进行三轮淘选后,将第三轮洗脱的噬菌体进行梯度稀释,稀释梯度为10-1、10-2、10-3、10-4,然后进行平板涂布,37℃过夜培养。选择合适的噬菌体浓度梯度,使用无菌牙签从过夜培养的平板上随机挑选多个噬菌体单克隆,按照PCR条件进行菌落PCR,琼脂糖凝胶电泳对PCR产物进行鉴定。鉴定后的PCR产物送至北京六合华大基因科技股份有限公司测序。运用BioEdit软件对测序序列分析,获取噬菌体表面展示的多肽序列。其中T1展示的八肽序列是ERNSVSPS,T2展示的八肽序列是ATRSANGM。
以肿瘤标记物AFP、hK-2、CA125、CA15-3、CA19-9作为对照靶标,通过噬菌体捕获实验进行特异性结合评价,确定特异性识别前列腺抗原的噬菌体单克隆,具体方法是分别以f-PSA、PSA-ACT、AFP、hK-2、CA125、CA15-3、CA19-9包被96孔酶标板(以空白孔作为空白对照);加入噬菌体单克隆106TU,4℃,16h过夜与之孵育;洗去未被包被抗原捕获的噬菌体,漂洗10次,每次10min,再用弱酸洗去被靶标捕获的噬菌体,经Tris-HCl中和后,感染饥饿细胞,进行滴度测定,分别测试不同抗原捕获的噬菌体数量,并计算回复率进行比较。T1仅对f-PSA表现出很高的亲和性和特异性,其识别特性为识别f-PSA。T2对f-PSA响应的同时,还可识别PSA-ACT,而且明显高于其它抗原和空白对照,其识别特性可确定为识别f-PSA和PSA-ACT,即t-PSA。
上述噬菌体文库的一个优选例是f8/8风景噬菌体文库。
上述噬菌体单克隆的一个优选例是噬菌体pVIII蛋白N端展示有随机八肽序列,可以与前列腺特异性抗原发生特异性相互作用。
所述噬菌体单克隆体作为前列腺抗原特异性配体探针。
所述特异性配体探针用于分别以f-PSA及t-PSA前列腺抗原为检测对象的检测中;所述检测方法是“噬菌体探针/前列腺抗原/前列腺抗原单克隆抗体”模式的夹心法ELISA检测方法。
所述的前列腺抗原特异性配体探针有两种,其中噬菌体单克隆T1能够特异性识别f-PSA,噬菌体单克隆T2能够特异性识别t-PSA。T1展示的八肽序列是ERNSVSPS,T2展示的八肽序列是ATRSANGM,两条氨基酸序列的同源性只有12.5%。
所述的ELISA检测方法是分别以f-PSA和t-PSA为靶标,建立的噬菌体探针/前列腺抗原/前列腺抗原单克隆抗体”模式的夹心法ELISA检测方法,实现f-PSA和t-PSA的分别检测,进而确定fPSA/tPSA的比值,对前列腺癌的诊断、鉴别以及确定前列腺疾病性质具有非常重要的意义。
本发明所具有的效果:
1.本发明利用噬菌体展示技术从噬菌体文库中筛选得到能够与前列腺抗原特异结合的展示有随机多肽的噬菌体单克隆,以此作为抗体类似物,克服了传统单克隆抗体制备过程复杂、昂贵、稳定性差和低效价的缺陷。
2.本发明利用含有与前列腺抗原特异结合短肽的噬菌体作为探针,建立了“噬菌体探针/前列腺抗原/前列腺抗原单克隆抗体”模式的夹心法ELISA前列腺抗原检测方法,此方法灵敏度高、稳定性好、成本低。
3.本发明以前列腺特异性抗原为靶标与噬菌体文库作用,经生物淘选后得到具备前列腺特异性抗原结合特性的噬菌体单克隆。
4.本发明以肿瘤标记物AFP、CA125、CA15-3、CA19-9作为对照靶标,通过噬菌体捕获实验对噬菌体单克隆进行特异性结合评价,其中噬菌体单克隆T1能够特异性识别f-PSA,噬菌体单克隆T2能够特异性识别t-PSA。T1展示的八肽序列是ERNSVSPS,T2展示的八肽序列是ATRSANGM。
5.本发明利用筛选获得的噬菌体单克隆作为探针,建立了噬菌体探针/前列腺抗原/前列腺抗原单克隆抗体”模式的夹心法ELISA检测方法,实现f-PSA和t-PSA的分别检测,检测的线性范围分别为0.8-165ng/mL和3.3-330ng/mL,检测限分别为0.33ng/ml和1.6ng/mL。
6.本发明利用筛选获得的噬菌体单克隆T1和T2分别实现了f-PSA和t-PSA的检测,进而确定fPSA/tPSA的比值,可更好地鉴别前列腺癌与前列腺疾病,大大提高前列腺癌早期诊断的特异性,对前列腺癌的诊断、鉴别以及确定前列腺疾病性质具有非常重要的意义。
7.本发明提供了含有与前列腺抗原特异性结合短肽的噬菌体的制备方法。所述的噬菌体单克隆可作为新型的生物检测探针,在分析化学、检测、免疫反应、生物医学等领域得到广泛的应用。
附图说明
图1为本发明实施例提供的噬菌体单克隆的特异性结合评价试验结果图。
图2为本发明实施例提供的基于噬菌体单克隆的前列腺特异性抗原ELISA检测方法的流程图。
图3为本发明实施例提供的包被液pH对ELISA的影响效果图。
图4为本发明实施例提供的噬菌体探针包被浓度对ELISA的影响效果图。
图5为本发明实施例提供的反应条件对噬菌体ELISA的影响效果图。
图6为本发明实施例提供的PSA抗体稀释度对噬菌体ELISA的影响效果图。
图7为本发明实施例提供的PSA的检测工作曲线图。
具体实施方式
以下结合附图和实施方式对本发明作进一步的详细说明。
实施例1
前列腺特异性抗原的生物淘选:以f-PSA为靶标对f8/8风景噬菌体文库进行生物淘选,获得与f-PSA高亲和力的噬菌体单克隆,具体过程如下:
1.饥饿细胞的制备
(1)将甘油冻存的大肠杆菌K91 Blue Kan(VA Petrenko,GP Smith,X Gong,T Quinn,A library of organic landscapes on filamentous phage,Protein Engineering,1996.9(9):797-801)接种于NZY培养基(10g/L酶水解酪素,5g/L酵母提取物,5g/L NaCl)中,于37℃,200rpm条件下摇床培养过夜;
(2)取过夜培养的大肠杆菌K91 Blue Kan菌株,接种于NZY培养基中,37℃,200rpm条件下摇床培养至OD600约0.45(约2~2.5小时);
(3)OD600达到0.45后,调整摇床转速至50rpm,37℃摇床培养8min;
(4)菌液4℃、2000g条件下离心10min;
(5)离心后去除上清,加20mL 80mM NaCl温和地悬浮细胞;
(6)细胞37℃、50rpm条件下摇床培养45min;
(7)菌液4℃、2000g条件下离心10min;
(8)离心后去除上清,取1mL冷的NAP缓冲溶液(12mL 1M NaCl,15mL 0.5M NH4H2PO4,123mL去离子水混合均匀)温和地悬浮菌体,于冰上存放。
2.噬菌体的扩增及纯化
(1)按照饥饿细胞的制备方法制备饥饿细胞;
(2)取适量噬菌体与等体积饥饿细胞温和混匀,室温下静置15min后转移至含40mL NZY培养基(含四环素,0.2μg/mL)的250mL三角瓶中,37℃,200rpm条件下振荡培养45min;
(3)培养基中补加四环素至终浓度20μg/mL,37℃,200rpm条件下摇床过夜培养;
(4)过夜培养菌液4℃、3000g条件下离心10min;
(5)上清4℃、6700g条件下离心10min;
(6)上清加入0.15倍体积的PEG-NaCl(100g PEG 4000,116.9g NaCl溶于475mL去离子水),置于4℃过夜沉淀;
(7)沉淀溶于200μL TBS溶液中,4℃储存。
3.噬菌体滴度的测定
(1)按照饥饿细胞的制备方法制备饥饿细胞;
(2)用TBS-gelatin(TBS缓冲液中加入0.1%的明胶)缓冲液制备噬菌体稀释液;
(3)分别取10μL噬菌体稀释液(稀释梯度可根据实际情况选择)于无菌的1.5mL离心管,加10μL制备好的饥饿细胞,温和的混匀,室温下静置15min;
(4)每个离心管分别加入980μL NZY培养基(含四环素,0.2μg/mL),37℃条件下静置培养45min,诱导四环素抗性;
(5)取100μL涂布于含四环素20μg/mL的NZY平板(每个梯度3个平行),37℃过夜培养;
(6)平板计数,计算噬菌体滴度:滴度=菌落数×1000×稀释梯度。TBS-gelatin是TBS缓冲液中加入0.1%的明胶。
4.前列腺特异性抗原的生物淘选
(1)将f-PSA(10μg/mL)置于96孔板(可拆酶标板Nunc-Immuno LockWell,Maxisorp表面)中,4℃,振荡孵育16h;
(2)吸出f-PSA溶液,添加100μL 10mg/mL牛血清白蛋白(BSA)溶液,室温下封闭1h;
(3)吸出BSA溶液,室温下加100μL TBST(TBS缓冲液中加入0.5%的Tween 20)轻微震荡漂洗6次,每次10min;
(4)添加f8/8风景噬菌体文库(VA Petrenko,GP Smith,X Gong,T Quinn,A library of organic landscapes on filamentous phage.Protein Engineering,1996.9(9):797-801):将含~1011个风景景噬菌体克隆的文库(作为生物淘选的输入量),加至包被有PSA的96孔板中,4℃,振荡孵育16h;
(5)按照饥饿细胞的制备方法制备饥饿细胞;
(6)吸出文库溶液,使用TBST 100μL震荡漂洗10次,每次10min;
(7)吸出96孔板中的TBST,并甩干残留,加入100μL洗脱缓冲液(0.1M HCl,1mg/mL BSA,0.1mg/mL酚红,甘氨酸调节pH至2.2),室温下振荡10min,洗脱与f-PSA特异性结合的噬菌体克隆;
(8)将洗脱液完全转移至离心管中,添加19μL Tris-HCl作为中和液,混匀,并注意观察液体颜色变化(从黄到红);
(9)加100μL TBS,室温下振荡10min,将TBS吸出加入到噬菌体洗脱液中(重复2~3次);使用30kDa的超滤管,浓缩至50μL(浓缩过程仅用于第一轮淘选),取5μL用于滴度测定;
(10)对上步中噬菌体进行梯度稀释,按照噬菌体滴度的测定方法,测定洗脱噬菌体的滴度;
(11)将洗脱噬菌体转移至1.5mL离心管中,与100μL饥饿细胞温和混匀,室温下静置15min,然后转移至40mL NZY培养基(含四环素0.2μg/mL),37℃、200rpm条件下摇床培养45min;
(12)待培养45min后,培养基中补加四环素至终浓度20μg/mL,37℃、200rpm条件下摇床培养过夜;
(13)平板计数,并计算噬菌体滴度作为生物淘选的输出量,计算回复率,即生物淘选过程中噬菌体输出量与输入量的比值;
(14)过夜培养菌液4℃、3000g条件下离心10min;
(15)上清液4℃、6700g条件离心10min;
(16)上清液加入0.15倍体积的PEG/NaCl,置于4℃过夜沉淀;
(17)噬菌体4℃、6700g条件离心50min,弃上清;
(18)4℃、6700g条件下离心5min,弃残留上清,沉淀溶于1mL TBS溶液中;
(19)4℃、12000g条件下离心2min,去除不溶物;
(20)加150μL PEG/NaCl,4℃过夜沉淀;
(21)按照饥饿细胞制备方法制备饥饿细胞;
(22)噬菌体4℃、12000g条件下离心50min,去除上清;
(23)4℃、12000g条件下离心5min去除残留上清,将沉淀溶于200μL TBS溶液中;
(24)4℃、12000g条件下离心2min,去除所有不溶物,上清转移至一新离心管中,作为新一轮淘选的输入文库;
(25)按照噬菌体滴度的测定方法对上步中纯化得到的噬菌体进行滴度测定;
(26)平板计数,计算噬菌体滴度。
按照上述淘选步骤依次进行第二轮、第三轮生物淘选,测定每一轮淘选的噬菌体文库的输入量、输出量,并计算每一轮淘选的回复率。经过f-PSA对f8/8风景噬菌体文库的三轮生物淘选,与靶标特异性结合噬菌体的回复率从(2.76×10-5)%增加到(3.05×10-2)%,目标噬菌体克隆得到有效富集。
6.单克隆噬菌体的挑选及测序
(1)引物的设计与合成
根据噬菌体的核苷酸序列设计寡核苷酸上下游引物,由南京金斯瑞生物科技有限公司合成:
正向引物F:5’-CAAAGCCTCCGTAGCCGTTG-3’
反向引物R:5’-CATTCCACAGACAGCCCTCA-3’
(2)噬菌体单克隆的挑取
待三轮生物淘选过后,将获得的目的噬菌体进行适当的梯度稀释,取10μL侵染饥饿细胞,涂布含四环素20μg/mL的NZY培养基平板,37℃过夜培养。
使用无菌牙签从长满单菌落的NZY平板上随机挑取噬菌体克隆,悬浮于100μL无菌水中,作为PCR的模板。取洁净无菌的0.5mL薄壁PCR管,依次加入模板、上下游引物、TaKaRa Taq、双蒸水,将各组分混合均匀后,采用PCR技术对单克隆噬菌体的目的基因进行扩增。
(3)单克隆噬菌体目的基因序列分析
将PCR产物送至北京六合华大基因科技股份有限公司测序,运用BioEdit软件对单克隆噬菌体的序列进行分析比较,获取噬菌体表面展示的多肽序列。其中T1展示的八肽序列是ERNSVSPS,T2展示的八肽序列是ATRSANGM。
实施例2
噬菌体单克隆的特异性测试:噬菌体与PSA的结合特异性通过噬菌体捕获实验测试。
前列腺抗原在血清中主要以游离态(f-PSA)和复合物(主要为PSA-ACT)的形式存在,以f-PSA和PSA-ACT同时分别捕获特异性噬菌体单克隆,通过回复率测定,确定特异性噬菌体单克隆的识别特性,根据其是否识别PSA-ACT确定特异性噬菌体单克隆识别f-PSA或t-PSA(f-PSA+PSA-ACT)。鉴于前列腺抗原属于血清中含有的一种肿瘤标记物,以肿瘤标记物AFP、hK-2、CA125、CA15-3、CA19-9以及空白作为参照,对噬菌体单克隆进行特异性测试。
(1)将抗原f-PSA、PSA-ACT、AFP、hK-2、CA125、CA15-3、CA19-9(10μg/mL)分别置于96孔酶标板(Nunc-Immuno LockWell,Maxisorp表面)孔中,4℃振荡孵育16h;
(2)吸出各靶标溶液,添加100μL 10mg/mL BSA溶液,室温下孵育1h;
(3)吸出BSA溶液,室温下加入100μL TBS-Tween漂洗,10次,每次10min;
(4)添加单克隆噬菌体:将~106TU的单克隆噬菌体(作为噬菌体捕获实验的输入量),加至包被有分别包被抗原PSA、PSA-ACT、AFP、hK-2、CA125、CA15-3、CA19-9的96孔酶标板中,4℃振荡孵育16h;
(5)按照饥饿细胞的制备方法制备饥饿细胞;
(6)吸出噬菌体溶液,使用TBST 100μL震荡漂洗10次,每次10min,洗去未与各抗原结合的噬菌体;
(7)吸出96孔酶标板中的TBST,并甩干残留,加入100μL洗脱液,室温下振荡10min,洗脱与各抗原结合的噬菌体克隆;
(8)将洗脱液完全转移至离心管中,分别添加19μL Tris-HCl作为中和液,混匀,并注意观察液体颜色变化(从黄到红);
(9)对上步中各噬菌体进行梯度稀释,按照噬菌体滴度的测定方法,测定各洗脱噬菌体的滴度;
(10)平板计数,并计算各抗原捕获的单克隆噬菌体的量(作为噬菌体捕获实验的输出量),计算回复率,即噬菌体捕获实验中噬菌体输出量与输入量的比值,比较各抗原对单克隆噬菌体的捕获情况。
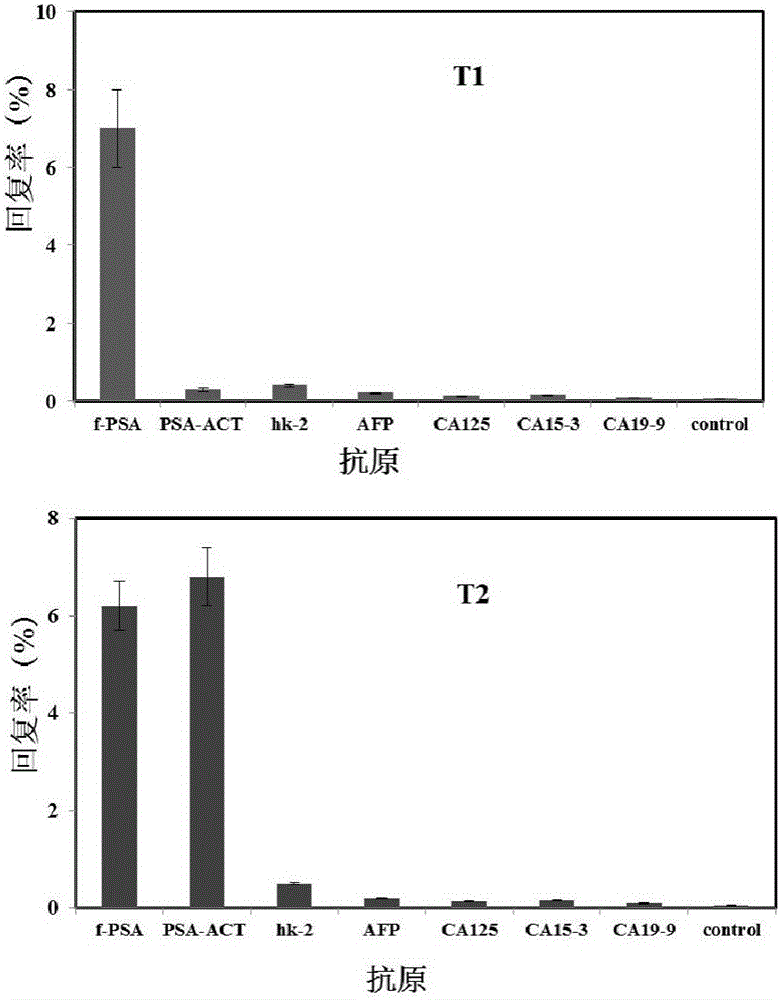
测定不同抗原捕获的噬菌体的数量,根据输入噬菌体的数量,计算捕获回复率进行比较(图1)。f-PSA对T1噬菌体克隆的捕获量明显高于PSA-ACT及其它抗原和空白对照,说明T1仅对f-PSA均表现出很高的亲和性和特异性,其识别特性为识别f-PSA。T2对f-PSA响应的同时,还可识别PSA-ACT,而且明显高于其它抗原和空白对照,其识别特性可确定为识别f-PSA和PSA-ACT,即t-PSA。
实施例3
基于噬菌体的ELISA检测方法(操作流程如图2所示):
1.包被液pH噬菌体包被效率的影响
在ELISA实验中,最佳包被液的选择主要依赖于蛋白或抗体的表面特性,对于不同的蛋白或抗体,其最佳包被液可能各不相同。对于大多数蛋白或抗体而言,常用的包被液主要为pH 7.5的中性缓冲液或pH 9.6作用的碱性溶液,为检验不同pH包被液对噬菌体包被的影响,我们分别选用不同pH的碳酸盐缓冲液和Tris-HCl缓冲液作为包被试剂,探索不同pH包被液对噬菌体包被效率的影响。
特异性噬菌体T1、T2分别溶于0.1M TBS(pH 7.0)、0.1M TBS(pH 7.5)、0.1M NaHCO3(pH 8.6)、0.1M Na2CO3(pH 9.6)至浓度1.0×1010TU/mL,分别取40μL(作为噬菌体包被平板的输入量)加入到96孔酶标板孔中(Corning,Costar),置于湿盒内,4℃包被16h;吸出酶标板中的噬菌体溶液,加200μL 0.05%PBST(PBS缓冲液中加入0.05%的Tween 20)漂洗4次,每次3min;然后弱酸洗脱包被于酶标板上的噬菌体,经Tris-HCl中和后,感染饥饿细胞,进行滴度测定,作为噬菌体包被平板的输出量。计算输出量与输入量的比值作为包被效率进行比较。
从图3中可知,噬菌体克隆T1在pH7.5和pH7.0的TBS包被液中的包被效率相当,但明显高于其它碱性pH的碳酸盐包被液,同样T2在pH7.5和pH7.0的TBS包被液中的包被效率也明显高于碱性pH的碳酸盐包被液,说明噬菌体在中性pH包被液中的包被效率高于碱性pH包被液,因此选择TBS(pH7.5)作为噬菌体T1的包被液,TBS(pH7.0)作为噬菌体T2的包被液,用于ELISA中噬菌体的固定。
2.噬菌体包被浓度对ELISA的影响
制备一系列浓度梯度的特异性噬菌体T1、T2(T1溶于TBS,pH7.5;T2溶于TBS,pH7.0),分别包被96孔酶标板(40μL每孔),经0.5%PBST漂洗4次后,加入10nM PSA 50μL(含0.5%Tween 20),37℃反应2h, 0.5%PBST漂洗6次后先后加入鼠抗人前列腺抗原单克隆抗体、辣根过氧化物酶(HRP)偶联的羊抗鼠IgG和显色底物邻苯二胺(OPD),催化显色15min后,酶标仪492nm测定OD值(图4)。
从图4可以看出,随着噬菌体浓度的增加,OD492值随之增大,对于噬菌体克隆T1而言,噬菌体浓度增达到2.5×1010TU/mL时,OD值变化基本达到稳定;噬菌体T2在浓度5.0×1011TU/mL时OD值达到最大。为更有效的利用噬菌体,分别选择2.5×1010TU/mL和5.0×1011TU/mL作为噬菌体克隆的包被浓度用于f-PSA和t-PSA的检测。
3.反应条件对噬菌体ELISA的影响
在ELISA试验中,固定化探针与抗原或抗体之间的反应是检测过程中最为关键的步骤之一,常用的反应条件为37℃孵育一定时间或4℃过夜孵育,为实现噬菌体ELISA中反应条件最优,达到较好的检测效果,选择合适的反应条件尤为重要。
分别以噬菌体T1(2.5×1010TU/mL)、噬菌体T2(5.0×1010TU/mL)40μL,4℃孵育16h包被96孔酶标板,0.5%PBST漂洗4次后,加入10nM PSA 50μL(含0.5%Tween 20),分别于以下条件孵育反应:4℃过夜12h,37℃1h,37℃2h,37℃3h,37℃4h,37℃5h,0.5%PBST漂洗6次后先后加入鼠抗人前列腺抗原单克隆抗体、HRP偶联的羊抗鼠IgG和显色底物OPD,催化显色15min后,酶标仪492nm测定OD值(图5)。
从图5中可知,37℃孵育3h后,OD值变化不大,噬菌体与PSA的反应基本可达到饱和,因此选择37℃孵育3h作为噬菌体ELISA检测的反应条件。
4.前列腺抗原抗体稀释度对噬菌体ELISA的影响
ELISA试验中,检测抗体对抗原的识别反应是ELISA检测过程中另一关键步骤,抗体浓度的选择往往影响到ELISA信号的测定以及非特异性背景值,因此ELISA实验中要选择最为合适的抗体稀释比,以获得检测过程中的最佳检测效果。
分别以噬菌体T1(2.5×1010TU/mL)、噬菌体T2(5.0×1010TU/mL)40μL,4℃孵育16h包被96孔酶标板,0.5%PBST漂洗4次后,加入10nM PSA 50μL(含0.5%Tween 20),于37℃孵育反应3h,0.5%PBST漂洗6次后加入不同稀释度的鼠抗人前列腺特异性抗原单克隆抗体(1:500,1:1000,1:2000,1:4000,1:8000),然后分别加入HRP偶联的羊抗鼠IgG和显色底物OPD,催化显色15min后,酶标仪测定OD492,计算不同抗体稀释度下加PSA板孔与对照板孔OD值的比值(图6)。
在此实验中,抗体稀释度越小产生的阳性信号值越高,但同时产生较大的非特异性背景信号,因此选择信噪比值最高的作为ELISA检测参数。抗体稀释度1:500与1:2000之间时,噬菌体T1、T2的ELISA的信噪比值 均较高,应用效果较好,为更有效的利用试剂,在此选择1:1000的PSA抗体稀释度用于噬菌体ELISA检测。
5.前列腺抗原检测工作曲线的绘制
将特异性识别f-PSA的噬菌体克隆T1溶于TBS(pH 7.5)至2.5×1010TU/mL,特异性识别t-PSA的噬菌体克隆T2溶于TBS(pH 7.0)至5.0×1010TU/mL,40μL包被96孔酶标板(Corning Corstar),置于湿盒内4℃包被16h,0.5%PBST洗涤6次后后加入一系列浓度的PSA,37℃孵育反应3h,0.5%PBST再次漂洗后先后加入鼠抗人前列腺特异性抗原单克隆抗体(Meridian Life Science)(1:1000稀释),然后分别加入HRP偶联的羊抗鼠IgG和显色底物OPD,催化显色15min后,酶标仪492nm测定OD值,绘制工作曲线(如图7所示),f-PSA检测的线性范围为0.8-165ng/mL,检测限度可达到0.33ng/ml,t-PSA检测的线性范围为3.3-330ng/mL,检测限度可达到1.6ng/mL。以上各实验重复10次的变异系数均小于8%,表明具有良好的重复性。
实施例4
前列腺抗原实际样品的检测
利用所建立的“噬菌体探针/前列腺抗原/前列腺抗原单克隆抗体”夹心法对血清样品进行检测。分别对血清样品中的f-PSA和t-PSA平行3份进行检测,结果如表1所示。表1中也列出了电化学免疫分析法检测结果。本法和电化学免疫分析法相比较,两者相关性较好,相对误差在10%以内,表明本研究建立的ELISA法可用于实际血清样品的检测。
表1.血清样品中PSA的测定
- 还没有人留言评论。精彩留言会获得点赞!