用于免疫组库测序的组合物和方法与流程
用于免疫组库测序的组合物和方法
1.相关申请的交叉引用
2.本申请要求于2019年4月26日提交的美国临时申请第62/839,505号和于2018年7月18日提交的美国临时申请第62/700,168号的优先权和权益。前述申请中的每个申请的全部内容通过引用并入本文。
背景技术:
3.适应性免疫应答包括识别抗原的b细胞和t细胞的选择性应答。编码抗体(ab,在b细胞中)和t细胞受体(tcr,在t细胞中)抗原受体的免疫球蛋白基因包括复合基因座,其中由于相应可变(v)、多样性(d)和连接(j)基因片段的重组,以及随后的在早期淋巴分化期间的体细胞超突变事件而产生广泛的受体多样性。每种受体的两个亚基链单独发生重组过程,并且随后,异二聚体配对产生仍更大的组合多样性。有助于人免疫受体组库的潜在组合可能性和连接可能性的计算已经估计,可能性的数量大大超过个体中外周b或t细胞的总数。参见,例如,davis和bjorkman(1988)《自然(nature)》334:395
‑
402;arstila等人.(1999)《科学(science)》286:958
‑
961;van dongen等人,《白血病(leukemia)》,henderson等人.(编辑)费城:wb桑德斯公司(philadelphia:w.b.saunders company),2002,第85
‑
129页。
4.多年来已经进行了广泛的努力以便以高分辨率改善对免疫组库的分析。用于特异性检测和监测淋巴细胞的扩增克隆的手段将为表征和分析正常免疫反应和应答和致病性免疫反应和应答提供重要机会。尽管付出了努力,但有效的高分辨率分析提供了挑战。如桑格(sanger)测序等低通量技术可以提供分辨率,但仅限于提供广泛捕获整个免疫组库的有效手段。在下一代测序(ngs)方面取得的进展已经提供捕获组库的途径,然而,由于大量相关序列的性质和由所述技术引起的序列错误的引入,已经证明难以对真实组库进行高效和有效反映。因此,正在开发能够解析高度可变的免疫细胞受体序列的复合群体的改善的测序方法和工作流程。仍需要有效分析大量免疫细胞受体组库的新方法,以更好地理解免疫细胞应答、增强诊断能力和处理能力并设计新的疗法。
技术实现要素:
5.在本发明的一方面,提供用于单一流测定样品中的免疫组库的组合物。在一些实施例中,所述组合物包括至少一组引物i)和ii),其中i)由针对免疫受体编码序列的大多数不同可变区的多个可变(v)基因引物组成;并且ii)由针对相应免疫受体编码序列的相应靶恒定区的至少一部分的一个或多个恒定(c)基因引物组成。在一些实施例中,所述组合物包括至少一组引物i)和ii),其中i)由针对免疫受体编码序列的大多数不同可变(v)基因的多个v基因引物组成;并且ii)由针对相应靶免疫受体编码序列的大多数不同连接(j)基因的多个j基因引物组成。在一些实施例中,用于分析样品中的b细胞受体(bcr)组库的所述组合物包含至少一组引物i)和ii),其中i)由(a)针对包括v基因内的框架区1(fr1)的至少一部分的至少一个bcr编码序列的大多数不同v基因的多个v基因引物或(b)针对包括v基因内的
框架区3(fr3)的至少一部分的至少一个bcr编码序列的大多数不同v基因的多个v基因引物组成;并且ii)由(a)一个或多个c基因引物或(b)多个j基因引物组成,所述一个或多个c基因引物针对所述至少一个bcr编码序列的c基因的至少一部分,所述多个j基因引物针对所述至少一个bcr编码序列的大多数不同j基因的至少一部分;其中每组i)引物和ii)引物针对选自igh、igl和igk的同一靶bcr基因的编码序列;并且其中针对所述同一靶bcr的每组i)引物和ii)引物被配置成扩增所述靶bcr组库。
6.在一些实施例中,所述v基因引物识别v基因内的fr1的至少一部分。在一些实施例中,所述v基因引物识别v基因内的fr2的至少一部分。在一些实施例中,所述v基因引物识别v基因内的fr3的至少一部分。每组i)引物和ii)引物针对选自igh、igl和igk组成的组的同一靶bcr序列并且被配置成使得使用此类组合物产生的所得扩增子代表样品中的相应受体的序列的组库。在特定实施例中,所提供的组合物包含选自表2和表5的多种引物对试剂。在特定实施例中,所提供的组合物包含选自表3和表5的多种引物对试剂。在特定实施例中,所提供的组合物包含选自表3和表6
‑
10的多种引物对试剂。在特定实施例中,所提供的组合物包含选自表2和表6
‑
10的多种引物对试剂。在一些实施例中,所提供的组合物包含选自表4和表5或选自表4和表6
‑
10的多种引物对试剂。在一些实施例中,提供了包括本发明的组合物的多重测定。在一些实施例中,提供了包括本发明的组合物的测试试剂盒。
7.在本发明的其它方面,提供了用于测定生物样品中的免疫组库活性的方法。此类方法包括用在单个反应中靶向两种不同类型的免疫受体的引物组执行多重扩增,例如tcr靶标和bcr靶标的多重扩增。
8.在一些实施例中,用于扩增样品中的免疫受体组库的表达核酸序列的方法包括使用以下的至少一组执行单一多重扩增反应以扩增表达的靶免疫受体核酸模板分子:
9.i)(a)针对包括v基因内的fr1的至少一部分的至少一个免疫受体编码序列的大多数不同v基因的多个v基因引物,
10.(b)针对包括v基因内的fr2的至少一部分的至少一个免疫受体编码序列的大多数不同v基因的多个v基因引物,或
11.(c)针对包括v基因内的fr3的至少一部分的至少一个免疫受体编码序列的大多数不同v基因的多个v基因引物;以及
12.ii)(a)一个或多个c基因引物,所述一个或多个c基因引物针对所述至少一个免疫受体编码序列的c基因的至少一部分,或
13.(b)多个j基因引物,所述多个j基因引物针对所述至少一个免疫受体编码序列的大多数不同j基因的至少一部分;
14.其中每组i)引物和ii)引物针对选自t细胞受体基因或抗体受体基因的同一靶免疫受体基因的编码序列,并且其中使用所述至少一组i)和ii)引物执行所述扩增产生代表所述样品中的所述靶免疫受体组库的扩增子分子;由此产生包括所述靶免疫受体组库的免疫受体扩增子分子。
15.在某些实施例中,免疫受体序列的v基因的第一框架区(fr1)的至少一部分到c基因的至少一部分涵盖在经扩增靶免疫受体序列内。在某些实施例中,免疫受体序列的v基因的第二框架区(fr2)的至少一部分到c基因的至少一部分涵盖在经扩增靶免疫受体序列内。在某些实施例中,免疫受体序列的v基因的第三框架区(fr3)的至少一部分到c基因的至少
一部分涵盖在经扩增靶免疫受体序列内。在其它实施例中,方法包括扩增样品中的免疫受体组库的表达核酸序列,这包括在扩增条件下在存在聚合酶的情况下执行多重扩增反应,以产生多个经扩增的靶表达序列,所述多个经扩增的靶表达序列包括具有可变、多样性和连接(vdj)基因部分的所关注的一个或多个免疫受体或具有可变和连接(vj)基因部分的所关注的一个或多个免疫受体。在某些实施例中,免疫受体序列的v基因的第一框架区(fr1)的至少一部分到连接(j)基因的至少一部分涵盖在经扩增靶免疫受体序列内。在某些实施例中,免疫受体序列的v基因的第二框架区(fr2)的至少一部分到连接(j)基因的至少一部分涵盖在经扩增靶免疫受体序列内。在某些实施例中,免疫受体序列的v基因的第三框架区(fr3)的至少一部分到连接(j)基因的至少一部分涵盖在经扩增靶免疫受体序列内。
16.本发明的方法进一步包括通过将衔接子序列引入到经扩增的靶序列的末端,使用经扩增的靶免疫受体序列制备bcr组库文库。在一些实施例中,衔接子修饰的免疫受体组库文库是克隆扩增的。
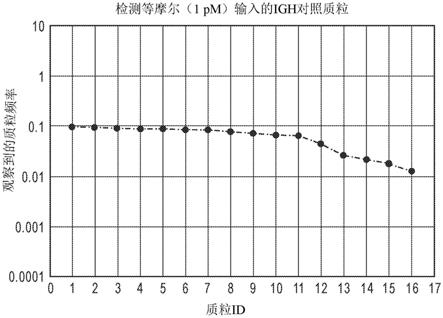
17.所述方法进一步包括检测样品中的免疫受体中的每个免疫受体的免疫组库的序列和/或所述多个靶免疫受体序列中的每个靶免疫受体序列的表达,其中与第二样品或对照样品相比,组库序列和/或一个或多个靶免疫受体标记物的表达的水平的变化决定样品中的免疫组库活性的变化。在某些实施例中,使用下一代序列分析执行对免疫受体扩增子分子进行的测序以测定免疫受体扩增子的序列。在特定实施例中,测定免疫受体扩增子分子的序列包含获得初始序列读段,比对和鉴别生产性读段并校正错误以产生拯救的生产性读段以及测定所得总生产性读段的序列,由此提供样品中的免疫组库的序列。本文描述的所提供的方法利用本文提供的本发明的组合物。在本发明的仍其它方面,提供用于校正错误的特定分析方法,以便从本文提供的方法产生全面、有效的序列信息。
18.在另一方面,提供了用于鉴别或筛选受试者的疾病或病状的生物标志物的方法。在一些实施例中,此类方法包括使用以下的至少一组执行单一多重扩增反应以扩增从受试者样品中获得的靶bcr核酸模板分子:
19.i)(a)针对包括v基因内的fr1的至少一部分的至少一个bcr编码序列的大多数不同v基因的多个v基因引物,
20.(b)针对包括v基因内的fr2的至少一部分的至少一个bcr编码序列的大多数不同v基因的多个v基因引物,或
21.(c)针对包括v基因内的fr3的至少一部分的至少一个bcr编码序列的大多数不同v基因的多个v基因引物;以及
22.ii)(a)一个或多个c基因引物,所述一个或多个c基因引物针对所述至少一个bcr编码序列的c基因的至少一部分,或
23.(b)多个j基因引物,所述多个j基因引物针对所述至少一个bcr编码序列的大多数不同j基因的至少一部分;
24.其中每组i)引物和ii)引物针对选自igh、igl和igk基因的同一靶bcr基因的编码序列,并且其中使用所述至少一组i)引物和ii)引物执行所述扩增产生代表所述样品中的所述靶bcr组库的扩增子分子;由此产生包括所述靶bcr组库的靶bcr扩增子分子。所述方法进一步包括:对靶bcr扩增子分子执行测序并测定所述分子的序列,其中测定所述序列包含获得初始序列读段,将所述初始序列读段与参考序列进行比对,鉴别生产性读段以及校正
一个或多个插入缺失错误以产生拯救的生产性序列读段;从所测定的靶bcr序列中鉴别bcr组库克隆群体;以及鉴别至少一个bcr克隆的序列,以用作所述疾病或病状的生物标志物。在一些实施例中,所述疾病或病状生物标志物被鉴别或筛选选自癌症、自身免疫性疾病、感染性疾病、过敏、对疫苗接种的应答以及对免疫疗法治疗的应答。
附图说明
25.图1是用于使用对类似cdr3核苷酸序列进行的逐步聚类去除pcr或测序衍生的错误的示例性工作流程图,其中步骤为:(a)基于相似性(cd
‑
hit
‑
est)非常快速的启发式聚类成组;(b)将被选为最常见的序列、随机挑选以形成平局的代表聚类;(c)将读段合并到代表中;(d)比较代表,并且如果在所分配的汉明距离(hamming distance)内,则合并聚类。
26.图2是用于通过使用莱文斯坦距离(levenshtein distance)比较均聚物塌缩的cdr3序列来去除残余插入/缺失(插入缺失(indel))错误的示例性工作流程图,其中步骤为:(a)使均聚物塌缩并计算聚类代表之间的莱文斯坦距离;(b)合并现在聚类在一起的读段,这些读段表示复合插入缺失错误;(c)向用户报告谱系。
27.图3是描绘了针对单独的bcr测定、在一个池中扩增的bcr和tcr测定以及在两个单独的池中扩增的bcr和tcr测定的读段数量和对读取质量的表征(生产性对脱靶或非生产性)的结果的图。
28.图4a
‑
4b描绘了在组合测定中检测到的总克隆数(图4a)以及bcr克隆和tcr克隆的群体(按总数的百分比计)(图4b)。
29.图5a
‑
5f是描绘了来自以下各种细胞或组织样品的rna的igh组库的序列读段长度的直方图:(图5a)pbl、(图5b)cd19+细胞、(图5c)扁桃体ffpe、(图5d)肺肿瘤ffpe、(图5e)骨髓、(图5f)正常脾以及(图5g)正常大脑。
30.图6描绘了使用示例性igh v基因fr1
‑
c基因引物组1
‑
7在对pbl cdna进行多重扩增后获得的序列读段长度。
31.图7a
‑
7b条形图描绘了pbl样品内的从使用示例性igh v基因fr1
‑
c基因多重扩增反应进行测定获得的作为每个同种型的序列读段(图7a)和每个同种型检测到的克隆(图7b)的总同种型代表。
32.图8a
‑
8b描绘了对于所有igh同种型(图8a)和仅igd的pbl样品(图8b)中的igh v基因突变率的直方图。
33.图9描绘了来自样品的总生产性读段(每个图上的最右边的点)以及源自总生产性读段的8个下采样的数据集的igh克隆分析结果。
34.图10描绘了示出在从等摩尔浓度的混合有白细胞cdna的20个对照质粒的池中产生的igh文库中质粒检测的线性的图。表15中示出了与质粒id号相关的质粒。
具体实施方式
35.已经开发了用于有效检测和分析样品中的免疫组库的多重下一代测序工作流程。所提供的方法、组合物、系统和试剂盒在监测和解析受试者的一个或多个复合免疫细胞组库时用于对免疫细胞受体序列(例如,t细胞受体(tcr)、b细胞受体(bcr或ab)靶标)进行高准确度地扩增和测序。靶免疫细胞受体基因已经进行vdj或vj基因片段的重排(或重组),所
述基因片段取决于特定受体基因(例如,igh、igk、tcrβ或tcrα)。在某些实施例中,本公开提供了使用如聚合酶链反应(pcr)等核酸扩增来富集免疫受体靶核酸的表达可变区以进行后续测序的方法、组合物和系统。在某些实施例中,本公开提供了使用如pcr等核酸扩增来富集来自gdna的重排的靶免疫细胞受体基因序列以进行后续测序的方法、组合物和系统。在某些实施例中,本公开还提供了用于有效鉴别和去除扩增或测序衍生的一个或多个错误以改善读段分配准确度并降低假阳性率的方法和系统。具体地,本文描述的所提供的方法可以改善在核苷酸序列与基因组重组和高可变性相关的测序应用中的准确度和性能。在一些实施例中,本文提供的方法、组合物、系统和试剂盒用于对样品中的表达的免疫受体的互补决定区(cdr)进行扩增和测序。在一些实施例中,本文提供的方法、组合物、系统和试剂盒用于对样品中的重排的免疫细胞受体gdna的cdr进行扩增和测序。因此,本文提供了多重免疫细胞受体表达组合物和针对免疫细胞受体基因的组合物,以进行结合下一代测序技术和工作流程解决方案(例如,手动或自动化)使用的多重文库制备,从而有效检测和表征样品中的免疫组库。
36.tcr或bcr的cdr由进行v(d)j基因片段的重组以及在基因片段连接处的核苷酸的添加和/或缺失的基因组dna产生。v(d)j基因片段的重组和后续超突变事件导致表达的免疫细胞受体的广泛多样性。由于v(d)j重组的随机性质,通常情况是t或b细胞受体基因组dna的重排将不能产生功能性受体,而是产生所谓的“非生产性”重排。通常,非生产性重排具有框外可变和连接编码片段并导致过早终止密码子的存在和无关肽的合成。然而,处于如下等许多生物学或生理学原因,在基于cdna的组库测序中非生产性tcr或bcr基因重排通常是罕见的:1)无义介导的衰变,其破坏含有过早终止密码子的mrna,2)b和t细胞选择,其中只有具有功能性受体的b细胞和t细胞存活,并且3)等位基因排斥,其中在任何给定的b或t细胞中仅表达单个重排的受体等位基因。
37.因此,在一些实施例中,本文提供的方法和组合物用于扩增免疫细胞受体mrna(例如bcr和/或tcr mrna)的重组表达的可变区。在一些实施例中,从生物样品中提取的rna转化为cdna。多重扩增用于使包含受体的可变区的至少一部分的bcr或tcr cdna的一部分富集。在一些实施例中,扩增的cdna包含靶受体的一个或多个互补决定区cdr1、cdr2和/或cdr3。在一些实施例中,扩增的cdna包含免疫球蛋白重链(igh)的一个或多个互补决定区cdr1、cdr2和/或cdr3。
38.tcr序列和bcr序列还可以表现为在扩增反应期间或在测序过程期间引入的错误的非生产性重排。例如,在靶扩增或测序反应期间的插入或缺失(插入缺失)错误可以导致所得编码序列的读框中的移码。此类改变可以导致生产性重排的靶序列读段被解释为非生产性重排并从所鉴别的克隆型的组中丢弃。因此,在一些实施例中,本文提供的方法和系统包含用于从确定的免疫受体序列中鉴别和/或去除pcr或测序衍生的错误的方法。
39.在一些实施例中,所提供的方法和组合物用于扩增免疫细胞受体gdna(例如,重排的bcr和/或tcr基因dna)的重排可变区。多重扩增用于使包含受体的可变区的至少一部分的重排的bcr或tcr gdna的一部分富集。在一些实施例中,扩增的gdna包含靶受体的一个或多个互补决定区cdr1、cdr2和/或cdr3。在一些实施例中,扩增的gdna包含igh的一个或多个互补决定区cdr1、cdr2和/或cdr3。在一些实施例中,扩增的gdna主要包含靶受体的cdr3,例如igh的cdr3。
40.本文所用的“免疫细胞受体”和“免疫受体”可互换使用。
41.本文所用的术语“互补决定区”和“cdr”是指t细胞受体或抗体(免疫球蛋白)的区,其中分子补充抗原的构象,由此测定分子的特异性和与特定抗原的接触。在t细胞受体和抗体的可变区中,cdr散布有更保守的被称为框架区(fr)的区。t细胞受体和抗体的每个可变区含有3个cdr,命名为cdr1、cdr2和cdr3,还含有4个框架子区,命名为fr1、fr2、fr3和fr4。
42.如本文所用,术语“框架”或“框架区”或“fr”是指除本文定义的cdr残基之外的可变区的残基。构成框架的有四个独立的框架子区:fr1、fr2、fr3和fr4。
43.在所属领域中对于在受体分子(tcr或免疫球蛋白)内cdr和fr的确切位置的特定名称根据所采用的定义而变化。除非另外特别说明,否则本文使用imgt名称来描述cdr和fr区(参见brochet等人(2008)《核酸研究(nucleic acids res.)》36:w503
‑
508,特别以引用方式并入本文)。作为cdr/fr氨基酸名称的一个实例,构成t细胞受体β的fr和cdr的残基已经通过imgt表征如下:残基1
‑
26(fr1)、27
‑
38(cdr1)、39
‑
55(fr2)、56
‑
65(cdr2)、66
‑
104(fr3)、105
‑
117(cdr3)和118
‑
128(fr4)。
44.用于描述所述区的其它众所周知的标准名称包含存在于kabat等人,(1991)《具有免疫学重要性的蛋白序列(sequences of proteins of immunological interest)》,第5版.马里兰州贝塞斯达的美国国家卫生研究院公共卫生服务部(public health service,national institutes of health,bethesda,md.)中以及chothia和lesk 1987,《分子生物学期刊(j.mol.biol.)》196:901
‑
917)中的那些文献,所述文献通过引用明确并入本文。作为cdr名称的一个实例,组成六种免疫球蛋白cdr的残基已经由kabat表征如下:轻链可变区中的残基24
‑
34(cdrl1)、50
‑
56(cdrl2)和89
‑
97(cdrl3)以及重链可变区中的31
‑
35(cdrh1)、50
‑
65(cdrh2)和95
‑
102(cdrh3);并且由chothia表征如下:轻链可变区中的残基26
‑
32(cdrl1)、50
‑
52(cdrl2)和91
‑
96(cdrl3)以及重链可变区中的26
‑
32(cdrh1)、53
‑
55(cdrh2)和96
‑
101(cdrh3)。
45.本文所用的术语“t细胞受体”或“t细胞抗原受体”或“tcr”是指脊椎动物例如哺乳动物的抗原/mhc结合异二聚体蛋白质产物、tcr基因复合体,包含人tcrα链、β链、γ链和δ链。例如,已经对人tcrβ基因座的完整序列进行了测序,参见例如rowen等(1996)science272:1755
‑
1762;已经对人tcrα基因座进行了测序和重新测序,参见,例如,mackelprang等(2006)hum genet。119:255
‑
266;以及关于t细胞受体v基因片段家族的一般分析,参见例如arden(1995)immunogenetics 42:455
‑
500;其中的每一篇都通过引用具体地并入本文中用于在出版物中提供和引用的序列信息。
46.如本文所用,术语“抗体”或“免疫球蛋白”或“b细胞受体”或“bcr”意指由通过二硫键相互连接的四条多肽链(两条重(h)链和两条轻(l)链)(λ或κ)组成的免疫球蛋白分子。抗体具有与其结合的已知特异性抗原。抗体的每条重链包含重链可变区(本文中缩写为hcvr、hv或vh)和重链恒定区。重链恒定区包括三个结构域,ch1、ch2以及ch3。每条轻链包含轻链可变区(本文缩写为lcvr或vl或kv或lv以指定κ或λ轻链)和轻链恒定区。轻链恒定区包含一个结构域cl。重链决定了免疫球蛋白所属的类别或同种型。例如,在哺乳动物中,五个主要的免疫球蛋白同种型是iga、igd、igg、ige和igm,并且所述免疫球蛋白同种型分别根据其含有的α、δ、ε、γ或μ重链进行分类。
47.如所提到的,tcr和bcr链cdr的多样性通过种系可变(v)、多样性(d)和连接(j)基
因片段的重组以及在tcr和bcr基因重排的过程期间在基因片段连接中的每个基因片段连接处的核苷酸的独立添加和缺失产生。在编码bcr重链的重排核酸中,在v基因片段中发现cdr1和cdr2,并且cdr3包含v基因片段以及d和j基因片段中的一些基因片段。在编码bcr轻链的重排核酸中,在v基因片段中发现cdr1和cdr2,并且cdr3包含v基因片段和j基因片段中的一些基因片段。例如在编码tcrβ和tcrδ的重排核酸中,在v基因片段中发现cdr1和cdr2,并且cdr3包含v基因片段以及d和j基因片段中的一些基因片段。在编码tcrα和tcrγ的重排核酸中,在v基因片区段中发现cdr1和cdr2,并且cdr3包含v基因片段和j基因片段中的一些基因片段。
48.在一些实施例中,多重扩增反应用于扩增源自从重排的bcr和/或tcr基因组dna表达的mrna的cdna。在一些实施例中,多重扩增反应用于从源自生物样品的cdna扩增bcr和/或tcr cdr的至少一部分。在一些实施例中,多重扩增反应用于从源自生物样品的cdna扩增bcr和/或tcr的至少两个cdr。在一些实施例中,多重扩增反应用于从源自生物样品的cdna扩增bcr和/或tcr的至少三个cdr。在一些实施例中,所得扩增子用于测定样品中表达的bcr和/或tcr cdr的核苷酸序列。在一些实施例中,测定包括至少3个cdr的此类扩增子的核苷酸序列用于鉴别和表征新颖的bcr和/或tcr等位基因。
49.在一些实施例中,多重扩增反应用于扩增已经进行v(d)j重排的bcr和/或tcr基因组dna。在一些实施例中,多重扩增反应用于从源自生物样品的gdna扩增包括bcr和/或tcr cdr的至少一部分的一个或多个核酸分子。在一些实施例中,多重扩增反应用于从源自生物样品的gdna扩增包括bcr和/或tcr的至少两个cdr的一个或多个核酸分子。在一些实施例中,多重扩增反应用于从源自生物样品的gdna扩增包括bcr和/或tcr的至少三个cdr的核酸分子。在一些实施例中,所得扩增子用于测定样品中的重排的bcr和/或tcr cdr的核苷酸序列。在一些实施例中,测定至少包括cdr3的此类扩增子的核苷酸序列用于鉴别和表征新颖的bcr和/或tcr等位基因。
50.在多重扩增反应的一些实施例中,使用的每个引物组靶向同一bcr或tcr区,然而所述组中的不同引物允许靶向基因的不同v(d)j基因重排。例如,用于扩增表达的igh或重排的igh gdna的引物组全部设计成靶向分别来自igh mrna或igh gdna的一个或多个相同的区,但所述组中的单独的引物导致各种igh vdj基因组合的扩增。在一些实施例中,至少一个引物或引物组针对免疫受体基因的相对保守区(例如,c基因的一部分),并且另一个引物组包含针对同一基因的更可变区(例如,v基因的一部分)的各种引物。在其它实施例中,至少一个引物组包括针对免疫受体基因的j基因片段的至少一部分的各种引物,并且另一个引物组包含针对同一基因的v基因片段的至少一部分的各种引物。
51.在一些实施例中,多重扩增反应用于扩增源自从包含重排的igh、igk和igl基因组dna的重排的bcr基因组dna表达的mrna的cdna。在一些实施例中,在多重扩增反应中从cdna扩增bcr cdr的至少一部分,例如cdr3。在一些实施例中,在多重扩增反应中从cdna扩增bcr的至少两个cdr部分。在某些实施例中,多重扩增反应用于至少扩增bcr cdna的cdr1区、cdr2区和cdr3区。在一些实施例中,所得扩增子用于测定表达的bcr cdr核苷酸序列。在一些实施例中,所得扩增子用于测定表达的bcr cdr核苷酸序列和所述序列的ig同种型。在一些实施例中,所得扩增子用于测定表达的igh cdr核苷酸序列和ig同种型以及ig亚同种型。
52.在一些实施例中,多重扩增反应用于扩增重排的bcr基因组dna,包含重排的igh、
igk和igl基因组dna。在一些实施例中,在多重扩增反应中从gdna扩增bcr cdr的至少一部分,例如cdr3。在一些实施例中,在多重扩增反应中从gdna扩增bcr的至少两个cdr部分。在某些实施例中,多重扩增反应用于至少扩增重排bcr gdna的cdr1区、cdr2区和cdr3区。在一些实施例中,所得扩增子用于测定重排的bcr cdr核苷酸序列。在一些实施例中,所得扩增子用于测定重排的bcr cdr核苷酸序列和所述序列的ig同种型。
53.在一些实施例中,用设计用于产生扩增子的引物组执行多重扩增反应,所述扩增子包含靶免疫受体mrna的表达的cdr1区、cdr2区和/或cdr3区。在一些实施例中,使用以下执行多重扩增反应:(i)每个引物针对v基因的框架区fr1的至少一部分的一组引物以及(ii)针对靶免疫受体的至少一个c基因的一部分的至少一个引物。在其它实施例中,使用以下执行多重扩增反应:(i)每个引物针对v基因的框架区fr2的至少一部分的一组引物以及(ii)针对靶免疫受体的至少一个c基因的一部分的至少一个引物。在其它实施例中,使用以下执行多重扩增反应:(i)每个引物针对v基因的框架区fr3的至少一部分的一组引物以及(ii)针对靶免疫受体的至少一个c基因的一部分的至少一个引物。在一些实施例中,用设计成产生包含靶mrna的一种或多种表达的igh同种型的扩增子的引物组执行多重扩增反应,并且使用以下执行此类反应:(i)上述fr1引物组、fr2引物组或fr3引物组之一和(ii)每个引物针对iga、igd、ige、igg和/或igm的至少一个c基因的一部分的一组引物。在一些实施例中,一个或多个针对c基因的引物是所述一个或多个c基因的5'末端的约200个核苷酸内的针对c基因的编码序列。在一些实施例中,一个或多个针对c基因的引物是所述一个或多个c基因的5'末端的约150个核苷酸内的针对c基因的编码序列。在一些实施例中,一个或多个针对c基因的引物是所述一个或多个c基因的5'末端的约100个核苷酸内的针对c基因的编码序列。在一些实施例中,一个或多个针对c基因的引物是所述一个或多个c基因的5'末端的约50个核苷酸内、约50到约150个核苷酸内、约75到约175个核苷酸内、或约100到约200个核苷酸内的针对c基因的编码序列。在一些实施例中,一个或多个针对c基因的引物针对不仅区分同种型而且还允许测定亚同种型的针对c基因的基因编码测序。例如,在一些实施例中,一个或多个针对c基因的引物在扩增子中产生恒定区的足够部分,从而可以基于所测定的序列数据测定亚同种型。在一些实施例中,一个或多个针对c基因的引物包含针对允许鉴别igg1亚同种型、igg2亚同种型、igg3亚同种型、igg4亚同种型、iga1亚同种型和iga2亚同种型的igg和/或iga c基因编码序列的引物。
54.在一些实施例中,多重扩增反应使用(i)其中的每一个都与v基因fr1区的至少一部分退火的一组引物和(ii)与恒定(c)基因的一部分退火的至少一个引物以扩增bcr cdna,使得所得扩增子包含bcr mrna的cdr1编码部分、cdr2编码部分和cdr3编码部分。在某些实施例中,将针对fr1的引物组与一组至少两个针对c基因的引物组合以产生至少包含bcr mrna的cdr1编码部分、cdr2编码部分和cdr3编码部分的扩增子。在一些实施例中,将针对igh fr1的引物组与针对两个不同igh同种型的编码部分的一组至少两个c基因引物组合以产生至少包含igh mrna的cdr1编码部分、cdr2编码部分和cdr3编码部分的扩增子。在一些实施例中,将针对igh fr1的引物组与针对不同igh同种型的编码部分的至少三个、至少四个或至少五个引物组合。例如,表3中示出了对igh v基因fr1区特异的示例性引物,并且表6
‑
10中示出了对igh c基因特异的示例性引物。
55.在一些实施例中,多重扩增反应使用(i)其中的每一个都与v基因fr2区的至少一
部分退火的一组引物和(ii)与c基因的一部分退火的至少一个引物以扩增bcr cdna,使得所得扩增子包含bcr mrna的cdr2编码部分和cdr3编码部分。在某些实施例中,将此类针对fr2的引物组与至少两个针对c基因的引物组合以产生包含bcr mrna的cdr2编码部分和cdr3编码部分的扩增子。在一些实施例中,将针对igh fr2的引物组与针对两个不同igh同种型的编码部分的一组至少两个c基因引物组合以产生具有igh mrna的cdr2和cdr3编码部分的扩增子。在一些实施例中,将针对igh fr2的引物组与针对不同igh同种型的编码部分的至少三个、至少四个或至少五个c基因引物组合。示例性针对fr2的引物包含由欧洲学术实验室和研究医院的联盟开发和标准化并在表4中示出的biomed
‑
2引物(van dongen等人.(2003)《白血病》17:2257
‑
2327)。表6
‑
10中示出对igh c基因特异的示例性引物。
56.在一些实施例中,多重扩增反应使用(i)其中的每一个都与v基因fr3区的至少一部分退火的一组引物和(ii)与c基因的一部分退火的至少一个引物以扩增bcr cdna,使得所得扩增子主要包含bcr mrna的cdr3编码部分。在某些实施例中,将此类针对fr3的引物组与至少两个针对c基因的引物组合以产生具有bcr mrna的cdr3编码部分的扩增子。在一些实施例中,将针对igh fr3的引物组与针对两个不同igh同种型的编码部分的一组至少两个c基因引物组合以产生具有igh mrna的cdr3编码部分的扩增子。在一些实施例中,将针对igh fr3的引物组与针对不同igh同种型的编码部分的至少三个、至少四个或至少五个c基因引物组合。例如,表2中示出了对igh v基因fr3区特异的示例性引物,并且表6
‑
10中示出了对igh c基因特异的示例性引物。
57.在一些实施例中,用设计用于产生扩增子的引物组执行多重扩增反应,所述扩增子包含靶免疫受体mrna或重排的gdna的cdr1区、cdr2区和/或cdr3区。在一些实施例中,使用以下执行多重扩增反应:(i)每个引物针对v基因的框架区fr1的至少一部分的一组引物以及(ii)每个引物针对靶免疫受体的j基因的至少一部分的一组引物。在其它实施例中,使用以下执行多重扩增反应:(i)每个引物针对v基因的框架区fr2的至少一部分的一组引物以及(ii)每个引物针对靶免疫受体的j基因的至少一部分的一组引物。在其它实施例中,使用以下执行多重扩增反应:(i)每个引物针对v基因的框架区fr3的至少一部分的一组引物以及(ii)每个引物针对靶免疫受体的j基因的至少一部分的一组引物。
58.在一些实施例中,多重扩增反应使用(i)其中的每一个都与v基因fr1区的至少一部分退火的一组引物和(ii)与j基因的一部分退火的一组引物以扩增bcr核酸,使得所得扩增子包含bcr mrna或重排的gdna的cdr1编码部分、cdr2编码部分和cdr3编码部分。例如,表3中示出了对igh v基因fr1区特异的示例性引物,并且表5中示出了对igh j基因特异的示例性引物。
59.在一些实施例中,多重扩增反应使用(i)其中的每一个均与v基因fr2区的至少一部分退火的一组引物和(ii)与j基因的一部分退火的一组引物以扩增bcr核酸,使得所得扩增子包含bcr mrna或重排的gdna的cdr2编码部分和cdr3编码部分。例如,表4中示出了对igh v基因fr2区特异的示例性引物,并且表5中示出了对igh j基因特异的示例性引物。
60.在一些实施例中,多重扩增反应使用(i)其中的每一个都与v基因fr3区的至少一部分退火的一组引物和(ii)与j基因的一部分退火的一组引物以扩增bcr核酸,使得所得扩增子主要包含bcr mrna或重排的gdna的cdr3编码部分。例如,表2中示出了对igh v基因fr3区特异的示例性引物,并且表5中示出了对igh j基因特异的示例性引物。
61.在一些实施例中,提供了用于对表达的bcr可变区的至少一部分进行多重扩增的组合物。在一些实施例中,组合物包括针对选自由以下组成的组的重排靶免疫受体基因的v基因框架区的一部分和恒定(c)基因的一部分的多组引物对试剂:免疫球蛋白重链(igh)、免疫球蛋白轻链λ(igl)和免疫球蛋白轻链κ(igk)。在一些实施例中,组合物包括针对选自由igh、igl和igk组成的组的重排靶免疫受体基因的v基因框架区的一部分和j基因的一部分的多组引物对试剂。
62.在一些实施例中,组合物包括(i)针对重排的igh基因的igh v基因框架区的一部分和igh c基因的一部分的多组引物对试剂和(ii)针对重排的tcrβ基因的tcrβv基因框架区的一部分和tcrβc基因的一部分的多组引物对试剂。在一些实施例中,组合物包括(i)针对重排的igh基因的igh v基因框架区的一部分和igh j基因的一部分的多组引物对试剂和(ii)针对重排的tcrβ基因的tcrβj基因框架区的一部分和tcr v基因的一部分的多组引物对试剂。
63.用至少两个引物执行通过pcr的扩增。对于本文提供的方法,使用足以在所关注的基因座处扩增可变序列的全部或限定部分的一组引物,所述基因座可以包含上述tcr和免疫球蛋白基因座中的任何或全部tcr和免疫球蛋白基因座。在一些实施例中,可以使用本文概述的各种参数或标准来选择靶特异性引物组以进行多重扩增。
64.在一些实施例中,在多重反应中使用的引物组被设计成在所关注的基因座处扩增至少50%的已知表达的重排或gdna重排。在某些实施例中,在多重反应中使用的引物组被设计成在所关注的基因座处扩增至少75%、至少85%、至少90%、至少95%、至少97%、至少98%或更多的已知表达的重排或gdna重排。又例如,使用表3的27个正向引物(每个引物针对来自不同igh v基因的fr1区的一部分)与表6
‑
10的至少一个反向引物(每个引物针对不同igh c基因的一部分)组合将为给定同种型扩增目前已知的表达的igh重排中的所有重排。又例如,使用表2的68个正向引物(每个引物针对来自不同igh v基因的fr3区的一部分)与表6
‑
10的至少一个反向引物(每个引物针对不同igh c基因的一部分)组合将为给定同种型扩增目前已知的表达的igh重排中的所有重排。又例如,使用表2的68个正向引物(每个引物针对来自不同igh v基因的fr3区的一部分)与表5的4个反向引物(每个引物针对不同igh j基因的一部分)组合将扩增目前已知的表达的igh重排或gdna igh重排中的所有重排。又例如,使用表3的27个正向引物(每个引物针对来自不同igh v基因的fr1区的一部分)与表5的4个反向引物(每个引物针对不同igh j基因的一部分)组合将扩增目前已知的表达的igh重排或gdna igh重排中的所有重排。
65.例如,此类多重扩增反应至少包含15个、20个、25个、30个、35个、40个、45个、50个、55个、60个、65个、70个、75个、80个、85个或90个,优选地22个、23个、24个、25个、26个、27个、28个、29个、30个、34个、38个、42个、46个、50个、54个、58个或62个反向引物,其中每个反向引物针对对应于一个或多个bcr v基因fr1区的至少一部分的序列。在此类实施例中,针对bcr v基因fr1区的所述多个反向引物与针对对应于同一bcr基因的恒定基因的至少一部分的序列的至少1个正向引物组合。在一些实施例中,针对bcr v基因fr1区的所述多个反向引物与至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10、至少11、至少12、至少15、或约2到约7、约5到约20、约5到约15或约7到约12个正向引物组合,每个引物都针对对应于同一bcr基因的恒定基因的至少一个基因的至少一部分的序列。在多
重扩增反应的一些实施例中,针对bcr v基因fr1的引物可以是正向引物,并且一个或多个针对bcr c基因的引物可以是一个或多个反向引物。因此,在一些实施例中,多重扩增反应至少包含15个、20个、25个、30个、35个、40个、45个、50个、55个、60个、65个、70个、75个、80个、85个或90个,优选地22个、23个、24个、25个、26个、27个、28个、29个、30个、34个、38个、42个、46个、50个、54个、58个或62个正向引物,其中每个正向引物针对对应于一个或多个bcr v基因fr1区的至少一部分的序列。在此类实施例中,针对bcr v基因fr1区的所述多个正向引物与针对对应于同一bcr基因的c基因的至少一部分的序列的至少1个反向引物组合。在一些实施例中,针对bcr v基因fr1区的所述多个正向引物与至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10、至少11、至少12、至少15、或约2到约7、约5到约20、约5到约15或约7到约12个反向引物组合,每个引物都针对对应于同一bcr基因的c基因的至少一个基因的至少一部分的序列。在一些实施例中,此类fr1和c基因扩增引物组可以针对igh基因序列。在一些优选实施例中,将针对不同igh v基因fr1区的约22到约35个反向引物与针对igh c基因的一部分的约2到约8个正向引物组合。在其它优选实施例中,将针对不同igh v基因fr1区的约22到约35个反向引物与针对igh c基因的一部分的约5到约15个正向引物组合。在其它优选实施例中,将针对不同igh v基因fr1区的约48到约60个反向引物与针对igh c基因的一部分的约5到约15个正向引物组合。在一些优选实施例中,将针对不同igh v基因fr1区的约22到约35个正向引物与针对igh c基因的一部分的约2到约8个反向引物组合。在其它优选实施例中,将针对不同igh v基因fr1区的约22到约35个正向引物与针对igh c基因的一部分的约5到约15个反向引物组合。在又其它优选实施例中,将针对不同igh v基因fr1区的约48到约60个正向引物与针对igh c基因的一部分的约5到约15个反向引物组合。在一些优选实施例中,针对igh v基因fr1区的正向引物选自表3中列出的那些正向引物,并且针对igh c基因的反向引物选自表6
‑
10中列出的那些反向引物。在其它实施例中,fr1和c基因扩增引物组可以针对ig轻链λ、ig轻链κ、tcrα、tcrγ、tcrδ或tcrβ基因序列。
66.在一些实施例中,多重扩增反应至少包含5个、10个、15个、20个、25个、30个、40个、50个、60个、70个、80个或90个反向引物,其中每个反向引物针对对应于一个或多个bcr v基因fr2区的至少一部分的序列。在此类实施例中,针对bcr v基因fr2区的所述多个反向引物与针对对应于同一bcr基因的c基因的至少一部分的序列的至少1个正向引物组合。在一些实施例中,针对bcr v基因fr2区的所述多个反向引物与至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10、至少11、至少12、至少15、或约2到约7、约5到约20、约5到约15或约7到约12个正向引物组合,每个引物都针对对应于同一bcr基因的c基因的至少一个基因的至少一部分的序列。在多重扩增反应的一些实施例中,针对bcr v基因fr2的引物可以是正向引物,并且一个或多个针对bcr c基因的引物可以是一个或多个反向引物。因此,在一些实施例中,多重扩增反应至少包含5个、10个、15个、20个、25个、30个、40个、50个、60个、70个、80个或90个正向引物,其中每个正向引物针对对应于一个或多个bcr v基因fr2区的至少一部分的序列。在此类实施例中,针对bcr v基因fr2区的所述多个正向引物与针对对应于同一bcr基因的c基因的至少一部分的序列的至少1个反向引物组合。在一些实施例中,针对bcr v基因fr2区的所述多个正向引物与至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10、至少11、至少12、至少15、或约2
到约7、约5到约20、约5到约15或约7到约12个反向引物组合,每个引物都针对对应于同一bcr基因的c基因的至少一个基因的至少一部分的序列。在一些实施例中,此类fr2和c基因扩增引物组可以针对igh基因序列。在一些实施例中,将针对不同igh v基因fr2区的约5到约15个反向引物与针对igh c基因的一部分的约2到约8个正向引物组合。在一些实施例中,将针对不同igh v基因fr2区的约5到约15个反向引物与针对igh c基因的一部分的约5到约15个正向引物组合。在一些实施例中,将针对不同igh v基因fr2区的约5到约15个正向引物与针对igh c基因的一部分的约2到约8个反向引物组合。在一些实施例中,将针对不同igh v基因fr2区的约5到约15个正向引物与针对igh c基因的一部分的约5到约15个反向引物组合。在一些优选实施例中,针对igh v基因fr2区的正向引物选自表4中列出的那些正向引物,并且针对igh c基因的反向引物选自表6
‑
10中列出的那些反向引物。在其它实施例中,fr2和c基因扩增引物组可以针对ig轻链λ、ig轻链κ、tcrα、tcrγ、tcrδ或tcrβ基因序列。
67.在一些实施例中,多重扩增反应至少包含20个、25个、30个、40个、45个,优选地50个、55个、60个、65个、70个、75个、80个、85个或90个反向引物,其中每个反向引物针对对应于一个或多个bcr v基因fr3区的至少一部分的序列。在此类实施例中,针对bcr v基因fr3区的所述多个反向引物与针对对应于同一bcr基因的c基因的至少一部分的序列的至少1个正向引物组合。在一些实施例中,针对bcr v基因fr3区的所述多个反向引物与至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10、至少11、至少12、至少15、或约2到约7、约5到约20、约5到约15或约7到约12个正向引物组合,每个引物都针对对应于同一bcr基因的c基因的至少一个基因的至少一部分的序列。在多重扩增反应的一些实施例中,针对bcr v基因fr3的引物可以是正向引物,并且一个或多个针对bcr c基因的引物可以是一个或多个反向引物。因此,在一些实施例中,多重扩增反应至少包含20个、25个、30个、40个、45个,优选地50个、55个、60个、65个、70个、75个、80个、85个或90个反向引物,其中每个正向引物针对对应于一个或多个bcr v基因fr3区的至少一部分的序列。在此类实施例中,针对bcr v基因fr3区的所述多个正向引物与针对对应于同一bcr基因的c基因的至少一部分的序列的至少1个反向引物组合。在一些实施例中,针对bcr v基因fr3区的所述多个正向引物与至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10、至少11、至少12、至少15、或约2到约7、约5到约20、约5到约15或约7到约12个反向引物组合,每个引物都针对对应于同一bcr基因的c基因的至少一个基因的至少一部分的序列。在一些实施例中,此类fr3和c基因扩增引物组可以针对igh基因序列。在一些优选实施例中,将针对不同igh v基因fr3区的约62到约75个反向引物与针对igh c基因的一部分的约2到约8个正向引物组合。在其它优选实施例中,将针对不同igh v基因fr3区的约62到约75个反向引物与针对igh c基因的一部分的约5到约15个正向引物组合。在一些优选实施例中,将针对不同igh v基因fr3区的约62到约75个正向引物与针对igh c基因的一部分的约2到约8个反向引物组合。在其它优选实施例中,将针对不同igh v基因fr3区的约62到约75个正向引物与针对igh c基因的一部分的约5到约15个反向引物组合。在一些优选实施例中,针对igh v基因fr3区的正向引物选自表2中列出的那些正向引物,并且针对igh c基因的反向引物选自表6
‑
10中列出的那些反向引物。在其它实施例中,fr3和c基因扩增引物组可以针对ig轻链λ、ig轻链κ、tcrα、tcrγ、tcrδ和tcrβ基因序列。
68.在一些实施例中,此类多重扩增反应至少包含15个、20个、25个、30个、35个、40个、
45个、50个、55个、60个、65个、70个、75个、80个、85个或90个,优选地22个、23个、24个、25个、26个、27个、28个、29个、30个、34个、38个、42个、46个、50个、54个、58个或62个反向引物,其中每个反向引物针对对应于一个或多个bcr v基因fr1区的至少一部分的序列。在此类实施例中,针对bcr v基因fr1区的所述多个反向引物与针对对应于同一bcr基因的j基因的至少一部分的序列的至少2个、3个、4个、5个、6个、8个或约3
‑
6个正向引物组合。在多重扩增反应的一些实施例中,针对bcr v基因fr1的引物可以是正向引物,并且针对bcr j基因的引物可以是反向引物。因此,在一些实施例中,多重扩增反应至少包含15个、20个、25个、30个、35个、40个、45个、50个、55个、60个、65个、70个、75个、80个、85个或90个,优选地22个、23个、24个、25个、26个、27个、28个、29个、30个、34个、38个、42个、46个、50个、54个、58个或62个正向引物,其中每个正向引物针对对应于一个或多个bcr v基因fr1区的至少一部分的序列。在此类实施例中,针对bcr v基因fr1区的所述多个正向引物与针对对应于同一bcr基因的j基因的至少一部分的序列的至少2个、3个、4个、5个、6个、8个或约3
‑
6个反向引物组合。在一些实施例中,此类fr1和j基因扩增引物组可以针对igh基因序列。在一些优选实施例中,将针对不同igh v基因fr1区的约22到约35个反向引物与针对不同igh j基因的约3到约6个正向引物组合。在一些优选实施例中,将针对不同igh v基因fr1区的约22到约35个正向引物与针对不同igh j基因的约3到约6个反向引物组合。在一些优选实施例中,针对igh v基因fr1区的正向引物选自表3中列出的那些正向引物,并且针对igh j基因的反向引物选自表5中列出的那些反向引物。在其它实施例中,fr1和j基因扩增引物组可以针对ig轻链λ、ig轻链κ、tcrα、tcrγ、tcrδ或tcrβ基因序列。
69.在一些实施例中,多重扩增反应至少包含5个、10个、15个、20个、25个、30个、40个、50个、60个、70个、80个或90个反向引物,其中每个反向引物针对对应于一个或多个bcr v基因fr2区的至少一部分的序列。在此类实施例中,针对bcr v基因fr2区的所述多个反向引物与针对对应于同一bcr基因的j基因的至少一部分的序列的至少2个、3个、4个、5个、6个、8个或约3
‑
6个正向引物组合。在多重扩增反应的一些实施例中,针对bcr v基因fr2的引物可以是正向引物,并且针对bcr j基因的引物可以是反向引物。因此,在一些实施例中,多重扩增反应至少包含5个、10个、15个、20个、25个、30个、40个、50个、60个、70个、80个或90个正向引物,其中每个正向引物针对对应于一个或多个bcr v基因fr2区的至少一部分的序列。在此类实施例中,针对bcr v基因fr2区的所述多个正向引物与针对对应于同一bcr基因的j基因的至少一部分的序列的至少2个、3个、4个、5个、6个、8个或约3
‑
6个反向引物组合。在一些实施例中,此类fr2和j基因扩增引物组可以针对igh基因序列。在一些优选实施例中,将针对不同igh v基因fr2区的约5到约15个反向引物与针对不同igh j基因的约3到约6个正向引物组合。在一些优选实施例中,将针对不同igh v基因fr2区的约5到约15个正向引物与针对不同igh j基因的约3到约6个反向引物组合。在一些优选实施例中,针对igh v基因fr2区的正向引物选自表4中列出的那些正向引物,并且针对igh j基因的反向引物选自表5中列出的那些反向引物。在其它实施例中,fr2和j基因扩增引物组可以针对ig轻链λ、ig轻链κ、tcrα、tcrγ、tcrδ或tcrβ基因序列。
70.在一些实施例中,多重扩增反应至少包含20个、25个、30个、40个、45个,优选地50个、55个、60个、65个、70个、75个、80个、85个或90个反向引物,其中每个反向引物针对对应于一个或多个bcr v基因fr3区的至少一部分的序列。在此类实施例中,针对bcr v基因fr3
区的所述多个反向引物与针对对应于同一bcr基因的j基因的至少一部分的序列的至少2个、3个、4个、5个、6个、8个或约3
‑
6个正向引物组合。在多重扩增反应的一些实施例中,针对bcr v基因fr3的引物可以是正向引物,并且针对bcr j基因的引物可以是反向引物。因此,在一些实施例中,多重扩增反应至少包含20个、25个、30个、40个、45个,优选地50个、55个、60个、65个、70个、75个、80个、85个或90个正向引物,其中每个正向引物针对对应于一个或多个bcr v基因fr3区的至少一部分的序列。在此类实施例中,针对bcr v基因fr3区的所述多个正向引物与针对对应于同一bcr基因的j基因的至少一部分的序列的至少2个、3个、4个、5个、6个、8个或约3
‑
6个反向引物组合。在一些实施例中,此类fr3和j基因扩增引物组可以针对igh基因序列。在一些优选实施例中,将针对不同igh v基因fr3区的约62到约75个反向引物与针对不同igh j基因的约3到约6个正向引物组合。在一些优选实施例中,将针对不同igh v基因fr3区的约62到约75个正向引物与针对不同igh j基因的约3到约6个反向引物组合。在一些优选实施例中,针对igh v基因fr3区的正向引物选自表2中列出的那些正向引物,并且针对igh j基因的反向引物选自表5中列出的那些反向引物。在其它实施例中,fr3和j基因扩增引物组可以针对ig轻链λ、ig轻链κ、tcrα、tcrγ、tcrδ和tcrβ基因序列。
71.在一些实施例中,在多重扩增反应中正向引物的浓度约等于反向引物的浓度。在其它实施例中,在多重扩增反应中正向引物的浓度约为反向引物的浓度的两倍。在其它实施例中,在多重扩增反应中正向引物的浓度约为反向引物的浓度的一半。在一些实施例中,靶向v基因fr区的引物中的每个引物的浓度为约5nm到约2000nm。在一些实施例中,靶向v基因fr区的引物中的每个引物的浓度为约50nm到约800nm。在一些实施例中,靶向v基因fr区的引物中的每个引物的浓度为约50nm到约400nm或约100nm到约500nm。在一些实施例中,靶向v基因fr区的引物中的每个引物的浓度为约200nm、约400nm、约600nm或约800nm。在一些实施例中,靶向v基因fr区的引物中的每个引物的浓度为约5nm、约10nm、约50nm、约100nm或约150nm。在一些实施例中,靶向v基因fr区的引物中的每个引物的浓度为约1000nm、约1250nm、约1500nm、约1750nm或约2000nm。在一些实施例中,靶向v基因fr区的引物中的每个引物的浓度为约50nm到约800nm。在一些实施例中,靶向j基因的引物中的每个引物的浓度为约5nm到约2000nm。在一些实施例中,靶向j基因的引物中的每个引物的浓度为约50nm到约800nm。在一些实施例中,靶向j基因的引物中的每个引物的浓度为约50nm到约400nm或约100nm到约500nm。在一些实施例中,靶向j基因的引物中的每个引物的浓度为约200nm、约400nm、约600nm或约800nm。在一些实施例中,靶向j基因的引物中的每个引物的浓度为约5nm、约10nm、约50nm、约100nm或约150nm。在一些实施例中,靶向j基因的引物中的每个引物的浓度为约1000nm、约1250nm、约1500nm、约1750nm或约2000nm。在一些实施例中,靶向j基因的引物中的每个引物的浓度为约50nm到约800nm。在一些实施例中,靶向c基因的引物中的每个引物的浓度为约5nm到约2000nm。在一些实施例中,靶向c基因的引物中的每个引物的浓度为约50nm到约800nm。在一些实施例中,靶向c基因的引物中的每个引物的浓度为约50nm到约400nm或约100nm到约500nm。在一些实施例中,靶向c基因的引物中的每个引物的浓度为约200nm、约400nm、约600nm或约800nm。在一些实施例中,靶向c基因的引物中的每个引物的浓度为约5nm、约10nm、约50nm、约100nm或约150nm。在一些实施例中,靶向c基因的引物中的每个引物的浓度为约1000nm、约1250nm、约1500nm、约1750nm或约2000nm。在一些实施例中,靶向c基因的引物中的每个引物的浓度为约50nm到约800nm。在一些实施例中,在多
重反应中每个正向和反向引物的浓度为约50nm、约100nm、约200nm或约400nm。在一些实施例中,在多重反应中每个正向和反向引物的浓度为约5nm到约2000nm。在一些实施例中,在多重反应中每个正向和反向引物的浓度为约50nm到约800nm。在一些实施例中,在多重反应中每个正向和反向引物的浓度为约50nm到约400nm或约100nm到约500nm。在一些实施例中,在多重反应中每个正向和反向引物的浓度为约600nm、约800nm、约1000nm、约1250nm、约1500nm、约1750nm或约2000nm。在一些实施例中,在多重反应中每个正向和反向引物的浓度为约5nm、约10nm、约150nm或50nm到约800nm。
72.在一些实施例中,v基因fr和针对c基因靶标的引物以扩增引物对的形式组合,以扩增靶免疫受体cdna序列并产生靶扩增子。通常,靶扩增子的长度将取决于哪个v基因引物组(例如,fr1、fr2或针对fr3的引物)与一个或多个c基因引物配对。因此,在一些实施例中,靶扩增子的长度可以在约100个核苷酸(或碱基或碱基对)到约600个核苷酸(或碱基或碱基对)的范围内。在一些实施例中,靶扩增子的长度可以在约80个核苷酸到约600个核苷酸的范围内。在一些实施例中,靶扩增子的长度为约200到约600或约300到约600个核苷酸。在一些实施例中,靶扩增子的长度为约80到约140、约90到约130、或约100到约120个核苷酸。在一些实施例中,靶扩增子的长度为约250到约275、约250到约350、约300到约350、约310到约330、约325到约375、约300到约400、约350到约400、约350到约425、约350到约450、约380到约410、约375到约425、约400到约500、约425到约500、约450到约550、约500到约600、约400到约500、或约400到约600个核苷酸。在一些实施例中,靶扩增子的长度为约80、约100、约120、约140、约200、约250、约275、约300、约320、约350、约375、约400、约425、约450、约500、约550或约600个核苷酸。在一些实施例中,igh扩增子的长度为约100、约80到约140、约90到约130或约100到约120个核苷酸。在一些实施例中,igh扩增子的长度为约320、约300到约350或约310到约330个核苷酸。在一些实施例中,igh扩增子的长度为约400、约375到约425或约390到约410个核苷酸。
73.在一些实施例中,v基因fr和针对j基因靶标的引物以扩增引物对的形式组合,以扩增靶免疫受体cdna或重排gdna序列并产生靶扩增子。通常,靶扩增子的长度将取决于哪个v基因引物组(例如,fr1、fr2或针对fr3的引物)与j基因引物配对。因此,在一些实施例中,靶扩增子的长度可以在约50个核苷酸到约350个核苷酸的范围内。在一些实施例中,靶扩增子的长度为约50到约200、约70到约170、约200到约350、约250到约320、约270到约300、约225到约300、约250到约275、约200到约235、约200到约250、或约175到约275个核苷酸。在一些实施例中,igh扩增子的长度为约80、约60到约100或约70到约90个核苷酸。在一些实施例中,如使用v基因fr3和针对j基因的引物对产生的那些扩增子等igh扩增子的长度为约50到约200个核苷酸,优选地长度为约60到约160、约65到约120、约90到约120、约70到约90个核苷酸、或约80个核苷酸。在一些实施例中,产生此类长度很短的扩增子使所提供的方法和组合物有效地检测和分析来自高度降解的gdna模板材料(如源自ffpe样品或无细胞dna(cfdna)的模板材料)的免疫组库。
74.在一些实施例中,扩增引物可以包含条形码序列,例如以区分或分离样品中的多个扩增的靶序列。在一些实施例中,扩增引物可以包含两个或更多个条形码序列,例如以区分或分离在样品中的多个扩增的靶序列。在一些实施例中,扩增引物可以包含标记序列,其可帮助随后对所生成的扩增子进行编目、鉴别或测序。在一些实施例中,通过包含在扩增引
物中或通过衔接子的接合将条形码序列或标记序列并入扩增的核苷酸序列中。引物可以进一步包括可用于后续测序例如焦磷酸测序的核苷酸。此类序列易于通过商业上可获得的软件程序或公司设计。
75.在一些实施例中,使用不包含标记序列的靶向扩增引物进行多重扩增。在其它实施例中,用扩增引物进行多重扩增,所述扩增引物各自包含靶向序列和标记序列,例如正向引物或引物组包括标记序列1,而反向引物或引物组包括标记序列2。在仍其它实施例中,用扩增引物执行多重扩增,其中一个引物或引物组包含针对靶标的序列和标记序列,并且另一个引物或引物组包含针对靶标的序列但不包含标记序列,例如,正向引物或引物组包含标记序列,并且反向引物或引物组不包含标记序列。
76.因此,在一些实施例中,多个靶cdna或gdna模板分子在单一多重扩增反应混合物中用针对bcr和/或tcr的扩增引物扩增,其中正向和/或反向引物包含标记序列,并且所得扩增子在一端或两端包含靶bcr和/或tcr序列和标记序列。在一些实施例中,正向和/或反向扩增引物或引物组还可以包含条形码,并且然后将一个或多个条形码包含在所得扩增子中。
77.在一些实施例中,多个靶cdna或gdna模板分子在单一多重扩增反应混合物中用针对bcr和/或tcr的扩增引物扩增,并且所得扩增子仅含有bcr和/或tcr序列。在一些实施例中,通过例如衔接子接合将标记序列添加到此类扩增子的末端中。在一些实施例中,通过例如衔接子接合将条形码序列添加到此类扩增子的一端或两端中。
78.适合用作条形码和条形码文库的核苷酸序列是本领域已知的。包含条形码序列的衔接子和扩增引物和引物组是可商购的。含有条形码序列的寡核苷酸衔接子也是可商购的,包含例如ionxpress
tm
、ioncode
tm
和离子选择(ion select)条形码衔接子(赛默飞世尔科技公司(thermo fisher scientific))。类似地,本领域描述和已知的另外和其它通用衔接子/引物序列(例如,依诺米那(illumina)通用衔接子/引物序列、太平洋生物科学(pacbio)通用衔接子/引物序列等)可以与本文提供的方法和组合物结合使用,并且使用相关分析平台对所得扩增子进行测序。
79.在一些实施例中,当对多重样品进行测序时,将两个或更多个条形码添加到扩增子。在一些实施例中,在对多重样品进行测序之前,将至少两个条形码添加到扩增子,以降低源自条形码交叉污染或在样品之间条形码渗透的人工结果(例如,免疫受体基因重排或克隆鉴别)的频率。在一些实施例中,当跟踪免疫组库的低频克隆时,使用至少两个条形码来标记样品。在一些实施例中,当使用测定法检测频率小于1:1,000的克隆时,将至少两个条形码添加到扩增子。在一些实施例中,当使用测定来检测频率小于1:10,000的克隆时,将至少两个条形码添加到扩增子中。在其它实施例中,当使用测定来检测频率小于1:20,000、小于1:40,000、小于1:100,000、小于1:200,000、小于1:400,000、小于1:500,00、或小于1:1,000,000的克隆时,将至少两个条形码添加到扩增子中。用于表征免疫组库的受益于每个克隆的高测序深度和/或在如此低的频率下进行的克隆检测的方法包含但不限于监测患有过度增殖性疾病的患者进行治疗以及在治疗后测试最小残留疾病。
80.在一些实施例中,选择或设计在本发明的方法中使用的靶特异性引物(例如,v基因fr1、fr2和针对fr3的引物、针对j基因的引物和针对c基因的引物)以满足以下标准中的任何一个或多个标准:(1)在所述引物序列内包含两个或更多个经修饰的核苷酸,所述核苷
酸中的至少一个核苷酸包含在所述引物的末端附近或末端处,并且所述核苷酸中的至少一个核苷酸包含在所述引物序列的中心核苷酸位置处或中心核苷酸位置周围;(2)长度为约15到约40个碱基长;(3)tm为高于60℃到约70℃;(4)与在所关注样品中存在的非靶序列的交叉反应性低;(5)至少前四个核苷酸(从3'到5'方向)与在同一反应中存在的任何其它引物内的任何序列不互补;并且(6)与在任何其它所产生的靶扩增子内的至少5个核苷酸的任何连续段不互补。在一些实施例中,选择或设计在所提供的方法中使用的靶特异性引物以满足上述标准中的任何2个、3个、4个、5个或6个。
81.在一些实施例中,在本发明方法中使用的靶特异性引物包含一个或多个具有可切割基团的修饰的核苷酸。在一些实施例中,在本发明方法中使用的靶特异性引物包含两个或更多个具有可切割基团的修饰的核苷酸。在一些实施例中,靶特异性引物包括选自以下的具有可切割基团的至少一种修饰的核苷酸:甲基鸟嘌呤、8
‑
氧代
‑
鸟嘌呤、黄嘌呤、次黄嘌呤、5,6
‑
二氢尿嘧啶、尿嘧啶、5
‑
甲基胞嘧啶、胸腺嘧啶二聚体、7
‑
甲基鸟苷、8
‑
氧代
‑
脱氧鸟苷、黄嘌呤核苷、肌苷、二氢尿苷、溴脱氧尿苷、尿苷或5
‑
甲基胞苷。
82.在一些实施例中,使用本文公开的扩增方法(和相关组合物、系统和试剂盒)的靶扩增子用于制备免疫受体组库文库。在一些实施例中,免疫受体组库文库包含将衔接子序列引入到靶扩增子序列的末端。在某些实施例中,用于制备免疫受体组库文库的方法包括根据本文所述的任何多重扩增方法生成靶免疫受体扩增子分子,通过消化处于扩增子分子的引物序列内的修饰的核苷酸来处理扩增子分子,并将至少一个衔接子接合到至少一个经过处理的扩增子分子,从而产生包含靶免疫受体组库的衔接子接合的靶免疫受体扩增子分子文库。在一些实施例中,制备文库的步骤在仅涉及添加步骤的单个反应容器中进行。在某些实施例中,方法进一步包含克隆扩增至少一个衔接子接合的靶扩增子分子的一部分。
83.在一些实施例中,使用本文公开的方法(和相关组合物、系统和试剂盒)的靶扩增子与下游过程偶联,如但不限于文库制备和核酸测序。例如,可以使用桥式扩增、乳液pcr或等温扩增来扩增靶扩增子,以产生适合于核酸测序的多个克隆模板。在一些实施例中,使用任何合适的dna测序平台对扩增子文库进行测序,所述测序平台如任何下一代测序平台,包含半导体测序技术,如离子激流(ion torrent)测序平台。在一些实施例中,使用ion genestudio s5 540
tm
系统或ion genestudio s5 520
tm
系统或ion genestudio s5 530
tm
系统或ion pgm 318
tm
系统对扩增子文库进行测序。
84.在一些实施例中,对使用本文公开的方法(和相关组合物和试剂盒)产生的免疫受体扩增子进行的测序产生长度为约200到约600个核苷酸的连续序列读段。在一些实施例中,连续读段长度为约300至约400个核苷酸。在一些实施例中,连续读段长度为约350至约450个核苷酸。在一些实施例中,读段长度平均为约300个核苷酸、约350个核苷酸或约400个核苷酸。在一些实施例中,连续读段长度为约250至约350个核苷酸、约275至约340或约295至约325个核苷酸。在一些实施例中,读段长度平均长度为约270、约280、约290、约300或约325个核苷酸。在其它实施例中,连续读段长度为约180到约300个核苷酸、约200到约290个核苷酸、约225到约280个核苷酸,或约230到约250个核苷酸。在一些实施例中,读段长度平均为约200、约220、约230、约240或约250个核苷酸。在其它实施例中,连续读段长度为约70至约200个核苷酸、约80至约150个核苷酸、约90至约140个核苷酸、或约100至约120个核苷酸长。在其它实施例中,连续读段长度为约50至约170个核苷酸、约60至约160个核苷酸、约
60至约120个核苷酸、约70至约100个核苷酸、约70至约90个核苷酸或约80个核苷酸长。在一些实施例中,读段长度平均为约70、约80、约90、约100、约110或约120个核苷酸。在一些实施例中,序列读段长度包含扩增子序列和条形码序列。在一些实施例中,序列读段长度不包含条形码序列。
85.在一些实施例中,扩增子引物和引物对是可以扩增核酸分子的特定区的靶特异性序列。在一些实施例中,靶特异性引物可以扩增表达的rna或cdna。在一些实施例中,靶特异性引物可以扩增哺乳动物rna,如人rna或由其制备的cdna,或鼠rna或由其制备的cdna。在一些实施例中,靶特异性引物可以扩增dna,如gdna。在一些实施例中,靶特异性引物可以扩增哺乳动物dna,如人dna或鼠dna。
86.在本文提供的方法和组合物,例如用于测定、表征和/或跟踪生物样品中的免疫组库的那些方法和组合物中,扩增靶序列所需的输入rna或gdna的量将部分取决于样品中带有免疫受体的细胞(例如,t细胞或b细胞)的级分。例如,如富集b细胞的样品等样品中较高级分的b细胞允许使用较低量的输入rna或gdna以进行扩增。在一些实施例中,用于扩增一个或多个靶序列的输入rna的量可以为约0.05ng到约10微克。在一些实施例中,用于一个或多个靶序列的多重扩增的输入rna的量可以为约5ng至约2微克。在一些实施例中,用于多重扩增一个或多个靶序列的rna的量可以是约5ng至约1微克或约10ng至约1微克。在一些实施例中,用于一个或多个免疫组库靶序列的多重扩增的rna的量为约1.5微克、约2微克、约2.5微克、约3微克、约3.5微克、约4.0微克、约5微克、约6微克、约7微克、或约10微克。在一些实施例中,用于多重扩增一种或多种免疫组库靶序列的rna的量为约10ng、约25ng、约50ng、约100ng、约200ng、约250ng、约500ng、约750ng、或约1000ng。在一些实施例中,用于多重扩增一种或多种免疫组库靶序列的rna的量为约25ng至约500ng rna或约50ng至约200ng rna。在一些实施例中,用于多重扩增一种或多种免疫组库靶序列的rna的量为约0.05ng至约10ng rna、约0.1ng至约5ng rna、约0.2ng至约2ng rna、或约0.5ng至约1ng rna。在一些实施例中,用于对一种或多种免疫组库靶序列进行多重扩增的rna的量为约0.05ng、约0.1ng、约0.2ng、约0.5ng、约1.0ng、约2.0ng或约5.0ng。
87.如本文中所描述的,在多重扩增之前,通常在逆转录反应中使用逆转录酶,将来自生物样品的rna转化成cdna。在一些实施例中,用输入rna执行逆转录反应,并且将来自逆转录反应的cdna的一部分用于多重扩增反应中。在一些实施例中,将从输入rna制备的基本上所有cdna加入到多重扩增反应中。在其它实施例中,将从输入rna制备的cdna的一部分,如约80%、约75%、约66%、约50%、约33%或约25%添加到多重扩增反应中。在其它实施例中,将从输入rna制备的cdna的约15%、约10%、约8%、约6%或约5%加入多重扩增反应中。
88.在一些实施例中,来自样品的添加到多重扩增反应中的cdna的量可以为约0.001ng到约5微克。在一些实施例中,用于一个或多个免疫组库靶序列的多重扩增的cdna的量可以为约0.01ng至约2微克。在一些实施例中,用于多重扩增一个或多个靶序列的cdna的量可以是约0.1ng至约1微克或约1ng至约0.5微克。在一些实施例中,用于多重扩增一种或多种免疫组库靶序列的cdna的量为约0.5ng、约1ng、约5ng、约10ng、约25ng、约50ng、约100ng、约200ng、约250ng、约500ng、约750ng、或约1000ng。在一些实施例中,用于多重扩增一种或多种免疫组库靶序列的cdna的量为约0.01ng至约10ng cdna、约0.05ng至约5ng cdna、约0.1ng至约2ng cdna、或约0.01ng至约1ng cdna。在一些实施例中,用于多重扩增一
种或多种免疫组库靶序列的cdna的量为约0.005ng、约0.01ng、约0.05ng、约0.1ng、约0.2ng、约0.5ng、约1.0ng、约2.0ng、或约5.0ng。
89.在一些实施例中,使用常规方法从生物样品中获得mrna并将其转化为cdna用于扩增目的。用于从生物样品提取或分离核酸的方法和试剂为众所周知的并且可商购获得。在一些实施例中,通过本文描述的或本领域的技术人员以其它方式已知的任何方法执行从生物样品中提取rna,所述方法例如涉及蛋白酶k组织消化和基于醇的核酸沉淀、用dnase处理以消化污染的dna以及使用硅胶膜技进行的rna纯化或其任何组合。用于从生物样品中提取rna的示例性方法使用可商购的试剂盒,包含recoverall
tm
多样品rna/dna工作流程(英杰公司(invitrogen))、recoverall
tm
总核酸分离试剂盒(英杰公司)、血液(马歇雷
‑
纳格尔公司(macherey
‑
nagel))、血液rna系统、tri reagent
tm
(英杰公司)、purelink
tm
rna微观尺度试剂盒(英杰公司)、magmax
tm
ffpe dna/rna超试剂盒(应用生物系统公司(applied biosystems))、zr rna microprep
tm
试剂盒(兹莫研究公司(zymo research))、rneasy微试剂盒(凯杰公司(qiagen))以及reliaprep
tm
rna组织小量制备系统(普洛麦格公司(promega))。
90.在一些实施例中,用于扩增一个或多个靶序列的输入gdna的量可以为约0.1ng到约10微克。在一些实施例中,扩增一个或多个靶序列所需的gdna的量可为约0.5ng到约5微克。在一些实施例中,扩增一个或多个靶序列所需的gdna的量可为约1ng到约1微克或约10ng到约1微克。在一些实施例中,扩增一个或多个免疫组库靶序列所需的gdna的量为约10ng到约500ng、约25ng到约400ng或约50ng到约200ng。在一些实施例中,扩增一个或多个靶序列所需的gdna的量为约0.5ng、约1ng、约5ng、约10ng、约20ng、约50ng、约100ng或约200ng。在一些实施例中,扩增一个或多个免疫组库靶序列所需的gdna的量为约1微克、约2微克、约3微克、约4.0微克或约5微克。
91.在一些实施例中,使用常规方法从生物样品获得gdna。用于从生物样品提取或分离核酸的方法和试剂为众所周知的并且可商购获得。在一些实施例中,从生物样品提取dna通过本文所述的任何方法或所属领域技术人员另外已知的方法进行,例如涉及蛋白酶k组织消化和基于醇的核酸沉淀的方法、用rnase处理以消化污染的rna、和使用硅胶
‑
膜技术的dna纯化,或其任何组合。用于从生物样品中提取dna的示例性方法使用可商购的试剂盒,包含针对ion ampliseq
tm
的ffpe dna试剂盒、magmax
tm ffpe dna/rna超试剂盒、tri reagent
tm
(英杰公司)、purelink
tm
基因组dna小量试剂盒(英杰公司)、recoverall
tm
总核酸分离试剂盒(英杰公司)、magmax
tm dna多样品试剂盒(英杰公司)以及来自生物链研究所公司(biochain institute inc.)(例如,ffpe组织dna提取试剂盒、基因组dna提取试剂盒、血液和血清dna分离试剂盒)的dna提取试剂盒。
92.本文所用的样品或生物样品是指来自含有或可能含有与免疫系统相关的细胞的个体的组合物。示例性生物样品包含但不限于组织(例如,淋巴结、器官组织、骨髓)、全血、滑液、脑脊液、肿瘤活检和其它含有细胞的临床标本。样品可以包含正常细胞和/或患病细胞,并且为细针抽吸、细针活检、芯样品或其它样品。在一些实施例中,生物样品可以包括造血细胞、外周血单核细胞(pbmc)、t细胞、b细胞、肿瘤浸润淋巴细胞(“til”)或其它淋巴细胞。在一些实施例中,样品可以是新鲜的(例如,未保存的)、冷冻的或福尔马林固定石蜡包埋的组织(ffpe)。一些样品包括癌细胞,如癌、黑素瘤、肉瘤、淋巴瘤、骨髓瘤、白血病等,并
且癌细胞可以是循环肿瘤细胞。在一些实施例中,生物样品包括如例如在血液或血浆中发现的cfdna。
93.生物样品可以是组织或细胞类型的混合物、富集至少一种特定类别或细胞类型的细胞制剂或特定类型或表型的分离的细胞群。在分析之前,可通过离心、淘洗、密度梯度分离、单采血液成分术、亲和选择、淘选、facs、用hypaque离心等分离样品。用于分选、富集和分离特定细胞类型的方法是众所周知的,并且可以由普通技术人员容易地执行。在一些实施例中,样品可以是富集b细胞的制剂。
94.在一些实施例中,所提供的方法和系统包含用于分析免疫组库受体cdna或gdna序列数据和用于从测定的免疫受体序列中鉴别和/或去除一个或多个pcr或测序衍生的错误的方法。
95.在一些实施例中,纠错策略包含以下步骤:
96.1)将经过测序的重排与可变、多样性和连接/恒定基因的参考数据库比对,以产生查询序列/参考序列对。许多比对程序可用于此目的,包含例如igblast,一个来自ncbi的可自由使用的工具,以及定制计算机脚本。
97.2)考虑到用于测序的流程顺序,将参考和查询序列相互重新比对。流程顺序提供允许人们鉴别和校正某些类型的错误比对的信息。
98.3)通过其特征序列基序鉴别cdr3区的边界。
99.4)在对应于可变基因和连接/恒定基因(不包括cdr3区)的重排的比对部分,在查询中相对于参考标识插入缺失并改变错配查询碱基位置以使其与参考一致。
100.5)对于cdr3区,如果cdr3长度不是三的倍数(表示插入缺失错误):
101.(a)基于phred得分(表示为e),在cdr3中搜索具有最高概率的含有序列错误的均聚物延伸。
102.(b)基于phred得分(表示为t)获得整个cdr3区的错误概率
103.(c)如果e/t大于确定的阈值,则通过将均聚物的长度增加或减少一个碱基来编辑均聚物,使得cdr3核苷酸长度是三的倍数。
104.(d)作为步骤a
‑
c的替代方案,在cdr3中搜索最长的均聚物,并且如果均聚物的长度高于限定的阈值,则通过将均聚物的长度增加或减少一个碱基来编辑均聚物,使得cdr3核苷酸长度是三的倍数。
105.在一些实施例中,提供了用于在对pcr和测序错误来说是稳健的组库数据中鉴别b细胞和/或t细胞克隆的方法。因此,以下描述了可以用于此类方法以便以对pcr和测序错误来说是稳健的方式鉴别b细胞和/或t细胞克隆的步骤。表1是用于从免疫受体测序数据中鉴别和去除pcr或测序衍生的错误的示例性工作流程图。此工作流程的示例性部分和实施例也在图1
‑
2中表示。
106.表1:序列校正工作流程
[0107][0108]
对于一组源自mrna或gdna的tcr或bcr序列,其中1)每个序列已经被注释为生产性重排,无论是天然的还是在纠错后,如先前所述,和2)每个序列具有鉴别的v基因和cdr3核苷酸区,在一些实施例中,方法包含以下:
[0109]
1)鉴别并排除嵌合序列。对于数据集中存在的每个独特的cdr3核苷酸序列,计算具有该cdr3核苷酸序列和任何可能的v基因的读段的数量。构成该cdr3核苷酸序列总读段少于10%的任何v基因
‑
cdr3组合被标记为嵌合体并从下游分析中消除。例如,对于具有相同cdr3核苷酸序列的下述序列,例如,具有与cdr3nt序列aattggt配对的trbv3和trbv6的序列将被标记为嵌合。
[0110]
v基因cdr3nt读段计数trbv2aattggt1000trbv3aattggt10trbv6aattggt3
[0111]
2)鉴别并排除含有简单插入缺失错误的序列。对于数据集中的每次读段,获得该读段的cdr3序列的均聚物
‑
塌陷表示。对于具有相同v基因和塌陷
‑
cdr3组合的每组读段,计算每个未塌陷的cdr3核苷酸序列的出现次数。构成该读段集的总读段的<10%的任何未塌陷的cdr3序列被标记为具有简单的均聚物错误。作为实例,呈现三种不同的v基因
‑
cdr3核苷酸序列,其在cdr3核苷酸序列的均聚物塌缩后是相同的。两个较不频繁的v基因
‑
cdr3组合构成读段集的总读段的<10%,并且将被标记为包含简单的插入缺失错误。例如:
[0112][0113][0114]
3)鉴别并排除单例读段。对于数据集中的每次读段,记录在数据集中找到精确读段序列的次数。在数据集中仅出现一次的读段将被标记为单例读段。
[0115]
4)鉴别并排除截断的读段。对于数据集中的每次读段,确定读段是否具有注释的v基因fr1、cdr1、fr2、cdr2和fr3区,如通过对igblast参考v基因集的读段的igblast比对所指示的。如果基于用于扩增的特定v基因引物预期区,则将不具有上述区的读段标记为截短的。
[0116]
5)鉴别并排除缺乏双向支持的重排。对于数据集中的每次读段,获得读段的v基因
和cdr3序列以及读段的链方向(正或负链)。对于数据集中的每个v基因
‑
cdr3组合,计算具有该v基因
‑
cdr3nt组合的正链和负链读段的数目。仅存在于一个方向的读段中的v基因
‑
cdr3nt组合将被认为是假的。具有假v基因
‑
cdr3nt组合的所有读段将被标记为缺乏双向支持。
[0117]
6)对于未标记的基因,基于cdr3核苷酸相似性进行逐步聚类。基于读段的v基因同一性将序列分成组,排除等位基因信息(v基因组)。对于每组:
[0118]
a.使用cd
‑
hit
‑
est和以下参数将每组中的读段布置到聚类中:
[0119]
cd
‑
hit
‑
est
‑
i vgene_groups.fa
‑
o clustered_vgene_groups.cdhit
‑
t 24
‑
d 0
‑
m 100000
‑
b 0
‑
r 0
‑
g 1
‑
s 0
‑
u 2
‑
ul.05
‑
n 10
–
l 7。(可免费获得的软件程序cd
‑
hit
‑
est将核苷酸数据集聚类为满足用户定义的相似性阈值的聚类)。(有关cd
‑
hit
‑
est的代码和说明,参见https://github.com/weizhongli/cdhit/wiki/3.
‑
user%27s
‑
guide#cdhitest)。
[0120]
其中vgene_groups.fa是具有同一v基因的序列的cdr3核苷酸区的fasta格式文件,并且clustered_vgene_groups.cdhit是含有细分序列的输出。
[0121]
b.为聚类中的每个序列分配相同的克隆id,用于表示该子组的成员被认为代表相同的t细胞克隆或b细胞克隆。
[0122]
c.选择每个聚类的代表性序列,使得代表性序列为出现最多次数的序列,或在平局的情况下,为随机选择的。
[0123]
d.将聚类中的所有其它读段合并到代表性序列中,使得代表性序列的读段数根据合并序列的读段数增加。
[0124]
e.基于汉明距离将在v基因组内的代表性序列相互比较。如果代表性序列与>50倍更丰富的代表性序列在汉明距离1内,则将所述序列合并到更常见的代表性序列中。如果代表性序列与>10000倍更丰富的代表性序列在汉明距离2内,则将所述序列合并到更常见的代表性序列中。
[0125]
f.鉴别复合序列错误。对每个v基因组内的代表性序列进行均聚物
‑
塌缩,然后使用莱文斯坦距离相互比较。如果代表性序列与>50倍更丰富的代表性序列在1莱文斯坦距离内,则将所述序列合并到更常见的代表性序列中。
[0126]
g.鉴别cdr3错误注释错误。对每个v基因组内的代表性序列进行均聚物
‑
塌缩,然后对每个均聚物
‑
塌缩的序列执行成对比较。对于每对序列,测定一个序列是否是另一个序列的子集。如果是,如果更丰富的序列为>500倍更丰富,则将较不丰富的序列合并到更丰富的序列中。
[0127]
7)向用户报告聚类代表。
[0128]
在一些实施例中,以上工作流程的步骤6基于v基因同一性(不包含等位基因信息)和cdr3核苷酸长度将重排序列分成组。在其它实施例中,j基因同一性和/或同种型同一性也用作分组标准的一部分。因此,在一些实施例中,上述工作流程的步骤6包含以下步骤:
[0129]
a.使用cd
‑
hit
‑
est和以下参数将每组中的读段布置到聚类中:
[0130]
cd
‑
hit
‑
est
‑
i vgene_groups.fa
‑
o clustered_vgene_groups.cdhit
‑
t 24
‑
l 9
‑
d 0
‑
m 100000
‑
b 0
‑
r 0
‑
g 1
‑
s 15
‑
u 2
‑
ul.05
–
n 9。
[0131]
其中vgene_groups.fa是vdj重排的已测序部分的fasta格式文件。
[0132]
在一些实施例中,vdj的完整序列被考虑用于聚类,因为体细胞超突变可以发生在
整个vdj区。
[0133]
b.为聚类中的每个序列分配相同的克隆id,所述克隆id用于表示子组的成员被认为代表相同的t细胞克隆或b细胞克隆。
[0134]
c.为每个聚类选择代表性序列,使得代表性序列是出现最多次数的序列,或在平局的情况下是随机选择的。
[0135]
d.将聚类中的所有其它读段合并到代表性序列中,使得根据合并序列的读段数增加代表性序列的读段数。
[0136]
e.基于汉明距离将在v基因组内的代表性序列相互比较。如果代表性序列与>50倍更丰富的代表性序列在汉明距离1内,则将所述序列合并到更常见的代表性序列中。如果代表性序列与>10000倍更丰富的代表性序列在汉明距离2内,则将所述序列合并到更常见的代表性序列中。在一些实施例中,>50/3和>10000/3的倍数阈值等用于分别合并汉明距离为1或2的序列。当比较整个vdj区的序列而不是仅cdr3区的序列时,降低倍数阈值可能有用,因为较长的序列更有可能积累扩增和/或测序错误。
[0137]
f.鉴别复合序列错误。对每个v基因组内的代表性序列进行均聚物
‑
塌缩,然后使用莱文斯坦距离相互比较。如果代表性序列与>50倍更丰富的代表性序列在1莱文斯坦距离内,则将所述序列合并到更常见的代表性序列中。
[0138]
g.鉴别cdr3误注释错误。对每个v基因组内的代表性序列进行均聚物
‑
塌缩,然后对每个均聚物
‑
塌缩的序列执行成对比较。对于每对序列,测定一个序列是否是另一个序列的子集。如果是,如果更丰富的序列为>500倍更丰富,则将较不丰富的序列合并到更丰富的序列中。
[0139]
在一些实施例中,所提供的工作流程不限于在各个步骤中列出的频率比率阈值,并且其它频率比率阈值可以代替以上包含的代表性频率比率阈值。频率比率是指较常见的代表性序列的丰度值与较不常见的代表性序列的丰度值之比。频率比率阈值给出了将较不常见的代表性序列合并到较常见的代表性序列中的阈值。例如,在一些实施例中,基于汉明距离将在v基因组内的代表性序列相互比较可以使用除了以上步骤(e)中列出的那些频率比率阈值之外的频率比率。例如但不限于,如果一个代表性序列与一个代表性序列在汉明距离2内,则可以使用1000、5000、20,000等频率比率阈值。例如但不限于,如果一个代表性序列与一个代表性序列在汉明距离1内,则可以使用20、100、200等频率比率阈值。所提供的频率比率阈值代表将类似对的更丰富的序列标记为正确序列的一般过程。
[0140]
类似地,当对在工作流程中其它步骤(例如步骤(1)、步骤(2)、步骤(6f)和步骤(6g))的两个序列的频率进行比较时,可以使用除了上述步骤中列出的频率比率阈值之外的频率比率。
[0141]
本文所用的术语“均聚物
‑
塌缩的序列”旨在表示其中重复碱基塌缩成单个碱基代表的序列。作为实例,对于非塌缩序列aaaatttttatccccccccggg(seq id no:603),均聚物
‑
塌缩的序列为atatcg。
[0142]
本文所用的术语“克隆”、“克隆型”、“谱系”或“重排”旨在描述用于如tcr或bcr等免疫受体的独特的v基因核苷酸组合。例如,独特的v基因
‑
cdr3核苷酸组合。
[0143]
本文所用的术语“生产性读段”是指不具有终止密码子并具有框内可变基因片段和连接基因片段的tcr或bcr序列读段。在编码多肽时,生产性读段在生物学上是合理的。
[0144]
如本文所用,“嵌合体”或“嵌合序列”是指在靶扩增例如pcr期间由模板转换产生的人工序列。嵌合体通常作为移植到不相关的v基因上的cdr3序列存在,产生与数据集内的多个v基因相关的cdr3序列。嵌合序列通常远不如数据集中的真实序列丰富。
[0145]
如本文所用,术语“插入缺失”是指核酸序列中一个或多个核苷酸碱基的插入和/或缺失。在核酸序列的编码区中,除非插入缺失的长度为3的倍数,否则当翻译序列时它将产生移码。如本文所用,“简单的插入缺失错误”为不改变序列的均聚物
‑
塌缩表示的错误。如本文所用,“复合插入缺失错误”为改变序列的均聚物
‑
塌缩表示的插入缺失测序错误,并且包含但不限于消除均聚物、将均聚物插入序列或产生阅读障碍型错误的错误。
[0146]
如本文所用,“单例读段”是指其缺失校正的序列在数据集中仅出现一次的序列读段。通常,单列读段富集含有pcr或测序错误的读段。
[0147]
如本文所用,“截短的读段”是指缺失注释的v基因区的免疫受体序列读段。例如,截短的读段包含但不限于缺失注释的tcr或bcr v基因fr1、cdr1、fr2、cdr2或fr3区的序列读段。由于质量修整,此类读段通常缺少v基因序列的一部分。如果截断导致错误鉴别v基因,截断的读段可能会产生伪影。
[0148]
在鉴别的v基因
‑
cdr3序列(克隆型)的背景下,“双向支持”表示在至少一个映射到正链的读段中(从v基因进行到恒定基因)和至少一个映射到负链的读段(从恒定基因进行到v基因)中发现特定的v基因
‑
cdr3序列。系统性测序错误通常导致鉴别具有单向支持的v基因
‑
cdr3序列。
[0149]
对于已经根据预定的序列相似性阈值考虑由于pcr或测序误差的变化进行了分组的一组序列,“聚类代表”是被选择为最可能无错误的序列。这通常为最丰富的序列。
[0150]
如本文所用,“igblast注释错误”是指罕见事件,其中cdr3的边界被鉴别为处于不正确的相邻位置。这些事件通常对cdr3核苷酸序列的5'或3'端添加三个碱基。
[0151]
对于两个等长的序列,“汉明距离”是对应碱基或氨基酸不同的位置数。对于任何两个序列,“莱文斯坦距离”或“编辑距离”是使一个核苷酸或氨基酸序列成为另一个核苷酸或氨基酸序列所需的单个碱基或氨基酸编辑的数量。
[0152]
在其中针对j基因的引物用于扩增免疫受体序列的一些实施例(例如用针对v基因fr3区的引物和针对j基因的引物进行的多重扩增)中,从测定衍生的原始序列读段在任何下游分析之前进行j基因序列推断过程。在该过程中,询问原始读取序列的开始和结束是否存在10
‑
30个核苷酸的特征序列,其对应于在测序之前在用j引物扩增以及扩增子末端的任何后续操作或处理(例如,消化)后预期存在的j基因序列的部分。特征核苷酸序列允许推断j引物的序列,以及由于每个j基因的序列已知而被靶向的j基因的剩余部分。为了完成j基因序列推断过程,将推断的j基因序列添加到原始读段中以产生延伸的读段,然后跨越整个j基因。然后扩展的读段包含整个j基因序列、cdr3区的完整序列和至少一部分v基因序列,其将在下游分析后报告。扩展读段中的v基因序列的部分将取决于用于多重扩增的针对v基因的引物,例如fr3、fr2或针对fr1的引物。
[0153]
使用v基因fr3和j基因引物扩增表达的免疫受体序列或重排的免疫受体gdna序列产生最小长度的扩增子(例如,长度为约60
‑
100或约80个核苷酸),同时仍产生允许报告整个cdr3区的数据。由于预期很短的扩增子长度,在序列分析工作流程期间,长度为<100个核苷酸的扩增子的读段不作为低质量和/或脱靶产物而被消除。然而,在原始读段中明确搜索
预期的j基因序列允许消除从通过j基因引物进行的脱靶扩增衍生的扩增子。另外,这种短扩增子长度改善了对高度降解的模板材料(例如源自ffpe或cfdna样品的模板材料)进行测定的性能。
[0154]
在一些实施例中,所提供的方法包括对免疫受体文库进行测序并使获得的序列数据经受错误鉴别和校正过程以产生拯救的生产性读段,以及鉴别生产性序列读段和拯救的生产性序列读段。在一些实施例中,所提供的方法包括对免疫受体文库进行测序并使获得的序列数据集经受错误鉴别和校正过程,鉴别生产性序列读段和拯救的生产性序列读段,以及通过克隆型对序列读段进行分组以鉴别文库中的免疫受体克隆型。
[0155]
在一些实施例中,所提供的方法包括对重排的免疫受体dna文库进行测序并对于v基因部分,使获得的序列数据经受错误鉴别和校正过程以产生拯救的生产性读段,以及鉴别生产性序列读段、拯救的生产性序列读段和非生产性序列读段。在一些实施例中,提供的方法包括测序重排的免疫受体dna文库并且对于v基因部分对获得的序列数据集进行错误鉴别和校正过程,鉴别生产性、拯救的生产性和非生产性的序列读段,并通过克隆型对序列读段进行分组以鉴别在文库中的免疫受体克隆型。在一些实施例中,单独报告重排的免疫受体dna的生产性序列读段和非生产性序列读段两者。
[0156]
在一些实施例中,所提供的错误鉴别和校正工作流程用于鉴别和解析导致序列读段被鉴别为来自非生产性重排的pcr或测序衍生的错误。在一些实施例中,所提供的错误鉴别和校正工作流程应用于从测序平台产生的免疫受体序列数据,其中在产生序列数据时发生插入缺失或其它引起移码的错误。
[0157]
在一些实施例中,提供的错误鉴别和校正工作流程应用于由ion torrent测序平台生成的序列数据。在一些实施例中,所提供的错误鉴别和校正工作流程应用于由罗氏454生命科学(roche 454life sciences)测序平台、太平洋生物科学公司测序平台和牛津纳米孔(oxford nanopore)测序平台产生的序列数据。
[0158]
在一些实施例中,bcr组库分析工作流程包含鉴别样品中的克隆谱系的另外的最后步骤。克隆谱系代表源自共同的vdj重排但由于体细胞超突变和/或类别转换重组而不同的一组b细胞克隆(例如,被鉴别为具有独特的vdj序列)。通常假设克隆谱系的成员可以比不同克隆谱系的成员更可能靶向同一抗原。
[0159]
在一些实施例中,克隆谱系鉴别的过程包含使用鉴别(例如,如本文所述)的一组bcr克隆(例如,igh克隆)以执行以下:
[0160]
1.将克隆序列分成几组,其中组成员共有同一可变基因(不包含等位基因信息),同一cdr3核苷酸长度和同一连接基因(不包含等位基因信息)。在一些实施例中,可以省略上述j基因标准。
[0161]
2.基于克隆序列的cdr3核苷酸相似性,将每组中的克隆序列排列成聚类。cdr3的核苷酸相似性的阈值为约0.70到约0.99。在一些实施例中,cdr3的核苷酸相似性的阈值介于约0.80与约0.99之间。在一些实施例中,cdr3的核苷酸相似性的阈值介于约0.80与约0.90之间。在某些实施例中,cdr3的核苷酸相似性的阈值为约0.80、0.81、0.82、0.83、0.84、0.85、0.86、0.87、0.88、0.89、0.90、0.91、0.92、0.93、0.94、0.95、0.96、0.97、0.98或0.99。
[0162]
a.在一些实施例中,使用如下所述的cd
‑
hit
‑
est执行聚类:
[0163]
cd
‑
hit
‑
est
‑
i vgene_groups.fa
‑
o clustered_vgene_groups.cdhit
‑
t 24
‑
l 9
‑
d 0
‑
m 100000
‑
b 0
‑
r 0
‑
g 1
‑
s 0
‑
c.85
–
n 5,其中vgene_groups.fa由一组内每个克隆的一组cdr3核苷酸序列组成。同一聚类内的克隆被视为同一克隆谱系的成员。
[0164]
b.在一些情况下,体细胞超突变可能足够广泛,以至于所描述的聚类标准可能不会对所有克隆谱系成员进行分组。对于此类情况,在一些实施例中,执行另外的步骤以合并在(a)中鉴别的聚类。另外的步骤由以下组成:在克隆谱系之间的可变基因中搜索共有的体细胞超突变衍生的突变的实例,然后如果共有突变的级分和/或数量高于某个阈值,则合并克隆谱系。如上所述,通过将可变基因序列与imgt数据库中最匹配的可变基因序列进行比较来鉴别可变基因突变。在一些实施例中,共有突变数量的阈值为2或更大。在一些实施例中,共有突变数量的阈值为3或更大。在其它实施例中,共有突变数量的阈值为4、5、6、7、8、9、10或更大。在一些实施例中,共有突变的级分为约0.15到约0.95。在一些实施例中,共有突变的级分为约0.75或约0.85。在其它实施例中,共有突变的级分为约0.15、0.2、0.25、0.3、0.35、0.4、0.5、0.6、0.7、0.8、0.9或0.95。
[0165]
在一些情况下,可以鉴别出imgt数据库中未表达的可变基因等位基因。在此类情况下,与imgt数据库进行的比对将指示并非源自体细胞超突变的不匹配。为了避免由此类未注释的基因变体引起的噪声,在一些实施例中,在(b)之前执行初始步骤,其中鉴别样品中的所有推定的新颖可变基因等位基因,注意与参考不同的每个位置。在一些实施例中,然后在(b)中描述的分析中,此类位置不在考虑范围之内。例如,gadala
‑
maria等人.(2015)《美国国家科学院院刊(proc.natl.acad.sci.usa)》112:e862
‑
e870和pct申请出版物第wo2018/136562号已经描述用于从免疫组库测序数据中鉴别新颖等位基因的方法。
[0166]
在这种克隆谱系鉴别过程结束时,已经将每个克隆分配到克隆谱系。可以使用克隆谱系作为分析单位来计算bcr组库的特征,如多样性、均匀度和收敛。在一些实施例中,计算并向用户报告克隆谱系特征,如属于谱系的克隆数、那些克隆的同种型、谱系中克隆的最大和最小频率、谱系中最大和最小可变基因体细胞超突变等。
[0167]
在不存在体细胞超突变的情况下,可以以氨基酸序列相同或功能相同但核苷酸序列不同的克隆的频率的形式计算bcr收敛。这些代表独立进行vdj重组并通常假定已响应于常见抗原而增殖的克隆。但是,体细胞超突变可以产生不代表独立进行vdj重组的b细胞的不同的vdj序列。为了解决这种情况,使用了收敛的定义,所述定义考虑了克隆谱系鉴别。出于此目的,“bcr收敛”被定义为b细胞克隆的频率,所述b细胞克隆是如上所述的不同克隆谱系的成员,但氨基酸序列类似或相同。在一些实施例中,如果两个igh重排被分配到单独的克隆谱系但是具有相同的可变基因(不包含等位基因信息)和相同或类似的cdr3氨基酸序列,则所述重排被认为是收敛的。在测序覆盖igh链的所有三个cdr结构域的其它实施例中,如果两个igh重排被分配到单独的克隆谱系但是具有相同的可变基因(不包含等位基因信息)和相同或类似的cdr1、2和3氨基酸序列,则所述重排可以被认为是收敛的。在一些实施例中,类似的cdr氨基酸序列在汉明或莱文斯坦编辑距离1内。在其它实施例中,类似的cdr氨基酸序列在汉明或莱文斯坦编辑距离2内。
[0168]
因此,在一些实施例中,通过搜索具有相同的可变基因和在汉明或莱文斯坦编辑距离1或2内的cdr氨基酸序列的bcr克隆来鉴别功能上等效的b细胞。在一些实施例中,程序cd
‑
hit可以用于鉴别具有类似但功能上等效的氨基酸序列的克隆。(有关程序cd
‑
hit的代码和信息,参见https://github.com/weizhongli/cdhit/wiki/3.
‑
user%27s
‑
guide)在一
些实施例中,使用以下命令运行cd
‑
hit:
[0169]
cd
‑
hit
‑
i vgene_groups.fa
‑
o clustered_vgene_groups.cdhit
‑
t 24
‑
l 5
‑
d 0
‑
m 100000
‑
b 0
‑
g 1
‑
s 1
‑
u 1
–
n 5,其中vgene_groups.fa由具有相同可变基因的克隆的一组cdr3氨基酸序列组成。同一聚类内的克隆被认为是功能上等效的。
[0170]
在一些实施例中,参数
‑
s的值可以为0、1、2或3。在一些实施例中,参数
‑
u的值可以为0、1、2或3。
[0171]
在一些实施例中,vgene_groups.fa由具有相同可变基因的克隆的一组cdr1、2和3氨基酸序列组成。在一些实施例中,vgene_groups.fa由具有相同可变基因和相同cdr3长度两方面的一组克隆组成。
[0172]
在一些实施例中,所提供的序列分析工作流程包含下采样分析。对于免疫组库测序和后续分析,使用下采样分析可以帮助例如消除由于跨测定的测序深度的差异引起的可变性。例如,用于与rna或cdna测序和分析工作流程一起使用的示例性下采样分析对数据应用以下程序:a)从生产性+拯救的生产性读段的总组开始,除去序列读段随机直到若干读段深度之一;以及b)使用此读段子集执行所有下游计算(例如,次级组库特征的克隆型和计算,所述次级组库特征包含但不限于均匀度、收敛、多样性、检测到的克隆数和身份以及克隆谱系)。
[0173]
在一些实施例中,下采样分析鉴别将特定样品测序到饱和的点,例如另外的读段不鉴别另外的克隆或谱系或将另外的多样性添加到检测到的组库中的点。在一些实施例中,下采样允许在使用类似样品类型进行的测定间或之间对测序深度进行精化或多重化。
[0174]
在一些实施例中,通过所提供的测定方法和组合物检测的一组可变基因等位基因可以用于重新鉴别人类群体内的单倍型组。在特定实施例中,所提供的包含使用多个v基因特异性引物和至少一个c基因特异性引物以扩增igh cdr1、2和3核苷酸序列的测定方法和组合物可以用于鉴别受试者的bcr组库的igh单倍型。例如,在一些实施例中,所提供的方法和组合物可以用于鉴别受试者的bcr组库的igh单倍型,所述方法和组合物使用包括选自表3的多个v基因fr1引物和选自表6
‑
10的至少一个c基因引物的至少一组引物。用于鉴别tcr单倍型组的方法于2019年3月22日提交的pct申请第pct/us2019/023731号中进行了描述,所述申请的全部内容通过引用并入本文,并且可以类似地与本文提供的方法和组合物结合使用以鉴别igh单倍型组。在一些实施例中,通过对igh cdr1、2和3个核苷酸序列进行扩增和测序而检测的一组可变基因等位基因可以用于将样品分配到若干先前存在的单倍型组之一,作为用于预测在免疫疗法之后的自身免疫性疾病或不良事件的风险的较大程序的一部分。在用于预测在免疫疗法之后的自身免疫性疾病或不良事件的风险的程序中,用于将样品分配到单倍型组的方法也在于2019年3月22日提交并通过引用并入本文中的pct申请第pct/us2019/023731号中描述,并且类似地可以与本文提供的方法和组合物结合使用以将样品分配到igh单倍型组,例如以预测此类风险。在一些实施例中,使用所提供的测定方法和组合物获得的igh cdr1、2、3序列数据可以用于推断阶段性igh基因座单倍型(例如,kidd等人.(2012)《免疫学杂志(j.immunol.)》188(3):1333
‑
1340)。
[0175]
在一些实施例中,所提供的方法包括制备和形成多个免疫受体特异性扩增子。在一些实施例中,所述方法包括:将多个v基因特异性引物和至少一个c基因特异性引物与cdna分子杂交;延伸引物对的第一引物(例如,v基因特异性引物);使来自cdna分子的延伸
的第一引物变性;将引物对的第二引物(例如,c基因特异性引物)与延伸的第一引物产物杂交并延伸第二引物;消化靶特异性引物对以产生多个靶扩增子。在其它实施例中,所述方法包括:将多个v基因基因特异性引物和多个j基因特异性引物与cdna分子杂交;延伸引物对的第一引物(例如,v基因特异性引物);使来自cdna分子的延伸的第一引物变性;将引物对的第二引物(例如,j基因特异性引物)与延伸的第一引物产物杂交并延伸第二引物;消化靶特异性引物对以产生多个靶扩增子。在一些实施例中,在执行切口平移反应之前将衔接子接合到靶扩增子的末端,以生成适于核酸测序的多个靶扩增子。在一些实施例中,接合的衔接子中的至少一个衔接子包含至少一个条形码序列。在一些实施例中,接合到靶扩增子的末端的每个衔接子包含条形码序列。在一些实施例中,可以使用桥式扩增、乳液pcr或等温扩增来扩增所述一个或多个靶扩增子,以产生适于核酸测序的多个克隆模板。
[0176]
在一些实施例中,所提供的方法包括制备和形成多个免疫受体特异性扩增子。在一些实施例中,方法包括将多个v基因基因特异性引物和多个j基因特异性引物与gdna分子杂交,延伸引物对的第一引物(例如,v基因特异性引物),使来自gdna分子的延伸的第一引物变性,将引物对的第二引物(例如,j基因特异性引物)与延伸的第一引物产物杂交,并延伸第二引物,消化靶特异性引物对以生成多个靶扩增子。在一些实施例中,在执行切口平移反应之前将衔接子接合到靶扩增子的末端,以生成适于核酸测序的多个靶扩增子。在一些实施例中,接合的衔接子中的至少一个衔接子包含至少一个条形码序列。在一些实施例中,接合到靶扩增子的末端的每个衔接子包含条形码序列。在一些实施例中,可以使用桥式扩增或乳液pcr对所述一个或多个靶扩增子进行扩增以产生适于核酸测序的多个克隆模板。
[0177]
在一些实施例中,本公开提供了用于对靶扩增子进行测序并处理序列数据以鉴别在cdna所源自的生物样品中表达的生产性免疫受体重排的方法。在一些实施例中,本公开提供了用于对靶扩增子进行测序并处理序列数据以鉴别来自生物样品的生产性免疫受体基因重排gdna的方法。在其中使用针对j基因的引物扩增表达的免疫受体序列或重排的免疫受体gdna序列的实施例中,处理序列数据包含用于扩增的j基因引物的核苷酸序列以及所靶向的j基因的剩余部分,如本文所描述。在一些实施例中,处理序列数据包含执行所提供的错误鉴别和校正步骤以产生拯救的生产性序列。在一些实施例中,使用所提供的错误鉴别和校正工作流程可以导致生产性读段和拯救的生产性读段的组合为免疫受体cdna或gdna样品的测序读段的至少50%。在一些实施例中,使用所提供的错误鉴别和校正工作流程可以导致生产性读段和拯救的生产性读段的组合为免疫受体cdna或gdna样品的测序读段的至少60%、至少70%、至少80%、至少90%或至少95%。在一些实施例中,使用所提供的错误鉴别和校正工作流程可以导致生产性读段和拯救的生产性读段的组合为免疫受体cdna或gdna样品的测序读段的约50
‑
60%、约60
‑
70%、约70
‑
80%、约80
‑
90%、约50
‑
80%、或约60
‑
90%。在一些实施例中,使用所提供的错误鉴别和校正工作流程可以导致生产性读段和拯救的生产性读段的组合为免疫受体cdna或gdna样品的测序读段的约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%。
[0178]
在特定样品的情况下,所提供的错误鉴别和校正工作流程可以导致在使用特定样品时,生产性读段和拯救的生产性读段的组合小于免疫受体cdna或gdna样品的测序读段的50%。此类样品包含例如rna或gdna高度降解的那些样品(如ffpe样品和cfdna样品),以及靶免疫细胞的数量非常低的那些样品,例如具有非常低的b细胞计数的样品或来自经历严
重的白细胞减少症的受试者的样品。因此,在一些实施例中,使用所提供的错误鉴别和校正工作流程可以导致生产性读段和拯救的生产性读段的组合为免疫受体cdna或gdna样品的测序读段的约30
‑
50%、约40
‑
50%、约30
‑
40%、约40
‑
60%、至少30%或至少40%。
[0179]
在某些实施例中,本发明的方法包括使用靶免疫受体引物组,其中引物针对相同靶免疫受体基因例如bcr(免疫球蛋白)基因和tcr基因的序列。在一些实施例中,免疫受体是选自由以下组成的组的抗体受体:重链α、重链δ、重链ε、重链γ、重链μ、轻链κ和轻链λ。在一些实施例中,t细胞受体是选自由以下组成的组的t细胞受体:tcrα、tcrβ、tcrγ和tcrδ。在一些实施例中,本发明的方法包括使用靶免疫受体引物组,其中引物组中的至少一个引物组针对bcr的序列且另一个引物组针对tcr的序列,并且来自样品的bcr靶核酸和tcr靶核酸两者在单一多重扩增反应中扩增。
[0180]
在某些实施例中,提供了用于扩增样品中的bcr组库的表达核酸序列的方法,所述方法包括使用以下的至少一组执行多重扩增反应以扩增具有恒定部分和可变部分的bcr核酸模板分子:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)一个或多个c基因引物,所述一个或多个c基因引物针对bcr编码序列的相应靶恒定基因的至少一部分,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,并且其中使用每组执行扩增产生代表样品中相应免疫受体的整个组库的扩增子;由此产生包括bcr的组库的免疫受体扩增子。在特定实施例中,i)的所述一个或多个多个v基因引物针对高于框架区的约80个核苷酸部分的序列。在更特定实施例中,i)的所述一个或多个多个v基因引物针对高于框架区的约50个核苷酸部分的序列。
[0181]
在某些实施例中,提供了用于扩增样品中的免疫受体组库的表达核酸序列的方法,所述方法包括使用以下的至少一组执行多重扩增反应以扩增具有恒定部分和可变部分的bcr核酸模板分子:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区1(fr1)的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)一个或多个c基因引物,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,并且其中使用每组执行扩增产生代表样品中相应免疫受体的整个组库的扩增子;由此产生包括bcr的组库的免疫受体扩增子。在特定实施例中,i)的所述一个或多个多个v基因引物针对高于框架区的约80个核苷酸部分的序列。在更特定实施例中,i)的所述一个或多个多个v基因引物针对高于框架区的约50个核苷酸部分的序列。在一些实施例中,i)的所述一个或多个多个v基因引物与模板分子的框架区1的至少一部分退火。在某些实施例中,ii)的一个或多个c基因引物包括与模板分子的c基因部分的至少一部分退火的至少两个引物。在一些实施例中,ii)的一个或多个c基因引物包括至少两个引物,所述至少两个引物中的每个引物与iga、igd、igg、igm或ige模板分子的c基因的至少一部分退火。在一些实施例中,ii)的一个或多个c基因引物包括至少一个引物,所述至少一个引物分别针对iga、igd、igg、igm和ige模板分子中的每个模板分子的c基因的一部分。在特定实施例中,至少一组产生的扩增子包含bcr表达序列的互补决定区cdr1、cdr2和cdr3。在一些实施例中,扩增子长度为约300到约600个核苷酸或长度为至少约350到约500个核苷酸。在一些实施例中,方法中使用的核酸模板是通过从逆转录从生物样品中提取的核酸分子而产生的cdna。
[0182]
在某些实施例中,提供了用于在样品中提供bcr组库的序列的方法,所述方法包括使用至少一组引物执行多重扩增反应以扩增具有恒定部分和可变部分的bcr核酸模板分子,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区1(fr1)的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)一个或多个c基因引物,所述一个或多个c基因引物针对bcr编码序列的一个或多个相应靶c基因的至少一部分,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,由此产生bcr扩增子分子。然后执行对所得bcr扩增子分子进行的测序,并且由此测定的bcr扩增子分子的序列在样品中提供bcr组库的序列。在特定实施例中,测定bcr扩增子分子的序列包含:获得初始序列读段;将初始序列读段与参考序列比对并鉴别生产性读段;校正一个或多个插入缺失错误以产生拯救的生产性序列读段;以及测定所得bcr分子的序列。在特定实施例中,生产性读段和拯救的生产性读段的组合是bcr的测序读段的至少50%、至少60%、至少70%或至少75%。在另外的实施例中,所述方法进一步包括序列读段聚类和bcr克隆型报告。在一些实施例中,将鉴别的免疫组库的序列与imgt数据库的同期或当前版本进行比较,并鉴别所述imgt数据库中不存在的至少一个等位基因变体的序列。在一些实施例中,平均序列读段长度介于300与600个核苷酸之间、或介于350与550个核苷酸之间、或介于330与425个核苷酸之间、或介于约350与约425个核苷酸之间,这部分地取决于在读段长度中包含任何条形码序列。在某些实施例中,至少一组测序的扩增子包含bcr表达序列的互补决定区cdr1、cdr2和cdr3。
[0183]
在一些实施例中,所提供的方法利用包括v基因引物的靶bcr引物组,其中多个v基因引物中的一个或多个v基因引物针对长度为比fr1区高出约70个核苷酸的序列。在其它特定实施例中,多个v基因引物中的一个或多个v基因引物针对长度为比fr1区高出约50个核苷酸的序列。在某些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约18到约45个不同的针对fr1的引物。在一些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约22到约35个不同的针对fr1的引物。在一些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约25到约35个不同的针对fr1的引物。在某些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约40到约65个不同的针对fr1的引物。在一些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约48到约60个不同的针对fr1的引物。在一些实施例中,靶bcr引物组包括一个或多个c基因引物。在特定实施例中,靶免疫受体引物组包括至少5到约15个c基因引物,其中每个基因引物针对靶c基因中的每个靶c基因内的50个相同核苷酸区的至少一部分。在特定实施例中,靶免疫受体引物组包括至少2到约8个c基因引物,其中每个基因引物针对靶c基因中的每个靶c基因内的50个相同核苷酸区的至少一部分。在一些实施例中,靶bcr引物组包括针对不同ig同种型分子,例如iga、igd、igg、igm和ige的两个或更多个c基因引物。在一些实施例中,靶bcr引物组包括至少五个c基因引物,每个引物针对不同ig同种型分子的c基因。
[0184]
在特定实施例中,本发明的方法包括使用至少一组引物,所述至少一组引物包括分别选自表3和表6
‑
10的v基因引物i)和c基因引物ii)。在某些实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物分别包括选自表3的约15到约35个引物和选自表6
‑
10的约5到约20个引物。在一些实施例中,所提供的方法包括使用至少一组引物,所述至少一组引物包括i)选自表3的约22到约35个引物,以及ii)选自表6
‑
10中的每个表的
一个或多个引物。在某些实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物分别包括选自表3的约40到约65个引物和选自表6
‑
10的约5到约20个引物。在一些实施例中,所提供的方法包括使用至少一组引物,所述至少一组引物包括i)选自表3的约48到约60个引物,以及ii)选自表6
‑
10中的每个表的一个或多个引物。在其它某些实施例中,本发明的方法包括使用至少一组引物,所述至少一组引物包括i)选自seq id no:137
‑
283的引物和ii)选自seq id no:448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的引物。在其它实施例中,所提供的方法包括使用至少一组引物,所述至少一组引物包括i)选自seq id no:284
‑
430的引物和ii)选自seq id no:460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的引物。在一些实施例中,本发明的方法包括使用至少一组引物,所述至少一组引物包括i)选自seq id no:137
‑
283的引物和ii)选自seq id no:460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的引物或包括i)选自seq id no:284
‑
430的引物和ii)选自seq id no:448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的引物。
[0185]
在一些实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的至少20或至少25个引物和选自seq id no:448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的至少一个引物。在一些实施例中,所提供的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的约15到约35个引物和选自seq id no:448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的约5到约15个引物。在一些实施例中,所提供的方法包括使用至少一组引物,所述至少一组引物包括i)选自seq id no:137
‑
283的约22到约35个引物和ii)选自seq id no:448
‑
459的至少一个引物、选自seq id no:472
‑
479的至少一个引物、选自seq id no:488
‑
513的至少一个引物、选自seq id no:540
‑
551的至少一个引物和选自seq id no:564
‑
582的至少一个引物。在其它实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的至少20或至少25个引物和选自seq id no:460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的至少一个引物。在一些实施例中,所提供的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的约15到约35个引物和选自seq id no:460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的约5到约15个引物。在一些实施例中,所提供的方法包括使用至少一组引物,所述至少一组引物包括i)选自seq id no:284
‑
430的约22到约35个引物和ii)选自seq id no:460
‑
471的至少一个引物、选自480
‑
487的至少一个引物、选自514
‑
539的至少一个引物、选自552
‑
563的至少一个引物和选自583
‑
601的至少一个引物。在一些实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的至少20或至少25个引物和选自seq id no:448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的至少一个引物。在其它实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的至少20或至少25个引物和选自seq id no:460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的至少一个引物。
[0186]
在一些实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的至少40或至少50个引物和选自seq id no:448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的至少一个引物。在一些实施例中,所提供的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的约40到约65个
引物和选自seq id no:448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的约5到约15个引物。在一些实施例中,所提供的方法包括使用至少一组引物,所述至少一组引物包括i)选自seq id no:137
‑
283的约48到约60个引物和ii)选自seq id no:448
‑
459的至少一个引物、选自seq id no:472
‑
479的至少一个引物、选自seq id no:488
‑
513的至少一个引物、选自seq id no:540
‑
551的至少一个引物和选自seq id no:564
‑
582的至少一个引物。在其它实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的至少40或至少50个引物和选自seq id no:460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的至少一个引物。在一些实施例中,所提供的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的约40到约65个引物和选自seq id no:460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的约5到约15个引物。在一些实施例中,所提供的方法包括使用至少一组引物,所述至少一组引物包括i)选自seq id no:284
‑
430的约48到约60个引物和ii)选自seq id no:460
‑
471的至少一个引物、选自480
‑
487的至少一个引物、选自514
‑
539的至少一个引物、选自552
‑
563的至少一个引物和选自583
‑
601的至少一个引物。在一些实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的至少40或至少50个引物和选自seq id no:448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的至少一个引物。在其它实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的至少40或至少50个引物和选自seq id no:460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的至少一个引物。
[0187]
在某些实施例中,提供了用于扩增样品中的bcr组库的表达核酸序列的方法,所述方法包括使用以下的至少一组执行多重扩增反应以扩增具有恒定部分和可变部分的bcr核酸模板分子:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区3(fr3)的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)一个或多个c基因引物,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,并且其中使用每组执行扩增产生代表样品中相应免疫受体的整个组库的扩增子;由此产生包括bcr组库的免疫受体扩增子。在特定实施例中,i)的所述一个或多个多个v基因引物针对高于框架区的约80个核苷酸部分的序列。在更特定实施例中,i)的所述一个或多个多个v基因引物针对高于框架区的约50个核苷酸部分的序列。在更特定实施例中,i)的所述一个或多个多个v基因引物针对高于框架区的约40到约60个核苷酸部分的序列。在一些实施例中,i)的所述一个或多个多个v基因引物与模板分子的框架3区的至少一部分退火。在某些实施例中,ii)的一个或多个c基因引物包括与bcr模板分子的c基因的至少一部分退火的至少两个引物。在一些实施例中,ii)的一个或多个c基因引物包括至少两个引物,所述至少两个引物中的每个引物与iga、igd、igg、igm或ige模板分子的c基因的至少一部分退火。在一些实施例中,ii)的一个或多个c基因引物包括至少一个引物,所述至少一个引物分别针对iga、igd、igg、igm和ige模板分子中的每个模板分子的c基因的一部分。在特定实施例中,至少一组产生的扩增子包含bcr表达序列的互补决定区cdr3。在一些实施例中,扩增子的长度为约80到约200个核苷酸、长度为约80到约140个核苷酸、长度为约90到约130个核苷酸或长度为至少约100到约120个核苷酸。在一些实施例中,方法中使用的核酸模板是通过从逆转录从生物样品中提
取的核酸分子而产生的cdna。
[0188]
在某些实施例中,提供了用于在样品中提供bcr组库的序列的方法,所述方法包括使用至少一组引物执行多重扩增反应以扩增具有恒定部分和可变部分的bcr核酸模板分子,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区3(fr3)的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)一个或多个c基因引物,所述一个或多个c基因引物针对bcr编码序列的一个或多个相应靶c基因的至少一部分,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,由此产生bcr扩增子分子。然后执行对所得bcr扩增子分子进行的测序,并且由此测定的bcr扩增子分子的序列在样品中提供bcr的序列。在特定实施例中,测定bcr扩增子分子的序列包含:获得初始序列读段;将初始序列读段与参考序列比对并鉴别生产性读段;校正一个或多个插入缺失错误以产生拯救的生产性序列读段;以及测定所得bcr分子的序列。在特定实施例中,生产性读段和拯救的生产性读段的组合是bcr的测序读段的至少50%、至少60%、至少70%或至少75%。在另外的实施例中,所述方法进一步包括序列读段聚类和bcr克隆型报告。在一些实施例中,将鉴别的bcr组库的序列与imgt数据库的同期或当前版本进行比较,并鉴别所述imgt数据库中不存在的至少一个等位基因变体的序列。在一些实施例中,平均序列读段长度介于80与185个核苷酸之间、介于115与200个核苷酸之间、介于90与130个核苷酸之间或介于约100与约120个核苷酸之间,这部分地取决于在读段长度中包含任何条形码序列。在某些实施例中,至少一组测序的扩增子包含bcr表达序列的互补决定区cdr3。
[0189]
在某些实施例中,所提供的方法利用包括v基因引物的靶bcr引物组,其中多个v基因引物中的一个或多个v基因引物针对长度为比fr3区高出约70个核苷酸的序列。在特定实施例中,所提供的方法利用包括v基因引物的靶bcr引物组,其中多个v基因引物中的一个或多个v基因引物针对长度为比fr3区高出约50个核苷酸的序列。在其它特定实施例中,多个v基因引物中的一个或多个v基因引物针对长度为比fr3区高出约40到约60个核苷酸的序列。在某些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约50到约85个不同的针对fr3的引物。在某些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约55到约80个不同的针对fr3的引物。在一些实施例中,靶免疫受体引物组包括v基因引物,所述v基因引物包括约62到约75个不同的针对fr3的引物。在一些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约65、66、67、68、69或70个不同的针对fr3的引物。在一些实施例中,靶bcr引物组包括一个或多个c基因引物。在特定实施例中,靶免疫受体引物组包括至少5到约15个c基因引物,其中每个基因引物针对靶c基因中的每个靶c基因内的50个相同核苷酸区的至少一部分。在特定实施例中,靶bcr引物组包括至少2到约8个c基因引物,其中每个基因引物针对靶c基因中的每个靶c基因内的50个相同核苷酸区的至少一部分。在一些实施例中,ii)的一个或多个c基因引物包括至少两个引物,所述至少两个引物中的每个引物与iga、igd、igg、igm或ige模板分子的c基因的至少一部分退火。在一些实施例中,ii)的一个或多个c基因引物包括至少一个引物,所述至少一个引物分别针对iga、igd、igg、igm和ige模板分子中的每个模板分子的c基因的一部分。
[0190]
在特定实施例中,本发明的方法包括使用至少一组引物,所述至少一组引物包括分别选自表2和表6
‑
10的v基因引物i)和c基因引物ii)。在某些实施例中,本发明的方法包
括使用至少一组引物i)和ii),所述至少一组引物分别包括选自表2的约55到约80个引物和选自表6
‑
10的约5到约20个引物。在一些实施例中,所提供的方法包括使用至少一组引物,所述至少一组引物包括i)选自表2的约62到约75个引物,以及ii)选自表6
‑
10中的每个表的一个或多个引物。在其它某些实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:1
‑
68以及448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582或选自seq id no:69
‑
136以及460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的引物。在一些实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:1
‑
68以及460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601或选自seq id no:69
‑
136以及448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的引物。
[0191]
在一些实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:1
‑
68的至少60个引物和选自seq id no:448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的至少一个引物。在一些实施例中,所提供的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:1
‑
68的至少60个引物和选自seq id no:448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的约5到约15个引物。在一些实施例中,所提供的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:1
‑
68的至少60个引物和选自seq id no:448
‑
459的至少一个引物、选自seq id no:472
‑
479的至少一个引物、选自seq id no:488
‑
513的至少一个引物、选自seq id no:540
‑
551的至少一个引物和选自seq id no:564
‑
582的至少一个引物。在其它实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:69
‑
136的至少60个引物和选自seq id no:460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的至少一个引物。在一些实施例中,所提供的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:69
‑
136的至少60个引物和选自seq id no:460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的约5到约15个引物。在一些实施例中,所提供的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:69
‑
136的至少60个引物和选自seq id no:460
‑
471的至少一个引物、选自seq id no:480
‑
487的至少一个引物、选自seq id no:514
‑
539的至少一个引物、选自seq id no:552
‑
563的至少一个引物和选自seq id no:583
‑
601的至少一个引物。在一些实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:1
‑
68的至少60个引物和选自seq id no:460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的至少一个引物。在其它实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:69
‑
136的至少60个引物和选自seq id no:448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的至少一个引物。
[0192]
在某些实施例中,提供了用于扩增样品中的bcr组库的表达核酸序列的方法,所述方法包括使用以下的至少一组执行多重扩增反应以扩增具有恒定部分和v基因部分的bcr核酸模板分子:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区2(fr2)的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)一个或多个c基因引物,所述一个或多个c基因引物针对相应bcr编码序列的c基因的至少一部分,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,并且其中使用每组执行扩增产生代表样品中相应免疫受体的整个组库的扩增子;由此产生包括bcr组库的扩增子。在特定实施例中,i)的所述一个或多个多个v基因引物针对高于框架区的约80个核苷酸
部分的序列。在更特定实施例中,i)的所述一个或多个多个v基因引物针对高于框架区的约50个核苷酸部分的序列。在一些实施例中,i)的所述一个或多个多个v基因引物与bcr模板分子的fr2区的至少一部分退火。在某些实施例中,ii)的一个或多个c基因引物包括与bcr模板分子的恒定部分c基因的至少一部分退火的至少两个引物。在一些实施例中,ii)的一个或多个c基因引物包括至少两个引物,所述至少两个引物中的每个引物与iga、igd、igg、igm或ige模板分子的c基因的至少一部分退火。在一些实施例中,ii)的一个或多个c基因引物包括至少一个引物,所述至少一个引物分别针对iga、igd、igg、igm和ige模板分子中的每个模板分子的c基因的一部分。在特定实施例中,至少一组产生的扩增子包含bcr表达序列的互补决定区cdr2和cdr3。在一些实施例中,扩增子的长度为约180到约375个核苷酸、约200到约350个核苷酸、约225到约325个核苷酸或长度为约250到约300个核苷酸。在一些实施例中,方法中使用的核酸模板是通过从逆转录从生物样品中提取的核酸分子而产生的cdna。
[0193]
在某些实施例中,提供了用于在样品中提供bcr组库的序列的方法,所述方法包括使用至少一组引物执行多重扩增反应以扩增具有恒定部分和可变部分的bcr核酸模板分子,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的fr2的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)一个或多个c基因引物,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,由此产生bcr扩增子分子。然后执行对所得bcr扩增子分子进行的测序,并且由此测定的bcr扩增子分子的序列在样品中提供bcr组库的序列。在特定实施例中,测定bcr扩增子分子的序列包含:获得初始序列读段;将初始序列读段与参考序列比对并鉴别生产性读段;校正一个或多个插入缺失错误以产生拯救的生产性序列读段;以及测定所得bcr分子的序列。在特定实施例中,生产性读段和拯救的生产性读段的组合是bcr的测序读段的至少40%、至少50%、至少60%、至少70%或至少75%。在另外的实施例中,所述方法进一步包括序列读段聚类和bcr克隆型报告。在一些实施例中,将鉴别的免疫组库的序列与imgt数据库的同期或当前版本进行比较,并鉴别所述imgt数据库中不存在的至少一个等位基因变体的序列。在一些实施例中,平均序列读段长度介于约200与约375个核苷酸之间、介于约250与约350个核苷酸之间或介于约275与约350个核苷酸之间,这部分地取决于在读段长度中包含任何条形码序列。在某些实施例中,至少一组测序的扩增子包含bcr表达序列的互补决定区cdr2和cdr3。
[0194]
在特定实施例中,所提供的方法利用包括v基因引物的靶bcr引物组,其中多个v基因引物中的一个或多个v基因引物针对长度为比fr2区高出约70个核苷酸的序列。在其它特定实施例中,多个v基因引物中的一个或多个v基因引物针对长度为比fr2区高出约50个核苷酸的序列。在某些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约4到约20个不同的针对fr2的引物。在一些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约5到约15个不同的针对fr2的引物。在一些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约5、6、7、8、9、10、11或12个不同的针对fr2的引物。在一些实施例中,靶bcr引物组包括一个或多个c基因引物。在特定实施例中,靶免疫受体引物组包括至少5到约15个c基因引物,其中每个基因引物针对靶c基因中的每个靶c基因内的50个相同核苷酸区的至少一部分。在特定实施例中,靶bcr引物组包括至少2到约8个c基因引物,其中每个基因引
物针对靶c基因中的每个靶c基因内的50个相同核苷酸区的至少一部分。在一些实施例中,ii)的一个或多个c基因引物包括至少两个引物,所述至少两个引物中的每个引物与iga、igd、igg、igm或ige模板分子的c基因的至少一部分退火。在一些实施例中,ii)的一个或多个c基因引物包括至少一个引物,所述至少一个引物分别针对iga、igd、igg、igm和ige模板分子中的每个模板分子的c基因的一部分。
[0195]
在特定实施例中,本发明的方法包括使用至少一组引物,所述至少一组引物包括分别选自表4和表6
‑
10的v基因引物i)和c基因引物ii)。在某些其它实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:431
‑
437以及448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的引物。在其它实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:431
‑
437以及460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的引物。在一些实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:431
‑
437的至少5个引物和选自seq id no:448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的至少一个引物。在一些实施例中,所提供的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:431
‑
437的至少5个引物和选自seq id no:448
‑
459的至少一个引物、选自seq id no:472
‑
479的至少一个引物、选自seq id no:488
‑
513的至少一个引物、选自seq id no:540
‑
551的至少一个引物和选自seq id no:564
‑
582的至少一个引物。在其它实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:431
‑
437的至少5个引物和选自seq id no:460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的至少一个引物。在一些实施例中,所提供的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:431
‑
437的至少5个引物和选自seq id no:460
‑
471的至少一个引物、选自seq id no:480
‑
487的至少一个引物、选自seq id no:514
‑
539的至少一个引物、选自seq id no:552
‑
563的至少一个引物和选自seq id no:583
‑
601的至少一个引物。
[0196]
在某些实施例中,提供了用于扩增样品中的bcr组库的表达核酸序列的方法,所述方法包括使用以下的至少一组执行多重扩增反应以扩增具有j基因部分和v基因部分的bcr核酸模板分子:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区的至少一部分的bcr编码序列的大多数不同v基因,和ii)多个j基因引物,所述多个j基因引物针对相应靶免疫受体编码序列的大多数不同j基因,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,并且其中使用每组执行扩增产生代表样品中相应免疫受体的整个组库的扩增子;由此产生包括bcr的组库的扩增子。在特定实施例中,i)的所述一个或多个多个v基因引物针对高于框架区的约80个核苷酸部分的序列。在更特定实施例中,i)的所述一个或多个多个v基因引物针对高于框架区的约50个核苷酸部分的序列。在特定实施例中,ii)的所述一个或多个多个j基因引物针对高于j基因的约50个核苷酸部分的序列。在更特定实施例中,ii)的所述一个或多个多个j基因引物针对高于j基因的约30个核苷酸部分的序列。在某些实施例中,ii)的所述一个或多个多个j基因引物针对完全在j基因内的序列。
[0197]
在某些实施例中,提供了用于扩增样品中的bcr组库的表达核酸序列的方法,所述方法包括使用以下的至少一组执行多重扩增反应以扩增具有j基因部分和v基因部分的bcr核酸模板分子:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区3(fr3)的
至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)多个j基因引物,所述多个j基因引物针对相应靶bcr编码序列的大多数不同j基因,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,并且其中使用每组执行扩增产生代表样品中相应免疫受体的整个组库的扩增子;由此产生包括bcr的组库的bcr扩增子。在特定实施例中,i)的所述一个或多个多个v基因引物针对高于框架区的约80个核苷酸部分的序列。在更特定实施例中,i)的所述一个或多个多个v基因引物针对高于框架区的约50个核苷酸部分的序列。在更特定实施例中,i)的所述一个或多个多个v基因引物针对高于框架区的约40到约60个核苷酸部分的序列。在一些实施例中,i)的所述一个或多个多个v基因引物与模板分子的框架3区的至少一部分退火。在某些实施例中,ii)的所述多个j基因引物包括与模板分子的j基因部分的至少一部分退火的至少两个引物。在一些实施例中,ii)的所述多个j基因引物包括与模板分子的j基因部分的至少一部分退火的至少2到约8个引物。在一些实施例中,ii)的所述多个j基因引物包括与模板分子的j基因部分的至少一部分退火的约4个引物。在一些实施例中,ii)的所述多个j基因引物包括与模板分子的j基因部分的至少一部分退火的约3到约6个引物。在特定实施例中,至少一组产生的扩增子包含bcr表达序列的互补决定区cdr3。在一些实施例中,扩增子的长度为约60到约160个核苷酸、长度为约70到约100个核苷酸、长度为约100到约120个核苷酸、长度为至少约70到约90个核苷酸、长度为约80到约90个核苷酸或长度为约80个核苷酸。在一些实施例中,方法中使用的核酸模板是通过从逆转录从生物样品中提取的核酸分子而产生的cdna。
[0198]
在某些实施例中,提供了用于在样品中提供bcr组库的序列的方法,所述方法包括使用至少一组引物执行多重扩增反应以扩增具有j基因部分和v基因部分的bcr核酸模板分子,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区3(fr3)的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)多个j基因引物,所述多个j基因引物针对相应靶免疫受体编码序列的大多数不同j基因,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,由此产生bcr扩增子分子。然后执行对所得bcr扩增子分子进行的测序,并且由此测定的免疫受体扩增子分子的序列在样品中提供bcr组库的序列。在一些实施例中,测定bcr扩增子分子的序列包含:获得初始序列读段;将初始序列读段与参考序列比对;鉴别生产性读段;校正一个或多个插入缺失错误以产生拯救的生产性序列读段;以及测定所得免疫受体分子的序列。在特定实施例中,测定bcr扩增子分子的序列包含:获得初始序列读段;向序列读段添加推断的j基因序列以产生延伸的序列读段;将延伸的序列读段与参考序列比对并鉴别生产性读段;校正一个或多个插入缺失错误以产生拯救的生产性序列读段;以及测定所得bcr分子的序列。在特定实施例中,生产性读段和拯救的生产性读段的组合是bcr的测序读段的至少50%、至少60%、至少70%或至少75%。在另外的实施例中,所述方法进一步包括序列读段聚类和bcr克隆型报告。在一些实施例中,将鉴别的bcr组库的序列与imgt数据库的同期或当前版本进行比较,并鉴别所述imgt数据库中不存在的至少一个等位基因变体的序列。在一些实施例中,序列读段长度为约60到约185个核苷酸,这部分地取决于将任何条形码序列包含在读段长度中。在一些实施例中,平均序列读段长度介于90与120个核苷酸之间、介于70与90个核苷酸之间、或介于约75与约85个核苷酸之间或约80个核苷酸。在某些实施例中,至少一组测序的扩增子包含bcr表达序列的互补决定区cdr3。
[0199]
在特定实施例中,所提供的方法利用包括v基因引物的靶bcr引物组,其中多个v基因引物中的一个或多个v基因引物针对长度为比fr3区高出约50个核苷酸的序列。在其它实施例中,多个v基因引物中的一个或多个v基因引物针对长度为比fr3区高出约70个核苷酸的序列。在其它特定实施例中,多个v基因引物中的一个或多个v基因引物针对长度为比fr3区高出约40到约60个核苷酸的序列。在某些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约50到约85个不同的针对fr3的引物。在某些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约55到约80个不同的针对fr3的引物。在一些实施例中,靶免疫受体引物组包括v基因引物,所述v基因引物包括约62到约75个不同的针对fr3的引物。在一些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约65、66、67、68、69或70个不同的针对fr3的引物。在一些实施例中,靶bcr引物组包括多个j基因引物。在特定实施例中,靶bcr引物组包括至少两个j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。在一些实施例中,靶bcr引物组包括2到约8个j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。在一些实施例中,靶bcr引物组包括约3到约6个不同的j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。在一些实施例中,靶bcr引物组包括约2、3、4、5、6、7或8个不同的j基因引物。在一些实施例中,靶免疫受体引物组包括约4个j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。
[0200]
在特定实施例中,本发明的方法包括使用至少一组引物,所述至少一组引物包括分别选自表2和5的v基因引物i)和j基因引物ii)。在某些其它实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:1
‑
68和438
‑
442或选自seq id no:69
‑
136和443
‑
447的引物。在某些其它实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:1
‑
68和443
‑
447或选自seq id no:69
‑
136和438
‑
442的引物。
[0201]
在一些实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:1
‑
68的至少60个引物和选自seq id no:438
‑
442的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:69
‑
136的至少60个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:69
‑
136的至少60个引物和选自seq id no:438
‑
442的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:1
‑
68的至少60个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。
[0202]
在某些实施例中,提供了用于扩增样品中的bcr组库的表达核酸序列的方法,所述方法包括使用以下的至少一组执行多重扩增反应以扩增具有j基因部分和v基因部分的bcr核酸模板分子:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区1(fr1)的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)多个j基因引物,所述多个j基因引物针对相应靶免疫受体编码序列的大多数不同j基因,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,并且其中使用每组执行扩增产生代表样品中相应免疫受体的整个组库的扩增子;由此产生包括bcr的组库的bcr扩增子。
在特定实施例中,i)的所述一个或多个多个v基因引物针对高于框架区的约80个核苷酸部分的序列。在更特定实施例中,i)的所述一个或多个多个v基因引物针对高于框架区的约50个核苷酸部分的序列。在一些实施例中,i)的所述一个或多个多个v基因引物与模板分子的框架1区的至少一部分退火。在某些实施例中,ii)的所述多个j基因引物包括与模板分子的j基因部分的至少一部分退火的至少两个引物。在一些实施例中,ii)的所述多个j基因引物包括与模板分子的j基因部分的至少一部分退火的至少2到约8个引物。在一些实施例中,ii)的所述多个j基因引物包括与模板分子的j基因部分的至少一部分退火的约4个引物。在一些实施例中,ii)的所述多个j基因引物包括与模板分子的j基因部分的至少一部分退火的约3到约6个引物。在特定实施例中,至少一组产生的扩增子包含bcr表达序列的互补决定区cdr1、cdr2和cdr3。在一些实施例中,扩增子的长度为约220到约350个核苷酸、约225到约300个核苷酸、约250到约325个核苷酸、约250到约275个核苷酸或长度为约270到约300个核苷酸。在一些实施例中,方法中使用的核酸模板是通过从逆转录从生物样品中提取的核酸分子而产生的cdna。
[0203]
在某些实施例中,提供了用于在样品中提供bcr组库的序列的方法,所述方法包括使用至少一组引物执行多重扩增反应以扩增具有j基因部分和v基因部分的bcr核酸模板分子,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区1(fr1)的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)多个j基因引物,所述多个j基因引物针对相应靶免疫受体编码序列的大多数不同j基因,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,由此产生bcr扩增子分子。然后执行对所得免疫受体扩增子分子进行的测序,并且由此测定的bcr扩增子分子的序列在样品中提供bcr组库的序列。在一些实施例中,测定bcr扩增子分子的序列包含:获得初始序列读段;将初始序列读段与参考序列比对;鉴别生产性读段;校正一个或多个插入缺失错误以产生拯救的生产性序列读段;以及测定所得免疫受体分子的序列。在特定实施例中,测定bcr扩增子分子的序列包含:获得初始序列读段;向序列读段添加推断的j基因序列以产生延伸的序列读段;将延伸的序列读段与参考序列比对并鉴别生产性读段;校正一个或多个插入缺失错误以产生拯救的生产性序列读段;以及测定所得bcr分子的序列。在特定实施例中,生产性读段和拯救的生产性读段的组合是免疫受体的测序读段的至少50%、至少60%、至少70%或至少75%。在另外的实施例中,所述方法进一步包括序列读段聚类和bcr克隆型报告。在一些实施例中,将鉴别的免疫组库的序列与imgt数据库的同期或当前版本进行比较,并鉴别所述imgt数据库中不存在的至少一个等位基因变体的序列。在一些实施例中,平均序列读段长度介于200与350个核苷酸之间、介于225与325个核苷酸之间、介于250与300个核苷酸之间、介于270与300个核苷酸之间或介于295与325个核苷酸之间,这部分地取决于在读段长度中包含任何条形码序列。在某些实施例中,至少一组测序的扩增子包含bcr表达序列的互补决定区cdr1、cdr2和cdr3。
[0204]
在特定实施例中,所提供的方法利用包括v基因引物的靶bcr引物组,其中多个v基因引物中的一个或多个v基因引物针对长度为比fr1区高出约70个核苷酸的序列。在其它某些实施例中,多个v基因引物中的一个或多个v基因引物针对长度为比fr1区高出约80个核苷酸的序列。在其它特定实施例中,多个v基因引物中的一个或多个v基因引物针对长度为比fr1区高出约50个核苷酸的序列。在某些实施例中,靶bcr引物组包括v基因引物,所述v基
因引物包括约18到约45个不同的针对fr1的引物。在一些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约22到约35个不同的针对fr1的引物。在一些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约25到约35个不同的针对fr1的引物。在某些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约40到约65个不同的针对fr1的引物。在一些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约48到约60个不同的针对fr1的引物。在一些实施例中,靶bcr引物组包括多个j基因引物。在特定实施例中,靶bcr引物组包括至少两个j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。在一些实施例中,靶bcr引物组包括2到约8个j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。在一些实施例中,靶bcr引物组包括约3到约6个不同的j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。在一些实施例中,靶bcr引物组包括约2、3、4、5、6、7或8个不同的j基因引物。在一些实施例中,靶免疫受体引物组包括约4个j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。
[0205]
在特定实施例中,本发明的方法包括使用至少一组引物,所述至少一组引物包括分别选自表3和5的v基因引物i)和j基因引物ii)。在某些其它实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283和438
‑
442或选自seq id no:284
‑
430和443
‑
447的引物。在其它实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283和443
‑
447或选自seq id no:284
‑
430和438
‑
442的引物。在一些实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的至少20或至少25个引物和选自seq id no:438
‑
442的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,所提供的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的约15到约35个引物和选自seq id no:438
‑
442的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,所提供的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的约22到约35个引物和选自seq id no:438
‑
442的至少2个引物、至少3个引物或至少4个引物。在其它实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的至少20或至少25个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,所提供的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的约15到约35个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,所提供的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的约22到约35个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的至少20或至少25个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。在其它实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的至少20或至少25个引物和选自seq id no:438
‑
442的至少2个引物、至少3个引物或至少4个引物。
[0206]
在一些实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的至少40或至少50个引物和选自seq id no:438
‑
442的至
少2个引物、至少3个引物或至少4个引物。在一些实施例中,所提供的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的约40到约65个引物和选自seq id no:438
‑
442的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,所提供的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的约48到约60个引物和选自seq id no:438
‑
442的至少2个引物、至少3个引物或至少4个引物。在其它实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的至少40或至少50个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,所提供的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的约40到约65个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,所提供的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的约48到约60个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的至少40或至少50个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。在其它实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的至少40或至少50个引物和选自seq id no:438
‑
442的至少2个引物、至少3个引物或至少4个引物。
[0207]
在某些实施例中,提供了用于扩增样品中的bcr组库的表达核酸序列的方法,所述方法包括使用以下的至少一组执行多重扩增反应以扩增具有j基因部分和v基因部分的bcr核酸模板分子:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区2(fr2)的至少一部分的bcr编码序列的大多数不同v基因,和ii)多个j基因引物,所述多个j基因引物针对相应靶免疫受体编码序列的大多数不同j基因,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,并且其中使用每组执行扩增产生代表样品中相应免疫受体的整个组库的扩增子;由此产生包括bcr的组库的免疫受体扩增子。在特定实施例中,i)的所述一个或多个多个v基因引物针对高于框架区的约80个核苷酸部分的序列。在更特定实施例中,i)的所述一个或多个多个v基因引物针对高于框架区的约50个核苷酸部分的序列。在一些实施例中,i)的所述一个或多个多个v基因引物与模板分子的fr2区的至少一部分退火。在某些实施例中,ii)的所述多个j基因引物包括与模板分子的j基因的至少一部分退火的至少十个引物。在一些实施例中,ii)的所述多个j基因引物包括与模板分子的j基因部分的至少一部分退火的约14个引物。在一些实施例中,ii)的所述多个j基因引物与模板分子的j基因部分的至少一部分退火的至少两个引物。在一些实施例中,ii)的所述多个j基因引物包括与模板分子的j基因部分的至少一部分退火的至少2到约8个引物。在一些实施例中,ii)的所述多个j基因引物包括与模板分子的j基因部分的至少一部分退火的约4个引物。在一些实施例中,ii)的所述多个j基因引物包括与模板分子的j基因部分的至少一部分退火的约3到约6个引物。在特定实施例中,至少一组产生的扩增子包含bcr基因序列的互补决定区cdr2和cdr3。在一些实施例中,扩增子的长度为约160到约270个核苷酸、约180到约250个核苷酸或长度为约195到约225个核苷酸。在一些实施例中,方法中使用的核酸模板是通过从逆转录从生物样品中提取的核酸分子而产生的cdna。
[0208]
在某些实施例中,提供了用于在样品中提供bcr组库的序列的方法,所述方法包括
使用至少一组引物执行多重扩增反应以扩增具有j基因部分和v基因部分的bcr核酸模板分子,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的fr2的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)多个j基因引物,所述多个j基因引物针对相应靶免疫受体编码序列的大多数不同j基因,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,由此产生bcr扩增子分子。然后执行对所得免疫受体扩增子分子进行的测序,并且由此测定的bcr扩增子分子的序列在样品中提供bcr组库的序列。在一些实施例中,测定bcr扩增子分子的序列包含:获得初始序列读段;将初始序列读段与参考序列比对;鉴别生产性读段;校正一个或多个插入缺失错误以产生拯救的生产性序列读段;以及测定所得免疫受体分子的序列。在特定实施例中,测定bcr扩增子分子的序列包含:获得初始序列读段;向序列读段添加推断的j基因序列以产生延伸的序列读段;将延伸的序列读段与参考序列比对并鉴别生产性读段;校正一个或多个插入缺失错误以产生拯救的生产性序列读段;以及测定所得bcr分子的序列。在特定实施例中,生产性读段和拯救的生产性读段的组合是bcr的测序读段的至少40%、至少50%、至少60%、至少70%或至少75%。在另外的实施例中,所述方法进一步包括序列读段聚类和bcr克隆型报告。在一些实施例中,将鉴别的免疫组库的序列与imgt数据库的同期或当前版本进行比较,并鉴别所述imgt数据库中不存在的至少一个等位基因变体的序列。在一些实施例中,平均序列读段长度介于160与300个核苷酸之间、介于180与280个核苷酸之间、介于200与260个核苷酸之间或介于225与270个核苷酸之间,这部分地取决于在读段长度中包含任何条形码序列。在某些实施例中,至少一组测序的扩增子包含bcr表达序列的互补决定区cdr2和cdr3。
[0209]
在特定实施例中,所提供的方法利用包括v基因引物的靶bcr引物组,其中多个v基因引物中的一个或多个v基因引物针对长度为比fr2区高出约70个核苷酸的序列。在其它特定实施例中,多个v基因引物中的一个或多个v基因引物针对长度为比fr2区高出约50个核苷酸的序列。在某些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约4到约20个不同的针对fr2的引物。在一些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约5到约15个不同的针对fr2的引物。在一些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约5、6、7、8、9、10、11或12个不同的针对fr2的引物。在一些实施例中,靶bcr引物组包括多个j基因引物。在特定实施例中,靶bcr引物组包括至少两个j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。在一些实施例中,靶bcr引物组包括2到约8个j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。在一些实施例中,靶bcr引物组包括约3到约6个不同的j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。在一些实施例中,靶bcr引物组包括约2、3、4、5、6、7或8个不同的j基因引物。在一些实施例中,靶免疫受体引物组包括约4个j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。
[0210]
在特定实施例中,本发明的方法包括使用至少一组引物,所述至少一组引物包括分别选自表4和5的v基因引物i)和j基因引物ii)。在某些其它实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:431
‑
437和438
‑
442或选自seq id no:431
‑
437和443
‑
447的引物。在一些实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:431
‑
437的至少5个引物和选自
seq id no:438
‑
442的至少2个引物、至少3个引物或至少4个引物。在其它实施例中,本发明的方法包括使用至少一组引物i)和ii),所述至少一组引物包括选自seq id no:431
‑
437的至少5个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。
[0211]
在某些实施例中,本发明的方法包括使用选自由造血细胞、淋巴细胞和肿瘤细胞组成的组的生物样品。在一些实施例中,生物样品选自由以下组成的组:外周血单核细胞(pbmc)、t细胞、b细胞、循环肿瘤细胞和肿瘤浸润淋巴细胞(本文中称为“tils”或“til”)。在一些实施例中,生物样品包括进行离体活化和/或扩增的b细胞。在一些实施例中,生物样品包括如例如在血液或血浆中发现的cfdna。在一些实施例中,生物样品选自由以下组成的组:组织(例如,淋巴结、器官组织、骨髓)、全血、滑液、脑脊液、肿瘤活检和其它含有细胞的临床标本。
[0212]
在一些实施例中,提供了用于通过评估来自生物样品的表达的免疫受体rna和重排的免疫受体基因组dna(gdna)两者来测定生物样品的免疫组库的方法、组合物和系统。在一些实施例中,可以同时评估样品rna和gdna,并且在对rna进行逆转录以形成cdna之后,可以在相同的多重扩增反应中扩增cdna和gdna。在一些实施例中,来自样品rna和样品gdna的cdna可以在单独的反应中进行多重扩增。在一些实施例中,来自样品rna和样品gdna的cdna可以用平行引物池进行多重扩增。在一些实施例中,使用针对相同的bcr的引物池评估来自样品的gdna和rna的bcr组库。在一些实施例中,使用针对不同的免疫受体的引物池评估来自样品的gdna和rna的免疫组库。在一些实施例中,用来自样品rna和样品gdna的cdna单独执行多重扩增反应以扩增来自样品的相同或不同靶免疫受体分子,并且对所得免疫受体扩增子进行测序,由此提供生物样品的表达的免疫受体rna和重排的免疫受体gdna的序列。
[0213]
在一些实施例中,使用针对不同的免疫受体的引物池评估来自样品的gdna和/或rna的免疫组库。在一些实施例中,用本文提供的一组igh引物和例如如以下中描述的一组针对tcrβ的引物来执行多重扩增反应:于2018年1月17日提交的pct申请第pct/us2018/014111号和于2018年8月31日提交的pct申请第pct/us2018/049259号,所述申请中的每个申请的全部内容通过引用并入本文或作为oncomine
tm tcrβ
‑
sr测定dna、oncomine
tm tcrβ
‑
sr测定rna和oncomine
tm tcrβ
‑
lr测定(赛默飞世尔科技公司)可商购获得。使用单一多重扩增反应评估来自样品的bcr(例如,igh)组库和tcr(例如,tcrβ)组库两者的能力可用于节省时间和有限的生物样品并且适用于本文所述的方法中的许多方法,包含与过敏和自身免疫、疫苗研发和使用以及免疫肿瘤学有关的方法。例如,将b细胞组库分析与t细胞组库分析相结合可以用于改善在施用免疫疗法(如检查点阻断或检查点抑制剂免疫疗法)后对免疫组库变化的检测,这潜在地表示对免疫疗法的应答。而且,将b细胞组库分析与t细胞组库分析相结合可以用于改善对疫苗功效的评估。响应于免疫疗法或响应于疫苗施用的示例性免疫组库变化包含但不限于与治疗前均匀度值相比在治疗之后(例如但不限于在治疗后的第7
‑
14天时)的t细胞均匀度和b细胞均匀度的降低以及与治疗前的值相比在一次或多次治疗后的igg1表达b细胞的代表的增加。
[0214]
在一些实施例中,所提供的方法和组合物用于鉴别和/或表征受试者的免疫组库。在一些实施例中,所提供的方法和组合物用于鉴别和表征受试者的免疫组库的新颖或非典型的bcr等位基因。在一些实施例中,将鉴别的免疫组库的序列与imgt数据库的同期或当前版本进行比较,并鉴别所述imgt数据库中不存在的至少一个等位基因变体的序列。在一些
实施例中,使用例如克隆数支持、序列读段支持和/或具有等位基因变体的个体数等标准,使imgt数据库中不存在的所鉴别的等位基因变体经受基于证据的过滤。可以将imgt中不存在的所鉴别和报告的等位基因变体与含有免疫组库序列信息的其它数据库如ncbi nr数据库和lym1k数据库进行比较,以交叉验证报告的新颖或非经典的bcr等位基因。例如,表征无记录或非经典的igh多态性的存在可能有助于理解影响自身免疫性疾病、传染病和对免疫疗法的应答的因素。在一些实施例中,如本文所述的所鉴别的新颖或非经典的bcr等位基因的序列可以用于产生重组bcr核酸或分子。因此,在其它实施例中,提供了用于制备编码所鉴别的新颖igh等位基因变体的重组核酸的方法。在一些实施例中,提供了用于制备重组igh等位基因变体分子和用于制备表达所述分子的重组细胞的方法。
[0215]
在一些实施例中,所提供的方法和组合物用于鉴别和表征受试者的免疫组库的新颖或非典型的bcr等位基因。在一些实施例中,可以在治疗性治疗例如对癌症或免疫病症的治疗之前和/或之后鉴别或表征患者的免疫组库。在一些实施例中,鉴别或表征免疫组库可以用于评估治疗的效果或功效,以修改治疗方案和/或优化对治疗剂的选择。在一些实施例中,鉴别或表征免疫组库可以用于评估患者对免疫疗法、癌症疫苗和/或其它基于免疫的治疗或其一种或多种组合的应答。在一些实施例中,鉴别或表征免疫组库可以指示患者对治疗剂做出应答的可能性或可以指示患者对治疗剂不做出应答的可能性。
[0216]
在一些实施例中,可以鉴别或表征患者的bcr组库以监测过度增殖性疾病的进展和/或治疗(包含在患者治疗之后检测残留疾病)、监测自身免疫性疾病的进展和/或治疗、移植监测并且监测抗原刺激的病状,包含在接种疫苗、暴露于细菌、真菌、寄生虫或病毒抗原或被细菌、真菌、寄生虫或病毒感染之后。在一些实施例中,鉴别或表征bcr组库可以用于评估患者对抗感染或抗炎疗法的应答。
[0217]
在一些实施例中,提供了用于鉴别和/或表征来自受试者的样品中的免疫组库克隆群体的方法和组合物,所述方法和组合物包括用样品或从样品制备的cdna执行一个或多个多重扩增反应以使用至少一组引物扩增具有恒定部分和可变部分的免疫组库核酸模板分子,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区1(fr1)的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)一个或多个c基因引物,所述一个或多个c基因引物针对免疫受体编码序列的相应靶c基因的至少一部分,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,由此产生bcr扩增子分子。所述方法进一步包括:对所得bcr扩增子分子进行测序;测定bcr扩增子分子的序列;以及从样品中鉴别靶bcr的一个或多个免疫组库克隆群体。在特定实施例中,测定免疫受体扩增子分子的序列包含:获得初始序列读段;将初始序列读段与参考序列比对并鉴别生产性读段;校正一个或多个插入缺失错误以产生拯救的生产性序列读段;以及测定所得免疫受体分子的序列。在此类方法和组合物的其它实施例中,使用至少一组引物执行所述一个或多个多重扩增反应,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区3(fr3)的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)一个或多个c基因引物,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组。在此类方法和组合物的其它实施例中,使用至少一组引物执行所述一个或多个多重扩增反应,所述至少一组引物包括:i)多个v基因引物,所述多个v
基因引物针对包括v基因内的框架区2(fr2)的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)一个或多个c基因引物,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组。
[0218]
在一些实施例中,提供了用于鉴别和/或表征来自受试者的样品中的免疫组库克隆群体的方法和组合物,所述方法和组合物包括使用至少一组引物用样品或从样品制备的cdna执行一个或多个多重扩增反应以扩增具有j基因部分和v基因部分的免疫组库核酸模板分子,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区3(fr3)的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)多个j基因引物,所述多个j基因引物针对相应靶bcr编码序列的大多数不同j基因,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,由此产生bcr扩增子分子。所述方法进一步包括:对所得bcr扩增子分子进行测序;测定bcr扩增子分子的序列;以及从样品中鉴别靶bcr的一个或多个免疫组库克隆群体。在特定实施例中,测定免疫受体扩增子分子的序列包含:获得初始序列读段;向序列读段添加推断的j基因序列以产生延伸的序列读段;将延伸的序列读段与参考序列比对并鉴别生产性读段;校正一个或多个插入缺失错误以产生拯救的生产性序列读段;以及测定所得免疫受体分子的序列。在此类方法和组合物的其它实施例中,使用至少一组引物执行所述多重扩增反应,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区1(fr1)的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)多个j基因引物,所述多个j基因引物针对相应靶bcr编码序列的大多数不同j基因引物,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组。在此类方法和组合物的其它实施例中,使用至少一组引物执行多重扩增反应,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区2(fr2)的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)多个j基因引物,所述多个j基因引物针对相应靶bcr编码序列的大多数不同j基因引物,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组。
[0219]
因此,在一些实施例中,所提供的方法、组合物和工作流程用于但不限于评估b细胞群的克隆性、多样性和丰富性。例如,克隆扩增可以鉴别对抗原攻击响应的b细胞,并且纵向分析可以用于评估疫苗接种的功效。在一些实施例中,所提供的方法、组合物和工作流程用于鉴别具有许多成员的克隆谱系。例如,具有许多成员的克隆谱系可以代表对慢性抗原刺激响应的b细胞。在一些实施例中,所提供的方法、组合物和工作流程用于鉴别抗原特异性b细胞。例如,跨已经暴露于相同抗原的个体组比价igh组库可以揭示指示抗原特异性igh链的共有igh氨基酸基序。在一些实施例中,所提供的方法、组合物和工作流程用于评估克隆重叠。例如,克隆重叠分析可以揭示b细胞运输和b细胞群之间的发育关系。在一些实施例中,所提供的方法、组合物和工作流程用于测定包含在纵向分析中的优势克隆vdj序列。在一些实施例中,所提供的方法、组合物和工作流程用于通过克隆谱系分析来鉴别恶性亚克隆。例如,对于一些b细胞恶性肿瘤(例如,滤泡性淋巴瘤),体细胞超突变正在进行中,从而导致具有不同但相关的igh序列的恶性亚克隆的存在,所述恶性亚克隆可以用所提供的方法、组合物和工作流程来跟踪。
[0220]
在一些实施例中,所提供的方法、组合物和工作流程用于评估克隆演化。例如,对克隆谱系的分析可以揭示对抗原结合很重要的同种型转换和igh残基。在一些实施例中,所提供的方法、组合物和工作流程用于评估同种型丰度。例如,某些同种型的过度表达或未充分表达可能表明疾病或免疫缺陷,如但不限于响应于病毒感染的igg1升高、过敏时的ige升高以及同种型缺失或未充分表达可能表明原发性免疫缺陷。在一些实施例中,所提供的方法、组合物和工作流程用于量化体细胞超突变。例如,体细胞超突变的频率提供了对发生恶性转化的b细胞发育阶段的了解。
[0221]
在一些实施例中,所提供的方法和组合物用于鉴别和/或表征bcr组库或克隆群体内的体细胞超突变(shm)。在一些实施例中,所提供的方法和组合物用于鉴别和/或筛选罕见的bcr克隆或亚克隆,例如具有体细胞超突变的vdj重排的那些bcr克隆或亚克隆。在一些实施例中,鉴别、量化和/或表征罕见的bcr克隆可以为给定的病状或治疗应答提供生物标志物。因此,在一些实施例中,本文提供的方法和组合物用于使用例如从回顾性或纵向受试者研究中获得的样品鉴别、筛选和/或表征作为生物标志物的bcr克隆。
[0222]
在一些实施例中,用于鉴别和/或表征bcr克隆谱系和shm的方法包括:使用至少一组引物和一个或多个c基因引物用受试者的样品执行一个或多个多重扩增反应以扩增具有恒定部分和可变部分的bcr核酸模板分子,所述至少一组引物针对包括v基因内的fr1、fr2或fr3的至少一部分的至少一个bcr编码序列的大多数不同v基因,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分;对所得bcr扩增子进行测序;以及执行本文提供的vdj序列分析以鉴别和/或量化来自样品的靶bcr的smh和克隆谱系。在其它实施例中,用于鉴别和/或表征bcr克隆谱系和shm的方法包括:使用至少一组引物和多个j基因引物用受试者的样品执行一个或多个多重扩增反应,以扩增具有j基因部分和可变部分的bcr核酸模板分子,所述至少一组引物针对包括v基因内的fr1、fr2或fr3的至少一部分的至少一个bcr编码序列的大多数不同v基因,所述多个j基因引物针对相应靶bcr编码序列的大多数不同j基因;对所得bcr扩增子进行测序;以及执行本文提供的vdj序列分析以鉴别来自样品的靶bcr的shm和克隆谱系。
[0223]
在一些实施例中,所提供的方法和组合物用于鉴别、量化、表征和/或监测bcr组库或b细胞克隆谱系内的同种型(或亚同种型)类别或同种型类别转换。在一些实施例中,此类方法包括:使用至少一组引物和一个或多个c基因引物用受试者的样品执行一个或多个多重扩增反应,以扩增具有恒定部分和可变部分的igh核酸模板分子,所述至少一组引物针对包括v基因内的fr1、fr2或fr3的至少一部分的大多数不同igh v基因编码序列,所述一个或多个c基因引物针对igh编码序列的c基因的至少一部分;对所得扩增子进行测序;执行本文提供的序列分析以鉴别样品的bcr组库或克隆谱系的一个或多个igh同种型类别。在一些实施例中,引物组包括针对单一同种型例如ige的c基因的至少一部分的一个或多个引物。在其它实施例中,引物组包括至少两个引物,每个引物针对两个不同同种型的c基因的至少一部分。在其它实施例中,引物组包括单独针对iga、igd、igg、igm和ige同种型类型的c基因的至少一部分的至少一个引物。
[0224]
在某些实施例中,所提供的方法和组合物用于监测bcr组库克隆群体和克隆谱系的变化,例如克隆扩增的变化、克隆收缩的变化、bcr组库内的克隆或克隆群体的相对比例的变化、克隆谱系的扩展或收缩的变化、组库内体细胞超突变和/或同种型类别转换的变
化。在一些实施例中,所提供的方法和组合物用于监测响应于肿瘤生长的bcr组库克隆群体或克隆谱系的变化(例如,克隆群体或谱系扩增、克隆群体或谱系收缩、以相对比率的克隆群体或谱系变化、体细胞超突变和/或类别转换的变化)。在一些实施例中,所提供的方法和组合物用于监测响应于肿瘤治疗的bcr组库克隆群体的变化(例如,克隆群体或谱系扩增、克隆群体或谱系收缩、以相对比率的克隆群体或谱系变化、体细胞超突变和/或类别转换的变化)。在一些实施例中,所提供的方法和组合物用于监测在缓解期间的bcr组库克隆群体或克隆谱系的变化(例如,克隆群体或谱系扩增、克隆群体或谱系收缩、以相对比率的克隆群体或谱系变化、体细胞超突变和/或类别转换的变化)。对于许多淋巴恶性肿瘤,克隆b细胞受体序列可以用作特定癌症(例如,白血病)的恶性细胞的生物标志物并且用于监测残留疾病、肿瘤扩增、收缩和/或治疗应答。在某些实施例中,可以鉴别并进一步表征克隆b细胞受体以确认治疗、生物标志物和/或诊断用途中的新的实用性。
[0225]
在一些实施例中,提供了用于监测受试者中的bcr克隆群体的变化的方法和组合物,所述方法和组合物包括:使用至少一组引物和ii)一个或多个c基因引物用受试者的样品执行一个或多个多重扩增反应,以扩增具有恒定部分和可变部分的bcr核酸模板分子,所述至少一组引物针对包括v基因内的fr1、fr2或fr3的至少一部分的至少一个bcr编码序列的大多数不同v基因,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分;对所得bcr扩增子进行测序;鉴别来自样品的靶bcr的免疫组库克隆群体;以及将所鉴别的bcr组库克隆群体与在不同时间从受试者获得的样品中鉴别的那些克隆群体进行比较。在一些实施例中,提供了用于监测受试者中的bcr克隆群体的变化的方法和组合物,所述方法和组合物包括:使用至少一组引物和多个j基因引物用受试者的样品执行一个或多个多重扩增反应,以扩增具有j基因部分和v基因部分的免疫组库核酸模板分子,所述至少一组引物针对包括v基因内的fr1、fr2或fr3的至少一部分的至少一个bcr编码序列的大多数不同v基因,所述多个j基因引物针对相应靶bcr编码序列的大多数不同j基因;对所得bcr扩增子进行测序;鉴别来自样品的靶bcr的免疫组库克隆群体;以及将所鉴别的免疫组库克隆群体与在不同时间从受试者获得的样品中鉴别的那些克隆群体进行比较。在各个实施例中,在此类方法中执行的所述一个或多个多重扩增反应可以是单一多重扩增反应或可以是并行执行的两个或更多个多重扩增反应,例如用不同的引物池执行的并行高度多重化的扩增反应。用于监测bcr组库克隆群体的变化的样品包含但不限于在诊断之前获得的样品、在诊断的任何阶段获得的样品、在缓解期间获得的样品、在治疗之前的任何时间获得的样品(治疗前的样品),在治疗完成后的任何时间获得的样品(治疗后的样品)和在治疗过程期间获得的样品。
[0226]
在某些实施例中,提供了用于鉴别和/或表征患者的bcr组库以监测患者的过度增殖性疾病的进展和/或治疗的方法和组合物。在一些实施例中,所提供的方法和组合物用于患者治疗后的最小残留疾病(mrd)监测。在一些实施例中,所提供的方法和组合物允许对可用于mrd测量和用于鉴别罕见的bcr克隆的患者bcr组库进行深度测序。在一些实施例中,监测mrd包含评估bcr组库的体细胞超突变。在一些实施例中,方法和组合物用于鉴别和/或跟踪b细胞谱系恶性肿瘤或t细胞谱系恶性肿瘤。在一些实施例中,方法和组合物用于检测和/或监测诊断患有白血病或淋巴瘤的患者的mrd,包含但不限于急性淋巴细胞白血病、慢性髓性白血病、慢性淋巴细胞白血病、慢性髓性白血病、皮肤t细胞淋巴瘤、b细胞淋巴瘤、套细胞
淋巴瘤和多发性骨髓瘤。在一些实施例中,方法和组合物用于检测和/或监测诊断患有实体瘤的患者的mrd,所述实体瘤包含但不限于乳腺癌、肺癌、结肠直肠癌和神经母细胞瘤。在一些实施例中,方法和组合物用于检测和/或监测在癌症治疗之后的患者的mrd,所述癌症治疗包含但不限于骨髓移植、淋巴细胞输注、过继性t细胞疗法、其它基于细胞的免疫疗法和基于抗体的免疫疗法。
[0227]
在一些实施例中,提供了用于鉴别和/或表征患者的bcr组库以监测患者的过度增殖性疾病的进展和/或治疗的方法和组合物,所述方法和组合物包括:使用至少一组引物用来自患者的样品或从样品制备的cdna执行一个或多个多重扩增反应以扩增具有恒定部分和可变部分的bcr核酸模板分子,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区1(fr1)的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)一个或多个c基因引物,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,由此产生bcr扩增子分子。所述方法进一步包括:对所得bcr扩增子分子进行测序;测定bcr扩增子分子的序列;以及从样品中鉴别靶bcr的免疫组库。在特定实施例中,测定免疫受体扩增子分子的序列包含:获得初始序列读段;将初始序列读段与参考序列比对并鉴别生产性读段;校正一个或多个插入缺失错误以产生拯救的生产性序列读段;以及测定所得免疫受体分子的序列。在此类方法和组合物的其它实施例中,使用至少一组引物执行多重扩增反应,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的fr3的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)一个或多个c基因引物,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组。在此类方法和组合物的其它实施例中,使用至少一组引物执行多重扩增反应,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的fr2的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)一个或多个c基因引物,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组。
[0228]
在一些实施例中,提供了用于鉴别和/或表征患者的bcr组库以监测患者的过度增殖性疾病的进展和/或治疗的方法和组合物,所述方法和组合物包括:使用至少一组引物用来自患者的样品或从样品制备的cdna执行一个或多个多重扩增反应以扩增具有j基因部分和v基因部分的免疫组库核酸模板分子,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区3(fr3)的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)多个j基因引物,所述多个j基因引物针对相应靶bcr编码序列的大多数不同j基因,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,由此产生bcr扩增子分子。所述方法进一步包括:对所得bcr扩增子分子进行测序;测定bcr扩增子分子的序列;以及从样品中鉴别靶bcr的免疫组库。具体地,确定免疫受体扩增子分子的序列的实施例包含:获得初始序列读段;向序列读段添加推断的j基因序列以产生延伸的序列读段;将延伸的序列读段与参考序列比对并鉴别生产性读段;校正一个或多个插入缺失错误以产生拯救的生产性序列读段;以及测定所得免疫受体分子的序列。在此类方法和组合物的其它实施例中,使用至少一组引物执行所述多重扩增反应,所述至
少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的fr1的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)多个j基因引物,所述多个j基因引物针对相应靶bcr编码序列的大多数不同j基因引物,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组。在此类方法和组合物的其它实施例中,使用至少一组引物执行多重扩增反应,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的fr2的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)多个j基因引物,所述多个j基因引物针对相应靶bcr编码序列的大多数不同j基因引物,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组。
[0229]
在一些实施例中,提供了用于对患有过度增殖性疾病的患者进行mrd监测的方法和组合物,所述方法和组合物包括:使用至少一组引物和ii)一个或多个c基因引物用患者的样品执行一个或多个多重扩增反应以扩增具有恒定部分和可变部分的bcr核酸模板分子,所述至少一组引物针对包括v基因内的fr1、fr2或fr3的至少一部分的至少一个bcr编码序列的大多数不同v基因,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分;对所得bcr扩增子进行测序;鉴别靶bcr的免疫组库序列;以及检测与过度增殖性疾病相关的样品中一个或多个bcr序列的存在或不存在。在一些实施例中,提供了用于对患有过度增殖性疾病的患者进行mrd监测的方法和组合物,所述方法和组合物包括:使用至少一组引物和多个j基因引物用患者的样品执行一个或多个多重扩增反应以扩增具有j基因部分和v基因部分的免疫组库核酸模板分子,所述至少一组引物针对包括v基因内的fr1、fr2或fr3的至少一部分的至少一个bcr编码序列的大多数不同v基因,所述多个j基因引物针对相应靶bcr编码序列的大多数不同j基因;对所得bcr扩增子进行测序;鉴别靶bcr的免疫组库序列;以及检测与过度增殖性疾病相关的样品中一个或多个免疫受体序列的存在或不存在。在各个实施例中,在此类方法中执行的所述一个或多个多重扩增反应可以是单一多重扩增反应或可以是并行执行的两个或更多个多重扩增反应,例如用不同的引物池执行的并行高度多重化的扩增反应。用于mrd监测的样品包含但不限于在缓解期间获得的样品,在完成治疗后的任何时间获得的样品(治疗后样品)和在治疗过程期间获得的样品。
[0230]
在某些实施例中,提供了用于响应于治疗而鉴别和/或表征受试者的bcr组库的方法和组合物。在一些实施例中,方法和组合物用于在肿瘤治疗之前、期间和/或之后表征和/或监测肿瘤浸润淋巴细胞(til)的群体或克隆。在一些实施例中,分析til的免疫受体组库提供对肿瘤微环境的表征和/或评估。在一些实施例中,用于测定免疫组库的方法和组合物用于鉴别和/或跟踪一个或多个治疗性t细胞群和b细胞群。在一些实施例中,所提供的方法和组合物用于鉴别和/或监测在患者治疗后基于细胞的疗法的持久性,包含但不限于工程化t细胞群的存在(例如,持续存在),所述细胞群包含但不限于car
‑
t细胞群、tcr工程化t细胞群、持续car
‑
t表达,施用的til群体的存在(例如,持续存在),过继性t细胞疗法后的til表达(例如,持续表达)和/或同种异体造血细胞移植之后的免疫重建。
[0231]
在一些实施例中,所提供的方法和组合物用于表征和/或监测在向患者施用基于细胞的疗法后存在于患者样品中的b细胞克隆或群体,所述基于细胞的疗法包含但不限于例如癌症疫苗细胞、car
‑
t、til和/或其它工程化基于细胞的疗法。在一些实施例中,所提供的方法和组合物用于在基于细胞的疗法后表征和/或监测患者样品中的bcr组库,以便评估
和/或监测患者对所施用的基于细胞的疗法的应答。用于在基于细胞的疗法后进行的此类表征和/或监测的样品包含但不限于来自患者的循环血细胞、循环肿瘤细胞、til、组织、cfdna和一个或多个肿瘤样品。
[0232]
在一些实施例中,提供了用于监测对接受此类疗法的患者进行的基于细胞的疗法的方法和组合物,所述方法和组合物包括:使用至少一组引物和ii)一个或多个c基因引物用患者的样品执行一个或多个多重扩增反应以扩增具有恒定部分和可变部分的bcr核酸模板分子,所述至少一组引物针对包括v基因内的fr1、fr2或fr3的至少一部分的至少一个bcr编码序列的大多数不同v基因,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分;对所得bcr扩增子进行测序;鉴别靶bcr的免疫组库序列;以及检测与基于细胞的疗法相关的样品中一个或多个bcr序列的存在或不存在。在一些实施例中,提供了用于监测对接受此类疗法的患者进行的基于细胞的疗法的方法和组合物,所述方法和组合物包括:使用至少一组引物和多个j基因引物用患者的样品执行一个或多个多重扩增反应以扩增具有j基因部分和v基因部分的bcr组库核酸模板分子,所述至少一组引物针对包括v基因内的fr1、fr2或fr3的至少一部分的至少一个bcr编码序列的大多数不同v基因,所述多个j基因引物针对相应靶bcr编码序列的大多数不同j基因;对所得bcr扩增子进行测序;鉴别靶bcr的免疫组库序列;以及检测与基于细胞的疗法相关的样品中一个或多个bcr序列的存在或不存在。
[0233]
在一些实施例中,提供了用于在施用基于细胞的疗法后监测患者的应答的方法和组合物,所述方法和组合物包括:使用至少一组引物和ii)一个或多个c基因引物用受试者的样品执行一个或多个多重扩增反应以扩增具有恒定部分和可变部分的bcr组库核酸模板分子,所述至少一组引物针对包括v基因内的fr1、fr2或fr3的至少一部分的至少一个bcr编码序列的大多数不同v基因,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分;对所得bcr扩增子进行测序;鉴别靶bcr的免疫组库序列;以及将所鉴别bcr组库与在不同时间从患者获得的样品中鉴别的一个或多个免疫受体序列进行比较。在一些实施例中,提供了用于在施用基于细胞的疗法后监测患者的应答的方法和组合物,所述方法和组合物包括:使用至少一组引物和多个j基因引物用患者的样品执行一个或多个多重扩增反应以扩增具有j基因部分和v基因部分的bcr组库核酸模板分子,所述至少一组引物针对包括v基因内的fr1、fr2或fr3的至少一部分的至少一个bcr编码序列的大多数不同v基因,所述多个j基因引物针对相应靶bcr编码序列的大多数不同j基因;对所得bcr扩增子进行测序;鉴别靶bcr的免疫组库序列;以及将所鉴别bcr组库与在不同时间从患者获得的样品中鉴别的一个或多个免疫受体序列进行比较。适于此类监测的基于细胞的疗法包含但不限于car
‑
t细胞、tcr工程化t细胞、til和其它富集的自体细胞。在各个实施例中,在此类方法中执行的所述一个或多个多重扩增反应可以是单一多重扩增反应或可以是并行执行的两个或更多个多重扩增反应,例如用不同的引物池执行的并行高度多重化的扩增反应。用于此类监测的样品包含但不限于在诊断之前获得的样品、在诊断的任何阶段获得的样品、在缓解期间获得的样品、在治疗之前的任何时间获得的样品(治疗前的样品),在治疗完成后的任何时间获得的样品(治疗后的样品)和在治疗过程期间获得的样品。
[0234]
在一些实施例中,用于测定b细胞受体组库或b细胞和t细胞受体组库的方法和组合物用于在治疗之前、期间和/或之后测量和/或评估免疫能力,所述治疗包含但不限于实
体器官移植或骨髓移植。
[0235]
在某些实施例中,所提供的方法和组合物用于响应于治疗性治疗而鉴别和/或表征受试者的bcr组库,所述治疗包含但不限于免疫疗法、抗过敏治疗和抗感染剂治疗。因此,在一些实施例中,所提供的方法和组合物用于鉴别bcr组库或克隆谱系生物标志物或治疗应答的特征,所述治疗应答如对治疗性治疗的有利应答(例如,疫苗接种成功)或有害应答(例如,免疫系统介导的不良事件)。在一些实施例中,提供了用于响应于治疗而鉴别和/或表征的受试者的bcr组库的方法和组合物,所述方法和组合物包括:在开始治疗之后从受试者获得样品;使用至少一组引物用样品或从样品制备的cdna执行一个或多个多重扩增反应以扩增具有恒定部分和可变部分的bcr核酸模板分子,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区1(fr1)的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)一个或多个c基因引物,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,由此产生bcr扩增子分子。所述方法进一步包括:对所得bcr扩增子分子进行测序;测定bcr扩增子分子的序列;以及从样品中鉴别靶bcr的免疫组库。在一些实施例中,所述方法进一步包括将来自在治疗开始后获得的样品的所鉴别的bcr组库与来自在治疗前获得的患者样品的bcr组库进行比较。具体地,测定bcr扩增子分子的序列的实施例包含:获得初始序列读段;将初始序列读段与参考序列比对并鉴别生产性读段;校正一个或多个插入缺失错误以产生拯救的生产性序列读段;以及测定所得免疫受体分子的序列。在此类方法和组合物的其它实施例中,使用至少一组引物执行多重扩增反应,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的fr3的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)一个或多个c基因引物,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组。在此类方法和组合物的其它实施例中,使用至少一组引物执行多重扩增反应,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的fr2的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)一个或多个c基因引物,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组。
[0236]
在一些实施例中,提供了用于响应于治疗而鉴别和/或表征的受试者的bcr组库的方法和组合物,所述方法和组合物包括:在开始治疗之后从受试者获得样品;使用至少一组引物用样品或从样品制备的cdna执行一个或多个多重扩增反应以扩增具有j基因部分和v基因部分的bcr核酸模板分子,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区3(fr3)的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)多个j基因引物,所述多个j基因引物针对相应靶bcr编码序列的大多数不同j基因,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,由此产生bcr扩增子分子。所述方法进一步包括:对所得bcr扩增子分子进行测序;测定bcr扩增子分子的序列;以及从样品中鉴别靶bcr的免疫组库。在一些实施例中,所述方法进一步包括将来自在治疗开始后获得的样品的所鉴别的bcr组库与来自在治疗前获得的患者样品的bcr组库进行比较。具体地,测定bcr扩增子分子的序列的实施例包含:获得初始序列
读段;向序列读段添加推断的j基因序列以产生延伸的序列读段;将延伸的序列读段与参考序列比对并鉴别生产性读段;校正一个或多个插入缺失错误以产生拯救的生产性序列读段;以及测定所得bcr分子的序列。在此类方法和组合物的其它实施例中,使用至少一组引物执行多重扩增反应,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的fr1的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)多个j基因引物,所述多个j基因引物针对相应靶bcr编码序列的大多数不同j基因引物,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组。在此类方法和组合物的其它实施例中,使用至少一组引物执行多重扩增反应,所述至少一组引物包括:i)多个v基因引物,所述多个v基因引物针对包括v基因内的fr2的至少一部分的至少一个bcr编码序列的大多数不同v基因,和ii)多个j基因引物,所述多个j基因引物针对相应靶bcr编码序列的大多数不同j基因引物,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组。
[0237]
在一些实施例中,提供了用于响应于治疗而监测受试者的bcr组库的变化的方法和组合物,所述方法和组合物包括:使用至少一组引物和一个或多个c基因引物用受试者或患者的样品执行一个或多个多重扩增反应,以扩增具有恒定部分和可变部分的bcr核酸模板分子,所述至少一组引物针对包括v基因内的fr1、fr2或fr3的至少一部分的至少一个bcr编码序列的大多数不同v基因,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分;对所得bcr扩增子进行测序;鉴别来自样品的靶bcr的免疫组库序列;以及将所鉴别的bcr组库与在不同时间从受试者获得的样品中鉴别的那些组库进行比较。在一些实施例中,提供了用于响应于治疗而监测受试者的bcr组库的变化的方法和组合物,所述方法和组合物包括:使用至少一组引物和多个j基因引物用受试者或患者的样品执行一个或多个多重扩增反应以扩增具有j基因部分和v基因部分的bcr核酸模板分子,所述至少一组引物针对包括v基因内的fr1、fr2或fr3的至少一部分的至少一个bcr编码序列的大多数不同v基因,所述多个j基因引物针对相应靶bcr编码序列的大多数不同j基因;对所得bcr扩增子进行测序;鉴别来自样品的靶bcr的免疫组库序列;以及将所鉴别的bcr组库与在不同时间从受试者获得的样品中鉴别的组库进行比较。在各个实施例中,在此类方法中执行的所述一个或多个多重扩增反应可以是单一多重扩增反应或可以是并行执行的两个或更多个多重扩增反应,例如用不同的引物池执行的并行高度多重化的扩增反应。用于监测bcr组库变化的样品包含但不限于在诊断之前获得的样品、在诊断的任何阶段获得的样品、在缓解期间获得的样品、在治疗之前的任何时间获得的样品(治疗前的样品),在治疗完成后的任何时间获得的样品(治疗后的样品)和在治疗过程期间获得的样品。
[0238]
在某些实施例中,所提供的方法和组合物用于表征和/或监测与一个或多个免疫系统介导的不良事件相关的bcr组库,所述不良事件包含但不限于与炎性病状、自身免疫性反应和/或自身免疫性疾病或病症相关的那些不良事件。在一些实施例中,所提供的方法和组合物用于鉴别和/或监测与慢性自身免疫性疾病或病症相关的b细胞免疫组库或b细胞和t细胞免疫组库,所述疾病或病症包含但不限于多发性硬化、i型糖尿病、嗜睡症、类风湿性关节炎、强直性脊柱炎、哮喘和sle。在一些实施例中,使用如血液样品等全身性样品测定患有自身免疫性病状的个体的一个或多个免疫组库。在一些实施例中,使用如来自受影响关节或肿胀区的流体样品等局部样品来测定患有自身免疫性病状的个体的一个或多个免疫
组库。在一些实施例中,将在局部或受影响区样品中发现的免疫组库与在全身性样品中发现的免疫组库进行比较可以鉴别所靶向的克隆t或b细胞群进行去除。
[0239]
在一些实施例中,提供了用于鉴别和/或监测与患者的一个或多个免疫系统介导的不良事件的进展和/或治疗相关的bcr组库的方法和组合物,所述方法和组合物包括:使用至少一组引物和一个或多个c基因引物用受试者的样品执行一个或多个多重扩增反应以扩增具有恒定部分和可变部分的bcr组库核酸模板分子,所述至少一组引物针对包括v基因内的fr1、fr2或fr3的至少一部分的至少一个bcr编码序列的大多数不同v基因,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分;对所得bcr扩增子进行测序;鉴别来自样品的靶bcr的免疫组库序列;以及将所鉴别bcr组库与在不同时间从患者获得的样品中鉴别的一个或多个bcr组库进行比较。在一些实施例中,提供了用于鉴别和/或监测与患者的一个或多个免疫系统介导的不良事件的进展和/或治疗相关的bcr组库的方法和组合物,所述方法和组合物包括:使用至少一组引物和多个j基因引物用患者的样品执行一个或多个多重扩增反应以扩增具有j基因部分和v基因部分的bcr核酸模板分子,所述至少一组引物针对包括v基因内的fr1、fr2或fr3的至少一部分的至少一个bcr编码序列的大多数不同v基因,所述多个j基因引物针对相应靶bcr编码序列的大多数不同j基因;对所得bcr扩增子进行测序;鉴别来自样品的靶免疫受体的bcr序列;以及将所鉴别bcr组库与在不同时间从患者获得的样品中鉴别的一个或多个bcr组库进行比较。在各个实施例中,在此类方法中执行的所述一个或多个多重扩增反应可以是单一多重扩增反应或可以是并行执行的两个或更多个多重扩增反应,例如用不同的引物池执行的并行高度多重化的扩增反应。用于监测与免疫系统介导的(一种或多种)不良事件相关联的免疫组库变化的样品包含但不限于在诊断之前获得的样品,在诊断的任何阶段获得的样品,在缓解期间获得的样品,在治疗之前的任何时间获得的样品(治疗前样品),在治疗完成后的任何时间获得的样品(治疗后样品)和在治疗过程中获得的样品。
[0240]
在一些实施例中,提供的方法和组合物用于表征和/或监测与被动免疫相关联的免疫组库,所述被动免疫包含自然获得的被动免疫力和人工获得的被动免疫疗法。例如,提供的方法和组合物可用于鉴别和/或监测保护性抗体,所述保护性抗体在将抗体介导的免疫力转移到受体后向受体提供被动免疫力,包含但不限于怀孕期间从母体传递到胎儿或通过母乳喂养的婴儿或经由向接受者施用抗体传递的抗体介导的免疫力。在另一个实例中,提供的方法和组合物可用于鉴别和/或监测与细胞介导的免疫力被动转移到接受者(如将成熟的循环淋巴细胞施用到与供体组织相容的接受者)相关联的b细胞和/或t细胞免疫组库。在一些实施例中,提供的方法和组合物用于监测在接受者中被动免疫的持续时间。
[0241]
在一些实施例中,所提供的方法和组合物用于表征和/或监测与主动免疫或疫苗接种疗法相关的免疫组库。例如,在暴露于疫苗或感染剂后,所提供的方法和组合物可以用于鉴别和/或监测可以为暴露的个体提供主动免疫的保护性抗体或保护性克隆b细胞群或克隆b细胞和t细胞群。在一些实施例中,所提供的方法和组合物用于监测有助于暴露个体的免疫的b细胞克隆或b细胞和t细胞克隆的持续时间。在一些实施例中,所提供的方法和组合物用于鉴别和/或监测与暴露于细菌、真菌、寄生虫或病毒抗原相关的b细胞和/或t细胞免疫组库。在一些实施例中,所提供的方法和组合物用于鉴别和/或监测与细菌、真菌、寄生虫或病毒感染相关的b细胞和/或t细胞免疫组库。因此,在一些实施例中,所提供的方法和
组合物用于疫苗研发,包含但不限于出于质量或监管目的鉴别和/或表征对疫苗候选物的一个或多个应答,以及评估对疫苗的一个或多个应答。
[0242]
在一些实施例中,提供了用于在暴露于疫苗或感染剂后监测bcr组库的变化的方法和组合物,所述方法和组合物包括:使用至少一组引物和一个或多个c基因引物用暴露的受试者的样品执行一个或多个多重扩增反应,以扩增具有恒定部分和可变部分的bcr组库核酸模板分子,所述至少一组引物针对包括v基因内的fr1、fr2或fr3的至少一部分的至少一个bcr编码序列的大多数不同v基因,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分;对所得bcr扩增子进行测序;鉴别来自样品的靶bcr的免疫组库序列;以及将所鉴别的bcr组库与在不同时间从受试者获得的样品中(例如,在暴露之前或获得所测试的样品之后)鉴别的一个或多个bcr组库进行比较。在一些实施例中,提供了用于在暴露于疫苗或感染剂后监测bcr组库的变化的方法和组合物,所述方法和组合物包括:使用至少一组引物和多个j基因引物用暴露的受试者的样品执行一个或多个多重扩增反应以扩增具有j基因部分和v基因部分的bcr组库核酸模板分子,所述至少一组引物针对包括v基因内的fr1、fr2或fr3的至少一部分的至少一个bcr编码序列的大多数不同v基因,所述多个j基因引物针对相应靶bcr编码序列的大多数不同j基因;对所得bcr扩增子进行测序;鉴别来自样品的靶免疫受体的bcr序列;以及将所鉴别bcr组库与在不同时间从患者获得的样品中鉴别的一个或多个bcr组库进行比较。在某些实施例中,提供了用于在暴露于疫苗或感染剂后监测bcr组库的变化的方法和组合物,所述方法和组合物包括:使用至少一组引物用从暴露的受试者的样品制备的cdna执行一个或多个多重扩增反应以扩增具有恒定部分和可变部分的igh核酸模板分子,所述至少一组引物包括:i)针对包括v基因内的fr1、fr2或fr3的至少一部分的大多数不同igh v基因的多个v基因引物和针对igh c基因的至少一部分的一个或多个c基因引物;对所得bcr扩增子进行测序;鉴别来自样品的包含组库同种型信息的表达的igh组库序列;以及将所鉴别的igh组库与在不同时间从受试者获得的样品中(例如,在暴露之前或获得所测试的样品之后)鉴别的一个或多个igh组库进行比较。在一些实施例中,引物组包括针对单一同种型例如igg的c基因的至少一部分的一个或多个引物。在其它实施例中,引物组包括至少两个引物,每个引物针对两个不同同种型的c基因的至少一部分。在其它实施例中,引物组包括单独针对iga、igd、igg、igm和ige同种型类型的c基因的至少一部分的至少一个引物。因此,方法和组合物可以用于监测b细胞组库的变化(包含同种型类别转换)并评估受试者对疫苗暴露的应答。
[0243]
在某些实施例中,提供了用于在暴露于诱导过敏反应或应答的过敏原或药剂后鉴别和/或表征受试者的ige组库的方法和组合物,所述方法和组合物包括:使用至少一组引物和一个或多个c基因引物用暴露的受试者的样品执行一个或多个多重扩增反应以扩增具有恒定部分和可变部分的igh组库核酸模板分子,所述至少一组引物针对包括v基因内的fr1、fr2或fr3的至少一部分的大多数不同igh v基因,所述一个或多个c基因引物针对ige基因编码序列的至少一部分;对所得igh扩增子进行测序;鉴别来自样品的表达的ige免疫组库序列。在一些实施例中,提供了用于在暴露于诱导过敏反应或应答的过敏原或药剂后监测受试者的ige组库的变化的方法和组合物,所述方法和组合物包括:使用至少一组引物和一个或多个c基因引物用暴露的受试者的样品执行一个或多个多重扩增反应以扩增具有恒定部分和可变部分的igh组库核酸模板分子,所述至少一组引物针对包括v基因内的fr1、
fr2或fr3的至少一部分的大多数不同igh v基因,所述一个或多个c基因引物针对ige基因编码序列的至少一部分;对所得igh扩增子进行测序;鉴别来自样品的表达的ige免疫组库序列;以及将所鉴别的ige组库与在不同时间从受试者获得的样品中(例如,在暴露之前或获得所测试的样品之后)鉴别的一个或多个ige组库进行比较。在一些实施例中,此类方法和组合物的至少一个引物组包括针对如针对igg、igm、iga和/或igd引物等其它igh同种型的至少一部分的另外的c基因引物。在其它实施例中,引物组包括单独针对iga、igd、igg、igm和ige同种型类型的c基因的至少一部分的至少一个引物。因此,方法和组合物可以用于监测总bcr组库内的ige组库的变化(包含同种型类别转换)并评估受试者对过敏原暴露的过敏反应或应答。在一些实施例中,此类方法和组合物用于测定和/或监测组库内的ige表达b细胞的同种型转换起点。
[0244]
在一些实施例中,所提供的方法和组合物用于筛选或表征在体外生长和/或活化的用作免疫治疗剂或在基于免疫治疗的方案中使用的淋巴细胞群。在一些实施例中,所提供的方法和组合物用于筛选或表征在体外生长和/或活化的til群体或其它采集的b细胞群。在一些实施例中,测定bcr的igh序列促进对抗原特异性b细胞进行的鉴别和产生。在一些实施例中,所提供的方法和组合物用于筛选或表征在体外生长和/或活化的例如用于免疫疗法或抗体产生的工程化b细胞群。在一些实施例中,所提供的方法和组合物用于例如出于质量控制或监管测试目的在用于制造工程化细胞制备的离体工作流程期间通过监测bcr组库来评估细胞群。
[0245]
在一些实施例中,如本文所述的所鉴别的新颖或非经典的bcr等位基因的序列可以用于产生重组bcr核酸或分子。在一些实施例中,所提供的方法和组合物用于筛选和/或产生重组抗体文库。所提供的涉及鉴别bcr的组合物可以用于快速评估重组抗体文库大小和组合物以鉴别所关注的抗体。
[0246]
在一些实施例中,分析如本文提供的免疫受体组库可以与分析免疫应答基因表达组合以提供对肿瘤微环境进行的表征。在一些实施例中,将肿瘤样品的bcr组库谱与靶向免疫应答基因表达谱组合或关联提供对肿瘤微环境的更彻底的分析并且可以建议或提供免疫疗法治疗的指导。
[0247]
用于分析的合适的细胞包含但不限于各种造血细胞、淋巴细胞和肿瘤细胞,如外周血单核细胞(pbmc)、t细胞、b细胞、循环肿瘤细胞和肿瘤浸润淋巴细胞(til)。表达免疫球蛋白的淋巴细胞包含前b细胞、b细胞,例如记忆b细胞和浆细胞。表达t细胞受体的淋巴细胞包含胸腺细胞、nk细胞、前t细胞和t细胞,其中t细胞的许多亚群是本领域已知的,例如th1、th2、th17、ctl、t reg等。例如,在一些实施例中,包括pbmc的样品可以用作抗体免疫组库分析的来源。样品可以含有例如淋巴细胞、单核细胞和巨噬细胞以及抗体和其它生物成分。
[0248]
对bcr组库的分析对于涉及细胞增殖和抗原暴露的病状是有意义的,所述病状包含但不限于癌症的存在、暴露于癌抗原、暴露于来自感染剂的抗原、暴露于疫苗、暴露于过敏原、暴露于食物、移植物或植入物的存在以及自身免疫性活动或疾病的存在。与免疫缺陷相关的病状还对分析具有意义,所述病状包含先天性和后天性免疫缺陷综合征。
[0249]
所关注的b细胞谱系恶性肿瘤包含但不限于多发性骨髓瘤;急性淋巴细胞白血病(all);复发/难治性b细胞all、慢性淋巴细胞白血病(cll);弥漫性大b细胞淋巴瘤;粘膜相关淋巴组织淋巴瘤(malt);小细胞淋巴细胞淋巴瘤;套细胞淋巴瘤(mcl);伯基特(burkitt)
淋巴瘤;纵隔大b细胞淋巴瘤;瓦尔登斯特伦巨球蛋白血症(macroglobulinemia);淋巴结边缘区b细胞淋巴瘤(nmzl);脾边缘区淋巴瘤(smzl);血管内大b细胞淋巴瘤;原发性渗出性淋巴瘤;淋巴瘤样肉芽肿病等。非恶性b细胞过度增殖性病状包含单克隆b细胞淋巴细胞增多症(mbl)。
[0250]
所关注的t细胞谱系恶性肿瘤包含但不限于前体t细胞淋巴母细胞淋巴瘤;t细胞幼淋巴细胞白血病;t细胞颗粒淋巴细胞白血病;侵袭性nk细胞白血病;成人t细胞淋巴瘤/白血病(htlv 1
‑
阳性);结外nk/t细胞淋巴瘤;肠病型t细胞淋巴瘤;肝脾型γδt细胞淋巴瘤;皮下脂膜炎样t细胞淋巴瘤;蕈样肉芽肿/sezary综合征;间变性大细胞淋巴瘤、t/裸细胞;外周t细胞淋巴瘤;血管免疫母细胞性t细胞淋巴瘤;慢性淋巴细胞白血病(cll);急性淋巴细胞白血病(all);幼淋巴细胞白血病;和毛细胞白血病。
[0251]
所关注的其它恶性肿瘤包含但不限于急性髓性白血病、头颈癌、脑癌、乳腺癌、卵巢癌、宫颈癌、结肠直肠癌、子宫内膜癌、胆囊癌、胃癌、膀胱癌、前列腺癌、睾丸癌、肝癌、肺癌、肾(肾细胞)癌、食管癌、胰腺癌、甲状腺癌、胆管癌、垂体肿瘤、威耳姆氏瘤(wilms tumor)、卡波西肉瘤(kaposi sarcoma)、骨肉瘤、胸腺癌、皮肤癌、心脏癌、口腔和咽喉癌症、神经母细胞瘤和非霍奇金淋巴瘤(non
‑
hodgkin lymphoma)。
[0252]
关注神经炎性病状,例如阿尔茨海默氏病(alzheimer's disease)、帕金森氏病(parkinson's disease)、卢伽雷氏病(lou gehrig's disease)等,以及脱髓鞘疾病,如多发性硬化、慢性炎性脱髓鞘多神经病等,以及炎性病状如类风湿性关节炎。系统性红斑狼疮(sle)为自身免疫性疾病,其特征在于多克隆b细胞活化,其产生多种抗蛋白和非蛋白自身抗体(参见kotzin等人(1996)《细胞(cell)》85:303
‑
306)。这些自身抗体形成免疫复合体,其沉积在多个器官系统中,导致组织损伤。自身免疫组分可归因于动脉粥样硬化,其中候选自身抗原包含hsp60、氧化的ldl和2
‑
糖蛋白i(2gpi)。
[0253]
用于本文所述方法的样品可为从患有恶性肿瘤或过度增殖性病状的受试者收集的样品,包含淋巴瘤、白血病和浆细胞瘤。淋巴瘤为淋巴细胞来源的固体肿瘤,并且最常见于淋巴组织中。因此,例如,来自含有此类淋巴瘤的淋巴结(例如扁桃体)的活组织检查将构成合适的活组织检查。可以在疾病进展和/或疾病治疗的一个或多个时间点从受试者或患者获得样品。
[0254]
在一些实施例中,本公开提供了使用具有可切割基团的引物对具有多个表达的免疫受体靶序列的cdna样品进行靶特异性多重pcr的方法。
[0255]
在某些实施例中,待测序的文库和/或模板制剂使用自动化系统,例如ion chef
tm
系统,使用本文提供的组合物从核酸样品群自动制备。
[0256]
如本文所用,术语“受试者”包含人、患者、个体、被评定的人等。
[0257]
如本文所用,术语“包括(comprises/comprising)”、“包含(includes/including)”、“具有(has/having)”或其任何其它变化形式打算涵盖非排它性的包含。例如,包括一系列特征的过程、方法、物品或设备不必仅限于那些特征,但是可以包含未明确列出的或此类过程、方法、物品或设备所固有的其它特征。进一步地,除非明确相反地陈述,否则“或”是指包含性的或而不是排它性的或。
[0258]
如本文所用,“抗原”是指当被引入例如受试者体内时可刺激免疫应答的任何物质,如产生识别抗原的抗体或t细胞受体。抗原包含分子,如核酸、脂质、核糖核蛋白复合体、
蛋白质复合体、蛋白质、多肽、肽和此类分子的天然存在的或合成的修饰,对所述分子可产生涉及t和/或b淋巴细胞的免疫应答。关于自身免疫性疾病,本文的抗原通常称为自身抗原。关于过敏性疾病,本文的抗原通常称为过敏原。自身抗为是由可为免疫应答的靶的生物体产生的任何分子,包含在生物体基因组内编码的肽、多肽和蛋白质以及这些肽、多肽和蛋白质的翻译后产生的修饰。此类分子还包含碳水化合物、脂质和由生物体产生的其它分子。抗原还包含疫苗抗原,其包含但不限于病原体抗原、癌症相关抗原、过敏原等。
[0259]
如本文所用,“扩增(amplify/amplifying)”或“扩增反应”和其衍生词是指复制或拷贝至少一部分核酸分子(称为模板核酸分子)到至少一种另外的核酸分子中的任何作用或过程。另外的核酸分子任选地包含与模板核酸分子的至少一些部分基本上相同或基本上互补的序列。模板核酸分子可为单链或双链并且另一个核酸分子可独立地为单链或双链。在一些实施例中,扩增包含模板依赖性体外酶催化反应,其用于制备核酸分子的至少某一部分的至少一个拷贝或制备与核酸分子的至少某一部分互补的核酸序列的至少一个拷贝。扩增任选地包含核酸分子的线性或指数复制。在一些实施例中,使用等温条件进行此类扩增;在其它实施例中,此类扩增可以包含热循环。在一些实施例中,扩增为多重扩增,其包含在单次扩增反应中同时扩增多个靶序列。至少一些靶序列可单次扩增反应中所包含的相同核酸分子或不同靶核酸分子上。在一些实施例中,“扩增”包含单独或呈组合形式的基于dna和rna的核酸的至少某一部分的扩增。扩增反应可以包含单链或双链核酸底物并且可以进一步包含本领域的普通技术人员已知的扩增方法中的任何扩增方法。在一些实施例中,扩增反应包含pcr。
[0260]
本文所用的“扩增条件”及其衍生词是指适于扩增一个或多个核酸序列的条件。此类扩增可为线性或指数的。在一些实施例中,扩增条件可以包含等温条件或可替代地可以包含热循环条件或等温和热循环条件的组合。在一些实施例中,适于扩增一个或多个核酸序列的条件包含pcr条件。通常,扩增条件是指足以扩增如一个或多个靶序列的核酸或扩增接合到一个或多个衔接子的扩增的靶序列(例如,衔接子接合的扩增的靶序列)的反应混合物。扩增条件包含用于扩增或用于核酸合成的催化剂,例如聚合酶;与待扩增的核酸具有一定程度的互补的引物;以及核苷酸,如脱氧核糖核苷酸三磷酸酯(dntp),以促进与核酸杂交之后引物的延伸。扩增条件需要引物与核酸的杂交或粘接,引物的延伸和变性步骤,其中延伸的引物与经历扩增的核酸序列分离。通常但未必,扩增条件可以包含热循环,在一些实施例中,扩增条件包含多个循环,其中重复粘接、延伸和分离步骤。通常,扩增条件包含阳离子,如mg
2+
或mn
2+
(例如mgcl2等),并且还可以包含多种离子强度调节剂。
[0261]
如本文中所使用,“靶序列”或“目标靶序列”和其派生词指可根据本公开扩增或合成的任何单链或双链核酸序列,包含怀疑或预期样品中存在的任何核酸序列。在一些实施例中,在添加靶特异性引物或附接衔接子之前,靶序列以双链形式存在并且包含待扩增或合成的特定核苷酸序列的至少一部分或其补体。靶序列可以包含可与适用于扩增或合成反应的引物在聚合酶延伸之前杂交的核酸。在一些实施例中,所述术语指核酸序列,其序列一致性、核苷酸的次序或位置由本公开的方法中的一种或多种确定。
[0262]
如本文中所定义,“样品”和其衍生词以其最广泛含义使用并且包含任何怀疑包含靶的标本、培养物等。在一些实施例中,样品包括cdna、rna、pna、lna、嵌合、杂交或多重形式的核酸。样品可以包含任何含有一个或多个核酸的基于生物、临床、手术、农业、大气压或水
生的标本。所述术语还包含任何经分离的核酸样品,例如表达rna、新鲜冷冻或福尔马林(formalin)固定石蜡包埋的核酸标本。
[0263]
如本文中所使用,当关于两种或更多种组分使用时,“接触”和其派生词是指用于促进或实现参考组分的接近、靠近、混合物或共混而未必需要此类组分的物理接触的任何过程,并且包含含有所述参考组分中的任一种或多种的溶液的彼此混合。所提及的组分可以任何特定顺序或组合接触并且组分引述的特定顺序不具限制性。例如,“使a与b和c接触”涵盖其中a首先与b接触,然后与c接触的实施例,以及其中c与a接触,然后与b接触的实施例,以及其中a和c的混合物与b接触的实施例等。此外,此类接触不一定要求接触过程的最终结果是包含所有提及组分的混合物,只要在接触过程中的某些时间点,所有提及组分同时存在或同时包含在同一混合物或溶液中。当待接触的一个或多个提及组分包含多个(例如,“使靶序列与多个靶特异性引物和聚合酶接触”)时,所述多个中的每个成员可以被视为接触过程的单个组分,使得接触可以包含多个中的任何一个或多个成员与多个中的任何其它成员和/或与任何其它提及组分以任何顺序或组合接触(例如,多个靶特异性引物中的一些但不是全部可以接触靶序列,然后是聚合酶,然后与多个靶特异性引物的其它成员接触)。
[0264]
如本文中所使用,术语“引物”和其派生物指可与相关靶序列杂交的任何多核苷酸。在一些实施例中,引物也可用于引发核酸合成。通常,引物充当底物,其上可由聚合酶聚合核苷酸;然而,在一些实施例中,引物可变得并入合成的核酸链中并且提供另一引物可杂交的位点以引发与所合成的核酸分子互补的新链的合成。引物可以包含核苷酸或其类似物的任何组合,其可任选地连接以形成任何适合长度的线性聚合物。在一些实施例中,引物为单链寡核苷酸或多核苷酸。(在本公开中,术语“多核苷酸”和“寡核苷酸”在本文中可互换地使用并且未必指示两个核苷酸之间长度的任何差异)。在一些实施例中,引物为单链,但其也可为双链。引物任选地天然产生,如在纯化的限制消化中,或可以合成方式产生。在一些实施例中,当暴露于扩增或合成条件时,引物充当用于扩增或合成的起始点;此类扩增或合成可以模板依赖性方式进行并且任选地形成与至少一部分靶序列互补的引物延伸产物。示例性扩增或合成条件可以包含使引物与多核苷酸模板(例如包含靶序列的模板)、核苷酸和诱导剂(如聚合酶)在适合的温度和ph值下接触,以诱导靶特异性引物的末端上核苷酸的聚合。如果为双链,那么在用于制备引物延伸产物之前,可任选地处理引物以分离其链。在一些实施例中,引物为寡脱氧核苷酸或寡核糖核苷酸。在一些实施例中,引物可以包含一个或多个核苷酸类似物。靶特异性引物的确切长度和/或组成(包含序列)可影响许多特性,包含熔融温度(t
m
)、gc含量、次要结构的形成、重复核苷酸主结构、所预测的引物延伸产物的长度、跨越相关核酸分子的覆盖度的程度、单次扩增或合成反应中的引物数目、引物内是否存在核苷酸类似物或经修饰的核苷酸等。在一些实施例中,引物可在扩增或合成反应内与相容的引物配对以形成由正向引物和反向引物组成的引物对。在一些实施例中,引物对的正向引物包含基本上与核酸分子的一个链的至少一部分互补的序列,并且引物对引物的反向引物包含基本上与所述链的至少一部分一致的序列。在一些实施例中,正向引物和反向引物能够与核酸双螺旋的相对链杂交。任选地,正向引物引发第一核酸链的合成,并且反向引物引发第二核酸链的合成,其中第一和第二链基本上彼此互补,或可杂交以形成双链核酸分子。在一些实施例中,扩增或合成产物的一端由正向引物定义并且扩增或合成产物的另
一端由反向引物定义。在一些实施例中,当需要扩增或合成冗长引物延伸产物(如扩增外显子、编码区或基因)时,可产生若干引物对而非跨越所需长度以实现所述区的足够扩增。在一些实施例中,引物可以包含一个或多个可切割基团。在一些实施例中,引物长度在约10到约60个核苷酸、约12到约50个核苷酸和约15到约40个核苷酸长度范围内。通常,当在存在dntp和聚合酶的情况下暴露于扩增条件时,引物能够与对应的靶序列杂交并且进行引物延伸。在一些实施例中,引物在引物内的一个或多个位置包含一个或多个可切割基团。
[0265]
如本文所用,“靶特异性引物”和其衍生词指单链或双链多核苷酸,通常为寡核苷酸,其包含至少一个与包含靶序列的核酸分子的至少一部分至少50%互补,通常至少75%互补或至少85%互补,更通常至少90%互补,更通常至少95%互补,更通常至少98%或至少99%互补或一致的序列。在此类情况下,靶特异性引物和靶序列描述成彼此“对应”。在一些实施例中,靶特异性引物能够与其对应靶序列的至少一部分(或靶序列的补体)杂交;此类杂交可任选地在标准杂交条件下或在严格杂交条件下进行。在一些实施例中,靶特异性引物不能与靶序列或其补体杂交,但能够与包含靶序列的核酸链的一部分或其补体杂交。在一些实施例中,靶特异性引物包含至少一个与靶序列本身的至少一部分至少75%互补,通常至少85%互补,更通常至少90%互补,更通常至少95%互补,更通常至少98%互补或更通常至少99%互补的序列;在其它实施例中,靶特异性引物包含至少一个与除靶序列以外的核酸分子的至少一部分至少75%互补,通常至少85%互补,更通常至少90%互补,更通常至少95%互补,更通常至少98%互补或更通常至少99%互补的序列。在一些实施例中,靶特异性引物基本上不与存在于样品中的其它靶序列互补;任选地,靶特异性引物基本上不与存在于样品中的其它核酸分子互补。在一些实施例中,存在于样品中的不包含或对应于靶序列(或靶序列的补体)的核酸分子称为“非特异性”序列或“非特异性核酸”。在一些实施例中,靶特异性引物被设计成包含基本上与其对应靶序列的至少一部分互补的核苷酸序列。在一些实施例中,靶特异性引物与包含其对应靶序列的核酸分子的至少一部分至少95%互补或至少99%互补或一致(跨越其全部长度)。在一些实施例中,靶特异性引物与其对应靶序列的至少一部分至少90%、至少95%互补、至少98%互补或至少99%互补或一致(跨越其全部长度)。在一些实施例中,正向靶特异性引物和反向靶特异性引物定义靶特异性引物对,其用于经由模板依赖性引物延伸来扩增靶序列。通常,靶特异性引物对的每个引物包含至少一个与包含对应靶序列的核酸分子的至少一部分基本上互补,但与在样品中的至少一个其它靶序列小于50%互补的序列。在一些实施例中,扩增在单次扩增反应中使用多个靶特异性引物对进行,其中每个引物对包含正向靶特异性引物和反向靶特异性引物,各自包含至少一个与在样品中的对应靶序列基本上互补或基本上相同的序列,并且每个引物对具有不同的对应靶序列。在一些实施例中,靶特异性引物在其3'端或其5'端与扩增反应中的任何其它靶特异性引物为基本上不互补的。在一些实施例中,靶特异性引物可以包含扩增反应中与其它靶特异性引物的最小交叉杂交。在一些实施例中,靶特异性引物包含在扩增反应混合物中与非特异性序列的最小交叉杂交。在一些实施例中,靶特异性引物包含最小自身互补。在一些实施例中,靶特异性引物可以包含位于3'端的一个或多个可切割基团。在一些实施例中,靶特异性引物可以包含位于靶特异性引物的中心核苷酸附近或周围的一个或多个可切割基团。在一些实施例中,更多个靶特异性引物之一仅包含在靶特异性引物的5'端处的不可裂解核苷酸。在一些实施例中,任选地在相同扩增反应中,与一个或多个不同
靶特异性引物相比,靶特异性引物包含引物的3'端或5'端处的最小核苷酸序列重叠。在一些实施例中,在单一反应混合物中的1、2、3、4、5、6、7、8、9、10种或更多种靶特异性引物包含以上实施例中的一个或多个。在一些实施例中,在单一反应混合物中基本上所有的多种靶特异性引物包含以上实施例中的一个或多个。
[0266]
如本文所用,“聚合酶”和其衍生词指可催化核苷酸(包含其类似物)聚合成核酸链的任何酶。通常但未必,此类核苷酸聚合可以模板依赖性方式进行。此类聚合酶可以包含但不限于天然存在的聚合酶和其任何亚基和截断、突变聚合酶、变异聚合酶、重组、融合或以其它方式工程化的聚合酶、化学修饰的聚合酶、合成分子或组件以及保留催化此类聚合的能力的任何类似物、衍生物或其碎片。任选地,聚合酶为包括一个或多个突变的突变型聚合酶,所述突变涉及用其它氨基酸替换一个或多个氨基酸,来自聚合酶的一个或多个氨基酸的插入或缺失或两个或更多个聚合酶的部分的连接。通常,聚合酶包括可进行核苷酸结合和/或核苷酸聚合催化的一个或多个活性位点。一些示例性聚合酶包含但不限于dna聚合酶和rna聚合酶。如本文所用,术语“聚合酶”和其变化形式还指包括至少两个彼此连接的部分的融合蛋白质,其中第一部分包括可催化核苷酸聚合成核酸链的肽并且所述第一部分连接到包括第二多肽的第二部分。在一些实施例中,第二多肽可以包含报导子酶或增强持续合成能力的结构域。任选地,聚合酶可具有5'外切核酸酶活性或末端转移酶活性。在一些实施例中,聚合酶任选地再活化,例如通过使用热、化学物质或将新的量的聚合酶再添加到反应混合物中。在一些实施例中,聚合酶可以包含任选地再活化的热起始聚合酶或基于适体的聚合酶。
[0267]
如本文所用,术语“核苷酸”和其衍生词包括任何可选择性结合于聚合酶或通过聚合酶聚合的化合物,包含但不限于任何天然存在的核苷酸或其类似物。通常但未必,核苷酸与聚合酶的选择性结合后面是核苷酸通过聚合酶聚合成核酸链;然而偶尔,核苷酸可从聚合酶解离而不变得并入到核酸链中。此类核苷酸不仅包含天然存在的核苷酸,而且包含可与聚合酶选择性结合或可通过聚合酶聚合的任何类似物(与其结构无关)。虽然天然存在的核苷酸通常包括碱基、糖和磷酸酯部分,但本公开的核苷酸可以包含不具有此类部分中的任一个、一些或全部的化合物。在一些实施例中,核苷酸可任选地包含包括三个、四个、五个、六个、七个、八个、九个、十个或更多个磷原子的磷原子链。在一些实施例中,磷链连接到糖环的任何碳,如5'碳。可以用中间的o或s将磷链与糖连接。在一个实施例中,链中的一个或多个磷原子可以是具有p和o的磷酸基的一部分。在另一个实施例中,链中的磷原子用中间的o、nh、s、亚甲基、经取代亚甲基、亚乙基、经取代亚乙基、cnh2、c(o)、c(ch2)、ch2ch2、或c(oh)ch2r(其中r可以为4
‑
吡啶或1
‑
咪唑)连接在一起。在一个实施例中,链中的磷原子具有含o、bh3或s的侧基。在磷链中,具有除o之外的侧基的磷原子可以是经取代的磷酸基。在磷链中,具有除o之外的中间原子的磷原子可以是经取代的磷酸基。核苷酸类似物的一些实例描述于美国专利第7,405,281号中。在一些实施例中,核苷酸包括标记并且在本文中被称为“标记的核苷酸”;标记的核苷酸的标记在本文中被称为“核苷酸标记”。在一些实施例中,标记呈连接到末端磷酸基团,即距离糖最远的磷酸基团的荧光染料的形式。可以用于所公开的方法和组合物中的核苷酸的一些实例包含但不限于核糖核苷酸、脱氧核糖核苷酸、经修饰的核糖核苷酸、经修饰的脱氧核糖核苷酸、核糖核苷酸聚磷酸、脱氧核糖核苷酸聚磷酸、经修饰的核糖核苷酸聚磷酸、经修饰的脱氧核糖核苷酸聚磷酸、肽核苷酸、经修饰的肽核苷
酸、金属核苷酸、膦酸核苷酸和经修饰的磷酸
‑
糖主链核苷酸,前述化合物的类似物、衍生物或变体等。在一些实施例中,核苷酸可以包括非氧部分(如硫基或硼烷部分)代替氧部分,所述氧部分桥连核苷酸的α磷酸酯与糖,或核苷酸的α与β磷酸酯,或核苷酸的β与γ磷酸酯,或在核苷酸的任何其它两种磷酸酯之间,或其任何组合。“核苷酸5'
‑
三磷酸”是指在5'位置具有三磷酸酯基并且有时表示为“ntp”或“dntp”和“ddntp”以特别指出核糖的结构特征的核苷酸。三磷酸酯基可以包含硫取代各种氧,例如α
‑
硫基
‑
核苷酸5'
‑
三磷酸。关于核酸化学的综述,参见:shabarova,z.和bogdanov,a.,《核酸的高级有机化学(advanced organic chemistry of nucleic acids)》,德国化学学会出版社(vch),纽约(new york),1994。
[0268]
如本文所用,当关于既定引物使用时,术语“延伸”和其衍生词包括涉及一个或多个核苷酸在现有核酸分子的端上的聚合的既定聚合酶的任何体内或体外酶促活性特征。通常但未必,此类引物延伸以模板依赖性方式进行;在模板依赖性延伸期间,通过既定碱基配对规则进行碱基的排序和选择,所述规则可以包含沃森
‑
克里克型碱基配对规则,或替代地(并且尤其在涉及核苷酸类似物的延伸反应的情况下)通过一些其它类型的碱基配对范例进行。在一个非限制性实例中,延伸通过聚合酶经由核酸分子的3'oh端上核苷酸的聚合进行。
[0269]
如本文所用,术语“部分”和其衍生词,当用于提及给定的核酸分子例如引物或模板核酸分子时,在核酸分子的长度(包含核酸分子的部分或全部长度)内包括任何数目的连续核苷酸。
[0270]
如本文所用,术语“同一性”和“相同的”和其衍生词,当用于提及两个或更多个核酸序列时,是指两个或更多个序列(例如,核苷酸或多肽序列)的序列相似性。在两种或更多种同源序列的情况下,序列或其子序列的一致性或同源性百分比指示相同(即,约70%一致性,优选地75%、80%、85%、90%、95%、98%或99%一致性)的全部单体单元(例如,核苷酸或氨基酸)的百分比。一致性百分比可在规定区内,当出于比较窗内的最大对应而比较和比对时,或在指定区内,如使用blast或blast 2.0序列比较算法用下文所描述的默认参数或通过手动比对和目视检查所测量。当氨基酸水平或核苷酸水平存在至少85%一致性时,序列被称为“基本上一致”。优选地,一致性存在于至少约25、50或100个残基长的区内或至少一个所比较的序列的整个长度上。用于确定序列一致性百分比和序列类似性的典型算法为blast和blast 2.0算法,其描述于altschul等人,《核算研究(nuc.acids res.)》25:3389
‑
3402(1977)中。其它方法包含smith和waterman,《应用数学进展(adv.appl.math.)》2:482(1981),以及needleman和wunsch《分子生物学期刊》48:443(1970)的算法等。两个核酸序列基本上相同的另一个指示是所述两个分子或其补体在严格杂交的条件下彼此杂交。
[0271]
本文所用的术语“互补”和“补体”及其变体是指可以在反平行朝向中(如在杂交双链体中)的两个或更多个独立对应位置处进行累积碱基配对的任何两个或更多个核酸序列(例如,模板核酸分子、靶序列和/或引物的部分或整体)。此类碱基配对可根据任何现有规则集合进行,例如根据沃森
‑
克里克碱基配对规则或根据一些其它碱基配对范例。任选地,在第一与第二核酸序列之间可存在“完全”或“总体”互补,其中在第一核酸序列中的每个核苷酸可进行与第二核酸序列上的对应的反平行位置中的核苷酸的稳定化碱基配对相互作用。“部分”互补描述一个核酸序列的至少20%但少于100%的残基与在另一个核酸序列中的残基互补的核酸序列。在一些实施例中,一个核酸序列的至少50%但少于100%的残基与
dna连接酶可在约70℃
‑
72℃的温度下在核酸之间连接切口。
[0276]
如本文所用,“平末端接合”和其衍生词指两个平末端双链核酸分子彼此接合。“平末端”指其中核酸分子的一个链端中的基本上所有核苷酸与同一个核酸分子的另一个链中的相对核苷酸碱基配对的双链核酸分子的端。如果核酸分子具有包含长度大于两个核苷酸的单链部分的端(本文中称为“突出”),那么其不是平末端的。在一些实施例中,核酸分子的端不包含任何单链部分,使得端的一个链中的每个核苷酸与同一个核酸分子的另一个链中的相对核苷酸碱基配对。在一些实施例中,变成彼此接合的两个平末端核酸分子的端不包含任何重叠、共有或互补序列。通常,平末端接合不包含使用其它寡核苷酸衔接子帮助双链扩增的靶序列与双链衔接子的接合,如美国专利公开第2010/0129874号中所描述的补丁寡核苷酸。在一些实施例中,平末端接合包含用于密封在接合过程期间产生的切口的切口平移反应。
[0277]
如本文中所使用,术语“衔接子”或“衔接子和其补体”以及其派生词指任何接合到本公开的核酸分子的线形寡核苷酸。任选地,衔接子包含基本上不与样品内至少一个靶序列的3'端或5'端互补的核酸序列。在一些实施例中,衔接子基本上不与样品中任何靶序列的3'端或5'端互补。在一些实施例中,衔接子包含任何基本上不与扩增的靶序列互补的单链或双链线性寡核苷酸。在一些实施例中,衔接子基本上不与样品的至少一个、一些或全部核酸分子互补。在一些实施例中,合适的衔接子长度在长度为约10
‑
100个核苷酸、约12
‑
60个核苷酸和约15
‑
50个核苷酸的范围内。衔接子可以包含核苷酸和/或核酸的任何组合。在一些实施例中,衔接子可以在一个或多个位置处包含一个或多个可切割基团。在另一个实施例中,衔接子可以包含与引物(例如通用引物)的至少一部分基本上相同或基本上互补的序列。通用扩增引物的结构和性质是本领域的技术人员公知的并且可以被实施为结合所提供的方法和组合物利用以适应具体分析平台(例如,如本文所述的通用p1引物和a引物已经在本领域中描述并用于在离子激流测序平台上进行测序)。类似地,本领域描述和已知的另外和其它通用衔接子/引物序列(例如,依诺米那通用衔接子/引物序列、太平洋生物科学通用衔接子/引物序列等)可以与本文提供的方法和组合物结合使用。在一些实施例中,衔接子可以包含条形码或标签以辅助下游编目、鉴别或测序。在一些实施例中,当接合到经扩增的靶序列时,尤其在存在聚合酶和dntp的情况下,在合适的温度和ph值下,单链衔接子可以充当用于扩增的底物。
[0278]
在一些实施例中,通过平末端接合将衔接子接合到多核苷酸。在其它实施例中,经由衔接子和多核苷酸端上的核苷酸突出将衔接子接合到多核苷酸。对于突出接合,如果待接合的衔接子的多核苷酸(例如,扩增子)具有添加到相应链的3'和/或5'端的互补突出,那么衔接子可在相应链的3'和/或5'端添加核苷酸突出。例如,腺嘌呤核苷酸可添加到端拯救的pcr产物的3'端。具有由胸腺嘧啶核苷酸形成的突出的衔接子然后可与扩增子的a
‑
突出对接,并通过dna连接酶如t4 dna连接酶接合到扩增子上。
[0279]
如本文所用,“再扩增(reamplifying或reamplification)”和其衍生词是指经由任何适合的扩增过程进一步扩增至少一部分扩增的核酸分子的任何过程(在一些实施例中称为“二级”扩增或“再扩增”),从而产生再扩增的核酸分子。二级扩增不需要与产生扩增的核酸分子的原始扩增过程相同;也不需要再扩增的核酸分子与扩增的核酸分子完全相同或完全互补;所需要的只是再扩增的核酸分子包含至少一部分扩增的核酸分子或其补体。例
如,再扩增可涉及使用不同的扩增条件和/或不同的引物,包含与初级扩增不同的靶特异性引物。
[0280]
如本文中所定义,“可切割基团”指在并入核酸后可在适当条件下裂解的任何部分。例如,可以将可切割基团并入样品的引物、扩增的序列、衔接子或核酸分子中。在示例性实施例中,靶特异性引物可以包含可切割基团,其变成并入扩增的产物中并且随后在扩增之后裂解,从而从扩增的产物去除一部分或所有靶特异性引物。可切割基团可裂解或以其它方式通过任何可接受的手段从样品的靶特异性引物、扩增的序列、衔接子或核酸分子去除。例如,可以通过酶促、热学、光氧化或化学处理从样品的靶特异性引物、扩增序列、衔接子或核酸分子中去除可切割基团。在一个实施例中,可切割基团可以包含非天然存在的核碱基。例如,寡核糖核苷酸可以包含一个或多个rna核碱基,如可以通过尿嘧啶糖基化酶去除的尿嘧啶。在一些实施例中,可切割基团可以包含一个或多个修饰的核碱基(如7
‑
甲基鸟嘌呤、8
‑
侧氧基
‑
鸟嘌呤、黄嘌呤、次黄嘌呤、5,6
‑
二氢尿嘧啶或5
‑
甲基胞嘧啶)或一个或多个修饰的核苷(即,7
‑
甲基鸟苷、8
‑
侧氧基
‑
脱氧鸟苷、黄嘌呤核苷、肌苷、二氢尿苷或5
‑
甲基胞啶)。可通过酶促、化学或热学手段从核酸去除修饰的核碱基或核苷酸。在一个实施例中,可切割基团可以包含在暴露于紫外光(即,溴脱氧尿苷)时,可在扩增(或合成)之后从引物去除的部分。在另一个实施例中,可切割基团可以包含甲基化胞嘧啶。通常,甲基化胞嘧啶可由引物裂解,例如在诱导扩增(或合成)之后、在亚硫酸氢钠处理时。在一些实施例中,可裂解部分可以包含限制位点。例如,引物或靶序列可以包含对一种或多种限制酶具有特异性的核酸序列,并且在扩增(或合成)之后,引物或靶序列可用一种或多种限制酶处理使得去除可切割基团。通常,可在一个或多个位置包含一个或多个可切割基团以及样品的靶特异性引物、扩增的序列、衔接子或核酸分子。
[0281]
如本文所用,“裂解步骤”和其衍生词是指可切割基团从样品的靶特异性引物、扩增的序列、衔接子或核酸分子裂解或以其它方式去除的任何过程。在一些实施例中,裂解步骤可以涉及化学、热学、光氧化或消化过程。
[0282]
如本文所用,术语“杂交”符合其在所属领域中的用途,并且指用于使两个核酸分子进行碱基配对相互作用的方法。当一个核酸分子的任何部分与另一个核酸分子的任何部分碱基配对时,两个核酸分子分子称为杂交;未必需要两个核酸分子跨越其全部相应长度杂交,并且在一些实施例中,至少一个核酸分子可以包含不与另一个核酸分子杂交的部分。短语“在严格条件下杂交”和其衍生词是指可在存在高杂交温度和低离子强度的条件下进行靶特异性引物与靶序列的杂交的条件。在一个示例性实施例中,严格杂交条件包含在约60℃
‑
68℃下含有约30mm硫酸镁、约300mm tris
‑
硫酸盐(ph 8.9)和约90mm硫酸铵的水性环境或其等效物。如本文所用,短语“标准杂交条件”和其衍生词是指可在存在低杂交温度和高离子强度的情况下进行引物与寡核苷酸(即,靶序列)的杂交的条件。在一个示例性实施例中,标准杂交条件包含在约50℃
‑
55℃下含有约100mm硫酸镁、约500mm tris
‑
硫酸盐(ph 8.9)和约200mm硫酸铵的水性环境或其等效物。
[0283]
如本文所用,“gc含量”和其衍生词是指核酸分子的胞嘧啶和鸟嘌呤含量。本公开的靶特异性引物(或衔接子)的gc含量为85%或更低。更通常,本公开的靶特异性引物或衔接子的gc含量为15%
‑
85%。
[0284]
如本文所用,当关于核酸分子(例如靶序列或扩增的靶序列)使用时,术语“端”和
其衍生词可以包含核酸分子的末端30个核苷酸、末端20和甚至更通常末端15个核苷酸。包含一连串相邻核苷酸的线性核酸分子通常包含至少两个端。在一些实施例中,核酸分子的一端可以包含3'羟基或其等效物,并且称为“3'端”和其衍生物。任选地,3'端包含未连接到单核苷酸戊糖环的5'磷酸基的3'羟基。通常,3'端包含定位与包含未连接的3'羟基的核苷酸相邻的一个或多个5'连接的核苷酸,通常定位与3'羟基相邻的30个核苷酸,通常末端20个并且甚至更通常末端15个核苷酸。一个或多个连接的核苷酸可表示成寡核苷酸中存在的核苷酸的百分比,或可与未连接的3'羟基相邻的许多连接的核苷酸形式提供。例如,3'端可以包含寡核苷酸的核苷酸长度的小于50%。在一些实施例中,3'端不包含任何未连接的3'羟基,但可以包含任何能够充当核苷酸经由引物延伸和/或核苷酸聚合进行的连接的位点的部分。在一些实施例中,例如当参考靶特异性引物时,术语“3'端”可以包含在3'端处的末端10个核苷酸、末端5个核苷酸、末端4、3、2或更少个核苷酸。在一些实施例中,当参考靶特异性引物时,术语“3'端”可以包含位于核苷酸位置10的核苷酸或更少的来自3'端的核苷酸。
[0285]
如本文所用,“5'端”和其衍生词是指核酸分子(例如靶序列或扩增的靶序列)的端,其包含自由5'磷酸基或其等效物。在一些实施例中,5'端包含未连接到相邻单核苷酸戊糖环的3'羟基的5'磷酸基。通常,5'端包含定位与5'磷酸相邻的一个或多个连接的核苷酸,通常经定位与包含5'磷酸基的核苷酸相邻的30个核苷酸,通常末端20个并且甚至更通常末端15个核苷酸。一个或多个连接的核苷酸可表示为在寡核苷酸中存在的核苷酸的百分比,或可与5'磷酸相邻的许多连接的核苷酸形式提供。例如,5'端可小于寡核苷酸的核苷酸长度的50%。在另一个示例性实施例中,5'端可以包含与包含末端5'磷酸的核苷酸相邻的约15个核苷酸。在一些实施例中,5'端不包含任何未连接的5'磷酸基,但可以包含任何能够充当与3'羟基或另一个核酸分子的3'端的连接位点的部分。在一些实施例中,例如当参考靶特异性引物时,术语“5'端”可以包含5'端处的末端10个核苷酸、末端5个核苷酸、末端4、3、2或更少个核苷酸。在一些实施例中,当参考靶特异性引物时,术语“5'端”可以包含定位在位置10处的核苷酸或更少的来自5'端的核苷酸。在一些实施例中,靶特异性引物的5'端可仅包含非可裂解核苷酸,例如不含有如本文中所公开的一个或多个可切割基团的核苷酸,或可由所属领域的一般技术人员容易地确定的可裂解核苷酸。
[0286]
如本文所用,“dna条形码”和其衍生词是指可充当用于区分或分离样品中多个扩增的靶序列的
‘
钥匙’的衔接子内的独特短(6
‑
14个核苷酸)核酸序列。出于本公开的目的,dna条形码可以并入衔接子的核苷酸序列中。
[0287]
如本文所用,短语“两轮靶特异性杂交”或“两轮靶特异性选择”和其衍生词是指相同靶序列经历两轮连续的基于杂交的靶特异性选择的任何过程,其中靶序列与靶特异性序列杂交。每轮基于杂交的靶特异性选择可以包含针对靶特异性序列的至少一些部分的多个靶特异性杂交。在一个示例性实施例中,一轮靶特异性选择包含涉及靶序列的第一区的第一靶特异性杂交和涉及靶序列的第二区的第二靶特异性杂交。第一和第二区可相同或不同。在一些实施例中,每轮基于杂交的靶特异性选择可以包含使用两种靶特异性寡核苷酸(例如,正向靶特异性引物和反向靶特异性引物),使得每轮选择包含两个靶特异性杂交。
[0288]
如本文所用,“可比较的最大最小解链温度”及其衍生词是指切割可切割基团后单个衔接子或靶特异性引物的每个核酸片段的解链温度(t
m
)。比较由单个衔接子或靶特异性
引物产生的每个核酸片段的杂交温度,以确定防止靶特异性引物或衔接子的任何核酸片段与靶序列杂交所需的最大最小温度。一旦知道最大杂交温度,就可操作衔接子或靶特异性引物,例如通过沿着引物的长度移动可切割基团的位置,以获得相对于每个核酸碎片的可比较的最大最小解链温度。
[0289]
如本文所用,“仅添加”和其衍生词是指一系列步骤,其中将试剂和组分添加到第一或单一反应混合物中。通常,以系列步骤不包含将反应混合物从第一容器移到第二容器以完成一系列步骤。仅添加过程不包含在含有反应混合物的容器外操作反应混合物。通常,仅添加过程适合自动化和高吞吐量。
[0290]
如本文所用,“合成”和其衍生词是指涉及聚合酶的核苷酸聚合的反应,任选地以模板依赖性方式。聚合酶通过将核苷一磷酸从核苷三磷酸(ntp)、脱氧核苷三磷酸(dntp)或双脱氧核苷三磷酸(ddntp)转移至延伸的寡核苷酸链的3'羟基来合成寡核苷酸。出于本公开的目的,合成包含经由从脱氧核苷三磷酸转移核苷一磷酸来连续延伸杂交的衔接子或靶特异性引物。
[0291]
如本文所用,“聚合条件”和其衍生词是指适合于核苷酸聚合的条件。在典型的实施例中,此类核苷酸聚合由聚合酶催化。在一些实施例中,聚合条件包含用于任选地以模板依赖性方式进行引物延伸从而导致产生合成核酸序列的条件。在一些实施例中,聚合条件包含pcr。通常,聚合条件包含使用足以合成核酸并且包含聚合酶和核苷酸的反应混合物。聚合条件可以包含使靶特异性引物与靶序列粘接和在聚合酶存在下以模板依赖性方式延伸引物的条件。在一些实施例中,使用热循环实施聚合条件。另外,聚合条件可以包含多个循环,其中重复退火、延伸和分离两条核酸链的步骤。通常,聚合条件包含阳离子如mgcl2。一个或多个核苷酸的聚合以形成核酸链包含核苷酸通过磷酸二酯键彼此连接,然而,在特定核苷酸类似物的背景下,替代连接可能是可能的。
[0292]
本文所用的术语“核酸”是指天然核酸、人工核酸、其类似物或其组合,包含多核苷酸和寡核苷酸。本文所用的术语“多核苷酸”和“寡核苷酸”可互换使用并且意指核苷酸的单链和双链聚合物,包含但不限于通过核苷酸间磷酸二酯键接例如3'
‑
5'和2'
‑
5'、反向连接例如3'
‑
3'和5'
‑
5'、支链结构或类似物核酸连接的2'
‑
脱氧核糖核苷酸(核酸)和核糖核苷酸(rna)。多核苷酸具有相关的抗衡离子,例如h
+
、nh
4+
、三烷基铵、mg
2+
、na
+
等。寡核苷酸可完全由脱氧核糖核苷酸、完全由核糖核苷酸或其嵌合混合物组成。寡核苷酸可以包含核碱基和糖类似物。当它们在所属领域中更常被称为寡核苷酸时,多核苷酸的大小通常在几个单体单元的范围内,例如5
‑
40,当它们在所属领域中更常被称为多核苷酸时,到数千个单体核苷酸单元;然而,出于本公开的目的,寡核苷酸和多核苷酸两者都可具有任何合适的长度。除非另外指出,否则每当呈现寡核苷酸序列时,都应了解,核苷酸从左到右是按5'到3'的顺序并且“a”表示脱氧腺苷,“c”表示脱氧胞苷,“g”表示脱氧鸟苷,“t”表示胸苷,并且“u”表示脱氧尿苷。寡核苷酸被称为具有“5'端”和“3'端”,因为单核苷酸通常通过将5'磷酸或一个核苷酸的等同基团连接到(任选地通过磷酸二酯或其它合适的键)其相邻核苷酸的3'羟基或等同基团而反应形成寡核苷酸。
[0293]
如本文所定义,术语“切口平移”和其衍生词包括核酸链内的一个或多个切口或间隙易位到沿核酸链的新位置。在一些实施例中,当双链衔接子与双链扩增的靶序列接合时,形成切口。在一个实例中,引物可在其5'端包含磷酸基团,其可接合到双链扩增的靶序列,
在衔接子和互补链中的扩增的靶序列之间留下切口。在一些实施例中,切口平移导致切口移动到核酸链的3'端。在一些实施例中,移动切口可以包含在衔接子接合的扩增的靶序列上进行切口平移反应。在一些实施例中,切口平移反应是偶联的5'到3'dna聚合/降解反应,或偶联到5'到3'dna聚合/链置换反应。在一些实施例中,移动切口可以包含在切口位点处进行dna链延伸反应。在一些实施例中,移动切口可以包含在切口上进行单链外切核酸酶反应以形成衔接子接合的扩增的靶序列的单链部分,并在衔接子接合的扩增的单链靶序列上进行dna链延伸反应到新位置。在一些实施例中,在与接合位点相对的核酸链中形成切口。
[0294]
本文所用的术语“聚合酶链式反应”(“pcr”)是指k.b.mullis美国专利第4,683,195号和第4,683,202号的方法,在此以引用的方式并入,其描述用于在不进行克隆或纯化的情况下增加基因组rna或cdna的混合物中相关多核苷酸的片段的浓度的方法。这种用于扩增目标多核苷酸的过程由以下组成:将大量过量的两种寡核苷酸引物引入含有所需相关多核苷酸的dna混合物,接着在dna聚合酶存在下热循环的精确序列。两种引物与相关双链多核苷酸的其相应链互补。为了实现扩增,使混合物变性,并且接着使引物粘接到相关多核苷酸分子内的其互补序列。在粘接之后,用聚合酶使引物延伸以形成一对新的互补链。变性、引物粘接和聚合酶延伸的步骤可重复多次(即,变性、粘接和延伸构成一个“循环”;可存在许多“循环”)以获得高浓度的扩增的所需目标多核苷酸的片段。所关注的期望多核苷酸的扩增片段(扩增子)的长度通过引物相对于彼此的相对位置测定,并且因此此长度为可控参数。借助于重复所述过程,所述方法被称为“pcr”。因为所关注的多核苷酸的期望扩增片段变成混合物中的主要核酸序列(在浓度方面),所以所述扩增片段被称为“pcr扩增的”。如本文中所定义,包含多种靶核酸分子的在样品内的靶核酸分子经由pcr扩增。在上文所论述的方法的一个改进中,靶核酸分子使用多种不同引物对、在一些情况下一种或多种引物对/目标标靶核酸分子pcr扩增,由此形成多重pcr反应。在本文提供的一些实施例中,使用多个不同引物对进行多重pcr扩增,在典型情况下,每个靶核酸分子一个引物对。使用多重pcr,有可能同时从样品扩增多种相关核酸分子以形成经扩增的靶序列。还可能通过数种不同方法(例如,用生物分析仪或qpcr定量,用经标记的探针杂交;并入生物素化的引物,接着进行抗生物素蛋白
‑
酶结合物检测;将经
32
p标记的脱氧核苷酸三磷酸酯(例如dctp或datp)并入到经扩增的靶序列中)检测扩增的靶序列。任何寡核苷酸序列可用适合的引物集合扩增,从而实现靶核酸分子从rna、cdna、福尔马林固定石蜡包埋dna、细针穿刺活检(fine
‑
needle biopsies)和多种其它来源的扩增。具体来说,由如本文中所公开的多重pcr过程产生的扩增的靶序列本身是用于后续pcr扩增或多种下游测定或操作的有效底物。
[0295]
如本文中所定义,“多重扩增”是指使用至少一种靶特异性引物进行的样品内的两个或更多个靶序列的选择性和非随机扩增。在一些实施例中,进行多重扩增,使得一些或全部靶序列在单个反应容器内扩增。既定多重扩增的“重数(plexy)”或“重(plex)”是指在所述单一多重扩增期间扩增的不同靶特异性序列的数目。在一些实施例中,重数是约12重、24重、48重、74重、96重、120重、144重、168重、192重、216重、240重、264重、288重、312重、336重、360重、384重或398重。在一些实施例中,高度多重扩增反应包含具有大于12重的重的反应。
[0296]
在一些实施例中,扩增的靶序列通过pcr形成。可用一种或多种dna聚合酶完成靶特异性引物的延伸。在一个实施例中,聚合酶为任何家族a dna聚合酶(也称为pol i家族)
或任何家族b dna聚合酶。在一些实施例中,与非重组dna聚合酶相比,dna聚合酶为能够以更高的准确度和产率延伸靶特异性引物的重组形式。例如,聚合酶可以包含高保真聚合酶或热稳定聚合酶。在一些实施例中,靶特异性引物延伸的条件可以包含“热启动”条件,例如热启动聚合酶,例如amplitaqdna聚合酶(applied biosciences)、taq dna聚合酶高保真(invitrogen)或kod热启动dna聚合酶(emd biosciences)。“热启动”聚合酶包含热稳定聚合酶和一种或多种在环境温度下抑制dna聚合酶和3'
‑
5'核酸外切酶活性的抗体。在某些情况下,“热启动”条件可以包含适体。
[0297]
在一些实施例中,聚合酶是一种酶,例如taq聚合酶(来自水生栖热菌(thermus aquaticus)),tfi聚合酶(来自thermus filiformis),bst聚合酶(来自嗜热脂肪芽孢杆菌),pfu聚合酶(来自激烈火球菌(pyrococcus furiosus)),tth聚合酶(来自嗜热菌(thermus thermophilus)),pow聚合酶(来自pyrococcus woesei),tli聚合酶(来自斜纹热球菌(thermococcus litoralis)),ultima聚合酶(来自海栖热袍菌(thermotoga maritima)),kod聚合酶(来自极端嗜热古生菌(thermococcus kodakaraensis)),pol i和ii聚合酶(来自pyrococcus abyssi)和pab(来自pyrococcus abyssi)。在一些实施例中,dna聚合酶可以包含至少一种聚合酶,例如amplitaqdna聚合酶(applied biosciences),dna聚合酶的stoffel片段(roche),kod聚合酶(emd biosciences),kod热启动聚合酶(emd biosciences),deep vent
tm
dna聚合酶(new england biolabs),phusion聚合酶(new england biolabs),klentaq1聚合酶(dna polymerase technology,inc),klentaq long accuracy聚合酶(dna polymerase technology,inc),omni klentaq
tm
dna聚合酶(dna polymerase technology,inc),omni klentaq
tm
la dna聚合酶(dna polymerase technology,inc),taq dna聚合酶(invitrogen),hemo klentaq
tm
(new england biolabs),taq dna polymerase high fidelity(invitrogen),pfx(invitrogen),accuprime
tm pfx(invitrogen),或accuprime
tm taq dna polymerase high fidelity(invitrogen)。
[0298]
在一些实施例中,dna聚合酶是热稳定的dna聚合酶。在一些实施例中,dntp的混合物以随机或定义的顺序同时或顺序施用。在一些实施例中,多重反应中存在的dna聚合酶的量显著高于对应的单重pcr反应中使用的dna聚合酶的量。如本文所定义,术语“显著更高”是指与对应的单重pcr反应相比,多重pcr反应中存在的dna聚合酶浓度至少高3倍。
[0299]
在一些实施例中,扩增反应不包含扩增产物的环化,例如通过滚环扩增所公开的。
[0300]
除非另外指出,否则本主题的实践可采用在所属领域的技能内的有机化学、分子生物学(包含重组技术)、细胞生物学和生物化学的常规技术和描述。此类常规技术包含但不限于合成多核苷酸的制备、聚合技术、聚合物粒子的化学和物理分析、核酸文库的制备、核酸测序和分析等。合适技术的具体说明可参考本文提供的实例使用。也可使用其它等效的常规程序。此类常规技术和描述可以在标准实验室手册中找到,如《基因组分析:实验室手册丛书(genome analysis:a laboratory manual series)》(第i
‑
iv卷),《pcr引物:实验室手册(pcr primer:a laboratory manual)》,和《分子克隆:实验指南(molecular cloning:a laboratory manual)》(均来自冷泉港实验室出版社(cold spring harbor laboratory press)),hermanson,《生物结合技术(bioconjugate techniques)》,第二版
(学术出版社(academic press),2008);merkus,《粒度测量(particle size measurements)》(springer,2009);rubinstein和colby,《聚合物物理学(polymer physics)》(牛津大学出版社,2003);等。
[0301]
根据各种示例性实施例,可使用适当配置和/或编程的硬件和/或软件元件来进行或实施上述教示内容和/或示例性实施例中的任一个或多个的一个或多个特征。确定是否使用硬件和/或软件元件来实施实施例可基于任何数量的因素,如期望的计算速率、功率水平、耐热性、处理周期预算、输入数据速率、输出数据速率、存储器资源、数据总线速度等,以及其它设计或性能限制。
[0302]
硬件元件的实例可以包含通过以下以通信方式耦合的处理器、微处理器、一个或多个输入设备和/或一个或多个输出装置(i/o)(或外围设备):本地接口电路、电路元件(例如晶体管、电阻器、电容器、电感器等)、集成电路、专用集成电路(asic)、可编程逻辑装置(pld)、数字信号处理器(dsp)、现场可编程门阵列(fpga)、逻辑门、寄存器、半导体装置、芯片、微芯片、芯片组等。本地接口可以包含例如一个或多个总线或其它有线或无线连接、控制器、缓冲器(缓存器)、驱动器、中继器和接收器等,以允许硬件组件之间的适当通信。处理器为用于执行软件的硬件装置,尤其是储存在存储器中的软件。处理器可为任何定制的或市售的处理器、中央处理单元(cpu)、与计算机相关联的若干处理器中的辅助处理器、基于半导体的微处理器(例如呈微芯片或芯片组的形式)、宏处理器或用于执行软件指令的任何装置。处理器还可以表示分布式处理架构。i/o装置可以包含输入装置,例如键盘、鼠标、扫描仪、麦克风、触摸屏、用于各种医疗装置和/或实验室仪器的接口、条形码读取器、触笔、激光读取器、射频装置读取器等。此外,i/o装置还可以包含输出装置,例如打印机、条形码打印机、显示器等。最后,i/o装置可以进一步包含作为输入和输出两者进行通信的装置,例如调制器/解调器(调制解调器;用于访问另一个装置、系统或网络)、射频(rf)或其它收发器、电话接口、桥接器、路由器等。
[0303]
软件的实例可以包含软件组件、程序、应用、计算机程序、应用程序、系统程序、机器程序、操作系统软件、中间件、固件、软件模块、例程、子例程、函数、方法、程序、软件接口、应用程序接口(api)、指令集、计算代码、计算机代码、代码段、计算机代码段、字、值、符号或其任何组合。在存储器中的软件可以包含一个或多个独立程序,其可以包含用于执行逻辑功能的可执行指令的有序列表。在存储器中的软件可以包含用于识别根据本发明的教示内容的数据流的系统和任何适合的定制或可商购的操作系统(o/s),其可控制如系统等其它计算机程序的执行,并且提供排程、输入
‑
输出控制、文件和数据管理、存储器管理、通信控制等。
[0304]
根据各种示例性实施例,可使用可存储指令或指令集的适当地配置和/或编程的非暂时性机器可读介质或物件来执行或实施上述教示内容和/或示例性实施例中的任一个或多个的一个或多个特征,所述指令或指令集如果由机器执行,那么可使机器执行根据示例性实施例的方法和/或操作。此类机器可以包含例如任何合适的处理平台、计算平台、计算装置、处理装置、计算系统、处理系统、计算机、处理器、科学或实验室仪器等,并且可使用硬件和/或软件的任何合适的组合来实施。机器可读介质或物件可以包含例如任何合适类型的存储器单元、存储器装置、存储器物件、存储器介质、存储装置、存储物件、存储介质和/或存储单元,例如存储器、可移动介质或不可移动介质、可擦除介质或不可擦除介质、可写
或可重写介质、数字或模拟介质、硬盘、软盘、只读存储器光盘(cd
‑
rom)、可刻录光盘(cd
‑
r)、可重写光盘(cd
‑
rw)、光盘、磁性介质、磁光介质、可移动存储卡或盘、各种类型的数字多功能光盘(dvd)、磁带、磁带盒等,包含适用于计算机的任何介质。存储器可以包含易失性存储器元件(例如随机存取存储器(ram,如dram、sram、sdram等))和非易失性存储器元件(例如rom、eprom、eerom、闪存储器、硬盘驱动器、磁带、cdrom等)中的任一个或组合。此外,存储器可并入电子、磁性、光学和/或其它类型的存储介质。存储器可以具有分布式结构,其中各种组件彼此远离地定位,但仍通过处理器接入。指令可以包含使用任何适合的高阶、低阶、面向对象、视觉、经编译和/或经解译的编程语言实施的任何合适类型的代码,如源代码、经编译的代码、解译的代码、可执行码、静态代码、动态代码、加密的代码等。
[0305]
根据各种示例性实施例,可至少部分地使用分布式、丛集、远程或云计算资源来进行或实施上述教示内容和/或示例性实施例中的任一个或多个的一个或多个特征。
[0306]
根据各种示例性实施例,上述教示内容和/或示例性实施例中的任一个或多个的一个或多个特征可使用源程序、可执行程序(目标代码)、脚本或任何其它包括待执行的指令集的实体来执行或实施。当源程序时,所述程序可通过可以包含或不包含在存储器中的编译器、汇编器、解释器等翻译以便与o/s一起正确地操作。指令可使用以下书写:(a)具有数据类和方法类的面向对象的编程语言;或(b)具有例程、子例程和/或函数的过程编程语言,可以包含例如c、c++、pascal、basic、fortran、cobol、perl、java和ada。
[0307]
根据各种示例性实施例,上述示例性实施例中的一个或多个可以包含向使用者接口装置、计算机可读储存介质、本地计算机系统或远程计算机系统发送、显示、储存、打印或输出与可以通过此类示例性实施例生成、访问或使用的任何信息、信号、数据和/或中间结果或最终结果有关的信息。例如,此类发送、显示、储存、打印或输出的信息可采用可搜索和/或可过滤的运行和报告、图片、表格、图表、图形、电子表格、相关性、序列和其组合列表的形式。
[0308]
可通过重复、添加或替换在一个或多个上述示例性实施例中阐述的任何一般或具体描述的特征和/或组件和/或物质和/或步骤和/或操作条件来导出各种另外的示例性实施例。进一步地,应该理解,除非另外特别说明,否则只要步骤或动作的目的仍然可实现,步骤的顺序或执行某些动作的顺序是不重要的。此外,除非特别说明,否则可同时进行两个或更多个步骤或动作,只要步骤或动作的目标仍然可实现。此外,除非另外特别说明,否则在上文讨论的示例性实施例之一中提到的任何一个或多个特征、组件、方面、步骤或其它特征可以被认为是上文讨论的示例性实施例的任何其它实施例的潜在任选的特征、组件、方面、步骤或其它特征,只要上文讨论的示例性实施例的任何此类其它实施例的目的仍然是可实现的。
[0309]
在某些实施例中,本发明的组合物包括靶bcr引物组,其中引物针对相同靶bcr基因的序列。在一些实施例中,免疫受体是选自由以下组成的组的抗体受体:重链α、重链δ、重链ε、重链γ、重链μ、轻链κ和轻链λ。在一些实施例中,靶bcr引物组可以与针对选自由以下组成的组的tcr的引物组结合:tcrα,tcrβ,tcrγ和tcrδ。
[0310]
在一些实施例中,本发明的组合物包括被选择为具有本文所概述的各种参数或标准的靶bcr引物组。在一些实施例中,本发明的组合物包括长度为约15个核苷酸到约40个核苷酸并具有至少两个或更多个以下标准的多种靶特异性引物(例如,v基因fr1、fr2和针对
fr3的引物,针对j基因的引物和针对c基因的引物):可切割基团定位于所述多个引物中的基本上所有引物的3'末端处、可切割基团定位于所述多个引物中的基本上所有引物的中心核苷酸附近或周围、所述多个引物中的基本上所有引物都位于仅包含不可切割的核苷酸的5'末端处、与所述多个引物中的基本上所有引物进行最小交叉杂交、与样品中存在的非特异性序列进行最小交叉杂交、最小自互补性以及最小核苷酸序列在所述多个引物中基本上所有引物的3'末端或5'末端处重叠。在一些实施例中,组合物可以包含具有上述标准的任何3、4、5、6或7条的引物。
[0311]
在一些实施例中,组合物包括多种靶特异性引物,其长度约15个核苷酸至40个核苷酸,具有两个或更多个以下标准:可切割基团位于基本上所有多个引物的中心核苷酸附近或周围,5'端的基本上所有多个引物仅包含不可裂解的核苷酸,在包含可切割基团的引物的整个长度上基本上所有多个引物具有小于20%的核苷酸,至少一个引物在其整个长度上具有与样品中存在的靶序列互补的核酸序列,与多个引物中基本上所有引物最小交叉杂交,与存在于样品的非特异性序列最小交叉杂交,和最小核苷酸序列在多个引物中基本上所有引物的3'端或5'端重叠。在一些实施例中,组合物可以包含具有上述标准的任何3、4、5、6或7条的引物。
[0312]
在一些实施例中,选择或设计在本发明的组合物中使用的靶特异性引物(例如,v基因fr1、fr2和针对fr3的引物、针对j基因的引物和针对c基因的引物)以满足以下标准中的任何一个或多个标准:(1)在所述引物序列内包含两个或更多个经修饰的核苷酸,所述核苷酸中的至少一个核苷酸包含在所述引物的末端附近或末端处,并且所述核苷酸中的至少一个核苷酸包含在所述引物序列的中心核苷酸位置处或中心核苷酸位置周围;(2)长度为约15到约40个碱基长;(3)t
m
为高于60℃到约70℃;(4)与在所述样品中存在的非靶序列的交叉反应性低;(5)至少前四个核苷酸(从3'到5'方向)与在所述组合物中存在的任何其它引物内的任何序列不互补;并且(6)与用于使用引物进行扩增所靶向的任何其它序列内的至少5个核苷酸的任何连续段不互补。在一些实施例中,选择或设计在所述组合物中使用的靶特异性引物以满足上述标准中的任何2个、3个、4个、5个或6个。在一些实施例中,所述两个或更多个经修饰的核苷酸具有可切割基团。在一些实施例中,所述多个靶特异性引物中的每个靶特异性引物包括选自以下的可切割基团的两个或更多个经修饰的核苷酸:甲基鸟嘌呤、8
‑
氧代
‑
鸟嘌呤、黄嘌呤、次黄嘌呤、5,6
‑
二氢尿嘧啶、尿嘧啶、5
‑
甲基胞嘧啶、胸腺嘧啶二聚体、7
‑
甲基鸟苷、8
‑
氧代
‑
脱氧鸟苷、黄嘌呤核苷、肌苷、二氢尿苷、溴脱氧尿苷、尿苷或5
‑
甲基胞苷。
[0313]
在一些实施例中,提供了用于分析样品中的免疫组库的组合物,所述组合物包括以下的至少一组:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区1(fr1)的至少一部分的至少一个bcr编码序列的大多数不同v基因;和ii)一个或多个c基因引物,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,并且其中针对所述同一靶bcr的每组i)引物和ii)引物被配置成扩增所述靶bcr组库。在某些实施例中,组合物中涵盖包括i)和ii)单个引物组。在更特定的实施例中,此类组包括针对igh的引物。在又其它实施例中,组合物中涵盖至少两组引物,其中所述组针对igh和tcrβ。
[0314]
在特定实施例中,所提供的组合物包含靶bcr引物组,所述引物组包括针对在fr1
id no:540
‑
551的至少一个引物和选自seq id no:564
‑
582的至少一个引物。在其它实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的至少20或至少25个引物和选自seq id no:460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的至少一个引物。在一些实施例中,所提供的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的约15到约35个引物和选自seq id no:460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的约5到约15个引物。在一些实施例中,所提供的组合物包括至少一组引物,所述至少一组引物包括i)选自seq id no:284
‑
430的约22到约35个引物和ii)选自seq id no:460
‑
471的至少一个引物、选自seq id no:480
‑
487的至少一个引物、选自seq id no:514
‑
539的至少一个引物、选自seq id no:552
‑
563的至少一个引物和选自seq id no:583
‑
601的至少一个引物。在一些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的至少20或至少25个引物和选自seq id no:460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的至少一个引物。在其它实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的至少20或至少25个引物和选自seq id no:448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的至少一个引物。
[0317]
在一些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的至少40或至少50个引物和选自seq id no:448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的至少一个引物。在一些实施例中,所提供的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的约40到约65个引物和选自seq id no:448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的约5到约15个引物。在一些实施例中,所提供的组合物包括至少一组引物,所述至少一组引物包括i)选自seq id no:137
‑
283的约48到约60个引物和ii)选自seq id no:448
‑
459的至少一个引物、选自seq id no:472
‑
479的至少一个引物、选自seq id no:488
‑
513的至少一个引物、选自seq id no:540
‑
551的至少一个引物和选自seq id no:564
‑
582的至少一个引物。在其它实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的至少40或至少50个引物和选自seq id no:460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的至少一个引物。在一些实施例中,所提供的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的约40到约65个引物和选自seq id no:460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的约5到约15个引物。在一些实施例中,所提供的组合物包括至少一组引物,所述至少一组引物包括i)选自seq id no:284
‑
430的约48到约60个引物和ii)选自seq id no:460
‑
471的至少一个引物、选自seq id no:480
‑
487的至少一个引物、选自seq id no:514
‑
539的至少一个引物、选自seq id no:552
‑
563的至少一个引物和选自seq id no:583
‑
601的至少一个引物。在一些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的至少40或至少50个引物和选自seq id no:460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的至少一个引物。在其它实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的至少40或至少50个引物和选自seq id no:448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的至少一个引物。
[0318]
在一些实施例中,提供了用于分析样品中的bcr组库的组合物,所述组合物包括以
下的至少一组:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区3(fr3)的至少一部分的至少一个bcr编码序列的大多数不同v基因;和ii)一个或多个c基因引物,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,并且其中针对所述同一靶免疫受体的每组i)引物和ii)引物被配置成扩增所述靶bcr组库。在某些实施例中,组合物中涵盖包括i)和ii)单个引物组。在更特定的实施例中,此类组包括针对igh的引物。在又其它实施例中,组合物中涵盖至少两组引物,其中所述组针对igh和tcrβ。
[0319]
在某些实施例中,所提供的组合物包含包括v基因引物的靶bcr引物组,其中多个v基因引物中的一个或多个v基因引物针对长度为比fr3区高出约70个核苷酸的序列。在特定实施例中,所提供的组合物包含包括v基因引物的靶bcr引物组,其中多个v基因引物中的一个或多个v基因引物针对长度为比fr3区高出约50个核苷酸的序列。在其它特定实施例中,多个v基因引物中的一个或多个v基因引物针对长度为比fr3区高出约40到约60个核苷酸的序列。在某些实施例中,靶bcr引物组包括约50到约85个不同的针对fr3的引物的v基因引物。在某些实施例中,靶bcr引物组包括约55到约80个不同的针对fr3的引物的v基因引物。在一些实施例中,靶bcr引物组包括约62到约75个不同的针对fr3的引物的v基因引物。在一些实施例中,靶bcr引物组包括约65、66、67、68、69或70个不同的针对fr3的引物的v基因引物。在一些实施例中,靶bcr引物组包括一个或多个c基因引物。在特定实施例中,靶bcr引物组包括至少5到约15个c基因引物,其中每个基因引物针对靶c基因中的每个靶c基因内的50个相同核苷酸区的至少一部分。在特定实施例中,靶免疫受体引物组包括至少2到约8个c基因引物,其中每个基因引物针对靶c基因中的每个靶c基因内的50个相同核苷酸区的至少一部分。在一些实施例中,靶bcr引物组包括针对不同ig同种型分子,例如iga、igd、igg、igm和ige的两个或更多个c基因引物。在一些实施例中,靶bcr引物组包括至少5个c基因引物,每个引物针对不同ig同种型分子的c基因。
[0320]
在特定实施例中,本发明的组合物包括至少一组引物,所述至少一组引物包括分别选自表2和表6
‑
10的v基因引物i)和c基因引物ii)。在某些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物分别包括选自表2的约55到约80个引物和选自表6
‑
10的约5到约20个引物。在一些实施例中,所提供的组合物包括至少一组引物,所述至少一组引物包括i)选自表2的约62到约75个引物,以及ii)选自表6
‑
10中的每个表的一个或多个引物。在某些其它实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:1
‑
68以及448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582或选自seq id no:69
‑
136以及460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的引物。在一些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:1
‑
68以及460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601或选自seq id no:69
‑
136以及448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的引物。
[0321]
在一些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:1
‑
68的至少60个引物和选自seq id no:448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的至少一个引物。在一些实施例中,所提供的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:1
‑
68的至少60个引物和选自seq id no:448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的约5到约15个引物。在一些实施例中,所提
供的组合物包括至少一组引物,所述至少一组引物包括i)选自seq id no:1
‑
68的至少60个引物和ii)选自seq id no:448
‑
459的至少一个引物、选自seq id no:472
‑
479的至少一个引物、选自seq id no:488
‑
513的至少一个引物、选自seq id no:540
‑
551的至少一个引物和选自seq id no:564
‑
582的至少一个引物。在其它实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:69
‑
136的至少60个引物和选自seq id no:460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的至少一个引物。在一些实施例中,所提供的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:69
‑
136的至少60个引物和选自seq id no:460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的约5到约15个引物。在一些实施例中,所提供的组合物包括至少一组引物,所述至少一组引物包括i)选自seq id no:69
‑
136的至少60个引物和ii)选自seq id no:460
‑
471的至少一个引物、选自seq id no:480
‑
487的至少一个引物、选自seq id no:514
‑
539的至少一个引物、选自seq id no:552
‑
563的至少一个引物和选自seq id no:583
‑
601的至少一个引物。在一些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:1
‑
68的至少60个引物和选自seq id no:460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的至少一个引物。在其它实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:69
‑
136的至少60个引物和选自seq id no:448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的至少一个引物。
[0322]
在一些实施例中,提供了用于分析样品中的bcr组库的组合物,所述组合物包括以下的至少一组:i)多个v基因引物,所述多个v基因引物针对包括v基因内的fr2的至少一部分的至少一个bcr编码序列的大多数不同v基因;和ii)一个或多个c基因引物,所述一个或多个c基因引物针对bcr编码序列的相应靶c基因的至少一部分,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,并且其中针对所述同一靶免疫受体的每组i)引物和ii)引物被配置成扩增所述靶bcr组库。在某些实施例中,组合物中涵盖包括i)和ii)单个引物组。在更特定的实施例中,此类组包括针对igh的引物。在又其它实施例中,组合物中涵盖至少两组引物,其中所述组针对igh和tcrβ。
[0323]
在特定实施例中,所提供的组合物包含包括v基因引物的靶bcr引物组,其中多个v基因引物中的一个或多个v基因引物针对长度为比fr2区高出约70个核苷酸的序列。在其它特定实施例中,多个v基因引物中的一个或多个v基因引物针对长度为比fr2区高出约50个核苷酸的序列。在某些实施例中,靶bcr引物组包括约5到约15个不同的针对fr2的引物的v基因引物。在一些实施例中,靶bcr引物组包括约5、6、7、8、9、10、11或12个不同的针对fr2的引物的v基因引物。在一些实施例中,靶bcr引物组包括一个或多个c基因引物。在特定实施例中,靶bcr引物组包括至少5到约15个c基因引物,其中每个基因引物针对靶c基因中的每个靶c基因内的50个相同核苷酸区的至少一部分。在特定实施例中,靶bcr引物组包括至少2到约8个c基因引物,其中每个基因引物针对靶c基因中的每个靶c基因内的50个相同核苷酸区的至少一部分。在一些实施例中,靶bcr引物组包括针对不同ig同种型分子,例如iga、igd、igg、igm和ige的两个或更多个c基因引物。在一些实施例中,靶bcr引物组包括至少5个c基因引物,每个引物针对不同ig同种型分子的c基因。
[0324]
在特定实施例中,本发明的组合物包括至少一组引物,所述至少一组引物包括分别选自表4和表6
‑
10的v基因引物i)和c基因引物ii)。在某些其它实施例中,本发明的组合
物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:431
‑
437以及448
‑
459、472
‑
479、488
‑
513、540
‑
551和564
‑
582的引物。在其它实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:431
‑
437以及460
‑
471、480
‑
487、514
‑
539、552
‑
563和583
‑
601的引物。在其它实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:431
‑
437的至少5个引物和选自seq id no:448、472、488、540、541、564和565的至少一个引物。在其它实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:431
‑
437的至少5个引物和选自seq id no:460、480、514、552、553、583和584的至少一个引物。
[0325]
在一些实施例中,提供了用于分析样品中的bcr组库的组合物,所述组合物包括以下的至少一组:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区3(fr3)的至少一部分的至少一个bcr编码序列的大多数不同v基因;和ii)多个j基因引物,所述多个j基因引物针对相应靶bcr编码序列的大多数不同j基因的多个j基因引物,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,并且其中针对所述同一靶免疫受体的每组i)引物和ii)引物被配置成扩增所述靶bcr组库。在某些实施例中,组合物中涵盖包括i)和ii)单个引物组。在更特定的实施例中,此类组包括针对igh的引物。在又其它实施例中,组合物中涵盖至少两组引物,其中所述组针对igh和tcrβ。
[0326]
在特定实施例中,所提供的组合物包含包括v基因引物的靶bcr引物组,其中多个v基因引物中的一个或多个v基因引物针对长度为比fr3区高出约50个核苷酸的序列。在其它实施例中,多个v基因引物中的一个或多个v基因引物针对长度为比fr3区高出约70个核苷酸的序列。在其它特定实施例中,多个v基因引物中的一个或多个v基因引物针对长度为比fr3区高出约40到约60个核苷酸的序列。在一些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约50到约85个不同的针对fr3的引物。在某些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约55到约80个不同的针对fr3的引物。在一些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约62到约75个不同的针对fr3的引物。在一些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约65、66、67、68、69或70个不同的针对fr3的引物。在一些实施例中,靶bcr引物组包括多个j基因引物。在特定实施例中,靶bcr引物组包括至少2个j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。在某些实施例中,靶bcr引物组包括2到约8个j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。在一些实施例中,靶bcr引物组包括约3到约6个不同的j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。在一些实施例中,靶bcr引物组包括约2、3、4、5、6、7或8个不同的j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。在一些实施例中,靶bcr引物组包括约4个j基因引物,其中每个基因引物针对靶多核苷酸内的j基因部分的至少一部分。
[0327]
在特定实施例中,本发明的组合物包括至少一组引物,所述至少一组引物包括分别选自表2和5的v基因引物i)和j基因引物ii)。在某些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:1
‑
68和438
‑
442或选自seq id no:69
‑
136和443
‑
447的引物。在其它某些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:1
‑
68和443
‑
447或选自seq id no:69
‑
136和438
‑
442的引物。
[0328]
在一些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:1
‑
68的至少60个引物和选自seq id no:438
‑
442的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:69
‑
136的至少60个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:1
‑
68的至少60个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:69
‑
136的至少60个引物和选自seq id no:438
‑
442的至少2个引物、至少3个引物或至少4个引物。
[0329]
在一些实施例中,提供了用于分析样品中的bcr组库的组合物,所述组合物包括以下的至少一组:i)多个v基因引物,所述多个v基因引物针对包括v基因内的框架区1(fr1)的至少一部分的至少一个bcr编码序列的大多数不同v基因;和ii)多个j基因引物,所述多个j基因引物针对相应靶bcr编码序列的大多数不同j基因,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,并且其中针对所述同一靶免疫受体的每组i)引物和ii)引物被配置成扩增所述靶bcr组库。在某些实施例中,组合物中涵盖包括i)和ii)单个引物组。在更特定的实施例中,此类组包括针对igh的引物。在又其它实施例中,组合物中涵盖至少两组引物,其中所述组针对igh和tcrβ。
[0330]
在特定实施例中,所提供的组合物包含靶bcr引物组,所述引物组包括针对在fr1区的长度为约70个核苷酸的序列的多个v基因引物中的一个或多个基因引物。在其它实施例中,多个v基因引物中的一个或多个v基因引物针对长度为比fr1区高出约80个核苷酸的序列。在其它特定实施例中,多个v基因引物中的一个或多个v基因引物针对长度为比fr1区高出约50个核苷酸的序列。在某些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约18到约45个不同的针对fr1的引物。在一些实施例中,靶bcr引物组包括约22到约35个不同的针对fr1的引物的v基因引物。在一些实施例中,靶bcr引物组包括约25到约35个不同的针对fr1的引物的v基因引物。在某些实施例中,靶bcr引物组包括约40到约65个不同的针对fr1的引物的v基因引物。在一些实施例中,靶bcr引物组包括约48到约60个不同的针对fr1的引物的v基因引物。在一些实施例中,靶bcr引物组包括多个j基因引物。在特定实施例中,靶bcr引物组包括至少2个j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。在某些实施例中,靶bcr引物组包括2到约8个j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。在一些实施例中,靶bcr引物组包括约3到约6个不同的j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。在一些实施例中,靶bcr引物组包括约2、3、4、5、6、7或8个不同的j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。在一些实施例中,靶bcr引物组包括约4个j基因引物,其中每个基因引物针对靶多核苷酸内的j基因部分的至少一部分。
[0331]
在特定实施例中,本发明的组合物包括至少一组引物,所述至少一组引物包括分别选自表3和5的v基因引物i)和j基因引物ii)。在某些其它实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283和438
‑
442或选自seq id no:284
‑
430和443
‑
447的引物。在其它实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283和443
‑
447或选自seq id no:
284
‑
430和438
‑
442的引物。
[0332]
在一些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的至少20个或至少25个引物和选自seq id no:438
‑
442的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,所提供的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的约15到约35个引物和选自seq id no:438
‑
442的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,所提供的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的约22到约35个引物和选自seq id no:438
‑
442的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的至少20个或至少25个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,所提供的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的约15到约35个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,所提供的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的约22到约35个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的至少20个或至少25个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的至少20个或至少25个引物和选自seq id no:438
‑
442的至少2个引物、至少3个引物或至少4个引物。
[0333]
在一些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的至少40个或至少50个引物和选自seq id no:438
‑
442的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,所提供的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的约40到约65个引物和选自seq id no:438
‑
442的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,所提供的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的约48到约60个引物和选自seq id no:438
‑
442的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的至少40个或至少50个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,所提供的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的约40到约65个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,所提供的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的约48到约60个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:137
‑
283的至少40个或至少50个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。在一些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:284
‑
430的至少40个或至少50个引物和选自seq id no:438
‑
442的至少2个引物、至少3个引物或至少4个引物。
[0334]
在一些实施例中,提供了用于分析样品中的bcr组库的组合物,所述组合物包括以下的至少一组:i)多个v基因引物,所述多个v基因引物针对包括v基因内的fr2的至少一部分的至少一个bcr编码序列的大多数不同v基因;和ii)多个j基因引物,所述多个j基因引物针对相应靶bcr编码序列的大多数不同j基因,其中针对同一靶免疫受体序列的每组i)引物和ii)引物选自由igh、igl和igk组成的组,并且其中针对所述同一靶免疫受体的每组i)引物和ii)引物被配置成扩增所述靶bcr组库。在某些实施例中,组合物中涵盖包括i)和ii)单个引物组。在更特定的实施例中,此类组包括针对igh的引物。在又其它实施例中,组合物中涵盖至少两组引物,其中所述组针对igh和tcrβ。
[0335]
在特定实施例中,所提供的组合物包含包括v基因引物的靶bcr引物组,其中多个v基因引物中的一个或多个v基因引物针对长度为比fr2区高出约70个核苷酸的序列。在其它特定实施例中,多个v基因引物中的一个或多个v基因引物针对长度为比fr2区高出约50个核苷酸的序列。在某些实施例中,靶bcr引物组包括v基因引物,所述v基因引物包括约5到约15个不同的针对fr2的引物。在一些实施例中,靶bcr引物组包括约5、6、7、8、9、10、11或12个不同的针对fr2的引物的v基因引物。在一些实施例中,靶bcr引物组包括多个j基因引物。在特定实施例中,靶bcr引物组包括至少2个j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。在某些实施例中,靶bcr引物组包括2到约8个j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。在一些实施例中,靶bcr引物组包括约3到约6个不同的j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。在一些实施例中,靶bcr引物组包括约2、3、4、5、6、7或8个不同的j基因引物,其中每个基因引物针对靶多核苷酸内的j基因的至少一部分。在一些实施例中,靶bcr引物组包括约4个j基因引物,其中每个基因引物针对靶多核苷酸内的j基因部分的至少一部分。
[0336]
在特定实施例中,本发明的组合物包括至少一组引物,所述至少一组引物包括分别选自表4和5的v基因引物i)和j基因引物ii)。在一些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:431
‑
437和438
‑
442或选自seq id no:431
‑
437和443
‑
447的引物。在一些实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:431
‑
437的至少5个引物和选自seq id no:438
‑
442的至少2个引物、至少3个引物或至少4个引物。在其它实施例中,本发明的组合物包括至少一组引物i)和ii),所述至少一组引物包括选自seq id no:431
‑
437的至少5个引物和选自seq id no:443
‑
447的至少2个引物、至少3个引物或至少4个引物。
[0337]
在一些实施例中,包含至少一个经修饰的核苷酸的多个不同引物可以用于单一扩增反应。例如,可以将包含修饰的核苷酸的多重引物添加到扩增反应混合物中,其中每个引物(或引物组)选择性地与在核酸群体内的不同的重排的靶核酸分子杂交并促进其扩增。在一些实施例中,靶特异性引物可以包含至少一个尿嘧啶核苷酸。
[0338]
在一些实施例中,可以使用pcr和变性、引物退火和聚合酶延伸步骤的循环在设定温度下进行多重扩增持续设定的时间。在一些实施例中,使用约12个循环至约30个循环来在多重扩增反应中产生扩增子文库。在一些实施例中,使用13个循环、14个循环、15个循环、16个循环、17个循环、18个循环、19个循环、优选地20个循环、23个循环或25个循环来在多重扩增反应中产生扩增子文库。在一些实施例中,17
‑
25个循环用于在多重扩增反应中产生扩增子文库。
[0339]
在一些实施例中,扩增反应在单个反应阶段内并行进行(例如,在单个孔或管内的相同扩增反应混合物内)。在一些情况下,扩增反应可生成产物的混合物,包含预期的扩增子产物以及非预期的、不需要的非特异性扩增伪影,如引物
‑
二聚体两个方面。扩增后,然后用任何合适的试剂处理反应,所述试剂将选择性地裂解或以其它方式选择性破坏过量未掺入的引物和扩增伪影内的修饰核苷酸的核苷酸键,而不裂解或破坏规格扩增产物。例如,引物可以包含含尿嘧啶的核碱基,其可使用ung/udg(任选地加热和/或碱)选择性裂解。在一些实施例中,引物可以包含含尿嘧啶的核苷酸,其可使用ung和fpg选择性裂解。在一些实施例中,裂解处理包含暴露于氧化条件以选择性裂解二硫醇,用rnase h处理以选择性裂解修饰的核苷酸,包含rna特异性部分(例如核糖等)等。该切割处理可以有效地将原始扩增引物和非特异性扩增产物分裂成小核酸片段,每个核酸片段包含相对较少的核苷酸。此类碎片通常不能在升高的温度下促进另外扩增。通过所属领域已知的各种扩增后净化程序(例如,离心柱、naetoh沉淀等),也可相对容易地从反应池中除去此类碎片。
[0340]
在一些实施例中,任选地处理修饰核苷酸的核苷酸键的裂解或其它选择性破坏后的扩增产物,以产生在5'端具有磷酸的扩增产物。在一些实施例中,磷酸化处理包含酶促操作以产生5'磷酸化的扩增产物。在一个实施例中,酶如聚合酶可用于产生5'磷酸化的扩增产物。例如,t4聚合酶可用于制备5'磷酸化扩增子产物。klenow可与一种或多种其它酶一起使用以产生具有5'磷酸的扩增产物。在一些实施例中,所属领域已知的其它酶可用于制备具有5'磷酸基团的扩增产物。例如,含有尿嘧啶核苷酸的扩增产物与酶udg、fpg和t4聚合酶的孵育可用于产生在5'端具有磷酸的扩增产物。对于所属领域技术人员显而易见的是,除了本文具体描述的那些之外的其它技术可用于产生磷酸化的扩增子。应当理解,应用于实践本文公开的方法、系统、试剂盒、组合物和装置而不诉诸过度实验的此类变化和修改被认为在本公开的范围内。
[0341]
在一些实施例中,并入预期的(特异性)扩增产物中的引物,这些引物被类似地裂解或破坏,导致在特定扩增产物内形成“粘性端”(例如,5'或3'突出)。此类“粘性端”可用几种方式解决。例如,如果要克隆特异性扩增产物,可设计突出区以补充引入克隆载体中的突出,从而使得实现比平末端接合更快速和有效的粘性端接合。替代地,可能需要拯救突出(与几种新一代测序方法一样)。此类拯救可通过仅使用仅由天然碱基组成的正向和反向扩增引物(例如,对应于a和p1引物)的二次扩增反应来完成。以此方式,随后的几轮扩增重建双链模板,在引物破坏之前具有原始链的完整序列的扩增子的新生拷贝。替代地,可使用某些形式的填充和接合处理去除粘性端,其中正向和反向引物与模板粘接。然后聚合酶可以用于延伸引物,并且然后连接酶(任选地,热稳定连接酶)可以用于连接所得核酸链。这显然也可以通过如循环延伸
‑
接合等各种其它反应途径实现。在一些实施例中,可以使用一种或多种dna连接酶执行接合步骤。
[0342]
在一些实施例中,使用靶特异性引物对制备的扩增子文库可以用于下游富集应用,如乳液pcr、桥式pcr或等温扩增。在一些实施例中,扩增子文库可以用于富集应用和测序应用。例如,可以使用包含任何合适的下一代dna测序平台的任何合适的dna测序平台对扩增子文库进行测序。在一些实施例中,可以使用ion pgm测序仪或ion genestudio s5测序仪(赛默飞世尔科技公司)对扩增子文库进行测序。在一些实施例中,pgm测序仪或s5测序仪可以耦接到应用参数或软件以测定扩增的靶核酸分子的序列的服务器。在一些实施例
中,可以在不到24小时内对扩增子文库进行制备、富集和测序。在一些实施例中,扩增子文库可在约9小时内制备、富集和测序。
[0343]
在一些实施例中,用于产生扩增子文库的方法可以包含:使用v基因特异性和c基因特异性引物扩增免疫受体基因的cdna以产生扩增子;从输入的dna和引物中纯化扩增子;磷酸化扩增子;将衔接子接合到磷酸化的扩增子;纯化接合的扩增子;对扩增的扩增子进行切口平移;并纯化切口平移的扩增子以产生扩增子文库。在一些实施例中,用于产生扩增子文库的方法可以包含:使用v基因特异性和j基因特异性引物扩增免疫受体基因的cdna以产生扩增子;从输入的dna和引物中纯化扩增子;磷酸化扩增子;将衔接子接合到磷酸化的扩增子;纯化接合的扩增子;对扩增的扩增子进行切口平移;并纯化切口平移的扩增子以产生扩增子文库。在一些实施例中,可以在扩增重排免疫受体基因靶标以产生扩增子的步骤之后进行另外的扩增子文库操作。在一些实施例中,可以任何顺序进行另外的反应的任何组合,并且可以包含:纯化;磷酸化;接合衔接子;缺口平移;扩增和/或测序。在一些实施例中,可省略或可重复这些反应中的任何一种。对于所属领域技术人员来说显而易见的是,方法可重复或省略任何一个或多个上述步骤。对于所属领域技术人员来说显而易见的是,可修改步骤的顺序和组合以生成所需的扩增子文库,因此不限于所提供的示例性方法。
[0344]
磷酸化的扩增子可与衔接子连接以进行切口平移反应,随后的下游扩增(例如,模板制备),或用于附着到粒子(例如珠粒)或两者。例如,与磷酸化扩增子连接的衔接子可与附接到粒子的寡核苷酸捕获引物粘接,并且可进行引物延伸反应以生成附接到粒子或表面的扩增子的互补拷贝,从而将扩增子附接到表面或粒子。衔接子可具有一个或多个扩增引物杂交位点、测序引物杂交位点、条形码序列和其组合。在一些实施例中,通过本文公开的方法制备的扩增子可与一个或多个ion torrent
tm
相容的衔接子连接以构建扩增子文库。通过此类方法生成的扩增子可连接到一个或多个衔接子用于文库构建,以与下一代测序平台兼容。例如,通过本公开的教导产生的扩增子可以连接到在ion ampliseq
tm
文库试剂盒2.0或ion ampliseq
tm
文库试剂盒加(赛默飞世尔科技公司)中提供的衔接子。
[0345]
在一些实施例中,对免疫受体cdna或重排的gdna进行的扩增可以使用5x ion ampliseq
tm hifi主混合物进行。在一些实施例中,5x ion ampliseq
tm hifi主混合物可以包含甘油、dntp和dna聚合酶,如platinum
tm taq dna聚合酶高保真。在一些实施例中,5x ion ampliseq
tm hifi主混合物可以进一步包含以下中的至少一种:防腐剂、氯化镁、硫酸镁、三硫酸盐和/或硫酸铵。
[0346]
在一些实施例中,免疫受体重排的gdna多重扩增反应进一步包含至少一种用于改进靶上扩增(on
‑
target amplification)、扩增产量和/或生产性测序读段的百分比的pcr添加剂。在一些实施例中,所述至少一种pcr添加剂包含氯化钾或另外的dntp(例如,datp、dctp、dgtp、dttp)中的至少一种。在一些实施例中,作为pcr添加剂的dntp为dntp的等摩尔混合物。在一些实施例中,作为pcr添加剂的dntp为datp、dctp、dgtp和dttp的等摩尔混合物。在一些实施例中,将约0.2mm到约5.0mm dntp添加到多重扩增反应。在一些实施例中,可以使用5x ion ampliseq
tm hifi主混合物和反应混合物中的另外的约0.2mm到约5.0mm dntp执行对重排的免疫受体gdna进行的扩增。在一些实施例中,可在反应混合物中使用5x ion ampliseq
tm hifi主混合物和另外约0.5mm到约4mm、约0.5mm到约3mm、约0.5mm到约2.5mm、约0.5mm到约1.0mm、约0.75mm到约1.25mm、约1.0mm到约1.5mm、约1.0到约2.0mm、约
2.0mm到约3.0mm、约1.25到约1.75mm、约1.3到约1.8mm、约1.4mm到约1.7mm,或约1.5到约2.0mm dntp进行重排的免疫受体gdna的扩增。在一些实施例中,可在反应混合物中使用5x ion ampliseq
tm hifi主混合物和另外约0.2mm、约0.4mm、约0.6mm、约0.8mm、约1.0mm、约1.2mm、约1.4mm、约1.6mm、约1.8mm、约2.0mm、约2.2mm、约2.4mm、约2.6mm、约2.8mm、约3.0mm、约3.5mm或约4.0mm dntp进行重排的免疫受体gdna的扩增。在一些实施例中,将约10mm到约200mm的氯化钾添加到多重扩增反应。在一些实施例中,可在反应混合物中使用5x im ampliseq
tm hifi主混合物和另外约10mm到约200mm氯化钾进行重排的免疫受体gdna的扩增。在一些实施例中,可在反应混合物中使用5x ion ampliseq
tm hifi主混合物和另外约10mm到约60mm、约20mm到约70mm、约30mm到约80mm、约40mm到约90mm、约50mm到约100mm、约60mm到约120mm、约80mm到约140mm、约50mm到约150mm、约150mm到约200mm或约100mm到约200mm氯化钾进行重排的免疫受体gdna的扩增。在一些实施例中,可在反应混合物中使用5x ion ampliseq
tm hifi主混合物和另外约10mm、约20mm、约30mm、约40mm、约50mm、约60mm、约70mm、约80mm、约90mm、约100mm、约120mm、约140mm、约150mm、约160mm、约180mm或约200mm氯化钾进行重排的免疫受体gdna的扩增。
[0347]
在一些实施例中,扩增子的磷酸化可使用fupa试剂进行。在一些实施例中,fupa试剂可以包含dna聚合酶、dna连接酶、至少一种尿嘧啶裂解或修饰酶,和/或储存缓冲液。在一些实施例中,fupa试剂可以进一步包含以下中的至少一种:防腐剂和/或去污剂。
[0348]
在一些实施例中,扩增子的磷酸化可使用fupa试剂进行。在一些实施例中,fupa试剂可以包含dna聚合酶、至少一种尿嘧啶裂解或修饰酶、抗体和/或储存缓冲液。在一些实施例中,fupa试剂可以进一步包含以下中的至少一种:防腐剂和/或去污剂。在一些实施例中,提供抗体以在环境温度下抑制dna聚合酶和3'
‑
5'核酸外切酶活性。
[0349]
在一些实施例中,通过本公开内容的教导产生的扩增子文库的产率足以用于各种下游应用,包含ion chef
tm
仪器和ion s5
tm
测序系统(赛默飞世尔科技)。
[0350]
对于本领域的普通技术人员显而易见的是,用于克隆扩增的平台或方法,如野火(wildfire)pcr和桥式扩增可以结合本公开的扩增靶序列使用。还设想了本领域的普通技术人员在进一步精化或优化本文提供的条件时可以直接进行核酸测序(例如使用ion pgm
tm
系统或ion s5
tm
系统或ion proton
tm
系统测序仪,赛默飞世尔科技公司)而不执行克隆扩增步骤。
[0351]
在一些实施例中,待克隆扩增的扩增靶序列中的至少一个序列可以连接到载体或颗粒。载体可以包含任何合适的材料,并具有任何合适的形状,包含例如平面、球状或颗粒。在一些实施例中,载体是如美国公开申请第20100304982号中描述的支架聚合物颗粒,所述美国公开申请通过引用以其整体并入本文。
[0352]
在一些实施例中,提供了用于在单一反应中扩增来自核酸分子群的多个免疫受体表达序列的试剂盒。在一些实施例中,试剂盒包含含有一个或多个可切割基团的多个靶特异性引物对、一个或多个dna聚合酶、dntp的混合物和至少一种切割试剂。在一个实施例中,可切割基团为8
‑
氧代
‑
脱氧鸟苷、脱氧尿苷或溴脱氧尿苷。在一些实施例中,至少一种裂解试剂包含rnaseh、尿嘧啶dna糖基化酶、fpg或碱。在一个实施例中,裂解试剂为尿嘧啶dna糖基化酶。在一些实施例中,提供试剂盒以在单个反应室或容器中进行多重pcr。在一些实施例中,试剂盒包含至少一种dna聚合酶,其为热稳定dna聚合酶。在一些实施例中,与单个pcr
反应相比,一种或多种dna聚合酶的浓度以3倍过量存在。在一些实施例中,每种靶特异性引物对的最终浓度以约5nm到约2000nm存在。在一些实施例中,每种靶特异性引物对的最终浓度以约25nm到约50nm或约100nm到约800nm存在。在一些实施例中,每种靶特异性引物对的最终浓度以约50nm到约400nm或约50nm到约200nm存在。在一些实施例中,每种靶特异性引物对的最终浓度以约200nm或约400nm存在。在一些实施例中,该试剂盒提供来自单个反应室中的核酸分子群的tcrβ、tcrα、tcrγ、tcrδ、免疫球蛋白重链γ、免疫球蛋白重链μ、免疫球蛋白重链α、免疫球蛋白重链δ、免疫球蛋白重链ε、免疫球蛋白轻链λ或免疫球蛋白轻链κ的免疫组库表达序列的扩增。在特定实施例中,提供的试剂盒为测试试剂盒。在一些实施例中,试剂盒进一步包括一个或多个衔接子、条形码和/或抗体。
[0353]
表2——igh v基因fr3
[0354]
[0355]
[0356]
[0357][0358]
表3——igh v基因fr1
[0359]
[0360]
[0361]
[0362]
[0363]
[0364]
[0365]
[0366][0367]
表4——igh v基因fr2
[0368]
序列seq id noctgggtgcgacaggcccctggacaa431tggatccgtcagcccccagggaagg432ggtccgccaggctccagggaa433tggatccgccagcccccagggaagg434gggtgcgccagatgcccgggaaagg435tggatcaggcagtccccatcgagag436ttgggtgcgacaggcccctggacaa437
[0369]
表5——igh j基因
[0370]
序列seq id nogaggagacggtgaccgtg438gagacagtgaccagggtgc439gagacggtgaccattgtcc440tgaggagacggtgaccagg441ccagtggcagaggagtccattc442gaggagacggugaccgug443gagacagugaccagggugc444gagacggugaccattgucc445tgaggagacggugaccagg446ccaguggcagaggagtccatuc447
[0371]
表6——igh c基因a同种型
[0372]
[0373][0374]
表7——igh c基因d同种型
[0375]
序列seq id nogacagtcacggacgttggg472accacagggctgttatcctttgg473accacagggctgttatcctttg474caggaccacagggctgttatcctt475caggaccacagggctgttatcct476cccatgtaccaggtgacagtcac477cccatgtaccaggtgacagtca478cccatgtaccaggtgacagtc479gacagucacggacgtuggg480accacagggcugttatccttugg481accacagggcugttatccttug482caggaccacagggcugttatccut483caggaccacagggcugttaucct484cccatguaccaggtgacagucac485cccatguaccaggtgacaguca486cccatguaccaggtgacaguc487
[0376]
表8——igh c基因g同种型
[0377]
[0378][0379]
表9——igh c基因m同种型
[0380]
[0381][0382]
表10——igh c基因e同种型
[0383]
[0384][0385]
对各种示例性实施例的以下描述仅是示例性和说明性的,并且不应以任何方式解释为有限或限制性的。根据说明书和附图以及权利要求,本教导的其它实施例、特征、目的和优点将显而易见。
[0386]
尽管本说明书详细描述了某些示例性实施例,但是其它实施例也是可能的并且在本发明的范围内。考虑到说明书和附图以及权利要求书、说明书和附图中描述的教导的实践,变化和修改对于所属领域技术人员来说是显而易见的。
[0387]
实例
[0388]
所提供的免疫组库组合物包含但不限于设计用于文库制备和对表达的igh序列和重排的基因组igh序列进行测序的试剂。通常,对从样品(例如,血液样品、分选的细胞样品、正常组织样品、肿瘤样品(例如,各种类型的新鲜、冷冻、ffpe))中提取的rna进行逆转录;从样品中提取gdna;例如,使用ion chef
tm
或ion onetouch
tm 2系统产生文库,制备模板,然后使用下一代测序技术,例如,ion s5
tm
系统和ion pgm
tm
系统对制备的模板进行测序,以及使用ion reporter
tm
软件执行序列分析。适于从生物样品中提取和/或分离rna和基因组dna的试剂盒可从例如赛默飞世尔科技公司和生物链研究所公司商购获得。
[0389]
实例1
[0390]
根据制造商的说明,用superscript
tm iv vilo
tm
主混合物(赛默飞世尔科技公司)将来自外周血白细胞的总rna逆转录为cdna。cdna(25ng或50ng)用于多重pcr,以扩增igh和/或tcrβcdr3结构域序列。在一个多重pcr中,选自表2和5的正向引物和反向引物的组用作在从v基因fr3区到igh cdna的j基因的序列进行扩增时的引物对。在另一个多重pcr中,在同一反应中扩增igh和tcrβ的fr3
‑
j区时,将这些相同的igh正向和反向fr3
‑
j引物的组与来自oncomine
tm tcrβ
‑
sr测定(rna)的tcrβfr3
‑
j引物组结合。在另一个多重pcr中,将oncomine
tm tcrβ
‑
sr测定rna(赛默飞世尔科技公司)用于扩增tcrβcdna的fr3
‑
j区的序列。在示例性igh v基因fr3
‑
j扩增反应中,所述多重引物组包含68个不同的ighv正向引物seq id no:69
‑
136和4个不同的ighj反向引物seq id no:443
‑
446。
[0391]
通常,多重扩增反应执行如下。向96孔pcr板的单个孔中加入10微升制备的cdna
(25ng或50ng)、4微升2μm正向和反向引物池、4微升5x ion ampliseq
tm hifi混合物(可以包含甘油、dntp和taq高保真dna聚合酶(英杰公司,目录号:11304)的扩增反应混合物)以及2微升dnase/rnase游离水以将最终反应体积调至20微升。以相同的方式制备igh+tcrβ(1个池)反应。根据制造商的说明执行oncomine
tm tcrβ
‑
sr测定rna。
[0392]
将pcr板密封,使反应混合物混合并装载到热循环仪(例如,veriti
tm 96孔热循环仪(应用生物系统公司))中,并且在以下温度曲线下运行以产生扩增子文库。在95℃下执行初始保持阶段持续2分钟,然后在95℃下进行约20个循环的变性阶段持续15秒,在60℃下进行退火阶段持续45秒,并且在72℃下进行延伸阶段持续45秒。在循环后,在72℃下执行最终延伸持续10分钟,并且将扩增子文库保持在10℃下直到继续进行。通常,使用约20个循环来产生扩增子文库。对于一些应用,可以使用多达30个循环。
[0393]
在继续进行之前,将扩增子样品短暂地离心以收集内容物。向扩增子文库(约20微升)中加入2微升的fupa试剂。将反应混合物密封,彻底混合以确保均匀性并在50℃下温育10分钟,在55℃下温育10分钟,在60℃下温育20分钟,然后在10℃下保持长达1小时。在继续进行之前,将样品短暂地离心以收集内容物。
[0394]
温育后,反应混合物直接进行到接合步骤。此处,现在将含有磷酸化扩增子文库的反应混合物与2微升离子选择条形码衔接子(每种5μm)(赛默飞世尔科技公司)、4微升ampliseq加转换溶液(作为ion ampliseq
tm
文库试剂盒加的组分出售,赛默飞世尔科技公司)和最后添加的2微升dna连接酶(作为ion ampliseq
tm
文库试剂盒加的组分出售,赛默飞世尔科技公司),然后在以下情况下温育:22℃下持续30分钟、68℃下持续5分钟、72℃下持续5分钟,然后在10℃下保持长达1小时。在继续进行之前,将样品短暂地离心以收集内容物。
[0395]
在温育步骤后,将45微升(1.5x样品体积)室温xp珠粒(贝克曼库尔特公司(beckman coulter))加入接合的dna,并且使混合物彻底移液以使珠粒悬浮液与dna混合。将混合物在室温下温育5分钟,置于如dynamag
tm
‑
96侧磁体(英杰公司,部件号:12331d)等磁架上持续两分钟。在溶液澄清后,丢弃上清液。在不从磁架上去除板的情况下,将150微升新鲜制备的70%乙醇引入样品中,并温育同时轻轻旋转磁架上的管。在溶液澄清后,在不影响沉淀的情况下丢弃上清液。进行第二次乙醇洗涤,丢弃上清液,通过脉冲旋转管除去任何剩余的乙醇并小心地除去残留的乙醇,同时不干扰沉淀。将沉淀在室温下风干约5分钟。在50微升低te缓冲液中从珠粒上洗脱接合的dna。
[0396]
根据制造商的说明,使用离子文库定量试剂盒(离子激流公司,目录号:4468802),通过qpcr对洗脱的文库进行定量。在定量后,将文库稀释到约25pm的浓度。
[0397]
根据制造商的说明,使用ion chef
tm
仪器将文库归一化为20pm,并且将最终文库用于模板制备和芯片装载。根据制造商的说明,使用ion s5
tm
系统上的ion 540
tm
芯片执行测序,并且使用ion torrent suite
tm
软件执行基因序列分析。由于序列是根据使用j基因引物产生的,因此所述序列经受j基因序列推断过程,所述推断过程涉及向序列读段添加推断的j基因序列以产生延伸的序列读段,将延伸的序列读段与参考序列比对,并鉴别生产性读段,如本文所述。另外,所生成的序列数据中的所有序列数据将进一步经受本文提供的错误鉴别和去除程序。
[0398]
对12个文库进行测序导致每样品平均具有6m个读段。如图3所示,当单独执行igh
测定时,高达66%的总读段是生产性的。当将igh(bcr)测定和tcrβ(tcr)测定结合时,约12%的读段是生产性igh读段,而约58%的读段是tcrβ生产性读段。
[0399]
检测到的b细胞克隆和t细胞克隆的总数与血液中的淋巴细胞的相对丰度成比例。如图4a所示,当单独进行igh测定时,鉴别出约45,000个bcr克隆,并且当将igh和tcrβ引物组合时,鉴别出约30,000个bcr克隆。由于在测序之前对文库进行归一化,并且降低了bcr的读段深度,因此预期在两次测定之间检测到的bcr克隆数的这种差异。将bcr和tcr测定合并到一个池中相对于在两个单独的池中进行扩增时,克隆数的相似性表明合并的扩增反应中没有引物干扰。igh(bcr)和tcrβ(tcr)克隆的群体与外周血中b细胞和t细胞的相对丰度成比例(图4b)。t淋巴细胞和b淋巴细胞的相对比例可以分别在61
‑
85%和7
‑
23%的范围内(palmer等人.(2006)上海启因生物科技有限公司(bmc genomics)7:115)。
[0400]
实例2
[0401]
从生物样品中分离出白细胞基因组dna,并将其用于多重pcr中以评估样品中的igh免疫组库。在多重pcr中,在对从v基因fr3区到重排的igh gdna的j基因的序列进行扩增时,将来自igh v基因fr3区的正向引物和来自igh j基因的反向引物的组用作引物对。示例性引物组包含选自表2和5的正向引物和反向引物的组,如包含ighv正向引物seq id no:69
‑
136和ighj反向引物seq id no:443
‑
446的多重引物组。
[0402]
向96孔pcr板的单个孔中加入250ng白细胞gdna、4微升1μm引物混合物(fr3正向引物和j反向引物,每种1μm)、4微升5x ion ampliseq
tm hifi混合物(英杰公司,目录号:11304)、2微升dntp混合物(dgtp、dctp、datp和dttp;每种7.5mm)以及dnase/rnase游离水以将最终反应体积调至20微升。
[0403]
将pcr板密封,使反应混合物混合,并将板装载到热循环仪(例如,veriti
tm 96孔热循环仪(应用生物系统公司)中,并且在以下温度曲线下运行以产生扩增子文库。在95℃下执行初始保持阶段持续2分钟,然后在95℃下进行约25个循环的变性阶段持续30秒,在60℃下进行退火阶段持续45秒,并且在72℃下进行延伸阶段持续45秒。在循环后,在72℃下执行最终延伸持续10分钟,并且将扩增子文库保持在10℃下直到继续进行。对于一些应用,所使用的循环可以在约17到约30个循环的范围内。如实例1中所述执行扩增子和文库制备、芯片装载、测序和序列数据处理。白细胞gdna测定产生约1.3m个序列读段,其中约50%为生产性的。平均序列读段长度为103个核苷酸,并鉴别出约1000个igh克隆。
[0404]
实例3
[0405]
表2的igh v基因fr3引物和表5的igh j基因引物被设计为扩增目前已知的表达或gdna人igh重排中的所有重排。在多重pcr中,选自表2和5的正向引物和反向引物的池用作在从v基因fr3区到igh cdna的j基因的序列进行扩增时的引物对。在示例性igh v基因fr3
‑
j扩增反应中,多重引物组池包含正向引物seq id no:69
‑
136和反向引物seq id no:443
‑
446。对来自多种人细胞和组织样品的cdna执行测定。
[0406]
根据制造商的说明,用superscript
tm iv vilo
tm
主混合物(赛默飞世尔科技公司)将来自人类成人归一化外周血白细胞(来自生物链研究所公司)的总rna逆转录为cdna。向96孔pcr板的单个孔中加入10微升制备的cdna(50ng)、4微升1μm正向和反向引物池、4微升5x ion ampliseq
tm hifi混合物(赛默飞世尔科技公司)以及2微升dnase/rnase游离水以将最终反应体积调至20微升。将pcr板密封,使反应混合物混合并装载到热循环仪(例如,
veriti
tm 96孔热循环仪(应用生物系统公司))中,并且在以下温度曲线下运行以产生扩增子文库。在95℃下执行初始保持阶段持续2分钟,然后在95℃下进行约20个循环的变性阶段持续15秒,在60℃下进行退火阶段持续45秒,并且在72℃下进行延伸阶段持续45秒。在循环后,在72℃下执行最终延伸持续10分钟,并且将扩增子文库保持在10℃下直到继续进行。通常,使用约20个循环来产生扩增子文库。对于一些应用(例如,或多或少的cdna起始材料,ffpe来源的rna等),可以减少(例如,
‑
3)或增加(例如,+3、+6,最多30个循环)循环数。
[0407]
在继续进行之前,将扩增子样品短暂地离心以收集内容物。向扩增子文库(约20微升)中加入2微升的fupa试剂。将反应混合物密封,彻底混合以确保均匀性并在50℃下温育10分钟,在55℃下温育10分钟,在60℃下温育20分钟,然后在10℃下保持长达1小时。在继续进行到接合步骤之前,将样品短暂地离心以收集内容物。现在将含有磷酸化扩增子文库的反应混合物与2微升ion torrent
tm
双条形码衔接子(赛默飞世尔科技公司)、4微升ampliseq加转换溶液(作为ion ampliseq
tm
文库试剂盒加的组分出售,赛默飞世尔科技公司)和最后添加的2微升dna连接酶(作为ion ampliseq
tm
文库试剂盒加的组分出售,赛默飞世尔科技公司),然后在以下情况下温育:22℃下持续30分钟、68℃下持续5分钟、72℃下持续5分钟,然后在10℃下保持长达1小时。在继续进行到文库纯化步骤之前,将样品短暂地离心以收集内容物。
[0408]
在接合步骤温育后,将45微升(1.5x样品体积)室温xp珠粒(贝克曼库尔特公司(beckman coulter))加入连接的dna,并且使混合物彻底移液以使珠粒悬浮液与dna混合。将混合物在室温下温育5分钟,置于如dynamag
tm
‑
96侧磁体(英杰公司,部件号:12331d)等磁架上持续两分钟。在溶液澄清后,丢弃上清液。在不从磁架去除板的情况下,将150微升新鲜制备的70%乙醇引入样品中,并保温同时轻轻旋转磁架上的管。在溶液澄清后,在不影响沉淀的情况下丢弃上清液。进行第二次乙醇洗涤,丢弃上清液,通过脉冲旋转管除去任何剩余的乙醇并小心地除去残留的乙醇,同时不干扰沉淀。将沉淀在室温下风干约5分钟。在50微升低te缓冲液中从珠粒上洗脱接合的dna。
[0409]
根据制造商的说明,使用离子文库定量试剂盒(离子激流公司,目录号:4468802),通过qpcr对洗脱的文库进行定量。在定量后,将文库稀释到约25pm的浓度。
[0410]
根据制造商的说明,使用ion chef
tm
仪器将文库归一化为25pm,并且将最终文库用于模板制备和芯片装载。根据制造商的说明,使用ion s5
tm
系统上的ion 540
tm
芯片执行测序,并且使用ion torrent suite
tm
软件执行基因序列分析。由于序列是根据使用j基因引物产生的,因此所述序列经受j基因序列推断过程,所述推断过程涉及向序列读段添加推断的j基因序列以产生延伸的序列读段,将延伸的序列读段与参考序列比对,并鉴别生产性读段,如本文所述。另外,所生成的序列数据中的所有序列数据将进一步经受本文提供的错误鉴别和去除程序。
[0411]
表11中示出了从将4个单独的外周血白细胞rna的管用作起始样品进行igh fr3
‑
j测定的示例性结果。这些测定中的每个测定均产生2
‑
3m个原始序列读段,其中约75%为生产性的。均匀度(也被称为克隆归一化香农熵)描述了样品中均匀的克隆表示如何;越接近1.0,克隆群体的大小就越均匀。
[0412]
表11
[0413][0414]
从人细胞和组织样品(生物链研究所公司)获得总rna,此类样品中通常存在的b细胞的量不同。rna样品包含从分离的cd19+细胞、正常脾组织、外周血白细胞(pbl)、骨髓、正常脑组织、肺肿瘤组织(ffpe)、扁桃体(ffpe)和jurkat细胞(t细胞系)中提取的样品。对于每个总rna样品,如上所述,制备cdna并使用包含seq id no:69
‑
136和443
‑
446的引物组进行多重扩增。从所得的扩增子制备文库,并如上所述对文库进行测序。表12中示出了各种样品的测定结果,并且图5a
‑
5g描绘了针对pbl、cd19+细胞、扁桃体ffpe、肺肿瘤ffpe、骨髓、脾和脑rna样品获得的读段长度直方图。除了来自jurkat细胞和正常脑组织样品的结果外,这些测定中的每个测定导致约70
‑
80%的序列读段为生产性igh读段。jurkat细胞rna样品用作阴性对照物,因为所述样品是不表达igh的t细胞系。
[0415]
表12
[0416][0417]
实例4
[0418]
表3的igh v基因fr1引物和表6
‑
10的igh c基因引物被设计为扩增目前已知的表达的人igh重排中的所有重排。使用选自表3的正向引物和选自表6
‑
10的反向引物产生用于对v基因fr1区到igh cdna的c基因的序列进行扩增的各种引物组。引物组中的一些引物组包含针对igh同种型iga、igd、igg、igm和ige中的igh同种型中的每个同种型的c基因的至少一个引物。表13中描述了示例性fr1
‑
c引物组组,其中所述组中的每个引物的浓度为1微摩尔。
[0419]
表13
[0420][0421]
如实例3所述,从pbl总rna中制备cdna。使用50ng pbl cdna和表13的引物组执行多重扩增反应,从所得扩增子制备文库,并对文库进行测序,如实例3中所述。图6描绘了针对示例性引物组1
‑
7获得的所得序列读段长度。表14中示出了来自这些引物组的示例性测定结果。
[0422]
表14
[0423][0424]
在所提供的多重扩增和测序分析工作流程中,使用选自表6
‑
10的一个或多个c基因引物进行的b细胞组库分析导致对所检测的igh克隆序列进行同种型表征。使用包含针对同种型iga、igd、igg、igm和ige中的每个同种型的c基因的至少一个引物的引物组,检测并表征样品中b细胞受体组库和克隆谱系的所有同种型。图7a
‑
7b示出了来自如在igh v基因fr1
‑
c多重扩增反应(用25
‑
50ng cdna输入)和如上所述的测序分析中使用表13的引物组8检测到的pbl样品的示例性同种型使用结果。图7的条形图示出了pbl样品内的通过每同种型读段数(图7a)和每同种型克隆和谱系数(图7b)报告的总同种型表示的汇总。考虑到pbl rna中iga和igg同种型的较高表达,预期获得的同种型表示(iga和igg比igm、igd和ige的表示更高)。
[0425]
本文提供的生物信息学工作流程鉴别克隆谱系的体细胞超突变并产生样品的体细胞超突变谱。例如,图8a
‑
8b示出了来自在igh v基因fr1
‑
c多重扩增反应(用25
‑
50ng cdna输入)和如上所述的测序分析中使用表13的引物组8测定的pbl rna样品的示例性smh谱。图8a示出了样品的所有同种型的igh v基因突变率的直方图,并且报告了没有shm的克隆的预期群体和具有高达约15%的shm的克隆的分布。图8b所示的smh谱表示同种型igd(即预期具有低shm率的初始b细胞同种型)的igh v基因突变。
[0426]
本文提供的序列分析工作流程可以包含可以帮助例如由于跨测定的测序深度的
差异而消除变异性的下采样分析。对于此类下采样分析,在克隆分析之前将序列读段随机去除到固定的读段深度。对于此类分析,使用25
‑
50ng cdna输入和表13的引物组9以及如上所述的测序工作流程,在igh v基因fr1
‑
c多重扩增反应中对pbl rna样品进行测定。使生成的序列数据经受本文提供的错误鉴别和去除步骤,并且鉴别样品的生产性读段(即,生产性读段和拯救的生产性读段)组。将整组生产性读段用作起始点并且然后随机选择固定数量的读段下采样到所选固定深度中的每个固定深度。执行下采样到以下固定深度:10k、50k、250k、500k、750k、1m、1.5m和2m读段。由于每个下采样分析都是从整组生产性读段开始的,因此较低下采样深度的读段不一定是较高下采样深度的读段的子集。利用下采样的数据集以及总生产性读段数据集中的每一个执行克隆分析。在将下采样应用于igh序列读段之后,图9中示出了示例性克隆分析的结果。图9的曲线图描绘了下采样的数据集中的每个数据集和样品的总生产性读段(每个曲线图上的最右边的点)的检测到的克隆数和谱系数、克隆和谱系香农多样性以及克隆和谱系均匀度。下采样分析允许用户鉴别将特定样品测序到饱和的点,这意指另外的读段未鉴别另外的克隆或谱系或向所检测的组库添加另外的都阳性的点。例如,下采样允许用户在利用类似样品类型进行测定之间或在未来测定时对测序深度或多重化进行精化。
[0427]
实例5
[0428]
产生20个对照质粒的文库(表15)以代表一组各种igh序列并用于评估本文提供的测定和工作流程的性能。每个对照质粒均含有来自11种慢性淋巴细胞白血病(cll)之一或广泛中和的hiv
‑
1抗体(bnab)谱系的9个成员之一的igh cdna的vdj区到c基因ch1结构域(约恒定基因的前300bp)(liao等人.(2013)《自然》496:469
‑
476)。对照质粒文库包含所有igh同种型和cll重排的代表,以最大化v基因多样性,包含种系和突变的重排。每个质粒的总igh插入物长度为约650bp。对照质粒文库中的一些质粒设计有fr1区内的阻碍引物结合(质粒18)的核苷酸突变或具有同种型错误(质粒17和20)。对照文库还包含产生的具有框外非功能性受体序列的质粒(质粒19),所述序列将在序列分析工作流程中作为非生产性读段而被过滤掉。
[0429]
表15
[0430]
[0431][0432]
为了评估测定和工作流程的检测限,在100ng白细胞cdna的背景下使用单一已知的输入浓度的合并质粒来制备对照文库。质粒输入浓度在10pg到0.00001pg(相当于5m份拷贝到约5份拷贝)的范围内。在用于测定之前,将对照质粒线性化(单独或大量)或保持完整。使用表13的引物组8或引物组9,其中每个引物处于200nm处,在多重反应中对合并的文库进行扩增,并且如实例4所述执行扩增和测序。使所生成的序列数据经受本文所提供的错误鉴别和去除程序。
[0433]
如图10所示,在1pm的等摩尔浓度下,对20个对照质粒的池进行测定的性能导致所检测的质粒频率在一个数量级内。在测定中未检测处设计有序列错误而不产生生产性序列读段的对照质粒17
‑
20。
[0434]
使用含有对照质粒2(jx432218.1_ighv3
‑
9*01_96.3_igha1)的igh vdj
‑
c插入物的合成寡核苷酸用于评估检测限并表明测定和分析工作流程鉴别和检测所关注的单个克隆的频率的能力。以不同的浓度向25ng pbl总rna样品加入对照合成寡核苷酸,并且使用与igh v基因fr3
‑
j多重引物组进行的多重反应并且执行如上文和实例3中所述的扩增、测序和分析来测定对照序列的克隆型频率,所述多重引物组包含正向引物seq id no:69
‑
136和反向引物seq id no:443
‑
446,其中每个引物处于200nm。对照寡核苷酸输入量在0.1pg到0.00001pg的范围内。表16示出了复制品测定的克隆检测频率。
[0435]
表16
[0436][0437][0438]
在其它克隆型频率检测测定中,以0.1pg到0.0000001pg的输入量向50ng pbl总rna、100ng pbl总rna和100ng骨髓(bm)总rna加入含有对照质粒2(jx432218.1_ighv3
‑
9*01_96.3_igha1)的igh vdj
‑
c插入物的合成寡核苷酸。使用包含正向引物seq id no:69
‑
136和反向引物seq id no:443
‑
446的igh v基因fr3
‑
j多重引物组执行多重扩增反应,并且对所得扩增子执行测序和分析,如实例3所述。在dna测定中,以0.1pg到0.0000001pg的输入量向1μg pbl gdna添加合成寡核苷酸。使用包含正向引物seq id no:69
‑
136和反向引物
seq id no:443
‑
446的多重引物组执行多重扩增反应,并且对所得扩增子执行测序和分析,如实例2所述。表17中示出了此类克隆频率测定的示例性检测限结果。igh fr3
‑
j测定能够利用仅使用100ng的输入pbl或骨髓rna的单个文库以介于7.6x10
‑6与1.0x 10
‑6之间的频率鉴别对照cll序列。igh fr3
‑
j测定能够使用1μg的输入pbl gdna以约5.2x10
‑6鉴别对照cll序列。在使用一系列输入量的寡核苷酸的1μg骨髓gdna的背景下执行相同的测定,并且使用ion s5
tm
系统和ion 540
tm
芯片将所得文库测序到10m个读段的目标深度。具有骨髓背景的igh fr3
‑
j dna测定能够使用单个文库检测对照cll序列的频率为10
‑5。
[0439]
表17
[0440][0441]
对于使用igh v基因fr1
‑
c引物组进行的克隆型频率检测测定,以0.1pg to 0.0000001pg的输入量向50ng骨髓(bm)总rna加入含有对照质粒13(kc575862.1_ighv4
‑
59*01_96.9_ighm*01)的igh vdj
‑
c插入物的合成寡核苷酸。使用表13的多重引物组9执行多重扩增反应,并且对所得扩增子执行测序,如实例3所述。表18中示出了此类克隆频率测定的示例性检测限结果。igh fr1
‑
c测定能够利用仅使用50ng的输入骨髓rna的单个文库以介于1.1x10
‑4与8.7x 10
‑5之间的频率鉴别对照bnab序列。
[0442]
表18
[0443][0444]
使用具有cll衍生的插入物的对照质粒评估本文提供的测定和工作流程的对体细胞超突变(shm)和种系和突变的cll igh克隆的同种型进行定量的能力。向pbl总rna背景加入表15的所选质粒构建体。使用表13的多重引物组9执行多重扩增反应,并如实例3所述制备文库并对其进行测序,并分析序列,其中使用ion s5
tm
系统和ion 530
tm
芯片将文库测序到1.5m个读段的长度。表19中示出了此类shm定量测定的示例性结果。表19示出了基于测定
的输入的每个质粒的预期的shm状态、shm频率和同种型以及来自测定结果的每个质粒的观察的shm状态、shm频率和同种型。如图所示,测定准确地定量对照cll组的shm和同种型。
[0445]
表19
[0446][0447]
检测限、克隆型频率检测以及shm和同种型定量的此类结果证明所提供的测定和分析工作流程的鉴别和检测罕见的bcr克隆的能力。此能力非常适于纵向研究,在所述研究中跟踪特定克隆(或小组克隆)的频率。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1