新酯酶及其用途的制作方法
新酯酶及其用途
1.相关申请
2.本发明涉及新酯酶,更特别地涉及与亲本酯酶相比具有改进的活性和/或改进的热稳定性的酯酶。本发明还涉及所述新酯酶用于降解含聚酯材料(如塑料制品)的用途。本发明的酯酶特别适用于降解聚对苯二甲酸乙二醇酯和含有聚对苯二甲酸乙二醇酯的材料。
背景技术:
3.酯酶能够催化各种聚合物(包括聚酯)的水解。在这种情况下,酯酶已经在许多工业应用中显示出有希望的效果,包括作为洗碗和洗衣应用的洗涤剂、作为用于处理生物质和食品的降解酶、作为环境污染物去毒中的生物催化剂或用于处理纺织工业中的聚酯织物。使用酯酶作为降解酶来水解聚对苯二甲酸乙二醇酯(pet)是特别令人感兴趣的。实际上,pet用于众多技术领域,例如用于制造服饰、地毯或以热固性树脂形式用于制造包装材料或汽车塑料制品等,从而填埋场中的pet积累变成与日俱增的生态问题。
4.聚酯(特别是pet)的酶促降解被认为是减少这种塑料废物积累的令人感兴趣的解决方案。实际上,酶可以加速含聚酯材料(更特别是塑料制品)的水解,甚至达到单体水平。此外,水解产物(即单体和低聚物)可以作为合成新聚合物的材料再循环。
5.在这种情况下,已经鉴定了几种酯酶作为用于聚酯的候选降解酶,并且已经开发了这种酯酶的一些变体。在酯酶中,角质酶,也称为角质水解酶(ec 3.1.1.74),是特别令人感兴趣的。已经从各种真菌(p.e.kolattukudy in"lipases",ed.b.borg
‑
str
ó
m and h.l.brockman、elsevier 1984、471
‑
504)、细菌和植物花粉中鉴定了角质酶。最近,宏基因组学途径已经鉴定了其他酯酶。
6.但是,仍然需要与已知酯酶相比具有改进的活性和/或改进的热稳定性的酯酶,以提供更有效的聚酯降解方法,从而更具竞争力。
7.发明概述
8.本发明提供与具有seq id n
°
1所示的氨基酸序列的亲本或野生型酯酶相比,表现出增加的活性和/或增加的热稳定性的新酯酶。该野生型酯酶对应于sulaiman et al.,appl environ microbiol.2012mar中描述的宏基因组衍生的角质酶的氨基酸序列的氨基酸36
‑
293,并且在swissprot中被称为g9by57。本发明的酯酶在降解塑料制品,特别是含有pet的塑料制品的方法中特别有用。
9.在这方面,本发明的一个目的是提供酯酶,其(i)与seq id n
°
1所示的全长氨基酸序列具有至少75%、80%、85%、90%、95%或99%的同一性,和(ii)在对应于选自以下的残基的位置处具有至少一个氨基酸取代:t11、r12、a14、w69、r73、a205、n214、a215、a216、i217、f238、v242、d244、p245、a246、l247、d94、r138、d158、q182、f187、p10、l15、d18、n87、s88、s95、q99、k159、a174、a125和s218,其中所述位置通过参考seq id n
°
1所示的氨基酸序列编号,和(iii)与seq id n
°
1的酯酶相比,显示出增加的聚酯降解活性和/或增加的热稳定性。
10.本发明的另一个目的是提供编码本发明的酯酶的核酸。本发明还涉及包含所述核
酸的表达盒或表达载体,并且涉及包含所述核酸、表达盒或载体的宿主细胞。
11.本发明还提供包含本发明的酯酶、本发明的宿主细胞或其提取物的组合物。
12.本发明的进一步目的是提供生产本发明酯酶的方法,其包括:
13.(a)在适于表达编码酯酶的核酸的条件下培养根据本发明的宿主细胞;和任选地
14.(b)从细胞培养物回收所述酯酶。
15.本发明的进一步目的是提供降解聚酯的方法,其包括:
16.(a)使聚酯与根据本发明的酯酶或根据本发明的宿主细胞或根据本发明的组合物接触;和任选地
17.(b)回收单体和/或低聚物。
18.特别地,本发明提供降解pet的方法,其包括使pet与至少一种本发明的酯酶接触,和任选地回收pet的单体和/或低聚物。
19.本发明还涉及降解含聚酯材料的至少一种聚酯的方法,其包括以下步骤:
20.(a)使含聚酯材料与根据本发明的酯酶或宿主细胞接触,从而降解含聚酯材料的至少一种聚酯;和任选地
21.(b)回收所述至少一种聚酯的单体和/或低聚物。
22.本发明还涉及本发明的酯酶在降解pet或含pet的塑料制品中的用途。
23.本发明还涉及含聚酯材料,其中包括本发明的酯酶或宿主细胞或组合物。
24.本发明还涉及包含根据本发明的酯酶或宿主细胞的洗涤剂组合物或包含本发明的酯酶的组合物。
25.发明详述
26.定义
27.通过参考以下定义将最好地理解本公开。
28.本文中,术语“肽”、“多肽”、“蛋白质”、“酶”是指通过肽键连接的氨基酸链,而不管形成所述链的氨基酸的数量。本文中,氨基酸根据以下命名法由它们的单字母或三字母代码表示:a:丙氨酸(ala);c:半胱氨酸(cys);d:天冬氨酸(asp);e:谷氨酸(glu);f:苯丙氨酸(phe);g:甘氨酸(gly);h:组氨酸(his);i:异亮氨酸(ile);k:赖氨酸(lys);l:亮氨酸(leu);m:甲硫氨酸(met);n:天冬酰胺(asn);p:脯氨酸(pro);q:谷氨酰胺(gln);r:精氨酸(arg);s:丝氨酸(ser);t:苏氨酸(thr);v:缬氨酸(val);w:色氨酸(trp)和y:酪氨酸(tyr)。
29.术语“酯酶”是指根据酶命名法属于分类为ec 3.1.1的一类水解酶的酶,其催化酯水解成酸和醇。术语“角质酶”或“角质水解酶”是指根据酶命名法分类为ec 3.1.1.74的酯酶,其能够催化由角质和水生产角质单体的化学反应。
30.术语“野生型蛋白质”或“亲本蛋白质”是指天然存在的多肽的非突变形式。在本案中,亲本酯酶是指具有seq id n
°
1所示的氨基酸序列的酯酶。
31.术语“突变体”和“变体”是指衍生自seq id n
°
1且在一个或多个(例如,几个)位置处包含至少一种修饰或改变,即取代、插入和/或缺失并具有聚酯降解活性的多肽。可以通过本领域熟知的各种技术获得变体。特别地,用于改变编码野生型蛋白质的dna序列的技术的实例包括但不限于定点诱变、随机诱变和合成寡核苷酸构建。因此,本文所用的与特定位置有关的术语“修饰”和“改变”是指与野生型蛋白质中该特定位置处的氨基酸相比,该特定位置处的氨基酸已被修饰。
[0032]“取代”是指一个氨基酸残基被另一个氨基酸残基取代。优选地,术语“取代”是指由另一个氨基酸残基替换一个氨基酸残基,所述另一个氨基酸残基选自天然存在的20个标准氨基酸残基、天然存在的稀有氨基酸残基(例如羟脯氨酸、羟赖氨酸、别羟基赖氨酸、6
‑
n
‑
甲基赖氨酸、n
‑
乙基甘氨酸、n
‑
甲基甘氨酸、n
‑
乙基天冬酰胺、别异亮氨酸、n
‑
甲基异亮氨酸、n
‑
甲基缬氨酸、焦谷氨酰胺、氨基丁酸、鸟氨酸、正亮氨酸、正缬氨酸)和通常是合成的非天然存在的氨基酸残基(例如环己基
‑
丙氨酸)。优选地,术语“取代”是指由另一个选自天然存在的20个标准氨基酸残基(g、p、a、v、l、i、m、c、f、y、w、h、k、r、q、n、e、d、s和t)替换一个氨基酸残基。符号“+”表示取代的组合。在本文件中,以下术语用于表示取代:l82a表示亲本序列的第82位氨基酸残基(亮氨酸,l)被丙氨酸(a)取代。a121v/i/m表示亲本序列的第121位氨基酸残基(丙氨酸,a)被下列氨基酸之一取代:缬氨酸(v)、异亮氨酸(i)或甲硫氨酸(m)。取代可以是保守或非保守取代。保守取代的实例是在以下组内进行:碱性氨基酸(精氨酸、赖氨酸和组氨酸)、酸性氨基酸(谷氨酸和天冬氨酸)、极性氨基酸(谷氨酰胺、天冬酰胺和苏氨酸)、疏水性氨基酸(蛋氨酸、亮氨酸、异亮氨酸、半胱氨酸和缬氨酸)、芳族氨基酸(苯丙氨酸、色氨酸和酪氨酸)和小氨基酸(甘氨酸、丙氨酸和丝氨酸)。
[0033]
除非另有说明,否则本申请公开的位置参考seq id n
°
1所示的氨基酸序列编号。
[0034]
如本文所用,术语“序列同一性”或“同一性”是指两个多肽序列之间的匹配(相同的氨基酸残基)的数目(或以百分比%表示的分数)。通过在对齐时比较序列来测定序列同一性,以便最大化重叠和同一性,同时最小化序列空位。特别地,序列同一性可以根据两个序列的长度使用许多数学全局或局部对齐算法中的任何一种来测定。优选使用在全长上最佳地对齐序列的全局对齐算法(例如needleman和wunsch算法;needleman和wunsch,1970)来对齐相似长度的序列,而优选使用局部对齐算法(例如smith和waterman算法(smith和waterman,1981)或altschul算法(altschul等,1997;altschul等,2005))来对齐基本上不同长度的序列。用于确定氨基酸序列同一性百分比的对齐可以以本领域技术范围内的各种方式实现,例如,使用互联网网站如http://blast.ncbi.nlm.nih.gov/或http://www.ebi.ac.uk/tools/emboss/上可获得的公共可用计算机软件。本领域技术人员可以确定用于测量对齐的适当参数,包括在所比较的序列的全长上实现最大对齐所需的任何算法。为了本文的目的,%氨基酸序列同一性值是指使用成对序列对齐程序emboss needle产生的值,其使用needleman
‑
wunsch算法产生两个序列的最佳全局对齐,其中所有检索参数被设置为默认值,即评分矩阵=blosum62,空位开放=10,空位延长=0.5,末端空位罚分=错误,末端空位开放=10以及末端空位延长=0.5。
[0035]“聚合物”是指化合物或化合物的混合物,其结构由通过共价化学键连接的多个单体(重复单元)组成。在本发明的上下文中,术语聚合物包括天然或合成聚合物,由单一类型的重复单元(即均聚物)或不同重复单元的混合物(即共聚物或杂聚物)组成。根据本发明,“低聚物”是指含有2至约20个单体的分子。
[0036]
在本发明的上下文中,“含聚酯材料”或“含聚酯产品”是指包含至少一种结晶、半结晶或完全无定形形式的聚酯的产品,例如塑料制品。在一个具体实施方案中,含聚酯材料是指由至少一种塑料材料制成的任何物品,例如塑料片、管、棒、型材(profile)、模型(shape)、膜、大块等,其包含至少一种聚酯,和可能的其他物质或添加剂,如增塑剂、矿物或有机填料。在另一个具体实施方案中,含聚酯材料是指适用于制造塑料制品的熔融或固体
状态的塑料化合物或塑料制剂。在另一个具体实施方案中,含聚酯材料是指包含至少一种聚酯的纺织品、织物或纤维。在另一个具体实施方案中,含聚酯材料是指包含至少一种聚酯的塑料废物或纤维废物。
[0037]
在本说明书中,术语“聚酯”涵盖但不限于聚对苯二甲酸乙二醇酯(pet)、聚对苯二甲酸丙二醇酯(ptt)、聚对苯二甲酸丁二醇酯(pbt)、聚对苯二甲酸异山梨酯(peit)、聚乳酸(pla)、聚羟基链烷酸酯(pha)、聚丁二酸丁二醇酯(pbs)、聚丁二酸己二酸丁二酯(pbsa)、聚己二酸对苯二甲酸丁二酯(pbat)、聚乙烯呋喃酸酯(pef)、聚己内酯(pcl)、聚(己二酸乙二醇酯)(pea)、聚萘二甲酸乙二醇酯(pen)和这些聚合物的掺合物/混合物。
[0038]
新酯酶
[0039]
与亲本酯酶相比,本发明提供具有改进的活性和/或改进的热稳定性的新酯酶。更特别地,发明人设计了特别适用于工业方法的新型酶。本发明的酯酶特别适合于降解聚酯,更特别是pet,包括含pet的材料,特别是含pet的塑料制品。在具体实施方案中,酯酶表现出增加的活性和增加的热稳定性。
[0040]
因此,本发明的一个目的是提供与具有seq id n
°
1所示的氨基酸序列的酯酶相比,表现出增加的活性的酯酶。
[0041]
特别地,发明人鉴定了seq id n
°
1中的特定氨基酸残基,其旨在与酯酶的x射线晶体结构(即,折叠的3d结构)中的聚合物底物接触,所述酯酶的x射线晶体结构可以被有利地修饰以促进底物与酯酶的接触,从而增加聚合物的吸附和/或由此增加酯酶在该聚合物上的活性。
[0042]
在本发明的上下文中,术语“增加的活性”或“增加的降解活性”是指与seq id n
°
1的酯酶在相同温度下降解相同聚酯的能力相比,酯酶在给定温度下降解聚酯的能力增加和/或吸附在聚酯上的能力增加。特别地,本发明的酯酶具有增加的pet降解活性。这种增加可以比seq id n
°
1的酯酶的pet降解活性高至少10%,优选高至少20%、30%、40%、50%、60%、70%、80%、90%、100%、110%、120%、130%或更高。特别地,降解活性是导致聚酯的单体和/或低聚物的解聚活性,其可以被进一步回收和任选地被再利用。
[0043]
根据本领域本身已知的方法,本领域技术人员可以评估酯酶的“降解活性”。例如,可以通过测量特定聚合物的解聚活性率、测量降解分散在琼脂板中的固体聚合物化合物的速率、或测量聚合物在反应器中的解聚活性率来评估降解活性。特别地,可以通过测量酯酶的“比降解活性”来评估降解活性。酯酶对pet的“比降解活性”对应于反应初期(即前24小时)内水解的pet的μmol/分钟或mg产生的当量ta/小时和每mg的酯酶,并且由反应水解曲线的线性部分测定,该曲线通过在最初的24小时内在不同时间进行的几次采样建立。作为另一个实例,“降解活性”可以通过在限定的时期后测量在合适的温度、ph和缓冲液条件下将聚合物或含聚合物的塑料制品与降解酶接触时释放的低聚物和/或单体的速率来评估。
[0044]
酶吸附在底物上的能力可以由本领域技术人员根据本领域本身已知的方法来评估。例如,可以从含酶溶液测量酶吸附在底物上的能力,并且其中已经预先在合适的条件下将酶与底物一起孵育。
[0045]
发明人还鉴定了seq id n
°
1中的靶氨基酸残基,其可被有利地修饰以改进相应酯酶在高温下的稳定性(即,改进的热稳定性),并且有利地在高于50℃,优选高于70℃的温度下的稳定性。
[0046]
因此,本发明的一个目的是提供新酯酶,与具有seq id n
°
1所示氨基酸序列的酯酶的热稳定性相比,其显示出增加的热稳定性。
[0047]
在本发明的上下文中,术语“增加的热稳定性”是指与seq id n
°
1的酯酶相比,酯酶在高温下,特别是在50℃
‑
90℃的温度下,对抗其化学和/或物理结构变化的能力增加。
[0048]
特别地,热稳定性可通过评估酯酶的熔化温度(tm)来评估。在本发明的上下文中,“熔化温度”是指所考虑的一半酶群体被展开或错误折叠的温度。典型地,与seq id n
°
1的酯酶的tm相比,本发明的酯酶显示出tm增加约1℃、2℃、3℃、4℃、5℃、10℃、12℃或更高。特别地,与seq id n
°
1的酯酶相比,本发明的酯酶在50℃
‑
90℃的温度下可具有增加的半衰期。
[0049]
酯酶的熔化温度(tm)可以由本领域技术人员根据本领域本身已知的方法来测量。例如,dsf可用于定量酯酶的热变性温度的变化,从而测定其tm。或者,可以通过使用圆二色性分析蛋白质折叠来评估tm。优选地,使用在实验部分中描述的dsf或圆二色性来测量tm。在本发明的上下文中,用在相同条件下(例如ph、聚酯的性质和量等)测量的tm进行tm的比较。
[0050]
或者,可以通过在不同温度下孵育后测量酯酶的酯酶活性和/或聚酯解聚活性并与亲本酯酶的酯酶活性和/或聚酯解聚活性相比较来评估热稳定性。还可以评估在不同温度下进行多轮聚酯解聚测定的能力。快速且有价值的测试可以包括通过晕圈直径测量评估酶在不同温度下孵育后降解分散在琼脂板中的固体聚酯化合物的能力。
[0051]
因此,本发明的一个目的是提供酯酶,其(i)与seq id n
°
1所示的全长氨基酸序列具有至少75%、80%、85%、90%、95%、96%、97%、98%或99%的同一性,和(ii)与氨基酸序列seq id n
°
1相比,在对应于选自以下的残基的位置处包含至少一个氨基酸取代:t11、r12、a14、w69、r73、a205、n214、a215、a216、i217、f238、v242、d244、p245、a246、l247、d94、r138、d158、q182、f187、p10、l15、d18、n87、s88、s95、q99、k159、a174、a125和s218,和(iii)与seq id n
°
1的酯酶相比,显示出增加的聚酯降解活性和/或增加的热稳定性。
[0052]
除非另有说明,否则本申请中公开的位置通过参考seq id n
°
1所示的氨基酸序列编号。
[0053]
根据本发明,靶向的氨基酸可以被19种其他氨基酸中的任何一种取代。
[0054]
在本发明的一个优选实施方案中,酯酶在对应于选自以下的残基的位置处包含至少一个取代:t11、r12、a14、w69、r73、a205、n214、a215、a216、i217、f238、v242、d244、p245、a246或l247。优选地,酯酶在选自以下的位置处包含至少一个取代:t11、r12、a14、w69、r73、a205、n214、a215、a216、f238、v242、d244、p245、a246或l247。取代更优选选自t11m/e/i/s/n/d/q、r12q/d/n/g/p/f/v/e/l/y、r12h、a14e/d、w69d/m/e/r、r73i/g/m/d/e/s/c/q/f/n/v、a205d、n214d/e/c、n214i/l/f/y/h、a215n、a216q、f238e、v242p/y、d244e/c、p245d/y/e、a246s/d/h/e或l247t。
[0055]
在一个实施方案中,酯酶包含选自w69r或v242y的至少一个取代。
[0056]
在一个实施方案中,酯酶包含选自以下的至少一个取代:t11m/i/s/n/d、r12n/g/p/v/l、a14e、w69m、r73i/g/d/s/c/q/f/n/v、a205d、n214e/c、a215n、p245y或a246d/h。
[0057]
在另一个优选的实施方案中,酯酶在对应于选自以下的残基的位置处包含至少一个取代:d94、r138、d158、q182或f187。优选地,酯酶在选自q182或f187,更优选选自q182d/e
或f187y/i的位置处包含至少一个取代。在一个具体实施方案中,酯酶至少包含取代q182e,并且与seq id n
°
1的酯酶相比,表现出增加的聚酯降解活性和增加的热稳定性。
[0058]
在另一个优选的实施方案中,酯酶在对应于选自以下的残基的位置处包含至少一个取代:p10、l15、d18、n87、s88、s95、q99、k159、a174、a125或s218。更优选地,酯酶在选自a125或s218的位置处包含至少一个取代。更优选地,取代选自a125g或s218a/e。在一个实施方案中,与seq id n
°
1的酯酶相比,酯酶至少包含取代a125g并且表现出增加的聚酯降解活性。
[0059]
在一个具体实施方案中,酯酶具有seq id n
°
1所示的氨基酸序列,和对应于选自以下的残基的位置处的单个氨基酸取代:t11、r12、a14、w69、r73、a205、n214、a215、a216、i217、f238、v242、d244、p245、a246、l247、d94、r138、d158、q182、f187、p10、l15、d18、n87、s88、s95、q99、k159、a174、a125或s218。在一个实施方案中,酯酶具有seq id n
°
1所示的氨基酸序列,和选自以下的单个氨基酸取代:t11m/e/i/s/n/d/q、r12q/d/n/g/p/f/v/e/l/y、r12h、a14e/d、w69d/m/e/r、r73i/g/m/d/e/s/c/q/f/n/v、a205d、n214d/e/c、n214i/l/f/y/h、a215n、a216q、f238e、v242p/y、d244e/c、p245d/y/e、a246s/d/h/e、l247t、q182d/e、f187y/i、a125g或s218a/e。
[0060]
在优选的实施方案中,本发明的酯酶如亲本酯酶中那样包含至少一个选自s130、d175或h207的氨基酸残基,即,本发明的酯酶在这些位置的一个、两个或全部上未被修饰。优选地,酯酶如亲本酯酶中那样包含组合s130+d175+h207。
[0061]
根据一个具体实施方案,所述酯酶可以在对应于选自以下的残基的位置处进一步包含至少一个取代或取代的组合:s13、t16、a62、l67、d91、p93、m131、l202、n204、a209、p210、s212、v219、y220、q237、l239、n241、n243、p179、r30、g37、a68、r72、r96、s98、h156、h183、a17、t27、s48、l82、f90、y92、g135、a140、n143、s145、a149、s164、v167、s206、n213、t252、d203+s248、e173、f208、v177、g53、s65、a121、t157、v170、t176、n211、y60、t61、d63或s66。
[0062]
在一个具体实施方案中,酯酶在对应于选自以下的残基的位置处包含至少一个取代:s13、t16、a17、a62、l67、d91、p93、m131、l202、n204、s206、f208、a209、p210、s212、n213、v219、y220、q237、l239、n241、n243。
[0063]
在另一个具体实施方案中,酯酶在对应于选自以下的残基的位置处包含至少一个取代:a17、t27、s48、l82、f90、y92、g135、a140、n143、s145、a149、s164、v167、s206、n213或t252。特别地,取代选自a17t、t27s、s48t、l82i、f90l、y92f、n213p、g135a、a140s、n143i、s145t、a149g、s164p、v167q、s206t或t252s。在一个实施方案中,酯酶在对应于选自g135和n213的残基的位置处包含至少一个取代。优选地,取代选自g135a和n213p。
[0064]
在一个实施方案中,酯酶在位置n211处包含至少一个取代。优选地,取代选自n211d/m。
[0065]
在一个实施方案中,酯酶在位置s212处包含至少一个取代。优选地,取代选自s212f。
[0066]
在一个实施方案中,酯酶进一步包含如wo 2018/011284和/或wo 2018/011281所引用的一个或多个取代或取代的组合。例如,酯酶在对应于选自以下的残基的位置处包含取代:f208、d203+s248、t61、y92、v170、v177或e173。在另一个实例中,酯酶至少包含选自以
下的取代:f208w/i、v177i、y92g/p、t61m和v170i。在另一个实例中,酯酶包含选自以下的取代的组合:d203c+s248c、d203c+s248c+e173r、d203c+s248c+e173a、f208i+d203c+s248c、f208w+d203c+s248c、d203c+s248c+e173r+n204d+l202r、f208w+d203c+s248c+e173a、f208i+d203c+s248c+e173a、f208w+v170i、y92p+f208l、y92p+f208w、t176h+f208w、v170i+a121s、v170i+a121s+s223a、f208w+t157q、f208w+t157n、f208w+t157s、f208w+s65t、f208w+t157e。优选地,酯酶包含选自以下的取代的组合:d203c+s248c、f208i+d203c+s248c或f208w+d203c+s248c。
[0067]
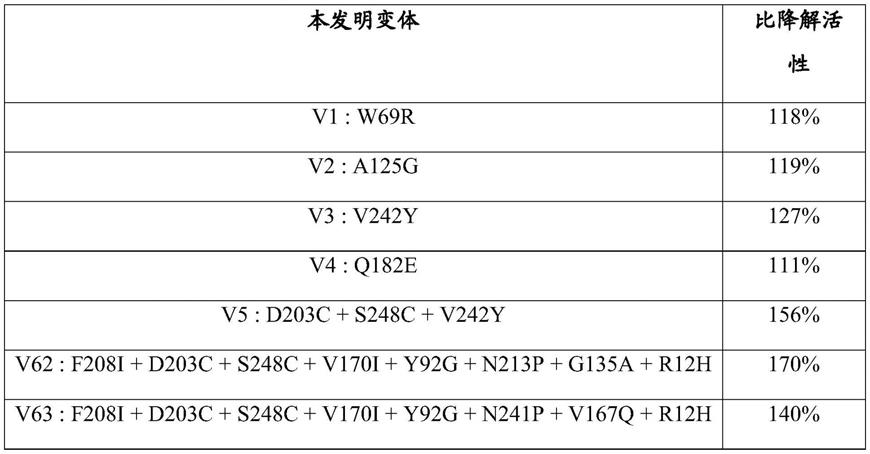
在一个实施方案中,本发明的酯酶至少包含取代d203c+s248c+v242y的组合,并且与seq id n
°
1的酯酶相比,表现出增加的聚酯降解活性和增加的热稳定性。
[0068]
在一个实施方案中,酯酶包含选自以下的至少一个取代:t11m/i/s/n/d、r12n/g/p/v/l、a14e、w69m、r73i/g/d/s/c/q/f/n/v、a205d、n214e/c、a215n、p245y或a246d/h,和选自d203c+s248c、f208i+d203c+s248c或f208w+d203c+s248c的取代的组合。
[0069]
在一个具体实施方案中,酯酶在选自以下的位置处进一步包含至少四个取代:f208、d203、s248、v170、v177、t176、s65、t61、n211或y92。特别地,酯酶至少包含位置f208+d203+s248处的取代和选自v170、v177、t176、t61、s65、n211或y92的位置处的一个取代的组合。优选地,酯酶至少包含选自f208i+d203c+s248c或f208w+d203c+s248c的取代和选自v170i、v177i、t176n、t61m、s65t、n211d/m或y92g/p/f的一个取代的组合。在另一个实例中,酯酶至少包含选自以下的取代的组合:f208i+d203c+s248c+v170i、f208i+d203c+s248c+y92g或f208i+d203c+s248c+v170i+y92g、f208w+d203c+s248c+v170i、f208w+d203c+s248c+y92g或f208w+d203c+s248c+v170i+y92g。
[0070]
在一个实施方案中,酯酶包含取代r12h和取代f208i+d203c+s248c+v170i+y92g的组合。特别地,酯酶至少包含选自以下的取代的组合:f208i+d203c+s248c+v170i+y92g+n213p+g135a+r12h或f208i+d203c+s248c+v170i+y92g+n241p+v167q+r12h。
[0071]
在进一步实施方案中,本发明的酯酶如亲本酯酶那样进一步包含选自以下的氨基酸残基的组合:c240+c257或s130+d175+h207+c240+c257,即,与seq id n
°
1相比,本发明的酯酶在这些位置未被修饰。
[0072]
在另一个实施方案中,本发明的酯酶如亲本酯酶那样进一步包含选自以下的至少一个氨基酸残基:g59、y60、t61、d63、s65、s66、n85、t86、r89、f90、h129、w155、t157、t176、v177、a178和n211,即,与seq id n
°
1相比,本发明的酯酶在这些位置之一未被修饰。优选地,酯酶如亲本酯酶那样包含氨基酸残基f90。
[0073]
本发明的进一步目的是提供酯酶,其(i)具有seq id n
°
2所示的氨基酸序列,(ii)与seq id n
°
2相比,在对应于选自以下的残基的位置处具有至少一个氨基酸取代:t11、r12、a14、w69、r73、a205、n214、a215、a216、i217、f238、v242、d244、p245、a246、l247、d94、r138、d158、q182、f187、p10、l15、d18、n87、s88、s95、q99、k159、a174、a125或s218,其中所述位置通过参考seq id n
°
2所示的氨基酸序列编号,和(iii)与seq id n
°
1的酯酶相比,显示出增加的聚酯降解活性和/或增加的热稳定性。
[0074]
根据本发明,靶向的氨基酸可以被19种其他氨基酸中的任何一种取代。
[0075]
seq id n
°
2所示的氨基酸序列对应于seq id n
°
1的氨基酸序列的变体,其与seq id n
°
1相比具有取代a17t+t27s+s48t+l82i+f90l+y92f+g135a+a140s+n143i+s145t+a149g
+s164p+v167q+s206t+n213p+t252s的组合。
[0076]
在一个优选实施方案中,与seq id n
°
2相比,酯酶在对应于选自以下的残基的位置处包含至少一个取代:t11、r12、a14、w69、r73、a205、n214、a215、a216、i217、f238、v242、d244、p245、a246或l247。优选地,酯酶在选自以下的位置处包含至少一个取代:t11、r12、a14、w69、r73、a205、n214、a215、a216、f238、v242、d244、p245、a246或l247。取代更优选选自t11m/e/i/s/n/d/q、r12q/d/n/g/p/f/v/e/l/y、r12h、a14e/d、w69d/m/e/r、r73i/g/m/d/e/s/c/q/f/n/v、a205d、n214d/e/c、n214i/l/f/y/h、a215n、a216q、f238e、v242p/y、d244e/c、p245d/y/e、a246s/d/h/e或l247t。
[0077]
在一个实施方案中,酯酶包含选自w69r或v242y的至少一个取代。
[0078]
在一个实施方案中,酯酶包含选自以下的至少一个取代:t11m/i/s/n/d、r12n/g/p/v/l、a14e、w69m、r73i/g/d/s/c/q/f/n/v、a205d、n214e/c、a215n、p245y或a246d/h。
[0079]
在另一个优选实施方案中,与seq id n
°
2相比,酯酶在对应于选自以下的残基的位置处包含至少一个取代:d94、r138、d158、q182或f187。优选地,酯酶在选自q182或f187,更优选选自q182d/e或f187y/i的位置处包含至少一个取代。在一个具体实施方案中,酯酶至少包含取代q182e,并且与seq id n
°
1的酯酶相比,表现出增加的聚酯降解活性和增加的热稳定性。
[0080]
在另一个优选实施方案中,与seq id n
°
2相比,酯酶在对应于选自以下的残基的位置处包含至少一个取代:p10、l15、d18、n87、s88、s95、q99、k159、a174、a125或s218。更优选地,酯酶在选自a125或s218的位置处包含至少一个取代。更优选地,取代选自a125g或s218a/e。在一个实施方案中,与seq id n
°
1的酯酶相比,酯酶至少包含取代a125g并且表现出增加的聚酯降解活性。
[0081]
在一个具体实施方案中,酯酶具有seq id n
°
2所示的氨基酸序列,和对应于选自以下的残基的位置处的单个氨基酸取代:t11、r12、a14、w69、r73、a205、n214、a215、a216、i217、f238、v242、d244、p245、a246、l247、d94、r138、d158、q182、f187、p10、l15、d18、n87、s88、s95、q99、k159、a174、a125或s218。在一个实施方案中,酯酶具有seq id n
°
2所示的氨基酸序列,和选自以下的单个氨基酸取代:t11m/e/i/s/n/d/q、r12q/d/n/g/p/f/v/e/l/y、r12h、a14e/d、w69d/m/e/r、r73i/g/m/d/e/s/c/q/f/n/v、a205d、n214d/e/c、n214i/l/f/y/h、a215n、a216q、f238e、v242p/y、d244e/c、p245d/y/e、a246s/d/h/e、l247t、q182d/e、f187y/i、a125g或s218a/e。
[0082]
在一个优选实施方案中,与seq id n
°
2相比,本发明的酯酶包含选自s130、d175或h207的至少一个氨基酸残基,即,本发明的酯酶在这些位置的一个、两个或全部上未被修饰。优选地,与seq id n
°
2相比,酯酶包含组合s130+d175+h207。
[0083]
根据一个具体实施方案,与seq id n
°
2相比,所述酯酶可以在对应于选自以下的残基的位置处进一步包含至少一个取代或取代的组合:s13、t16、a62、l67、d91、p93、m131、l202、n204、a209、p210、s212、v219、y220、q237、l239、n241、n243、p179、r30、g37、a68、r72、r96、s98、h156、h183、d203+s248、e173、f208、v177、g53、s65、a121、t157、v170、t176、n211、y60、t61、d63、f92或s66。
[0084]
在一个具体实施方案中,与seq id n
°
2相比,所述酯酶可以在对应于选自以下的残基的位置处包含至少一个取代:s13、t16、a62、l67、d91、p93、m131、l202、n204、f208、
a209、p210、s212、v219、y220、q237、l239、n241、n243。
[0085]
在一个实施方案中,与seq id n
°
2相比,酯酶在位置n211处包含至少一个取代。优选地,取代选自n211d/m。
[0086]
在一个实施方案中,与seq id n
°
2相比,酯酶在位置s212处包含至少一个取代。优选地,取代是s212f。
[0087]
在另一个具体实施方案中,酯酶包含如wo 2018/011284和/或wo 2018/011281所引用的一个或多个取代或取代的组合。例如,酯酶在对应于选自以下的残基的位置处包含取代:f208、d203+s248、t61、f92、v170、v177或e173。在另一个实例中,酯酶至少包含选自以下的取代:f208w/i、v177i、f92g/p、t61m和v170i。在另一个实例中,酯酶包含选自以下的取代的组合:d203c+s248c、d203c+s248c+e173r、d203c+s248c+e173a、f208i+d203c+s248c、f208w+d203c+s248c、d203c+s248c+e173r+n204d+l202r、f208w+d203c+s248c+e173a、f208i+d203c+s248c+e173a、f208w+v170i、f92p+f208l、f92p+f208w、t176h+f208w、v170i+a121s、v170i+a121s+s223a、f208w+t157q、f208w+t157n、f208w+t157s、f208w+s65t、f208w+t157e。优选地,酯酶包含选自以下的取代的组合:d203c+s248c、f208i+d203c+s248c或f208w+d203c+s248c。
[0088]
在一个实施方案中,本发明的酯酶至少包含取代d203c+s248c+v242y的组合,并且与seq id n
°
1的酯酶相比,表现出增加的聚酯降解活性和增加的热稳定性。
[0089]
在一个实施方案中,酯酶包含选自以下的至少一个取代:t11m/i/s/n/d、r12n/g/p/v/l、a14e、w69m、r73i/g/d/s/c/q/f/n/v、a205d、n214e/c、a215n、p245y或a246d/h,和选自d203c+s248c、f208i+d203c+s248c或f208w+d203c+s248c的取代的组合。
[0090]
在一个具体实施方案中,酯酶在选自以下的位置处进一步包含至少四个取代:f208、d203、s248、v170、v177、t176、s65、t61、n211或f92。特别地,酯酶至少包含位置f208+d203+s248处的取代和选自v170、v177、t176、t61、s65、n211或f92的位置处的取代的组合。优选地,酯酶至少包含选自f208i+d203c+s248c或f208w+d203c+s248c的取代和选自v170i、v177i、t176n、t61m、s65t、n211d/m或f92g/p的一个取代的组合。在另一个实例中,酯酶至少包含选自以下的取代的组合:f208i+d203c+s248c+v170i、f208i+d203c+s248c+f92g、f208i+d203c+s248c+v170i+f92g、f208w+d203c+s248c+v170i、f208w+d203c+s248c+f92g或f208w+d203c+s248c+v170i+f92g。
[0091]
在一个实施方案中,酯酶包含取代r12h和取代f208i+d203c+s248c+v170i+f92g的组合。特别地,酯酶至少包含选自以下的取代的组合:f208i+d203c+s248c+v170i+f92g+n213p+g135a+r12h或f208i+d203c+s248c+v170i+f92g+n241p+v167q+r12h。
[0092]
在一个具体实施方案中,本发明的酯酶如seq id n
°
2中那样进一步包含选自c240+c257或s130+d175+h207+c240+c257的氨基酸残基的组合,即与seq id n
°
2相比,本发明的酯酶在这些位置处未被修饰。
[0093]
在另一个具体实施方案中,本发明的酯酶如seq id n
°
2中那样进一步包含选自g59、y60、t61、d63、s65、s66、n85、t86、r89、h129、w155、t157、t176、v177、a178和n211的至少一个氨基酸残基,即与seq id n
°
2相比,本发明的酯酶在这些位置之一处未被修饰。
[0094]
在一个具体实施方案中,衍生自seq id n
°
1或seq id n
°
2的本发明酯酶在n
‑
末端还包含与seq id n
°
3所示的全长氨基酸序列具有至少55%、65%、75%、85%或100%的同
一性的氨基酸序列。特别地,酯酶可以在n
‑
末端包含选自下组的氨基酸序列:如seq id n
°
3、seq id n
°
4、seq id n
°
5、seq id n
°
6或seq id n
°
7所示的氨基酸序列。
[0095]
变体的聚酯降解活性
[0096]
本发明的一个目的是提供具有酯酶活性的新型酶。在一个具体实施方案中,本发明的酶表现出角质酶活性。
[0097]
在一个具体实施方案中,本发明的酯酶具有聚酯降解活性,优选聚对苯二甲酸乙二醇酯(pet)降解活性和/或聚己二酸对苯二甲酸丁二酯(pbat)降解活性和/或聚丁二酸丁二醇酯(pbs)降解活性和/或聚己内酯(pcl)降解活性,更优选聚对苯二甲酸乙二醇酯(pet)降解活性和/或聚己二酸对苯二甲酸丁二酯(pbat)降解活性和/或聚己内酯(pcl)降解活性。甚至更优选地。本发明的酯酶具有聚对苯二甲酸乙二醇酯(pet)降解活性。
[0098]
有利地,本发明的酯酶至少在20℃
‑
90℃的温度范围内,优选40℃
‑
80℃,更优选50℃
‑
70℃,甚至更优选60℃
‑
70℃表现出聚酯降解活性。在一个具体实施方案中,酯酶在65℃下表现出聚酯降解活性。在一个具体实施方案中,酯酶在70℃下表现出聚酯降解活性。在一个具体实施方案中,聚酯降解活性仍可在60℃
‑
90℃的温度下测量。
[0099]
在一个具体实施方案中,与seq id n
°
1的酯酶相比,本发明的酯酶在给定温度,更特别地,在40℃
‑
80℃,更优选在50℃
‑
70℃,甚至更优选在60℃
‑
70℃,甚至更优选在65℃的温度下具有增加的聚酯降解活性。
[0100]
在一个具体实施方案中,酯酶在65℃下的聚酯降解活性比seq id n
°
1的酯酶的聚酯降解活性高至少5%、优选高至少10%、20%、50%、100%、130%或更高。
[0101]
在一个具体实施方案中,本发明的酯酶至少在5
‑
11的ph范围内,优选在6
‑
9的ph范围内,更优选在ph至6.5
‑
9的范围内,甚至更优选在6.5
‑
8的ph范围内显示出可测量的酯酶活性。
[0102]
核酸、表达盒、载体、宿主细胞
[0103]
本发明的另一个目的是提供编码如上定义的酯酶的核酸。
[0104]
如本文所用,术语“核酸”、“核酸序列”、“多核苷酸”、“寡核苷酸”和“核苷酸序列”是指脱氧核糖核苷酸和/或核糖核苷酸的序列。核酸可以是dna(cdna或gdna)、rna或其混合物。它可以是单链形式或双链形式或其混合物。它可以是重组、人造和/或合成来源,并且它可以包含修饰的核苷酸,包括例如修饰的键、修饰的嘌呤或嘧啶碱基、或修饰的糖。本发明的核酸可以是分离或纯化形式,并且可以通过本领域本身已知的技术制备、分离和/或操作,例如cdna文库的克隆和表达、扩增、酶促合成或重组技术。核酸也可以通过如belousov(1997)nucleic acids res.25:3440
‑
3444所述的众所周知的化学合成技术在体外合成。
[0105]
本发明还涵盖在严格条件下与编码如上定义的酯酶的核酸杂交的核酸。优选地,这种严格条件包括在2
×
ssc/0.1%sds中在约42℃下孵育杂交过滤器约2.5小时,然后在1
×
ssc/0.1%sds中在65℃下洗涤过滤器4次,每次15分钟。所使用的方案描述在sambrook等的参考文献中。(molecular cloning:a laboratory manual、cold spring harbor press、cold spring harbor n.y.(1988))and ausubel(current protocols in molecular biology(1989))。
[0106]
本发明还涵盖编码本发明酯酶的核酸,其中所述核酸的序列或至少一部分所述序列已经使用优化的密码子使用进行了工程化。
[0107]
或者,可以从根据本发明的酯酶的序列推导出根据本发明的核酸,并且可以根据核酸应转录的宿主细胞来调整密码子使用。这些步骤可以根据本领域技术人员熟知的方法进行,其中一些描述于sambrook等的参考手册(sambrook等,2001)中。
[0108]
本发明的核酸可以进一步包含额外的核苷酸序列,例如调控区,即可以用于在选定的宿主细胞或系统中引起或调控多肽表达的启动子、增强子、沉默子、终止子、信号肽等。
[0109]
本发明进一步涉及表达盒,其包含与一个或多个控制序列可操作地连接的根据本发明的核酸,所述控制序列指导所述核酸在合适的宿主细胞中的表达。
[0110]
如本文所用,术语“表达”是指涉及多肽产生的任何步骤,包括但不限于转录、转录后修饰、翻译、翻译后修饰和分泌。
[0111]
术语“表达盒”表示核酸构建体,其包含编码区,即本发明的核酸,和调控区,即包含一个或多个可操作地连接的控制序列。
[0112]
典型地,表达盒包含与控制序列(例如转录启动子和/或转录终止子)可操作地连接的根据本发明的核酸或由其组成。控制序列可包括被用于表达编码本发明酯酶的核酸的宿主细胞或体外表达系统识别的启动子。启动子含有介导酶表达的转录控制序列。启动子可以是在宿主细胞中显示转录活性的任何多核苷酸,包括突变、截短和杂合启动子,并且可以从编码与宿主细胞同源或异源的细胞外或细胞内多肽的基因获得。控制序列也可以是转录终止子,其被宿主细胞识别以终止转录。终止子与编码酯酶的核酸的3'末端可操作地连接。在宿主细胞中有功能的任何终止子可用于本发明。典型地,表达盒包含与转录启动子和转录终止子可操作地连接的根据本发明的核酸或由其组成。
[0113]
本发明还涉及包含如上定义的核酸或表达盒的载体。
[0114]
如本文所用,术语“载体”或“表达载体”是指包含本发明的表达盒、用作将重组遗传物质转移到宿主细胞中的介质的dna或rna分子。载体的主要类型是质粒、噬菌体、病毒、粘粒和人工染色体。载体本身通常是由插入物(异源核酸序列、转基因)和作为载体“骨架”的较大序列组成的dna序列。将遗传信息转移到宿主的载体的目的典型地是在靶细胞中分离、繁殖或表达插入物。称为表达载体(表达构建体)的载体特别适合于在靶细胞中表达异源序列,并且通常具有驱动编码多肽的异源序列表达的启动子序列。通常,存在于表达载体中的调控元件包括转录启动子、核糖体结合位点、终止子和任选地存在的操纵子。优选地,表达载体还包含用于宿主细胞中自主复制的复制起点、选择标记、有限数量的有用的限制酶位点和高拷贝数的可能性。表达载体的实例是克隆载体、修饰的克隆载体、特定设计的质粒和病毒。在不同宿主中提供合适的多肽表达水平的表达载体是本领域熟知的。载体的选择典型地取决于载体与待引入载体的宿主细胞的相容性。优选地,表达载体是线性或环状双链dna分子。
[0115]
本发明的另一个目的是提供包含如上所述的核酸、表达盒或载体的宿主细胞。因此,本发明涉及根据本发明的核酸、表达盒或载体用于转化、转染或转导宿主细胞的用途。载体的选择典型地取决于载体与必须将其引入的宿主细胞的相容性。
[0116]
根据本发明,宿主细胞可以以瞬时或稳定的方式转化、转染或转导。将本发明的表达盒或载体引入宿主细胞中,使得盒或载体维持为染色体整合子或自我复制的染色体外载体。术语“宿主细胞”还涵盖由于在复制过程中发生突变而与亲本宿主细胞不同的亲本宿主细胞的任何后代。宿主细胞可以是用于产生本发明变体的任何细胞,例如原核细胞或真核
细胞。原核宿主细胞可以是任何革兰氏阳性或革兰氏阴性细菌。宿主细胞也可以是真核细胞,例如酵母、真菌、哺乳动物、昆虫或植物细胞。在一个具体实施方案中,宿主细胞选自下组:大肠杆菌(escherichia coli)、芽孢杆菌属(bacillus)、链霉菌属(streptomyces)、木霉属(trichoderma)、曲霉属(aspergillus)、酿酒酵母属(saccharomyces)、毕赤酵母属(pichia)、弧菌属(vibrio)或耶氏酵母属(yarrowia)。
[0117]
可以通过本领域技术人员已知的任何方法将根据本发明的核酸、表达盒或表达载体引入宿主细胞,例如电穿孔、缀合、转导、感受态细胞转化、原生质体转化、原生质体融合、生物射弹“基因枪”转化、peg介导的转化、脂质辅助转化或转染、化学介导的转染、醋酸锂介导的转化、脂质体介导的转化。
[0118]
任选地,可以将多于一个拷贝的本发明的核酸、盒或载体插入宿主细胞中以增加变体的产生。
[0119]
在一个具体实施方案中,宿主细胞是重组微生物。本发明确实允许工程化具有改进的降解含聚酯材料的能力的微生物。例如,本发明的序列可用于补充已知能够降解聚酯的真菌或细菌的野生型菌株,以改进和/或增加菌株能力。
[0120]
生产酯酶
[0121]
本发明的另一个目的是提供生产本发明的酯酶的方法,其包括表达编码酯酶的核酸并任选地回收酯酶。
[0122]
特别地,本发明涉及生产本发明酯酶的体外方法,其包括(a)使本发明的核酸、盒或载体与体外表达系统接触;(b)回收产生的酯酶。体外表达系统是本领域技术人员公知的并且是可商购的。
[0123]
优选地,生产方法包括
[0124]
(a)在适于表达核酸的条件下培养包含编码本发明酯酶的核酸的宿主细胞;和任选地
[0125]
(b)从细胞培养物回收所述酯酶。
[0126]
有利地,宿主细胞是重组芽孢杆菌属、重组大肠杆菌、重组曲霉属、重组木霉属、重组链霉菌属、重组酿酒酵母属、重组毕赤酵母属、重组弧菌属或重组耶氏酵母属。
[0127]
使用本领域已知的方法在适于产生多肽的营养培养基中培养宿主细胞。例如,可以通过摇瓶培养,或在合适的培养基和允许表达和/或分离酶的条件下在实验室或工业发酵罐中进行小规模或大规模发酵(包括连续、分批、分批补料或固态发酵)培养细胞。在来自商业供应商或根据公开的组合物(例如,在美国典型培养物保藏中心的目录中)制备的合适的营养培养基中进行培养。
[0128]
如果酯酶被分泌到营养培养基中,则可以从培养物上清液直接回收酯酶。相反,可以从细胞裂解物或在透化后回收酯酶。可以使用本领域已知的任何方法回收酯酶。例如,可以通过常规方法,包括但不限于收集、离心、过滤、提取、喷雾干燥、蒸发或沉淀,从营养培养基回收酯酶。任选地,酯酶可以通过本领域已知的各种方法部分或完全纯化,包括但不限于色谱法(例如,离子交换、亲和性、疏水、色谱聚焦和尺寸排除)、电泳程序(例如,制备型等电聚焦)、差异溶解度(例如,硫酸铵沉淀)、sds
‑
page或提取,以获得基本上纯的多肽。
[0129]
酯酶可以以纯化形式单独使用或与其它酶组合使用,以催化聚酯和/或含聚酯材料(例如含聚酯的塑料制品)的降解和/或再循环中涉及的酶促反应。酯酶可以是可溶形式,
也可以是固相。特别地,它可以与细胞膜或脂质囊泡结合,或与合成支持物(例如玻璃、塑料、聚合物、过滤器、膜),例如以珠、柱、板等形式结合。
[0130]
组合物
[0131]
本发明的另一个目的是提供包含本发明的酯酶或宿主细胞或其提取物的组合物。在本发明的上下文中,术语“组合物”涵盖任何种类的包含本发明酯酶或宿主细胞的组合物。
[0132]
基于组合物总重量,本发明的组合物可包含0.1重量%
‑
99.9重量%,优选0.1重量%
‑
50重量%,更优选0.1重量%
‑
30重量%,甚至更优选0.1%
‑
5%的酯酶。或者,组合物可包含5
‑
10重量%的本发明的酯酶。
[0133]
组合物可以是液体或干燥的,例如为粉末形式。在一些实施方案中,组合物是冻干物。
[0134]
组合物可进一步包含赋形剂和/或试剂等。合适的赋形剂涵盖生物化学中常用的缓冲剂;用于调节ph的试剂;防腐剂,例如苯甲酸钠、山梨酸钠或抗坏血酸钠;保守剂、保护剂或稳定剂,如淀粉、糊精、阿拉伯树胶、盐、糖(例如山梨醇、海藻糖或乳糖)、甘油、聚乙二醇、聚丙二醇、丙二醇;螯合剂(如edta);还原剂;氨基酸;载体(如溶剂或水溶液)等。本发明的组合物可以通过将酯酶与一种或多种赋形剂混合而获得。
[0135]
在一个具体实施方案中,基于组合物总重量,组合物包含0.1重量%
‑
99.9重量%,优选50重量%
‑
99.9重量%,更优选70重量%
‑
99.9重量%,甚至更优选95重量%
‑
99.9重量%的赋形剂。或者,组合物可包含90重量%
‑
95重量%的赋形剂。
[0136]
在一个具体实施方案中,组合物可以进一步包含表现出酶活性的其他多肽。例如取决于待降解的聚酯的性质和/或组合物中含有的其它酶/多肽,本领域技术人员可以容易地调整本发明的酯酶含量。
[0137]
在一个具体实施方案中,本发明的酯酶与一种或多种赋形剂一起溶解在水性介质中,所述赋形剂尤其是能够稳定或保护多肽免于降解的赋形剂。例如,本发明的酯酶可以最终与其他组分,例如甘油、山梨醇、糊精、淀粉、二醇(如丙二醇)、盐等一起溶于水中。然后,可以干燥所得混合物以获得粉末。干燥这种混合物的方法是本领域技术人员公知的,包括但不限于冻干、冷冻干燥、喷雾干燥、超临界干燥、向下通风蒸发、薄层蒸发、离心蒸发、输送干燥、流化床干燥、滚筒干燥或其任何组合。
[0138]
在一个具体的实施方案中,组合物为粉末形式,并且包含酯酶和稳定/增溶量的甘油、山梨醇或糊精(如麦芽糖糊精和/或环糊精)、淀粉、二醇(如丙二醇)和/或盐。
[0139]
在一个具体实施方案中,本发明的组合物包含至少一种表达本发明酯酶的重组细胞或其提取物。“细胞提取物”表示从细胞获得的任何部分,例如细胞上清液、细胞碎片、细胞壁、dna提取物、酶或酶制剂或通过化学、物理和/或酶处理从细胞衍生的任何制剂,其基本上不含活细胞。优选的提取物是酶活性提取物。本发明的组合物可包含一种或多种本发明的重组细胞或其提取物,和任选的一种或几种另外的细胞。
[0140]
在一个实施方案中,组合物包含表达和分泌本发明酯酶的重组微生物的培养基或由其组成。在一个具体实施方案中,所述组合物包含冻干的这种培养基。
[0141]
酯酶的用途
[0142]
本发明的进一步目的是提供使用本发明的酯酶在需氧或厌氧条件下降解和/或回
收聚酯或含聚酯材料的方法。本发明的酯酶特别适用于降解pet和含pet的材料。
[0143]
因此,本发明的一个目的是本发明的酯酶、或相应的重组细胞或其提取物、或组合物用于酶促降解聚酯的用途。
[0144]
在一个具体实施方案中,酯酶针对的聚酯选自:聚对苯二甲酸乙二醇酯(pet)、聚对苯二甲酸丙二醇酯(ptt)、聚对苯二甲酸丁二醇酯(pbt)、聚对苯二甲酸异山梨酯(peit)、聚乳酸(pla)、聚羟基链烷酸酯(pha)、聚丁二酸丁二醇酯(pbs)、聚丁二酸己二酸丁二酯(pbsa)、聚己二酸对苯二甲酸丁二酯(pbat)、聚乙烯呋喃酸酯(pef)、聚己内酯(pcl)、聚(己二酸乙二醇酯)(pea)、聚萘二甲酸乙二醇酯(pen)和这些材料的掺合物/混合物,优选聚对苯二甲酸乙二醇酯。
[0145]
在一个优选实施方案中,聚酯是pet,并且至少回收单体(例如单乙二醇或对苯二甲酸)和/或低聚物(例如对苯二甲酸2
‑
羟乙基甲酯(mhet)、对苯二甲酸双(2
‑
羟乙基)酯(bhet)、对苯二甲酸1
‑
(2
‑
羟乙基)4
‑
甲酯(hemt)和对苯二甲酸二甲酯(dmt)。
[0146]
本发明的另一个目的是本发明的酯酶,或其相应的重组细胞或提取物,或组合物用于酶促降解含聚酯材料的至少一种聚酯的用途。
[0147]
本发明的另一个目的是提供降解含聚酯材料的至少一种聚酯的方法,其中使含聚酯材料与本发明的酯酶或宿主细胞或组合物接触,从而降解含聚酯材料的至少一种聚酯。
[0148]
有利地,将聚酯解聚成单体和/或低聚物。
[0149]
特别地,本发明提供降解含pet材料的pet的方法,其中使含pet材料与本发明的酯酶或宿主细胞或组合物接触,从而降解pet。
[0150]
在一个实施方案中,将至少一种聚酯降解为可再聚合的单体和/或低聚物,其可有利地回收以便再利用。回收的单体/低聚物可用于再循环(例如,再聚合聚酯)或甲烷化。在一个具体实施方案中,至少一种聚酯是pet,并且回收单乙二醇、对苯二甲酸、对苯二甲酸2
‑
羟乙基甲酯(mhet)、对苯二甲酸双(2
‑
羟乙基)酯(bhet)、对苯二甲酸1
‑
(2
‑
羟乙基)4
‑
甲酯(hemt)和/或对苯二甲酸二甲酯(dmt)。
[0151]
在一个实施方案中,含聚酯材料的聚酯被完全降解。
[0152]
降解含聚酯材料所需的时间可根据含聚酯材料本身(即含聚酯材料的性质和来源、其组成、形状等)、所用酯酶的类型和含量以及各种工艺参数(即温度、ph、其他试剂等)而变化。本领域技术人员可以容易地使工艺参数适应含聚酯材料以及预期的降解时间。
[0153]
有利地,降解方法在20℃
‑
90℃,优选在40℃
‑
80℃,更优选在50℃
‑
70℃,更优选在60℃
‑
70℃的温度下实施。在一个具体实施方案中,降解方法在65℃下实施。在另一个具体实施方案中,降解方法在70℃下实施。更一般地,温度保持低于灭活温度,其对应于酯酶失活(即,与其在最佳温度下的活性相比,活性损失大于80%)和/或重组微生物不再合成酯酶的温度。特别是,温度保持低于目标聚酯的玻璃化转变温度(tg)。
[0154]
有利地,该方法以连续流方法并在酯酶可以使用数次和/或再循环的温度下实施。
[0155]
有利地,降解方法在ph为5
‑
11,优选ph为6
‑
9,更优选ph为6.5
‑
9,甚至更优选ph为6.5
‑
8下实施。
[0156]
在一个具体实施方案中,可以在与酯酶接触之前将含聚酯材料进行预处理,以在物理上改变其结构,从而增加聚酯和酯酶之间的接触表面。
[0157]
本发明的另一个目的是提供由含聚酯材料生产单体和/或低聚物的方法,包括将
含聚酯材料暴露于本发明的酯酶或其相应的重组细胞或提取物或组合物,和任选地回收单体和/或低聚物。
[0158]
可以依次或连续回收由解聚产生的单体和/或低聚物。取决于起始的含聚酯材料,可以回收单一类型的单体和/或低聚物或几种不同类型的单体和/或低聚物。
[0159]
本发明的方法特别适用于生产选自单乙二醇和对苯二甲酸的单体,和/或选自对苯二甲酸2
‑
羟乙基甲酯(mhet)、对苯二甲酸双(2
‑
羟乙基)酯(bhet)、对苯二甲酸1
‑
(2
‑
羟乙基)4
‑
甲酯(hemt)和对苯二甲酸二甲酯(dmt)、选自pet和/或包含pet的塑料制品的低聚物。
[0160]
可以使用所有合适的纯化方法进一步纯化回收的单体和/或低聚物,并以可再聚合的形式进行调节。纯化方法的实例包括汽提法、通过水性溶液分离、蒸汽选择性冷凝、生物过程后的介质过滤和浓缩、分离、蒸馏、真空蒸发、萃取、电渗析、吸附、离子交换、沉淀、结晶、浓缩和酸添加脱水和沉淀、纳滤、酸催化剂处理、半连续模式蒸馏或连续模式蒸馏、溶剂萃取、蒸发浓缩、蒸发结晶、液/液萃取、加氢、共沸蒸馏法、吸附、柱层析、简单真空蒸馏和微滤,组合或不组合。
[0161]
回收的可再聚合单体和/或低聚物可再用于例如合成聚酯。有利地,将相同性质的聚酯再聚合。但是,可以将回收的单体和/或低聚物与其他单体和/或低聚物混合,以便例如合成新的共聚物。或者,回收的单体可用作化学中间体,以产生新的目标化合物。
[0162]
本发明还涉及含聚酯材料的表面水解或表面官能化的方法,包括将含聚酯材料暴露于本发明的酯酶、或相应的重组细胞或其提取物、或组合物。本发明的方法特别适用于增加聚酯材料的亲水性或吸水性。这种增加的亲水性可能在纺织品生产、电子和生物医学应用方面特别令人感兴趣。
[0163]
本发明的另一个目的是提供含聚酯材料,其中包括本发明的酯酶和/或表达和分泌所述酯酶的重组微生物。作为实例,专利申请wo2013/093355、wo 2016/198650、wo 2016/198652、wo2019/043145和wo 2019/043134中公开了制备包含本发明酯酶的这种含聚酯材料的方法。
[0164]
因此,本发明的一个目的是提供包含本发明酯酶和/或重组细胞和/或组合物或其提取物和至少pet的含聚酯材料。根据一个实施方案,本发明提供包含pet和本发明的具有pet降解活性的酯酶的塑料制品。
[0165]
因此,本发明的另一个目的是提供包含本发明的酯酶和/或重组细胞和/或其组合物或提取物和至少pbat的含聚酯材料。根据一个实施方案,本发明提供了包含pbat和本发明的具有pbat降解活性的酯酶的塑料制品。
[0166]
因此,本发明的另一个目的是提供包含本发明的酯酶和/或重组细胞和/或其组合物或提取物和至少pbs的含聚酯材料。根据一个实施方案,本发明提供了包含pbs和本发明的具有pbs降解活性的酯酶的塑料制品。
[0167]
因此,本发明的另一个目的是提供包含本发明的酯酶和/或重组细胞和/或其组合物或提取物和至少pcl的含聚酯材料。根据一个实施方案,本发明提供了包含pcl和本发明的具有pcl降解活性的酯酶的塑料制品。
[0168]
典型地,本发明的酯酶可以用于洗涤剂、食品、动物饲料和药物应用中。更特别地,本发明的酯酶可以用作洗涤剂组合物的组分。洗涤剂组合物包括但不限于手洗或机洗衣物洗涤剂组合物,例如适于预处理染色的织物和漂洗添加的织物柔软剂组合物的衣物添加剂
组合物、用于一般家用硬表面清洁操作的洗涤剂组合物、用于手洗或机洗洗碗操作的洗涤剂组合物。在一个具体实施方案中,本发明的酯酶可以用作洗涤剂添加剂。因此,本发明提供包含本发明的酯酶的洗涤剂组合物。特别地,本发明的酯酶可以用作洗涤剂添加剂,以减少纺织品清洁期间的起球和变灰效果。
[0169]
本发明还涉及在动物饲料中使用本发明的酯酶的方法,以及涉及包含本发明的酯酶的饲料组合物和饲料添加剂。术语“饲料”和“饲料组合物”是指适于或旨在被动物摄取的任何化合物、制剂、混合物或组合物。在另一个具体实施方案中,本发明的酯酶用于水解蛋白质,并产生包含肽的水解产物。这种水解产物可用作饲料组合物或饲料添加剂。
具体实施方式
[0170]
实施例1
‑
酯酶的构建、表达和纯化
[0171]
‑
构建
[0172]
使用质粒构建pet26b
‑
lcc
‑
his产生根据本发明的酯酶。该质粒在于克隆在ndei和xhoi限制性位点之间的编码seq id n
°
1的酯酶的基因,该基因被优化用于大肠杆菌表达。根据供应商的建议使用了两个定点诱变试剂盒,以产生酯酶变体:来自agilent的quikchange ii定点诱变试剂盒和quikchange lightning多定点诱变试剂盒(santa clara、california、usa)。
[0173]
‑
酯酶的表达和纯化
[0174]
在50ml lb
‑
miller培养基或zym自诱导培养基(studier等、2005
‑
prot.exp.pur.41、207
‑
234)中连续使用菌株stellar
tm
(clontech、california、usa)和大肠杆菌one bl21 de3(life technologies、carlsbad、california、usa)进行克隆和重组表达。在16℃下使用0.5mm异丙基β
‑
d
‑1‑
硫代半乳糖吡喃糖苷(iptg,euromedex,souffelweyersheim,france)进行lb
‑
miller培养基中的诱导。通过在avanti j
‑
26xp离心机(beckman coulter,brea,usa)中离心(8000rpm,10℃下20分钟)终止培养。将细胞悬浮于20ml talon缓冲液(tris
‑
hcl 20mm,nacl 300mm,ph 8)中。然后,通过fb 705超声波仪(fisherbrand,illkirch,france)在2分钟内对细胞悬浮液进行超声处理,其中振幅为30%(2秒on和1秒off循环)。然后,进行离心步骤:在eppendorf离心机中在11000rpm,10℃下30分钟。收集可溶性级分并进行亲和层析。该纯化步骤用metal affinity resin(clontech、ca、usa)完成。用补充有咪唑的talon缓冲液步骤进行蛋白质洗脱。将纯化的蛋白质用talon缓冲液透析,然后根据制造商的指示(lifescience bio
‑
rad,france)使用bio
‑
rad蛋白质测定法定量,并在+4℃下储存。
[0175]
实施例2
‑
评估酯酶的降解活性
[0176]
测定酯酶的降解活性,并与seq id n
°
1的酯酶的降解活性比较。
[0177]
已经使用了多种方法来评估比活性:
[0178]
(1)基于pet水解的比活性;
[0179]
(2)基于固态下聚酯降解的活性;
[0180]
(3)基于大于100ml反应器中pet水解的活性。
[0181]
2.1基于pet水解的比活性
[0182]
称取100mg无定形pet(以粉末形式并根据wo 2017/198786制备以使其结晶度低于
20%)并将其引入100ml玻璃瓶中。将在talon缓冲液(tris
‑
hcl 20mm,nacl 0.3m,ph8)中制备的0.02或0.03mg/ml的1ml包含seq id n
°
1的酯酶制剂(作为参照对照)或本发明的酯酶引入玻璃瓶中。最终,添加49ml 0.1m磷酸钾缓冲液(ph8)。
[0183]
通过在max q 4450孵育箱(thermo fisher scientific,inc.waltham,ma,usa)中以60℃、65℃或70℃和150rpm孵育每个玻璃瓶开始解聚。
[0184]
通过在最初24小时期间的不同时间进行的取样,并通过超高效液相色谱(uhplc)分析测定解聚反应的初始速率,以mg产生的当量ta/小时计。如有必要,将样品稀释于ph8的0.1m磷酸钾缓冲液中。然后,将150μl甲醇和6.5μl hcl 6n添加到150μl样品或稀释液中。在0.45μm注射器过滤器上混合并过滤后,将样品加载到uhplc上以监测对苯二甲酸(ta)、mhet和bhet的释放。使用的色谱系统是ultimate 3000uhplc系统(thermo fisher scientific,inc.waltham,ma,usa),其包括泵模块、自动进样器、25℃恒温的柱温箱和240nm的uv检测器。使用的柱是hsc18 hplc柱(150
×
4.6mm,5μm,配备有预柱,supelco,bellefonte,usa)。使用1mm h2so4中的梯度meoh(30%
‑
90%)以1ml/min分离ta、mhet和bhet。注射量为20μl样品。根据商业化ta和bhet和内部合成的mhet制备的标准曲线以与样品相同的条件测量ta、mhet和bhet。在反应的水解曲线的线性部分中测定pet水解的比活性(mg当量ta/小时/mg酶),这种曲线通过在最初24小时内的不同时间进行采样来建立。当量ta对应于测量的ta和测量的mhet和bhet中包含的ta的总和。
[0185]
下表1显示本发明的酯酶的比降解活性。在表1中,将seq id n
°
1的酯酶的比降解活性用作参考并视为具有100%的比降解活性。如实施例2.1中所述测量比降解活性。
[0186]
表1:本发明变体的比降解活性
[0187][0188]
除了分别列出的取代或取代的组合以外,v1
‑
v5、v62和v63具有seq id n
°
1的确切氨基酸序列。
[0189]
2.2基于降解固态形式的聚酯的活性
[0190]
诱导的细胞、半纯化的蛋白质提取物或纯化的蛋白质可用作包含本发明的酯酶的组合物,以评估这种酯酶的活性。
[0191]
诱导的细胞对应于在zym自动诱导培养基培养之后或在lb
‑
miller培养基中通过
iptg诱导后获得的细胞培养样品(如实施例1所述)。
[0192]
在以下方案下,从zym自动诱导培养基培养后或在lb
‑
miller培养基中通过iptg诱导后获得半纯化的蛋白质提取物(如实施例1所述)。通过在avanti j
‑
26xp离心机(beckman coulter、brea、usa)中离心(8000rpm,10℃下20分钟)来停止培养。将细胞沉淀物悬浮于裂解缓冲液(20mm tris
‑
hcl、ph 8、300mm nacl)中。在
‑
80℃的2h冷冻/解冻循环中破坏细胞,然后添加1μl lysonase生物处理试剂(merck millipore、darmstadt、germany),并在28℃孵育1h,包括每15分钟涡旋均质化。通过离心(2250
×
g,15min,4℃)使裂解物澄清。为了产生半纯化的级分,将裂解物在70℃处理1h,并通过离心(2250
×
g,15分钟,4℃)澄清。根据生产商的说明(lifescience bio
‑
rad、france)使用bio
‑
rad蛋白测定法定量该级分的蛋白质浓度。
[0193]
如实施例1所述获得纯化的蛋白质。
[0194]
将组合物样品置于在包含如下制备的pet或另一种固态聚酯化合物(例如pbat或类似物)的琼脂多用途盘(agar omnitray)中产生的表面上或孔中。通过将500mg pet溶于六氟
‑2‑
丙醇(hfip)中来制备含pet的琼脂平板,并将该培养基倒入250ml水溶液中。在52℃和140mbar下蒸发hfip后,将溶液与包含3%琼脂的0.2m磷酸钾缓冲液(ph8)以v/v混合。使用约30ml的混合物制备每种多用途盘并在4℃下储存。
[0195]2‑
6小时后,在60℃、65℃或70℃下测量并比较通过野生型酯酶和本发明变体降解聚酯而形成的晕圈的表面积或直径。
[0196]
表2总结了使用诱导细胞的由本发明的酯酶形成的晕圈的表面积。由seq id n
°
1的野生型酯酶形成的表面积对应于100%。
[0197]
表2:与seq id n
°
1的酯酶相比,使用诱导细胞的本发明变体的pet降解晕圈表面积。
[0198]
[0199]
[0200][0201]
除了分别列出的取代之外,v6
‑
v61具有seq id n
°
1的确切氨基酸序列。
[0202]
2.3基于反应器中pet水解的活性
[0203]
将在80ml的100mm磷酸钾缓冲液(ph8)中制备的0.69μmol
‑
2.07μmol的纯化酯酶与20g无定形pet(根据wo 2017/198786制备以使其结晶度低于20%)在500ml minibio生物反应器(applikon biotechnology、delft、the netherlands)中混合。通过水浴浸泡在65℃进行温度调节,并使用单个船用叶轮在250rpm下保持恒定搅拌。通过6n naoh将pet解聚测定的ph值调节为8,并通过my
‑
control生物控制器系统(applikon biotechnology、delft、the netherlands)确认。在测定期间记录碱消耗,并且该碱消耗可用于pet解聚测定的表征。
[0204]
通过测定残留的pet重量或通过测定产生的当量ta和eg或通过碱消耗来测定pet
解聚测定的最终收率。在反应结束时,通过将反应体积通过12
‑
15μm的11级无灰纸过滤器(dutscher sas、brumath、france)过滤并在称重之前干燥此类保留物来评估残留pet的重量。使用2.1中所述的uhplc法测定产生的当量ta和eg,并基于给定时间的摩尔浓度比(ta+mhet+bhet)与初始样品中所含ta总量的比率来计算水解百分比。pet解聚产生酸性单体,该酸性单体将用碱中和以能够保持反应器中的ph。使用相应摩尔的碱消耗量来计算所产生的当量ta,并基于给定时间的当量ta的摩尔浓度与初始样品中所含ta总量的比率来计算水解百分比。
[0205]
实施例3
‑
评估本发明酯酶的热稳定性
[0206]
测定本发明酯酶的热稳定性,并与seq id n
°
1的酯酶的热稳定性进行比较。
[0207]
使用不同的方法来估计热稳定性:
[0208]
(1)溶液中蛋白质的圆二色性;
[0209]
(2)在给定的温度、时间和缓冲液条件下孵育蛋白质后残余酯酶的活性;
[0210]
(3)在给定的温度、时间和缓冲条件下孵育蛋白质后残余聚酯的解聚活性;
[0211]
(4)在给定的温度、时间和缓冲液条件下孵育蛋白质后,降解分散在琼脂平板中的固体聚酯化合物(如pet或pbat或类似物)的能力;
[0212]
(5)在给定的温度、缓冲液、蛋白质浓度和聚酯浓度条件下进行多轮聚酯的解聚测定的能力;
[0213]
(6)差示扫描荧光法(dsf);
[0214]
下文给出了这些方法的方案的细节。
[0215]
3.1圆二色性
[0216]
用jasco 815装置(easton,usa)进行圆二色性(cd)以比较seq id n
°
1的酯酶的熔化温度(t
m
)(tm=84.7℃)和本发明的酯酶的tm。技术上,在talon缓冲液中以0.5mg/ml制备400μl蛋白质样品并用于cd。实现从280nm到190nm的第一次扫描以测定对应于蛋白质正确折叠的cd的两个最大强度。然后,以对应于这种最大强度的长波进行从25℃到110℃的第二次扫描,并提供特定曲线(sigmoid 3参数y=a/(1+e^((x
‑
x0)/b))),其通过sigmaplot版本11.0软件分析,当x=x0时测定t
m
。获得的t
m
反映了给定蛋白质的热稳定性。t
m
越高,变体在高温下越稳定。
[0217]
3.2残余酯酶的活性
[0218]
将1ml的seq id n
°
1的酯酶或本发明酯酶的40mg/l(在talon缓冲液中)的溶液在不同温度(65、70、75、80和90℃)下孵育10天。定期取样,在ph8.0的0.1m磷酸钾缓冲液中稀释1至500倍,进行对硝基苯酚
‑
丁酸盐(pnp
‑
b)测定。将20μl样品与ph8.0的175μl0.1m磷酸钾缓冲液和5μl pnp
‑
b在2
‑
甲基
‑2‑
丁醇(40mm)中的溶液混合。在30℃、搅拌下进行酶促反应15分钟,并通过微孔板分光光度计(versamax,molecular devices,sunnyvale,ca,usa)获得405nm处的吸光度。使用水解曲线的线性部分中释放的对硝基苯酚的标准曲线测定pnp
‑
b水解的活性(初始速度表示为μmol pnpb/min)。
[0219]
3.3残余聚酯的解聚活性
[0220]
将10ml的seq id n
°
1的酯酶和本发明酯酶的40mg/l(在talon缓冲液中)的溶液分别在不同温度(65、70、75、80和90℃)下孵育1到30天。定期取1ml样品,并转移到包含100mg微粉化为250
‑
500μm的无定形pet(根据wo 2017/198786制备以使其结晶度低于20%)和
orange染料5000x储备溶液在水中稀释至250x。将蛋白质样品加载到白色透明96孔pcr板(bio
‑
rad cat#hsp9601)上,其中每个孔包含25μl的终体积。每孔中蛋白质和sypro orange染料的最终浓度分别为5μm(0.14mg/ml)和10x。每孔加载的体积如下:15μl缓冲液a、9μl 0.4mg/ml蛋白质溶液和1μl 250x sypro orange稀释溶液。然后,用光学质量密封带密封pcr板,并在室温下以2000rpm旋转1分钟。然后,使用cfx96实时pcr系统进行dsf实验,所述系统设置为使用450/490激发和560/580发射滤光片。将样品以0.3℃/秒的速率从25℃加热至100℃。每0.03秒进行单次荧光测量。使用bio
‑
rad cfx manager软件从熔化曲线一阶导数的峰测定熔化温度。
[0230]
然后,基于它们的tm值比较seq id n
°
1的酯酶和本发明酯酶。由于来自不同生产的相同蛋白质的实验之间的高重现性,0.8℃的δtm被认为对于比较变体是显著的。tm值对应于至少3次测量的平均值。在84.7℃下评估seq id n
°
1的酯酶的tm。
[0231]
本发明的酯酶(变体)的热稳定性总结于下表3中,以tm值表示并根据实施例3.6评估。括号中显示与seq id n
°
1的酯酶相比tm的增加。
[0232]
表3:与seq id n
°
1相比,本发明酯酶的tm
[0233]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1