埃博霉素B的氮乙酰葡萄糖苷或半乳糖苷化合物及其酶法制备与应用的制作方法
本发明涉及一组埃博霉素b糖苷化合物及其酶法制备与应用,尤其涉及埃博霉素b的氮乙酰葡萄糖苷或半乳糖苷化合物及其酶法制备,以及该类埃博霉素b糖苷化合物在制备治疗和预防肝癌的药物中的应用。属于微生物技术及其制品与应用技术领域。
背景技术:
纤维堆囊菌(sorangiumcellulosum)是一类广泛分布于土壤中的革兰氏阴性细菌。能够产生丰富的次级代谢产物,属粘球菌目,堆囊菌亚目,堆囊菌科,堆囊菌属。
埃博霉素(epothilone)是一类16元大环内酯类化合物,目前仅来源于纤维堆囊菌。埃博霉素与紫杉醇都是通过聚合微管蛋白而抑制肿瘤生长,但埃博霉素对多重耐药的肿瘤细胞尤其是紫杉醇耐药的肿瘤细胞表现出更好的抑制活性,并且具有大规模发酵生产的潜力,被认为是紫杉醇良好的替代品。该类化合物有两种主产物,分别是埃博霉素a和埃博霉素b,其结构式如下:
epothilone结构式(r=h,epothilonea;r=ch3,epothiloneb)
埃博霉素的化学结构相比于紫杉醇更为简单,其包含一个16元的大内酯环、一个三元氧环、以及一个噻唑环侧链。埃博霉素的类似物结构骨架基本相同,埃博霉素b比a在大环内酯的12位碳上多了一个甲基基团,使得对肿瘤细胞的抑制活性显著提高。目前,埃博霉素b的类似物伊沙匹隆(ixabepilone)被fda批准进行乳腺癌的治疗,除伊沙匹隆外,还有多种埃博霉素类似物进入不同的临床评估阶段,例如,帕土匹龙(patupilone),埃博霉素d(kos-862),zk-epo以及abj879。尽管如此,以上报道的埃博霉素类似物均存在较强的神经毒性,血液毒性或是水溶性差等问题,这使得埃博霉素临床应用时受到限制。基于此,对埃博霉素的结构进行合理的后修饰改造十分必要。
由糖基转移酶催化的天然产物糖基化修饰在自然界中广泛存在,所引入的糖基往往对化合物的水溶性、稳定性、以及生物活性方面都有重要的改善作用。对于埃博霉素的糖基化修饰的报道,仅限于2010年发现的epothiloneosidea以及2014年报道的埃博霉素a7-o-β-d葡萄糖苷(epothilonea7-o-β-dglucoside)。然而,对于抗肿瘤活性更好的埃博霉素b的糖基化,仅有有机化学合成的galactosylatedepothiloneb,或者埃博霉素b3-o-α-d阿拉伯吠喃糖苷,其他类型糖基化产物尚未见报道。此外,有机化学方法合成epothiloneb糖基化产物步骤复杂繁琐(galactosylatedepothiloneb在化学合成过程中引入额外的衍生基团),副产物多,分离纯化困难,且还存在有机化学合成方法难度大、合成条件要求高,很难做到选择性保护等缺陷。鉴于此,迫切需要找到更好的对埃博霉素b这一重要的抗肿瘤药物的多样的糖基化修饰替代方法,并能制备出种类更为丰富的埃博霉素b糖基化产物。
技术实现要素:
针对现有技术的不足,本发明要解决的问题是提供一种埃博霉素b的氮乙酰葡萄糖苷或半乳糖苷化合物及其酶法制备,以及该类埃博霉素b糖苷化合物在制备治疗和预防肝癌的药物中的应用。
本发明所述的埃博霉素b的氮乙酰葡萄糖苷或半乳糖苷化合物,其特征在于,所述埃博霉素b的氮乙酰葡萄糖苷化合物是化合物1:埃博霉素b7-o-β-d氮乙酰葡萄糖苷;所述埃博霉素b的半乳糖苷化合物是化合物2:埃博霉素b7-o-β-d半乳糖苷;所述化合物结构式及其连接方式和相应名称如下:
其中:所述埃博霉素b的半乳糖苷化合物优选是化合物2:埃博霉素b7-o-β-d半乳糖苷。
本发明所述的埃博霉素b氮乙酰葡萄糖苷或埃博霉素b半乳糖苷酶法制备的方法是:
埃博霉素b氮乙酰葡萄糖苷酶法制备:以如下比例量,在50mmtris-hcl,10mmmgcl2的缓冲液环境下,以终浓度为10mm的埃博霉素b和终浓度为50mm的udp-o-α-dn-acetyl-glucose与500μg/ml的糖基转移酶bsgt-1的q318c突变蛋白进行体外酶活反应实验;
埃博霉素b半乳糖苷酶法制备:以如下比例量,在50mmtris-hcl,10mmmgcl2的缓冲液环境下,以终浓度为10mm的埃博霉素b和终浓度为50mm的udp-o-α-d-galactose与500μg/ml的糖基转移酶bsgt-1的m296a突变蛋白进行体外酶活反应实验;
分别将以上反应混合液在37±1℃孵育12±2小时,然后添加3倍体积量的甲醇终止反应,14000r/min,30min去除蛋白沉淀,对样品旋转蒸干处理,再添加甲醇重悬产物,14000r/min再次离心30min后将产物通过半制备液相进行分离纯化;色谱柱尺寸规格选ymc-packproc18,250mm×10.0mm,5μm;流动相体系:以35:65乙腈水系统洗脱,埃博霉素b糖苷的出峰时间:化合物1:13.9min;化合物2:14.4min;分离后的糖苷化合物分别蒸干,用cd3od溶解,再使用uhplc-esi-q-tof高分辨质谱和核磁共振分别进行鉴定;
其中,所述的糖基转移酶bsgt-1的q318c突变蛋白是以pet28a-bsgt-1重组质粒为模板,设计突变引物为:
f-q318c:gtatgagtgcgagctcactgcaaatcgggttg;
r-q318c:tgagctcgcactcatacatttgcggaatgacg;
通过一次pcr产生线性重组突变质粒片段,再通过重组反应环化,形成q318c突变的pet28a-bsgt-1重组质粒,经重组质粒的转化和蛋白的诱导表达及纯化获得。
同样,糖基转移酶bsgt-1的m296a突变蛋白获取与糖基转移酶bsgt-1的q318c突变蛋白获取步骤一致,设计突变引物为:
f-m296a:ggggcaaacagtacgatggaagcgatgaacgc;
r-m296a:atcgtactgtttgccccgccatgagagatgaaca;
上述的糖基转移酶bsgt-1(cub50191),其蛋白序列已经公布,其是通过提取b.subtilisjrs11基因组,设计引物(f-bamhi:cgcggatccatgaaaaagtaccatatttcgat;r-sali:acgcgtcgacttactgcgggacagcggattttt),经过双酶切连接形成pet28a-bsgt-1重组质粒,由重组载体转化大肠杆菌bl21(de3)诱导表达获得。
上述埃博霉素b氮乙酰葡萄糖苷或埃博霉素b半乳糖苷酶法制备的方法中:所述埃博霉素b和udp-o-α-n-acetyl-dglucose或udp-o-α-d-galactose混合的摩尔比优选为1:5,其与糖基转移酶bsgt-1的q318c或m296a突变蛋白介导糖基化反应的反应混合液优选在37℃孵育12小时。
本发明所述埃博霉素b氮乙酰葡萄糖苷或埃博霉素b半乳糖苷化合物在制备预防和治疗肝癌的药物中的应用。
实验证实:本发明所述的埃博霉素b氮乙酰葡萄糖苷或埃博霉素b半乳糖苷化合物均对肝癌具有预防和治疗作用。其中,本发明所述的埃博霉素b氮乙酰葡萄糖苷化合物1在浓度为19.76μm时,对人肝癌细胞hepg2有半抑制作用;并且对正常肝细胞hl7702的毒性相比于埃博霉素b原药下降了10604倍。进一步的比较实验显示:埃博霉素b半乳糖苷化合物2在浓度为1.09μm时,对人肝癌细胞hepg2有半抑制作用;并且对正常肝细胞hl7702的毒性相比于埃博霉素b原药下降了3116倍。提示本发明的化合物2在用于制备相关的药物制剂的优越性。所以,优选化合物2:埃博霉素b半乳糖苷作为针对肝癌细胞的低毒高效抑制剂的候选药物,或者作为有效成分用于制备预防和治疗肝癌相关的药物制剂。
本发明公开了一种埃博霉素b的氮乙酰葡萄糖苷或半乳糖苷化合物及其酶法制备的方法,通过温和的酶法合成,一步实现埃博霉素b氮乙酰葡萄糖苷和埃博霉素b半乳糖苷的转化;体外糖基化反应可使原料的循环利用;酶作为一种温和的催化剂,具备很强的可塑性,在酶中引入突变可以产生新功能的突变酶,有利于埃博霉素多样化糖苷的产生,在本发明中,埃博霉素b可以连接多样新颖的udp-sugars,形成的埃博霉素糖苷衍生物增加了埃博霉素糖苷家族的多样性。随着抗癌药物的发掘和发展,临床上对低毒,高活性的新型抗癌药物的需求日益增加。本发明所获得的多样新颖埃博霉素b糖苷有望增益其在抗肿瘤活性中的应用价值,从而产生良好的社会效益和经济价值。
附图说明
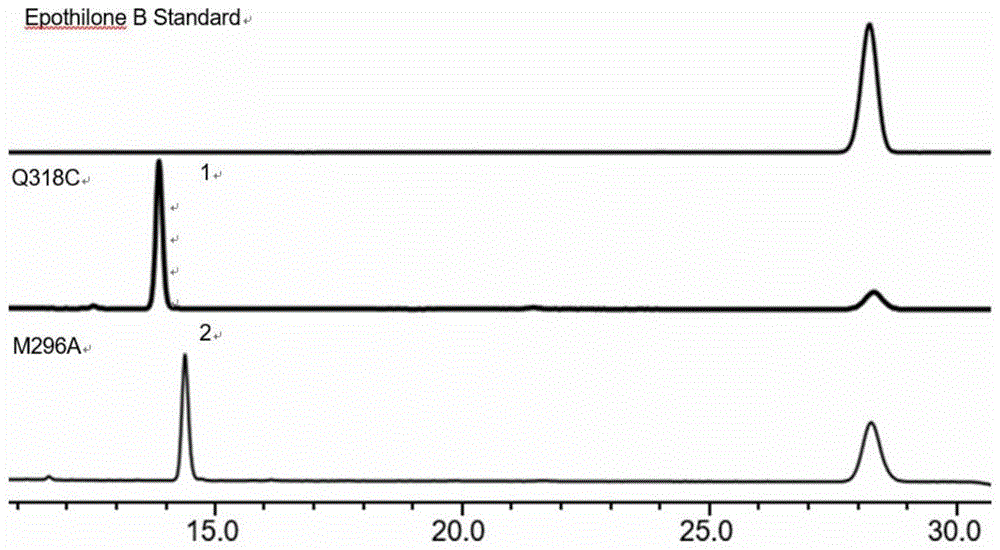
图1:突变蛋白q318c和m296a对埃博霉素b糖基化反应的hplc分析色谱图
其中,两种埃博霉素b糖苷的出峰时间:化合物1:13.9min;化合物2:14.4min;埃博霉素b标准品(epothiloneb)出峰时间,28.4min。
图2:化合物1:埃博霉素b7-o-β-d氮乙酰葡萄糖苷的高分辨质谱图,准分子离子峰[m+h]+为m/z711.3395。
图3:化合物2:埃博霉素b7-o-β-d半乳糖苷的高分辨质谱图,准分子离子峰[m+h]+为m/z670.3127。
具体实施方式
下面结合具体实施例对本发明内容进行详细说明。如下所述例子仅是本发明的较佳实施方式而已,并非对本发明作任何形式上的限制,凡是依据本发明的技术实质对实施方式所做的任何简单修改,等同变化与修饰,均属于本发明技术方案的范围内。
本发明使用的试剂、质粒、菌株、细胞、或实验器材均为市售产品。
实施例1埃博霉素糖基转移酶bsgt-1重组质粒的获取,构建q318c和m296a突变的重组质粒,表达q318c和m296a突变蛋白,以及两种埃博霉素b糖苷的制备
发明人实验筛选确定了能够高效糖基化埃博霉素b的糖基转移酶bsgt-1(cub50191),其蛋白序列已经公布。获取埃博霉素糖基转移酶bsgt-1重组质粒并表达获得糖基转移酶bsgt-1的方法是:
通过提取b.subtilisjrs11基因组dna获取编码糖基转移酶bsgt-1的基因片段,设计双酶切引物(f-bamhi:cgcggatccatgaaaaagtaccatatttcgat;r-sali:acgcgtcgacttactgcgggacagcggattttt),采用
发明人将糖基转移酶bsgt-1的第318位谷氨酰胺突变成半胱氨酸(q318c)以及将第296位甲硫氨酸突变成丙氨酸(m296a),利用构建q318c和m296a突变的重组质粒,表达q318c和m296a突变蛋白。本发明在糖基转移酶bsgt-1引入突变的方法是:
选用mutexpressiifastmutagenesiskitv2,设计突变引物
f-q318c:gtatgagtgcgagctcactgcaaatcgggttg;
r-q318c:tgagctcgcactcatacatttgcggaatgacg;
f-m296a:ggggcaaacagtacgatggaagcgatgaacgc;
r-m296a:atcgtactgtttgccccgccatgagagatgaaca;
利用
本发明使用镍填料对q318c和m296a突变蛋白进行纯化,将超声破碎后的上清加入到预先用缓冲液(50mmtris–hcl,ph7.5)平衡好的镍填料中,而后在4℃环境下,过夜孵育12小时,而后,将孵育后的混合液加入纯化柱中,待填料自然沉降,经过缓冲液的冲洗和平衡后,用不同浓度咪唑的tris-hcl缓冲液(20mm,50mm,100mm,150mm,200mmand250mm咪唑,50mmtris-hcl,ph7.5)分别洗脱到1.5ml离心管中,而后收集蛋白并用sds-page检测。将收集的纯化蛋白用30kda的超滤管去除咪唑并浓缩,将浓缩后的蛋白(q318c和m296a突变蛋白)样品进行下一步糖基化反应。
利用分离纯化的糖基转移酶bsgt-1的q318c和m296a突变蛋白分别制备埃博霉素b7-o-β-d氮乙酰葡萄糖苷和埃博霉素b7-o-β-d半乳糖苷,制备方法及反应条件是:
4ml的体外酶活反应体系分别包括糖基转移酶bsgt-1的q318c或m296a突变蛋白(500μg/ml),tris-hcl缓冲液(50mmtris-hcl,10mmmgcl2),埃博霉素b(终浓度10mm,溶于dmso,约20mg)以及udp-o-α-dn-acetyl-glucose(或udp-o-α-d-galactose,终浓度50mm,溶于水)进行体外酶活实验。反应混合液在37℃孵育12个小时,然后添加3倍体积量的甲醇终止反应,14000r/min,30min去除蛋白沉淀,对样品旋转蒸干处理,再添加甲醇重悬产物,14000r/min再次离心30min后将产物通过半制备液相进行分离纯化。
以上两种埃博霉素b糖苷的制备利用ymc色谱柱(ymc-packproc18,250mm×10.0mm,5μm),流动相体系:乙腈水系统洗脱(35:65),四种埃博霉素b葡萄糖苷的出峰时间:化合物1:13.9min;化合物2:14.4min。分离后的两种化合物分别蒸干,用cd3od溶解,再使用uhplc-esi-q-tof高分辨质谱和核磁共振分别进行鉴定。
实施例2化合物1的结构鉴定
依据图2,uhplc-esi-q-tof高分辨质谱给出化合物1的准分子离子峰[m+h]+为m/z711.3395,从而推测化合物1为埃博霉素b的氮乙酰葡萄糖的单糖苷。同时,单糖也可以从化合物1的核磁共振氢谱(1hnmr)和碳谱(13cnmr)上加以确证。hmbc谱中,h-7与c-1'相关及h-1'与c-7相关,从而确定氮乙酰葡萄糖基连接在埃博霉素b大环内酯骨架的7位羟基。糖上端基质子h-1'和h-2'之间的较大耦合常数(j1',2'=8.4hz)以及端基质子偏高场的化学位移值4.65ppm,揭示了糖基供体和埃博霉素b受体是通过β-d糖苷键连接的。因此,化合物1为epothiloneb7-o-β-dn-acetyl-glucoside,其具体核磁数据归属见表1。
表1.化合物1的核磁数据归属
实施例3化合物2的结构鉴定
依据图3,高分辨质谱给出化合物2的准分子离子峰[m+h]+为m/z670.3127,推测其为埃博霉素b的半乳糖苷。同时,化合物2的核磁共振氢谱(1hnmr)和碳谱(13cnmr)进一步确定为埃博霉素b单糖苷。hmbc谱中,h-7与c-1'相关及h-1'与c-7相关,从而确定氮乙酰葡萄糖基连接在埃博霉素b大环内酯骨架的7位羟基。糖上端基质子h-1'和h-2'之间的较大耦合常数(j1',2'=7.2hz)以及端基质子偏高场的化学位移值4.42ppm,揭示了糖基供体和埃博霉素b受体是通过β-d糖苷键连接的。因此,化合物2为epothiloneb7-o-β-dgalactoside,核磁数据归属见表2。
表2.化合物2的核磁数据归属。
实施例4两种埃博霉素b糖苷的抗肿瘤活性测试
筛选方法:四氮唑盐(methyl-thiazol-tetozolium,mtt)还原法
细胞株:hepg2人肝癌和正常肝细胞hl7702
作用时间:48小时
实验方法:
胰酶消化对数生长期的细胞,加一定量培养液终止反应后离心收集细胞,并用1ml培液基重悬细胞。另取一支无菌排枪枪槽,将细胞悬液与新鲜培养液充分混匀并加入到96孔板中(边缘孔用无菌pbs填充)。将接种好的细胞培养板放入培养箱中培养,贴壁生长,至细胞单层铺满96孔底板,分别加入浓度梯度的四种埃博霉素b葡萄糖苷化合物,每孔100μl,设平行实验复孔4个。5%co2,37℃孵育48小时,吸出上清,pbs洗2-3遍后,而后加入100μl的mtt溶液(0.5mg/ml,即0.5%mtt培养基),继续培养4h,弃上清,pbs洗2-3遍后,每孔加入100μl二甲基亚砜(dmso),置摇床上低速振荡10min,使结晶物充分溶解。在酶标仪od492nm处测量各孔的吸光值。
分别在不同药物浓度下测得四种埃博霉素b糖苷化合物对人肝癌hepg2的抑制率:
化合物1:埃博霉素b7-o-β-d氮乙酰葡萄糖苷对人肝癌hepg2的抑制率分别为3.52%(0.01μm),0.98%(0.1μm),2.89%(1μm),15.49%(5μm),45.43%(20μm),78.73%(100μm),83.52%(200μm);
化合物2:埃博霉素b7-o-β-d半乳糖苷对人肝癌hepg2的抑制率分别为2.89%(0.01μm),6.74%(0.1μm),46.78%(1μm),55.82%(5μm),69.93%(20μm),83.32%(100μm);
对此,发明人通过非线性拟合曲线求得两种埃博霉素b糖苷化合物对人肝癌细胞hepg2的ic50值以及对正常肝细胞抑制的ic50值如表3和表4:
表3.两种埃博霉素b糖苷对人肝癌细胞hepg2的ic50值
表4.两种埃博霉素b糖苷对人正常肝细胞hl7702的ic50值
结论:从表3可以看出,埃博霉素b糖苷化合物2在浓度为1.09μm(10-6m)时,对肝癌细胞hepg2有半抑制作用,并且从表4可以看出,化合物2对正常肝细胞hl7702的毒性相比于埃博霉素b原药下降了3116倍。所以该化合物可望作为针对肝细胞等肿瘤细胞的低毒高效抑制剂的候选药物。
- 还没有人留言评论。精彩留言会获得点赞!