一种小麦抗逆制剂及其应用的制作方法
本发明属于农业制剂
技术领域:
,具体涉及一种小麦抗旱制剂及其作为植物生长调节剂中的应用。
背景技术:
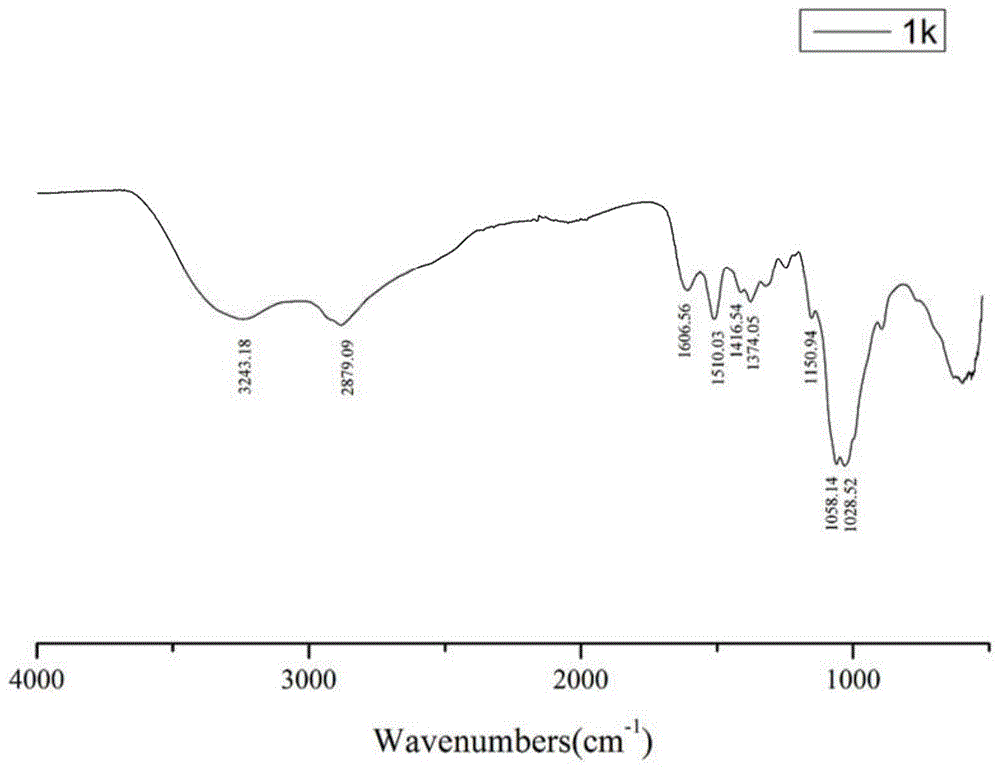
:小麦不仅是世界上重要的粮食作物,也是我国第二大粮食作物,小麦的产量直接关系到人民的生活状态,与国民经济发展紧密相关。在小麦的萌发、发育、生长期内常常受到干旱、少雨等胁迫,尤其在萌发期和幼苗期,小面的抵抗力较弱,容易造成大面积的不出苗以及幼苗失水萎蔫、叶片衰退早、光合系统受到损伤等不良状态,不利于小麦后期的生长和发育,最终影响产量。技术实现要素:本发明目的在于克服现有的抗旱制剂配比复杂、作用效果有限、环境友好性差的缺点,提供一种天然来源的制备简单、结构新颖且环境友好的小麦抗旱制剂及其作为植物生长调节剂中的应用。为实现上述目的,本发明采用技术方案为:一种小麦抗逆化合物,小麦抗逆化合物为壳聚糖氨基丁酸衍生物,其通式如式ⅰ所示,式ⅰ中,n=1-250;n1、n2均大于1。小麦抗逆化合物的制备方法:将氨基丁酸溶于缓冲液中混合均匀,然后加入缩合剂和偶联剂,室温搅拌反应2-4小时;而后向反应液中加入壳聚糖进行反应,反应液纯化、冻干得式ⅰ所示壳聚糖氨基丁酸衍生物。所述向反应体系内加入壳聚糖而后搅拌18-48小时或微波条件下,进行反应1-3小时;反应结束后将反应液装入透析袋中用去离子水透析,冻干得式ⅰ所示壳聚糖氨基丁酸衍生物。所述微波条件为功率:100-2000w,时间:1-3小时,温度:25-80℃。所述氨基丁酸:缩合剂:偶联剂的摩尔比为1:(2-3):(2-3);缩合剂:偶联剂的摩尔比为1:1;氨基丁酸:壳聚糖的摩尔比根据壳聚糖的聚合度计,为(7-200):1;所述缓冲液为0.1mol/lph=5.5的吗啉乙磺酸水溶液;缩合剂为1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc·hcl);偶联剂为n-羟基琥珀酰亚胺(nhs),所述氨基丁酸为γ-氨基丁酸或β-氨基丁酸。一种小麦抗逆化合物的应用,所述小麦抗逆化合物在作为小麦抗旱制剂中的应用。采用浸种、叶面喷施或灌根的方式处理小麦种子或小麦植株,处理植株的时期为种子萌发期和/或幼苗期。一种小麦抗逆化合物的应用,所述小麦抗逆化合物在作为植物生长调节剂中的应用。一种小麦抗逆制剂,所述制剂含所述化合物。所述制剂为水剂、粉剂、可湿性粉剂、乳油、悬浮剂或微乳剂。小麦抗逆制剂,适用的逆境环境为自然状态下的干旱和营养液模拟的干旱等。所述配置制剂的浓度范围为1mg/l-1g/l。原理:氨基丁酸的羧基经过缩合剂和偶联剂活化后与壳聚糖中脱掉了乙酰基的氨基进行酰化反应形成酰胺键,但是由于氨基丁酸中也存在氨基基团,所以游离的氨基丁酸中活化了的羧基也会和和接枝到壳寡糖上的氨基丁酸的氨基进行反应,所以合成的衍生物是壳聚糖多聚氨基丁酸衍生物。而使用微波反应器可以缩短实验时间。本发明所具有的优点:本发明壳聚糖-氨基丁酸衍生物,结构新颖,合成方法简单、原料来源广泛,成本低廉;将其通过浸种、灌根或喷施的方式作用于小麦,进而增强小麦的抗旱等效果,同时安全环保、易降解、操作便捷、具有促生长作用等优势,具有很好的应用潜力;具体为:1.本发明合成了一系列的新型壳聚糖-氨基丁酸衍生物,结构新颖,合成方法简单、原料来源广泛,成本低廉。2.本发明的化合物能够显著增强小麦的抗旱活性,并较成分原料壳聚糖(或壳寡糖)、β-氨基丁酸或γ-氨基丁酸的抗旱效果显著提升。3.本发明小麦抗旱制剂应用广泛、实施方便、使用效果显著;同时采用本发明小麦抗旱制剂,提高小麦种子的出苗率,保证小麦苗期生长良好,提高小麦抗旱能力,进一步保证产量。附图说明图1为本发明实施例提供的壳聚糖(chitosan)的红外光谱图,其红外特征吸收(cm-1):3243.18、2879.09、1606.56、1510.03、1413.54、1374.05、1150.94、1058.14、1028.52等。图2为本发明实施例提供的采用本发明方法所得壳聚糖衍生物1的红外光谱图(1k-b:1000da的壳聚糖和β-氨基丁酸衍生物),其红外特征吸收(cm-1):3273.51、2874.66、1634、1545、1378、1148.96、1062.09、1026.54等。图3为本发明实施例提供的采用本发明方法所得的壳聚糖衍生物2的红外光谱图(1k-g:1000da的壳聚糖和γ-氨基丁酸衍生物),其红外特征吸收(cm-1):3273.86、2872.95、1632、1547、1375.68、1148.64、1058.64、1027.95等。图4为本发明实施例提供的采用本发明方法所得的壳聚糖衍生物3的红外光谱图(9k-g:9000da的壳聚糖和γ-氨基丁酸衍生物),其红外特征吸收(cm-1):3273.95、2872.95、1634.14、1549.43、1373.64、1152.73、1056.59、1027.95等。图5为本发明实施例提供的采用本发明方法所得的壳聚糖衍生物4的红外光谱图(9k-g:9000da的壳聚糖和β-氨基丁酸衍生物),其红外特征吸收(cm-1):3279.10、2873.28、1634.14、1549.43、1372.13、1151.49、1060.87、1023.44等。图6为本发明实施例提供的采用本发明方法所得1k的壳聚糖-多聚β-氨基丁酸衍生物(chitosan-baba),1k的壳聚糖-多聚γ-氨基丁酸衍生物(chitosan-gaba)与壳聚糖(chitosan)的液态核磁碳谱图。具体实施方式以下通过实施例对本发明的具体实施方式做进一步说明,应当指出的是,此处所描述的具体实施方式只是为了说明和解释本发明,并不局限于本发明。本发明所述化合物以壳聚糖为骨架(参见图1),在壳聚糖2位氨基接枝氨基丁酸结构。式ⅰ中,n=1-250。下面更具体地描述本发明式ⅰ化合物的制备方法,但这些具体方法不对本发明构成任何限制。实施例1:壳聚糖氨基丁酸衍生物的制备方法:γ-氨基丁酸或β-氨基丁酸溶于0.1mol/lph=5.5的吗啉乙磺酸水溶液中混合均匀,然后加入1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc·hcl)和n-羟基琥珀酰亚胺(nhs),室温搅拌反应2小时;而后向反应液中加入壳聚糖继续搅拌24小时;反应结束后将反应液装入透析袋中用去离子水透析,冻干得式ⅰ所示壳聚糖氨基丁酸衍生物。即,衍生物1,添加β-氨基丁酸时,式ⅰ中,n=6,n2大于1。衍生物2,添加γ-氨基丁酸时,式ⅰ中,n=6,n1大于1。所述壳聚糖是高脱乙酰化、聚合度在6。所述氨基丁酸:edc·hcl缩合剂:nhs的摩尔比为1:3:3;氨基丁酸:壳聚糖的摩尔比根据壳聚糖的聚合度计,为7:1。红外光谱表明:壳聚糖衍生物1的外红谱图(图2)与壳聚糖的红外谱图(图1)相比,位于1606.56cm-1的nh2特征吸收峰消失,表明nh2已经发生反应;1634和1545cm-1为c=o吸收峰和n-h变形振动吸收峰,说明形成了新的酰胺键。综上,证明衍生物1合成成功。红外光谱表明:壳聚糖衍生物2的外红谱图(图3)与壳聚糖的红外谱图(图1)相比,位于1606.56cm-1的nh2特征吸收峰消失,表明nh2已经发生反应;1632和1547cm-1为c=o吸收峰和n-h变形振动吸收峰,说明形成了新的酰胺键、综上,证明衍生物2合成成功。实施例2壳聚糖氨基丁酸衍生物的制备方法:γ-氨基丁酸或β-氨基丁酸溶于0.1mol/lph=5.5的吗啉乙磺酸水溶液中混合均匀,然后加入1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc·hcl)和n-羟基琥珀酰亚胺(nhs),室温搅拌反应3小时;而后将反应液置于微波反应器中600w,40℃反应2小时;反应结束后将反应液装入透析袋中用去离子水透析,冻干得式ⅰ所示壳聚糖氨基丁酸衍生物。即,衍生物3,添加γ-氨基丁酸时,式ⅰ中,n=56,n1大于1。衍生物4,添加β-氨基丁酸时,式ⅰ中,n=56,n2大于1。红外光谱表明:壳聚糖衍生物3的外红谱图(图4)与壳聚糖的红外谱图(图1)相比,位于1606.56cm-1的nh2特征吸收峰消失,表明nh2已经发生反应;1634.14和1549.43cm-1为c=o吸收峰和n-h变形振动吸收峰,说明形成了新的酰胺键、综上,证明衍生物3合成成功。所述壳聚糖是高脱乙酰化、聚合度在56。所述氨基丁酸:edc·hcl缩合剂:nhs的摩尔比为1:3:3;氨基丁酸:壳聚糖的摩尔比根据壳聚糖的聚合度计,为60:1。实施例3称取0.0125gβ-氨基丁酸(记为b);称取0.0125gγ-氨基丁酸(记为g);0.0125g分子量为1000da的壳寡糖(1k);0.0125g上述实施例1制备获得壳聚糖β-氨基丁酸衍生物(记为1k-b);0.0125g上述实施例1制备获得壳聚糖γ-氨基丁酸衍生物(记为1k-g);分别用水定容到25ml制备成小麦抗旱制剂各样品组,同时以去离子水作为空白组。利用上述个样品组对小麦种子进行处理,具体实验如下:实验方法:用上述样品组和空白组分别对小麦种子进行浸种处理8小时;取出浸泡后种子摆放在湿润的纱布上放置在暗处催芽24小时;挑选饱满、品相均一、生长状态相似的露白种子播种于装有对应湿度的土壤的花盆中,每盆50粒种子,种子播种于土下3cm;放置于光照培养箱中培养,培养条件为25/20℃(昼/夜)、光照强度60%、光照周期14/10h(昼/夜)、相对湿度65±5%;待小麦生长至两叶一心后测定小麦幼苗的相关指标。此实施例中提及的指标只是部分指标。具体相关指标:①丙二醛(mda)代表着干旱胁迫下脂质过氧化的产物之一,其含量的多少代表着膜损伤程度的大小;②电解质渗出率代表着质膜的透性,也是代表着受损伤的程度和稳定性;③叶片相对含水量代表着小麦幼苗叶片保存水的能力;④待小麦幼苗生长至两叶一心后,测量小麦幼苗的根长、苗高以及苗湿重,然后用105℃烘箱烘干至恒重,再测定苗干重;(参见表1和表2)表1小麦抗旱制剂对小麦幼苗叶片各项指标的影响由上述表1可见,上述各样品组和空白组中干旱处理后丙二醛含量显著升高,经本发明抗逆制剂衍生物处理后能够明显降低小麦幼苗丙二醛的产生,且较原料效果显著,降低对质膜的损伤;同时,干旱处理样品明显增加了电解质的渗出率,经抗逆制剂处理后能够显著降低小麦幼苗电解质渗出率,且较原料效果显著,进一步的从另一个角度验证了脂质过氧化对膜的损伤程度;另外,本实验中干旱明显降低叶片含水量,经小麦抗逆制剂样品组处理后显著提高叶片含水量,且较原料效果显著。表2小麦抗旱制剂对小麦幼苗生物量的影响。组别苗高(cm)根长(cm)苗湿重(g)苗干重(g)control33.5728.230.44240.0476drought25.039.700.13660.0210b+drought25.8810.530.14500.0219g+drought25.8910.100.16370.02211k+drought25.299.770.15770.0224(1k-b)+drought27.2013.100.20520.0301(1k-g)+drought26.6312.830.17020.0250并且由表2可见本实验中干旱胁迫明显减低了小麦幼苗的苗高、根长、苗湿重、苗干重,经过小麦抗逆制剂处理后显著增加了小麦的苗高、根长、苗湿重、苗干重,且较原料效果显著,说明小麦抗旱制剂可以提高小麦幼苗抵抗干旱胁迫的能力。实施例4:称取0.0125gβ-氨基丁酸(记为b);称取0.0125gγ-氨基丁酸(记为g);0.0125g分子量为1000da的壳寡糖(1k);0.0125g上述实施例1制备获得壳聚糖β-氨基丁酸衍生物(记为1k-b);0.0125g上述实施例1制备获得壳聚糖γ-氨基丁酸衍生物(记为1k-g);分别用水定容到25ml制备成小麦抗旱制剂各样品组,同时以去离子水作为空白组。利用上述个样品组对小麦种子进行处理,具体实验如下:用上述样品组和空白组分别对小麦种子进行浸种处理8小时;取出种子后摆放在湿润的纱布上放置在暗处催芽24小时;挑选饱满、品相均一、生长状态相似的露白种子播种于装有hoagland营养液/hoagland营养液+20%peg6000的水培装置中,每盆25粒种子,每组4瓶;放置于光照培养箱中培养,培养条件为25/20℃(昼/夜)、光照强度60%、光照周期14/10h(昼/夜)、相对湿度65±5%,培养四天后每天用实施例2中制得的小麦抗逆制剂对小麦叶片进行喷施处理;待小麦生长至两叶一心后测定小麦幼苗的相关指标。此实施例中提及的指标只是部分指标。具体相关指标:①丙二醛(mda)代表着干旱胁迫下脂质过氧化的产物之一,其含量的多少代表着膜损伤程度的大小;②电解质渗出率代表着质膜的透性,也是代表着受损伤的程度和稳定性;③叶片相对含水量代表着小麦幼苗叶片保存水的能力;④本实验待小麦幼苗生长至两叶一心后,测量小麦幼苗的苗高以及苗湿重;(参见表3和表4)。表3小麦抗逆制剂对小麦幼苗叶片各项指标的影响组别丙二醛含量nmol/g电解质渗出率%叶片相对含水量%control5.551.4985.23drought9.0112.1969.80b+drought7.2810.6871.63g+drought6.549.0471.751k+drought7.4111.2170.24(1k-b)+drought6.466.872.42(1k-g)+drought6.36.2372.97由表3可见,本实验中高渗处理后丙二醛含量显著升高,经抗逆制剂处理后能够明显降低小麦幼苗丙二醛的产生,且较原料效果显著,降低对质膜的损伤。同时,本实验中高渗处理明显增加了电解质的渗出率,经抗逆制剂处理后能够显著降低小麦幼苗电解质渗出率,且较原料效果显著,从另一个角度验证了脂质过氧化对膜的损伤程度;另外,本实验中高渗明显降低叶片含水量,经小麦抗逆制剂处理后显著提高叶片含水量,且较原料效果显著。表4小麦抗逆制剂对小麦幼苗生物量的影响。由表4可见,本实验中干旱胁迫明显减低了小麦幼苗的苗高、苗湿重,经过小麦抗逆制剂处理后显著增加了小麦的苗高、苗湿重,且较原料效果显著,说明小麦抗旱制剂可以提高小麦幼苗抵抗干旱胁迫的能力。实施例5:称取0.0125gβ-氨基丁酸(记为b);称取0.0125gγ-氨基丁酸(记为g);0.0125g分子量为9000da的壳寡糖(9k);0.0125g上述实施例2制备获得壳聚糖-β-氨基丁酸衍生物(记为9k-b);0.0125g上述实施例2制备获得壳聚糖γ-氨基丁酸衍生物(记为9k-g);分别用水定容到25ml制备成小麦抗旱制剂各样品组,同时以去离子水作为空白组。利用上述个样品组对小麦种子进行处理,具体实验如下:用上述样品组和空白组分别对小麦种子进行浸种处理8小时;取出种子后摆放在湿润的纱布上放置在暗处催芽24小时;挑选饱满、品相均一、生长状态相似的露白种子播种于装有对应湿度的土壤的花盆中,每盆50粒种子,种子播种于土下3cm;放置于光照培养箱中培养,培养条件为25/20℃(昼/夜)、光照强度60%、光照周期14/10h(昼/夜)、相对湿度65±5%;待小麦生长至两叶一心后测定小麦幼苗的相关指标。此实施例中提及的指标只是部分指标。具体相关指标:①丙二醛(mda)代表着干旱胁迫下脂质过氧化的产物之一,其含量的多少代表着膜损伤程度的大小;②电解质渗出率代表着质膜的透性,也是代表着受损伤的程度和稳定性;③叶片相对含水量代表着小麦幼苗叶片保存水的能力;④本实验待小麦幼苗生长至两叶一心后,测量小麦幼苗的苗高以及苗湿重;(参见表5和表6)。表5小麦抗逆制剂对小麦幼苗叶片各项指标的影响组别丙二醛含量nmol/g电解质渗出率%叶片相对含水量%control22.341.3086.32drought34.327.4867.41b+drought27.714.2571.86g+drought32.805.8670.129k+drought29.35.1970.50(9k-b)+drought27.114.1172.27(9k-g)+drought27.324.1372.22由表5可见,本实验中干旱处理后丙二醛含量显著升高,经抗逆制剂处理后能够明显降低小麦幼苗丙二醛的产生,且较原料效果显著,降低对质膜的损伤。本实验中干旱处理明显增加了电解质的渗出率,经抗逆制剂处理后能够显著降低小麦幼苗电解质渗出率,且较原料效果显著,从另一个角度验证了脂质过氧化对膜的损伤程度。另外,本实验中干旱明显降低叶片含水量,经小麦抗逆制剂处理后显著提高叶片含水量,且较原料效果显著。表6小麦抗逆制剂对小麦幼苗生物量的影响。组别苗高(cm)根长(cm)苗湿重(g)苗干重(g)control33.5728.230.44240.0476drought25.039.700.13660.0197b+drought25.8810.530.14500.0219g+drought25.8910.100.16370.02179k+drought25.299.650.16680.0227(9k-b)+drought27.2012.150.17270.0234(9k-g)+drought26.6312.050.17730.0248由表6可见,本实验中干旱胁迫明显减低了小麦幼苗的苗高、根长、苗湿重、苗干重,经过小麦抗逆制剂处理后显著增加了小麦的苗高、根长、苗湿重、苗干重,且较原料效果显著,说明小麦抗旱制剂可以提高小麦幼苗抵抗干旱胁迫的能力。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1