一种抗人CS1抗原的单克隆抗体及其CAR-T细胞的制作方法
一种抗人cs1抗原的单克隆抗体及其car-t细胞
技术领域
[0001]
本发明涉及一种能特异性抑制人多发性骨髓瘤及其他cs1阳性肿瘤细胞生长的新型抗cs1抗原的单克隆抗体(克隆5g5a4),以及表达含有该单克隆抗体序列的嵌合抗原受体的t免疫细胞(car-t)或自然杀伤细胞(car-nk)等,它们在肿瘤过继免疫治疗中起作用。
背景技术:
[0002]
细胞与免疫治疗是一种非常有前景的癌症治疗方法。t细胞或t淋巴细胞是我们人体免疫系统细胞免疫的重要组成部分,它通过不断寻找和识别外来、异己抗原,从体细胞中区分正常细胞和异常细胞(癌细胞或受病毒感染细胞)并杀灭与清除异常细胞。利用表达嵌合抗原受体的载体对t细胞进行基因修饰是设计特异性肿瘤t细胞的常用方法。将靶向肿瘤相关抗原(taa)的car-t细胞注入患者体内(称为过继细胞转移或act)是一种有效的免疫治疗方法
[1,2]
。与化疗或者抗体疗法相比,car-t技术的优势在于基因重组的工程t细胞可以在病人体内增殖、持续存或并杀伤靶细胞(“活体药物”)
[1
,3
,4]
。
[0003]
car通常由源于单克隆抗体n端之单链可变片段(scfv)、铰链区、跨膜区和一些胞内共刺激结构域如(i)cd28、(ii)cd137(4-1bb)、cd27或其他共刺激结构域,及与其串联的cd3 zeta活化结构域组成
[2
,3](图1)。在图1中,左图为第一代的car结构(无共刺激结构域);中图为第二代的car结构(一个共刺激结构域,cd28或4-bb);并且右图为第三代的car结构(两个或多个共刺激结构域)。该图来自golubovskaya,wu,cancers,2016年3月15日;8(3)。car的发展经历了从第一代(无共刺激结构域)到第二代(有一个共刺激结构域),再到第三代(具有多个共刺激结构域)。包含有多个共刺激结构域的car(即第三代car)及其转染表达的car-t、car-nk细胞的应用使car-t、car-nk肿瘤杀伤活性增强,在体内的持久性延长,并且抗肿瘤疗效提高。
[0004]
cs1抗原
[0005]
cs1为淋巴细胞信号活化分子(slam家族第七成员,cd319抗原),在多发性骨髓瘤细胞中过度表达。细胞外结构域如图2中下划线部分所示。基于其在多发性骨髓瘤中的高表达,它被用作制备治疗多发性骨髓瘤及cs1阳性肿瘤抗体或car-t细胞的靶点。
附图说明
[0006]
图1:car的结构。
[0007]
图2:cs1蛋白的氨基酸序列。
[0008]
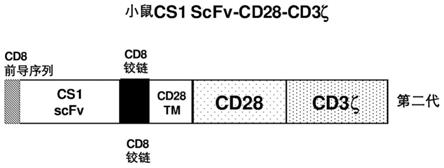
图3:cs1-car构建体的结构。
[0009]
图4:在多发性骨髓瘤细胞系h929、mm1s、rpmi8226中检测到cs1,而在淋巴瘤、k562细胞中未检测到。
[0010]
图5:检测稳定表达cs1抗原的cho细胞中的cs1抗原。
[0011]
图6:通过cs1抗体免疫组化染色检测cs1在不同组织中的表达。
[0012]
图7:通过小鼠fab抗体流式细胞术,可检测car表达阳性的t细胞。
[0013]
图8:cs1-car-t细胞杀死cho-cs1细胞,但不杀伤cho细胞。
[0014]
图9:cs1-car-t细胞在与rpmi8226、ht929和mm1s多发性骨髓瘤细胞共孵育后可特异性分泌ifn-γ。
[0015]
图10:cs1-car-t细胞与cho-cs1细胞共孵育后分泌高水平的ifn-γ,但与cho细胞共孵育后未检测到ifn-γ分泌。
[0016]
图11:rpmi8226肿瘤异种移植nsg小鼠分别经cs1-car-t细胞、pbs和t细胞处理后的体内肿瘤生长的影像学图像。
具体实施方式
[0017]
定义
[0018]
如本文所用,“嵌合抗原受体(car)”是指融合蛋白,其由能与抗原结合的胞外结构域、源于多肽的跨膜结构域(该多肽不同于衍生胞外结构域多肽)、以及至少一个细胞内结构域组成。“嵌合抗原受体(car)”有时被称为“嵌合受体”、“t体”或“嵌合免疫受体(cir)”,“能够与抗原结合的胞外结构域”是指能与某一抗原结合的任何寡肽或多肽。“细胞内结构域”是指已知功能为传递信号以引起细胞内生物过程的激活或抑制的结构域的任何寡肽或多肽。
[0019]
如本文所用,“结构域”是指多肽中独立于其他区域折叠成特定结构的一个区域。
[0020]
如本文所用,“单链可变片段(scfv)”是指由保留结合抗原能力的抗体衍生的单链多肽。scfv的示例包括通过重组dna技术形成的抗体多肽,其中免疫球蛋白重链(h链)和轻链(l链)的可变区fv片段通过间隔序列连接。用于工程化scfv的各种方法是本领域技术人员已知的。
[0021]
如本文所用,“肿瘤抗原”是指具有抗原性的生物分子,其表达引起癌症。
[0022]
本发明人已构建了特异性靶向人cs1抗原的鼠抗人单克隆抗体。本发明人也已构建了cs1-car-t细胞,以靶向过度表达cs1抗原的癌细胞。本发明的cs1-car-t细胞对多种肿瘤细胞系具有高细胞毒活性。
[0023]
本发明涉及一种抗人cs1抗原的单克隆抗体,包含具有seq id no:5的氨基酸序列的vh片段和具有seq id no:6的氨基酸序列的vl片段,本发明的抗cs1单克隆抗体具有抗人cs1抗原的特异性。在一个实施方式中,该抗人cs1单克隆抗体是单链可变区片段(scfv)。
[0024]
本发明还涉及一种嵌合抗原受体融合蛋白,其从n端到c端包含:(i)抗cs1单链可变片段(scfv),(ii)跨膜结构域,(iii)至少一个共刺激结构域,以及(iv)激活结构域。
[0025]
本发明人已构建cs1-scfv-cd28-cd3-car-t(cs1-car-t)细胞用以治疗cs1过表达的血液学癌症(包括多发性骨髓瘤)。本发明人提供了证明cs1在不同类型血液系统癌症(淋巴瘤、多发性骨髓瘤)中有效表达的数据。同时显示本发明的cs1-car-t细胞对cs1阳性癌细胞的杀伤活性高于未转染的t细胞和模拟car-t细胞。
[0026]
本发明的cs1单克隆抗体或cs1-scfv相对于其他已知的cs1抗体的优势在于,本发明抗体对淋巴瘤抗原和多发性骨髓瘤抗原都具有高的结合活性,并且其对cs1阳性癌细胞(包括淋巴瘤和多发性骨髓瘤)都具有高度的特异性。该cs1单克隆抗体或cs1-scfv片段在血液系统肿瘤抗体治疗领域具有广泛的应用前景。作为治疗性抗体,此cs1抗体将在许多临床应用中显示很强的治疗作用。
[0027]
本发明的小鼠抗人cs1单克隆抗体可检测cs1阳性癌细胞中的cs1抗原。
[0028]
本发明的cs1抗体可用于免疫治疗:包括毒素/药物偶联抗体、治疗性单克隆抗体、cs1人源化抗体、car-t、car-nk细胞免疫治疗等。
[0029]
使用本发明的cs1抗体构建的cs1-car-t、cs1-cat-nk细胞可有效用于cs1阳性肿瘤治疗中的靶标cs1抗原:淋巴瘤、白血病和多发性骨髓瘤。
[0030]
本发明的cs1-car-t、cs1-car-nk也可与不同的其他疗法联合使用,包括化疗、免疫检查点抑制剂、靶向治疗、小分子抑制剂和抗体等疗法。。
[0031]
本发明cs1抗体可通过定点突变进行亲和力优化,也可用于人源化开发全人源抗体。
[0032]
cs1-car-t、cs1-car-nk细胞可用于cs1阳性肿瘤治疗。
[0033]
共激活结构域(cd28,4-1bb等)的修饰有助于提高csi-car-t/nk细胞的有效性。标记的cs1 scfv片段可用于car的制备。
[0034]
第三代car-t或其他共激活信号结构域可在car结构内应用于同一cs1scfv片段。
[0035]
人源化的cs1可用于构建人源化cs1-car。
[0036]
本发明cs1-car可与靶向其他肿瘤抗原或肿瘤微环境因子如(vegfr-1-3)、pdl-1、cd80或双靶点bi-scfv car联合应用,以提高cs1-car单一治疗的效果。同时,本发明cs1抗体或scfv片段也可用于开发靶向cs1和cd3或其他抗原的双特异性抗体。
[0037]
本发明cs1-car也可用于生成其他类型的细胞,例如cs1-car-nk自然杀伤细胞、cs1-car巨噬细胞和其他细胞。
[0038]
以下实施例对本发明进行了进一步说明。这些实施例仅旨在说明本发明,而不应被解释为是限制性的。
[0039]
实施例
[0040]
本发明人在慢病毒载体内,经克隆至慢病毒载体的xbaⅰ和ecorⅰ酶切位点之间,构建了cs1 car结构体。pcd510-cs1-28-cd3慢病毒car结构体包含插入的cs1 scfv-cd28-cd3zeta片段——或类似地可以用41bb刺激结构域代替cd28,其插入点位于xba i和eco-ri克隆位点之间。
[0041]
慢病毒是在293t细胞中生长,其生长滴度由rt-pcr方法测定。如实施例所述,等剂量慢病毒被用于转染t细胞。
[0042]
实施例1:用流式细胞仪检测法,cs1抗体可检测到多发性骨髓瘤细胞和稳定cho-cs1细胞株中的cs1蛋白
[0043]
采用标准的杂交瘤技术,我们制备了小鼠抗人cs1单克隆抗体,克隆5g5a4。采用流式细胞仪facs染色法,本发明cs1单抗在三种不同的多发性骨髓瘤细胞系中检测到细胞外cs1蛋白的表达,但在淋巴瘤细胞中检测结果无cs1表达(图4)。我们在稳定转化的cho-cs1细胞中也检测到了cs1表达(图5),其中cs1-ab p为本发明单抗,cs1-ab为阳性单抗对照,同种型为阴性对照。
[0044]
实施例2:cs1在正常组织中低表达
[0045]
我们对正常人和癌症患者的组织进行了ihc染色。我们在造血细胞所在的扁桃体中检测到高染色,而在一些正常组织:肺、脑、小脑,以及肺癌、宫颈癌和子宫内膜癌中也检测到低染色(图6)。因此,该抗体具有cs1特异性,可用于cs1-car产品开发。
[0046]
实施例3:cs1 vh、vl、可变链序列和car结构的测序
[0047]
我们对cs1抗体进行了测序。通过对其中一个cs1阳性杂交瘤细胞克隆(2b8d12)的测序结果,得到了抗体重链可变区vh、轻链可变区vl和单链可变结构域scfv的dna核酸序列。cs1可变结构域scfv为:vh-接头-vl。接头为:g4sx3。
[0048]
如以下所示,粗体字突出显示了重链可变区v
h
的核苷酸序列(seq id no:1);下划线突出显示v
l
的核苷酸序列(seq id no:2);中间(斜体)是编码3xg4s接头3x(ggggs)的核苷酸序列,序列号3(seq id no:3)。
[0049][0050]
以下为cs1 scfv蛋白序列:(seq id no:4)
[0051]
在蛋白序列中,粗体突出显示了v
h
的氨基酸序列(seq id no:5);下划线突出显示了v
l
的氨基酸序列(seq id no:6);中间(斜体)是3xg4s接头序列的氨基酸序列(seq id no:7)。
[0052]
实施例4:cs1-car序列
[0053]
cs1-car结构如图3所示,第二代car采用cd28共刺激结构域。慢病毒载体lenti cmv-mcs-ef1a-puro用于克隆所有scfv car序列。
[0054]
下面的核苷酸序列显示了本发明的cs1 scfv-cd8-tm28-cd28-cd3 zeta序列。该结构包括人cd8信号肽、cs1 scfv(v
h-接头3x(g4s)-v
l
)、cd8铰链区、cd28跨膜结构域、激活结构域、cd3zeta(图3)。
[0055]
cd8信号肽-cs1 scfv(v
h-接头-v
l)-cd8铰链区-cd28 tm-cd28-cd3-zeta:
[0056]
<cd8前导序列>
[0057]
atggccttaccagtgaccgccttgctcctgccgctggccttgctgctccacgccgccag gccggctagc
[0058]
<cs1 scfv>
[0059]
gaggtgaagctggtggagtctgggggagccttagtgaagcctggagggtccctgaaactcgcctgtgctgcctctggattcgctttcagcagctatgacatgtcttgggttcgccagactccggagaagaggctggagtgggtcgcaaccattagtagtggtggtaggaacacctactatccagacagtgtgaggggccgattcaccatctccagagacaatg
ccagaaacaccctgtatctgcaaatgagcagtctgaggtctgaggacacggccttgtattactgtgcaacaagaaatagtaactacgcctttgcttattggggccaagggactctggtcactgtctctgca
[0060]
ggtggcggtggttct ggtggcggtggttct ggtggcggtggttct
[0061]
gacatcaagatgacccagtctccatcttccatgtatgcatctctaggagagagagtcactatcacttgcaaggcaagtcaggacattaatatctatttaaactggttccagcagagaccagggaaatctcctaagaccctgatctatcgtgcaaacagattggttgacggggtcccagcaaggttcagtggcagtggatctgggcaagatttttctctcaccatcaccagcctggaatatgaagatatgggaatttattattgtctacagtttgatgagtttccgctcacgttcggtgctgggaccaagctggagctgaaacgg
[0062]
<xhoi限制性酶切点>
[0063]
ctcgag
[0064]
<cd8铰链区>
[0065]
aagcccaccacgacgccagcgccgcgaccaccaacaccggcgcccaccatcgcgtcgcagcccctgtccctgcgcccagaggcgagccggccagcggcggggggcgcagtgcacacgagggggctggacttcgccagtgataagccc
[0066]
<cd28跨膜结构域,激活结构域>
[0067]
ttttgggtgctggtggtggttggtggagtcctggcttgctatagcttgctagtaacagtggcctttattattttctgggtgaggagtaagaggagcaggctcctgcacagtgactacatgaacatgactccccgccgccccgggcccacccgcaagcattaccagccctatgccccaccacgcgacttcgcagcctatcgctcc
[0068]
<cd3zeta激活结构域>
[0069]
agagtgaagttcagcaggagcgcagacgcccccgcgtaccagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgcagagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgctaatag
[0070]
<ecori限制性酶切点>
[0071]
gaattc
[0072]
如下显示翻译后cs1-car蛋白质氨基酸序列。
[0073]
malpvtalllplalllhaarpasqvqlqesgagllkpsetlsltcavyggsfsgyywswirqppgkglewigeinhsgstnynpslksrvtisvdtsknqfslklssvtaadtavyycarghssgwyrryfdlwgrgtlvtvssggggsggggsggggseivltqspatlslspgeratlscrasqsvssylawyqqkpgqaprlliydasnratgiparfsgsgsgtdftltisslepedfavyycqqrsnwpptfgqgtkveiklekptttpaprpptpaptiasqplslrpeasrpaaggavhtrgldfasdkpfwvlvvvggvlacysllvtvafiifwvrskrsrllhsdymnmtprrpgptrkhyqpyapprdfaayrsrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkpqrrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr
[0074]
慢病毒载体是使用293细胞通过工业界常规标准技术制备的,具体方法如文献
(5)
描述。
[0075]
实施例5:从全血中分离外周血单核细胞
[0076]
从个人或混合供体(取决于所需的血液量)采集全血并置于10ml肝素真空采集器(becton dickinson)中。在50ml锥形离心管中,将约10ml抗凝血用无菌磷酸盐缓冲液(pbs)
混合至总体积为20ml(pbs,ph 7.4,不含ca
+2
/mg
+2
)。小心地获取在稀释血浆/ficoll界面上看到的含有外周血单个核细胞(pbmc)的细胞层,避免吸取到ficoll;用pbs洗涤两次,在室温下以200xg离心10min。用血细胞计数仪计数细胞。用含有5%ab血清和1.25μg/ml两性霉素b(gemini bioproducts,woodland,ca)、100u/ml青霉素和100μg/ml链霉素的car-t培养基(aim v-albumax(bsa)(life technologies))清洗pbmc,并用于实验或在-80℃下冷冻。
[0077]
实施例6:来源于pbmc的t细胞活性
[0078]
在不含人白细胞介素-2(huil-2)(invitrogen)的情况下,分离的细胞(用1xpbs(ph7.4),不含ca
2+
/mg
2+
)以5x105个细胞/ml浓度,用含有5%ab血清和1.25μg/ml两性霉素b(gemini bioproducts,woodland,ca)、100u/ml青霉素和100μg/ml链霉素的car-t培养基(aim v-albumax(bsa)(life technologies))清洗一次。在含有300u/ml huil2的car-t培养基中,将细胞重新悬浮至5x105个细胞/ml的最终浓度。在cd3-cd28磁珠与细胞比例为1:1下激活pbmc。
[0079]
实施例7:t细胞的转导和扩增
[0080]
激活pbmc后,将细胞在37℃、5%co2下培养24小时。向每孔1x106个细胞中添加5x106个慢病毒和2μl/ml transplus培养基(alstem,richmond,ca)(最终稀释度为1:500)。在重复添加病毒之前,将细胞培养24小时。然后继续在含300u/ml il-2的新鲜培养基中培养12-14天(总培养时间取决于所需的car-t细胞的最终数量)。每2-3天分析一次细胞浓度,并在这个时候加入培养基,将细胞悬浮液稀释至1x106个细胞/ml。
[0081]
实施例8:流式细胞仪检测car阳性细胞
[0082]
将细胞洗涤并悬浮在facs缓冲液(含0.1%叠氮化钠和0.4%bsa的磷酸盐缓冲液(pbs))中。细胞以1x106个/份等分。
[0083]
用正常山羊igg(life-technologies)在冰上封闭fc受体10min。
[0084]
用生物素标记的多克隆山羊抗小鼠f(ab)2抗体(life technologies)检测cs1-scfc生物素标记的正常多克隆山羊igg抗体(life-technologies;1:200稀释,反应体积为100μl)作为同型对照。细胞在4℃下孵育25分钟,用流式细胞仪缓冲液冲洗一次。
[0085]
将细胞悬浮在facs缓冲液中并用正常小鼠igg(invitrogen)封闭,每根试管中加入100μl 1:1000稀释的正常小鼠lgg。细胞在冰中孵育10分钟,用facs缓冲液洗涤并重新悬浮在100μl的facs缓冲液中。然后用藻红蛋白(pe)标记的链霉亲和素(bd pharmingen,san diego,ca)和别藻蓝蛋白(apc)标记的cd3(ebicience,san diego,ca)染色。分别向管2和管3中添加1.0μl pe和apc。
[0086]
实施例9:细胞毒性试验(实时细胞毒性试验)
[0087]
按照实验操作说明
(5)
的描述,使用acea仪器检测细胞毒性。
[0088]
实施例10:cs1-car-t细胞表达cs1 scfv
[0089]
将cs1 scfv序列与cd28共刺激结构域和cd3 zeta结构域一起插入到car内,随后将car慢病毒导入t细胞。cs1-car细胞在体外有效扩增(未显示)。用细胞内蛋白作为scfv的模拟对照,并且也作为细胞毒性和细胞因子检测的阴性对照。用小鼠fab抗体通过facs检测cs1-car+细胞(用小鼠fab抗体检测到63%的car+阳性细胞)(图6)。
[0090]
实施例11:cs1-car-t细胞杀死cho-cs1细胞
[0091]
将cs1-car-t细胞与cho-cs1稳定细胞系和cho细胞(cs1阴性)共孵育,用
empetance-xcelligence系统进行实时细胞毒性检测。与其他已知的cs1抗体-car-t细胞相比,本发明cs1-car-t细胞显示对cho-cs1细胞更强的杀伤效果(图8)。cs1-car-t细胞不会杀死cho(阴性对照细胞)(图8)。在图8中,上图为cho-cs1细胞组,下图为cho细胞组。
[0092]
实施例12:cs1-car-t细胞对cs1阳性多发性骨髓瘤细胞分泌高水平ifn-γ
[0093]
我们收集了cs1-car-t细胞与多发性骨髓瘤细胞共孵育的上清液,并按fisher试剂盒说明进行elisa检测。cs1-car-t经与cs1阳性癌细胞共孵育后分泌的ifn-γ水平显著高于模拟1、模拟2-car-t细胞(图9),其中采用不同的模拟car-t细胞作为阴性对照细胞。这些数据表明cs1-28-cd3 car-t细胞分泌ifn-γ具有抗多发性骨髓瘤特异性。cs1-car-t细胞与cho-cs1细胞共孵育后也检测到高水平的ifn-γ-,但是与cho细胞共孵育后没有检测到(图10)。这表明cs1-car-t细胞具有很高的特异性。
[0094]
实施例13:cs1-28-cd3-car-t细胞显著降低体内rpmi8226多发性骨髓瘤肿瘤的生长
[0095]
我们使用nsg小鼠并将rpmi8226荧光素酶阳性细胞静脉注射到nsg小鼠体内。第二天,我们在nsg小鼠中静脉注射cs1-car-t细胞。cs1-cd28-cd3细胞使生物发光信号显著降低(图11)。这表明cs1-28-cd3 car-t细胞显著降低rpmi8226多发性骨髓瘤肿瘤的生长(图11)。cs1-car-t细胞也延长了小鼠的存活时间。在图11中,小鼠经cs1-28-cd3 car-t细胞治疗后,信号减弱(上图)。向nsg小鼠注射rpmi8226细胞后,y轴上的总通量(光子/秒)减小(下图);x轴表示小鼠注射入rpmi8226细胞后的天数。
[0096]
参考文献:
[0097]
1.grupp,s.a.,kalos,m.,barrett,d.,aplenc,r.,porter,d.l.,rheingold,s.r.,teachey,d.t.,chew,a.,hauck,b.,wright,j.f.,等人(2013).chimeric antigen receptor-modified t cells for acute lymphoid leukemia.n engl j med 368,1509-1518.
[0098]
2.maus,m.v.,haas,a.r.,beatty,g.l.,albelda,s.m.,levine,b.l.,liu,x.,zhao,y.,kalos,m.,和june,c.h.(2013).t cells expressing chimeric antigen receptors can cause anaphylaxis in humans.cancer immunol res 1,26-31.
[0099]
3.maus,m.v.,grupp,s.a.,porter,d.l.,和june,c.h.(2014).antibody-modified t cells:cars take the front seat for hematologic malignancies.blood 123,2625-2635.
[0100]
4.boeye,a.(1986).clonal isolation of hybridomas by manual single-cell isolation.methods enzymol 121,332-340.
[0101]
5.berahovich r,zhou h,xu s,wei y,guan j,guan j,harto h,fu s,yang k,zhu s,li l,wu l,golubovskaya v.car-t cells based on novel bcma monoclonal antibody block multiple myeloma cell growth.cancers(basel),10(9),2018.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1