用于副流感病毒分型检测的引物探针组合物及实时荧光定量PCR试剂盒的制作方法
本发明属于生物医药
技术领域:
,具体涉及一种用于副流感病毒分型检测的引物探针组合物及实时荧光定量pcr试剂盒。
背景技术:
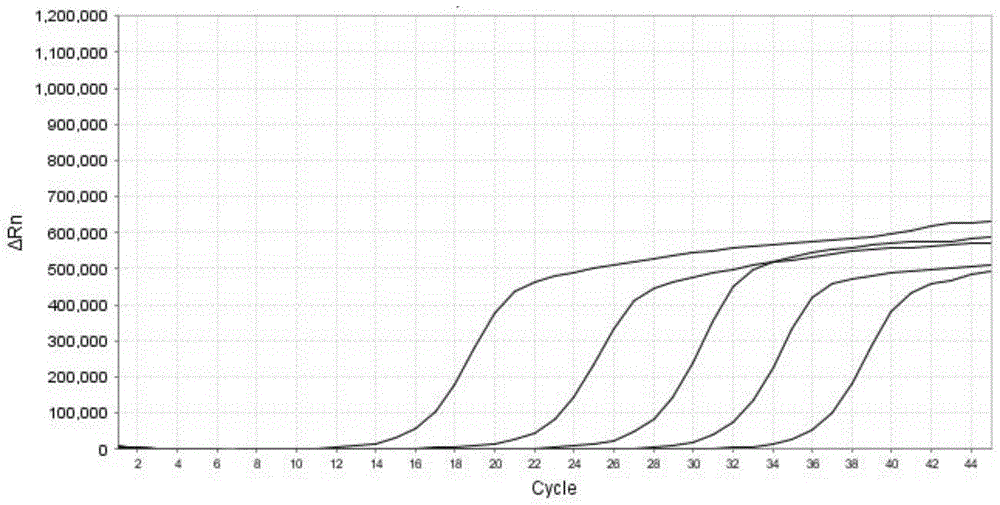
:副流感病毒是属于副黏病毒属的一类有包膜的单股负链rna病毒,是一种常见的呼吸道感染病原体,主要引起婴幼儿及儿童严重的下呼吸道感染疾病,目前缺乏有效的治疗药物和病毒疫苗。根据遗传性和抗原性,副流感病毒可以分为1型、2型、3型和4型,1-3型副流感病毒是较为常见的引起婴幼儿急性呼吸道感染的重要病原体,4型仅会引起症状较轻的婴幼儿呼吸道感染。副流感病毒所引起的感染症状和流感病毒较为相似,仅依靠临床症状及常规的检测方法进行病毒病原的确定并不可靠。因此早期快速对呼吸道病毒感染的病原进行诊断能够及时指导临床治疗,为合理选择抗病毒药物提供依据,避免药物滥用。为了解决上述问题,公开号为cn108676913a的中国发明专利申请公开了一种人副流感病毒核酸免提取基因分型检测试剂盒,该试剂盒分别针对副流感病毒1型、2型、3型和4型设计引物和探针,直接对咽拭子样本和血清样本进行多重实时荧光定量pcr扩增,最终实现对副流感病毒的分型检测。众所周知,对病毒进行分型检测的难度主要集中于特异性引物的设计,由于是需要在亚型的层级对副流感病毒1-4型进行区分,因此对引物的自身型保守性和对其他型别的特异性存在非常高的要求。若引物或探针设计不当,就会出现假阳性和假阴性的检测结果。上述检测试剂盒则存在以下不足:(1)引物特异性较差,可能引起较为严重的漏检现象或脱靶效应,导致出现假阴性或假阳性结果;(2)各副流感病毒血清型的特异性引物的tm值存在较大差异,使得检测结果的准确性偏低;(3)引物在对各副流感病毒进行分型检测时的灵敏度较差。技术实现要素:本申请的发明目的是提供一种用于副流感病毒分型检测的引物探针组合物及实时荧光定量pcr试剂盒,该引物探针组合物能够对副流感病毒1型、2型、3型和4型中的至少两种进行快速的分型检测,各引物和探针对目标血清型的目标基因特异性强,且检测灵敏度高。为实现上述发明目的,本申请的技术方案如下:一种用于副流感病毒分型检测的引物探针组合物,用于检测副流感病毒1型、2型、3型和4型中的至少两种,其中,①用于检测副流感病毒1型的引物和探针包括:具有如seqno.1所示核苷酸序列的正向引物、具有如seqidno.2所示核苷酸序列的反向引物以及具有如seqidno.3所示核苷酸序列的探针;②用于检测副流感病毒2型的引物和探针包括:具有如seqno.4所示核苷酸序列的正向引物、具有如seqidno.5所示核苷酸序列的反向引物以及具有如seqidno.6所示核苷酸序列的探针;③用于检测副流感病毒3型的引物和探针包括:具有如seqno.7所示核苷酸序列的正向引物、具有如seqidno.8所示核苷酸序列的反向引物以及具有如seqidno.9所示核苷酸序列的探针;④用于检测副流感病毒4型的引物和探针包括:具有如seqno10所示核苷酸序列的正向引物、具有如seqidno.11所示核苷酸序列的反向引物以及具有如seqidno.12所示核苷酸序列的探针。本发明的引物探针组合物中,四组引物和探针均具有优异的特异性,能够特异性地对相应的副流感病毒血清型进行分型检测,其中,第①组引物和探针能够特异扩增副流感病毒1型hn基因,第②组引物和探针能够特异性扩增副流感病毒2型l基因,第③组引物和探针能够特异性扩增副流感病毒3型l基因,第④组引物和探针能够特异性扩增副流感病毒4型f基因,不同组的引物和探针不相干扰,对副流感病毒四种血清型的分型效果优异。本发明的四组引物间的tm值差异小(在±2°范围内),当将四组引物和探针同时使用时,在相同的pcr温度条件下,各组引物与模板的结合能力较为一致,不仅方便pcr反应体系的调整和优化,而且能够确保各组引物的检测结果均具有较高的准确性。本发明的四组引物和探针对各自对应的毒流感病毒血清型的检测灵敏度高,经检测,第①组引物和探针对副流感病毒1型hn基因的最低检出限为5.7×101copies/μl;第②组引物和探针对副流感病毒2型l基因的最低检出限为7.2×101copies/μl;第③组引物和探针对副流感病毒3型l基因的最低检出限为9.6×101copies/μl;第④组引物和探针对副流感病毒4型f基因的最低检出限为4.8×101copies/μl。本发明中,上述seqidno.1-12所示的核苷酸序列可以是相应引物和探针的完整序列,也可以是相应引物和探针的完整序列中的部分片段,本领域技术人员可以在本发明公开的seqidno.1-12所示的核苷酸序列的5’端或3’端增加一个或多个碱基来获得不同的引物和探针,这些引物和探针都在本发明的保护范围之内。作为优选,上述的用于副流感病毒分型检测的引物探针组合物用于检测副流感病毒1型、2型、3型和4型,其中,①用于检测副流感病毒1型的引物和探针为:正向引物:5’-ctaattgtaaaacctgatatgacttccc-3’;反向引物:5’-caattggtgatgcaatatatgcgt-3’;探针:5’-荧光报告基团-tctgcacatccttgagtgattaagtttgatga-荧光淬灭基团-3’;②用于检测副流感病毒2型的引物和探针为:正向引物:5’-acacgtttaattaattcagatttagctac-3’;反向引物:5’-ctagggcacttcccgca-3’;探针:5’-荧光报告基团-ttgccagagaagaatccaatcttgctga-荧光淬灭基团-3’;③用于检测副流感病毒3型的引物和探针为:正向引物:5’-tgtaattgtgctattttacctttaacga-3’;反向引物:5’-aaaaacttaggagcaaagcgtg-3’;探针:5’-荧光报告基团-acacagtgccattgttagattcagt-荧光淬灭基团-3’;④用于检测副流感病毒4型的引物和探针为:正向引物:5’-ccagaartccawaaatagtacttttcga-3’;反向引物:5’-tcrgtygataaatcaagaggagtca-3’;探针:5’-荧光报告基团-aagtagttwtagaatctactcargtyagatctt-荧光淬灭基团-3’;用于检测四种副流感病毒的各探针中含有的荧光报告基团各不相同。作为优选,在上述的用于副流感病毒分型检测的引物探针组合物中,用于检测四种副流感病毒的各探针中含有的荧光报告基团分别选自fam、cy5、rox或vic,用于检测四种副流感病毒的各探针中含有的荧光淬灭基团选自bhq-1或bhq-2。以第①、②、③和④组所含探针中的荧光报告基团依次为fam、cy5、rox和vic为例,在经多重rt-qpcr后,若fam通道ct值<38,且扩增曲线呈典型s型,其余荧光信号通道ct值≥38或显示为undetermined/noct,则被测样本为副流感病毒1型感染;若cy5通道ct值<38,且扩增曲线呈典型s型,其余荧光信号通道ct值≥38或显示为undetermined/noct,则被测样本为副流感病毒2型感染;若rox通道ct值<38,且扩增曲线呈典型s型,其余荧光信号通道ct值≥38或显示为undetermined/noct,则被测样本为副流感病毒3型感染;若vic通道ct值<38,且扩增曲线呈典型s型,其余荧光信号通道ct值≥38或显示为undetermined/noct,则被测样本为副流感病毒4型感染。本发明还公开了一种用于副流感病毒分型检测的实时荧光定量pcr试剂盒,该试剂盒中即含有上述的用于副流感病毒分型检测的引物探针组合物。作为优选,在上述的用于副流感病毒分型检测的实时荧光定量pcr试剂盒中,用于检测各副流感病毒血清型的正向引物、反向引物和探针的用量比均为2:2:1;用于检测不同副流感病毒血清型的引物探针组合物的用量均相同。引物和探针比例合适会使得试剂盒具有良好的检测灵敏度,本发明中,各引物和探针的比例均为2:1,在该比例下本底最小荧光强度最大。同时四组引物和探针的用量均相同,表明四组引物和探针的扩增效率相近,不同组别的引物和探针之间互相干扰少,试剂盒性能稳定。上述的用于副流感病毒分型检测的实时荧光定量pcr试剂盒还含有实时荧光定量pcr反应所需的dntps、dutp、mg2+和缓冲液;上述的用于副流感病毒分型检测的实时荧光定量pcr试剂盒还含有rt-qpcr酶系,该rt-qpcr酶系包括ung酶、逆转录酶和热启动dna聚合酶。本发明中,dutp和ung酶组成了pcr反应体系中的防污染体系,该dutp-ung酶防污染体系能够有效避免气溶胶污染影响pcr结果,从根本上避免假阳性结果的出现。上述的用于副流感病毒分型检测的实时荧光定量pcr试剂盒还含有阳性对照,所述的阳性对照为具有副流感病毒1型hn基因、副流感病毒2型l基因、副流感病毒3型l基因、副流感病毒4型f基因的重组假病毒。与现有技术相比,本发明的有益效果体现在:(1)本发明中,四组引物和探针均具有优异的特异性,能够特异性地对相应的副流感病毒血清型进行分型检测,其中,第①组引物和探针能够特异扩增副流感病毒1型hn基因,第②组引物和探针能够特异性扩增副流感病毒2型l基因,第③组引物和探针能够特异性扩增副流感病毒3型l基因,第④组引物和探针能够特异性扩增副流感病毒4型f基因,不同组的引物和探针不相干扰,对副流感病毒四种血清型的分型效果优异。(2)本发明的四组引物间的tm值差异小(在±2°范围内),当将四组引物和探针同时使用时,在相同的pcr温度条件下,各组引物与模板的结合能力较为一致,不仅方便pcr反应体系的调整和优化,而且能够确保各组引物的检测结果均具有较高的准确性。(3)本发明的四组引物和探针对各自对应的毒流感病毒血清型的检测灵敏度高,经检测,第①组引物和探针对副流感病毒1型hn基因的最低检出限为5.7×101copies/μl;第②组引物和探针对副流感病毒2型l基因的最低检出限为7.2×101copies/μl;第③组引物和探针对副流感病毒3型l基因的最低检出限为9.6×101copies/μl;第④组引物和探针对副流感病毒4型f基因的最低检出限为4.8×101copies/μl。(3)本发明的实时荧光定量pcr试剂盒对副流感病毒进行分型检测周期短、灵敏度高、分型效果好,并且采用了dutp-ung酶防污染体系,该dutp-ung酶防污染体系能够有效避免气溶胶污染影响pcr结果,从根本上避免假阳性结果的出现。附图说明图1为本发明用于副流感病毒分型检测的引物探针组合物对副流感病毒1型的检测灵敏度测试结果;其中,cycle表示循环数,δrn表示荧光强度;下同;图2为本发明用于副流感病毒分型检测的引物探针组合物对副流感病毒2型的检测灵敏度测试结果;图3为本发明用于副流感病毒分型检测的引物探针组合物对副流感病毒3型的检测灵敏度测试结果;图4为本发明用于副流感病毒分型检测的引物探针组合物对副流感病毒4型的检测灵敏度测试结果。具体实施方式下面结合附图和具体实施方式对本发明的技术方案做进一步详细说明。实施例1分别针对副流感病毒1型hn基因、副流感病毒2型l基因、副流感病毒3型l基因和副流感病毒4型f基因设计特异性引物和探针,并委托生工生物工程(上海)股份有限公司合成;获得的四组引物和探针的核苷酸序列信息见表1。表1引物和探针组合物序列信息其中,副流感病毒1型hn基因扩增产物长度为90bp,副流感病毒2型l基因扩增产物长度为137bp,副流感病毒3型l基因扩增产物长度为128bp,副流感病毒4型f基因扩增产物长度为90bp。采用表1所示的引物探针组合物制备用于副流感病毒分型检测的多重rt-qpcr试剂盒,该试剂盒中包含有rt-qpcr反应液、引物探针组合物、rt-qpcr酶系、阳性对照以及阴性对照,其中,引物探针组合物的组成如表2所示,rt-qpcr反应液的试剂组成如表3所示,rt-qpcr酶系的组成如表4所示;阳性对照为含有副流感病毒1型hn基因、副流感病毒2型l基因、副流感病毒3型l基因、副流感病毒4型f基因的重组假病毒;阴性对照为rnase-freeh2o。表3引物探针组合物的组成(50人份)表2rt-qpcr反应液的试剂组成(50人份)表4rt-qpcr酶系组成(50人份)采用已通过高通量测序验证后确诊的副流感病毒阳性样本s1-s6(其中,s1样本为副流感病毒1型阳性患者,s2为副流感病毒2型阳性患者,s3为副流感病毒3型阳性患者,s4为副流感病毒4a型阳性患者,s5为副流感病毒4b型阳性患者)和阴性样本s6对上述多重rt-qpcr试剂盒对副流感病毒的分型检测效果进行验证,验证方法为:(1)核酸提取:在全自动核酸提取仪上,使用核酸提取试剂同时对样本s1~s6进行核酸自动提取,将完成提取的核酸样本置于-20℃保存备用;(2)多重rt-qpcr:先根据表5配制rt-qpcr反应体系,再根据表6所示的反应程序进行多重rt-qpcr,获得荧光扩增曲线;表5rt-qpcr反应体系rt-qpcr反应体系加样量(μl)rt-qpcr反应液10引物/探针组合物4rt-qpcr酶液1待测样本/阴阳性对照5总体积20表6多重rt-qpcr反应程序(3)病毒分型:根据以下判断标准对样本中所含副流感病毒的血清型进行判断,判断结果见表7。判断标准为:若fam通道ct值<38,且扩增曲线呈典型s型,其余荧光信号通道ct值≥38或显示为undetermined/noct,则被测样本为副流感病毒1型感染;若cy5通道ct值<38,且扩增曲线呈典型s型,其余荧光信号通道ct值≥38或显示为undetermined/noct,则被测样本为副流感病毒2型感染;若rox通道ct值<38,且扩增曲线呈典型s型,其余荧光信号通道ct值≥38或显示为undetermined/noct,则被测样本为副流感病毒3型感染;若vic通道ct值<38,且扩增曲线呈典型s型,其余荧光信号通道ct值≥38或显示为undetermined/noct,则被测样本为副流感病毒4型感染。表7s1-s6样本在各个荧光通道中的ct值样本编号famroxcy5vics125.94noctnoctnocts2noctnoct30.47nocts3noct28.24noctnocts4noctnoctnoct28.67s5noctnoctnoct30.93s6noctnoctnoctnoct由表7的ct值检测结果可以判断为:s1样本感染了副流感病毒1型,s2样本感染了副流感病毒2型,s3样本感染了副流感病毒3型,s4和s5样本感染了副流感病毒4型,而s6样本未感染副流感病毒;该判断结果与实际情况相符,表明本发明的试剂盒能够准确的判定副流感病毒阳性患者所感染副流感病毒的具体血清型。实施例2将测定浓度和纯度后的包含副流感病毒1型hn基因、副流感病毒2型l基因、副流感病毒3型l基因、副流感病毒4型f基因的各阳性质粒分别做10倍梯度稀释,得到从2.4×101~2.4×106copies/μl共6个稀释度的阳性质粒作为标准模版。根据实施例1中表5所示配制pcr反应体系,根据表6所示反应程序进行多重rt-qpcr反应,获得荧光扩增曲线(如图1、图2、图3和图4所示),绘制标准曲线并确定最低检出限。由图1、图2、图3和图4所示,在浓度2.4×102~2.4×106copies/μl范围内,本发明的试剂盒对副流感病毒1型hn基因、副流感病毒2型l基因、副流感病毒3型l基因、副流感病毒4型f基因进行扩增获得的荧光扩增曲线均呈典型的s型曲线,且在不同浓度下获得的各荧光扩增曲线间距均匀,具有良好的相关性,其线性方程可以解析为:副流感病毒1型hn基因:y=-5.061logx+46.234(r2=0.992);副流感病毒2型l基因:y=-5.041logx+48.157(r2=0.999);副流感病毒3型l基因:y=-5.304logx+46.570(r2=0.997);副流感病毒4型f基因:y=-3.51logx+40.446(r2=0.988)。从上述线性方程中,可以得出本发明的试剂盒对各副流感病毒血清型的最低检出限分别为:流感病毒1型hn基因:5.7×101copies/μl;副流感病毒2型l基因:7.2×101copies/μl;副流感病毒3型l基因:9.6×101copies/μl;副流感病毒4型f基因:4.8×101copies/μl。同时,通过对四个荧光通道的灵敏度比较来看,四个荧光通道的扩增效率相近,引物间相互干扰少,试剂盒性能稳定。序列表<110>宁波海尔施基因科技有限公司首都儿科研究所<120>用于副流感病毒分型检测的引物探针组合物及实时荧光定量pcr试剂盒<160>12<170>siposequencelisting1.0<210>1<211>28<212>dna<213>人工合成序列(unknown)<400>1ctaattgtaaaacctgatatgacttccc28<210>2<211>24<212>dna<213>人工合成序列(unknown)<400>2caattggtgatgcaatatatgcgt24<210>3<211>32<212>dna<213>人工合成序列(unknown)<400>3tctgcacatccttgagtgattaagtttgatga32<210>4<211>29<212>dna<213>人工合成序列(unknown)<400>4acacgtttaattaattcagatttagctac29<210>5<211>17<212>dna<213>人工合成序列(unknown)<400>5ctagggcacttcccgca17<210>6<211>28<212>dna<213>人工合成序列(unknown)<400>6ttgccagagaagaatccaatcttgctga28<210>7<211>28<212>dna<213>人工合成序列(unknown)<400>7tgtaattgtgctattttacctttaacga28<210>8<211>22<212>dna<213>人工合成序列(unknown)<400>8aaaaacttaggagcaaagcgtg22<210>9<211>25<212>dna<213>人工合成序列(unknown)<400>9acacagtgccattgttagattcagt25<210>10<211>28<212>dna<213>人工合成序列(unknown)<400>10ccagaartccawaaatagtacttttcga28<210>11<211>25<212>dna<213>人工合成序列(unknown)<400>11tcrgtygataaatcaagaggagtca25<210>12<211>33<212>dna<213>人工合成序列(unknown)<400>12aagtagttwtagaatctactcargtyagatctt33当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1