一种瑞德西韦中间体化合物的制备方法与流程
1.本发明涉及医药中间体领域,主要涉及一种瑞德西韦中间体化合物的制备方法。
背景技术:
2.瑞德西韦是一种腺苷类似物的单磷酸酰胺酸前药,通过阻断病毒rna的复制,来展现抗病毒活性。研究发现,瑞德西韦对于埃博拉病毒、章德拉病毒、冠状病毒、呼吸道合胞病毒等都有抑制效果。但是,核苷类似物的前药在实际合成过程中面临着诸多复杂问题,其工艺路线复杂,产率不高,关键中间体的纯化需要经历柱色谱和柱层析分离过程,这些问题很大程度上限制了其大规模制备和应用。
3.三嗪胺衍生物7-碘吡咯并[2,1-f][1,2,4]三嗪-4-胺是合成瑞德西韦的关键中间体,目前主要由以下路线合成:
[0004][0005]
该工艺路线需要使用制备色谱进行纯化,且使用了大量的混合溶剂,增加了反应过程的复杂性,且第一步合成工艺中还用到了三氯化磷这个剧毒危险品,安全风险较大,容易对环境造成污染,同时该路线总体收率较低,不适合工业化生产。
[0006]
故提供一种不需柱层析纯化,操作简便,能降低能耗、成本和环境污染,且提高纯度和收率的7-碘吡咯并[2,1-f][1,2,4]三嗪-4-胺的合成方法。
技术实现要素:
[0007]
本发明的目的在于提供一种不需柱层析纯化,操作简便,能降低能耗、成本和环境污染,且提高纯度和收率的7-碘吡咯并[2,1-f][1,2,4]三嗪-4-胺的合成方法。
[0008]
本发明提供一种7-碘吡咯并[2,1-f][1,2,4]三嗪-4-胺的合成方法,其结构式如下,简称化合物vi:
[0009]
[0010]
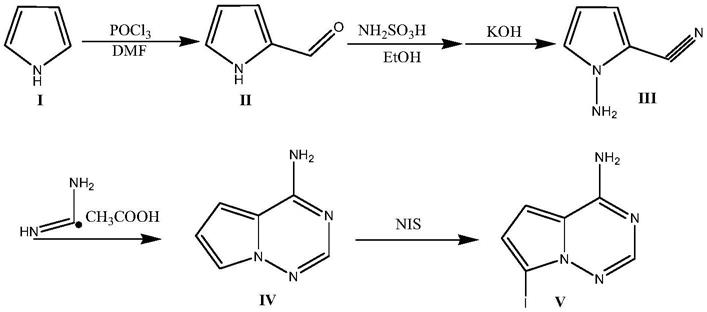
本发明提供的制备方法,其可以以化合物i为起始物料,经环胺化反应得到化合物ii,化合物ii经氰化反应得到化合物iii,化合物iii经水解反应得到化合物iv,化合物iv经环化反应得到化合物v,化合物v经碘加成反应得到化合物vi,其反应路线如下所示:
[0011][0012]
本发明一方面提供了一种化合物vi的制备方法,包括:在一定的反应温度下,在反应溶剂中,化合物v与n-碘代丁二酰亚胺反应得到化合物vi。
[0013][0014]
所述反应溶剂选自四氢呋喃和乙腈中的至少一种。在一些实施方式中,所述溶剂为四氢呋喃,有利于反应的进行和处理。
[0015]
所述化合物vi的制备方法,反应完全后,任选进行后处理。在一些实施方式中,所述化合物vi的制备方法,后处理包括:反应完毕后,将反应液进行抽滤、水洗和干燥获得高纯度的n-(s)-(7-碘吡咯并[2,1-f][1,2,4]三嗪-4-胺。
[0016]
在一些实施方式中,一种前述化合物v的制备方法,包括:在一定温度下,在反应溶剂中,化合物iv与乙酸甲脒在缚酸剂存在的条件下发生环合反应得到化合物v。
[0017][0018]
所述缚酸剂为碳酸铯、磷酸氢二钾、三乙胺和吡啶中的至少一种,在一些实施方式中,所述缚酸剂为碳酸铯,有利于反应的进行和处理。
[0019]
所述缚酸剂与化合物iv的摩尔比可为1:1-3:1。在一些实施方式中,所述缚酸剂与化合物iv的摩尔比为1.5:1,有利于产物的生成和获得。
[0020]
所述化合物v的制备方法,反应完全后,任选进行后处理。在一些实施方式中,所述化合物v的制备方法,后处理包括:反应完毕后,浓缩反应体系除去溶剂,然后加入水搅拌以溶解大部分盐,将混合物抽滤,所得滤饼浓缩除去残留溶剂即得化合物v。
[0021]
发明人发现化合物iv与乙酸甲脒发生反应环合生成三嗪环的过程中需要碱中和游离的酸,同时,从化合物iv制备化合物v也是需要通过碱催化加速反应进程。发明人还发
现,缚酸剂最优的选择是无机碱,选择无机碱优势在于其易溶于水,而化合物v不溶于水,后处理过程中无机碱很容易通过抽滤和水洗涤从产品中分离除去,而有机碱通过非柱层析纯化的方法比较难除干净,需要多次纯化,势必会影响化合物v的收率和纯度,并且无机碱中选用碳酸铯作为缚酸剂参加环合反应能获得更高纯度和收率的化合物v。
[0022]
在一些实施方式中,一种前述化合物iv的制备方法,包括,化合物iii经盐酸水解得到化合物iv。
[0023][0024]
所述化合物iv的制备方法,反应完全后,任选进行后处理。在一些实施方式中,所述化合物iv的制备方法,后处理包括:反应完毕后,将反应体系抽滤,滤饼用二氯甲烷洗涤,滤饼旋蒸除去溶剂即得化合物iv。
[0025]
在一些实施方式中,一种前述化合物iii的制备方法,包括,在一定温度下,合适的溶剂中,在缚酸剂存在的条件下,化合物ii与氯磺酰异氰酸酯发生氰化反应生成化合物iii。
[0026][0027]
所述氯磺酰异氰酸酯与化合物ii的摩尔比为1:1-3:1,在一些实施方式中,所述氯磺酰异氰酸酯与化合物ii的摩尔比为2:1,有利于产物的生成和获得。
[0028]
所述化合物iii的制备方法,反应完全后,任选进行后处理。在一些实施方式中,所述化合物iii的制备方法,后处理包括:反应完毕后,将反应液倒入冷的na2co3溶液中,混合物充分搅拌后进行分液,上层为棕色液体,水相用二氯甲烷萃取,tlc确认萃取完全,有机相合并后水洗,分离出二氯甲烷相,往二氯甲烷中加入硅胶,同时加入硫酸钠干燥,体系过滤,滤饼用二氯甲烷洗,合并滤液后将滤液减压蒸除溶剂即得粗品。
[0029]
发明人发现,降低氯磺酰异氰酸酯用量至1.0eq时,有少量起始原料化合物ii未反应完全,增加氯磺酰异氰酸酯用量至3.0eq时,收率明显降低。而1.5eq和2.0eq不管是纯度还是收率都比较相近。综合对比发现,当选择2当量的氯磺酰异氰酸酯参与反应时,获得的化合物iii粗品纯度和收率最高。
[0030]
在一些实施方式中,一种前述化合物ii的制备方法,包括,在一定温度下,合适的溶剂中,催化剂条件下,化合物i与2,5-二甲氧基四氢呋喃发生环胺化反应得到化合物ii。
[0031][0032]
所述催化剂选自五水硝酸铋、方酸、七水合氯化铁和三氟甲磺酸钪中的至少一种,在一些实施方式中,催化剂为五水硝酸铋,更利于产物的生成和获得。
[0033]
所述催化剂与化合物i的摩尔比可为0.2:1-2:1,在一些实施方式中,所述催化剂与化合物i的摩尔比为0.25:1,有利于产物的生成和获得。
[0034]
所述反应温度为50-100℃,在一些实施方式中,所述反应温度为50-60℃,有利于反应的进行和处理。
[0035]
所述反应时间为3-13h,在一些实施方式中,所述反应时间为3-4h,有利于反应的进行和处理。
[0036]
所述化合物ii的制备方法,反应完全后,任选进行后处理。在一些实施方式中,所述化合物ii的制备方法,后处理包括:反应完毕后,将反应体系冷却至室温,加入饱和na2co3溶液,充分搅拌,将反应混合物抽滤,滤饼用少量二氯甲烷洗涤,合并滤液并浓缩至干,将剩余物料冷却至0℃左右,加入乙酸乙酯/石油醚=3:1混合溶液打浆,将固体过滤,滤饼滤干,用适量乙酸乙酯/石油醚洗,滤饼收集并减压蒸除溶剂即得纯品,合并的滤液浓缩至干,再用乙酸乙酯/石油醚打浆,将固体抽滤并浓缩蒸除溶剂得到纯品。
[0037]
发明人发现,现有技术中生成化合物ii的反应大多采用盐酸为催化剂,但是采用盐酸作为催化剂反应时间较长,收率也较低,发明人还发现五水硝酸铋、方酸、七水合氯化铁和三氟甲磺酸钪都可以作为合成化合物ii的催化剂,都能达到较高的收率,其中五水硝酸铋催化反应温度低、时间短,能耗相对少。
[0038]
综上所述,本发明包括以下有益的技术效果:
[0039]
1、本发明提供的7-碘吡咯并[2,1-f][1,2,4]三嗪-4-胺的合成方法不需采用柱层析纯化方法,简化了反应操作;
[0040]
2、本发明提供的7-碘吡咯并[2,1-f][1,2,4]三嗪-4-胺的合成方法,缩短了反应周期,反应条件温和,收率和纯度得到了提高;
[0041]
3、本发明提供的7-碘吡咯并[2,1-f][1,2,4]三嗪-4-胺的合成方法,没有使用混合溶剂,没有使用危险品,更加环保,更适合工业化生产。
具体实施方式
[0042]
为了便于理解,下面将对本技术进行更全面的描述,并给出了本技术的较佳实施例。但是,本技术可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
[0043]
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
[0044]
实施例1化合物ii的制备方法
[0045]
于20l三口瓶内,依次加入二氧六环(6.2kg),肼基甲酸叔丁酯(1000g),2,5-二甲氧基四氢呋喃(1200g),搅拌均匀后缓慢加入五水硝酸铋(1000g),加完后保持反应体系的ph=6.0。升温至反应釜内温50℃并搅3小时后,再将体系升温至58℃继续反应。反应4小时后体系逐渐由淡黄色变深橘黄色至黑色。此时保持反应体系回流。通过分水器分出甲醇,通过tlc确认(pe:ea=5:1,茚三酮显色确认肼基甲酸叔丁酯基本反应完全)。后处理:反应体系冷却至室温,加入375ml饱和na2co3溶液,充分搅拌10min。将反应混合物抽滤。滤饼用少
量二氯甲烷洗涤。合并滤液并浓缩至干。将剩余物料冷却至0℃左右,加入乙酸乙酯/石油醚=3:1混合溶液打浆(1.2l)2小时。将固体过滤,滤饼滤干,用适量乙酸乙酯/石油醚(3:1)洗,滤饼收集并减压蒸除溶剂即得纯品915g。合并的滤液浓缩至干,再用乙酸乙酯/石油醚(3:1)打浆(400ml)。将固体抽滤并浓缩蒸除溶剂得到纯品326g。共得1241g纯品收率90%。
[0046]
1h nmr(400mhz,cdcl3)δ:7.17(s,br,1h),6.66(m,2h),6.11(m,2h),1.49(s,9h).13cnmr(100mhz,cdcl3)δ154.0,117.7,108.5,79.2,28.6.
[0047]
实施例2化合物ii的制备方法
[0048]
于20l三口瓶内,依次加入二氧六环(6.2kg),肼基甲酸叔丁酯(1000g),2,5-二甲氧基四氢呋喃(1200g),搅拌均匀后缓慢加入方酸(863g),加完后保持反应体系的ph=6.0。升温至反应釜内温90℃并搅3小时后,再将体系升温至98℃继续反应。反应4小时后体系逐渐由淡黄色变深橘黄色至黑色。此时保持反应体系回流。通过分水器分出甲醇,通过tlc确认(pe:ea=5:1,茚三酮显色确认肼基甲酸叔丁酯基本反应完全)。后处理:反应体系冷却至室温,加入375ml饱和na2co3溶液,充分搅拌10min。将反应混合物抽滤。滤饼用少量二氯甲烷洗涤。合并滤液并浓缩至干。将剩余物料冷却至0℃左右,加入乙酸乙酯/石油醚=3:1混合溶液打浆(1.2l)2小时。将固体过滤,滤饼滤干,用适量乙酸乙酯/石油醚(3:1)洗,滤饼收集并减压蒸除溶剂即得纯品941g。合并的滤液浓缩至干,再用乙酸乙酯/石油醚(3:1)打浆(400ml)。将固体抽滤并浓缩蒸除溶剂得到纯品355g。共得1296g纯品收率94%。
[0049]
1h nmr(400mhz,cdcl3)δ:7.17(s,br,1h),6.66(m,2h),6.11(m,2h),1.49(s,9h).13cnmr(100mhz,cdcl3)δ154.0,117.7,108.5,79.2,28.6.
[0050]
实施例3化合物iv的制备方法
[0051]
于10l三口瓶内先加入乙腈7l,再加入化合物ii(753.9g),搅拌使其尽量溶解(未溶清),降温至-5℃。逐滴滴加磺酰氯异氰酸酯(614g)并控至温度保持反应体系不超过5℃。滴加过程,反应液变澄清,然后会生成大量的固体。滴完后搅拌45min。再往反应体系中滴加dmf(725.78g),同时保持温度小于5℃。滴加完毕后保持反应体系继续搅拌30min。tlc检测(小样加冰水淬灭,乙酸乙酯萃取点板,pe:ea=5:1)反应终点。反应完成后,将反应液倒入冷的na2co3(506.5g)溶液(7.5l)中。混合物充分搅拌后进行分液,上层为棕色液体,水相用二氯甲烷萃取(3l*2)。tlc确认萃取完全。有机相合并后水洗(2l*3),分离出二氯甲烷相,往二氯甲烷中加入硅胶753g,同时加入硫酸钠干燥。体系过滤,滤饼用二氯甲烷洗。合并滤液后将滤液减压蒸除溶剂即得粗品。将该粗品溶于2.25l二氯甲烷,通入盐酸气并tlc跟踪直至反应完全。后处理:将反应体系抽滤,滤饼用二氯甲烷洗涤,滤饼旋蒸除去溶剂即得产品375g,收率84.61%,纯度98.05。
[0052]
1h nmr(400mhz,cdcl3)δ6.92(s,1h),6.71(d,j=4.2hz,1h),6.08(d,j=3.62hz,1h),4.42(br s,2h).13cnmr(100mhz,cdcl3)δ128.0,117.4,113.5,107.2,105.2.
[0053]
实施例4化合物v的制备方法
[0054]
于5l三口瓶内依次加入乙醇(2320ml),化合物iv(145g),醋酸甲脒(525.73g),碳酸铯(821.88g),充分混合后升温至回流(75-78℃)条件下反应17-20h,通过tlc监控反应进程(小样加冰水淬灭,ea萃取点板,pe:ea=5:1,产品点rf=0.1-0.15)。反应结束后,浓缩反应体系除去绝大部分乙醇,然后加入3l水搅拌以溶解大部分盐(30min)。将混合物抽滤,所得滤饼浓缩除去残留溶剂即得产品124.51g,收率92%,纯度96.8%。
[0055]1h nmr(400mhz,meod)δ7.78(s,1h),7.57(s,1h),6.90(s,1h),6.68(s,1h).
13
c nmr(100mhz,dmso-d6)δ155.7,148.1,118.2,114.2,110.2,101.5.lc-ms:calculated mw=134.64g/mol,found m/z[m+1]
+
=135.85。
[0056]
实施例5化合物v的制备方法
[0057]
于5l三口瓶内依次加入乙醇(2320ml),化合物iv(145g),醋酸甲脒(525.73g),磷酸氢二钾(351.49g),充分混合后升温至回流(75-78℃)条件下反应17-20h,通过tlc监控反应进程(小样加冰水淬灭,ea萃取点板,pe:ea=5:1,产品点rf=0.1-0.15)。反应结束后,浓缩反应体系除去绝大部分乙醇,然后加入3l水搅拌以溶解大部分盐(30min)。将混合物抽滤,所得滤饼浓缩除去残留溶剂即得产品129.66g,收率95.8%,纯度90.05%。
[0058]1h nmr(400mhz,meod)δ7.78(s,1h),7.57(s,1h),6.90(s,1h),6.68(s,1h).
13
c nmr(100mhz,dmso-d6)δ155.7,148.1,118.2,114.2,110.2,101.5.lc-ms:calculated mw=134.64g/mol,found m/z[m+1]
+
=135.85。
[0059]
实施例6化合物vi的制备方法
[0060]
于2l三口瓶内,依次加入四氢呋喃(826ml),加入化合物v(118.1g,0.88mol),搅拌至充分溶解。将反应体系升温至30℃,少量多次分批加入nis(196.23g,0.9mol)。加料过程中会有一个体系内部放热升温过程,控制反应温度不超过30℃。待nis全部加完后,搅拌持续12小时。tlc检测若未反应完全需要升温至45℃直至反应完全为止。后处理:首先配制0.5m/l的氢氧化钠溶液,将反应液一边搅拌一边缓慢加入到配制好的0.5m/l的氢氧化钠溶液中,温度体系控制在20-30℃。混合完毕后,继续搅拌1h。有大量固体产生。将固体抽滤,滤饼用水洗多次以除去残留四氢呋喃。将滤饼用乙醇打浆(2l),抽滤,滤饼旋蒸除去溶剂得产品190.62g,收率83.3%,纯度88.6%。
[0061]1h nmr(400mhz,dmso)δ7.95(s,1h),7.8(s,1h),7.03(d,j=4.3hz,1h),6.86(d,j=4.3hz,1h).
13
c nmr(100mhz,dmso-d6)δ155.7,149.1,118.8,118.1,104.4,71.9。lc-ms:calculated mw=260.04g/mol,found m/z[m+na
+
]=283.25。
[0062]
以上所述实施例仅表达了本技术的实施方式,其描述较为具体和详细,但并不能因此而理解为对本技术专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本技术构思的前提下,还可以做出若干变形和改进,这些都属于本技术的保护范围。因此,本技术专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1