核酸斑点杂交法检测PSTVd的探针及其制备方法、试剂盒与检测方法
核酸斑点杂交法检测pstvd的探针及其制备方法、试剂盒与检测方法
技术领域
1.本发明属于马铃薯病毒检测技术领域,尤其涉及核酸斑点杂交法检测pstvd的探针及其制备方法、试剂盒与检测方法。
背景技术:
2.马铃薯纺锤块茎类病毒(potato spimdle tuber viroid,简称pstvd),是引起马铃薯纺锤块茎病的原因,属于世界性检疫病害,易感染,易传播。据报道,pstvd强系可使马铃薯减产达60%,弱系减产约20~35%,常造成较大的经济损失。pstvd不能通过茎尖剥离、组织培养脱毒,必须通过严格的马铃薯种薯检疫预防和控制其传播。
3.目前,pstvd的检测方法主要为rt-pcr技术及核酸斑点杂交技术,rt-pcr对实验条件及技术要求高,普及程度不高。而核酸斑点杂交法具有操作简单易掌握、检测灵敏度高的优点,更易于推广。但现阶段应用的核酸斑点杂交法所使用的探针产量低、成本高,约20μl探针的试剂成本即1600元。受探针成本高昂的影响,每次检测探针用量极少,约1μl探针用于检测100个反应,杂交反应池中探针浓度低直接导致检测灵敏度的降低。
4.申请号为200910073290.1的申请文件公开了一种pstvd双体cdna探针,该探针制备过程需经过2次酶切并与质粒连接,制成具有pstvd双体探针序列的载体,并以包含双体探针序列的载体为模板通过pcr扩增双体探针,在扩增过程中将探针中的碱基“t”替换为被标记的dig-dutp。该方法虽然提高了检测的灵敏度,但双体探针制备过程复杂,探针产量低,成本高。且其探针中含有dutp,其易被rna酶降解,需长期保存在-20℃以下,对保存条件要求较高,存在应用场景不灵活的缺点。
5.申请号为201310642994.2的申请文件公开了一种pstvd液相芯片检测方法,其探针应用方式是将探针固定于微球上,利用一对带标记物的引物对pstvd阳性样品进行扩增,使扩增产物上标记上生物素,然后使扩增产物与探针发生杂交,最终通过检测微球上是否发生荧光反应进行检测pstvd的有无。该方法检测过程需要对待测样本进行pcr扩增,对检测设备要求高,检测程序复杂。
技术实现要素:
6.为解决现有核酸斑点杂交法检测pstvd使用的探针成本高、检测程序复杂的问题,本发明提供了核酸斑点杂交法检测pstvd的探针及其制备方法、试剂盒与检测方法。
7.本发明的技术方案:
8.一种核酸斑点杂交法检测pstvd的探针,所述探针的核苷酸序列如seq id no.1所示。
9.一种本发明所述核酸斑点杂交法检测pstvd的探针的制备方法,以pstvd反转录得到的cdna为模板,以正向引物pstvd-f和反向引物pstvd-r为引物组进行非对称pcr扩增,所得209bp扩增产物即为检测pstvd的探针;
10.所述正向引物pstvd-f的核苷酸序列如seq id no.2所示;
11.所述反向引物pstvd-r的核苷酸序列如seq id no.3所示,所述反向引物pstvd-r的5’端标记地高辛或生物素。
12.进一步的,所述非对称pcr扩增的反应体系为:pstvd阳性样品dna 1.0μl,浓度为10um的正向引物pstvd-f 0.1μl、浓度为10um的反向引物pstvd-r 0.5μl,10
×
pcr buffer 2.5μl,浓度为2.5mm的dntp mixture 2.0μl,浓度为5u/μl的taq酶0.3μl和ddh2o 17.2μl;
13.所述非对称pcr扩增的反应程序为:94℃预变性5min,94℃变性30s,54.5℃退火30s,72℃延伸30s,30次循环,72℃终延伸7min,4℃保温。
14.一种核酸斑点杂交法检测pstvd的试剂盒,包括本发明所述的核酸斑点杂交法检测pstvd的探针。
15.进一步的,还包括核酸提取缓冲液、氯仿、杂交液、洗液i、洗液ii、洗涤缓冲液、阻断液、抗体液、检测缓冲液、显色反应缓冲液、nbt、bcip和正电荷尼龙膜方格。
16.进一步的,所述抗体液含有抗地高辛碱性磷酸酶复合物或链霉亲和素-碱性磷酸酶复合物。
17.一种核酸斑点杂交法检测pstvd的方法,包括如下步骤:
18.步骤一、提取、固定核酸:
19.取马铃薯样品按质量体积比与提取缓冲液混合、研磨,将研磨所得混合体系置于37℃条件下完成孵育,加入氯仿旋涡震荡使其充分混合,离心所得上清液即为核酸溶液,取所得核酸溶液点样于正电荷尼龙膜的方格中,室温干燥后进行紫外交联固定核酸;
20.步骤二、杂交:
21.杂交液预热熔化后加入本发明所述检测pstvd的探针,混匀后将步骤一完成核酸固定的正电荷尼龙膜置于杂交液中,杂交过夜;取出完成杂交的正电荷尼龙膜,依次用洗液i、洗液ii和洗涤缓冲液进行洗涤;
22.步骤三、阻断显色:
23.配制1
×
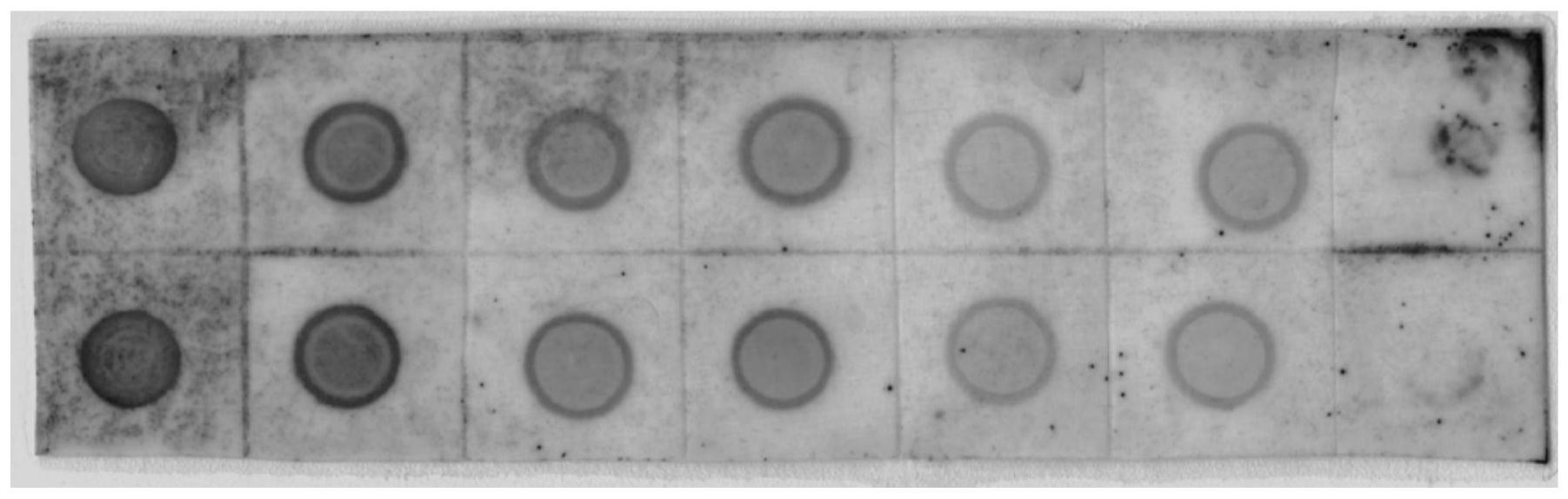
阻断液和抗体液,将步骤二洗涤后的正电荷尼龙膜依次置于1
×
阻断液和抗体液中进行孵育;将完成孵育的正电荷尼龙膜置于洗涤缓冲液中洗涤,再置于检测缓冲液中平衡,将显色反应缓冲液、nbt和bcip混匀后均匀涂在正电荷尼龙膜上,避光孵育显色,出现显色则表明待测马铃薯样本中存在pstvd,显色越深则pstvd阳性样本浓度越高。
24.进一步的,步骤一所述马铃薯样品与提取缓冲液的质量体积比为0.1g:150μl,所述提取缓冲液含有如下浓度的组分:1m nacl、20mm mgcl2、0.5m醋酸钠和3%sds;所述37℃孵育的时间为15min;所述离心为1000rpm离心10min;所述点样为2μl核酸溶液点样于正电荷尼龙膜上的一个方格中;所述紫外交联固定是在1200j条件下,将正电荷尼龙膜的正反面各交联1min。
25.进一步的,步骤二所述杂交液的预热温度为68℃;所述检测pstvd的探针与杂交液的体积比为10μl:5ml;所述杂交过夜的条件为68℃,8~15rpm;所述洗液i含有如下浓度的组分:2
×
ssc,0.1%sds,所述洗液i洗涤是用20ml洗液i在室温下洗涤2次,每次15min;所述洗液ii含有如下浓度的组分:1
×
ssc,0.1%sds,所述洗液ii洗涤是用20ml 50℃预热的洗液ii在55℃下洗涤2次,每次15min;所述洗涤缓冲液含有如下浓度的组分:0.1m马来酸,0.3%tween-20,所述洗涤缓冲液洗涤是用20ml洗涤缓冲液洗涤5min。
26.进一步的,步骤三所述1
×
阻断液的配制方法为用0.1m马来酸缓冲液将预热熔化的10
×
阻断液稀释至1
×
阻断液;抗体液的配制方法为10ml 1
×
阻断液加入2μl抗地高辛碱性磷酸酶复合物或链霉亲和素-碱性磷酸酶复合物;所述正电荷尼龙膜在1
×
阻断液中的孵育时间为20min,在抗体液中的孵育时间为30min;所述洗涤缓冲液含有如下浓度的组分:0.1m马来酸,0.3%tween-20,所述洗涤缓冲液洗涤是用20ml洗涤缓冲液洗涤2次,每次15min;所述检测缓冲液含有如下浓度的组分:0.1m tris-hcl,0.1m nacl,所述检测缓冲液平衡是用15ml检测缓冲液平衡2~5min;所述显色反应缓冲液、nbt和bcip混合的体积比为25:1:1;所述避光孵育显色是在37℃避光孵育显色30min。
27.本发明的有益效果:
28.本发明以pstvd阳性cdna为模板,采用pcr的方式扩增制备核酸斑点杂交法检测pstvd使用的探针,制备方法简便、产量高、成本低。本发明扩增探针只有反向引物5’端标记有dig,只标记1个碱基却保证了检测的显色效果,同时降低了探针对保存条件的要求。
29.本发明将待测样品的核酸固定于正电荷尼龙膜上,用带有dig标记的探针与待测样品的核酸进行杂交,通过标记物的颜色反应检测pstvd的有无。正是由于本发明提供的制备方法降低了探针的制备成本,才能在检测过程中提高探针的用量,以游离的探针与样品核酸进行杂交,能够检测到更低含量的核酸,检测方法的灵敏度更高。灵敏度能达到0.05pg。
30.本发明提供的检测方法不需要对待测样本进行pcr扩增,仅需粗提核酸即可进行检测,简化了检测程序,更易于操作,对检测设备的要求更低,检测场所的适应性更广。将本发明核酸斑点杂交法检测pstvd使用的探针和试剂配套制成试剂盒,更便于pstvd的田间检测和口岸检疫,能够显著提高pstvd的检测效率。
附图说明
31.图1为实施例5利用实施例1制备的探针对不同稀释度pstvd阳性样品进行核酸斑点杂交检测的显色照片;
32.图2为对比例1利用pstvd双体探针对不同稀释度pstvd阳性样品进行核酸斑点杂交检测的显色照片。
具体实施方式
33.下面结合实施例对本发明的技术方案做进一步的说明,但并不局限于此,凡是对本发明技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,均应涵盖在本发明的保护范围中。下列实施例中未具体注明的工艺设备或装置均采用本领域内的常规设备或装置,若未特别指明,本发明实施例中所用的原料等均可市售获得;若未具体指明,本发明实施例中所用的技术手段均为本领域技术人员所熟知的常规手段。
34.实施例1
35.本实施例提供了一种核酸斑点杂交法检测pstvd的探针,其核苷酸序列如seq id no.1所示,共209bp,具体序列如下:
36.gttttcacccttcctttcttcgggtgtccttcctcgcgcccgcaggaccacccctcgccccctttgcgctgtcgcttcggctactacccggtggaaacaactgaagctcccgagaaccgctttttctctatcttacttgcttcg
gggcgagggtgtttagcccttggaaccgcagttggttcctcggaactaaactcgtggttcctgtg。
37.实施例2
38.本实施例提供了实施例1检测pstvd的探针的制备方法。
39.本实施例以pstvd反转录得到的cdna为模板,pstvd阳性样品dna可由阳性样品rna反转录获得,或为含有目的片段的质粒dna,本实施例以pstvd阳性样品rna反转录获得。
40.本实施例使用的探针引物组为正向引物pstvd-f和反向引物pstvd-r,核苷酸序列如seq id no.2和seq id no.3所示,具体为:
41.pstvd-f:gttttcacccttcctttcttc,
42.pstvd-r:cacaggaaccacgagtttagt,pstvd-r的5’端标记地高辛。
43.本实施例使用的引物组由生工生物工程(上海)股份有限公司合成并进行标记。
44.本实施例以pstvd反转录得到的cdna为模板,正向引物pstvd-f和反向引物pstvd-r为引物组进行非对称pcr扩增,扩增的反应体系为:pstvd阳性样品dna 1.0μl,浓度为10um的正向引物pstvd-f 0.1μl、浓度为10um的反向引物pstvd-r 0.5μl,10
×
pcr buffer 2.5μl,浓度为2.5mm的dntp mixture 2.0μl,浓度为5u/μl的taq酶0.3μl和ddh2o 17.2μl;扩增的反应程序为:94℃预变性5min,94℃变性30s,54.5℃退火30s,72℃延伸30s,30次循环,72℃终延伸7min,4℃保温;所得209bp扩增产物即为检测pstvd的探针。
45.本实施例制备的检测pstvd的探针的浓度为64~160ng/μl,探针用量为10μl/100次,即每10μl探针可检测100个样品。也就是说,将100个待测样品点样至一片正电荷尼龙膜上的100个格内,检测杂交时需要5ml杂交液和10ul探针。
46.10
×
pcr buffer、dntp mixture、taq酶和ddh2o为本领域常规使用试剂,市售的10
×
pcr buffer、dntp mixture、taq酶和ddh2o均可用于本实施例。
47.本实施例反向引物pstvd-r的5’端标记地高辛时,后续检测pstvd时抗体液中对应的添加抗地高辛碱性磷酸酶复合物。同时,反向引物pstvd-r的5’端还可以标记生物素,标记生物素时,后续检测pstvd时抗体液中对应的添加链霉亲和素-碱性磷酸酶复合物。
48.实施例3
49.本实施例提供了一种核酸斑点杂交法检测pstvd的试剂盒,包括实施例1核酸斑点杂交法检测pstvd的探针;还包括核酸提取缓冲液、氯仿、杂交液、洗液i、洗液ii、洗涤缓冲液、阻断液、抗体液、检测缓冲液、显色反应缓冲液、nbt、bcip和正电荷尼龙膜方格;抗体液含有抗地高辛碱性磷酸酶复合物或链霉亲和素-碱性磷酸酶复合物。
50.本实施例中提取缓冲液含有如下浓度的组分:1m nacl、20mm mgcl2、0.5m醋酸钠和3%sds;洗液i含有如下浓度的组分:2
×
ssc,0.1%sds;洗液ii含有如下浓度的组分:1
×
ssc,0.1%sds;洗涤缓冲液含有如下浓度的组分:0.1m马来酸,0.3%tween-20;检测缓冲液含有如下浓度的组分:0.1m tris-hcl,0.1m nacl。
51.抗体液的配制方法为10ml 1
×
阻断液加入2μl抗地高辛碱性磷酸酶复合物或链霉亲和素-碱性磷酸酶复合物。
52.本实施例中杂交液(货号hyb-100)、阻断液(货号digd-110)、显色反应缓冲液(货号digd-110)、nbt、bcip、抗地高辛碱性磷酸酶复合物、链霉亲和素-碱性磷酸酶复合物均购自北京美莱博医学科技有限公司。
53.实施例4
54.本实施例利用实施例3提供的pstvd检测试剂盒对马铃薯样本进行检测,并提供了核酸斑点杂交法检测pstvd的方法,具体包括如下步骤:
55.步骤一、提取、固定核酸:
56.取0.2g马铃薯样品放入研磨袋中,加入300μl提取缓冲液,将马铃薯样本磨碎,将研磨所得混合体系转入1.5ml离心管中,37℃孵育15min,加入300μl氯仿,旋涡震荡使其充分混合,1000rpm离心10min至溶液分层,所得上清液即为核酸溶液,吸取上清液至新的离心管,4℃保存,备用;用移液器吸取2μl所得核酸溶液,点样于正电荷尼龙膜的一个方格中,室温干燥后,在紫外交联仪1200j条件下,将正电荷尼龙膜的正反面各交联1min固定核酸;
57.步骤二、杂交:
58.杂交液在68℃下预热,取熔化后杂交液5ml加入到杂交管中,加入实施例1提供的检测pstvd的探针10μl,探针浓度为120
±
20ng/μl,混匀,将步骤一完成核酸固定的正电荷尼龙膜置于杂交液中,排除气泡,68℃,转速为8-15rpm的条件下杂交过夜;
59.取出完成杂交的正电荷尼龙膜,置于20ml洗液i中,室温下洗涤2次,每次15min;将正电荷尼龙膜置转入20ml 50℃预热的洗液ii中,在杂交管中55℃下洗涤2次,每次15min;将正电荷尼龙膜置转入到20ml洗涤缓冲液中洗涤5min;
60.步骤三、阻断显色:
61.用0.1m马来酸缓冲液将预热熔化的10
×
阻断液稀释至1
×
阻断液,将正电荷尼龙膜置于阻断液中孵育20min;然后将正电荷尼龙膜置于含有抗地高辛碱性磷酸酶复合物的抗体液中孵育30min;将完成孵育的正电荷尼龙膜置于20ml洗涤缓冲液中洗涤2次,每次15min;再置于15ml检测缓冲液中平衡2-5min;
62.将显色反应缓冲液、nbt、bcip按体积比25:1:1混匀并均匀涂在夹在两层保鲜膜之间的正电荷尼龙膜上,37℃避光孵育显色30min,如出现显色则表明待测马铃薯样本中存在pstvd,显色越深则pstvd阳性样本浓度越高。
63.实施例5
64.本实施例利用实施例3提供的试剂盒和实施例4提供的检测方法分别对稀释度为1、10-1
、10-2
、10-3
、10-4
、10-5
、10-6
倍的pstvd阳性样品进行pstvd检测,考察本发明提供的检测pstvd的探针和检测方法的灵敏度。
65.本实施例pstvd阳性样品由黑龙江省农业科学院经济作物研究所病毒检测实验室保存,pstvd阳性样品初始核酸浓度为5ng,稀释倍数10-1
的pstvd阳性样品核酸浓度为0.5ng,稀释倍数10-2
的pstvd阳性样品核酸浓度为0.05ng(即50pg),稀释倍数10-3
的pstvd阳性样品核酸浓度为5pg,稀释倍数10-4
的pstvd阳性样品核酸浓度为0.5pg,稀释倍数10-5
的pstvd阳性样品核酸浓度为0.05pg,稀释倍数10-6
的pstvd阳性样品核酸浓度为0.005pg。
66.本实施例在固定核酸时,分别用移液器吸取2μl稀释倍数为1、10-1
、10-2
、10-3
、10-4
、10-5
、10-6
倍的pstvd阳性样品,由左至右分别点样于正电荷尼龙膜的14个方格中,其中上下两排方格为平行样品,室温干燥后,在紫外交联仪1200j条件下,将正电荷尼龙膜的正反面各交联1min固定核酸。
67.本实施例在杂交时,加入实施例1提供的检测pstvd的探针10μl,探针浓度为120
±
20ng/μl,。
68.本实施例其他操作与实施例4操作均相同,显色结果如图1所示,由左至右的方格
显色逐渐变浅,这说明pstvd核酸浓度高时,显色更深。本发明提供的pstvd的探针和检测方法在10-6
pstvd阳性样品稀释物时仍有显色,这表示仍能检出pstvd。
69.对比例1
70.本对比例以申请号为200910073290.1的申请文件中公开的探针分别对稀释度为1、10-1
、10-2
、10-3
、10-4
、10-5
、10-6
倍的pstvd阳性样品进行pstvd检测。
71.本对比例使用的pstvd阳性样品与实施例5是同一批次样品,初始核酸浓度及各级稀释倍数的核酸浓度与实施例5完全相同。本对比例在杂交时,加入申请号为200910073290.1的申请文件中公开的探针,加入量为2μl,该探针的浓度为300
±
10ng/μl。
72.本对比例其他操作与实施例5均相同,显色结果如图2所示,由左至右的方格显色逐渐变浅,其中10-5
pstvd阳性样品稀释物的显色明显比实施例5中10-5
pstvd阳性样品稀释物的显色浅。本对比例10-6
pstvd阳性样品稀释物的方格已无显色,这说明本对比例使用的探针无法检出10-6
pstvd阳性样品稀释物中的pstvd。
73.由实施例5与对比例1显色效果的对比可以看出,本发明提供的探针和检测方法与现有技术相比,能够检测到更低含量的核酸,具有更高的灵敏度,与申请号为200910073290.1的申请文件中公开的探针相比,灵敏度提高了10倍。
74.正是由于本发明提供的制备方法降低了探针的制备成本,才能在检测过程中提高探针的用量。以游离的探针与样品核酸进行杂交,探针用量越多,与样品核酸结合越充分,检测方法的灵敏度越高,本发明检测pstvd的灵敏度能达到0.05pg。
75.与此同时,本发明检测pstvd使用的探针制备方法更简便,且产量高、成本低,降低了探针对保存条件的要求;而且本发明的检测方法不需要对待测样本进行pcr扩增,仅需粗提核酸即可进行检测;探针在使用前无需进行变性操作,相比申请号为200910073290.1的申请文件中公开的探针需要99℃下变性5~10min,立即放在冰上10min才可使用,使用本发明探针进行检测简化了检测程序,更易于操作,对检测设备的要求更低,检测场所的适应性更广,更便于pstvd的田间检测和口岸检疫,能够显著提高pstvd的检测效率。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1