以Oligo(dT)为亲和配基的层析填料的用途的制作方法
以oligo(dt)为亲和配基的层析填料的用途
技术领域
1.本发明涉及层析填料的用途,特别涉及以oligo(dt)为亲和配基的层析填料的用途。
背景技术:
2.mrna疫苗在疫苗有效性上遥遥领先传统技术疫苗,这直接促使mrna技术在疾病预防和治疗领域的快速发展,包括传染病疫苗领域、肿瘤免疫治疗相关领域、单抗药物和其它蛋白类药物替代领域。基于mrna的疾病预防和治疗,简单来讲就是化学修饰后的mrna分子进入细胞后,利用细胞自身的蛋白合成机制进行翻译表达,生成疾病预防和治疗所需的目的蛋白。mrna最大的优势在于其不进入细胞核,不改变基因组,只有瞬时活性,能通过生理代谢降解,因此,mrna治疗被称为“开启你体内的药厂”。加上mrna的生产简易、成本低,极大地缩短和降低了新药开发的周期和成本,使得mrna药物具有很大优势。
3.图1所示为mrna的通式结构,其3
′
端修饰的poly(a)尾巴对于mrna的稳定性非常重要,同时,此poly(a)尾巴为mrna的纯化提供了有效的途径。将一定长度的寡聚脱氧胸腺嘧啶核苷(oligo(dt))键合到固相载体上,可以利用t-a之间的碱基配对原理捕获修饰有poly(a)尾巴的mrna,其它杂质则流穿。然而,mrna相关行业也是近两年才快速成长起来,如何获得大量可用于临床的mrna产品依然是一个很大的挑战。
4.本发明采用赛分科技研发生产的基于oligo(dt)的亲和填料,开发了一套用于纯化mrna的柱层析法工艺,在简化纯化步骤的同时,避免了使用有毒试剂,提高了纯度和收率,可用于mrna产品的放大生产。
5.此外,环形rna(circular rna,endless rna,erna)近年来受到了越来越多的关注,相比于mrna,环形rna具有稳定性好和制备简单的优势。环形rna在制备过程中可省去加帽、加尾和修饰这三个步骤,操作上相对更容易。如果在设计环形rna时,在碱基序列中加入poly(a)结构,同样可以使用oligo(dt)的亲和填料进行纯化。
技术实现要素:
6.mrna疫苗在疫苗有效性上遥遥领先传统技术疫苗,这直接促使mrna技术在疾病预防和治疗领域的快速发展,包括传染病疫苗领域、肿瘤免疫治疗相关领域、单抗药物和其它蛋白类药物替代领域。基于mrna的疾病预防和治疗,简单来讲就是化学修饰后的mrna分子进入细胞后,利用细胞自身的蛋白合成机制进行翻译表达,生成疾病预防和治疗所需的目的蛋白。mrna最大的优势在于其不进入细胞核,不改变基因组,只有瞬时活性,能通过生理代谢降解,因此,mrna治疗被称为“开启你体内的药厂”。加上mrna的生产简易、成本低,极大地缩短和降低了新药开发的周期和成本,使得mrna药物具有很大优势。
7.图1所示为mrna的通式结构,其3
′
端修饰的poly(a)尾巴对于mrna的稳定性非常重要,同时,此poly(a)尾巴为mrna的纯化提供了有效的途径。将一定长度的寡聚脱氧胸腺嘧啶核苷(oligo(dt))键合到固相载体上,可以利用t-a之间的碱基配对原理捕获修饰有poly
(a)尾巴的mrna,其它杂质则流穿。然而,mrna相关行业也是近两年才快速成长起来,如何获得大量可用于临床的mrna产品依然是一个很大的挑战。
8.本发明采用赛分科技研发生产的基于oligo(dt)的亲和填料,开发了一套用于纯化mrna的柱层析法工艺,在简化纯化步骤的同时,避免了使用有毒试剂,提高了纯度和收率,可用于mrna产品的放大生产。
9.此外,环形rna(circular rna,endless rna,erna)近年来受到了越来越多的关注,相比于mrna,环形rna具有稳定性好和制备简单的优势。环形rna在制备过程中可省去加帽、加尾和修饰这三个步骤,操作上相对更容易。如果在设计环形rna时,在碱基序列中加入poly(a)结构,同样可以使用oligo(dt)的亲和填料进行纯化。
附图说明
10.图1为mrna结构通式;
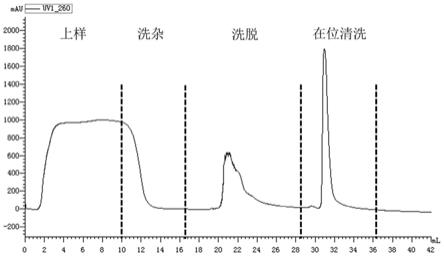
11.图2为采用实施例1的纯化方法对mrna分离纯化图谱;
12.图3为采用实施例1的纯化方法对mrna分离分析检测图谱;
13.图4为采用实施例2的纯化方法对mrna分离纯化图谱;
14.图5为采用实施例2的纯化方法对mrna分离分析检测图谱;
15.图6为采用实施例7的纯化方法对mrna分离纯化图谱;
16.图7为采用实施例7的纯化方法对mrna分离分析检测图谱;
17.图8为采用实施例8的mrna特异性结合实验;
18.图9为采用实施例9的mrna特异性结合实验。
具体实施方式
19.实施例1
20.本实施例采用赛分科技研发生产的monomix dt20亲和填料1ml预装柱(填料规格为30m,预装柱货号为283030950-70025),上样样品为2.0mg的mrna(约1000nt,浓度0.2mg/ml);平衡缓冲液为100mm tris+500mm nacl,ph 7.5;线性流速为87cm/h;cip:0.1m naoh的水溶液。
21.纯化过程:以缓冲液平衡层析柱;提前将层析柱置于柱温箱中预热到50℃,2mg的mrna溶解于含有500mm nacl的制样缓冲液中(1∶3体积比混合),上样。以缓冲液20mm tris+200mm nacl,ph 7.5冲洗柱子,线性流速为87cm/h;提前将层析柱置于柱温箱中预热到65℃,在260nm紫外光下,以洗脱液10mm tris,ph 7.5洗脱样品,并记录其峰面积;然后以cip缓冲液(0.1m naoh的水溶液)冲洗柱子,如图2。使用完色谱柱后,将其保存在20%乙醇水溶液中,4℃条件保存。检测所用的分析柱srt sec-1000,5μm,7.8x300mm(pn:215950-7830)由苏州赛分科技有限公司提供,检测结果如图3。
22.实验结果表明,monomix dt20层析柱采用此纯化方法具有如下特点:
23.1)可以在50℃条件下,通过oligo(dt)捕获带有poly(a)尾巴的mrna,通过提高温度,破坏poly(a)尾巴与oligo(dt)的亲和结合,达到了分离mrna的效果。
24.2)使用此纯化方法,mrna的回收率>75%,其纯度>95%。
25.3)以0.1m naoh水溶液作为cip的溶液,对色谱柱进行消毒和再生,以进行下一轮
纯化。
26.表1mrna纯化分离操作条件
[0027][0028][0029]
实施例2
[0030]
本实施例采用赛分科技研发生产的monomix dt20亲和填料1ml预装柱(填料规格为30m,预装柱货号为283030950-70025),上样样品为0.5mg的mrna(约4000nt,浓度0.2mg/ml);平衡缓冲液为10mm tris+400mm nacl,ph 7.5;线性流速为87cm/h;cip:0.1m naoh的水溶液。
[0031]
纯化过程:以缓冲液平衡层析柱;0.5mg的mrna上样溶解于(1∶8混合)平衡缓冲液中,65℃,反应10min,迅速放置冰上冷却10min。以上述缓冲液冲柱子,流速为87cm/h;在260nm紫外光下,收集洗脱样品,并记录其峰面积;然后以cip缓冲液(0.1m naoh的水溶液)冲洗柱子,如图4。使用完色谱柱后,将其保存在20%乙醇水溶液中,4℃条件保存。检测所用的分析柱srt sec-1000,5μm,7.8x300mm(pn:215950-7830)由苏州赛分科技有限公司提供,检测结果如图5。
[0032]
实验结果表明,monomix dt20层析柱采用此纯化方法具有如下特点:
[0033]
1)通过将mrna短暂加热至65℃-70℃,然后立即在冰上冷却,破坏其二级结构。低盐缓冲液(或水)在室温条件下破坏mrna中poly(a)尾巴与oligo(dt)之间的氢键,将mrna洗脱下来,达到了分离mrna的效果。
[0034]
2)使用此纯化方法,mrna的回收率>50%,其纯度>95%。
[0035]
3)以0.1m naoh水溶液作为cip的溶液,对色谱柱进行消毒和再生,以进行下一轮纯化。
[0036]
表2mrna纯化分离操作条件
[0037][0038][0039]
实施例3
[0040]
本实施例提供一种用于纯化mrna的柱层析法,与实施例2基本相同,区别仅在于将缓冲液10mm tris缓冲体系+400mm nacl,ph 7.4替换为10mm tris缓冲体系+800mm nacl,ph 7.4。
[0041]
使用此纯化方法,mrna的回收率>65%,其纯度>95%。
[0042]
实施例4
[0043]
本实施例提供一种用于纯化mrna的柱层析法,与实施例3基本相同,区别仅在于将缓冲液10mm tris缓冲体系+800mm nacl,ph 7.4替换为10mm tris缓冲体系+1.2m nacl,ph 7.4。
[0044]
使用此纯化方法,mrna的回收率>85%,其纯度>95%。
[0045]
实施例5
[0046]
本实施例提供一种用于纯化mrna的柱层析法,与实施例4基本相同,区别仅在于将上样量0.5mg替换为1.25mg;
[0047]
使用此纯化方法,mrna的回收率>80%,其纯度>95%。
[0048]
实施例6
[0049]
本实施例提供一种用于纯化mrna的柱层析法,与实施例4基本相同,区别仅在于将缓冲液10mm tris缓冲体系+1.2m nacl,ph 7.4替换为10mm tris缓冲体系+1.6m nacl,ph 7.4。
[0050]
使用此纯化方法,mrna的回收率>90%,其纯度>95%。
[0051]
实施例7
[0052]
本实施例提供一种用于纯化mrna的柱层析法,与实施例6基本相同,区别仅在于将上样量0.5mg替换为2.0mg;纯化结果如图6,检测结果如图7。
[0053]
使用此纯化方法,mrna的回收率>80%,其纯度>95%。
[0054]
实施例8
[0055]
mrna特异性结合实验,实施方法与实施例1相同。结论:纯化实验中收集到的流穿组分(没有保留)在同一根monomix dt20亲和色谱柱子上面重新进样,还会流穿,如图8所示。
[0056]
实施例9
[0057]
mrna特异性结合实验.实施方法与实施例1相同。结论:纯化实验中收集到的保留组分在同一根monomix dt20亲和色谱柱子上面重新进样,还会保留,如图9所示。
[0058]
实施例10
[0059]
本实施例提供一种用于纯化mrna的柱层析法,与实施例6基本相同,区别仅在于将约4000nt的mrna样品替换为约1500nt的mrna样品。
[0060]
使用此纯化方法,mrna的回收率>87%,其纯度>95%。
[0061]
实施例11
[0062]
本实施例提供一种用于纯化mrna的柱层析法,与实施例6基本相同,区别仅在于将约4000nt的mrna样品替换为约3000nt的mrna样品。
[0063]
使用此纯化方法,mrna的回收率>75%,其纯度>95%。
[0064]
实施例12
[0065]
本实施例提供一种用于纯化环形rna的柱层析法,与实施例2基本相同,区别仅在于样品为环形rna。该环形rna长度约2000nt,其碱基序列中含有50个碱基a构成的poly(a)结构,首尾相接成一个闭环,杂质主要为核酸酶、核苷酸原料等。
[0066]
使用此纯化方法,mrna的回收率>65%,其纯度>90%。
[0067]
实施例13
[0068]
本实施例提供一种用于纯化mrna的柱层析法,与实施例1基本相同,区别仅在于将monomix dt20亲和填料替换为monomix dt15亲和填料(dt配基的长度从20变为15)。
[0069]
使用此纯化方法,mrna的回收率>70%,其纯度>95%。
[0070]
实施例14
[0071]
本实施例提供一种用于纯化mrna的柱层析法,与实施例2基本相同,区别仅在于将monomix dt20亲和填料替换为monomix dt30亲和填料(dt配基的长度从20变为30)。
[0072]
使用此纯化方法,mrna的回收率>60%,其纯度>95%。
[0073]
实施例15
[0074]
本实施例提供一种用于纯化mrna的柱层析法,与实施例5基本相同,区别在于将monomix dt20亲和填料填装在赛分科技生产的generik fplc玻璃柱管中(货号为202000-1015-aa),填装高度为6.4cm,柱体积为5.0ml,并将上样量由0.5mg提高至6.25mg。
[0075]
使用此纯化方法,mrna的回收率>60%,其纯度>95%。
[0076]
实施例16
[0077]
本实施例提供一种用于纯化mrna的柱层析法,与实施例5基本相同,区别在于将monomix dt20亲和填料填装在不锈钢柱管中,规格为7.8x300mm柱体积为14.3ml,填料粒径由30μm变为60μm,并将上样量由0.5mg提高至18mg。
[0078]
使用此纯化方法,mrna的回收率>60%,其纯度>95%。
[0079]
实施例17
[0080]
本实施例提供一种用于纯化mrna的柱层析法,与实施例2基本相同,区别仅在于将monomix dt20亲和填料替换为proteomix dt20(ps-dvb基质,规格为20m,)亲和填料。
[0081]
使用此纯化方法,mrna的回收率>80%,其纯度>95%。
[0082]
实施例18
[0083]
本实施例提供一种用于纯化mrna的柱层析法,与实施例2基本相同,区别仅在于将monomix dt20亲和填料替换为agarosix dt20(琼脂糖基质,规格为45m)亲和填料。
[0084]
使用此纯化方法,mrna的回收率>75%,其纯度>95%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1