玉米ZmPRA1C1基因在提高植物热胁迫抗性中的应用
玉米zmpra1c1基因在提高植物热胁迫抗性中的应用
技术领域
1.本发明属于植物基因工程技术领域,具体涉及玉米zmpra1c1基因在提高植物热胁迫抗性中的应用。
背景技术:
2.温度是影响地球生命的关键物理参数之一。因此,几乎所有的生物体都进化出了信号通路来感知环境温度的轻微变化,并调整其代谢和细胞功能,以防止与热相关的损伤。热应激会对植物生长、发育、生殖和产量的所有方面产生不利影响。由于植物是固着在土壤中的有机体,无法逃逸热量,它们主要通过热驯化手段改变体内的新陈代谢以防止热量造成的损害,如果体内的热量超过植物的承受水平,植物通过激活特定细胞或组织中的程序性细胞死亡,导致叶片脱落、花朵凋谢、果实减少,甚至整个植物的死亡。在1964年至2007年期间,干旱和极端高温使全球谷物产量分别下降了10.1%和9.1%,其中由极端干旱天气共造成约18.2亿美元损失(约等于2013年全球玉米和小麦的产量),而由极端高温灾害共造成约11.9亿美元损失。
3.由于pra1家族数量较多,大多数的植物pra1的确切功能没有被阐述,一般来说pra1功能主要通过与下游rab蛋白互作来发挥。在水稻中,作者发现了植物yip同源基因ospra1,它是一个定位于液泡前体的完整膜蛋白,它具有典型的yip/pra1蛋白家族的分子特性,具有两个疏水结构域,能够介导膜融合。能够与下游osrab7互作的,在液泡运输过程中通过液泡前体将osrab7靶向进入液泡膜中发挥重要作用,对植物细胞的液泡运输至关重要。此外,ospra1也可以与osvamp3蛋白互作,可能参与了囊泡融合过程,但作者并没有对这一现象进行更加深入的研究。在拟南芥中,lee等研究了atpra1.b6对靶向到各种内膜系统蛋白质的顺行转运的影响。超表达atpra1导致了coat蛋白复合物ii囊泡介导不同蛋白的顺行转运均产生不同程度的抑制,这些蛋白包括液泡蛋白、分泌蛋白、质膜蛋白,而高尔基定位蛋白的转运不受影响。另外作者发现atpra1.b6介导的顺行转运抑制发生在内质网,该蛋白的表达水平受26s蛋白酶体介导的蛋白水解影响。atpra1.b6是内质网内由囊泡介导的外套蛋白复合物ii的负调控蛋白。与以上研究类似,pra1.f4主要在高尔基体蛋白转运中发挥功能,作者首先研究了该基因突变体超表达的表型,突变体表现为植株发育矮小,根短,对盐胁迫敏感;超表达次生根及根毛数量高于野生型,同样表现出盐敏感的表型。另外,该基因的突变体在液泡运输过程中存在缺陷而超表达则抑制了高尔基体中一系列蛋白的向外转运,这些蛋白包括液泡蛋白、质膜蛋白、反式高尔基体蛋白等,但也不是所有类型的高尔基体向外转运蛋白都受到抑制,例如分泌蛋白。基于以上,作者认为该基因对高尔基体的功能是至关重要的。
4.除了拟南芥pra1功能的研究,在番茄中,pra1a与leeix2互作,leeix2是番茄中的一个模式识别受体,能够激活微生物/病原体相关分子模式(mamp/pamp),触发针对病原体进展的免疫反应。slpra1a的超表达能够明显降低leeix2内体定位,以及leeix2蛋白水平。从而降低了对eix的先天免疫反应。抑制液泡功能可抑制slpra1a介导的leeix2蛋白水平降
低,slpra1a能够将leeix2转运至液泡进行降解。
技术实现要素:
5.针对上述现有技术的情况,本发明的目的在于提供玉米zmpra1c1基因在提高植物热胁迫抗性中的应用,本发明从玉米中分离和克隆到一个prenylated rab acceptor 1(pra1)家族基因,并将其命名为zmpra1c1,并通过该基因获得zmpra1c1基因过量表达载体,进而获得了zmpra1c1基因过量表达纯合株系,该过量表达纯合株系具有很好的热胁迫抗性。
6.为实现上述发明目的,本发明采用以下技术方案予以实现:
7.本发明提供了一种提高玉米耐热性的基因zmpra1c1,其特征在于:其核苷酸序列如seq id no:1所示,cds序列如seq id no:2所示,其编码的蛋白质的氨基酸序列如序列seq id no:3所示。扩增所述zmpra1c1基因的引物序列为:
8.上游引物5
’‑
ggatccatgtccaagtacggcaccattc-3’;
9.下游引物5
’‑
gagctctcagtgcgacggctgctg-3’。
10.本发明还提供了所述的zmpra1c1基因在调控植物苗期耐热性表型中的应用。
11.含有所述玉米zmpra1c1基因的植物过量表达纯合株系在热胁迫下植株萎蔫程度明显低于野生型株系。
12.进一步的,含有所述玉米zmpra1c1基因的植物过量表达纯合株系在热胁迫下的离子渗漏率率明显低于野生型株系。
13.进一步的,含有所述玉米zmpra1c1基因的植物过量表达纯合株系在热胁迫下的地上部分鲜重明显高于野生型株系。
14.进一步的,所述过量表达载体包括pcambia3300-zmpra1c1,其通过重组质粒经双酶切后,将所述玉米zmpra1c1基因连接到载体质粒中ubi启动子后获得。
15.进一步的,所述重组质粒包括pmd19-t-zmpra1c1,其通过扩增所述玉米zmpra1c1基因的产物经回收、纯化后克隆到克隆载体上获得。
16.与现有技术相比,本发明的优点和技术效果是:本发明通过基因工程技术将zmpra1c1基因进行过量表达,然后获得过量表达载体,将该载体转化进株系中,经过筛选得到zmpra1c1基因过量表达纯合株系,进而明显的提高了植物热胁迫抗性的能力。zmpra1c1基因过量表达不仅提高了热胁迫下植物地上部分鲜重,还降低了植物热胁迫下的离子渗漏率,降低了植物的萎蔫程度,降低了植物的热损伤程度,更有利于植物在高温环境下的生长发育。本发明通过实验首次确认了玉米zmpra1c1基因可以提高植物的热胁迫性,并鉴于zmpra1c1基因在热胁迫中的应用,可以认为该基因对提高植物热胁迫性具有潜在的应用价值,同时本发明也为利用zmpra1c1基因培育耐高温的农作物品种奠定良好的理论和应用基础。
附图说明
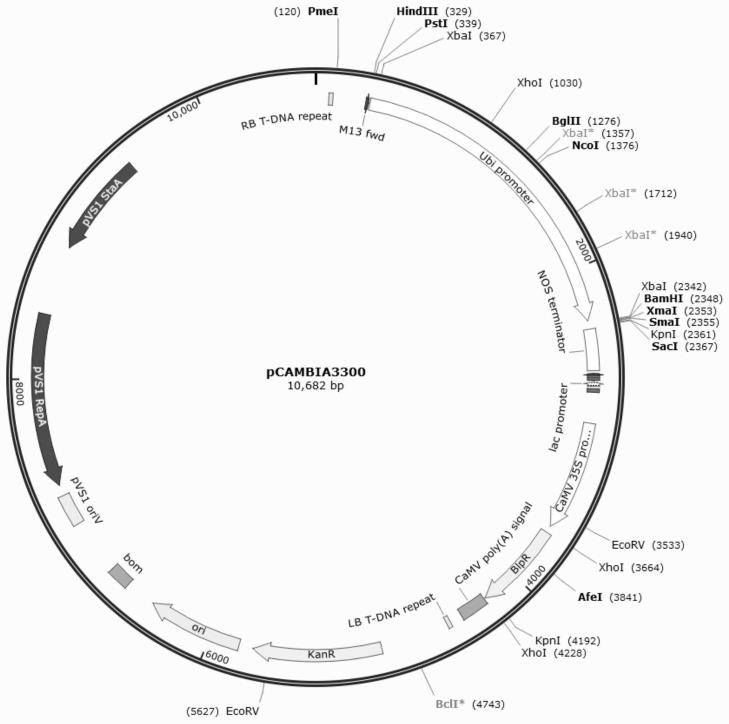
17.图1a是构建的表达载体的示意图以及酶切位点。其中,表达载体为pcambia3300,启动子为ubi,目的基因zmpra1c1两端的酶切位点分别为bamhι和sacι。
18.图1b是转基因株系阳性苗的鉴定;1号泳道为野生型b104,其余泳道为转基因株
系。
19.图2a是rt-qpcr检测b104与ubi::zmpra1c1转基因株系中zmpra1c1基因的转录水平。
20.图2b是western blot检测b104与ubi::zmpra1c1转基因株系中zmpra1c1蛋白水平。
21.图3a为转基因株系ubi::zmpra1c1与野生型b104在基质中生长2周后,在正常条件下和热胁迫处理之后的表型图。
22.图3b为转基因株系ubi::zmpra1c1与野生型b104在基质中生长2周后,在正常条件下和热胁迫处理之后地上部分鲜重的数据统计,且发现具有显著性差异。
23.图3c为转基因株系ubi::zmpra1c1与野生型b104在基质中生长2周后,在正常条件下和热胁迫处理之后离子渗漏率的数据统计,且发现具有显著性差异。
具体实施方式
24.以下结合附图和具体实施例对本发明的技术方案做进一步详细的说明。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件;未详细注明的试剂或材料,均为市售产品。本发明将上述表达载体导入到模式植物玉米细胞中,导入方法都是本领域人员熟知的,这些方法包括但不仅限于:农杆菌介导的转化法、基因枪法、电激法、子房注射法等。除此之外,本发明所采用的均为本领域现有技术。
25.本发明首先从玉米中获取了总rna,反转录获得cdna第一链,之后利用其作为模板,用zmpra1c1对应的特异性引物对获得的cdna进行高保真酶扩增。
26.玉米rna的提取和纯化可直接采用现有工艺,也可采用本发明中所记载的工艺;cdna第一链的合成的也是相同的情况,也可以采用现有的工艺或者试剂盒,但是上述两者均优选采用本发明所记载的具体工艺。
27.实施例1:转基因株系的获得
28.(一)玉米zmpra1c1基因的序列分析、克隆与载体构建
29.本发明利用玉米基因组数据库网站(https://www.maizegdb.org)找到基因zmpra1c1,该基因组序列全长为3529bp(序列如seq id no.1所示),而cds序列为582bp(序列如seq id no.2所示),该基因编码的蛋白质大小为193个氨基酸(序列如seq id no.3所示)。
30.根据找到的玉米zmpra1c1基因的cds序列设计引物,进行克隆,克隆方法如下:
31.1.rna的提取:使用康为世纪公司的全能型植物rna提取试剂盒(货号cw2598)提取玉米的总rna。
32.(1)取0.1-0.2g玉米组织在液氮中研磨成粉末,加入500μl的buffer rls,立即涡旋震荡混匀;
33.(2)4℃,12000rpm离心2min;
34.(3)取上清液置于过滤柱中(spin columns fs),4℃,12000rpm离心1min,吸取上清并转移至新的离心管中;
35.(4)加入250μl的无水乙醇,混匀,将得到的溶液转移到吸附柱(spin columns rm)中,4℃,12000rpm离心1min,弃废液;
36.(5)向吸附柱中加入350μl的buffer rw1,4℃,12000rpm离心1min,弃废液;
37.(6)配制dnase i溶液:取52μl rnase-free water,加入8μl 10
×
reaction buffer和20μl dnase i,混匀,配制成80μl的dnasei溶液;
38.(7)向吸附柱中加入80μl dnase i溶液,20-30℃静置15min;
39.(8)向吸附柱中加入350μl buffer rw1,4℃12,000rpm离心1min,弃废液;
40.(9)向吸附柱中加入500μl buffer rw2,4℃12,000rpm离心1min,弃废液;
41.(10)重复步骤(9);
42.(11)4℃12,000rpm离心2min;
43.(12)将吸附柱装入新的rnase-free离心管中,向吸附膜的中间滴加30μl rnase-free water,室温放置1min,12000rpm离心1min,将得到的rna溶液保存在-80℃冰箱中。
44.2.反转录cdna第一链的合成:将提取的rna溶解后测定rna浓度,然后使用transscript one-step gdna removal and cdna synthesis supermix反转录试剂盒进行反转录。
45.取5μg总rna,加入2
×
反应缓冲液10μl,引物oligo dt(0.5μg/μl)1μl,反转录酶1μl,去基因组酶1μl,补水到20μl,在42℃孵育30分钟,85℃酶失活5分钟。
46.3.zmpra1c1基因的克隆:
47.zmpra1c1基因引物序列:
48.上游引物5
’‑
ggatccatgtccaagtacggcaccattc-3’;(seq id no.4);
49.下游引物5
’‑
gagctctcagtgcgacggctgctg-3’;(seq id no.5);
50.其中下划线处为酶切位点,上游引物的酶切位点为bamhι,下游引物的酶切位点为saci。
51.使用phanta max super-fidelity dna polymerase高保真酶(挪威赞公司,货号p505)进行扩增,反应体系为:2
×
phanta max buffer 25μl,脱氧核糖核酸(dntp)1μl,上游引物2μl,下游引物2μl,phanta max super-fidelity dna polymerase高保真酶1μl,cdna模板1μl,水补齐到50μl。
52.pcr反应条件为:95℃预变性3分钟;
53.95℃变性15秒,53℃退火15秒,72℃延伸30秒,共37个循环;
54.72℃后延伸5分钟;
55.16℃保温。
56.反应结束后,进行琼脂糖凝胶电泳,检测到目的条带后,切胶并进行胶回收,胶回收方法根据bioteke公司的快捷型琼脂糖凝胶dna回收试剂盒(货号dp1722)进行。
57.高保真酶扩增的产物末端为平末端,需要添加polya后才能进行t-a克隆,反应体系如下:10
×
反应缓冲液1.5μl,脱氧核糖核酸(dntp)1.2μl,taq酶0.15μl,胶回收产物补齐15μl。之后再72℃反应30分钟。
58.4.取上述4μl加尾产物与pmd19-t克隆载体进行连接,操作步骤按照takara公司的产品pmd19-t说明书进行,然后连接产物使用热激法转化大肠杆菌top10菌株,在含有氨苄霉素的lb平板上生长过夜。挑取白色单个菌落在lb平板上划线,进行菌落pcr,反应体系如上,选取阳性菌落在lb液体培养基中过夜。
59.5.质粒dna的提取:使用康为世纪高纯度质粒小提取试剂盒(cw0500a)提取质粒
dna。
60.6.序列测定:该工作在生工生物工程(上海)股份有限公司进行。
61.7.表达载体的构建:用bamhι和saci酶切测序正确的带有zmpra1c1基因的质粒和带有ubi启动子的pcambia3300空载体(图1a),37℃酶切一个小时之后,进行琼脂糖凝胶电泳,切除正确的条带进行胶回收,将胶回收产物用thermo fisher scientific公司的t4dna连接酶连接,连接产物转化top10菌株,在含有卡那的lb平板上生长过夜。挑取白色单个菌落在lb平板上划线,进行菌落pcr,选取阳性菌落在lb液体培养基中过夜。质粒dna的提取:使用康为世纪高纯度质粒小提取试剂盒提取质粒dna,酶切鉴定。构建得到ubi::zmpra1c1的过表达载体。
62.8.取2.5μl质粒转化农杆菌eha105。
63.(二):过表达zmpra1c1转基因玉米阳性苗的获得与筛选
64.1.过表达zmpra1c1转基因玉米阳性苗的获得
65.携带ubi::zmpra1c1的过表达载体的eha105农杆菌转化玉米组织委托博美兴奥生物技术公司进行。
66.2.转基因阳性苗的筛选
67.(1)单株收到侵染后的玉米的种子为t0代。
68.(2)选取20粒t0代种子在基质上培养,提取转基因株系的基因组,用pcr检测转基因株系,挑选阳性苗种在大田中,单株收到的种子为t1代。
69.(3)每个t1代果穗中选取20粒种子在在基质上培养,提取转基因株系的基因组,用pcr检测转基因株系,挑选阳性苗种在大田中,单株收到的种子为t2代。
70.(4)每个t2代果穗中选取20粒种子在在基质上培养,提取转基因株系的基因组,用pcr检测转基因株系,结果全部是阳性株系的上一代t2株系即为纯合的转基因株系的种子,结果如图1b所示。以下所有实验均选用纯合的转基因株系的种子。
71.实施例2:转基因株系中zmpra1c1表达量的鉴定
72.依据qrt-pcr引物设计要求,使用beacon designer 7和primer premier 5.0等软件设计基因特异引物。选择sybr green design选项,建立文件,输入序列,运行blast search sequence和template structure search工具后,运行primer search工具,选择最优引物序列(先保证引物特异性再考虑避开模板结构影响)。引物在上海生工生物工程服务有限公司合成,采用page纯化,引物序列如下:
73.qrt-zmpra1c1-f:ccccgtctccctcatcgtat;(seq id no.6)
74.qrt-zmpra1c1-r:gtgaggaggagcaggacga;(seq id no.7)
75.应用qrt-pcr专用96孔板(axygen,美国)和高透光率封口膜(axygen,美国),荧光定量pcr仪icycler real-time pcr system(bio-rad,美国)进行qrt-pcr分析,每个样品3次重复。反转录产物为模板,反应体系参照sybr green realtime pcr master mix(qpk-201)说明书,反应条件如下:
76.(1)95.0℃60s;(2)95.0℃10s;(3)58.0
±
5.0℃10s;(4)72.0℃15s;(5)plate read;(6)incubate at 65℃for 20s;(7)melting curve from 65℃to 95℃,read every 0.5℃,hold1s;(8)end;其中(2)(3)(4)50-60cycles。
77.将多个样品混合,进行第一次扩增,检测引物是否可用,根据融解曲线验证引物扩
增的特异性,单一峰即认为特异扩增,如有双峰,适当调整退火温度及引物用量,若仍然不能特异扩增,重新设计引物。使用混合模板按10倍浓度依次稀释,共稀释4次,用5个浓度的样品构建相对标准曲线,验证所有引物的扩增效率,以及目的序列在此浓度范围内是否具有线性扩增的关系。
78.以tubulin为内参,调整各模板浓度使内参ct值之差小于2。每个基因扩增均有内参同时扩增,默认条件下读取ct值,每个样品作三次重复,数据分析采用双标准曲线法,计算平均表达量和相对偏差,用excel作图。同时利用2-δδct
大致计算与内参的相对表达量,确定基因的表达丰度。相对表达量计算fold change=2
–△△
ct
,此处
△△
ct=(c
t-gen
–ct-tubulin
)
处理
–
(c
t-gene
–ct-tubulin
)
对照
。结果显示(图2a),zmpra1c1基因在过量表达的纯合体株系oe-1与oe-2中呈现较高水平的表达。
79.除此之外,该研究还利用了anti-zmpra1c1抗体通过western blot实验检测了b104、oe-1、oe-2株系中zmpra1c1的表达量,结果如图2b显示,在蛋白水平上,两个超表达株系中zmpra1c1的蛋白量均明显高于对照b104,综上所示,zmpra1c1基因在过量表达的纯合体株系oe-1与oe-2中呈现较高水平的表达,因此选取该株系进行后续的研究。
80.实施例3:玉米zmpra1c1基因对幼苗热胁迫下表型的影响
81.(一):过表达zmpra1c1转基因玉米的培养
82.玉米种子用70%乙醇消毒5分钟,然后用15%的次氯酸钠消毒5分钟,最后用无菌ddh2o冲洗5-7次,将消毒的无菌种子种植在基质中,放置于25℃的长日照培养箱生长14天。长日照条件为16h光照/8h黑暗,25℃。
83.(二):过表达zmpra1c1转基因株系热胁迫下表型观察
84.挑选(一)中长势一致的b104野生型、oe-1、oe-2玉米幼苗各30株,同时在热培养箱中进行45℃,5.5小时的热胁迫处理,观察处理前后幼苗生长状态并拍照,结果如图3a所示,在正常条件下,三者的表型没有明显差异,在热胁迫处理之后,b104玉米幼苗已经出现了明显的萎蔫状态,相较于b104,两个过表达zmpra1c1转基因株系生长状态较为良好,萎蔫程度低。
85.(三):过表达zmpra1c1转基因株系热胁迫下地上部分鲜重统计
86.挑选(一)中长势一致的b104野生型、oe-1、oe-2玉米幼苗各30株,同时在热培养箱中进行45℃,5.5小时的热胁迫处理,统计热胁迫处理前后的地上部分鲜重,结果如图3b所示,在正常条件下,三者的地上部分鲜重没有明显差异,均在1g左右,在热胁迫处理之后,b104玉米幼苗的地上部分鲜重降低50%左右,说明植株生物量减少严重。相较于b104,两个过表达zmpra1c1转基因株系的地上部分鲜重依然保持未处理的80%左右,生物量降低程度较轻。
87.(四):过表达zmpra1c1转基因株系热胁迫下离子渗漏率统计
88.挑选(一)中长势一致的b104野生型、oe-1、oe-2玉米幼苗各30株,同时在热培养箱中进行45℃,5.5小时的热胁迫处理,统计热胁迫处理前后的幼苗离子渗漏率,结果如图3c所示,在正常条件下,三者的离子渗漏率没有明显差异,均在8%左右,在热胁迫处理之后,b104玉米幼苗的离子渗漏率明显升高到20%左右,说明细胞受到明显的热胁迫损伤。相较于b104,两个过表达zmpra1c1转基因株系的离子渗漏率明显升高到14%左右,受损伤程度明显低于b104。
89.以上所有证据说明zmpra1c1基因可以明显提高植物幼苗的热胁迫抗性,缓解幼苗遭受的热胁迫挑战。
90.以上实施例仅用以说明本发明的技术方案,而非对其进行限制;尽管参照前述实施例对本发明进行了详细的说明,对于本领域的普通技术人员来说,依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或替换,并不使相应技术方案的本质脱离本发明所要求保护的技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1