一种新型里氏木霉异源蛋白表达系统的构建及其应用的制作方法
1.本发明属于生物技术领域,具体内容涉及一种新型里氏木霉异源蛋白表达系统的构建及其应用。
背景技术:
2.里氏木霉(trichoderma reesei)是一种嗜温腐生丝状真菌,其生产的纤维素酶占全球90%以上的市场份额,被广泛应用于食品、纺织、饲料以及生物能源等领域。作为fda认证的安全菌株,里氏木霉强大的蛋白合成、分泌能力、突出的工业发酵性能以及类似高等真核生物的翻译修饰系统,使其成为理想的生产重组蛋白的细胞工厂。
3.蛋白质生产的调控首先发生在转录水平上,利用强启动子驱动基因表达是提高异源蛋白产量的主要策略之一,同时,建立与之适配的培养条件是实现异源蛋白高产的关键。里氏木霉中可用于重组蛋白表达的启动子极少,纤维二糖水解酶cbhi,由单拷贝基因编码,至少占胞外蛋白分泌量的50%,pcbh1因而成为最常用的强启动子。pcbh1的强度受碳源种类、ph值等影响较大,在实际应用中存在很大局限性,蛋白特别是非真菌来源蛋白,产量常常低于内源蛋白甚至无法表达或分泌到胞外。目前,木霉细胞工厂生产异源蛋白的潜力尚未真正发挥出来,非常有必要开发新的表达元件及其最佳发酵条件,弥补现有表达系统的不足。
技术实现要素:
4.在里氏木霉前期转录组测序中,发明人发现一个基因(将其命名为dcl)在不同碳源(如纤维素、葡萄糖、乳糖)条件下的转录水平高于或与cbh1相当,pdcl极有可能是与pcbh1相媲美的强启动子。在本发明中,发明人利用启动子pdcl构建了里氏木霉异源蛋白表达系统,以难分泌的实际定位于细胞质的红色荧光蛋白rfp为报告系统,建立了适合其高效分泌的培养条件,发现其在多种碳源培养条件下,胞内及胞外蛋白的生产均能达到较好的效果,这为利用里氏木霉高效生产异源蛋白提供了新的方法和手段。
5.本发明的第一个目的是提供一种里氏木霉异源蛋白表达系统,所述系统由dcl的启动子、dcl的信号肽、cbh2终止子及异源蛋白组成。
6.在一种实施方式中,所述dcl的启动子、dcl的信号肽、cbh2终止子的序列分别如seq id no.1、seq id no.2、seq id no.3所示。
7.在一种实施方式中,在异源蛋白的编码基因前连接dcl的信号肽并利用dcl的启动子启动异源蛋白的表达。
8.本发明的第二个目的是提供含有所述里氏木霉异源蛋白表达系统的质粒。
9.在一种实施方式中,按照dcl的启动子、dcl的信号肽、异源蛋白编码基因、cbh2终止子的顺序整合至出发质粒上,以启动和终止异源蛋白的表达。
10.在一种实施方式中,以peasy-blunt t simple质粒为出发质粒,构建重组质粒。
11.本发明的第三个目的是提供含有所述质粒的重组微生物细胞。
12.在一种实施方式中,以里氏木霉tu6作为出发菌株。
13.本发明的第四个目的是提供利用所述里氏木霉异源蛋白表达系统生产异源蛋白的方法,所述方法步骤为:
14.(1)构建含有所述里氏木霉异源蛋白表达系统的重组质粒;
15.(2)将重组质粒导入里氏木霉中构建得到重组里氏木霉;
16.(3)将重组里氏木霉在含有葡萄糖的mm基础培养基的反应体系中培养,所述反应体系中还含有纤维素、玉米芯、麸皮或麸皮浸提液。
17.在一种实施方式中,所述异源蛋白包括但不限于红色荧光蛋白。
18.在一种实施方式中,以尿嘧啶缺陷型菌株里氏木霉tu6作为出发菌株。
19.在一种实施方式中,所述重组质粒上还表达pyr4基因,以pyr4基因作为筛选标记,获得阳性转化子。
20.在一种实施方式中,所述pyr4基因的核苷酸序列如seq id no.4所示。
21.在一种实施方式中,所述mm基础培养基中的葡萄糖含量为2%(w/v)。
22.优选地,所述反应体系中含有玉米芯、麸皮或麸皮浸提液。
23.更优选地,所述玉米芯的含量为5%(w/v),所述麸皮的含量为3%(w/v),所述麸皮浸提液的浓度为3%。
24.在一种实施方式中,将所述重组里氏木霉接种至含有葡萄糖的mm培养基中在25~32℃,150~250rpm预培养40~50h,将得到的培养液转接至含有玉米芯、麸皮或麸皮浸提液的mm培养基中,在25~32℃,150~250rpm发酵120~144h。
25.优选地,所述mm培养基的ph 5.1~5.3。
26.本发明的第五个目的是提供所述里氏木霉表达系统或含有里氏木霉的重组质粒在表达异源蛋白中的应用。
27.在一种实施方式中,所述异源蛋白包括但不限于红色荧光蛋白、绿色荧光蛋白等能够在里氏木霉中表达的蛋白。
28.本发明的有益效果:
29.本发明利用里氏木霉基因dcl的启动子和信号肽构建了适用于里氏木霉异源蛋白表达的重组菌株,实现了蛋白的高效表达。将菌株在mm基础培养基+5%玉米芯中培养,胞外蛋白的表达强度是cbh表达系统的1.38倍,并且mm基础培养基+3%麸皮(ph 5.1~5.3)或mm基础培养基+3%麸皮浸提液(ph 5.1~5.3)均能使dcl表达系统在胞内外表达异源蛋白rfp,且mm基础培养基+3%麸皮浸提液(ph 5.1~5.3)为全液体培养基,更适于规模化的生产,同时可将蛋白直接分泌到胞外,简化了异源蛋白的分离纯化,有利于异源蛋白的工业化生产。
附图说明
30.图1为不包含目标基因的dcl系统载体骨架质粒图谱。
31.图2为不包含目标基因的cbh1系统载体骨架质粒图谱。
32.图3为两种系统中rfp表达质粒的构建示意图。
33.图4为dcl-rfp阳性转化子的pcr鉴定电泳图;1:dcl-rfp-1,2:dcl-rfp-2,3:dcl-rfp-3,4:dcl-rfp-4。
34.图5为cbh1-rfp阳性转化子的pcr鉴定;1:cbh1-rfp-1;2:cbh1-rfp-2;3:cbh1-rfp-3;4:cbh1-rfp-4;5:cbh1-rfp-5。
35.图6为dcl-rfp阳性转化子在纤维素诱导下胞内外蛋白的sds-page分析;1:dcl-rfp-1,2:dcl-rfp-2,3:dcl-rfp-3,4:dcl-rfp-4,5:出发菌株tu6。
36.图7为cbh1-rfp阳性转化子在纤维素诱导下胞内外蛋白的sds-page分析;1:出发菌株tu6,2:cbh1-rfp-1,3:cbh1-rfp-2,4:cbh1-rfp-3,5:cbh1-rfp-4,6:cbh1-rfp-5。
37.图8为两种重组菌株在不同培养基条件下发酵结果的sds-page分析及rfp相对荧光强度;1:dcl-rfp-4,2:cbh1-rfp-1,3:出发菌株tu6。
38.图9为在mm基础培养基+3%麸皮浸提液条件下发酵结果的sds-page分析及rfp相对荧光强度;1:dcl-rfp-4,2:cbh1-rfp-1,3:出发菌株tu6。
具体实施方式
39.1.菌株和质粒
40.大肠杆菌escherichia coli strain trans1-t1(购自北京全式金生物技术有限公司)用作重组质粒的构建。
41.里氏木霉tu-6菌株为尿嘧啶缺陷型菌株(公开于improved production of heterologous lipase in trichoderma reesei by rnai mediated gene silencing of an endogenic highly expressed gene,公开于2012年),作为宿主表达异源蛋白。
42.高保真fastpfu购自北京全式金生物技术有限公司。
43.以质粒peasy-blunt t simple购自北京全式金生物技术有限公司,以其为骨架分别构建dcl表达系统质粒pdcl-ssdcl-rfp以及cbh1表达系统质粒pcbh1-sscbh1-rfp。
44.红色荧光蛋白基因(genbank:ab830533.1)由南京金斯瑞生物科技有限公司合成。
45.无缝拼接试剂盒购自南京诺唯赞生物科技股份有限公司。
[0046]2×
master mix(dye plus)购自南京诺唯赞生物科技股份有限公司。
[0047]
2.培养基
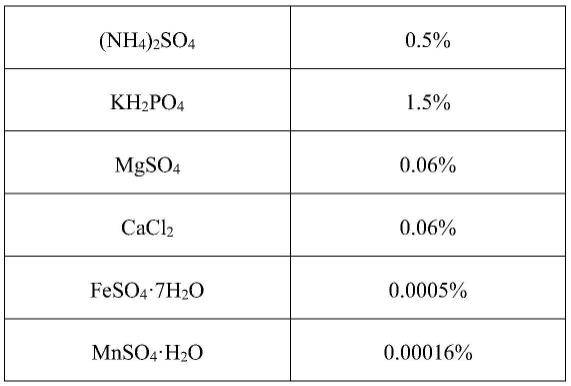
[0048]
(1)pda培养基
[0049]
葡萄糖20g马铃薯200g琼脂粉20g
[0050]
去离子水定容至1l,自然ph,115℃,20min高压蒸汽灭菌。
[0051]
(2)lb培养基
[0052]
蛋白胨1%氯化钠1%酵母提取物0.5%
[0053]
自然ph,121℃,20min高压蒸汽灭菌。
[0054]
(3)里氏木霉的基础培养基(简称:mm培养基)
[0055][0056][0057]
调ph 5.3,121℃,20min高压蒸汽灭菌。
[0058]
(4)发酵培养基
[0059]
a)mm基础培养基+1%(w/v)纤维素,ph 5.1~5.3;
[0060]
b)mm基础培养基+5%(w/v)玉米芯,ph 5.1~5.3;
[0061]
c)mm基础培养基+3%(w/v)麸皮,ph 5.1~5.3;
[0062]
d)mm基础培养基+1%(w/v)纤维素+5%(w/v)玉米芯+3%(w/v)麸皮,ph 5.1~5.3;
[0063]
e)mm基础培养基+3%(v/v)麸皮浸提液,ph 5.1~5.3;其中,称30g麸皮加入1l ddh2o,煮沸20min后双层纱布过滤,下层滤液即为3%麸皮浸提液;将mm基础培养基溶解于3%的麸皮浸提液中。
[0064]
3.主要仪器及试剂
[0065]
ctab植物基因组dna快速提取试剂盒(品牌:aidlab/艾德莱,货号:dn1402)用于提取里氏木霉的基因组。
[0066]
多功能荧光读板仪(品牌:synergy h4)用于检测rfp的荧光强度。
[0067]
4.里氏木霉的电转化
[0068]
(1)使用快速质粒小提试剂盒(购自天根生化科技(北京)有限公司)大量提取cbh1-rfp质粒以及dcl-rfp,随后用真空离心浓缩仪将质粒浓缩至ug/ul级别,-20℃保存备用;
[0069]
(2)取新鲜培养的培养皿(d=35mm)上的里氏木霉tu6孢子(每个转化用2~3个培养皿),使用1.1m山梨醇(amresco)洗涤孢子制成孢子悬液,200目细胞筛(d=50mm)过滤除去残余的菌丝;
[0070]
(3)将孢子液移至无菌离心管中,3000g,4℃离心5min,弃去上清;
[0071]
(4)用1.1m预冷的山梨醇洗涤孢子,3000g,4℃离心5min,弃去上清;
[0072]
(5)重复步骤(4)两次;
[0073]
(6)用100ul 1.1m预冷的山梨醇重悬孢子,冰上放置30min;
[0074]
(7)打开电转仪,设置电转参数为:1.8kv,800ω,25uf;
[0075]
(8)将质粒加入到上述孢子液中(质粒样品的体积不得超过20ul),轻轻混匀,随后将孢子液转移至预冷的电转杯中,进行电击;
[0076]
(9)电击结束后立即加入900ul预冷的1.1m山梨醇溶液,轻轻混匀,冰上放置;
[0077]
(10)用1.1m山梨醇溶液将10
×
yepd稀释10倍,取5ml稀释后的yepd(1
×
)加入到电转后的孢子液中,30℃孵育过夜;
[0078]
(11)取适量孢子液涂布于mm+2%葡萄糖+1.1m山梨醇+0.1%tritonx-100平板上,28℃培养。
[0079]
5.转化子的鉴定与发酵
[0080]
待转化子长出后,利用universall组织dna萃取缓冲液(购自北京伊诺凯科技有限公司)粗提转化子的基因组,粗提步骤如下:
[0081]
(1)挑取少量菌丝于25ul萃取缓冲液内,涡旋5s;
[0082]
(2)95~98℃加热10min;
[0083]
(3)再次涡旋5s后离心10s;
[0084]
(4)-20℃保存备用。
[0085]
以粗提体系中的上清为模板,利用表3中的引物对,通过pcr鉴定rfp表达盒是否成功整合到基因组上,所用酶为2
×
master mix(dye plus)(购自南京诺唯赞生物科技股份有限公司),扩增条件为:95℃预变性5min;95℃变性30s,58℃退火30s,72℃延伸1min,30个循环;最后72℃扩展延伸5min。
[0086]
挑取阳性转化子,转接至pda平板上,培养7-9天,待孢子成熟后,刮取少量孢子接种于mm培养基+2%葡萄糖,在28℃、200rpm条件下预培养48h后,转接于mm基础培养基+1%纤维素(ph5.1~5.3),28℃,200rpm培养5~6天,sds-page分析胞内、胞外蛋白表达情况。
[0087]
表1.dcl系统载体骨架质粒构建所需的引物
[0088][0089]
表2.cbh1系统载体骨架质粒构建所需的引物
[0090]
[0091]
表3.转化子鉴定所用到的引物
[0092][0093]
实施例一:表达载体的构建
[0094]
1、dcl表达系统的构建
[0095]
具体为含有dcl启动子、信号肽、cbh2终止子以及pyr4基因等元件的表达质粒构建:
[0096]
(1)里氏木霉tu6基因组dna的制备
[0097]
a)里氏木霉tu6孢子液接种至mm基础培养基+2%葡萄糖,30℃培养48h后,收集菌丝体至2ml离心管中最大转速离心10min,倒掉上清;
[0098]
b)使用研钵将菌丝充分捣碎,捣至均匀匀浆状;
[0099]
c)使用ctab植物基因组dna快速提取试剂盒提取里氏木霉tu6菌株的基因组;
[0100]
d)提取的基因组dna-20℃保存备用。
[0101]
(2)通过表1中的引物对,以里氏木霉tu6基因组为模板,分别扩增dcl启动子和信号肽、cbh2终止子、筛选基因pyr4序列;以peasy-blunt t simple质粒为模板,扩增表达载体骨架,所用酶为高保真fastpfu,扩增条件为:95℃预变性5min;95℃变性30s,56℃退火30s,72℃延伸2min,30个循环;最后72℃扩展延伸10min。通过不同片段之间的overlap(表1中下划线处),使用无缝拼接试剂盒将dcl启动子信号肽、cbh2终止子、筛选基因pyr4与peasy-blunt t simple骨架片段进行连接,获得不包含异源基因的dcl表达载体骨架质粒(图1)。
[0102]
2、cbh1表达系统的构建
[0103]
具体为含有cbh1启动子信号肽和cbh2终止子以及pyr4基因等元件的载体骨架质粒的制备:
[0104]
通过表2中的引物对,以里氏木霉tu6基因组为模板,扩增cbh1启动子信号肽,以上述构建的dcl表达骨架质粒为模板,扩增载体骨架片段,所用酶为高保真fastpfu,扩增条件为:95℃预变性5min;95℃变性30s,56℃退火30s,72℃延伸4min,30个循环;最后72℃扩展延伸10min。通过片段之间的overlap(下划线处),使用无缝拼接试剂盒将dcl表达骨架质粒中的dcl启动子信号肽替换为cbh1启动子信号肽,获得不包含目标基因的cbh1系统载体骨架质粒(图2)。
[0105]
3、基于两种表达系统的rfp表达质粒的构建
[0106]
将合成的rfp基因分别插入在dcl表达骨架质粒内dcl启动子信号肽、cbh1表达骨架质粒内cbh1启动子信号肽的后面,分别获得dcl表达系统中的rfp表达质粒dcl-rfp(图3b)以及cbh1表达系统中的rfp表达质粒ch1-rfp(图3a)。
[0107]
实施例二:重组菌株的构建与蛋白的发酵
[0108]
1、将实施例一种构建得到的表达质粒dcl-rfp和ch1-rfp分别转化至里氏木霉中,待转化子长出后,利用universall组织dna萃取缓冲液(购自北京伊诺凯科技有限公司)粗
提转化子的基因组,粗提步骤如下:
[0109]
(1)挑取少量菌丝于25ul萃取缓冲液内,涡旋5s;
[0110]
(2)95~98℃加热10min;
[0111]
(3)再次涡旋5s后离心10s取上清;
[0112]
(4)-20℃保存备用。
[0113]
以粗提体系中的上清为模板,利用表3中的引物对,通过pcr鉴定rfp表达盒是否成功整合到基因组上,所用酶为2
×
master mix(dye plus),扩增条件为:95℃预变性5min;95℃变性30s,58℃退火30s,72℃延伸1min,30个循环;最后72℃扩展延伸5min。
[0114]
对于dcl表达系统,经电转化法共获得23个转化子,其中4个转化子的表达框序列正确(图4),分别命名为:dcl-rfp-1~4。
[0115]
对于cbh1表达系统,经电转化法共获得55个转化子,通过pcr克隆及测序鉴定rfp表达框,结果发现,共有5个转化子的表达框序列无误(图5),分别命名为:cbh1-rfp-1~5。
[0116]
2、利用sds-page分析胞内、胞外蛋白表达情况:
[0117]
对于dcl表达系统,将鉴定得到的4个阳性转化子接种于mm培养基+2%葡萄糖,在28℃、200rpm条件下预培养48h后,转接于mm基础培养基+1%纤维素(ph5.1~5.3),28℃,200rpm培养5~6天,胞外发酵液离心取上清即为胞外蛋白,同时菌丝破碎获得胞内蛋白,胞内外蛋白进行sds-page蛋白分析。结果如图6所示,dcl-rfp-1,2,4成功发酵出rfp(箭头处)。从sds-page胶图分析可知,转化子dcl-rfp-4发酵的目标蛋白量最大,因此,接下来的实验主要使用转化子dcl-rfp-4。
[0118]
对于cbh1表达系统获得的5个阳性转化子接种于50ml以葡萄糖(2%,w/v)为唯一碳源的mm培养基,28℃,200rpm预培养48h后转接于以纤维素(1%,w/v)为唯一碳源的mm培养基(ph 5.1~5.3),28℃,200rpm发酵5~6天,胞外发酵液离心取上清即为胞外蛋白,发酵菌丝破碎后获得胞内蛋白,对胞内外蛋白分别进行sds-page蛋白分析。结果(图7)发现,rfp可以在cbh1表达系统的胞内很好的表达(箭头处),但并不能将其分泌至胞外。根据sds-page胶图分析可知,cbh1-rfp-1转化子的发酵结果最好,因此,接下来的实验主要使用cbh1-rfp-1。
[0119]
纤维素诱导条件下的发酵结果表明,与cbh1表达系统相比,dcl表达系统也可以成功表达rfp,且表达强度与cbh1表达系统的强度相当。因此,dcl表达系统也可以作为一个里氏木霉表达异源基因的选择。
[0120]
实施例三:最适培养条件的选择
[0121]
本实施例根据mm基础培养基+1%纤维素(ph5.1~5.3)的发酵结果,选择cbh1-rfp-1和dcl-rfp-4两个菌株,分别使用mm基础培养基+1%纤维素,ph 5.1~5.3;mm基础培养基+5%玉米芯,ph 5.1~5.3;mm基础培养基+3%麸皮,ph 5.1~5.3;mm基础培养基+1%纤维素+5%玉米芯+3%麸皮,ph 5.1~5.3;mm基础培养基+3%麸皮浸提液,ph 5.1~5.3;1.5%玉米浆+1%纤维素,ph 5.1~5.3等培养基发酵,根据胞外蛋白的表达量及rfp的相对荧光强度,选出适合于dcl表达系统的最优培养基。
[0122]
为了探索最适用于dcl表达系统的发酵条件,将dcl-rfp-4、cbh1-rfp-1两种重组菌株接种于50ml以葡萄糖(2%,w/v)为唯一碳源的mm培养基,28℃,200rpm预培养48h后分别转接于mm基础培养基+1%纤维素、mm基础培养基+5%玉米芯、mm基础培养基+3%麸皮、mm
基础培养基+1%纤维素+5%玉米芯+3%麸皮、mm基础培养基+3%麸皮浸提液和1.5%玉米浆+1%纤维素培养基中(ph 5.1~5.3),在28℃,200rpm发酵120h,利用sds-page分析两株重组菌的胞内外蛋白表达情况,同时检测rfp的荧光强度。
[0123]
结果如图8所示:
[0124]
在mm基础培养基+5%玉米芯中,dcl表达系统的胞外rfp荧光强度是cbh表达系统的1.38倍,适于目的蛋白的胞外表达;
[0125]
在mm基础培养基+3%麸皮中,dcl表达系统胞外rfp荧光强度是cbh表达系统的7.39倍,胞内rfp荧光强度是cbh表达系统的4.12倍;
[0126]
在mm基础培养基+3%麸皮浸提液(全液体培养基)条件下,dcl表达系统也能很好地在胞内外表达目的蛋白,其胞外rfp荧光强度是cbh表达系统的19.96倍,胞内rfp荧光强度是cbh表达系统的16.65倍。
[0127]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1