一种哈茨木霉QT20724及其应用的制作方法
一种哈茨木霉qt20724及其应用
技术领域
1.本发明涉及微生物的技术领域,具体涉及一种哈茨木霉qt20724及其应用。
背景技术:
2.连作障碍是制约经济作物产量的主要因素,而自毒物质是引起连作障碍的主要因素之一。研究表明,香草酸类物质是植物根系分泌的主要自毒性物质,能破坏细胞膜功能,影响光合和呼吸作用,使根系微生物区系失衡,抑制作物生长,刺激病原微生物生长,大幅度提高作物发病率,导致严重经济损失。
3.香草酸是地黄、三七、西洋参、花生等多种经济作物根际的主要酚酸类物质,随种植年限增加而累积,对作物的出苗率,幼苗生长,生长期病害等都有一定的影响。据报道,目前已经采取土壤消毒,轮作,种植抗性品种,合理施肥,接种微生物等方法缓解香草酸类物质造成的连作障碍。在众多措施中,利用微生物分解土壤中的香草酸类物质,从而降低香草酸含量,缓解其对作物的自毒作用,是一种有效途径。且微生物降解廉价高效,绿色环保,具有广阔的应用前景。因此,筛选一种高效降解香草酸菌株并应用于连作障碍土壤修复,具有重要的现实意义。
技术实现要素:
4.为了克服现有技术存在的上述不足,本发明提供一种降解香草酸的哈茨木霉及其应用。本发明的哈茨木霉qt20724能够高效地降解香草酸,有效缓解香草酸类物质对植物的自毒作用。
5.一种哈茨木霉(trichoderma harzianum)qt20724,其在中国微生物菌种保藏管理委员会普通微生物中心的保藏编号为cgmcc no.21034,保藏日期为2020年12月08日,保藏机构地址:北京市朝阳区北辰西路1号院3号。
6.一种含哈茨木霉qt20724的孢子悬液的制备方法,所述方法包括将哈茨木霉qt20724菌株接种到pda平板上,放置于25℃培养箱中生长4-5天,刮取一个平板的孢子,加入无菌水中后,过4层无菌镜头纸,所得滤液即为孢子悬液。
7.一种哈茨木霉qt20724的筛选方法,具体筛选方法如下:配置香草酸液体培养基,将液体培养基分装入试管中,高压灭菌,将活化的待测菌株制备成孢子悬液,血球计数板计数后,取1
×
105个孢子接入到香草酸液体培养基中,设不接菌的培养液为对照,置于25℃、150rpm摇床中培养3d;培养结束后,取1ml 培养液,10000g 离心2min,再取上清200 ml加入10 ml 0.1%的溴甲酚绿进行显色,根据溶液颜色的深浅,筛选降解率高的菌株,其中菌株qt20724显色最深,为深蓝色。
8.优选的,所述香草酸液体培养基的制备方法如下:取土豆200g,蒸馏水煮沸30min,纱布过滤后冷却定容至1l,得到土豆水;取土豆水50ml、蒸馏水950ml、香草酸400mg,混合均匀,配制成香草酸液体培养基。
9.一种哈茨木霉qt20724的应用,所述哈茨木霉qt20724用于降解香草酸。
10.一种含哈茨木霉qt20724的制剂在缓解香草酸对植物的自毒作用中的应用。
11.优选的,所述应用还包括在播种时,使用含哈茨木霉qt20724的孢子悬液对种子进行拌种或浸种处理。
12.一种含哈茨木霉qt20724的孢子悬液在修复香草酸引起的连作障碍土壤中的应用。
13.一种含哈茨木霉qt20724的孢子悬液在防治西洋参锈腐病防治方面的应用。
14.优选的,所述应用还包括使用以哈茨木霉qt20724为有效成分的制剂对植物移栽时进行蘸根处理。
15.本发明的有益效果为:本发明的哈茨木霉qt20724能够高效地降解香草酸,有效缓解香草酸对植物的自毒作用。该菌株在pdb培养基中,48h即可将浓度为400mg/l的香草酸完全降解;对土壤中的香草酸降解迅速,4天降解率达到52.94%,6天时降解率为94.23%,8天后完全降解。同时本发明的哈茨木霉qt20724对西洋参锈腐病有很好的防治效果,防效达到81.80%,明显好于生物农药青枯立克。
附图说明
16.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员而言,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
17.图1是本发明的哈茨木霉qt20724对pdb培养基中香草酸的降解趋势图。
18.图2是本发明的哈茨木霉qt20724对土壤中香草酸的降解趋势图。
19.图3是本发明实施例3中使用清水作为培养液对生菜发芽的生长图。
20.图4是本发明实施例3中使用哈茨木霉qt20724浸种后使用100mg/l的香草酸作为培养液,对生菜发芽的生长图。
21.图5是本发明实施例3中使用100mg/l的香草酸作为培养液对生菜发芽的生长图。
22.图6是本发明实施例4中哈茨木霉qt20724对毁灭柱孢菌的平板对峙结果图。
具体实施方式
23.为了使本技术领域的人员更好地理解本发明中的技术方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
24.实施例1哈茨木霉qt20724的筛选哈茨木霉(trichoderma harzianum)qt20724,已于2020年12月08日,保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址:北京市朝阳区北辰西路1号院3号,保藏编号为cgmcc no. 21034。该哈茨木霉的具体筛选方法如下:配置香草酸液体培养基,取土豆200g,蒸馏水煮沸30min,纱布过滤后冷却定容至
1l,得到土豆水;取土豆水50ml、蒸馏水950ml、香草酸400mg,混合均匀,配制成香草酸液体培养基。将液体培养基分装入试管中,高压灭菌,将活化的待测菌株制备成孢子悬液,血球计数板计数后,取1
×
105个孢子接入到香草酸液体培养基中,设不接菌的培养液为对照,置于25℃、150rpm摇床中培养3d;培养结束后,取1ml培养液,10000g离心2min,再取上清200ml加入10ml0.1%的溴甲酚绿进行显色,根据溶液颜色的深浅,筛选降解率高的菌株,其中菌株qt20724显色最深,为深蓝色。
25.实施例2哈茨木霉qt20724对香草酸的降解1.哈茨木霉qt20724对培养基中香草酸的降解1.1标准溶液的配制和标准曲线制作:用50%的甲醇做溶剂准确配制香草酸标准品,浓度分别为200、100、50、25、12.5、6.25、3.125mg/l,过0.22μm滤膜后用高效液相色谱仪进行测定,得香草酸浓度x与峰面积y的线性回归方程;1.2培养液中香草酸类物质含量的测定:制备pdb培养基(含香草酸浓度为400mg/l),将qt20724菌株按实施例1中的方法制备孢子悬液,接种到上述培养基中,不接菌的pdb培养基(含香草酸浓度400mg/l)为对照,25℃,150rpm振荡培养3d,接菌和对照各设三个重复,每隔8h取样一次。培养液离心,将上清液与甲醇1:1混合,取少量过0.22μm滤膜,用高效液相色谱仪检测香草酸的含量。
26.色谱条件:采用symmetryc18色谱柱(250mm
×
4.6mm,5μm),流动相为0.5%乙酸水溶液(a)和甲醇(b);流速0.7ml/min,柱温35℃,进样体积10μl,检测波长280nm;洗脱液:a:b=60:40,洗脱时间15min。
27.1.3结果:根据香草酸标准溶液的线性回归方程,计算培养液种香草酸的残留量,并根据公式:降解率(%)=(对照浓度-处理浓度)/对照浓度
×
100%计算香草酸的降解率。
28.分析结果表明,菌株qt20724在培养液中对香草酸降解迅速,48h内对400mg/l的香草酸完全降解,详见图1。
29.2.哈茨木霉qt20724对土壤中香草酸的降解2.1人工香草酸土壤处理:土壤过2mm筛后自然风干,121℃灭菌三次,每次1h,按100g/瓶放入组培瓶中,加入香草酸溶液,使其浓度都为400mg/g干土。按实施例1中的方法制备qt20724的孢子悬液,接入土壤中,使土壤中孢子浓度为6.25
×
105cfu/g干土,不接菌的香草酸土壤作为对照,土壤湿度为30%,透气膜封口,放入25℃培养箱中进行暗培养,每隔2d取样一次,检测土壤中香草酸的残留量。
30.2.2土壤中香草酸的提取:土样5g(干土重),加1mol/l的naoh溶液8ml,25℃,200rpm震荡提取12h,10000g离心20min,上清转移至新的离心管,用3mol/l的hcl调整溶液ph至2.5,用5ml乙酸乙酯萃取三次,合并萃取液,旋蒸(40℃)后,残渣用2ml80%甲醇溶解定容。
31.2.3土壤中香草酸含量的测定:上述提取液过0.22μm滤膜后用高效液相色谱仪进行测定,测定方法同液体降解,降解率计算公式:降解率(%)=(对照浓度—处理浓度)/对照浓度
×
100%2.4结果:哈茨木霉qt20724对土壤中的香草酸降解迅速,4天降解率达到52.94%,
6天时降解率为94.23%,8天后完全降解,详见图2。
32.实施例3哈茨木霉qt20724缓解香草酸对植物自毒作用的检测试验以生菜为研究对象,设置以下处理:清水对照组ck,香草酸对照组pa(100mg/l的香草酸),哈茨木霉处理组t(哈茨木霉qt20724+100mg/l的香草酸)。从平板刮取哈茨木霉qt20724的分生孢子,悬浮于无菌生理盐水中,经无菌镜头纸过滤后,得孢子悬液,血球计数板计数后,调整孢子悬液浓度为5.0
×
10
5 cfu/ml。哈茨木霉处理组用孢子悬液对生菜浸种30min,清水对照组和香草酸处理组用无菌水浸种,浸种后放于内置2层无菌滤纸的培养皿中,30粒/皿,每个处理四个重复,不同处理每皿各加溶液6ml。放于25℃光照培养箱中,2天统计发芽率,7天后查看根生长情况并统计芽长、根长及幼苗鲜重,结果见表1,各处理对生菜根生长的影响见图3-5。
33.表1-哈茨木霉qt20724对生菜幼苗香草酸自毒作用的缓解效果注:不同小写字母表示在0.05水平上的差异。
34.由表1可以看出,香草酸对生菜的出芽没有影响,但对幼苗的生长有严重影响。与清水对照相比较,香草酸处理的幼苗芽长、根长及生物量都有显著差异,且根毛显著增多;经哈茨木霉处理后,其幼苗的芽长、根长及生物量都与清水对照无差异,且根的生长恢复正常。
35.实施例4哈茨木霉qt20724对西洋参锈腐病病原菌-毁灭柱孢菌的平板对峙试验pda平板直径两端距中心35mm处分别接直径5mm的哈茨木霉菌株qt20724和病原真菌,以只接病原真菌的平板为空白对照,25℃培养5-7d,记录病原真菌对峙方向生长半径,计算抑制率(%)。
36.抑制率(%)=(对照病原菌生长半径-处理病原菌生长半径)/对照病原菌生长半径
×
100%。
37.如图6所示,哈茨木霉qt20724生长3天后能越过病原真菌,并在其上生长产孢,最后覆盖病原真菌,对毁灭柱孢菌平板抑制率6天为99.14%。qt20724对毁灭柱孢菌的平板抑制效果较好。
38.实施例5哈茨木霉qt20724对西洋参锈腐病的防治试验盆栽试验:选取长势接近的2年生无病西洋参苗(取自山东省荣成市虎山镇西洋参示范区),用哈茨木霉qt20724制剂的100倍稀释液进行蘸根(制剂有效孢子≥2亿/克)处理,栽种于花盆中,缓苗后采用伤根灌注法,在西洋参苗的伤根部位浇灌1ml 的毁灭柱孢菌孢子液(浓度为1.0
×
10
5 cfu /ml)。药剂对照和空白对照不用哈茨木霉蘸根,分别用青枯立
克150倍液和清水进行浇灌。以上各处理每盆4株,10盆为1个处理,每处理3次重复。放于人工气候室常规管理,接种病原菌50天后调查发病情况,计算病情指数和防治效果。西洋参锈腐病发病程度分级标准:0级,健康西洋参;1级,病斑占参根总面积25%以下;2级,病斑占参根总面积26%-50%;3级,病斑占参根总面积51%-75%;4级,病斑占参根总面积76% 以上或完全腐烂。
39.病情指数和防治效果分别按照下列公式计算病情指数 =[σ(各级病株数
×
各级代表值)/(调查总株数
×
最高级代表值)]
×
100防治效果(%)=[(对照病情指数-处理病情指数)/对照病情指数]
×
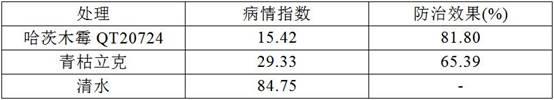
100结果先用microsoft office excel 2010进行数据统计,再用软件spss 26.0进行lsd方差分析。结果见表2:表2-哈茨木霉qt20724菌剂对西洋参锈腐病的防治效果由表2可以看出,哈茨木霉qt20724制剂对西洋参锈腐病有很好的防治效果,防效达到81.80%,明显好于生物农药青枯立克。
40.尽管通过参考附图并结合优选实施例的方式对本发明进行了详细描述,但本发明并不限于此。在不脱离本发明的精神和实质的前提下,本领域普通技术人员可以对本发明的实施例进行各种等效的修改或替换,而这些修改或替换都应在本发明的涵盖范围内/任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以权利要求所述的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1