一种红色电致变色聚合物材料、制备方法和应用与流程
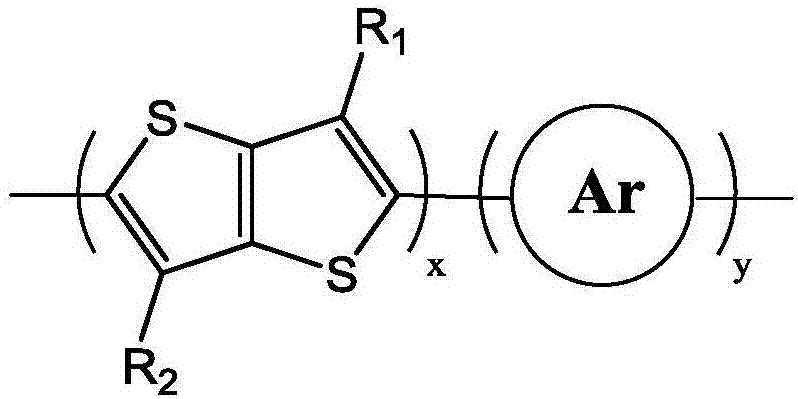
本发明属于有机光电材料器件,涉及一种红色电致变色聚合物材料、制备方法和应用。
背景技术:
:电致变色材料的特征是在外电压驱动下,其光学性能可发生可逆和持久稳固的变化,外观上表现为颜色变化。自上世纪80年代起,关于有机电致变色材料的报道大幅出现,有机电致变色材料易进行分子设计,颜色变化种类多、变色响应速度快,可加工制备成柔性器件,且价格便宜,有良好的应用前景。导电聚合物是一类重要的有机电致变色材料,这类材料具有较高的比容量、良好的导电性和柔性,且分子结构多样可调易得到丰富多彩的颜色。红色是三原色之一,性能优良的红色电致变色材料的缺失严重影响着这一领域的发展,开发红色的电致变色材料对实现电致变色的全色显示有重要意义。现有的红色电致变色材料,早期以聚噻吩类的为主,后也有多种类型的材料被研发,如edot、prodot与苯的衍生物共聚等,但这些材料大多数是通过电化学聚合而得,难以实现大面积的制备,亦或是颜色在红色光范围附近,不够接近纯红色。技术实现要素:本发明所要解决的技术问题是,提供一种红色电致变色聚合物材料、制备方法和应用,解决现有红色电致变色材料大多为电化学聚合而得,溶解度不佳,较难应用于柔性、大面积的电致变色器件制备及批量生产的问题。本发明为了解决上述问题,提供的技术方案之一为:提供一种红色电致变色聚合物材料,其分子结构式(如图1)为:其中,ar为苯、萘、蒽、菲、噻吩、硒吩、呋喃、吡咯、1,3-环戊二烯及它们的衍生物中的一种;r1,r2为-h、-ocnh2n+1、中的一种,1≤n≤50;1≤x≤50,1≤y≤50。在本发明提供的红色电致变色聚合物材料中,所述衍生物为在苯、萘、蒽、菲、噻吩、硒吩、呋喃、吡咯、1,3-环戊二烯上加以烷基链或者烷氧链。在本发明提供的红色电致变色聚合物材料中,所述烷基链或者烷氧链为直链或叉链。在本发明提供的红色电致变色聚合物材料中,对可见光的最大吸收波长落在490~540nm范围内。具体地,本发明将具有刚性共轭结构的并噻吩衍生物与杂原子芳环或其衍生物结合,从而调整带隙,使材料对可见光的最大吸收波长落在490~540nm范围内,以达到反射光为红色的目的。在主链上加以不同长度、形状的烷氧链作侧链,可以调节聚合物的溶解度,而其空间位阻以及氧原子和并噻吩上的硫原子的相互作用也可微调聚合物的能级。所列可能变化的结构中,ar部分可能的结构其能级在一个较小的波动范围内,所得材料颜色应落在红色范围内;而侧链的修饰是为了调节材料的溶解性,对能带结构有微调的作用。当r1,r2为-och3,ar部分为以下结构时,计算预测一个重复单元的能级结果为:ar苯对甲氧基苯噻吩硒吩呋喃吡咯带隙(ev)4.214.063.853.903.953.91虽带隙与聚合物有一定差距,但横向比较,数值波动范围不大。影响这一结果的因素可能有分子内的共轭数量,以及杂原子、侧链基团的吸电子或给电子能力对共轭长度、前线轨道配置的影响,所列可能结构的这些因素变化都不大。本发明还提供一种红色电致变色聚合物材料的制备方法,将单体1、单体2在催化剂的作用下进行聚合得到目标产物(如图2),过程如下所示:其中,单体1中a为-h或-br;单体2中b为-br或硼酸或硼酸酯或三烷基锡。在本发明提供的红色电致变色聚合物材料的制备方法中,具体包括如下三种方式:方法一为最后一步使用suzuki偶联聚合,具体包括以下步骤:a.将3,6-二甲氧基并噻吩与醇进行醚交换反应,将3,6-二甲氧基并噻吩与醇以及催化剂加入甲苯中,回流搅拌,待反应完全后,冷却至室温,倒入乙醇中,将沉淀过滤后溶解,加水萃取,合并有机相,除去有机溶剂,所得固体经纯化后得3,6-二烷氧基并噻吩;b.将步骤a所得产物3,6-二烷氧基并噻吩进行溴化,在有机溶剂中反应,反应完全后用有机溶剂中萃取,有机相经干燥、过滤后,除去有机溶剂,用柱层析法取得2,5-二溴-3,6-二烷氧基并噻吩;c.用硼酸酯取代ar芳香环上待偶联位点的氢原子,反应方法列举但不限于下述方法:以除水的四氢呋喃为溶剂,在-78℃下缓慢滴加正丁基锂,置于0℃下搅拌,再移至-78℃下加入异丙醇频哪醇硼酸酯(cas:61676-62-8),完成后置于室温搅拌,待反应完全后淬灭,用有机溶剂萃取,所得有机相经干燥、过滤,除去有机溶剂,用柱层析法获得产物为单体m2;e.suzuki偶联:将步骤b所得2,5-二溴-3,6-二烷氧基并噻吩(m1)以及步骤c所得单体m2溶解于有机溶剂中,同时加入除氧的碳酸盐水溶液,以及相转移催化剂,经除氧后,加入催化剂,加热反应,反应完全后冷却至室温,加水洗涤,有机溶剂萃取,合并有机相,浓缩后滴入甲醇中,将所得沉淀过滤,经索氏提取后得到终产物。上述方法一的制备方法如下所示:方法二为最后一步使用c-h直接偶联聚合,具体包括以下步骤:a.将3,6-二甲氧基并噻吩与醇进行醚交换反应,将3,6-二甲氧基并噻吩与醇以及催化剂加入甲苯中,回流搅拌,待反应完全后,冷却至室温,倒入乙醇中,将沉淀过滤后溶解,加水萃取,合并有机相,除去有机溶剂,所得固体经纯化后得3,6-二烷氧基并噻吩;b.用溴取代ar芳香环上待偶联位点的氢原子反应方法列举但不限于下述方法:在有机溶剂中溴化,在室温下反应,反应完全后用水和有机溶剂萃取,有机相用经干燥、过滤后,除去有机溶剂,用柱层析法取得产物为单体m4;c.c-h直接偶联:将步骤a所得产物3,6-二烷氧基并噻吩(m3)与步骤b所得单体m4溶于有机溶剂中,加入催化剂、配体以及碳酸盐,经除氧后,回流反应,反应完全后,将混合物滴入甲醇,过滤或离心得到沉淀物,经索氏提取得到最终产物。上述方法二的制备方法如下所示:方法三为最后一步使用stille偶联聚合,具体包括以下步骤:a.将3,6-二甲氧基并噻吩与醇进行醚交换反应,将3,6-二甲氧基并噻吩与醇以及催化剂加入甲苯中,回流搅拌,待反应完全后,冷却至室温,倒入乙醇中,将沉淀过滤后溶解,加水萃取,合并有机相,除去有机溶剂,所得固体经纯化后得3,6-二烷氧基并噻吩;b.将步骤a所得产物3,6-二烷氧基并噻吩进行溴化,在有机溶剂中反应,反应完全后用有机溶剂中萃取,有机相经干燥、过滤后,除去有机溶剂,用柱层析法取得2,5-二溴-3,6-二烷氧基并噻吩;c.用三烷基锡取代ar芳香环上待偶联位点的氢原子,反应方法列举但不限于下述方法:将反应物溶于干燥的有机溶剂,在-78℃下缓慢滴加正丁基锂,搅拌一段时间后,再加入三烷基氯化锡,完成后置于室温搅拌,待反应完全后加水猝灭,用有机溶剂萃取,所得有机相经干燥、过滤,除去有机溶剂,用柱层析法获得产物为单体m6;d.将步骤b所得2,5-二溴-3,6-二烷氧基并噻吩(m5)与步骤c所得单体m6加入有机溶剂中,通惰性气体后加入催化剂及催化剂配体,回流反应2~72小时,反应完全后冷却至室温,浓缩后滴入甲醇中沉淀,过滤后,经索氏提取得到最终产物。本发明还在于保护所述红色电致变色聚合物材料在用于制备包括但不限于电致变色装置的各种装置中的应用;进一步,本发明还在于保护含有所述红色电致变色聚合物材料的器件;器件优选为电致变色薄膜,所述电致变色薄膜可采用已有技术的任一种成膜方法制备得到,本发明优选成膜方法如下:将聚合物溶于氯仿溶液,使用喷涂装置(包含但不限于与空气压缩机连接的美工喷笔)喷涂聚合物溶液于镀有ito或fto的玻璃表面而形成电致变色薄膜。其中,聚合物的氯仿溶液浓度为1~5mg/ml。实施本发明,具有以下有益效果:本发明涉及的红色电致变色聚合物材料为基于并噻吩衍生物的一系列聚合物,该材料使用化学聚合而得,聚合物薄膜颜色可随施加电位不同而在红色和淡蓝色之间转变,具有稳定性良好、透过率高、响应速率较快、可溶液制备等特点,可以解决现有红色电致变色材料大多为电化学聚合而得,溶解度不佳,较难应用于柔性、大面积的电致变色器件制备及批量生产的问题。同时,所述材料红色纯度较高,而红色作为三原色之一,获得较纯红色的电致变色材料也势必推动电致变色全色显示的发展。附图说明为了更清楚地说明本发明实施例的技术方案,对实施例描述中所使用的附图作简单地介绍。附图中:图1为本发明所述红色电致变色聚合物材料分子结构式;图2为本发明所述红色电致变色聚合物材料制备方法示意图;图3为本发明实施例1中所述[3,6-二(十二烷氧基)并噻吩]-[2,5-二(甲氧基)苯]共聚物分子结构式;图4为本发明实施例2中所述聚合物薄膜的循环伏安曲线;图5为本发明实施例2中所述聚合物薄膜的原位吸收光谱;图6为本发明实施例2中所述聚合物薄膜在510nm处的透过率变化曲线;图7为本发明实施例2中所述聚合物薄膜的1500nm处的透过率变化曲线;图8为本发明实施例3中所述[3,6-二(十二烷氧基)并噻吩]-噻吩共聚物分子结构式;图9为本发明实施例4中所述聚合物薄膜的循环伏安曲线;图10为本发明实施例4中所述聚合物薄膜的原位吸收光谱;图11为本发明实施例5中所述[3,6-二(十二烷氧基)并噻吩]-[2,2’-联噻吩]共聚物分子结构式;图12为本发明实施例6中所述聚合物薄膜的循环伏安曲线;图13为本发明实施例6中所述聚合物薄膜的原位吸收光谱;图14为本发明实施例6中所述聚合物薄膜在538nm处的透过率变化曲线;图15为本发明实施例6中所述聚合物薄膜的1500nm处的透过率变化曲线;图16为本发明实施例7中[3,6-二(十二烷氧基)并噻吩]-苯共聚物分子结构式;图17为本发明实施例8中[3,6-二(4-己基-苯基)并噻吩]-苯共聚物分子结构式;图18为本发明实施例9中[3,6-二(4-己基-苯基)并噻吩]-噻吩共聚物分子结构式;具体实施方式下面将结合附图对本发明的实施例进行具体描述。实施例1ar为对甲氧基苯;n=12,r1,r2均为-oc12h25;x=y=1;所述聚合物为[3,6-二(十二烷氧基)并噻吩]-[2,5-二(甲氧基)苯]共聚物,其分子结构式为图3所示,其制备方法如下:a.将3,6-二甲氧基并噻吩(1.00g,5.0mmol)与正十二醇(3.73g,20.0mmol)以及硫酸氢钠(60.0mg,0.5mmol)加入甲苯(25.0ml)中,在110℃下回流搅拌15小时,待反应完全后,冷却至室温,倒入乙醇中,有沉淀出现,过滤后将滤饼溶于二氯甲烷,加水萃取,合并有机相,除去有机溶剂,所得淡蓝色晶体用氯仿和乙醇进行重结晶,得3,6-二(十二烷氧基)并噻吩(1.66g,产率65.4%);b.将步骤a所得产物3,6-二(十二烷氧基)并噻吩(1.02g,2.0mmol)用n-溴代丁二酰亚胺(nbs)(0.82g,4.6mmol)进行溴化,反应溶剂为氯仿,nbs被分两次加入,在室温下反应24小时,反应完全后用水和二氯甲烷萃取,有机相用硫酸钠干燥、过滤后,除去有机溶剂,用柱层析法取得2,5-二溴-3,6-二(十二烷氧基)并噻吩(0.99g,产率74.4%);c.将1,4-二醇-2,5二溴苯(8.04g,30.0mmol)、硫酸二甲酯(10.60g,84.0mmol)以及碳酸钾(20.70g,150.0mmol)加入丙酮(150.0ml)中,在65℃下回流8小时,反应完成后将混合物过滤,滤渣用乙酸乙酯洗涤,合并有机相,加水萃取,有机相经旋蒸移除有机溶剂,用柱层析方法取得白色固体产物,即1,4-二溴-2,5-二甲氧基苯(7.53g,产率84.8%);d.将1,4-二溴-2,5二甲氧基苯(2.96g,10.0mmol)加入除水的四氢呋喃(100.0ml)中,在-78℃下缓慢滴加正丁基锂(40.0mmol),置于0℃下搅拌1小时,再移至-78℃下加入异丙醇频哪醇硼酸酯(cas:61676-62-8)(7.44g,40.0mmol),完成后置于室温搅拌8小时,待反应完全后加入稀盐酸猝灭,用乙酸乙酯萃取,所得有机相用硫酸镁干燥、过滤,除去有机溶剂,用柱层析法获得白色固体产物,即2,5-二甲氧基苯-1,4-对苯二频哪醇硼酸酯(0.51g,产率13.1%);e.suzuki偶联:将步骤b所得2,5-二溴-3,6-二(十二烷氧基)并噻吩(0.67g,1.0mmol)以及步骤d所得2,5-二甲氧基苯-1,4-对苯二频哪醇硼酸酯(0.39g,1.0mmol)溶解于甲苯(10.0ml)中,通氮气除氧,同时加入除氧的碳酸钾水溶液(0.35g,2.5mmol,2mol/l),以及甲基三辛基氯化铵(aliquat336,即a336)(0.2g,0.5mmol),经通氮气后,加入催化剂pd(pph3)4(23.0mg,0.02mmol),加热至90℃反应72小时,反应完全后冷却至室温,加水洗涤,二氯甲烷萃取,合并有机相,浓缩后滴入甲醇中,将所得沉淀过滤,经索氏提取后得到终产物[3,6-二(十二烷氧基)并噻吩]-[2,5-二(甲氧基)苯]共聚物。实施例2:包含实施例1所述红色电致变色聚合物材料[3,6-二(十二烷氧基)并噻吩]-[2,5-二(甲氧基)苯]共聚物的组件,优选为电致变色薄膜。该电致变色薄膜可在红色和淡蓝色之间转化。聚合物的氧化电位为0.75v和1.2v,还原电位为0.6v和1.1v,最大吸收波长为510nm,该波长下透过率差为46%。本实施例所述聚合物薄膜的循环伏安曲线如图4所示,测试的对电极为pt丝,参比电极为ag丝,此图说明聚合物的氧化电位为0.75v和1.2v,还原电位为0.6v和1.1v。本实施例所述聚合物薄膜的原位吸收光谱如图5所示,图中为从0.0v至1.3v间不同电压下的吸收光谱,可见薄膜处于中性态时(施加电压0v)最大吸收波长为510nm,随着电压升高,该波长下的吸收减弱,而736nm处的吸收在0.9v下达到最大,当薄膜处于完全氧化状态时(施加电压1.3v)在1500nm处有最大吸收。这一系列的变化与薄膜的颜色变化可对应起来。中性态的吸收光谱截止波长为600.8nm,计算得其带隙为2.06ev。本实施例所述聚合物薄膜在中性态和氧化态下于510nm波长处的透过率变化示意图如图6所示,可见该条件下薄膜透过率变化量为46%,循环25圈以上薄膜仍稳定。本实施例所述聚合物薄膜在中性态和氧化态下于1500nm波长处的透过率变化示意图如图7所示,可见该条件下薄膜透过率变化量为47%。循环25圈以上薄膜仍稳定。实施例3ar为噻吩;n=12,r1,r2均为-oc12h25;x=y=1;所述聚合物为[3,6-二(十二烷氧基)并噻吩]-噻吩共聚物,其分子结构式为图8所示,其制备方法如下:a.将3,6-二甲氧基并噻吩(1.00g,5.0mmol)与正十二醇(3.73g,20.0mmol)以及硫酸氢钠(60.0mg,0.5mmol)加入甲苯(25.0ml)中,在110℃下回流搅拌15小时,待反应完全后,冷却至室温,倒入乙醇中,有沉淀出现,过滤后将滤饼溶于二氯甲烷,加水萃取,合并有机相,除去有机溶剂,所得淡蓝色晶体用氯仿和乙醇进行重结晶,得3,6-二(十二烷氧基)并噻吩(1.66g,产率65.4%);b.将步骤a所得产物3,6-二(十二烷氧基)并噻吩(1.02g,2.0mmol)用n-溴代丁二酰亚胺(nbs)(0.82g,4.6mmol)进行溴化,反应溶剂为氯仿,nbs被分两次加入,在室温下反应24小时,反应完全后用水和二氯甲烷萃取,有机相用硫酸钠干燥、过滤后,除去有机溶剂,用柱层析法取得2,5-二溴-3,6-二(十二烷氧基)并噻吩(0.99g,产率74.4%);c.将噻吩(1.68g,20.0mmol)溶解于四氢呋喃(100.0ml)中,在低温下滴加正丁基锂(44mmol),回流2小时,再加入三丁基氯化锡(14.32g,44.0mmol);反应12小时后,倒入100ml冷水中猝灭,分离有机层,水层用乙醚萃取,合并有机层,干燥、过滤后除去有机溶剂,经蒸馏后得到产物2,5-二(三丁基锡)噻吩;d.stille偶联:将步骤b所得产物2,5-二溴-3,6-二(十二烷氧基)并噻吩(0.22g,0.33mmol)与步骤d所得产物2,5-二(三丁基锡基)噻吩(0.22g,0.33mmol)溶于甲苯(5.0ml)中,通氮气10分钟后加入四(三苯基膦)钯,加热回流14小时,反应完全后滴入甲醇中,过滤得沉淀后进行索氏提取,得到最终产物[3,6-二(十二烷氧基)并噻吩]-噻吩共聚物。实施例4:包含实施例3所述红色电致变色聚合物材料[3,6-二(十二烷氧基)并噻吩]-噻吩共聚物的组件,优选为电致变色薄膜。该电致变色薄膜可在紫红色和淡蓝色之间转化。聚合物的氧化电位为0.63v,还原电位为0.42v,最大吸收波长为510nm。本实施例所述聚合物薄膜的循环伏安曲线如图9所示,测试的对电极为pt丝,参比电极为ag丝,此图说明聚合物的氧化电位为0.63v,还原电位为0.42v。本实施例所述聚合物薄膜的原位吸收光谱如图10所示,图中为从-0.2v至1.0v间不同电压下的吸收光谱,可见薄膜处于中性态时(施加电压-0.2v)最大吸收波长为510nm,随着电压升高,该波长下的吸收减弱,当薄膜处于完全氧化状态时(施加电压1.0v)在1302nm处有最大吸收。这一系列的变化与薄膜的颜色变化可对应起来。中性态的吸收光谱截止波长为652.8nm,计算得其带隙为1.90ev。实施例5ar为2,2’-联噻吩;n=12,r1,r2均为-oc12h25;x=y=1;所述聚合物为[3,6-二(十二烷氧基)并噻吩]-[2,2’-联噻吩]共聚物,其分子结构式为图11所示,其制备方法如下:a.将3,6-二甲氧基并噻吩(1.00g,5.0mmol)与正十二醇(3.73g,20.0mmol)以及硫酸氢钠(60.0mg,0.5mmol)加入甲苯(25.0ml)中,在110℃下回流搅拌15小时,待反应完全后,冷却至室温,倒入乙醇中,有沉淀出现,过滤后将滤饼溶于二氯甲烷,加水萃取,合并有机相,除去有机溶剂,所得淡蓝色晶体用氯仿和乙醇进行重结晶,得3,6-二(十二烷氧基)并噻吩(1.66g,产率65.4%);b.将2,2’-联噻吩(6.01g,36.1mmol)加入干燥的有机溶剂n,n-二甲基甲酰胺(dmf)(80ml)中,在0℃下缓慢加入n-溴代丁二酰亚胺(nbs)(12.8g,72.2mmol),然后在室温下反应24小时,反应完全后用水和有机溶剂萃取,有机相用经干燥、过滤后,除去有机溶剂,用柱层析法取得产物为5,5’-二溴-2,2’-联噻吩(4.20g,产率42.8%);c.c-h直接偶联:将步骤a所得产物3,6-二烷氧基并噻吩(0.15g,0.3mmol)与步骤b所得5,5’-二溴-2,2’-联噻吩(0.097g,0.3mmol)溶于n,n-二甲基乙酰胺(dmac)(10ml)中,加入醋酸钯(1.35mg,0.006mmol),特戊酸(9.18mg,0.09mmol)以及碳酸钾(82.9mg,0.6mmol),通氮气40分钟后,置于140℃下搅拌24小时,反应完全后,将混合物滴入甲醇,过滤得到沉淀物,经索氏提取得到最终产物[3,6-二(十二烷氧基)并噻吩]-[2,2’-联噻吩]共聚物。实施例6:包含实施例5所述红色电致变色聚合物材料[3,6-二(十二烷氧基)并噻吩]-[2,2’-联噻吩]共聚物的组件,优选为电致变色薄膜。该电致变色薄膜可在紫红色和淡蓝色之间转化。聚合物的氧化电位为0.56v和0.77v,还原电位为0.53v和0.86v,最大吸收波长为538nm。本实施例所述聚合物薄膜的循环伏安曲线如图12所示,测试的对电极为pt丝,参比电极为ag丝,此图说明聚合物的氧化电位为0.56v和0.77v,还原电位为0.53v和0.86v。本实施例所述聚合物薄膜的原位吸收光谱如图13所示,图中为从-0.2v至1.0v间不同电压下的吸收光谱,可见薄膜处于中性态时(施加电压-0.2v)最大吸收波长为538nm,随着电压升高,该波长下的吸收减弱,当薄膜处于完全氧化状态时(施加电压1.0v)在1500nm处有最大吸收。这一系列的变化与薄膜的颜色变化可对应起来。中性态的吸收光谱截止波长为672.8nm,计算得其带隙为1.84ev。本实施例所述聚合物薄膜在中性态和氧化态下于538nm波长处的透过率变化示意图如图14所示,可见该条件下薄膜透过率变化量为29%,循环15圈以上薄膜仍稳定。本实施例所述聚合物薄膜在中性态和氧化态下于1500nm波长处的透过率变化示意图如图15所示,可见该条件下薄膜透过率变化量为54%。循环15圈以上薄膜仍稳定。实施例7:ar为苯;n=12,r1,r2均为-oc12h25;x=y=1;所述聚合物为[3,6-二(十二烷氧基)并噻吩]-苯共聚物,其分子结构式为图16所示,其制备方法如下:a.将3,6-二甲氧基并噻吩(1.00g,5.0mmol)与正十二醇(3.73g,20.0mmol)以及硫酸氢钠(60.0mg,0.5mmol)加入甲苯(25.0ml)中,在110℃下回流搅拌15小时,待反应完全后,冷却至室温,倒入乙醇中,有沉淀出现,过滤后将滤饼溶于二氯甲烷,加水萃取,合并有机相,除去有机溶剂,所得淡蓝色晶体用氯仿和乙醇进行重结晶,得3,6-二(十二烷氧基)并噻吩(1.66g,产率65.4%);b.将步骤a所得产物3,6-二(十二烷氧基)并噻吩(1.02g,2.0mmol)用n-溴代丁二酰亚胺(nbs)(0.82g,4.6mmol)进行溴化,反应溶剂为氯仿,nbs被分两次加入,在室温下反应24小时,反应完全后用水和二氯甲烷萃取,有机相用硫酸钠干燥、过滤后,除去有机溶剂,用柱层析法取得2,5-二溴-3,6-二(十二烷氧基)并噻吩(0.99g,产率74.4%);c.将对二溴苯(4.70g,20.0mmol)、联硼酸频哪醇酯(cas:73183-34-3)(12.1g,47.8mmol)、醋酸钾(5.9g,60.0mmol)加入n,n-二甲基甲酰胺(dmf)(200.0ml)中,除氧后,加入钯催化剂,在80℃下回流2小时,反应完成后,用二氯甲烷和水萃取,有机相经旋蒸移除有机溶剂,用柱层析方法取得白色固体产物,即1,4-对苯二频哪醇硼酸酯;d.suzuki偶联:将步骤b所得2,5-二溴-3,6-二(十二烷氧基)并噻吩(0.22g,0.33mmol)以及步骤c所得1,4-对苯二频哪醇硼酸酯(0.11g,0.33mmol)溶解于甲苯(4.0ml)中,通氮气除氧,同时加入除氧的碳酸钾水溶液(0.182g,1.32mmol,2mol/l),以及甲基三辛基氯化铵(aliquat336,即a336),经通氮气后,加入催化剂pd(pph3)4(7.6mg,0.006mmol),加热至90℃反应72小时,反应完全后冷却至室温,加水洗涤,二氯甲烷萃取,合并有机相,浓缩后滴入甲醇中,将所得沉淀过滤,经索氏提取后得到终产物[3,6-二(十二烷氧基)并噻吩]-苯共聚物,产物为橘红色固体。实施例8:ar为苯,r1,r2均为x=y=1;所述聚合物为[3,6-二(4-己基-苯基)并噻吩]-苯共聚物,其分子结构式为图17所示,其制备方法如下:a.将3,6-二溴并噻吩(2.00g,6.71mmol)与4-己基-苯硼酸频哪醇酯(4.84g,16.8mmol)溶解于甲苯(60.0ml)中,通氮气除氧,同时加入除氧的碳酸钾水溶液(5.57g,2mol/l),以及甲基三辛基氯化铵(aliquat336,即a336),经通氮气后,加入催化剂pd(pph3)4(2%),加热至90℃反应24小时,反应完全后冷却至室温,加水洗涤,二氯甲烷萃取,合并有机相,浓缩后滴入甲醇中,将所得沉淀过滤,干燥,得3,6-二(4-己基-苯基)并噻吩。b.将步骤a所得产物3,6-二(4-己基-苯基)并噻吩(3.80g,8.26mmol)用n-溴代丁二酰亚胺(nbs)(4.41g,24.8mmol)进行溴化,反应溶剂为氯仿(42ml),加冰乙酸(13ml)催化,在室温下反应24小时,反应完全后用水和二氯甲烷萃取,有机相用硫酸钠干燥、过滤后,除去有机溶剂,用柱层析法取得2,5-二溴-3,6-二(4-己基-苯基)并噻吩;c.将对二溴苯(4.70g,20.0mmol)、联硼酸频哪醇酯(cas:73183-34-3)(12.1g,47.8mmol)、醋酸钾(5.9g,60.0mmol)加入n,n-二甲基甲酰胺(dmf)(200.0ml)中,除氧后,加入钯催化剂,在80℃下回流2小时,反应完成后,用二氯甲烷和水萃取,有机相经旋蒸移除有机溶剂,用柱层析方法取得白色固体产物,即1,4-对苯二频哪醇硼酸酯;d.suzuki偶联:将步骤b所得2,5-二溴-3,6-二(4-己基-苯基)并噻吩(0.31g,0.50mmol)以及步骤c所得1,4-对苯二频哪醇硼酸酯(1.58g,0.50mmol)溶解于甲苯(5.0ml)中,通氮气除氧,同时加入除氧的碳酸钾水溶液(0.35g,2.5mmol,2mol/l),以及甲基三辛基氯化铵(aliquat336,即a336),经通氮气后,加入催化剂pd(pph3)4(2%),加热至90℃反应72小时,反应完全后冷却至室温,加水洗涤,二氯甲烷萃取,合并有机相,浓缩后滴入甲醇中,将所得沉淀过滤,经索氏提取后得到终产物[3,6-二(4-己基-苯基)并噻吩]-苯共聚物,产物为红褐色固体。实施例9:ar为噻吩,r1,r2均为x=y=1;所述聚合物为[3,6-二(4-己基-苯基)并噻吩]-噻吩共聚物,其分子结构式为图18所示,其制备方法如下:a.将3,6-二溴并噻吩(2.00g,6.71mmol)与4-己基-苯硼酸频哪醇酯(4.84g,16.8mmol)溶解于甲苯(60.0ml)中,通氮气除氧,同时加入除氧的碳酸钾水溶液(5.57g,2mol/l),以及甲基三辛基氯化铵(aliquat336,即a336),经通氮气后,加入催化剂pd(pph3)4(2%),加热至90℃反应24小时,反应完全后冷却至室温,加水洗涤,二氯甲烷萃取,合并有机相,浓缩后滴入甲醇中,将所得沉淀过滤,干燥,得3,6-二(4-己基-苯基)并噻吩。b.将步骤a所得产物3,6-二(4-己基-苯基)并噻吩(3.80g,8.26mmol)用n-溴代丁二酰亚胺(nbs)(4.41g,24.8mmol)进行溴化,反应溶剂为氯仿(42ml),加冰乙酸(13ml)催化,在室温下反应24小时,反应完全后用水和二氯甲烷萃取,有机相用硫酸钠干燥、过滤后,除去有机溶剂,用柱层析法取得2,5-二溴-3,6-二(4-己基-苯基)并噻吩;c.将噻吩(1.68g,20.0mmol)加入干燥的四氢呋喃(40.0ml)中,在-78℃下滴加正丁基锂(30ml,48mmol),置于室温搅拌1小时,再放回-78℃下,加入三丁基氯化锡(15.62g,48.0mmol),置于室温搅拌1小时,反应完成后,用乙酸乙酯和水萃取,有机相经旋蒸移除有机溶剂,硅胶柱事先用三乙胺处理,用柱层析方法取得白色固体产物,即2,5-二(三丁基锡基)-噻吩;d.stille偶联:将步骤b所得产物2,5-二溴-3,6-二(4-己基-苯基)并噻吩(0.22g,0.33mmol)与步骤c所得产物2,5-二(三丁基锡基)噻吩(0.22g,0.33mmol)溶于甲苯(4.8ml)中,通氮气10分钟后加入四(三苯基膦)钯,加热回流14小时,反应完全后滴入甲醇中,过滤得沉淀后进行索氏提取,得到最终产物[3,6-二(4-己基-苯基)并噻吩]-噻吩共聚物,产物为橘红色固体。上面结合附图对本发明的实施例进行了描述,但是本发明并不局限于上述的具体实施方式,上述的具体实施方式仅仅是示意性的,而不是限制性的,本领域的普通技术人员在本发明的启示下,在不脱离本发明宗旨和权利要求所保护的范围情况下,还可做出很多形式,这些均属于本发明的保护之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1