一种检测丁酰胆碱酯酶活性的荧光探针及其制备方法和应用与流程
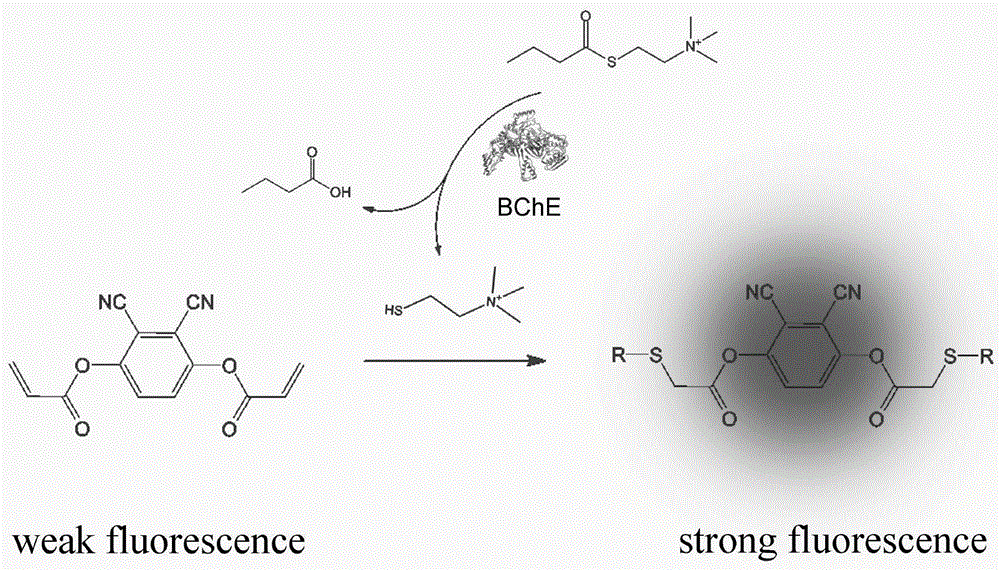
本发明涉及荧光探针技术领域,特别是涉及一种检测丁酰胆碱酯酶活性的荧光探针及其制备方法和应用。
背景技术:
巯基反应探针通常用于标记蛋白质以监测构象变化、多个亚基的组装和配体结合过程,还经常用于检测如谷胱甘肽等生物硫醇小分子,这些生物分子在人类健康和疾病中起着重要的特殊作用。目前,已有的巯基反应荧光探针存在的缺陷是对所有含巯基的物质无特异选择性,迫切需要设计开发新的谷胱甘肽、半胱氨酸和同型半胱氨酸的选择识别荧光探针。在这些能特异识别探针中,丙烯酰化功能化分子探针在选择性和响应时间上表现出更好的性能。因此,通过引入丙烯酰基和含硫醇的物种来合理地设计针对特定生物硫醇的分子探针是很重要且有应用前景的方法。
丁酰胆碱酯酶(bche;ec3.1.1.8)主要位于血浆中,可以以非特异的方式催化多种胆碱类酯类如乙酰胆碱的水解。其对人血清中胆碱酯酶活性的主要贡献使bche成为临床上有价值的生物标志物。目前,除了传统的埃尔曼比色法外,针对bche目标的荧光探针还几乎没有。
专利号为2013106811585的发明专利中公开了一种长波长荧光探针及其制备方法和应用,作为探针的化合物为1,7-二甲基-3,5-二苯乙烯基-8-苯基-(2’-马来酰亚胺)-二氟化硼二吡咯甲烷对巯基化合物选择性好,且与巯基反应后荧光强度增强,但是在专利中并没有公开该长波长荧光探针对bche具有检测作用。
技术实现要素:
本发明的目的在于提供一种检测丁酰胆碱酯酶活性的荧光探针,该发明能够通过快速巯基烯点击反应被硫醇点亮实现荧光增强,选择性好,抗干扰性强。
为解决此技术问题,本发明的技术方案是:一种检测丁酰胆碱酯酶活性的荧光探针,分子结构如下:
优选其中,r为乙烯基或者2-甲基丙烯基或者3,3,3-三氟-丙烯基。
优选化学名称为2,3-二氰基-1,4-亚苯基二丙烯酸酯或者2,3-二氰基-1,4-亚苯基二(3,3-二甲基丙烯酸酯)或者2,3-二氰基-1,4-亚苯基二(4,4,4-三氟丁烯酸酯)。
本发明的另一目的在于提供一种检测丁酰胆碱酯酶活性的荧光探针的制备方法,该发明制备方法简单,制得的荧光探针对bche的检测灵敏,抗干扰性强。
为解决此技术问题,本发明的技术方案是:一种检测丁酰胆碱酯酶活性的荧光探针制备方法,包括以下步骤:
步骤一、将2,3-二氰基对苯二酚溶于干燥的四氢呋喃中;
步骤二、向步骤一的混合液滴加过量的丙烯酰氯或者3,3-二甲基丙烯酰氯或者4,4,4-三氟丁烯酰氯的一种;
步骤三、向步骤二的混合液滴加少量三乙胺;
步骤四、将步骤三的混合液搅拌;
用旋转蒸发器除去溶剂,用硅胶柱色谱法纯化产物,最终获得白色粉末。
本发明的另一目的在于提供一种检测丁酰胆碱酯酶活性的荧光探针的应用,该发明通过结合丁酰胆碱酯酶催化的丁酰硫代胆碱的水解反应,荧光探针与水解反应生成含硫醇的物质发生快速巯基-烯点击反应检测bche的活性,检测灵敏,检测效果好。
为解决此技术问题,本发明的技术方案是:一种使用荧光探针应用于丁酰胆碱酯酶活性的荧光检测。
优选丁酰胆碱酯酶活性的荧光检测方法为:溶液中,丁酰硫代胆碱在丁酰胆碱酯酶的催化作用下发生水解生成硫醇,荧光探针与生成的硫醇发生反应生成荧光增强的化学物质,测定生成的荧光物质的荧光强度,获得丁酰胆碱酯酶活性强度。
进一步优选,包括以下步骤:
步骤一、制备所述探针标准测定溶液;
将30.0μl浓度为300μm探针水溶液和2.9mlhepes缓冲液混合制得探针标准测定溶液;
步骤二、制备含有丁酰硫代胆碱、所述探针标准测定溶液和丁酰胆碱酯酶的混合液,将混合溶液含有不同丁酰胆碱酯酶含量的荧光强度在0~30分钟的孵育时间内进行记录,获得不同丁酰胆碱酯酶活性下对应孵育时间的荧光强度。
通过采用上述技术方案,本发明的有益效果是:
本发明中利用bche对人血浆胆碱酯酶水平的主要贡献,通常作为临床诊断的重要生物标志物,现有的依赖于荧光底物的荧光测定法经常缺乏足够快的反应时间和特定底物识别;本发明设计合成了一种新型荧光分子探针,可以通过快速巯基烯点击反应被硫醇点亮;该探针通过巯基烯点击化学对硫醇具有灵敏的荧光响应,它可以区分不同发射颜色的谷胱甘肽和半胱氨酸或同型半胱氨酸。本发明还提供了制备荧光探针的方法,通过2,3-二氰基对苯二酚与丙烯酰氯或者3,3-二甲基丙烯酰氯或者4,4,4-三氟丁烯酰氯中的一种发生酰化反应,制得含有硫醇物质能引发荧光增强的荧光探针,该探针的快速硫醇反应使它能够实时监测由丁基胆碱酯酶催化的水解反应,其在温和条件下的快速反应速率能够监测酶催化的水解反应,通过巯基烯点击化学的跟踪酶反应;
本发明首次开发以丁酰硫代胆碱为底物,基于硫醇-烯点击化学引发的分子探针的荧光增强来检测bche活性,可应用于开发一种新型的胆碱酯酶活性检测试剂盒,所建立的bche检测试剂盒具有良好的灵敏度,能够避免复杂基质中谷胱甘肽和乙酰胆碱酯酶(ache)的干扰;本发明还用于评价他克林对bche的抑制作用,其结果验证了它在筛选bche潜在抑制剂中的可行性。
从而实现本发明的上述目的。
附图说明
图1.基于巯基反应的分子探针(dcpda)荧光增强的丁酰胆碱酯酶(bche)活性检测策略示意图;
图2.2,3-二氰基-1,4-亚苯基二丙烯酸酯(dcpda)的1hnmr谱图;
图3.2,3-二氰基-1,4-亚苯基二丙烯酸酯(dcpda)的13cnmr谱图;
图4.2,3-二氰基-1,4-亚苯基二丙烯酸酯(dcpda)的高分辨质谱图;
图5.(a)hepes缓冲溶液(ph7.4)中的2,3-二氰基对苯二酚(dchq)的pl光谱;(b)thf中的2,3-二氰基-1,4-亚苯基二丙烯酸酯(dcpda)的pl光谱;(c)在hepes缓冲液中,dcpda(300.0μm)对不同含硫醇的化合物(包括dtt、gsh、tga、pa、nahs、cys和hcy(300.0μm)响应的pl谱;(d)dcpda和每一种巯基化合物在0~15分钟的时间过程中的反应动力学。
图6.(a)在不同巯基乙酸(tga)比值下dcpda的1hnmr谱。(i)dcpda:tga1:0,(ii)dcpda:tga1:1,(iii)dcpda:tga1:2;(b)在含有不同硫醇的物种存在下dcpda的紫外可见光谱。
图7.(a)在hepes缓冲液(ph7.4)中加入不同浓度的gsh(0.0–600.0μμm)后,dcpda(300.0μm)的荧光谱的变化;(b)dcpda溶液在不同组分存在下的荧光谱变化:dcpda(300.0μm),dcpda(300.0μm)和btch(1.0mm),anddcpda(300.0μm),btch(1.0mm)和bche(5.0u/l);(c)在0.2~30u/l之间的不同浓度下的bche存在时的酶促反应动力学过程;(d)酶促反应速率k和bche活性在0.2~9u/l范围内线性图。
图8.(a)在不同浓度谷胱甘肽存在下的bche检测中的时间过程酶促反应动力学:(i)0.0μmgsh,(ii)10.0μmgsh;(iii)20.0μmgsh;(iv)30.0μmgsh;(ii)100.0μmgsh;(b)在不同底物btch或atch存在下的bche和ache的时间过程酶促反应动力学:(i)btch(1.0mm)和ache(5.0u/l),(ii)btch(1.0mm)和bche(5.0u/l),(iii)atch(1.0mm)和ache(5.0u/l),(iv)atch(1.0mm)和bche(5.0u/l)。
图9.(a)在不同浓度塔克林(0.0–5.0μm)存在下bche的时间分辨酶促反应动力学;(b)反应速率的倒数与塔克林浓度(1.0–5.0μm)的线性曲线。
具体实施方式
为了进一步解释本发明的技术方案,下面通过具体实施例来对本发明进行详细阐述。
实施例1
一、2,3-二氰基-1,4-亚苯基二丙烯酸酯(简称dcpda)的合成。
合成dcpda的步骤如下:
首先将0.5g(即3.1mmol)的2,3-二氰基对苯二酚溶于50ml干燥的thf中,然后滴加过量的丙烯酰氯2.0ml。在加入少量三乙胺后,将所得混合物充分搅拌24小时。最后用旋转蒸发器除去溶剂,用硅胶柱色谱法(乙酸乙酯:石油醚1:4)纯化产物。最终产物dcpda为白色粉末,产率为36%,制得的dcpda的nmr谱图和高分辨质谱图以及dcpda的结构式详见图2至图4所示。
2,3-二氰基对苯二酚与丙烯酰氯反应式如下:
r-cocl+r'oh→rcoor'+hcl
二、2,3-二氰基-1,4-亚苯基二丙烯酸酯(dcpda)对巯基化合物的荧光响应。
在3.0mlhepes缓冲液中加入一定量的dcpda溶液,其中hepes缓冲液ph值为7.4,dcpda溶液的用量为90.0μl,dcpda溶液的浓度为10.0mm。在上述dcpda溶液中分别加入各种含硫醇的化合物,包括nahs、谷胱甘肽(gsh)、二硫代苏糖醇(dtt)、半胱氨酸(cys)、同型半胱氨酸(hcy)、巯基乙酸(tga)、青霉素(pa),并在15分钟后记录其荧光光谱,详见图5(c)所示。dcpda与每一种含硫物质的反应动力学在15分钟内进行监测,间隔时间为1分钟,具体的反应动力学情况详见图5(d)所示,每种硫醇的化合物浓度为300.0μm。将0.0–600.0μm范围内的谷胱甘肽溶液连续加入到浓度为300.0μm的dcpda溶液中,在最佳激发波长下孵育5分钟后记录荧光光谱,详见图7(a)。
另外,从图5(c)中可知,nahs、谷胱甘肽(gsh)、二硫代苏糖醇(dtt)、半胱氨酸(cys)、同型半胱氨酸(hcy)、巯基乙酸(tga)、青霉素(pa)在dcpda通过巯基烯点击化学对各种硫醇化合物具有灵敏的荧光响应,它可以通过区分不同发射颜色的谷胱甘肽和半胱氨酸或同型半胱氨酸。
三、将dcpda应用于丁酰胆碱酯酶活性的荧光检测。
具体的检测方法如下:
溶液中,丁酰硫代胆碱在丁酰胆碱酯酶的催化作用下发生水解生成硫醇,dcpda与生成的硫醇发生硫醇-烯点击化学反应生成荧光增强的化学物质,测定生成荧光物质的荧光强度,获得丁酰胆碱酯酶活性强度。
dcpda应用于丁酰胆碱酯酶活性的荧光检测具体包括以下步骤:
步骤一、制备dcpda标准测定溶液;
将30.0μl浓度为300μmdcpda溶液和2.9mlhepes缓冲液混合制得dcpda标准测定溶液;
步骤二、制备含有丁酰硫代胆碱、dcpda标准测定溶液和和不同含量丁酰胆碱酯酶的混合液,将上述多种混合溶液的荧光强度在0~30分钟的孵育时间内进行记录,获得不同丁酰胆碱酯酶活性下对应孵育时间的荧光强度,具体情况详见图7(c)和图7(d)所示。从图7(c)和图7(d)可知,在丁酰硫代胆碱浓度和dcpda浓度不变的情况下,dcpda与生成的硫醇发生反应生成荧光增强的化学物质,测定生成荧光物质的荧光强度可以验证获得丁酰胆碱酯酶活性强度。
使用dcpda制备一种丁酰胆碱酯酶荧光检测试剂盒,包括以下成分:
dcpda,丁酰硫代胆碱和hepes缓冲液。将上述荧光检测试剂盒应用于丁酰胆碱酯酶浓度的检测,在温和条件下的快速反应速率能够监测丁酰胆碱酯酶催化的水解反应,通过巯基烯点击化学的跟踪丁酰胆碱酯酶反应即可实现丁酰胆碱酯酶浓度的检测。
首先制备dcpda溶液在thf中的原液,dcpda溶液的浓度为10.0mm;然后混合30.0μl的dcpda溶液和2.9mlhepes缓冲液,制备浓度为300.0μmdcpda的标准测定溶液。用含有300.0μmdcpda,bche(5.0u/l)和在0.1–1.0mm范围内的不同量的btch的标准测定溶液对饱和底物浓度进行了混合。将混合溶液的pl强度在0~30分钟的孵育时间内进行记录。用一系列含有300.0μmdcpda,1.0mmbtch和浓度分布在0.0–30.0u/l的bche的测试溶液,在孵育时间0~30分钟内获得bche检测的时间历程酶促反应动力学。记录在每个bche活性下对应孵育时间的pl强度,如图7(c)所示。
gsh对bche测定的影响的实验如下:
除了在加入1.0mmbtch之前加入浓度为10.0μm,20.0μm,30.0μm或100.0μm的gsh,bche检测的时间历程酶促反应动力学可按照前面相同方法进行,gsh对bche测定的影响情况详见图8(a)所示,从图中可知,gsh对bche活性的测定基本没有影响。
bche从与ache混合物中的选择性检测按下述方法进行:
含有特定水平的ache和bche以及以btch和atch分别为底物的的酶促反应动力学进行了记录和比较。在整个实验过程中,温度保持在37℃。从图8(b)中可知发明基于该探针首次开发以丁酰硫代胆碱为底物,基于硫醇-烯点击化学引发的分子探针的荧光增强来检测bche活性,应用于开发一种新型的胆碱酯酶活性检测试剂盒,所建立的bche检测试剂盒具有良好的灵敏度,能够避免复杂基质中谷胱甘肽和乙酰胆碱酯酶(ache)的干扰。
为了验证bche检测抑制剂筛选的功能,以他克林为例。他克林对bche活性的抑制按下列步骤进行评估:将一系列不同量的他克林(1.0–5.0μm)与15.0mlbche溶液(1.0u/ml)混合,将所得混合物加入到包含3.0ml浓度为0.3mm的dcpda和浓度为1.0mmbtch的测试溶液中。每一混合溶液的时间历程酶促反应动力学在0~30分钟范围内进行记录。从图9可知他克林对bche的抑制作用,其结果验证了它在筛选bche潜在抑制剂中的可行性。
实施例2
一、2,3-二氰基-1,4-亚苯基二(3,3-二甲基丙烯酸酯)(dcpdma)的合成。
合成dcpdma步骤如下:
首先将0.5g(物质的量为3.1mmol)2,3-二氰基对苯二酚溶于50ml干燥的thf中,然后滴加过量的3,3-二甲基丙烯酰氯2.0ml。在加入少量三乙胺后,将所得混合物充分搅拌24小时。最后用旋转蒸发器除去溶剂,用硅胶柱色谱法(乙酸乙酯:石油醚1:4)纯化产物。最终产物为白色粉末,产率为36%。
2,3-二氰基对苯二酚与3,3-二甲基丙烯酰氯反应式如下:
r-cocl+r'oh→rcoor'+hcl
二、2,3-二氰基-1,4-亚苯基二(3,3-二甲基丙烯酸酯)(dcpdma)对巯基化合物的荧光响应。
在3.0mlhepes缓冲液中加入一定量的dcpdma溶液,其中hepes缓冲液ph值为7.4,dcpdma溶液的体积为90.0μl,dcpdma溶液为10.0mm;在上述dcpdma溶液中分别加入各种含硫醇的化合物,包括nahs、谷胱甘肽(gsh)、二硫代苏糖醇(dtt)、半胱氨酸(cys)、同型半胱氨酸(hcy)、巯基乙酸(tga)、青霉素(pa),并在15分钟后记录其荧光光谱。dcpdma与每一种含硫物质的反应动力学在15分钟内进行监测,间隔时间为1分钟。每个化合物的浓度为300.0μm。将0.0–600.0μm范围内的谷胱甘肽溶液连续加入到浓度为300.0μm的dcpdma溶液中,在最佳激发波长下孵育5分钟后记录荧光光谱,dcpdma的荧光光谱同dcpda对巯基化合物的荧光响应的趋势相同。
三、将dcpdma应用于丁酰胆碱酯酶活性的荧光检测。
具体的检测方法如下:
溶液中,丁酰硫代胆碱在丁酰胆碱酯酶的催化作用下发生水解生成硫醇,dcpdma与生成的硫醇发生硫醇-烯点击化学反应生成荧光增强的化学物质,测定生成的荧光物质的荧光强度,获得丁酰胆碱酯酶活性强度。
dcpdma应用于丁酰胆碱酯酶活性的荧光检测具体包括以下步骤:
步骤一、制备dcpdma标准测定溶液;
将30.0μl浓度为300μmdcpdma溶液和2.9mlhepes缓冲液混合制得dcpdma标准测定溶液;
步骤二、制备含有丁酰硫代胆碱、dcpdma标准测定溶液和和不同含量丁酰胆碱酯酶的混合液,将上述多种混合溶液的荧光强度在0~30分钟的孵育时间内进行记录,获得不同丁酰胆碱酯酶活性下对应孵育时间的荧光强度,在丁酰硫代胆碱浓度和dcpdma浓度不变的情况下,dcpdma与生成的硫醇发生反应生成荧光增强的化学物质,测定生成荧光物质的荧光强度可以验证获得丁酰胆碱酯酶活性强度,dcpdma与dcpda具有类似的结构,因此dcpdma对bche浓度测定可参考7(c)和7(d)。
使用dcpdma制备一种丁酰胆碱酯酶荧光检测试剂盒,包括以下成分:
dcpdma,丁酰硫代胆碱和hepes缓冲液。将上述荧光检测试剂盒应用于丁酰胆碱酯酶浓度的检测,在温和条件下的快速反应速率能够监测丁酰胆碱酯酶催化的水解反应,通过巯基烯点击化学的跟踪丁酰胆碱酯酶反应即可实现丁酰胆碱酯酶浓度的检测。
首先制备dcpdma溶液在thf中的原液,其中dcpdma溶液为10.0mm;然后混合30.0l的dcpdma溶液和2.9mlph值为7.4hepes缓冲液,制备浓度为300.0μmdcpdma的标准测定溶液。用含有300.0μmdcpdma,5.0u/lbche和浓度分布在0.1–1.0mm范围内的不同量的btch的标准测定溶液对饱和底物浓度进行了混合。将混合溶液的pl强度在0~30分钟的孵育时间内进行记录。用一系列含有dcpdma(300.0μm),btch(1.0mm)和不同活性的bche(0.0–30.0u/l)的测试溶液,在孵育时间0~30分钟内获得bche检测的时间历程酶促反应动力学。记录在每个bche活性下对应孵育时间的pl强度,dcpdma对bche活性检测的性质同dcpda接近,由于二者具有相类似的结构,因此具有相似的性质。
gsh对bche测定的影响的实验如下:
除了在加入btch(1.0mm)之前加入一定量的gsh(10.0μm,20.0μm,30.0μm或100.0μm),bche检测的时间历程酶促反应动力学可按照前面相同方法进行。
bche从与ache混合物中的选择性检测按下述方法进行:含有特定水平的不同种类酶(ache和bche)和不同底物(btch和atch)的酶促反应动力学进行了记录和比较。在整个实验过程中,温度保持在37℃。基于硫醇-烯点击化学引发的dcpdma的荧光增强来检测bche活性的检测方法,用于开发一种新型的胆碱酯酶活性检测试剂盒,所建立的bche检测试剂盒具有良好的灵敏度,能够避免复杂基质中谷胱甘肽和乙酰胆碱酯酶(ache)的干扰。
为了验证bche检测抑制剂筛选的功能,以他克林为例。他克林对bche活性的抑制按下列步骤进行评估:将一系列不同量的他克林(1.0–5.0m)与15.0lbche溶液(1.0u/ml)混合,将所得混合物加入到包含dcpdma(3.0ml,0.3mm)和btch(1.0mm)的测试溶液中。每一混合溶液的时间历程酶促反应动力学在0~30分钟范围内进行记录。他克林对bche也具有抑制作用,其抑制效果可参考dcpda的数据,详见图9所示。
实施例3
一、2,3-二氰基-1,4-亚苯基二(4,4,4-三氟丁烯酸酯)(dcpdfc)的合成。
合成dcpdfc的步骤如下:首先将0.5g(物质的量为3.1mmol)2,3-二氰基对苯二酚溶于50ml干燥的thf中,然后滴加过量的4,4,4-三氟丁烯酰氯2.0ml。在加入少量三乙胺后,将所得混合物充分搅拌24小时。最后用旋转蒸发器除去溶剂,用硅胶柱色谱法(乙酸乙酯:石油醚1:4)纯化产物。最终产物为白色粉末,产率为36%。
2,3-二氰基对苯二酚与4,4,4-三氟丁烯酰氯反应式如下:
r-cocl+r'oh→rcoor'+hcl
二、2,3-二氰基-1,4-亚苯基二(4,4,4-三氟丁烯酸酯)(dcpdfc)对巯基化合物的荧光响应。
在3.0μlhepes缓冲液中加入90μl浓度为10.0mm的dcpdfc溶液。在上述dcpdfc溶液中分别加入各种含硫醇的化合物,包括nahs、谷胱甘肽(gsh)、二硫代苏糖醇(dtt)、半胱氨酸(cys)、同型半胱氨酸(hcy)、巯基乙酸(tga)、青霉素(pa),并在15分钟后记录其荧光光谱。dcpdfc与每一种含硫物质的反应动力学在15分钟内进行监测,间隔时间为1分钟。每个化合物的浓度为300.0μm。将0.0–600.0μm范围内的谷胱甘肽溶液连续加入到浓度为300.0μmdcpdfc溶液中,在最佳激发波长下孵育5分钟后记录荧光光谱。
首先制备dcpdfc溶液在thf中的原液,其中dcpdfc溶液为10.0mm;然后混合30.0μl的dcpdfc溶液和2.9mlph值为7.4hepes缓冲液,制备浓度为300.0μm的dcpdfc的标准测定溶液。用含有浓度为300.0μm的dcpdfc溶液,浓度为5.0u/lbche和浓度分布在0.1–1.0mm范围内不同浓度的btch的标准测定溶液对饱和底物浓度进行了混合。将混合溶液的pl强度在0~30分钟的孵育时间内进行记录。用一系列含有浓度为300.0μm的dcpdfc,1.0mmbtch和浓度分布在0.0–30.0u/l的bche的测试溶液,在孵育时间0~30分钟内获得bche检测的时间历程酶促反应动力学。记录在每个bche活性下对应孵育时间的pl强度,由于dcpdfc与dcpda具有相近似的结构,因此dcpdfc对bche浓度测定可参考7(c)和7(d)。
gsh对bche测定的影响的实验如下:除了在加入浓度为1.0mmbtch之前加入一定量浓度分别为10.0μm、20.0μm、30.0μm或100.0μmgsh,bche检测的时间历程酶促反应动力学可按照前面相同方法进行。
bche从与ache混合物中的选择性检测按下述方法进行:
含有特定水平的不同种类酶(ache和bche)和不同底物(btch和atch)的酶促反应动力学进行了记录和比较。在整个实验过程中,温度保持在37℃。
为了验证bche检测抑制剂筛选的功能,以他克林为例。他克林对bche活性的抑制按下列步骤进行评估:将一系列不同量的他克林(1.0–5.0m)与15.0lbche溶液(1.0u/ml)混合,将所得混合物加入到包含dcpdfc(3.0ml,0.3mm)和btch(1.0mm)的测试溶液中。每一混合溶液的时间历程酶促反应动力学在0~30分钟范围内进行记录,他克林对bche也具有抑制作用,其抑制效果可参考dcpda的数据,详见图9所示。
- 还没有人留言评论。精彩留言会获得点赞!