细菌化肿瘤细胞疫苗及其制备方法与流程
本发明涉及肿瘤细胞疫苗及疫苗制备技术,尤其涉及一种利用肿瘤细胞制备具有潜在治疗肿瘤作用的新型疫苗及其制备方法。
背景技术:
免疫识别的关键环节是免疫系统要对危险信号进行识别,对于入侵的病原生物,危险信号就是病原相关分子模式(pathogen-associatedmolecularpatterns,pamps),而自身异常的细胞则是损伤相关分子模式(damage-associatedmolecularpatterns,damps)。当前应用的有效疫苗几乎都针对细菌、病毒等病原微生物,其中最重要的原因是细菌和病毒能供给免疫系统有效的pamps信号。
肿瘤免疫方法多种多样,总体可归纳为被动(passive)和主动(active)免疫两大类,前者包括肿瘤特异抗体、细胞因子和过继免疫活性细胞等;后者包括肿瘤特异或相关抗原的蛋白或多肽疫苗、树突状细胞(dc)疫苗、同种或异种肿瘤全细胞疫苗、checkpointblocker等。
肿瘤全细胞疫苗是肿瘤免疫技术中的一个重要领域。由于肿瘤细胞是自身细胞,免疫原性较差,免疫系统对自身的肿瘤细胞也处于免疫耐受状态,直接选用经过处理(如辐射)使其不再具备增殖能力的肿瘤细胞作为疫苗效果并不理想。因此,制备肿瘤全细胞疫苗的关键是如何让免疫系统识别自身细胞抗原,进而打破免疫耐受。1993年,英国学者dranoff等将粒细胞-巨噬细胞集落刺激因子(gm-csf)转入黑色素瘤细胞表达并进行辐射处理后用作全细胞疫苗,在小鼠黑色素瘤模型中发现能够诱导树突状细胞(dcs)迁移、分化和成熟,这种dcs能在肿瘤原位处理肿瘤抗原,因而诱导肿瘤特异的免疫反应。此后,采用各种各样的修饰手段便成为肿瘤全细胞疫苗打破免疫耐受的主要技术策略。四川大学学者针对肿瘤组织免疫抑制的微环境,在肿瘤细胞中表达基质纤维母细胞的成纤维细胞激活蛋白,在小鼠肿瘤模型中证明可以有效诱导抗肿瘤免疫反应;美国科学家在肾癌细胞中表达能够让先天免疫系统和dcs相互作用的ny-eso-1分子,在小鼠模型中发现能促使dcs强有力处理并递呈肿瘤抗原,诱导有效的肿瘤特异免疫反应;爱尔兰研究者采用肿瘤特异光热处理,让肿瘤组织原位释放肿瘤抗原,然后用一种纳米材料加速抗原递呈细胞来处理肿瘤抗原,发现可以有效诱导肿瘤特异的细胞免疫反应;中科院学者利用纳米生物材料将多种(gm-csf和il-2)免疫增强成分转入肿瘤细胞,这种肿瘤全细胞疫苗较单成分疫苗具有更好的抗肿瘤效果。目前,尽管有多种肿瘤全细胞疫苗在临床进行试验,但进入iii期后都表现不理想,因此,肿瘤全细胞疫苗仍然需要技术改进,才有可能真正转化应用于临床。
技术实现要素:
本发明的目的在于:提供细菌化肿瘤细胞疫苗以及制备方法,该新型疫苗的主要特征为在肿瘤细胞表面覆盖一层细菌抗原成分;本发明将这种在肿瘤细胞表面覆盖细菌抗原成分的过程称为细菌化;将细菌化的肿瘤细胞灭活后制备成为肿瘤特异疫苗。将本发明的细菌化肿瘤细胞作为疫苗接种于肿瘤模型小鼠皮下(也可血管、肌肉或腹腔内注射等),可以诱导肿瘤细胞产生特异的免疫反应,具有很好的治疗肿瘤作用,展示了良好的转化应用前景。
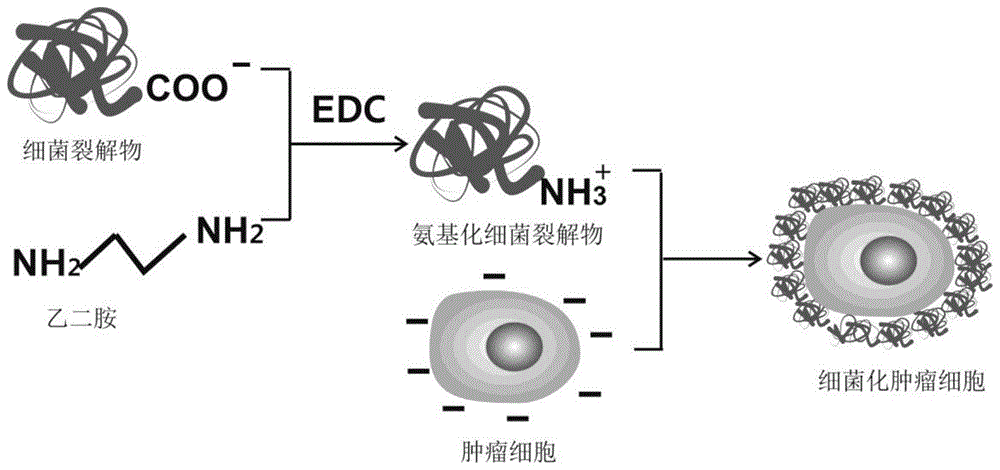
本发明将典型病原细菌裂解物(主要成分为蛋白质,作为抗原)粘附覆盖于肿瘤细胞表面(本发明将这一过程称为“肿瘤细胞细菌化”或“细菌化肿瘤细胞”,图1为肿瘤细胞细菌化的主要原理和步骤),也就是通过细菌化肿瘤细胞人为地给肿瘤细胞增加细菌的pamps信号。如图1所示,将细菌裂解物和过量带有正电荷的氨基化合物(如乙二胺)混合,氨基化合物中的氨基(-nh2)在酸性环境中经质子化后成为带正电荷的氨基(-nh3+),然后在1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(edc)的作用下,使得带有正电荷的氨基(-nh3+)结合到细菌裂解物的蛋白质上,从而使细菌裂解物带有正电荷,即:在edc的作用下,细菌蛋白上的羧基与乙二胺的一个氨基形成酰胺键,从而将细菌蛋白的羧基转化成带正电荷的氨基(显正电性,此过程称为氨基化),氨基化的蛋白质在生理溶液中带正电荷。此后加进细胞表面带有阴性电荷的肿瘤细胞,使二者通过正负电荷机制结合在一起,成为本发明提供的细菌化肿瘤细胞,灭活后将此细胞作为肿瘤疫苗。用这种细菌化肿瘤细胞作为疫苗,在小鼠肿瘤模型中进行实验,发现注射这种细菌化肿瘤细胞疫苗后能有效诱导肿瘤细胞特异的免疫反应,具有很好的治疗肿瘤作用。本发明通过“细菌化肿瘤细胞”来制备肿瘤疫苗,这是一种新的制备肿瘤细胞疫苗的策略方法,具有临床转化应用的前景。
为了实现上述目标,本发明的技术方案为:
一种细菌化肿瘤细胞疫苗及其制备方法,其特征包括以下方法、步骤和性能:
1)氨基化细菌裂解物。
先按照实验室常规方法培养细菌,收集细菌体并经冻溶和超声波裂解,将细菌裂解液冻干成粉状,即成为本发明需要的细菌裂解物。制备得到的细菌裂解物用于下一步制备氨基化细菌裂解物。本发明具体实施时,培养的细菌为大肠杆菌,也可以是其他细菌(如结核杆菌、葡萄球菌、假单胞菌、克雷白杆菌等)。
然后在酸性环境下将过量的氨基化合物溶液(带有正电荷-nh3+)和细菌裂解物混匀,接着加入1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(edc)后连续搅拌一段时间(具体实施时优选为48~52小时),在此期间每间隔一段时间(如16小时)加进新的dec溶液。此后,在超纯水中透析掉没有和细菌裂解物中的蛋白质结合的氨基化合物和未反应的edc等成分,就获得本发明需要的氨基化细菌裂解物溶液。
上述氨基化过程中,氨基化合物提供氨基给细菌裂解物,因此反应过程中须保证任何时间氨基化合物都要有足够的浓度,故反应过程中需反复添加。氨基化合物包括但不限于乙二胺;氨基化过程除了使用乙二胺外,也可以使用含有氨基基团的其他化学物质(如n,n-二甲基乙二胺、聚乙烯亚胺),因此,使用任何其他氨基物质氨基化细菌裂解物都可以的,均属于本发明权利范围。
2)用氨基化细菌裂解物制备细菌化肿瘤细胞。
按实验室培养肿瘤细胞的常规方法体外培养相应的肿瘤细胞,达到需要的细胞数量后收集对数生长期的细胞,计数后用磷酸盐缓冲溶液(pbs溶液)调整肿瘤细胞浓度(调整至肿瘤细胞数量为1×106个细胞/100μl);然后按比例将肿瘤细胞液(50μl)和氨基化细菌裂解物溶液(50μl,含蛋白质0.1mg)混匀,室温下轻摇(如30~50分钟)后即成为细菌化肿瘤细胞。
3)灭活细菌化肿瘤细胞制成细菌化肿瘤细胞疫苗。
将制备得到的细菌化肿瘤细胞放置于x线辐照仪(具体实施时采用radsourcers2000)中,按一定的辐射强度(如80~100gy)对细菌化肿瘤细胞进行灭活,使细菌化肿瘤细胞当作疫苗注射后不再继续生长增殖和转移,从而达到安全的目的。
然后将灭活的细菌化肿瘤细胞作为疫苗给小鼠注射,每只小鼠注射5×101~10个细菌化肿瘤细胞。具体实施时,可按每只小鼠用3~5×105个细菌化肿瘤细胞,在小鼠皮下、血管、腹腔内等途径注射。
较佳地,步骤1)具体为:按实验室常规通用方法培养细菌,收集对数生长期的细菌菌体,先后置于-160℃液氮(半小时以上)和37℃水浴(至全部溶解)反复冻融三次,然后用超声波对冻溶后的细菌进行破碎,离心(4℃,10000rpm)10分钟后取上清即为细菌裂解物,此后将细菌裂解物即刻放入-80℃冷冻后用冻干机将其冻干成粉状后放入-20℃保存。具体实施时,使用的冻干机为美国labconcofreezone4.5。制备氨基化细菌裂解物时,用4℃超纯水1ml溶解细菌裂解物冻干粉10mg,完全溶解后成为溶液一;在4℃超纯水0.5ml中分别加入乙二胺(纯度≥99.5%)10μl,混匀后用盐酸(浓度为12mol/l)或氢氧化钠(浓度为1mol/l)调定至ph值为7~9,成为溶液二;在4℃超纯水125μl中加入1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(edc)5mg,溶解后成为溶液三。然后将溶液一置于放有磁珠的烧瓶中,开动磁珠搅拌(转动设定为2~3档,不要过于激烈),然后缓慢地将溶液二加入溶液一中,等溶液一和溶液二完全混合后再将溶液三缓慢加入,此后在低温环境中搅拌共48~52小时,在这个过程中,为了让edc能持续发挥作用,期间每隔12小时另外加入溶液三,每次125μl。最后将反应溶液(氨基化细菌裂解物)装进透析袋(mwco14k)并将其放入装有4℃超纯水1l的烧杯中进行4℃透析48小时,每间隔8~12小时换水一次,共4~5次,即可获得氨基化细菌裂解物溶液。然后用盐酸(浓度为12mol/l)或氢氧化钠(浓度为1mol/l)将透析获得的氨基化细菌裂解物溶液调定至ph值为7~9。用bca蛋白定量试剂盒并按试剂盒说明书推荐的方法检测蛋白含量,用磷酸盐缓冲溶液(pbs)调整至含蛋白质的浓度为0.2mg/100μl。
以上溶液按细菌裂解物冻干粉10mg为一配制单位,可根据细菌裂解物冻干粉的量适当增减相应反应溶液的剂量。
较佳地,步骤(2)具体为:按实验室培养肿瘤细胞的常规方法体外培养相应的肿瘤细胞,达到需要的细胞数量后收集对数生长期的细胞,计数后用pbs溶液将肿瘤细胞数量调整至1×106个细胞/100μl。然后按比例将肿瘤细胞50μl(含有0.5×106个细胞)和氨基化细菌裂解物溶液50μl(含有蛋白质0.1mg)混匀,室温下轻摇30分钟后就成为细菌化肿瘤细胞。
较佳地,步骤(3)具体为:将以上制备的细菌化肿瘤细胞放置于x线辐照仪(radsourcers2000)中,按照80~100gy的辐射强度对细菌化肿瘤细胞进行灭活后就制成了肿瘤细胞疫苗。灭活的目的是使细菌化肿瘤细胞当作疫苗注射后不再继续生长增殖和转移,从而达到安全的目的。然后按每只小鼠皮下注射3~5×105个细菌化肿瘤细胞作为疫苗(也可肌肉、血管或腹腔内注射)。在小鼠体内可诱导肿瘤细胞特异的免疫反应,在肿瘤模型小鼠中展示了良好的治疗肿瘤效果(图3),有可能转化应用于人类肿瘤的治疗。
本发明的有益效果是:
本发明提供一种细菌化肿瘤细胞疫苗及其制备方法,在肿瘤细胞表面覆盖一层细菌抗原成分(本发明称为细菌化),将细菌化的肿瘤细胞灭活后制备成为肿瘤特异疫苗,通过细菌化肿瘤细胞人为地给肿瘤细胞增加细菌的pamps信号。
用这种细菌化肿瘤细胞作为疫苗,在小鼠肿瘤模型中进行实验,发现注射这种细菌化肿瘤细胞疫苗后能有效诱导肿瘤细胞特异的免疫反应,具有很好的治疗肿瘤作用。本发明通过“细菌化肿瘤细胞”来制备肿瘤疫苗,这是一种新的制备肿瘤细胞疫苗的策略方法,具有临床转化应用的前景。在实际应用中,从肿瘤患者肿瘤组织中获得肿瘤细胞后用本发明的方法制备成患者肿瘤细胞特异的细菌化肿瘤细胞疫苗。本发明为转化应用于人类肿瘤的治疗应用提供了可行性及技术支持。
附图说明
图1为本发明制备细菌化肿瘤细胞的原理及具体实施流程示意图。
图2为本发明制备的细菌化肿瘤细胞在共聚焦显微镜下观察到的主要特征;图中,a用荧光染料fitc标记氨基化细菌裂解物(图中显示为绿色荧光),此后图b中将其用来细菌化肿瘤细胞,同时用dapi染色细胞核(显示为蓝色荧光);其中,a和b表示用共聚焦显微镜观察并在同一视野下收集的两种荧光影像;c为影像a和b的叠加组合图像,显示氨基化细菌裂解物和肿瘤细胞核的关系,说明有效地将细裂解物覆盖于肿瘤细胞表面。
图3为具体实施时将本发明制备的细菌化肿瘤细胞作为疫苗,在肿瘤模型小鼠上观察疫苗产生的效果;
其中,a中的小鼠为疫苗治疗组,b中的小鼠为非治疗对照组,可见疫苗治疗组5只小鼠中,3只小鼠肿瘤完全或几乎消失,另外2只小鼠肿瘤体积明显小于对照组。
具体实施方式
下面结合实施例对本发明作进一步的说明,但本发明不限于下述实施例,利用任何种类的细菌、任何种类的肿瘤细胞进行类似程序制备的肿瘤细胞疫苗都应属于本专利方法的范围。
图1为肿瘤细胞细菌化的主要原理和步骤,如图1所示,将细菌裂解物和过量带有阳性离子的氨基(-nh3+)的化合物(如乙二胺)混合,然后在edc的作用下,使得带有阳性离子的氨基(-nh3+)结合到细菌裂解物的蛋白质上,从而使细菌裂解物带有阳性电荷,此后加进细胞表面带有阴性电荷的肿瘤细胞,使二者通过正负电荷机制结合在一起,成为本发明提供的细菌化肿瘤细胞,灭活后将此细胞作为肿瘤疫苗。
一、制备细菌裂解物
(1)细菌培养基(液)的配制(以培养大肠杆菌为例)
液体lb培养基配制:将5g酵母提取物(yeastextract)、10g胰化蛋白胨(tryptone)和10g氯化钠(nacl)置于足够容量的容器中,加去离子水900ml溶解后用1mol/l氢氧化钠(naoh)调定ph值为7.2~7.4,然后用去离子水定容到1l,高压灭菌(121℃,0.1~0.15mpa,20min)。固体lb培养基配制:在液体lb培养基的基础上加15g琼脂糖,高压灭菌,然后倒入专用细菌培养专用平皿中供后继使用。
(2)细菌的培养和收集(以大肠杆菌菌株jm109为例)
将甘油保种并置于-80℃保存的大肠细菌菌株jm109菌种从冰箱中取出置于0℃冰浴中,用消毒牙签或接种环挑取少许冻结的菌液均匀涂布到含有固体lb培养基的细菌培养平皿上,然后将培养平皿置于37℃生化培养箱(任何品牌均可)中培养8-12小时,出现单菌落;第二天用消毒牙签或接种环挑选一个单菌落放入含有30ml液体lb培养基的培养瓶中,然后置于摇床中,摇床设定为225转/分和37℃,将瓶中的细菌培养12-16小时;然后按1:100比例将培养的菌液加入到新鲜的液体lb培养基中,置摇床225转/分37℃培养至od600值为0.4~0.6(培养时间约2.5小时)时离心(4℃、5000g离心5分钟),然后弃上清收获细菌体。
(3)获得大肠杆菌裂解物
用4℃pbs(放置于4℃冰箱中5小时以上)清洗以上获得的细菌两遍,然后用4℃超纯水洗一遍,按原液体积的1/10加入4℃超纯水重悬菌体,分别置于-160℃液氮(半小时以上)和37℃水浴(至全部溶解)反复冻融三次,然后用超声波对冻溶后的细菌进行破碎。超声波破碎时盛菌液的容器应置于冰水(4℃)中,置探头在液面下1/3的位置,超声时工作3秒,停5秒,功率30%,10分钟一次,暂停10分钟后继续,共3次。超声破碎后进行离心(4℃,10000rpm)10分钟取上清即为细菌裂解物,最后将细菌裂解物即刻放入-80℃冷冻后用冻干机(美国labconcofreezone4.5)将其冻干成粉状后放入-20℃保存供后续使用。
二、制备氨基化细菌裂解物
(1)溶液配制
用1ml4℃超纯水溶解细菌裂解物冻干粉10mg,完全溶解后成为溶液一;将乙二胺(纯度≥99.5%)10μl加入0.5ml4℃超纯水中,混匀后用盐酸(浓度为12mol/l)或氢氧化钠(浓度为1mol/l)将ph值调至8~9,加4℃超纯水至1ml后为溶液二;在4℃超纯水125μl中加入edc5mg,溶解后成为溶液三;以上溶液按细菌裂解物冻干粉10mg为一配制单位,可根据冻干粉的量按比例增减相应反应的溶液的量。
(2)氨基化细菌裂解物
先将溶液一置于放有磁珠的烧瓶中,开动磁珠搅拌(转动设定为2~3档,不要过于激烈),然后缓慢地将溶液二加入溶液一中,等溶液一和溶液二完全混合后再将溶液三缓慢加入,此后在低温(4℃)环境中搅拌共48小时,在这个过程中,为了让edc能持续起作用,期间每间隔8~12小时另外加入溶液三,每次125μl。
(3)去除杂质后获得氨基化细菌裂解物溶液
将以上氨基化细菌裂解物放置于透析袋(mwco14k)中,并将其放入置有4℃超纯水1l的烧杯中进行低温(4℃)透析48小时,每间隔8~12小时换水一次,共4~5次,即可获得氨基化细菌裂解物溶液。然后用盐酸(浓度为12mol/l)或氢氧化钠(浓度为1mol/l)将透析获得的氨基化细菌裂解物溶液调定至ph值为8~9。用bca蛋白定量试剂盒并按试剂盒说明书推荐的方法测蛋白含量,用pbs溶液调整至蛋白含量0.2mg/100μl。
三、培养和收集肿瘤细胞
从液氮罐中取出保种传代的肿瘤细胞,迅速放入37℃水浴锅中,反复摇晃至完全溶解,大约需要1-2分钟。此后离心(2000rpm)5分钟,去上清,加入和肿瘤细胞相应的培养液(比如dmem、rpmi1640等)、胎牛血清、抗生素、生长因子等(具体根据细胞商品说明书中推荐的方法进行),混匀后加入细胞培养瓶中,置于37℃、5%co2细胞培养箱中培养,然后每隔1-2天更换细胞培养液。待细胞生长到培养瓶80%左右弃去培养液,pbs溶液洗两遍,加入0.25%胰酶消化肿瘤细胞,然后换瓶继续扩增培养(以便达到所需要的细胞数量),待细胞生长到所需要的数量时,再用pbs溶液洗两遍,加入0.25%胰酶消化肿瘤细胞,然后离心(2000rpm)5分钟,去除上清,pbs溶液洗两次并计数,计数后用pbs溶液将肿瘤细胞数量调整至1×106个细胞/100μl,供后续细菌化使用。
四、制备细菌化肿瘤细胞疫苗
(1)细菌化肿瘤细胞
按肿瘤细胞50μl(含有0.5×106个细胞)+氨基化细菌裂解物溶液50μl(含有蛋白质0.1mg)的比例将二者混匀,室温下轻摇30分钟后就成为细菌化肿瘤细胞(图2)。图2所示为本发明制备的细菌化肿瘤(小鼠ct26结肠癌)细胞在共聚焦显微镜下观察到的主要特征;用荧光染料fitc标记(图2a,彩色图显示为绿色)氨基化细菌裂解物,此后将其用来细菌化肿瘤细胞,同时用dapi染色细胞核(图2b,彩色图显示为蓝色),用共聚焦显微镜观察并在同一视野下收集两种荧光影像,通过重叠组合两种荧光图像(图中的c)显示了绿色荧光(为细菌裂解物)和细胞核蓝色荧光之间的关系。此图结果说明氨基化的细菌裂解物有效地连接覆盖到了肿瘤细胞表面。
(2)灭活细菌化肿瘤细胞制成疫苗
将以上制备的细菌化肿瘤细胞放置于x线辐照仪(radsourcers2000)中,按照80~100gy的辐射强度对细菌化肿瘤细胞进行灭活制成疫苗。在肿瘤模型小鼠中,每只小鼠皮下注射(也可血管、肌肉或腹腔内)3~5×105个细菌化肿瘤细胞(100μl)作为疫苗。
五、细菌化肿瘤(ct26结肠癌)细胞疫苗效果观察
选用6-8周龄雌性balb/c小鼠10只,在背部左下侧皮下注射ct26小鼠结肠癌细胞2×106建立肿瘤模型,同时在背部右上测皮下注射以上灭活的细菌化ct26结肠癌细胞5×105个(溶于100100μlpbs中)作为疫苗,然后观察小鼠肿瘤的生长状况,在注射肿瘤细胞28天时断颈处死小鼠,取血清检测ct26结肠癌细胞特异性抗体,取脾脏淋巴细胞作为效应细胞进行ct26结肠癌细胞的杀伤实验。结果发现:疫苗治疗组5只小鼠中,3只小鼠肿瘤完全或几乎消失,另外2只小鼠肿瘤体积明显小于对照组(附图3),疫苗治疗组小鼠血清中有ct26结肠癌细胞特异的抗体,同时来源于疫苗治疗组的淋巴细胞对ct26结肠癌细胞也具有明显的杀伤作用。这些结果说明疫苗可以有效诱导ct26结肠癌细胞的特异免疫反应,可以有效治疗小鼠结肠癌。
以上所描述的仅为本发明的较佳实施例子,不能以此来限定本发明之权利范围,因此依本发明权利要求所作的等同变化,比如利用不同种细菌或细菌抗原成分连接覆盖到肿瘤细胞表面制成的疫苗仍属于本发明所涵盖的范围。
- 还没有人留言评论。精彩留言会获得点赞!