从水性溶液中低影响地回收锂的制作方法
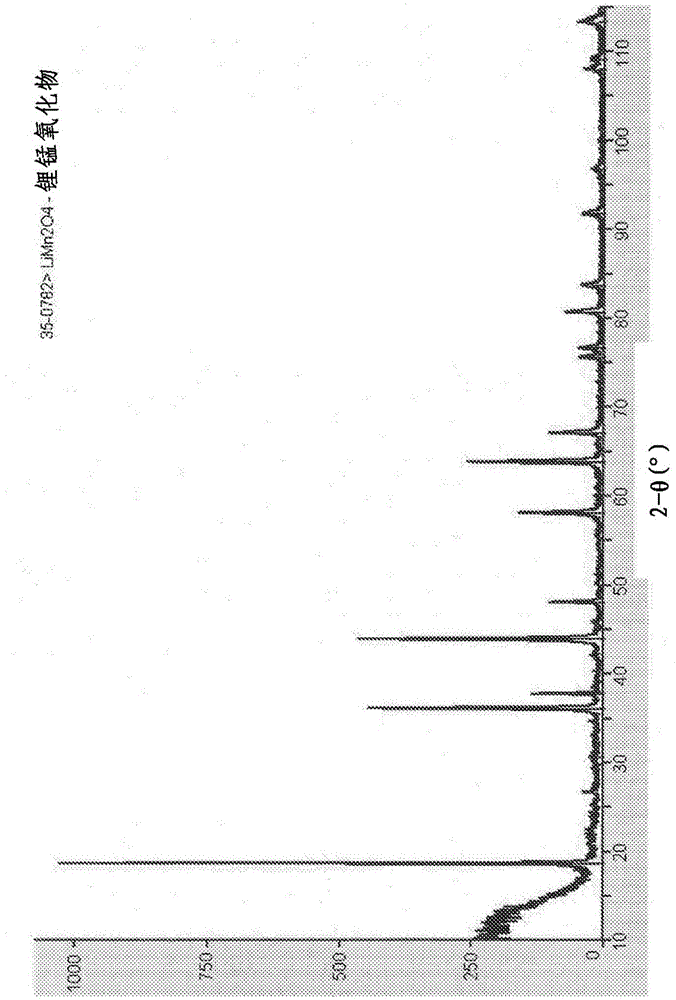
由于锂在不同领域的多种应用,例如电池、药理学制剂(例如,治疗躁狂抑郁症)、冷却剂、铝熔炼、陶瓷、搪瓷和玻璃、核燃料或铌酸锂、钽酸锂和氟化锂的电子级晶体的生产,无论在金属形式方面或者作为化合物,锂的工业重要性正在迅速增高。制造用于电动车辆和混合动力电动车辆的锂-空气电池和锂-离子电池中的多个部件(例如阴极材料和电解质盐)所需要的锂化合物。一些电池需要高纯度锂金属。在锂-离子电池的情况下,制造阴极可能需要锂化合物。锂化合物,例如锂锰氧化物、锂铁磷酸盐或混合的金属氧化物(例如锂钴镍锰氧化物)可被用作阴极的活性材料。通常通过从含锂矿物质(例如锂辉石(硅酸铝锂))中经过传统的开采进行提取、或通过从含锂盐水中提取而生产锂化合物(例如氯化锂或碳酸锂),所述含锂盐水例如在高海拔盐湖(例如智利的SalardeAtacama、玻利维亚的SalardeUyuni、阿根廷的SalardeOllaroz或SalardelHombreMuerto)中发现的盐水。可替代的盐水资源(例如地热、油田以及残余水热盐水)也是用于锂提取的有希望的来源。目前用于从高海拔湖泊中提取和纯化锂的商用方法依赖于氯化锂、氯化钠、氯化钾和氯化镁等的分馏重结晶的蒸发过程。在该过程中,含锂沉积物溶于水中或作为盐水回收、在开放池塘中蒸发以浓缩盐、以及通过加入苏打灰使锂沉淀为碳酸锂。随后,排出锂-贫化的盐水。化学加工相对简单,然而,由于发生在高海拔盐湖(高于海平面4,000米)(其中水资源缺乏并且生态系统脆弱),所述化学加工对环境具有高的影响。该提取过程极大地改变了高海拔盐湖中的水平衡,向环境中引入了化学品,并生成大量化学废物。例如,在太阳能的影响下,盐水的蒸发和浓缩是非常缓慢的过程,其中,每生产一公吨碳酸锂,则在高海拔沙漠地区通过蒸发损失至少成亿升(220,000US加仑)的水。陆地上的锂储备(主要来自盐水)为约1400万吨。感兴趣的是开发替代储备以满足增长的需求。在海水中,尽管锂的存在浓度远小于来自盐滩的盐水中的浓度(0.1-0.2ppm),但锂储备估计为约23,000万吨,因此,它的提取明显更贵。参见例如,Abe&Chitrakar,Hydrometallurgy19:117-128(1987);Chitrakar等,Ind.Eng.Chem.Res.40:2054-2058(2001);Kaneko&Takahashi,ColloidsandSurfaces47:69-79(1990);Kitajou,ArsSeparatoriaActa2:97-106(2003);Kunugita等,KagakuKogakuRonbunshu16:1045-1052(1990);Miyai等,SeparationScienceandTechnology23:179-191(1988);Ooi等,SeparationScienceandTechnology4:270-281(1986);DangandSteinberg,Energy3:325-336(1978);Ryabtsev等,RussianJournalofAppliedChemistry75:1069-1074(2002)。因此,需要有效且经济地从盐水和从低浓度来源中提取锂,并同时对环境具有较小影响的方法和装置。技术实现要素:本发明提供了有效且低环境影响的方法,用于从水性溶液(例如,来自高海拔盐湖的盐水)中回收锂。更具体而言,所公开的方法包括使用具有电极的电化学装置,所述电极对锂具有高度选择性。在提取步骤中,将锂离子置入充当阴极的电池型锂置入电极(例如,锰氧化物)的晶体结构中,其中,电解质为盐水或含锂的其它水性溶液。然后,在提取或浓缩步骤中,从锰氧化物的晶体结构中提取置入的锂,其中,电池型锂置入电极充当阳极,并且电解质是稀释的水性溶液。本发明还公开了包含三维电极的电化学装置,所述三维电极由嵌入在锂置入化合物(例如,锰氧化物)中的多孔基底(例如,碳毡)构成,并且将多个电化学装置组装以形成电化学反应器。在一些方面,所公开的电池型电极通过如下形成:用锂-锰氧化物/碳黑浆料浸渍多孔载体(例如碳毡或经煅烧的焦炭碳颗粒),并随后对锂-锰氧化物进行电解脱锂(delithiating)。本公开提供了用于从含有锂离子的水性溶液中提取锂的填充床电化学电池,所述填充床电化学电池包含:(a)第一电极,所述第一电极包含填充有高表面碳基底的隔室,所述高表面碳基底涂覆有包含LiMn2O4的锂置入化合物;(b)第二电极,所述第二电极包含填充有高表面碳基底的隔室,所述高表面碳基底涂覆有氯化物可逆电极材料;以及(c)插入至第一电极与第二电极之间的非膜状多孔材料;其中,所述高表面碳基底包含经煅烧的焦炭碳颗粒。在一些方面,经煅烧的焦炭碳颗粒为经煅烧的石油焦炭碳颗粒。在一些方面,氯化物可逆电极材料包含聚吡咯。在一些方面,分隔第一电极和第二电极的非膜状多孔材料包含多孔烧结的玻璃分隔物。在一些方面,填充床电化学电池进一步包含与电极相接触的集电触头。在一些方面,集电触头为钛网集电体。本公开还提供了填充床电化学反应器,所述填充床电化学反应器包含至少两个填充床电化学电池。本公开还提供了用于从含有锂离子的水性溶液中提取锂的电化学方法,所述方法包括:(a)使两个电极与含有锂离子的水性溶液接触,其中,所述电极为电池型电极和氯化物或聚吡咯可逆电极;(b)在两个电极之间施加电压或循环电流,其中,通过电池型电极捕获锂离子;以及(c)用氯化锂的稀溶液(或氯化钾的稀溶液)替换含有锂离子的水性溶液,并使电极性反转;其中,极性反转使锂离子从电池型电极释放入稀溶液中。在一些方面,上述公开的方法进一步包括:重复步骤(a)-步骤(c)至少两次,使用从在先步骤(c)得到的含有锂离子的水性溶液作为后续的步骤(a)的含有锂离子的水性溶液,其中,将来自各相继的步骤(c)的水性溶液用作下一步骤(a)的含有锂离子的水性溶液。在一些方面,重复步骤(a)-步骤(c)至少三次,其中,将来自各相继的步骤(c)的水性溶液用作下一步骤(a)的含有锂离子的水性溶液。在一些方面,水性溶液选自于由以下溶液所组成的组:海水、湖水、地下水、温泉水、地热盐水、油田盐水、残余水热盐水、或高海拔盐湖盐水。在具体的方面,水性溶液为海水。在其它的具体方面,水性溶液为高海拔盐湖盐水。在一些方面,水性溶液包含锂离子和杂质非锂金属离子。在一些方面,电池型电极为锂置入电池型电极,所述电极包含多孔或高表面基底和锂置入化合物。在一些方面,基底是碳基底。在其它方面,碳基底是导电性基底。在一些方面,电池型电极包含导电性添加材料。在某些方面,导电性添加材料是碳黑。在一些方面,锂置入化合物包括锰氧化物。在一些方面,锰氧化物包括γ-MnO2和/或λ-MnO2。在一些方面,锰氧化物具有尖晶石晶体结构。在某些方面,锰氧化物包括LiMn2O4。在其它方面,锂置入化合物包括锂钴氧化物、锂铁磷酸盐、锂锰氧化物或者它们的组合。在一些方面,锂钴氧化物包括LiCoO2。在其它方面,锂铁磷酸盐包括LiFePO4。在一些方面,电池型电极通过多孔基底或高表面基底的电解脱锂制备,所述多孔基底或高表面基底涂覆有锂钴氧化物(LiCoO2)、锂铁磷酸盐(LiFePO4)、锂锰氧化物(LiMn2O4)或它们的组合。在一些方面,碳基底选自于由以下物质所组成的组:碳毡、碳布、碳纸、石墨粒子、石墨泡沫、高表面积石墨纤维以及它们的组合。在一些方面,碳基底为碳毡。在一些方面,碳基底为经煅烧的焦炭碳基底。在一些方面,氯化物可逆电极包含多孔碳基底或高表面碳基底以及银金属颗粒。在其它方面,银金属颗粒为纳米颗粒。在一些方面,氯化物可逆电极包含导电聚合物。在其它方面,导电聚合物为聚吡咯。在一些方面,通过置入电池型电极的晶体结构中来捕获处于水性溶液中的锂离子。本公开还提供了用于从含有锂离子的水性溶液中提取锂的电化学装置,所述电化学装置包含至少一个电池型电极,所述电池型电极包含涂覆有锂置入化合物的多孔基底或高表面基底,其中,所述装置不包含反电极。在一些方面,装置进一步包含氯化物可逆电极或聚吡咯可逆电极。在一些方面,基底为碳基底。在其它方面,碳基底为导电性基底。在一些方面,电池型电极包含导电性添加材料。在一些方面,导电性添加材料为碳黑。在其它方面,锂置入化合物包括锰氧化物。在一些方面,锰氧化物包括γ-MnO2和/或λ-MnO2。在一些方面,锰氧化物具有尖晶石晶体结构。在一些方面,锰氧化物括含LiMn2O4。在其它方面,锂置入化合物包括锂钴氧化物、锂铁磷酸盐、锂锰氧化物或它们的组合。在一些方面,锂钴氧化物包括LiCoO2。在其它方面,锂铁磷酸盐包括LiFePO4。在一些方面,电池型电极通过多孔基底或高表面基底的电解脱锂制备,所述多孔基底或高表面基底涂覆有锂钴氧化物(LiCoO2)、锂铁磷酸盐(LiFePO4)、锂锰氧化物(LiMn2O4)或它们的组合,在一些方面,碳基底选自于由以下物质所组成的组:碳毡、碳布、碳纸、石墨粒子、石墨泡沫、高表面积石墨纤维以及它们的组合,在一些方面,碳基底为碳毡,在一些方面,碳基底为经煅烧的焦炭碳基底,在一些方面,氯化物可逆电极包含多孔基底或高表面碳基底以及银金属颗粒。在一些方面,银金属颗粒为纳米颗粒。在一些方面,氯化物可逆电极包含导电聚合物。在一些方面,导电聚合物为聚吡咯。在其它方面,通过置入电池型电极的晶体结构中来捕获水溶液中的锂离子。在一些方面,电池型电极和氯化物可逆电极位于分开的半电池中。在一些方面,通过半渗透性的电解膜分隔开包含电池型电极的半电池和包含氯化物可逆电极的半电池。在一些方面,电解膜为离聚物膜。在一些方面,离聚物膜为膜。在一些方面,膜为324。在一些方面,包含电池型电极的半电池和包含氯化物可逆电极或聚吡咯可逆电极的半电池未被半渗透性的电解膜分隔开。在一些方面,通过多孔材料分隔开包含电池型电极的半电池和包含氯化物可逆电极或聚吡咯可逆电极的半电池。在一些方面,多孔材料为纱。在一些方面,纱为聚酯纱。在一些方面,多孔材料为多孔的烧结玻璃。本公开还提供了用于从含有锂离子的水性溶液中提取锂的锂提取设备,所述锂提取设备包含至少一个如本文所公开的电化学装置。在一些方面,含有锂离子的水性溶液为盐水。在其它方面,盐水从高海拔盐湖中得到。在一些方面,通过清洁能源电压源控制锂提取设备。在其它方面,清洁能源电压源为太阳能源。本公开还提供了制造高纯度锂的方法,所述方法包括使用本文所公开的方法、电化学装置或锂提取设备。本公开还提供了用于从含有锂离子的水性溶液中提取锂的电化学方法,所述电化学方法包括使用:(a)本文所公开的填充床电化学电池、(b)本文所公开的填充床电化学反应器、(c)本文所公开的锂提取方法、(d)本文所公开的电化学装置、(e)本文所公开的锂提取设备、或者(e)它们的任意组合。附图说明图1是表示LiMn2O4标准品的X射线衍射图案的图。图2是表示在实验室中制备、并用于使用电化学离子交换从盐水中提取锂的分析中的锂和锰的氧化物(LiMn2O4)样品的X射线衍射图案的图。图3是LiMn2O4纳米晶体的电子显微图像,所述LiMn2O4纳米晶体用于使用电化学离子交换从盐水中提取锂。图4是导电性碳毡电极的电子显微图像。图5示出了用于从盐水中提取锂的电化学电池。将阴极置入包含盐水的“S”半电池中。将阳极置入包含0.1MHCl溶液的“HCl”半电池中。将离聚物膜插入两个半电池之间。图6示出了在50mMLiClO4水性溶液中于50mVs-1下,嵌有LiMn2O4的碳毡电极的循环伏安图。锰氧化物中的锂离子化学嵌入根据以下公式进行:LiMn2O4(LiMnIIIMnIVO4)→2α-MnO2+Li++e-。图7(A)是表示FM100型电化学反应器的示意图,所述电化学反应器用于从盐水和浓缩的氯化锂溶液中电化学提取锂。图7(B)示出了拆开的FM100型电化学反应器的组件。图8是用于从盐水中提取锂离子的电化学反应器的照片,所述电化学反应器具有穿过半电池的盐水循环,所述半电池含有阴极和处于连接至钛泵(ColeParmer75211流量泵)的阳极中的锂提取溶液。图9示出了相对于Ag/AgCl在0.2V下,置入LiMn2O4碳负载电极中的锂离子电流瞬态,以及在50mM高氯酸锂水性溶液中于1.2V下相对于Ag/AgCl而言的锂释放。图10是表示聚吡咯的氧化态/还原态的示意图,在氧化时摄取阴离子以保持电荷中性,另一方面,在还原时将阴离子释放入溶液中。图11A、图11B和图11C示出了用于在实施例7中出现的聚吡咯/碳电极和LiMn2O4/碳电极系统中的实验装备的不同视图。图12示出了在碳毡中的碳纤维的SEM显微照片,所述碳毡被LiMn2O4晶体覆盖,对应于实施例7中出现的实验装备。图13示出了描绘沉积在碳毡上的聚吡咯的SEM显微照片,对应于实施例7中出现的实验装备。图14示出了对应于LiMn2O4/碳毡阴极中的四个氯化锂捕获步骤的瞬态,对应于实施例7中出现的实验装备。图15示出了一系列锂回收步骤的电流瞬态,在锂回收步骤中,根据实施例7中的实验条件从LiMn2O4电极释放锂。图16示出了根据实施例7中的实验条件,在锂离子从LiMn2O4/碳电极释放入电解质期间的电荷演变。图17示出了负载有LiMn2O4晶体的焦炭颗粒的SEM显微照片,对应于在实施例8中出现的实验装备。图18显示了具有电解质的轴向磁通和垂直电流的压滤机反应器(FM100型)。所述反应器由如下组成:(i)钛集电体、(ii)处于一个电极的LiMn2O4的石油煅烧焦炭碳支撑物和碳毡支撑物、(iii)处于其它电极的碳毡支撑物和聚吡咯、(iv)聚四氟乙烯框架、以及(v)未分开的电池中的聚酯纱。图19示出了根据实施例8中的实验条件,对应于锂离子由LiMn2O4电极捕获和释放的充电瞬态和放电瞬态。图20示出了根据实施例8中的实验条件,在2小时内于恒定电流(±0.5mA/cm2)下通过LiMn2O4电极的放电和充电曲线。图21示出了根据实施例8中的实验条件,LiMn2O4电极的电势-充电曲线。图22示出了实验室规模的三维反应器,所述三维反应器具有分别负载有LiMn2O4和聚吡咯的焦炭紧凑床电极,对应于实施例8中出现的实验填充床装备。图23示出了纵向填充床圆柱形反应器原型,所述反应器原型包含具有通过多孔烧结玻璃分隔开的两个隔室的玻璃圆筒、具有钛棒电连接器的钛网集电体、含有20g负载有电极材料的焦炭的两个填充床、橡胶塞、以及连接至活塞式流量泵的管。图24示出了使用水银压力计在不同流速(每秒0-30mL)下测定图23中所示的反应器中的压降。具体实施方式本发明公开了有效且环境友好的方法,所述方法用于从含有锂离子的水性电解溶液中提取锂值(lithiumvalue)以及其它金属离子如钠离子、钾离子、镁离子和氯离子(例如,富含氯化物的盐水、海水等)。本文所述的方法和装置从含有其它离子的溶液中(甚至当这些其它离子以相对高的浓度存在时)选择性地提取锂。本公开还提供了用于以低能耗快速提取锂的清洁技术。在这方面,不同于目前用于从南美和其它地点的盐湖中回收锂的蒸发方法,本文所公开的方法和装置可用于从高海拔湖泊中的盐沉积物或盐水中提取锂而不改变水的平衡。应当注意的是,本文所公开的方法可应用于例如:(i)仅含有锂、或含有锂和其它盐的人工盐水;以及(ii)天然盐水。本领域技术人员将明白的是,适合于从仅含有锂、含有锂和低浓度的其它盐的人工盐水中,或者从具有限定组成的人工盐水中提取锂的方法,可能无法成功地从不仅含锂而且还含有高钠浓度和高浓度的许多其它盐的天然盐水中提取锂。特别是,本公开提供了用于从含有锂离子的水性溶液中提取锂的电化学方法,所述电化学方法包括将锂离子置入到锂置入材料(例如,锰氧化物)的晶体结构中,所述锂置入材料嵌在阴极中的多孔基底上(例如,碳毡),并且随后锂离子从阳极中的锂饱和氧化物的晶体结构中脱出(提取)。在一些方面,锂置入材料通过经煅烧的焦炭碳颗粒支撑。在美国专利公开号2011/0174739中已描述了从海水(含有约0.17mg/L锂)中回收锂,使用了以锰氧化物作为聚合物膜中的吸附剂的吸附/脱附方法。不同于本发明,膜中吸附的锂随后通过用盐酸溶液进行处理而释放,导致产生了大量的化学废物。本文所公开的方法通过使用电化学途径而避免了这一缺陷,其中,低价金属阳离子在电池型锂置入电极中氧化、并且氯化物通过电还原在氯化物可逆电极处释放。在一个方面,本文所公开的电化学方法包括将立方尖晶石锰氧化物MnO2的MnIV离子还原为MnIII,随后经历了存在于溶液(例如,盐湖盐水或海水)中的锂离子向LiMn2O4氧化物(或另一合适的锂离子置入材料,例如LiCoO2、LiFePO4等)的晶体结构中的自发置入。在本文所公开方法的后续的锂浓缩步骤中,通过恢复电化学电池的极性,将MnIII氧化为MnIV,从而将存在于离子置入材料的晶体结构中的置入锂离子释放至水性溶液。这使得水性溶液中的氯化锂的浓度增高。同样地,可通过使用其它锂置入材料(例如含铁或钴的锂化合物)而推广所述方法。在这些情况下,例如分别在含有LiCoO2和LiFePO4的电极中将CoII氧化为CoIII、或将FeII氧化为FeIII,将各自晶体结构中含有的锂离子释放至水性溶液。在两个步骤(锂提取以及锂释放/浓缩)中,第二电极是可逆电极,例如Ag/AgCl可逆电极或聚吡咯可逆电极。例如,在锂提取步骤中,Ag/AgCl可逆电极可从溶液中摄取氯离子以形成不溶的氯化银。然后,在锂释放/浓缩步骤中,Ag/AgCl可逆电极可通过形成金属银而将氯化物释放至溶液中。类似地,当将聚吡咯可逆电极用于锂释放/浓缩步骤中时,聚吡咯将氯离子释放至溶液中。因此,电化学电池中的电荷平衡通过氯离子和锂离子维持,并且没有氢离子的失衡而改变溶液pH(这是相对于使用非活性反电极的方法的关键区别,例如美国专利号5,198,081中所述的方法)。定义本文所使用的术语“锂”是指取决于上下文的锂金属、锂离子、锂原子或锂化合物。术语“锂化合物”涉及从含有锂离子的水性溶液中提取的锂产物,例如氯化锂、氢氧化锂、磷酸锂和碳酸锂等。本文所使用的术语“电池型电极”是指包含通常在锂电池阴极发现的组分的电极,例如具有尖晶石结构的锂锰氧化物。正尖晶石结构通常为立方密堆积氧化物,各氧化物具有一个八面体位点和两个四面体位点。四面体点小于八面体点。由于电荷因子(chargefactor),三价阳离子(B3+)占据了八面体孔,但只能占据半数的八面体孔。二价阳离子(A2+)占据1/8的四面体孔。正尖晶石为LiMn2O4。另外,存在中间情形,其中阳离子分布可描述为(Α1-xΒx)[Αx/2Β1-x/2]2O4,其中,圆括号()和方括号[]分别用于表示四面体位点和八面体位点,并且A和B代表阳离子。所谓的反转程度x的取值介于0(正常)至1(反转)之间,并且对于完全随机的阳离子分布而言,x=2/3。本文所使用的术语“锂置入化合物”是指能够可逆地寄存(host)并释放锂的化合物。在置入过程中,锂离子嵌入寄存化合物的晶体结构中。本文所使用的术语嵌入是指材料的如下性质:允许离子容易地进出材料的晶体结构而材料不用改变其晶体结构。本文所使用的术语“导电性基底”是指用作电极的基底。因此,本文所使用的导电性基底涵盖了由导电性材料制成的基底、以及通过将“导电性添加材料”的导电层涂敷、沉积或层压在非导电性基底的表面上而获得的基底。术语“导电性添加材料”是指可施用至另外的非导电性基底以赋予其导电性的导电组合物。导电性添加材料可包含导电微粒或非微粒材料。例如,导电性添加材料可包含导电性材料,例如碳黑或碳纳米纤维。其它合适的导电微粒材料包括但不限于,金属微粒(例如,处于具有不同尺寸和不同尺寸分布的粒子、薄片、球体形式的导电金属,如铝、银、镍等)、非导电级的碳黑、涂覆有导电性材料的颗粒或纤维、碳纤维、固有导电聚合物(即,一类具有共轭链构造、赋予其类似半导体的传输电子的固有能力的聚合物材料,例如聚乙炔或聚苯胺)。导电性添加材料还可包含在其中分散着导电性材料的液体组分。用于导电性添加材料中的液体组分可选自多种液体组分。合适的液体组分包括但不限于:聚酯载体、多元醇载体、环氧树脂、增塑剂和单体(例如,苯乙烯、二乙烯基苯和乙烯基甲苯等)。本文所使用的术语“基底”是指在制造电极的过程中使用的结构,在所述结构上建造其它层,例如在所述结构上沉积锰氧化物的碳毡。在一些方面,基底包含经煅烧的焦炭碳颗粒。在一些方面,通过石油煅烧生成焦炭碳颗粒。本文所使用的术语“纳米颗粒”是指具有至少两个100纳米(nm)以下的尺寸的颗粒。术语纳米颗粒包括,例如纳米球、纳米棒、纳米纤维,包括纳米线、纳米带、纳米片、纳米卡(nanocards)和纳米棱柱(nanoprisms)。本文所使用的术语“碳黑”是指通过碳质燃料的不完全燃烧或热分解制得的任意的各种细碎形式的碳。本文所使用的术语“碳毡”是指主要包含随机取向并交织的碳纤维的纺织材料,所述碳纤维通常通过有机毡的碳化制成(参见例如,IUPACCompendiumofChemicalTerminology第二版(1997))。最典型的是,有机纺织纤维毡在至少1200°K、更典型在1400°K、并且最典型在1600°K的温度下于惰性气氛中接受热解,使得残余物的碳含量为90wt%、更典型为95wt%、最典型为99wt%。碳毡的表面为至少约0.01-100m2/g、并且更典型为0.1-5m2/g、最典型为0.3-3m2/g。当碳毡活化时,碳毡的表面积通常大于100-500m2/g、更典型为至少约500-1200m2/g、并且最典型为至少约1200-1500m2/g以上。根据有机纺织材料和碳化条件,碳毡可为石墨的、非晶形的、具有部分金刚石结构(添加或通过碳化形成)、或它们的混合物。必须注意的是,当在本说明书和所附的权利要求书中使用时,除非上、下文另有明确指示,单数形式的“一(a、an、the)”包含复数形式。本文中的术语“一(a或an)”以及术语“一个或多个”、“至少一个”可互换使用。此外,本文所使用的“和/或”用作两个指定特征的各特征、或者具有或不具有另一组分的两个指定组分的各组分的具体公开。因此,例如在本文所述的短语“A和/或B”中使用的术语“和/或”旨在包括“A和B”、“A或B”、“A”(单独)、以及“B”(单独)。同样地,例如在短语“A、B和/或C”中使用的术语“和/或”旨在涵盖以下各个实施方式:A、B和C;A、B或C;A或C;A或B;B或C;A和C;A和B;B和C;A(单独);B(单独);以及C(单独)。单位、前缀和符号以在其SystèmeInternationaldeUnites(SI)中接受的形式加以表示。数值范围包括限定该范围的数字在内。本文所提供的标题并不会限制本发明的各个方面或实施方式,可通过将申请文件作为整体进行参考而获得。将能理解的是,在本文中无论何处使用措词“包含”对实施方式进行描述时,还提供了以术语“由···组成”和/或“基本上由…组成”描述的另外的类似实施方式。提取锂的电化学方法本公开提供了用于从含有锂离子的水性溶液中提取锂的电化学方法,所述方法包括:i.将两个电极与含有锂离子的水性溶液接触,其中,所述电极(阳极和阴极)为电池型电极和氯化物可逆电极(“锂提取步骤”);ii.在两个电极之间(在锂提取步骤中,阴极负极且阳极正极)施加电压或循环电流,其中,通过电池型电极捕获锂离子;以及iii.用氯化锂的稀溶液替换含有锂离子的水性溶液,并使电极性反转,由此将锂离子释放入稀溶液中(“锂释放/浓缩步骤”)。在一些方面,步骤(ii)和(iii)重复多次。在一些方面,步骤(ii)和(iii)重复2次。在一些方面,步骤(ii)和(iii)重复3次。在一些方面,步骤(ii)和(iii)重复4次。在一些方面,步骤(ii)和(iii)重复多于4次。在一些方面,步骤(ii)和(iii)的重复可提高稀溶液中的Li:Na浓度比,相对于盐水提高至少2倍、至少4倍、至少6倍、至少8倍、至少10倍、至少20倍、至少30倍、至少40倍、至少50倍、至少60倍、至少70倍、至少80倍、至少90倍、至少100倍、至少200倍、至少300倍、至少400倍、至少500倍、至少600倍、至少800倍、至少900倍、至少1000倍、至少1100倍、至少1200倍、至少1300倍、至少1400倍、至少1500倍、至少1600倍、至少1700倍、1800倍、1900倍或至少2000倍。在一些方面,由于步骤(ii)和(iii)的重复而在Li:Na浓度方面的提高可用于增高使用本文公开方法生产得到的锂的纯度。在一些方面,步骤(iii)重复多次。在一些方面,步骤(iii)重复2次。在一些方面,步骤(iii)重复3次。在一些方面,步骤(iii)重复4次。在一些方面,步骤(iii)重复多于4次。在一些方面,步骤(iii)的重复可提高稀溶液中的Li:Na浓度比,相对于盐水提高至少2倍、至少4倍、至少6倍、至少8倍、至少10倍、至少20倍、至少30倍、至少40倍、至少50倍、至少60倍、至少70倍、至少80倍、至少90倍、至少100倍、至少200倍、至少300倍、至少400倍、至少500倍、至少600倍、至少800倍、至少900倍、至少1000倍、至少1100倍、至少1200倍、至少1300倍、至少1400倍、至少1500倍、至少1600倍、至少1700倍、1800倍、1900倍或至少2000倍。在一些方面,步骤(iii)的重复可使盐水中的Li:Na浓度提高大于2000倍。在一些方面,步骤(iii)的重复可提高盐水中的Li:Na浓度大于2000倍。在一些方面,由步骤(iii)的重复得到的Li:Na浓度的提高可用于增高使用本文公开方法生产得到的锂的纯度。在一些方面,可将步骤(iii)中获得的水性溶液用作步骤(i)的含有锂离子的水性溶液,并且步骤(i)至步骤(iii)可循环进行,使用来自各相继的步骤(iii)中的水性溶液作为下一步骤(i)的含有锂离子的水性溶液。在一些方面,步骤序列(i)-(iii)重复2次,其中,将来自各相继的步骤(iii)中的水性溶液用作下一步骤(i)的含有锂离子的水性溶液。在一些方面,步骤序列(i)-(iii)重复3次,其中,将来自各相继的步骤(iii)中的水性溶液用作下一步骤(i)的含有锂离子的水性溶液。在一些方面,步骤序列(i)-(iii)重复4次,其中,将来自各相继的步骤(iii)中的水性溶液用作下一步骤(i)的含有锂离子的水性溶液。在一些方面,步骤序列(i)-(iii)重复多于4次,其中,将来自各相继的步骤(iii)中的水性溶液用作下一步骤(i)的含有锂离子的水性溶液。在一些方面,步骤序列(i)-(iii)的重复(其中,将来自各相继的步骤(iii)中的水性溶液用作下一步骤(i)的含有锂离子的水性溶液)可提高稀溶液中的Li:Na浓度比,相对于盐水提高至少2倍、至少4倍、至少6倍、至少8倍、至少10倍、至少20倍、至少30倍、至少40倍、至少50倍、至少60倍、至少70倍、至少80倍、至少90倍、至少100倍、至少200倍、至少300倍、至少400倍、至少500倍、至少600倍、至少800倍、至少900倍、至少1000倍、至少1100倍、至少1200倍、至少1300倍、至少1400倍、至少1500倍、至少1600倍、至少1700倍、1800倍、1900倍或至少2000倍。在一些方面,步骤序列(i)-(iii)的重复(其中,将来自各相继的步骤(iii)中的水性溶液用作下一步骤(i)的含有锂离子的水性溶液)可使盐水中的Li:Na浓度提高大于2000倍。在一些方面,步骤序列(i)-(iii)的重复(其中,将来自各相继的步骤(iii)中的水性溶液用作下一步骤(i)的含有锂离子的水性溶液)可使盐水中的Li:Na浓度提高大于2000倍。在一些方面,由步骤序列(i)-(iii)的重复(其中,将来自各相继的步骤(iii)中的水性溶液用作下一步骤(i)的含有锂离子的水性溶液)得到的Li:Na浓度的提高可用于增高使用本文公开方法生产得到的锂的纯度。在一些方面,可将所公开的方法施用至含有锂的多种水性溶液,例如海水、湖水、地下水、温泉水、地热盐水、油田盐水和残余的水热盐水等。因此,在一些方面,水性溶液可含有低浓度的锂(例如,海水为约0.17ppm),而在其它方面,水性电解质溶液可含有高浓度的锂(例如,来自高海拔湖泊的盐水为约700ppm)。在一些方面,水性电解质溶液中的锂浓度为至少约0.10ppm、或至少约0.12ppm、或至少约0.14ppm、或至少约0.16ppm、或至少约0.18ppm、或至少约0.20ppm、或至少约0.22ppm、或至少约0.24ppm、或至少约0.26ppm、或至少约0.28ppm、或至少约0.30ppm。在一些方面,水性电解质溶液中的锂浓度为至少约0.4ppm、或至少约0.5ppm、或至少约0.6ppm、或至少约0.7ppm、或至少约0.8ppm、或至少约0.9ppm、或至少约1ppm。在其它方面,水性电解质溶液中的锂浓度为至少约2ppm、或至少约3ppm、或至少约4ppm、或至少约5ppm、或至少约6ppm、或至少约7ppm、或至少约8ppm、或至少约9ppm、或至少约10ppm。在其它方面,水性电解质溶液中的锂浓度为至少约20ppm、或至少约30ppm、或至少约40ppm、或至少约50ppm、或至少约60ppm、或至少约70ppm、或至少约80ppm、或至少约90ppm、或至少约100ppm。在其它方面,水性电解质溶液中的锂浓度为至少约150ppm、或至少约200ppm、或至少约250ppm、或至少约300ppm、或至少约350ppm、或至少约400ppm、或至少约450ppm、或至少约500ppm、或至少约550ppm、或至少约600ppm、或至少约650ppm、或至少约700ppm、或至少约750ppm、或至少约800ppm、或至少约850ppm、或至少约900ppm、或至少约950ppm、或至少约1000ppm。本文所公开的方法可施用至含有锂的任何水性电解质溶液,例如含有氯化锂、碳酸锂、氢氧化锂、硫酸锂、硝酸锂、磷酸锂等的溶液。在一些方面,可将所公开的方法施用至包含锂离子、以及杂质非锂金属离子(例如钠、钾等)和/或非金属离子(例如氯化物、硫酸根、碳酸根、硝酸根等)的水性溶液。另一方面,可将所公开的方法施用至含有纯化或部分纯化的单一的锂化合物(例如碳酸锂)的溶液,从而生产氯化锂。还可通过保持电极性并反转半电池(其中,各电极定位),而非保持电极的位置并反转电极性,从而施用所公开的方法。在一些方面,可用高氯酸锂稀溶液替换“锂释放/浓缩步骤”中的氯化锂稀溶液。通常将高氯酸锂用作锂电池中的非活性电解质。还可将含锂矿石(例如,锂辉石、透锂长石、锂磷铝石、锂云母如铁锂云母或鳞云母(lepidolite))用作提供从其产生的含锂水性电解质溶液的来源。在一些方面,可通过溶解天然沉积物(例如,来自高海拔盐湖的盐沉积物或地下蒸发盐沉积物)或人工沉积物(例如,来自盐场的盐沉积物)来制备适用于本文所公开的方法的水性电解质溶液。在一些方面,在根据本文所公开的电化学方法进行纯化之前,可通过本领域已知的用于除去或减少各杂质的适当方法(例如,沉淀或离子交换)来减少或除去存在于水性电解质溶液中的杂质(例如,除锂以外的离子,如金属离子或非金属离子)。在一些方面,可通过常规能源(例如,由常规化石燃料源(如煤或天然气)、或者核能产生的电力)或清洁能源、例如太阳能(例如来自热发生器或光电发生器)提供电压或循环电流。可使用其它清洁能源,例如从水力发电机、生物质、地热源、风能、波/潮汐能、掩埋气或气体驱动的燃料电池获得的能量。在一些方面,在两个电极之间施加小的DC电压,所述电极为锂提取步骤中的电池型电极负极和氯化物可逆电极正极。在一些方面,DC电压介于约0.1V至约0.5V之间。在一些方面,DC电压低于0.1V。在其它方面,DC电压高于0.5V。在一些方面,DC电压为至少约0.1V、或至少约0.2V、或至少约0.3V、或至少约0.4V、或至少约0.5V。或者,DV电流能够以相同的电极极性循环。在一些方面,DC电流介于0.5mA.cm-2至1.0mA.cm-2之间。在一些方面,DC电流低于0.5mA.cm-2。在其它方面,DC电流高于1.0mA.cm-2。在一些方面中,DC电流为至少约0.5mA.cm-2、或至少约0.6mA.cm-2、或至少约0.7mA.cm-2、或至少约0.8mA.cm-2、或至少约0.9mA.cm-2、或至少约1.0mA.cm-2。在一些方面,本文公开的提取物电化学工艺可在恒定电势下操作。在其它方面,本文公开的提取物电化学工艺可在电流控制下操作。在一些方面,在将水性溶液与电极接触并在电极之间施加DC电压后,可通过稀的水性溶液(例如,氯化锂稀溶液)替换水性电解质溶液,从而对电化学电池提供欧姆导电性,并且电极性可随后反转。在该步骤中,电池型锂置入电极(例如,负载有锰氧化物的碳毡)为正极,且锰离子(或钴、铁等,取决于所使用的锂置入化合物)可被氧化以将锂离子释放至稀溶液中。结果,稀的水性溶液中的锂离子浓度增高。另一方面,氯化物可逆电极(例如,银/氯化银电极或聚吡咯电极)为负电极。当负极中的材料还原时,例如聚吡咯或氯化银发生还原(例如,还原为银),则释放氯离子以形成氯化锂浓缩溶液。在一些方面,在电解质极性反转之前,稀溶液中的氯化锂浓度为约50mmol。在一些方面,在电解质极性反转之前,稀溶液中的氯化锂浓度为至少约10mmol、或至少约15mmol、或至少约20mmol、或至少约25mmol、或者至少约30mmol、或至少约35mmol、或至少约40mmol、或者至少约45mmol、或至少约50mmol、或者至少约55mmol、或至少约60mmol、或至少约65mmol、或至少约70mmol、或至少约75mmol、或至少约80mmol、或至少约85mmol、或至少约90mmol、或至少约95mmol、或至少约100mmol。本文所公开的电池型锂置入电极可包含多孔或高表面基底以及锂置入化合物。所述多孔或高表面基底可为,例如导电性多孔碳毡、网状玻璃碳、经煅烧的焦炭碳、或者在其中可嵌入锂置入材料的任何其它大面积导电性碳电极材料。可将任何高表面或多孔碳结构、或它们的组合用于制造本文所公开的电极。例如,可使用碳布、碳纸、石墨粒子、石墨泡沫、高表面积石墨纤维、经煅烧的焦炭碳等制造电极。还可使用非碳基的导电性多孔基底。在一些方面,基底为包含碳组分和非碳粘合剂的高表面复合材料,所述碳组分例如碳粉或碳纤维、和/或经煅烧的焦炭碳。在一些方面,可使用碳材料的组合(例如含有碳基泡沫、或碳颗粒、或经煅烧的焦炭碳的碳布套)制造电极。在一些方面,锂置入电极包含高表面或多孔基底,所述基底包含经煅烧的焦炭碳颗粒。在一些方面,通过石油煅烧获得经煅烧的焦炭碳颗粒。在一些方面,经煅烧的焦炭碳颗粒的直径为约200微米至约800微米。在一些方面,经煅烧的焦炭碳颗粒的直径为至少约100微米、至少约200微米、至少约300微米、至少约400微米、至少约500微米、至少约600微米、至少约700微米、至少约800微米、至少约900微米或至少约1000微米。在一些具体方面,经煅烧的焦炭碳颗粒的直径为约500微米。在一些方面,碳毡基底的表面积为约500m2g-1至约3000m2g-1。在一些方面,碳毡基底的表面积为至少约500m2g-1、至少约600m2g-1、至少约700m2g-1、至少约800m2g-1、至少约900m2g-1、至少约1000m2g-1、至少约1100m2g-1、至少约1200m2g-1、至少约1300m2g-1、至少约1400m2g-1、至少约1500m2g-1、至少约1600m2g-1、至少约1700m2g-1、至少约1800m2g-1、至少约1900m2g-1、至少约2000m2g-1、至少约2100m2g-1、至少约2200m2g-1、至少约2300m2g-1、至少约2400m2g-1、至少约2500m2g-1、至少约2600m2g-1、至少约2700m2g-1、至少约2800m2g-1、至少约2900m2g-1、或至少约3000m2g-1。可将这些多孔基底用于制备电池型锂置入电极、氯化物可逆电极、或同时制备两者。在一些方面,碳基底为导电性碳基底(例如,碳纳米管基底或基于石墨的基底)。然而,在基底为非导电性的情况下,电池型锂置入电极可包含导电性添加材料。在一些方面,导电性添加材料为碳黑,例如SHAWINIGAN或碳黑。因此,可通过将由悬浮于适当溶剂中的锂置入化合物(例如,锂锰氧化物)和导电性添加材料(例如碳黑)组成的浆料施用至多孔导电性基底(例如,碳毡和/或经煅烧的焦炭碳颗粒、如经石油煅烧的焦炭碳颗粒),从而制备电池型锂置入电极。锂置入化合物一般为锂置入氧化物、例如锂锰氧化物。锂锰氧化物是用于生产锰氧化物的前体,可将锰氧化物用作离子筛型锂吸附剂。因此,在一些方面,电池型锂置入电极可包含嵌有锂置入材料的碳毡和/或经石油煅烧的焦炭碳(例如,经石油煅烧的焦炭碳颗粒),所述锂置入材料包括但不限于γ-MnO2和/或λ-MnO2。在一些方面,锂置入锰氧化物为γ-MnO2。在一些方面,锂置入锰氧化物为λ-MnO2。一旦将电池型锂置入化合物掺入电池型锂置入电极中,电池型锂置入化合物可进行电化学脱锂。锂离子从电池型锂置入化合物的晶体结构中的电化学移除在晶体结构中留下空隙,从而产生离子筛型锰氧化物,所述离子筛型锰氧化物可用作高选择性的锂吸附剂。因此,在锂提取步骤中,当离子筛型锰氧化物暴露至含有锂离子的水性溶液时,锰氧化物晶体结构中的空隙可被来自含有锂离子的水性溶液中的锂填充。在一些方面,锂置入氧化物包含具有尖晶石结构、特别是具有3D隧道结构的尖晶石结构的锰氧化物。作为实例,锰氧化物可为LinMn2-xO4,其中,1≤n≤1.33、0≤x≤0.33且n≤1+x,例如Li1.33Mn1.67O4或为Li1.6Mn1.6O4。在一些方面,锰氧化物为LiMn2O4,然而,可使用其它电池型锂置入化合物,例如锂钴氧化物(LiCoO2)、锂铁磷酸盐(LiFePO4)等。本领域已知的其它锂置入材料包括,例如锂镍锰氧化物(参见例如,Ohzuku等,JournalofMaterialsChemistry,21:10179-10188(2011));锂镍氧化物(参见例如,Ohzuku等,JournalofMaterialsChemistry,21:10179-10188(2011));钴钒氧化物(参见例如,Hibino等,Electrochem.Solid-StateLett,8:A500-A503(2005));钼氧化物(参见例如,Lee等,AdvancedMaterials,20:3627-3632(2008));钒氧化物(参见例如,Liu等,AdvancedMaterials,14:27-30(2002));反尖晶石钒酸盐,如LiNiVO4(参见例如,Broussely等,ElectrochimicaActa,45:3-22(1999));或进一步包含三价金属如铝、铬、镓、铟或钪的锂锰氧化物(参见例如,PCT公开号WO01/24293)。在一些方面,电池型锂置入电极包含单一的电池型锂置入化合物。在其它方面,电池型锂置入电极可包含大于一种的电池型锂置入化合物。可逆氯化物电极还可包含多孔或高表面碳基底(例如,如上所公开的碳毡或经煅烧的焦炭碳)和金属颗粒,例如银金属颗粒。在一些方面,银颗粒可为纳米颗粒。将金属颗粒或金属涂层沉积在基底上的方法是本领域公知的,例如使用层-层沉积。因此,在一些方面,可逆氯化物电极可包含在导电碳毡中支撑的银纳米颗粒,在所述导电性碳毡上具有通过层-层沉积而沉积的银离子。这些银离子被截留在碳毡纤维上的多层聚电解质中,通过化学还原或电化学还原可产生具有大的表面积的银纳米颗粒。反过来,这些银纳米颗粒可与氯离子反应以形成氯化银。在一些方面,可逆氯化物电极包含高表面或多孔基底,所述基底包含经煅烧的焦炭碳颗粒。在一些方面,可通过石油煅烧而获得经煅烧的焦炭碳颗粒。在一些方面,经煅烧的焦炭碳颗粒的直径为约200微米至约800微米。在一些方面,经煅烧的焦炭碳颗粒的直径为至少约100微米、至少约200微米、至少约300微米、至少约400微米、至少约500微米、至少约600微米、至少约700微米、至少约800微米、至少约900微米、或至少约1000微米。在一些具体方面,经煅烧的焦炭碳颗粒的直径为约500微米。可将含非银金属的电极用于制造可逆氯化物电极。例如,可使用包含导电性聚合物(例如聚吡咯/氯化物、聚苯胺、聚合酚等)的替代性氯化物可逆电极。因此,在一些方面,氯化物可逆电极可包含可摄取和释放氯离子的导电性聚合物,例如聚吡咯。可将具有良好电化学活性的其它导电聚合物(例如聚苯胺、聚噻吩、聚酰亚胺、聚乙炔、聚亚苯基亚乙烯、聚亚苯基硫酸盐/酯、或导电聚合物的组合)用于制造可逆氯化物电极。参见例如,Imisides等,Electroanalysis,3:879-889(2005);Bidan,SensorandActuatorsb:Chemical,6:45-56(1992);Walram&Bargon,CanadianJournalofChemistry,64:76-95(1986);Mermilliod等,JournaloftheElectrochemicalSociety,133:1073-1079(1986);Roth&Graupner,SyntheticMetals,57:3623-3631(1993),以引用的方式将这些内容整体并入本文。在一些方面,聚吡咯可逆氯化物电极还可包含多孔或高表面碳基底(例如,如上所公开的碳毡和/或经煅烧的焦炭碳颗粒)。生产涂覆在基底上的聚吡咯的方法是本领域公知的,例如使用在基底上的化学聚合。因此,在一些方面,可逆氯化物电极可包含通过化学聚合至导电性碳毡和/或经煅烧的焦炭碳颗粒上形成的聚吡咯。然后,聚吡咯可与氯化物反应。在一些方面,聚吡咯可逆氯化物电极可包含其它组分,例如掺杂剂。在一些方面,聚吡咯可逆氯化物电极可包含银,例如截留在聚合的聚吡咯膜或涂层中的银颗粒(例如,纳米颗粒)。参见例如,Song&Shiu,JournalofElectroanalyticalChemistry,498:161-170(2001)。用于锂提取的电化学装置本公开还提供了用于从含有锂离子的水性溶液中提取锂的电化学装置,所述电化学装置包含至少一个电池型锂置入电极,所述电池型锂置入电极包含涂覆有锂置入化合物的多孔或高表面基底,其中,所述装置不包含反电极。在一些方面,电化学装置进一步包含氯化物可逆电极,例如Ag/AgCl或聚吡咯氯化物可逆电极。适合用于本公开的电化学装置中的电池型锂置入电极和氯化物可逆电极已在上文中进行了详细描述。本文所公开的电化学装置可包含两个隔室或半电池,每个隔室或半电池由浸入电解质溶液中的电极组成。这些半电池被设计为独立地含有氧化半反应和还原半反应。在一些方面,电池型锂置入电极和氯化物可逆电极放置在分开的半电池中。在一些方面,通过半渗透性电解膜、例如离聚物膜(例如,膜)将包含电池型锂置入电极的半电池与包含氯化物可逆电极的半电池分隔开。在一些方面,膜为324。可将任何可得到的、选择性地透过阳离子并抑制阴离子透过的半渗透性电解膜用于本装置中。该膜对本领域技术人员而言是公知的。在一些方面,没有使用膜。在一些方面,作为多孔材料分隔开半电池。在一些方面,多孔材料可为纱。在一些方面,纱可为聚酯纱。在一些方面,多孔材料可为多孔的烧结玻璃。在一些方面,电化学装置为填充床反应器。在这一反应器构造中,电池型锂置入电极材料和氯化物可逆电极材料(例如,负载有如LiMn2O4或聚吡咯的多孔颗粒、例如经煅烧的焦炭碳颗粒)被放置在集电体(例如,钛集电体)和分离的多孔屏障(例如,聚酯纱)之间。在一些方面,填充床反应器并不包含分隔开阳极隔室与阴极隔室的半渗透性电解膜。在一些方面,填充床反应器中的锂提取颗粒包含:每60g经煅烧的焦炭颗粒约13gLiMn2O4。在一些方面,锂提取颗粒包含:每60g经煅烧的焦炭颗粒至少约1g、至少约2g、至少约3g、至少约4g、至少约5g、至少约6g、至少约7g、至少约8g、至少约9g、至少约10g、至少约11g、至少约12g、至少约13g、至少约14g、或至少约15g的LiMn2O4。在一些方面,将水性溶液直接输送至电化学装置用于锂提取。在其它方面,可针对锂含量对水性电解质溶液进行浓缩。在其它方面,将杂质从随后针对锂含量进行浓缩的水性电解质溶液中移除。在一些方面,例如可使用如同在实施例4中公开的FM100压滤机电化学反应器样式构建电化学装置。在一个方面,电化学装置包含与碳毡电极(例如,分别为电池型锂置入电极和氯化物可逆电极)接触的两个集电体触头(例如,不锈钢金属板)。电池型锂置入电极和可逆电极安装在绝缘支撑件上(例如,框架),并且流场通道允许溶液进行循环。允许溶液循环的绝缘体(例如,网状分隔物)嵌入在各电极之间以防止电极短路。反应器通过穿过所有组件板的绝缘螺栓固定在一起。系统可扩展至成堆中的多个电极(参见图7A和图7B)。在一些方面,可根据实施例8中公开的FM100电化学电池样式对FM100电化学反应器进行组装。因此,在一些方面,反应器包含集电体触头(例如,钛金属板),所述触头与包含官能团化多孔基底的碳毡电极接触。例如,一个电极包含碳毡,所述碳毡含有支撑电池型锂置入电极材料(例如,LiMn2O4)的经煅烧的石油焦炭碳颗粒;而另一电极包含碳毡,所述碳毡含有支撑氯化物可逆电极材料(例如,聚吡咯)的经煅烧的石油焦炭碳颗粒。电极通过非膜状多孔材料(例如,聚酯纱或多孔烧结玻璃)分隔开,所述非膜状多孔材料可任选地安装在合适的支撑物上(例如,框架)。为增高锂的生产,多个未分离的电化学电池可堆叠并串联连接。相同的电流可穿过所有串联的电化学电池循环。参见图18。在一些方面,电化学反应器为根据实施例8中公开的填充床电化学电池样式组装的填充床反应器。因此,在一些方面,电极包含官能团化多孔基底(例如,经煅烧的石油焦炭碳),而不含碳毡基底。在该配置中,一个电极包含填充有支撑电池型锂置入电极材料(例如,LiMn2O4)的经煅烧的石油焦炭碳颗粒的隔室,而另一电极包含填充有支撑氯化物可逆电极材料(例如,聚吡咯)的经煅烧的石油焦炭碳颗粒的隔室。两个隔室均由非膜状多孔材料(例如多孔烧结玻璃)分隔开。反应器还包含与电极接触的集电触头。在一些方面,可使用具有钛棒电连接件的钛网集电体。参见图22和图23。在一些情况下,填充床反应器可包含2个、3个、4个、5个、6个、7个、8个、9个、10个、或多于10个的上述公开的填充床电化学电池。本领域技术人员将理解的是,本文公开的电化学电池能够以多种形式(例如,串联或并联)进行组装,并且本文公开的电池可与设计用于从盐水中提取其它具有商业价值的离子的其它电化学电池以串联或并联的方式进行组合。术语“非膜状多孔材料”是指例如织造物和非织造物(例如纱)、玻璃纤维垫、熔喷垫、毡、烧结玻璃等材料。这些多孔的非膜状材料被广泛地用作过滤介质或者用作过滤的预过滤器。因此,术语非膜状多孔材料涵盖本领域中已知的、适于过滤或预过滤的任何材料,并且通常用于阻止大颗粒(例如,碳颗粒(如碳黑颗粒))在两个以上分隔开的隔室之间迁移。本领域技术人员将认识到的是,其它电池构造和材料可用于:(i)构建包含本申请中公开的电池型锂置入电极和氯化物可逆电极的电化学装置;以及(ii)根据本文公开的方法对该电化学装置进行操作。例如,作为不锈钢或钛板或者网的替代,电化学装置可使用任何其它耐腐蚀金属、合金、或者导电性合成材料或复合物。此外,可使用聚氨基甲酸酯、PVC、硅酮橡胶、玻璃等构建绝缘体(如果使用的话)。参见例如,M.I.Ismail,Ed."Electrochemicalreactorstheirscienceandtechnology-PartA:Fundamentals,electrolysers,batteriesandfuelcells",Elsevier,Amsterdam,TheNetherlands,1989,ISBN0-444-87139-X。不锈钢、塑料管或其它合适的管使得盐水和清洁的电解质分别通过三维扩展的碳毡电极进行循环,所述碳毡电极含有活性材料(例如,锰氧化物、银沉积物、银纳米颗粒、聚吡咯)。电化学装置可通过集电体触头连接至外部能量供给,所述外部能量供给使用来自例如清洁能源(如太阳能、风能、地热能等)的能量。含有锂离子的水性溶液(例如,来自高海拔盐湖的盐水)和氯化锂的稀溶液可通过装置以恒定的流量循环。在一些方面,溶液能够以可变的流量循环。在一些方面,溶液以约20mL/分钟至约50mL/分钟进行循环。在一些情况下,溶液以低于约20mL/分钟的流速进行循环。在其它情况下,溶液以高于约50mL/分钟的流速进行循环。在一些情况下,溶液以约5mL/分钟、或约10mL/分钟、或约15mL/分钟、或约20mL/分钟、或约25mL/分钟、或约30mL/分钟、或约35mL/分钟、或约40mL/分钟、或约45mL/分钟、或约50mL/分钟、或约55mL/分钟、或约60mL/分钟、或约65mL/分钟、或约70mL/分钟、或约75mL/分钟的流速进行循环。在一些方面,通过一些电压或电流源,可同时对多于一种的电化学装置进行操作。在这种情况下,电化学装置能够以串联或并联的方式进行操作。在其它方面,各电化学装置以单独的电压或电流源进行操作。电化学纯化的锂在一些方面,本文公开的方法和装置可用于生产非常高纯度的氯化锂溶液,所述氯化锂溶液可进行结晶并用于生产具有极低水平杂质的金属锂(例如,用于电池组分)。因此,在一些方面,所公开的方法和装置可生产纯度水平为至少约99.9%的氯化锂。在其它方面,根据所公开的方法和装置生产的氯化锂具有的纯度为至少约99.99%。在其它方面,根据所公开的方法和装置生产的氯化锂具有至少约99.999%的纯度。高纯度锂可电解为锂金属。用于锂提取的电化学设备本公开还提供了电化学设备,所述电化学设备通过使用从高海拔盐湖中提取的作为原料的盐水来提取锂和其它有价值的金属。电化学设备包含多个本发明所述的电化学装置,其中,对提取自高海拔盐湖的盐水进行处理,并且根据本文公开的方法提取锂。可使用低环境影响的能源(例如太阳能、风能、或地热能)操作电化学设备。使用该类型的能源消除了构建高排放发电设备或电力传输线的需要。此外,使用清洁能源减少了在高海拔生态系统中由化石燃料泄漏或烟尘排放造成的环境破坏的可能性。用作设备的原料的盐水可通过湖面下钻井来获得,并且经处理的锂贫乏盐水可重新注入湖面下,进一步降低了设备的环境影响和视觉影响。该生产工艺比起现有技术高度有利的方面在于:(i)含锂的盐沉积物并不需要溶于水中,由此降低了来自高海拔生态系统中的水通过蒸发的损失;(ii)该工艺无需加入化学品,如苏打灰;以及(iii)该工艺不会释放可在高海拔盐湖中积累的副产品(例如氯化钠)。可将类似的方法用于实现电化学设备从海水中提取锂,其中,可使用低环境影响的能源(例如太阳能、风能、潮汐能、或地热能)操作所述电化学设备,并且使经处理的锂贫乏海水返回至海洋。在一些方面,可将本文公开的方法和装置用于回收锂。根据这一方式,将从例如锂电池中提取的金属锂溶解以获得锂盐,所述锂盐可通过使用本文公开的方法和装置进行处理以生产高纯度锂。在其它方面,可将本文公开的方法和装置用于精炼锂。根据这一方式,使用本文公开的方法和装置、或使用传统方法得到的低纯度水平的锂可使用本文公开的方法和装置进一步精炼,从而产生高纯度锂。等同物本领域技术人员将认识到、或仅使用常规实验能够确定本文所述的发明特定实施方式的多种等同物。该等同物旨在由所附的权利要求书涵盖。本文所引用的所有出版物、专利和专利申请均以引用的方式将其整体明确地并入本文中。实施例实施例1:LiMn2O4的制备使用固态化学法合成LiMn2O4。在研钵中将0.377gLi2CO3(Aldrich)和1.74gMnO2(Aldrich)以摩尔比0.51:2充分混合,并在350℃下加热12小时。随后将样品在800℃下加热24小时,伴随3个循环的研磨和焙烧。通过扫描电子显微镜(SEM)和X射线衍射(XRD)对所得到的粉末进行表征。将根据上述方法获得的LiMn2O4样品的X-射线衍射图示于图2中。将该衍射图与LiMn2O4标准品的X射线衍射图(图1)进行比较表明,获得了单一相的混合氧化物。所得LiMn2O4样品的SEM检测显示出形成了非常良好的晶体,所述晶体的平均尺寸为数纳米至毫米(参见图3)。实施例2:嵌有LiMn2O4的碳毡的制备将导电性碳毡电极(国家电碳产品,MorganSpecialtyGraphite的部门;Greenville,SouthCarolina,US)切割成20×10×3mm的片,用1:1的异丙醇:Milli-Q水彻底清洗,最后用Milli-Q水进行漂洗(图4)。将合成的LiMn2O4粉末作为浆料负载至碳毡电极上,所述浆料用80%锂锰氧化物、10%碳黑(ChevronPhillipsSHAWINIGAN)和10%PVC(聚氯乙烯)在二氯甲烷中制备。随后,将碳毡在60℃下于真空中干燥24小时。随后,使负载有LiMn2O4的碳毡电极接受电解,从而对氧化物进行脱锂,而同时保持高选择性的晶体结构以允许锂离子的嵌入。将负载有氧化物的碳电极置于两隔室电池中的一个隔室,并将铂反电极置于第二个隔室。两个隔室通过324膜(E.I.duPontdeNemoursandCompany)分隔开。使用银/氯化银3MKCl参比电极,并将0.1M氯化钠或0.1M盐酸用作电解质。锂离子的嵌入-脱出通过循环伏安法在由324膜分隔开的6mL两隔室电池中进行表征。使用AutolabPG30稳压器(EcoChemie,Netherlands)进行循环伏安法测定(参见图5)。将所得的伏安图在图6中示出。循环伏安数据(50mVs-1)与由Cairns等(JournalofTheElectrochemicalSociety,146:4339-4347(1999))所述的在还原周期中的锰二氧化物的晶体结构中的锂置入和在氧化周期中的锂离子从锰二氧化物的晶体结构中的释放相一致。所观察到的反应为LiMn2O4(LiMnIIIMnIVO4)→2α-MnO2+Li++e-,对应于混合氧化物晶格中的Mn(III)离子的氧化,以及在阳极循环期间锂离子向溶液中的排出。实施例3:氯化银可逆电极的制备使用多种方式制备氯化物可逆电极。在一种氯化物可逆电极的制备中,通过将碳毡的电势保持在-0.1V,将银直接从商业化的氰化银浴(Argex,LaringS.A.,Argentina)中沉积。所述氰化银浴已预先在异丙醇中超声30分钟,并用Milli-Q水漂洗。在导电性碳纤维上获得100纳米至1微米的银晶体。在另一种氯化物可逆电极的制备中,例如在Rubner等,Langmuir,18:3370-75(2002)和Vago等,Chem.Commun.,5746-48(2008)中所述,将层叠的多层聚电解质沉积在碳纤维上。所述多层聚电解质充当纳米反应器以限制银离子。将银离子用5mM硼氢化钠进一步进行化学还原或进行电化学还原,从而在碳纤维上生成具有大的表面积的纳米颗粒。在另一种制备中,通过将碳毡顺次浸渍于各聚电解质溶液中并在浸渍步骤之间进行漂洗,使10毫摩尔的聚(丙烯酸)和聚(烯丙胺)逐层进行自组装。然后,通过将经修饰的碳毡浸渍于处于水中的10毫摩尔至50毫摩尔硝酸银溶液中,用蒸馏水进行漂洗,并进行化学还原或电化学还原,使经修饰的碳毡接受银离子交换。通过SEM对所得到的沉积在毡的碳纤维上的纳米颗粒进行检查,并进一步通过循环伏安法在50毫摩尔氯化锂中进行表征。实施例4:电化学反应器的构建如图7中所示,在具有处于两个碳毡电极(分别对锂可逆和对氯离子可逆)之间的塑料分隔物的不锈钢中建造FM100压滤机电化学反应器,所述电化学反应器用于从含有氯化物的盐水、盐水(saltwater)、温泉水等中提取锂。使用5mm不锈钢板(B)和薄板(G)构建在图7A中示意性示出的电化学电池。两个2mm不锈钢板(FP)充当集电体,并与框架(S)中的碳毡电极接触,所述碳毡电极具有流场通道使液体循环。将网状分割物嵌入各碳毡电极(46×156×3mm,横截面约60cm2)之间,即锂置入电极和氯化物可逆电极之间,从而防止导电性碳电极短路。夹层结构电池由穿过所有组件板的绝缘螺丝固定在一起。该系统可扩展至成堆的多个电极。不锈钢或塑料管允许盐水和清洁电解质分别穿过含有活性物质(分别为锰氧化物和银沉积物或纳米颗粒)的三维扩展碳毡电极循环。电化学电池通过集电体触头与外部能量供给物相连。盐水和清洁的回收电解质以可变流速(一般为20mL/min至50mL/min)用Cole-Parmer75211流量泵(Cole-Parmer,VernonHills,IL)循环。用稳压器/稳流器(RadiometerDEA332(Radiometer,Denmark)或者具有20安培电流升压器的AutolabPG30(EcoChemie,Netherlands))对电池电势进行控制。对Li+/Na+的选择性取决于阳离子的相对浓度,对于锂浓缩的溶液而言具有更大的选择性(大的Li+/Na+)(图8)。实施例5:锂提取-释放瞬态实验图9描绘了:(i)相对于Ag/AgCl在0.2V下,锂离子置入负载有LiMn2O4碳的电极中的瞬态(“锂提取步骤”);以及(ii)相对于Ag/AgCl在1.2V下,在50mM高氯酸锂水性溶液中的锂释放的瞬态(“锂释放/浓缩步骤”)。该实验示出了系统的如下能力:通过置入于沉积在碳毡上的锰氧化物锂置入化合物的晶体结构中,从水性溶液中提取锂,同时在稀的回收溶液中发生锂的释放。实施例6:从高海拔盐湖中提取锂的电化学设备可将本申请中公开的电池型锂置入电极和氯化物可逆电极、“锂提取”/“锂释放/浓缩”方法、以及电化学装置设计施用至对来自高海拔湖泊(例如,来自阿根廷puna的salares)的盐水进行的大规模处理。将清洁能源(例如太阳能、风能、地热能或它们的组合)用于驱动泵,所述泵从湖面下抽取富含锂的盐水。电化学设备使用多种由清洁能源驱动的电化学装置,从而对盐水进行处理并提取其锂内含物。随后,将锂贫乏的盐水泵回湖面下。可使用本申请中公开的电化学装置对所得到的氯化锂进行进一步的精炼,以生成处于纯度大于99%形式的高纯度氯化锂。纯化的氯化锂可依次通过使用来自清洁能源的电力的常规方法直接进行电解,以生产用于多种用途的锂金属。由于该提取系统并不用像用于从盐湖中提取锂的现有工艺中通过蒸发消耗水,所以该提取系统是可持续的。此外,该提取系统比起目前使用的蒸发方法更快(本专利申请中公开的系统和方法需要数分钟-数小时;而蒸发方法需数月)。此外,由于锂从盐水中的置入(提取)在电池型电极中是自发过程,并且锂的释放、以及盐水和电解质的泵送是低能耗过程,该过程可通过可再生能源(如太阳能)驱动,因此所公开的系统具有低的能量影响。实施例7:使用聚吡咯/氯化碳可逆电极以捕获(或释放)氯离子、以及使用LiMn2O4/碳置入电极以捕获(或释放)锂聚吡咯为导电性聚合物,可通过使吡咯从酸性溶液中化学聚合或电化学聚合来沉积在碳毡纤维上。一旦氧化,聚吡咯摄取阴离子以保持电荷中性,反过来,当聚吡咯还原时,将阴离子释放入溶液中。因此,根据图10中示出的反应,聚吡咯可用作阳极/阴极以选择性地从电解质(在我们的实验中为盐水)中捕获/释放阴离子(如氯)。因此,对提取工艺进行设计,其中,锂嵌入阴极为碳支撑的LiMn2O4电极,并且在捕获氯离子的同时使锂离子阴极置入的可逆氯化物电极为包含在碳毡上支撑的聚吡咯的复合电极。聚吡咯电极比起Ag/AgCl电极提供了多种优势。聚吡咯电极成本较低,使用与碳基底(例如,碳毡)接触的吡咯溶液进行化学氧化易于制造聚吡咯电极,聚吡咯电极不会将银离子释放入环境中,并且聚吡咯电极具有大的表面积。锂提取工艺的概述实施锂提取工艺,其中,通过在与盐水接触的碳毡阴极上支撑的LiMn2O4中进行连续电化学置入,随后通过从不含锂的KCl电解质溶液中的电极处释放LiCl,富集氯化锂(LiCl)溶液,从富钠的锂盐水(Li:Na为1:100)中提取氯化锂。使用基于碳毡的电极。碳毡为导电性的,并呈现出非常高的表面积以支撑用于锂置入的催化氧化物(LiMn2O4)。由于相对于钠的锂提取选择性取决于Li与Na的浓度比,对于选择性地提取锂,需要置入和释放的连续电化学步骤。锂置入电极(正极阴极)包含混合的锂锰氧化物,所述锂锰氧化物在还原态时在晶格中具有三价和四价锰离子(即MnIII和MnIV),并且晶体中置入的Li+补偿了MnIII的较低的电荷。置入过程如同在电池中一样自发发生。第二电极(负极阳极)捕获氯离子以补偿聚吡咯在还原的中性态PP0时的电荷,同时氧化为[PP+Cl-]态。在LiCl于不含锂的电解质中释放期间,在具有相对极性的电极处发生反转过程,即锰氧化物为负极电极(阳极),而聚吡咯电极为正极电极(阴极)。该过程并不是自发的,并且需要对电化学电池提供能量。在氯化锂回收步骤中,锂离子选择性地置入在阴极处且氯离子置入在阳极处,而在氯化锂释放入不含锂的电解质期间,发生相反的反应:在各电极上的电化学过程为,在阴极:以及在还原的中性聚吡咯阳极:由于181g化合物含有7g锂,从而能够计算LiMn2O4的容量。因此,完全置入可使每克锰氧化物产生的锂的理论最大值为39mg。在LiFePO4的情况下,158g化合物可置入7g锂,因此每克铁磷酸盐可产生的锂的理论最大值为44.3mg。此前图6示出了在碳支撑的LiMn2O4电极上的锂置入/释放的循环伏安法。电极电势以相对于Ag/AgCl参比电极的方式表示,并且同样处于Li/Li+规模。将在阴极末端的锂置入锰氧化物晶格中,而在正电势时,锂离子从氧化物释放至溶液中。参见Cairns等,JournalofTheElectrochemicalSociety146:4339-4347(1999)。由于电极电势是氧化物中的锂置入程度的量度(参见,Tarascon&Guyomard,J.Electrochem.Soc.,138:2864(1991)),在锂从盐水中释放和置入期间,对电极电势进行监测。电极将holder支撑的导电性碳毡电极(国家电碳产品,MorganSpecialtyGraphite的部门,Greenville,SouthCarolina,USA)切割成50×50mm的片,并浸于180mL电解质中(盐水或回收溶液)。图11中的照片描绘了实验装备。框架固定碳毡电极,所述碳毡电极被网分隔开以避免短路。各电极通过金板连接至稳压器的顶端。在该实验装备中未使用例如NAFIONTM膜。用异丙醇清洗碳毡样品(50×50mm)5分钟,然后用稀硫酸在超声下预处理10分钟。通过用由悬浮于5mLN-甲基吡咯烷酮中的2.4gLiMn2O4、0.3gSHAWINIGAN碳和0.3gPVC粘合剂制成的浆料浸渍碳毡片,制备LiMn2O4电极,并在70℃下干燥12小时。图12示出了所得到的覆盖有LiMn2O4晶体的毡中的碳纤维的SEM显微照片。观察到LiMn2O4晶体良好地覆盖了碳纤维。聚吡咯电极通过如下的吡咯化学聚合得到:将碳毡样品依次浸于处于0.02M盐酸中的0.5M吡咯(溶液A)中、以及0.5M过硫酸铵(溶液B)中,在各溶液中持续5分钟。用蒸馏水漂洗后,将毡在105℃下干燥24小时。图13为描绘沉积在碳毡上的聚吡咯的SEM显微照片。使用两种电化学处理从盐水中捕获氯化锂,并将捕获的锂释放入不含锂的溶液中,所述过程如下:a.为在阴极捕获锂并在阳极捕获氯,使用恒流方法。将-25mA的恒定DC电流施加至25cm2几何面积的三维多孔碳毡电极,随后将电极电势作为时间的函数。通过电流乘以流逝的时间给出电解电荷,一般为7200秒(2小时)或180库仑。b.为将LiCl释放入含有稀的氯化钾的不含锂的溶液中或最终含有稀的氯化锂的溶液中,按如下所述采用在搅拌下的恒电势处理。相对于Ag/AgCl,LiMn2O4/碳电极在1.4V下极化;3MNaCl参比电极,以及MnIII的氧化释放所置入的锂。随后为电流瞬态。当氧化的聚吡咯还原时,在另一电极(负极)上发生氯的释放。从天然盐水中提取锂使用在Jujuy(阿根廷)省的Ollaroz盐湖的盐水样品,对所公开的方法和装置选择性地从天然盐水中提取锂的能力进行了测试,所述盐水样品含有浓度比为1:100的Li:Na。除锂以外,所述盐水样品含有钠、钾、镁、硼等。通过盐水的原子发射进行的化学分析表明,在其它组分中,Li:1.3g/L;Na:62.6g/L;Ca:3.6g/L;Mg:3.3g/L;K:8.1g/L。1.从天然盐水中置入LiCl使用恒电流电化学置入法,从锂与钠的初始浓度比为1:100的盐水溶液(180mL)中,将锂离子置入LiMn2O4/碳毡阴极中,并将氯离子置入聚吡咯/碳毡阳极中。电极几何面积为25cm2,并且载量为0.6gLiMn2O4。当将-25mA的恒定电流施加至电化学反应器时,在锂置入期间,相对于Ag/AgCl的阴极电势、3MNaCl参比电极(相对于Li/Li+约3V)随时间而发展。总电荷为180库仑。图14示出了对应于四个氯化锂捕获步骤的四个瞬态。根据能斯特方程,电极电势取决于溶液中的锂浓度。在第一提取中,盐水溶液在锂方面高度浓缩,而随后的锂回收溶液非常稀(在毫摩尔范围内)。所穿过的总电荷为-180库仑(-25mA×7200秒)。如果所有电荷均归因于锂的置入,则应该已提取了13mg锂。2.漂洗毡通过在搅拌下将电极浸入一系列水浴中,直至洗涤液中的钠浓度小于1ppm,用蒸馏水对电极进行漂洗。3.锂释放可通过如上述循环伏安法中所示的,在将MnIII氧化为MnIV的区域中施加恒定电势或流过恒定电流(恒电流脉冲)来实现锂的释放。优选恒电势瞬态,以避免当锂在盐水或回收电解质中耗尽时达到过氧化电势。在锂释放的过程中,电极的极性在电解质溶液中反转,所述电解质溶液不含锂而含有稀的KCl作为背景电解质,从而提供足够的导电性。在不含锂的0.05MKCl溶液中,于控制在1.4V的电势、总电荷为22.18库仑下,在7200秒内发生了锂离子从LiMn2O4/碳毡阳极中的恒电势电化学释放、以及氯化物从聚吡咯/碳毡阴极中的释放。搅拌电解质,以避免锂离子在电极表面上的浓缩极化。图15示出了一系列锂回收步骤中的电流瞬态,在此期间,锂从LiMn2O4电极中释放。或者,在一些实验(未示出)中,使用稀的氯化锂溶液,然后在处理过程中,对所述氯化锂溶液在锂方面进行富集。分析电解质的锂收率和钠收率。富集过程产生了1.9mg(1.5mM)锂和3.9mg(0.94mM)钠。因此,第一电化学置入提取步骤实现了Li:Na原子比由初始盐水中的0.01达到1.59。保留在电极中的钠可能已经静电吸附至大面积的氧化物和碳毡上,并且还共同置入至LiMn2O4纳米颗粒中。由于钠离子(9.8nm)或钾离子(13.6nm)的晶体离子半径大于锂离子(6.8nm)的晶体离子半径,因此较少的钠或钾可置入尖晶石氧化物晶格中。在对第一步骤中使用的电极彻底漂洗后,使从第一提取得到的液体(Li:Na原子比为1.59)接受用LiMn2O4/碳毡阴极和还原的聚吡咯阳极进行的第二提取处理。恒电流的电势-时间瞬态显示出类似于第一电化学提取步骤中得到的形状。在控制在1.4V的恒电势下(反转电极极性),在相同的时间(7200秒)内,LiCl在不含锂的KCl稀溶液中释放。图16示出了在将锂离子从LiMn2O4/碳电极释放入电解质期间的电荷发展。如表1中所示,增高提取/释放步骤的次数提高了锂相对于钠的选择性,在三个周期之后,由初始的1:100的Li:Na浓度比变为最终的12.4:1的Li:Na浓度比。表1:通过增高的提取和释放步骤的次数来提高锂选择性的结果提取[Li+]ppmLi[Na-]PpmNa[Li]/[Na]0.01第一次1.51.90.943.91.59第二次2.32.91.084.52.30第三次3.54.90.311.312.4实施例8:可替代的电极和电化学装置在该可替代方法中,将直径为200微米-800微米的碳颗粒(来自石油的经煅烧的焦炭)用LiMn2O4或聚吡咯负载,并置于处于钛集电体与聚酯纱之间的薄的填充物床中。这种安排允许电解质以相当大的流速(即,2mL/s-30mL/s)轴向流动时,在焦炭颗粒之间、以及在焦炭颗粒与集电体之间保持良好的电接触。反应器组件在阴极和阳极隔室之间没有分离膜。在电化学反应器设计中重要的是,实现高的电解质流、低的压降、颗粒与颗粒的良好电接触、以及在最低的电解质浓度下的低欧姆降。与之前的实施例中所述的仅使用碳毡的情况相比,使用尺寸为数百微米的焦炭颗粒给予了:(i)在支撑在碳颗粒上的电极材料和电解质之间的更大的接触表面积;以及(ii)良好的流动床。在制备锂提取电极材料的一般方法中,将60g尺寸为500微米的焦炭颗粒与13gLiMn2O4、2.75g聚偏二氟乙烯(PVDF)和2.75g碳黑混合。将该混合物分散于吡咯烷酮中,在24小时内充分搅拌,并在70℃下于真空烘箱中干燥24小时。将所得到的粉末在碳毡与聚酯纱之间挤压。对于氯化物提取电极材料,将60g尺寸为500微米的焦炭颗粒分散于含0.5M吡咯、0.02M盐酸的溶液中以及0.5M过硫酸铵的溶液中。在110℃下蒸发24小时后,将负载有聚吡咯的焦炭颗粒用蒸馏水洗涤、干燥、并在第二电极的聚酯纱与碳毡之间挤压。在图17中示出负载有LiMn2O4结晶的焦炭颗粒的典型的SEM显微照片。将官能团化的焦炭电极颗粒用于组装如图18所示的具有电解质的轴向通量和垂直电流流动的压滤机反应器(FM100型)。反应器由如下组成:(i)钛集电体;(ii)在一个电极处的LiMn2O4的碳毡支撑物和经石油煅烧的焦炭碳支撑物;(iii)在另一电极处的碳毡支撑物和聚吡咯;(iv)框架;以及(v)在未分隔开的电池中的聚酯纱。为提高锂的产量,将多个未分隔开的电池堆叠,并在FM100型反应器中串联连接。相同的电流穿过所有串联的电池循环,施加各电池的阳极和阴极之间的电势差(一般为1.2V)。充电瞬态和放电瞬态显示出,通过LiMn2O4进行的锂离子的捕获和释放是可逆的(参见图19)。理论上,从盐水中每提取7g锂将需要26.8A.h的电荷(96,500库仑/3600s.h-1)。为提取7gLi+,需要126gLiMn2O4或174gMnO2。由于ArgentinianPuna盐水(例如,来自OllarozSaltpan的盐水)中的锂浓度为约1g/L,7L盐水将产生的锂的理论最大值为7g。在第一个周期中,LiMn2O4电极脱锂,以生产锂离子置入氧化物电极材料,当与含锂盐水接触时,所述锂离子置入氧化物电极材料自发地提取锂离子。将在恒定电流(±0.5mA/cm2)下、于2小时内的放电和充电曲线示于图20中。图21示出了电势-电荷曲线图。电势-电荷曲线的积分表明提取每吨锂的能量平衡为200kWh。还可将官能团化的焦炭电极颗粒用于组装可替代类型的反应器。根据图22中示出的构造,对具有焦炭碳上支撑的LiMn2O4和聚吡咯的填充床反应器进行组装。该构造提供了实验室规模的实际三维反应器的构思的证据,所述反应器具有分别负载有LiMn2O4和聚吡咯的焦炭紧凑床电极。电解质流动和电流流动为纵向。在充斥着电解质的填充床中,该系统呈现出大的欧姆降,但呈现出非常小的压降。纵向填充床圆柱形反应器原型由如下组成:具有通过多孔烧结玻璃分隔开的两个隔室的玻璃圆筒、具有钛棒电连接件的钛网集电体、包含负载有电极材料的20g焦炭的两个填充床、橡胶塞和连接至活塞流量泵的管(参见图23和表2)。如图24所示,通过连接水银压力计,在不同流速(每秒0-30mL)下对反应器中的压降进行测量。表2:填充床圆柱形反应器原型的特征焦炭颗粒的质量20g填充床高度4cm反应器直径4cm反应器横截面12,57cm2填充床体积50,27cm3焦炭密度2,0775g/cm3孔隙率80.85%考虑到(i)太阳能电池板的成本为每千瓦$2,000;(ii)提取每吨锂的能量消耗为200kWh;以及(iii)太阳能一天产生50kW,一吨锂每天回收的资本投入为$100,000美元(800平方米的太阳能电池板,其寿命为30年)。在太阳能电池板30年的寿命中,该太阳能驱动的电化学生产系统可得到11,000吨锂。因此,使用本文公开的电化学提取方法的生产成本为约每吨锂10美元(加上用于泵送盐水和其它工程操作的能量以及归因于动力学的能量损失等的成本)。该系统可用于从水性溶液(包括盐湖盐水、海水、地热水和油盐水)中回收锂。所述方法除了低的货币成本外,该方法由于如下方面而高度有利:(i)该方法是清洁的,不消耗水、石灰或Solvay;(ii)该方法具有低的能耗,即200kWh/吨;(iii)如果以重复的周期施用,该方法相对于钠而言对锂具有选择性;以及(iv)该方法产生适合于电池用的高纯度氯化锂。将能理解的是,具体实施方式部分(而非
发明内容和摘要部分)旨在用于对权利要求进行解释。
发明内容和摘要部分可阐明一个或多个本发明人所考虑到的本发明的示例性实施方式,而非全部的示例性实施方式,并且因此,
发明内容和摘要部分并非旨在以任何方式对本发明和所附的权利要求书进行限定。借助于功能化构造模块对本发明进行了以上描述,所述模块说明了特定功能的实施及其关系。为了便于描述,对这些功能化构造模块的界限进行了主观定义。只要指定的功能及其关系被适当施行,就可定义为替代的界限。具体实施方式的前述描述非常充分地揭示了本发明的一般性质,在不脱离本发明一般概念的情况下,其他人可通过施用本领域技术范围内的知识,容易地变更和/或修改各该具体实施方式的多种应用,而无需过多的实验。因此,基于本文中展现的教导和指导,此类修改和变更旨在落入所公开的实施方式的等同物的含义和范围内。将能理解的是,本文中的措词或术语用于说明而非限制的目的,从而本申请文件的术语或措词将能由技术人员根据教导和指导进行解释。本发明的广度和范围不应受限于任何上述示例性实施方式,而是应当仅根据所附的权利要求书及其等同物进行定义。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1