一种用于荧光免疫检测的微流控芯片及其制备方法与流程
本发明属于医学检验领域,具体涉及一种用于荧光免疫检测的微流控芯片及其制备方法。
背景技术:
:近年来,生物分析
技术领域:
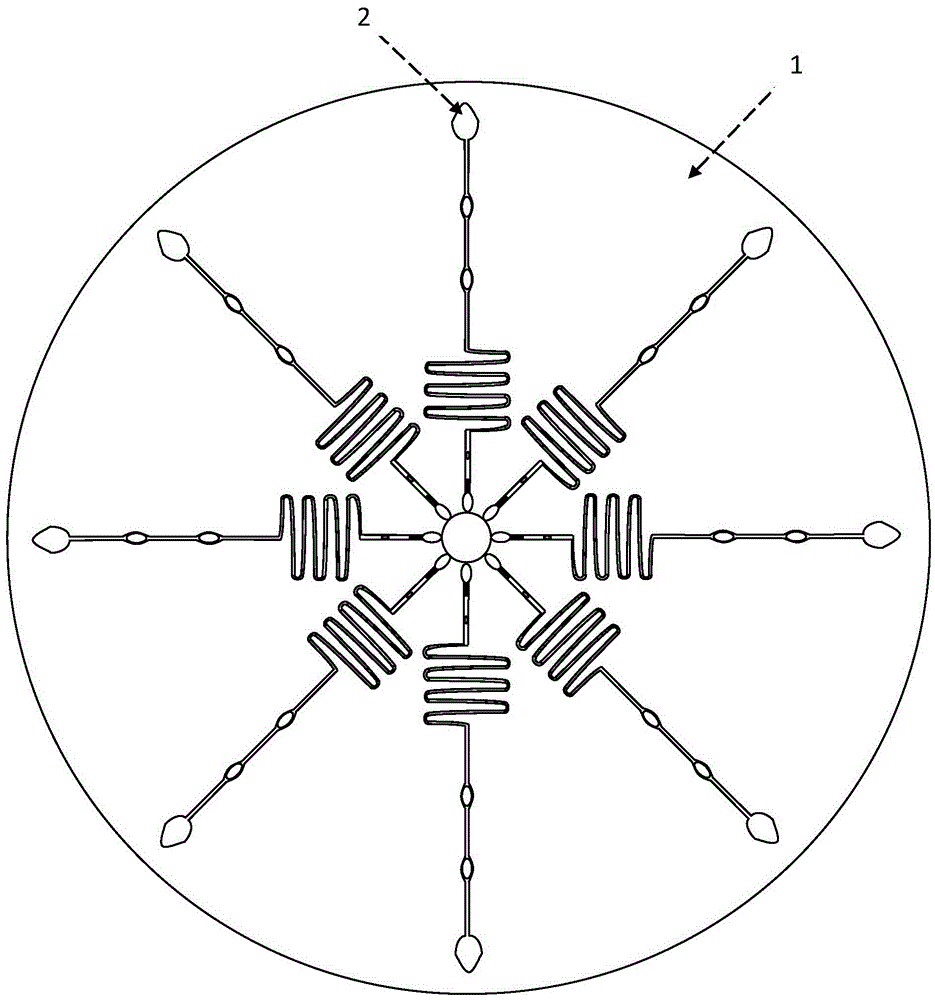
得到了快速的发展,出现了很多重要的研究方向。微流控芯片分析技术是其中最活跃的一支,在科研和应用领域都获得了广泛的重视。微流控芯片作为一种新型的分析检测平台,具有高通量、集成化、便携式、易操作、低成本等优点,已经在众多领域中得到了广泛的应用。然而目前公开的微流控芯片上仅有一个信号检测区,没有质控区。这种芯片制造工艺简单,但是在实际应用中会造成较大的批间和/或批内变异。技术实现要素:为了解决上述技术问题,本发明提供了一种用于荧光免疫检测的微流控芯片及其制备方法。本发明提供的用于荧光免疫检测的微流控芯片,包括:芯片基板,所述芯片基板上开设有至少一个微流控通道;所述微流控通道包括依次连通的样本滴加区、全血过滤区、抗体包被区、反应区、检测区、质控区和废液收集区;所述全血过滤区设有红细胞滤血膜;所述抗体包被区包被有生物素标记的待测物抗体、荧光微球标记的待测物抗体和荧光微球标记的质控抗原;检测区设置有链霉亲和素包被的聚苯乙烯微球;质控区设有质控抗原的抗体包被的聚苯乙烯微球。其中,所述微流控通道沿芯片基板的中心向外延伸,其中样品滴加区位于芯片基板的中心。所述芯片基板为圆形;所述微流控通道为多个,沿芯片基板的半径方向设置;其中各微流控通道的样品滴加区靠近芯片基板的中心,各微流控通道的样品滴加区距芯片基板的中心的距离相等。所述样本滴加区通过第一通道与反应区连通,第一通道与样本滴加区连通的一端设有全血过滤区,第一通道的中部设有抗体包被区。所述反应区为蛇形管道状。所述反应区与检测区通过第二通道连通;所述检测区与质控区通过第三通道连通;所述质控区和所述废液收集区通过第四通道连通。生物素标记的待测物抗体、荧光微球标记的待测物抗体和荧光微球标记的质控抗原的摩尔比为:1~4:1~4:1。本发明还提供制备上述的微流控芯片的方法,包括如下步骤:1)在芯片基板上开设至少一个微流控通道;2)全血过滤区的处理:取红细胞滤血膜贴覆于全血过滤区;3)抗体包被区的处理:a)生物素标记的待测物抗体:用碳酸钠缓冲液将生物素标记用待测物抗体稀释,透析,得到生物素标记用待测物抗体溶液;用N,N-二甲基酰胺将6-氨基己酸-N羟基琥珀酰亚胺-生物素溶解,得6-氨基己酸-N羟基琥珀酰亚胺-生物素溶液;将生物素标记用待测物抗体溶液加入到6-氨基己酸-N羟基琥珀酰亚胺-生物素溶液中,混合,搅拌,透析,截留分子量为10000,用磷酸缓冲液透析,保存;b)荧光微球标记的待测物抗体:取荧光微球,溶于碳酸钠缓冲液,然后加入碳二亚胺、荧光微球标记用待测物抗体和N-羟基琥珀酰亚胺,搅拌,加入赖氨酸,搅拌,透析,离心,固体物溶于柠檬酸-柠檬酸钠缓冲液;c)荧光微球标记的质控抗原:取荧光微球,溶于碳酸钠缓冲液,然后加入碳二亚胺、质控抗原和N-羟基琥珀酰亚胺,搅拌,加入赖氨酸,搅拌,透析,离心,固体物溶于柠檬酸-柠檬酸钠缓冲液;d)取步骤a)~c)制得的三种标记物溶液混合,涂覆于抗体包被区,干燥;4)检测区的处理:取链霉亲和素,将其溶于柠檬酸-柠檬酸钠缓冲液中;将聚苯乙烯微球溶于上述柠檬酸-柠檬酸钠缓冲液中,搅拌、包被;将聚苯乙烯微球过滤取出,以生理盐水溶液洗涤,最后用封闭液封闭,干燥,得包被好的聚苯乙烯微球;将包被好的聚苯乙烯微球置于检测区;5)质控区的处理:取质控抗原的抗体,将其溶于柠檬酸-柠檬酸钠缓冲液中;将聚苯乙烯微球溶于上述柠檬酸-柠檬酸钠缓冲液中,搅拌、包被;将聚苯乙烯微球过滤取出,以生理盐水溶液洗涤,最后用封闭液封闭,干燥,得包被好的聚苯乙烯微球;将包被好的聚苯乙烯微球置于质控区。步骤3)中生物素标记的待测物抗体、荧光微球标记的待测物抗体和荧光微球标记的质控抗原的摩尔比为:1~4:1~4:1。其中,所述碳酸钠缓冲液的制备方法为:碳酸钠和碳酸氢钠溶于水中;所述磷酸缓冲液的制备方法为:磷酸二氢钠和磷酸氢二钠溶于水中;所述柠檬酸-柠檬酸钠缓冲液的制备方法为:柠檬酸三钠、柠檬酸和氢氧化钠溶于水中;所述封闭液的制备方法为:牛血清白蛋白、蔗糖、磷酸二氢钠、磷酸氢二钠和Proclin300溶于水中。本发明的效果在于:1、本发明在微流控通道的抗体包被区包被有:生物素标记的待测物抗体、荧光微球标记的待测物抗体和荧光微球标记的质控抗原,并在检测区后面设置了一个质控区,此区域有一聚苯乙烯做成的球型,并用质控抗原的抗体浸泡包被此微球。以此减小产品批间和/或批内变异,提高产品质量。2、抗体包被区的生物素标记的待测物抗体、荧光微球标记的待测物抗体和荧光微球标记的质控抗原的摩尔比为:1~4:1~4:1时,可保证良好的检测灵敏度。附图说明图1为本发明的用于荧光免疫检测的微流控芯片的结构示意图;图2为本发明的用于荧光免疫检测的微流控芯片的微流控通道的结构示意图。具体实施方式下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好的理解本发明并能予以实施,但所举实施例不作为对本发明的限定。结合图1所示,本发明提供的用于荧光免疫检测的微流控芯片100,包括:芯片基板1,芯片基板1上开设有多个微流控通道2。在本发明的优选实施方式中,芯片基板1为圆形,微流控通道2沿芯片基板1的半径方向设置,其中,样品滴加区20靠近芯片基板的圆心,各微流控通道的样品滴加区20距芯片基板的中心的距离相等(一般情况下为5±0.5mm)。如图2所示,微流控通道2包括样本滴加区20、全血过滤区21、抗体包被区22、反应区23、检测区24、质控区25和废液收集区26。样本滴加区20通过第一通道27与反应区23连通,第一通道27与样本滴加区20连通的一端设有全血过滤区21,第一通道27的中部设有抗体包被区22。反应区23为蛇形管道状。反应区23与检测区24通过第二通道28连通;检测区24与质控区25通过第三通道29连通;质控区25和废液收集区26通过第四通道30连通。全血过滤区设有红细胞滤血膜;抗体包被区包被有生物素标记的待测物抗体、荧光微球标记的待测物抗体和荧光微球标记的质控抗原;检测区设置有链霉亲和素包被的聚苯乙烯微球;质控区设有质控抗原的抗体包被的聚苯乙烯微球。制备上述的微流控芯片的方法,包括如下步骤:1)在芯片基板上开设至少一个微流控通道;2)全血过滤区的处理:取红细胞滤血膜贴覆于全血过滤区;3)抗体包被区的处理:a)生物素标记的待测物抗体:用碳酸钠缓冲液将生物素标记用待测物抗体稀释,透析,得到生物素标记用待测物抗体溶液;用N,N-二甲基酰胺将6-氨基己酸-N羟基琥珀酰亚胺-生物素溶解,得6-氨基己酸-N羟基琥珀酰亚胺-生物素溶液;将生物素标记用待测物抗体溶液加入到6-氨基己酸-N羟基琥珀酰亚胺-生物素溶液中,混合,搅拌,透析,截留分子量为10000,用磷酸缓冲液透析,最后取出短期4℃保存,长期-20℃保存;b)荧光微球标记的待测物抗体:取荧光微球,溶于碳酸钠缓冲液,然后加入碳二亚胺、荧光微球标记用待测物抗体和N-羟基琥珀酰亚胺,搅拌,加入赖氨酸,搅拌,透析,离心,固体物溶于柠檬酸-柠檬酸钠缓冲液;c)荧光微球标记的质控抗原:取荧光微球,溶于碳酸钠缓冲液,然后加入碳二亚胺、质控抗原和N-羟基琥珀酰亚胺,搅拌,加入赖氨酸,搅拌,透析,离心,固体物溶于柠檬酸-柠檬酸钠缓冲液;d)取步骤a)~c)制得的三种标记物溶液混合,涂覆与抗体包被区,干燥;其中,生物素标记的待测物抗体、荧光微球标记的待测物抗体和荧光微球标记的质控抗原的1~4:1~4:1。4)检测区的处理:取链霉亲和素,将其溶于柠檬酸-柠檬酸钠缓冲液中;将聚苯乙烯微球溶于上述柠檬酸-柠檬酸钠缓冲液中,搅拌、包被;将聚苯乙烯微球过滤取出,以生理盐水溶液洗涤,最后用封闭液在37℃环境中封闭(封闭液的主要成分是牛血清白蛋白和蔗糖,其中白蛋白起到封闭微球上剩余微孔的作用,而蔗糖则是在微球表面形成一层膜,防止氧化),干燥,得包被好的聚苯乙烯微球;将包被好的聚苯乙烯微球置于检测区;5)质控区的处理:取质控抗原的抗体,将其溶于柠檬酸-柠檬酸钠缓冲液中;将聚苯乙烯微球溶于上述柠檬酸-柠檬酸钠缓冲液中,搅拌、包被;将聚苯乙烯微球过滤取出,以生理盐水溶液洗涤,最后用封闭液在37℃环境中封闭,干燥,得包被好的聚苯乙烯微球;将包被好的聚苯乙烯微球置于质控区。上述制备方法中,所述碳酸钠缓冲液的制备方法为:碳酸钠和碳酸氢钠溶于水中;所述磷酸缓冲液的制备方法为:磷酸二氢钠和磷酸氢二钠溶于水中;所述柠檬酸-柠檬酸钠缓冲液的制备方法为:柠檬酸三钠、柠檬酸和氢氧化钠溶于水中;所述封闭液的制备方法为:牛血清白蛋白、蔗糖、磷酸二氢钠、磷酸氢二钠和Proclin300溶于水中。检测原理:如图所示,在离心力的驱动下,全血样本经过过滤区,去除血细胞,随后通过抗体包被区;利用样本中的水将干燥的生物素标记的生物素标记用待测物抗体、荧光微球标记的荧光微球标记用待测物抗体、荧光微球标记的质控抗体,然后混合物一起运动至反应区进行特异性反应;此时,样本中目标抗原则会与生物素标记用待测物抗体和荧光微球标记用待测物抗体进行特异性反应,并最终形成生物素标记的生物素标记用待测物抗体-抗原-乳胶荧光微球标记的荧光微球标记用待测物抗体复合物;当运动至检测区(T)时,生物素迅速与链霉亲和素结合并将复合物固定于此,而未反应的其他物质和乳胶荧光微球标记的质控抗原则会继续运动;随后经过质控区(C)时,质控抗原会和质控抗体进行特异性反应,并吸附在此;随后,洗涤液将通道充分洗涤后,将芯片置于荧光分析仪中检测荧光强度,最后把T/C转换成浓度。实施例1以下,以用于检测心肌肌钙蛋白I(cTnI)的微流控芯片为例,对本发明进行说明:1、全血过滤区的处理将红细胞滤血膜裁剪成相应规格,用仪器将其贴于全血过滤区。2、抗体包被区的处理2.1生物素标记鼠抗cTnI单克隆抗体首先用碳酸钠缓冲液将生物素标记用鼠抗cTnI单克隆抗体稀释成1mg/mL,并用碳酸钠缓冲液室温(25℃±5℃)避光搅拌4小时透析;随后用N,N-二甲基酰胺(DMF)将6-氨基己酸-N羟基琥珀酰亚胺-生物素(BCNHS)配置成1mg/mL;在1mL生物素标记用鼠抗cTnI单克隆抗体溶液中加入上述DMF溶液125μL玻璃瓶中混合,室温(25℃±5℃)避光搅拌2小时;加入1mol/L氯化铵溶液9.6μL,室温(25℃±5℃)避光搅拌10分钟;然后混合溶液转入透析袋(截留分子量10000),用磷酸缓冲液4℃透析过夜。最后取出短期4℃保存,长期-20℃保存。2.2乳胶荧光微球标记鼠抗CTNI单克隆抗体取浓度为0.01g/mL的乳胶荧光微球10mL,离心30分钟,转速为10000r/min;弃上清液后用CB溶液10mL复融,然后加入10mg碳二亚胺(EDC)、2mg荧光微球标记用鼠抗cTnI单克隆抗体、10mgN-羟基琥珀酰亚胺(NHS),在室温(25℃±5℃)下搅拌4小时,随后加入5mg赖氨酸后室温(25℃±5℃)下搅拌15分钟;转入透析袋中,4℃过夜透析;第二天将透析完成的混合溶液在10000r/min的条件下离心15分钟,弃上清液,最后用20mLLM缓冲液复融即可。2.3乳胶荧光微球标记兔IgG取浓度为0.01g/mL的乳胶荧光微球5mL,离心30分钟,转速为10000r/min;弃上清液后用CB溶液5mL复融,然后加入5mg碳二亚胺(EDC)、1mg兔IgG、5mgN-羟基琥珀酰亚胺(NHS),在室温(25℃±5℃)下搅拌4小时,随后加入2.5mg赖氨酸后室温(25℃±5℃)下搅拌15分钟;转入透析袋中,4℃过夜透析;第二天将透析完成的混合溶液在10000r/min的条件下离心15分钟,弃上清液,最后用10mLLM缓冲液复融即可。1.4抗体包被将上述三种标记物,生物素标记鼠抗CRP单克隆抗体-1:乳胶荧光微球标记鼠抗CRP单克隆抗体-2:乳胶荧光微球标记兔IgG(摩尔比)=1:2:1混匀,按相应规格(取5ul此混合溶液)滴涂于芯片中的抗体包被区,置于湿度<35%环境中干燥8小时。3、检测区(T)和质控区(C)的抗体包被3.1检测区(T)链霉亲和素的包被取1-5mg链霉亲和素,将其溶于500mLLM缓冲液中;随后将聚苯乙烯微球(直径15微米)溶于上述LM缓冲液中,4℃搅拌、包被12-20小时;然后将微球过滤取出,以生理盐水溶液洗涤2次,最后用封闭液在37℃环境中封闭1-3小时,随后置于湿度<35%环境中干燥8-16小时即可。用仪器将包被好的微球放置于检测区即可。3.2质控区(C)羊抗兔IgG的包被取0.5-2mg羊抗兔IgG,将其溶于500mLLM缓冲液中;随后将聚苯乙烯微球(直径15微米)溶于上述LM缓冲液中,4℃搅拌、包被12-20小时;然后将微球过滤取出,以生理盐水溶液洗涤2次,最后用封闭液在37℃环境中封闭1-3小时,随后置于湿度<35%环境中干燥8-16小时即可。用仪器将包被好的微球放置于检测区即可。附:所需溶液配制1)碳酸钠缓冲液(CB)碳酸钠4.33g碳酸氢钠2.96g纯化水定容至1000mL;2)磷酸缓冲液(PB)磷酸二氢钠0.99g磷酸氢二钠5.16g纯化水定容至1000mL;3)柠檬酸-柠檬酸钠缓冲液(LM)柠檬酸三钠7.33g柠檬酸4.44g氢氧化钠1g纯化水定容至1000mL;4)生理盐水氯化钠9g纯化水定容至1000mL;5)封闭液牛血清白蛋白50g蔗糖50g磷酸二氢钠0.99g磷酸氢二钠5.16gProclin3001mL纯化水定容至1000mL。4、检测心肌肌钙蛋白I(cTnI)取5-50μL全血滴于样本区,在毛细管或者离心力的作用下,样本流经芯片。5-20分钟后,在荧光分析仪下检测T和C区的荧光强度,即可反算出样本中cTnI的浓度。检验原理:如图所示,在离心力的驱动下,全血样本经过过滤区,去除血细胞,随后通过抗体包被区;利用样本中的水将干燥的生物素标记的生物素标记用鼠抗cTnI单克隆抗体、乳胶荧光微球标记的荧光微球标记用鼠抗cTnI单克隆抗体、乳胶荧光微球标记的兔IgG溶解,然后混合物一起运动至反应区进行特异性反应;此时,样本中目标抗原则会与生物素标记用鼠抗cTnI单克隆抗体和荧光微球标记用鼠抗cTnI单克隆抗体进行特异性反应,并最终形成生物素标记的生物素标记用鼠抗cTnI单克隆抗体-抗原-乳胶荧光微球标记的荧光微球标记用鼠抗cTnI单克隆抗体复合物;当运动至检测区(T)时,生物素迅速与链霉亲和素结合并将复合物固定于此,而未反应的其他物质和乳胶荧光微球标记的兔IgG则会继续运动;随后经过质控区(C)时,兔IgG会和羊抗兔IgG进行特异性反应,并吸附在此;随后,洗涤液将通道充分洗涤后,将芯片置于荧光分析仪中检测荧光强度,最后把T/C转换成浓度。其中,洗涤液的配方:磷酸二氢钠0.99g磷酸氢二钠5.16g吐温-201mlProclin3001mL纯化水定容至1000mL。利用本实施例的微流控芯片,检测的数据显示T/C与心肌肌钙蛋白I浓度对应数据如下表:表一:心肌肌钙蛋白I浓度T/C0ng/mL0.0070.1ng/mL0.0360.5ng/mL0.1721.5ng/mL0.4786ng/mL1.74325ng/mL6.685实施例2本实施例的检测心肌肌钙蛋白I(cTnI)的微流控芯片与实施例1的相似,区别仅在于抗体包被区的生物素标记的待测物抗体、荧光微球标记的待测物抗体和荧光微球标记质控抗原的摩尔比=4:1:1。利用本实施例的微流控芯片,检测的数据显示T/C与心肌肌钙蛋白I浓度对应数据如下表:表二:心肌肌钙蛋白I浓度T/C0ng/mL0.0060.1ng/mL0.0280.5ng/mL0.1351.5ng/mL0.3896ng/mL1.52425ng/mL5.734实施例3本实施例的检测心肌肌钙蛋白I(cTnI)的微流控芯片与实施例1的相似,区别仅在于抗体包被区的生物素标记的待测物抗体、荧光微球标记的待测物抗体和荧光微球标记质控抗原的摩尔比=1:4:1。利用本实施例的微流控芯片,检测的数据显示T/C与心肌肌钙蛋白I浓度对应数据如下表:表三:心肌肌钙蛋白I浓度T/C0ng/mL0.0080.1ng/mL0.0290.5ng/mL0.1821.5ng/mL0.4916ng/mL1.61125ng/mL5.695实施例4本实施例的检测心肌肌钙蛋白I(cTnI)的微流控芯片与实施例1的相似,区别仅在于抗体包被区的生物素标记的待测物抗体、荧光微球标记的待测物抗体和荧光微球标记质控抗原的摩尔比=1:5:1。利用本实施例的微流控芯片,检测的数据显示T/C与心肌肌钙蛋白I浓度对应数据如下表:表四:心肌肌钙蛋白I浓度T/C0ng/mL0.0110.1ng/mL0.0410.5ng/mL0.2071.5ng/mL0.4286ng/mL1.12525ng/mL2.548从上述数据可看出,本实施例的微流控芯片检测略微存在HOOK效应。以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本
技术领域:
的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1