一种连接基含酯基的吡咯烷类手性Gemini表面活性剂及其制备方法与流程
本发明属于表面活性剂技术领域,具体涉及一种连接基含酯基的吡咯烷类手性gemini表面活性剂及其制备方法。
背景技术
表面活性剂是精细化工领域的重要产品,具有润湿、渗透和防水、乳化和破乳、起泡和消泡等一系列独特的应用性能,故有“工业味精”的美誉,在日化、食品、农药、医药和石油开采等众多领域受到广泛的关注和应用。目前大多数表面活性剂是以石油基为原料,存在原材料不可再生、化学安全性低等问题,同时使用后残留的表面活性剂会造成严重的环境污染。因此,为了满足消费者不断增长的环保意识以及个性化的需求,开发具有高表面活性、多功能性、良好的生物降解性和生物相容性的表面活性剂,提高产品安全性,减少其对环境的影响是目前表面活性剂的研究热点。
gemini表面活性剂是通过连接基团将两个两亲体在头基处或者紧靠头基处键合起来的物质,具有更高降低表面张力的能力、更低的临界胶束浓度、较好的水溶性、更强的复配协调效应和特殊的流变学性质等独特性能。通过改变连接基和疏水基的链长、亲/疏水性、构象、刚性/柔性等,目前已经合成结构不同和性能各异的gemini表面活性剂,但对于gemini表面活性剂的头基结构,尤其是杂环头基gemini表面活性剂研究较少。杂环头基的gemini表面活性剂包括吡啶头基、咪唑头基、吡咯烷酮头基、吡咯烷头基等表面活性剂。其中研究最多的是咪唑啉类杂环表面活性剂,而对吡咯烷为头基的gemini表面活性剂的研究则相对较少。menger等以吡咯烷、1,4-二氯-2-丁炔和长链烷烃溴为原料合成了含有刚性连接基炔基的吡咯烷头基阳离子gemini表面活性剂(langmuir,2000,16,2062);专利cn12941035a以吡咯烷、长链烷烃溴和二溴烷烃为原料,在氮气保护、催化剂作用下反应合成了以多个亚甲基为连接基的吡咯烷头基阳离子gemini表面活性剂;avinash以吡咯烷、十二烷基溴和1,2-双(溴乙酰氧基)乙烷反应得到以酯基为连接基的吡咯烷头基阳离子gemini表面活性剂(phys.chem.chem.phys.,2015,17,19474)。
手性表面活性剂是一类含有手性中心的表面活性剂,兼具表面活性剂和手性分子的特性,即在特定的化学反应中具有区域选择性、不对称催化能力,在特定的手性拆分中具有手性识别能力,已广泛的应用于不对称合成、手性材料的合成和手性分离等领域。根据来源不同,手性表面活性剂可分为天然手性表面活性剂和合成表面活性剂。天然表面活性剂包括胆汁酸类、黄皂苷类等种类,该类表面活性剂生产过程简单,但结构单一、功能有限,不能满足人们的特定需求。合成手性表面活性则是在已有的手性源基础上引入疏水烷基长链形成表面活性剂,其包括氨基酸、酒石酸和糖苷衍生的表面活性剂。
手性gemini表面活性剂是通过连接基团将两个带有手性中心的两亲体在头基处或者紧靠头基处键合起来的物质。sommerdijk等以d-酒石酸和l-酒石酸还原所得到手性丁四醇为原料合成带有手性gemini型磷酸型阴离子表面活性剂(j.am.chem.soc.,1997,119:4338)。shankar等以(2r,3r)-酒石酸乙酯、(2s,3s)-酒石酸乙酯和长链烷基溴为原料合成了(2r,3r)-2,3-二癸基酒石酸和(2s,3s)
-2,3-二癸基酒石酸,发现25℃时其临界胶束浓度为0.5mmol·l-1,表面张力为27.86mn·m-1,且在25℃下比旋光度值分别为+31.7和-31.7(j.phys.chem.b,2007,111:11419)。这些文献丰富了手性gemini表面活性剂的种类,为其应用提供了有益的探索,但关于吡咯类手性gemini表面活性剂的合成和性能未见报道。
技术实现要素:
本发明针对现有吡咯类手性gemini表面活性剂的合成和性能的空缺的问题,提供一种连接基含酯基的吡咯烷类手性gemini表面活性剂及其制备方法。本发明的表面活性剂以吡咯烷为亲水头基,酯基为连接基,该方法合成步骤简单,分离提纯容易,所得产物具有光学活性和良好的表面活性。
本发明采用如下技术方案:
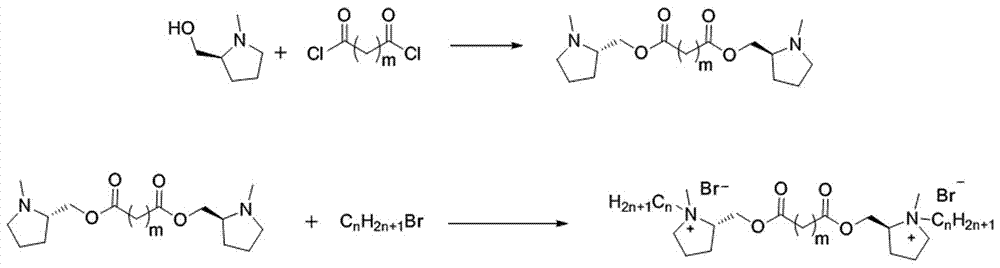
一种连接基含酯基的吡咯烷类手性gemini表面活性剂,以吡咯烷为亲水头基,酯基为连接基,其结构通式如下:
其中,m=2,4;n=12,14,16。
一种连接基含酯基的吡咯烷类手性gemini表面活性剂的制备方法,包括如下步骤:
第一步,烷基二酸二(n-甲基-l-脯氨醇)酯的合成
在反应容器中加入有机溶剂和n-甲基-l-脯氨醇,然后加入缚酸剂,冰浴冷却至0~10℃,氮气保护下缓慢滴加烷基二酰氯,滴加完全以后,反应3~8h,反应结束后,过滤,滤液加入饱和碳酸钠溶液,搅拌3min后,静置分层,取有机层水洗后,再用无水硫酸镁干燥,活性炭脱色,旋蒸后得到的无色粘稠液体,即烷基二酸二(n-甲基-l-脯氨醇)酯;
其中,烷基二酰氯与n-甲基-l-脯氨醇的摩尔比为1:2,烷基二酰氯与缚酸剂的摩尔比为1:3~1:8;
第二步,手性gemini表面活性剂的合成
将第一步所得的烷基二酸二(n-甲基-l-脯氨醇)酯和长链烷基溴以1:2.4~1:4的摩尔比在有机溶剂中反应,反应温度在70~100℃,反应时间24~36h,反应结束后,旋蒸脱除溶剂后得到粘液,粘液用石油醚洗涤后过滤,滤饼用丙酮洗涤和重结晶得到白色固体,真空干燥即可得到所述连接基含酯基的吡咯烷类手性gemini表面活性剂。
其中,第一步中所述有机溶剂为二氯甲烷、三氯甲烷、四氢呋喃、丙酮或乙腈,n-甲基-l-脯氨醇与所述有机溶剂体积比为1:50~1:100;第二步中所述的有机溶剂为乙腈、二氧六环或乙醇,烷基二酸二(n-甲基-l-脯氨醇)酯与所述有机溶剂摩尔比为1:50~1:80。
第一步中所述缚酸剂为三乙胺、碳酸钠或吡啶。
第一步中所述烷基二酰氯为己二酰氯或丁二酰氯。
第二步中所述长链烷基溴为溴代十二烷、溴代十四烷或溴代十六烷。
本发明的有益效果如下:
1.本发明公布了一种新的连接基含酯的吡咯烷类手性gemini表面活性剂,结构中含有酯基,对环境好容易降解。
2.本发明的合成步骤简单,分离提纯容易。
3.本发明合成不同链长的连接基含酯基的吡咯烷类手性gemini表面活性剂,调节表面活性,与传统的表面活性剂相比,有较低的临界胶束浓度(cmc)和较低的临界表面张力。例如,实例1的表面活性剂(i)的临界胶束浓度为0.457mmol•l-1,在临界胶束浓度下的表面张力约为32.14mn•m-1。
4.本发明所合成的连接基含酯的吡咯烷类手性gemini表面活性剂具有光学活性。例如实例2的表面活性剂(ii)浓度为2.52mmol•l-1时在λ=205-225nm处出现两个正的cotton吸收峰,在λ=230-245nm处出现负的cotton吸收峰,并有较强cd信号,表明表面活性剂(ii)具有光学活性。本发明所合成的连接基含酯的吡咯烷类手性gemini表面活性剂可构筑手性胶束、手性仿生细胞等手性识别材料,从而用于不对称合成、手性材料的合成和手性分离等领域。
附图说明
图1为本发明表面活性剂的合成路线;
图2为本发明实施例1的表面活性剂的红外光谱图;
图3为本发明实施例1的表面活性剂的1hnmr图;
图4为本发明实施例1的表面活性剂的esi-ms图;
图5为本发明实施例1的表面活性剂的圆二色谱图(4.57mmol•l-1);
图6为本发明实施例2的表面活性剂的红外光谱图;
图7为本发明实施例2的表面活性剂的1hnmr图;
图8为本发明实施例2的表面活性剂的esi-ms图;
图9为本发明实施例2的表面活性剂的圆二色谱图(2.52mmol•l-1);
图10为本发明实施例3的表面活性剂的红外光谱图;
图11为本发明实施例3的表面活性剂的1hnmr图;
图12为本发明实施例3的表面活性剂的esi-ms图;
图13为本发明实施例3的表面活性剂的圆二色谱图(0.55mmol•l-1);
图14为本发明三个实施例的表面活性剂的表面张力对浓度关系图。
具体实施方式
实施例1
表面活性剂(i)的结构式如下:
表面活性剂(i)的制备方法包括如下步骤:
第一步,己二酸二(n-甲基-l-脯氨醇)酯的合成
在250ml的三口瓶中加入9.30g(80.74mmol)n-甲基-l-脯氨醇,50ml二氯甲烷和12.26g(121.11mmol)三乙胺,通入氮气,冰浴冷却至0~10℃。缓慢滴加7.39g(40.37mmol)己二酰氯,待己二酰氯滴加完全以后,反应8h。待反应结束后,加入100ml饱和碳酸钠,搅拌3min分层。取有机层水洗,用适量的无水硫酸镁干燥,活性炭脱色,旋蒸得无色粘稠液体,即得己二酸二(n-甲基-l-脯氨醇)酯。
第二步,表面活性剂(i)的合成
在100ml的三口瓶中加入第一步所得3.42g(10mmol)己二酸二(n-甲基-l-脯氨醇)酯,50ml无水乙醇,升温搅拌至70℃,滴加9.97g(40mmol)溴代十二烷,保持70℃反应36h。反应结束后,旋蒸脱除溶剂。粘液用石油醚多次,洗去过量溴代十二烷,抽滤,滤饼用丙酮洗涤和重结晶,得到白色固体,真空干燥得到表面活性剂(i)。采用红外光谱法、核磁共振氢谱和高分辨率质谱进行结构表征,其红外光谱图见2,核磁共振氢谱见图3,高分辨率质谱见图4,圆二光谱图见5。
红外分析结果:ft-ir(kbr,cm-1):2931,2848,1741,1458,723。核磁:1hnmr(cdcl3,δ/ppm):0.841-0.874(t,6h),1.234(m,36h),1.467-1.480(m,16h),2.354-2.384(m,4h),3.352-3.469(m,14h),4.183-4.252(m,2h),4.512-4.521(d,4h)。质谱:esi-ms(positive):m/z339.31532[m-2br]2+/2,757.55125[m-br]+。
实施例2
表面活性剂(ii)的结构式如下:
表面活性剂(ii)的制备方法包括如下步骤:
第一步,己二酸二(n-甲基-l-脯氨醇)酯的合成
在250ml的三口瓶中加入9.30g(80.74mmol)n-甲基-l-脯氨醇,80ml三氯甲烷和25.68g(242.22mmol)无水碳酸钠,通入氮气,冰浴冷却至0~10℃。缓慢滴加7.39g(40.37mmol)己二酰氯,待己二酰氯滴加完全以后,反应6h。待反应结束后,加入100ml饱和碳酸钠,搅拌3min分层。取有机层水洗,用适量的无水硫酸镁干燥,活性炭脱色,旋蒸得无色粘稠液体,即得己二酸二(n-甲基-l-脯氨醇)酯。
第二步,表面活性剂(ii)的合成
在100ml的三口瓶中加入第一步所得3.42g(10mmol)己二酸二(n-甲基-l-脯氨醇)酯,75ml无水乙腈,升温搅拌至80℃,滴加9.70g(35mmol)溴代十四烷,回流条件下反应30h。反应结束后,旋蒸脱除溶剂。粘液用石油醚多次,洗去过量溴代十四烷,抽滤,滤饼用丙酮洗涤和重结晶,得到白色固体,真空干燥得到表面活性剂(ii)。采用红外光谱法、核磁共振氢谱和高分辨率质谱进行结构表征,其红外光谱图见6,核磁共振氢谱见图7,高分辨率质谱见图8,圆二光谱图见9。
红外分析结果:ft-ir(kbr,cm-1):2915,2862,1742,1457,721。核磁:1hnmr(cdcl3,δ/ppm):0.880(t,6h),1.262(m,44h),1.392-1.435(m,16h),2.334-2.364(m,4h),3.381-3.408(m,14h),4.218(m,2h),4.319-4.446(d,4h)。质谱:esi-ms(positive):m/z367.34517[m-2br]2+/2,813.61993[m-br]+。
实施例3
表面活性剂(iii)的结构式如下:
表面活性剂(iii)的制备方法包括如下步骤:
第一步,丁二酸二(n-甲基-l-脯氨醇)酯的合成
在250ml的三口瓶中加入9.30g(80.74mmol)n-甲基-l-脯氨醇,100ml无水丙酮和25.55g(322.96mmol)吡啶,通入氮气,冰浴冷却至0~10℃。缓慢滴加6.26g(40.37mmol)丁二酰氯,待丁二酰氯滴加完全以后,反应3h。带反应结束后,加入100ml饱和碳酸钠,搅拌3min分层。取有机层水洗,用无水硫酸镁干燥,活性炭脱色,旋蒸得无色粘稠液体,即得丁二酸二(n-甲基-l-脯氨醇)酯。
第二步,表面活性剂(iii)的合成
在100ml的三口瓶中加入步骤1所得3.12g(10mmol)丁二酸二(n-甲基-l-脯氨醇)酯,80ml无水二氧六环,升温搅拌至100℃,滴加5.98g(24mmol)溴代十二烷,保持回流反应24h。反应结束后,旋蒸脱除溶剂。粘液用石油醚多次,洗去过量溴代十二烷,抽滤,滤饼用丙酮洗涤和重结晶,得到白色固体,真空干燥得到表面活性剂(iii)。采用红外光谱法、核磁共振氢谱和高分辨率质谱进行结构表征,其红外光谱图见10,核磁共振氢谱见图11,高分辨率质谱见图12,圆二光谱图见13。
红外分析结果:ft-ir(kbr,cm-1):2932,2841,1732,1468,722。核磁:1hnmr(cdcl3,δ/ppm):0.866-0.894(t,6h),1.260(m,36h),1.406-1.435(m,12h),2.334-2.364(m,4h),3.381-3.409(m,14h),4.193(m,2h),4.394-4.456(d,4h)。质谱:esi-ms(positive):m/z729.51699[m-br]+。
- 还没有人留言评论。精彩留言会获得点赞!