基于微流控技术的PET显像剂模块化集成合成装置及其方法与流程
本发明属于放射性同位素标记合成领域,具体涉及一种基于微流控技术的pet显像剂模块化集成合成系统。
背景技术:
正电子发射断层扫描(pet)是一种功能强大的诊断工具,可用于多种领域,包括肿瘤学、神经学、心脏病学和炎症等。pet的原理是通过回旋加速器得到18f、11c、13n等放射性核素,然后经不同的化学合成模块(也称合成器)将这些放射性核素标记到不同的化学底物上,合成最终供临床使用的各种放射性药物,从而有效地收集生物相关的信息。放射性药物通常是通过相对大规模的自动化合成模块制备的,其中存在一些局限性。首先,为了易于处理,纳摩尔量的放射性药物至少需要400μl溶液,导致引入的标记试剂浓度过低,大大降低了反应速率。其次,在放射性药物由合成模块转移到医院的过程中会发生显著地剂量衰减,导致pet探针的比活性降低,显影质量降低,且患者需根据放射性药物的剩余剂量而不是自身的成像需求进行安排。第三,大规模的自动化合成模块是针对特定的放射性药物进行设计及优化的,通常不用于制备其他放射性药物。最后,该合成模块价格昂贵,仍然需要经过专门培训的人员以及配备“热室”的特殊实验室,用于生产pet探针。
微流控芯片技术的出现,为该领域带来的新的曙光,引起了科学家们的兴趣。微流控芯片(microfluidicchip)或称芯片实验室(lab-on-a-chip),是基于微电子机械系统发展起来的新型技术平台。由于所需样本量可以降低至μl和nl水平,微流控芯片技术已被广泛应用于疾病诊断、药物筛选和环境检测等诸多领域。放射性药物特别是18f标记pet药物的合成所需18f的化学量很少(<1.0ng),与微流控芯片的特点非常匹配。如能应用微流控芯片,标记前体的用量和反应体积均可以降低到很小。且18f-半衰期短,而18f-fdg的市场需求量很大。因此,基于微流控芯片技术,研发用于合成18f标记pet药物的微反应器具有非常重要的意义。对于pet-ct显像,目前虽然已经开发出了许多新的正电子放射性药物,但由于合成的复杂性且效率低,阻碍了它们的临床应用,使得只有少数pet探针可以作为放射性药物进行生产。其中,18f-fdg是临床使用最多、应用范围最广的显像剂。该物质的合成主要基于三个连续过程:(i)通过在回旋加速器中轰击[18o]水获得稀溶液(1-10ppm),从稀溶液中富集和干燥[18f]氟离子;(ii)使用kryptofix2.2.2提高kf在无水mecn中的溶解度,对甘露糖三氟甲磺酸酯前体进行[18f]氟化物取代;(iii)酸性水解氟化中间体四乙酰化[18f]氟代葡萄糖化合物([18f]tag)。
lee等人首次利用微流控芯片技术制造批量模式微流体放射合成装置,并利用该装置合成放射性元素18f标记的[18f]fdg。该装置从回旋加速器获得稀释的[18f]氟离子,将其捕获在内部离子交换柱上,然后用k2co3溶液释放到第一反应回路中。溶剂交换、氟化和水解反应都发生在第二反应回路中,该第二反应回路位于距离第一反应器约1毫米的同一芯片上。该方法的优点在于在同一芯片上实现最大数量的全集成,并且显着减少了放射性核素潜在损失的方式。这些芯片的局限性在于它们由pdms(聚二甲基硅氧烷)制成,该pdms对[18f]氟离子具有高反应性,会导致高达90%的放射性损失。此外,离子交换柱的容量小,该生产规模相对较低,产生的产品数量不足以进行小动物成像(<200mci)。章英剑等人设计了一种基于微流控芯片技术的18f微反应器。主要由pdms微流控芯片与定制的具有加热和冷却功能的玻璃微反应瓶组成。由此可在加热、有机溶剂等剧烈条件下工作。该装置先利用丝印技术和聚二甲基硅氧烷(pdms)材料制作微流控芯片,再与定制的具有加热或冷却功能的玻璃基微反应瓶组合而形成18f微反应器。微反应瓶的设计,克服了pdms材料在加热条件下不耐受有机溶剂的缺点。但该装置合成药物所需时间绝大部分用在了溶液转移上,反应瓶的加入使得该装置并未实现真正的微流控芯片全集成,且存在一定的放射性损失。因此,亟需发展另外的基于微流控技术的pet显像剂集成合成装置,以突破这种瓶颈状态,方便高效在线自动化合成18f-fdg以及其他的pet探针。
技术实现要素:
本发明的目的在于解决现有技术中存在的问题,并提供一种基于微流控技术的pet显像剂模块化集成合成装置,可用于合成正电子发射断层成像(pet)示踪剂,包括高效在线自动化合成18f-fdg、间接标记合成18f-奥曲肽。
本发明所采用的具体技术方案如下:
基于微流控技术的pet显像剂模块化集成合成装置,其包括第一注射泵和第二注射泵,两者的出液口均设有三通阀,三通阀与注射腔相连的入口与另外两个出口择一连通,且三通阀位于注射腔的上部;第一注射泵的第一出口通过缓冲盘管连接多位选择阀的入口,该入口与多位选择阀的其他若干出口之间择一连通;多位选择阀的第一出口放空,第四出口、第五出口、第十出口分别连接阴离子交换固相萃取芯片的一端、微流控反应芯片的通道入口、纯化芯片的一端,阴离子交换固相萃取芯片的另一端连接第二注射泵的第一出口,第二注射泵的第二出口连接废液收集装置,且连接管道的出口与液面不接触;纯化芯片的另一端连接纯化液收集装置;多位选择阀的其余出口通过管道分别与存储有反应试剂的试剂瓶相连。
本发明中,注射泵的注射腔是指由注射泵外筒和柱塞推杆所形成的密封腔。多位选择阀是具有一个入口和多个出口的阀门,入口与出口之间的连通状态可选择切换,每次仅连通一个出口,其余出口则密闭。另外,本发明中的各部件的入口和出口,仅为了表示其在某些状态下属于入口和出口,但由于部分状态下流体会反流,因此其入口功能和出口功能可能互换,不作为限定。另外,本发明中的连接方式可以是直接的连接,也可以是间接的连接。阴离子交换固相萃取芯片是指内部集成有阴离子交换树脂(如qma树柱)的芯片,用于富集18f-离子,纯化芯片是集成有对粗产物进行提纯的树脂柱的芯片,其树脂种类可根据实际进行选择。本发明中的微流控反应芯片可以根据反应的需要从市售产品中选择,或者自行设计。
基于该技术方案,还可以进一步提供如下优选方案,且各优选方案中的技术特征在没有冲突情况下均可相互组合。
作为优选,该装置中还包括一个旋转切换阀和用于向芯片中鼓入气体的鼓气装置;微流控反应芯片底部设有用于调节微通道中流体温度的温控装置;微流控反应芯片中设有微通道,且微通道的两端分别设有至少两个通道入口和一个通道出口,所有通道入口均通过支路通道连通微通道的前端;微通道的第一通道入口与旋转切换阀的第一接口相连,微通道的第二通道入口与旋转切换阀的第二接口相连,鼓气装置的出气口与旋转切换阀的第三接口相连,旋转切换阀的第四接口放空,微通道的通道出口与旋转切换阀的第五接口相连,多位选择阀的第五出口与旋转切换阀的第六接口相连;所述的旋转切换阀通过旋转切换具有两种工作状态;在第一工作状态下,其第一接口与第六接口连通,第二接口与第三接口连通,第四接口与第五接口连通;在第二工作状态下,其第一接口与第二接口连通,第三接口与第四接口连通,第五接口与第六接口连通。
本发明中,微通道是指用于实现微流控反应的细小通道,其尺寸一般为100-2000μm。微通道的通道入口可通入气体和液体试剂,出口可排出气体或液体或气液混合物,通过阀切换操作,将不同的试剂通入微通道中,可实现不同反应工序的控制。上述特殊结构的旋转切换阀、鼓气装置、微流控反应芯片配合,可以实现pet显像剂18f-fdg的合成,以及间接标记合成18f-奥曲肽。
进一步的,所述的微通道的水平两侧沿程设有若干个凹形腔,所述的凹形腔由通道内壁向背离通道中心一侧凹陷而成。
通道中心是指微通道用于流通试剂或者气体的通道中心线所在位置,因此通道内壁上向背离通道中心一侧凹陷就是指通道内壁由通道中心朝向芯片基材一侧凹陷,但凹陷方向并不一定要完全垂直通道内壁,可根据需要调整。由于凹形腔开设于通道内壁上,因此其尺寸也较小,当液体试剂流经该腔体时,试剂会因为表面张力被滞留在腔体内,而不会被气流推动带出微通道。后续保持气体不断通入微通道,即可使腔内的滞留试剂不断蒸发,实现干燥。该微流控芯片相对于采用pdms透气膜的方法,其能够以简单的结构实现试剂干燥脱水以及溶剂交换,而且在强酸强碱等场合也可以应用。另外,当试剂在微通道内快速来回往复运动时,凹形腔也可以通过对流体产生扰流,实现试剂的混合搅拌反应。
进一步的,所述微通道中包含顺次连接的第一管段、第二管段和第三管段,所述的凹形腔至少设置于第二管段中。第二管段中的液体试剂的推动主要是由其两端的第一管段和第三管段中的压力差所带来的。通过阀切换,使得第一管段密闭,第二管段与注射泵连接,两个管段中初始的气体压力相同,注射泵通过抽气和鼓气的不断切换,控制第三管段中的气压不断变化,从而使第二管段中的液体试剂被推动着来回往复,在经过凹形腔的位置实现紊流扰动,产生类似搅拌的效果。
进一步的,所述的温控装置具有多个,第一管段、第二管段和第三管段下方分别设有独立控制的温控装置。通过阀切换,保持第一管段和第三管段密闭,两个管段中初始的气体温度和压力相同,温控装置通过控制两个管段中的温度不同,使两者产生温度差,进而产生压力差,也可以使第二管段中的液体试剂被推动着来回往复。
作为优选,所述的多位选择阀中至少有10个出口。合成18f-fdg以及间接标记合成18f-奥曲肽的反应中,需要用到大量的不同试剂,该数量可以保证不同试剂的顺利供应。
作为优选,所述的旋转切换阀采用两位六通阀。两位六通阀可通过购买标准件获得,无需另外定制。
作为优选,合成装置中至少设有9个试剂瓶,其中第一注射泵的第二出口通过管道连接第一试剂瓶;多位选择阀的第二出口、第三出口、第六出口、第七出口、第八出口、第九出口分别通过管道连接第二试剂瓶、第三试剂瓶、第五试剂瓶、第六试剂瓶、第七试剂瓶、第八试剂瓶,第四试剂瓶作为废液收集装置,第九试剂瓶作为纯化液收集装置。不同的试剂可以预先装于这些试剂瓶中。当然,此处的试剂瓶应当做广义理解,理论上任何能够与试剂不反应且便于抽吸的容器均能够用于作为试剂瓶。
作为优选,所述的微流控反应芯片采用耐腐蚀材质,优选为石英、硅酸盐玻璃、硼酸盐玻璃;合成装置中所采用的连接管道均采用特氟龙材质。石英等材料具有较好的稳定性,且溶剂在其表面容易形成液膜。特氟龙(polytetrafluoroethylene,ptfe)具有抗粘结性能,使试剂不会在管路中残留。
本发明的另一目的在于提供一种利用上述合成装置的pet显像剂18f-fdg合成方法,其步骤如下:
s1:保持第一注射泵的注射腔与第一出口连通,多位选择阀的入口切换至与多位选择阀的第一出口连通,第一注射泵进行初始化,排出注射腔的气体;然后第一注射泵的注射腔切换至与第二出口连通;
s2:启动第一注射泵抽吸模式,吸入第一试剂瓶中预先存储的ch3cn溶液,然后将第一注射泵的注射腔切换至与第一出口连通,将注射腔内的气体和液体打入缓冲盘管中,再次将第一注射泵的注射腔切换至与第二出口连通并吸取ch3cn溶液,将第一注射泵的注射腔切换至与第一出口连通,将注射腔内的液体打入缓冲盘管中;不断重复直至缓冲盘管内的气体被完全排出;
s3:启动第一注射泵抽吸模式,向缓冲盘管中抽入一段气体,用于在管内已有的ch3cn溶液与后续将被抽入管内的其他溶液之间形成分隔段;
s4:将多位选择阀的入口切换至与多位选择阀的第二出口连通,启动第一注射泵的抽吸模式,将第二试剂瓶内预先通过回旋加速器得到的18f-溶液抽吸至缓冲盘管中;将多位选择阀的入口切换至与多位选择阀的第四出口连通,启动第一注射泵注射模式,将18f-溶液注入阴离子交换固相萃取芯片中;
s5:保持第二注射泵的注射腔与第二出口连通,第二注射泵进行初始化,排出注射腔的气体;
s6:将第二注射泵的注射腔切换至与第一出口连通,启动第二注射泵的抽吸模式,将阴离子交换固相萃取芯片中的溶液通过负压抽到注射腔内;将第二注射泵的注射腔切换至与第二出口连通,启动第二注射泵的注射模式,将注射腔内的溶液注入废液收集装置;
s7:将多位选择阀的入口切换至与多位选择阀的第三出口连通,启动第一注射泵的抽吸模式,将第三试剂瓶中预先存储的k2.2.2/k2co3溶液吸至缓冲盘管中;然后将多位选择阀的入口切换至与多位选择阀的第四出口连通,启动第一注射泵注射模式,将k2.2.2/k2co3溶液注入阴离子交换固相萃取芯片中,对18f-离子进行洗脱;再启动第二注射泵的抽吸模式,向注射腔中吸入空气,然后将第二注射泵的注射腔切换至与第一出口连通,启动第二注射泵的注射吸模式利用空气将阴离子交换固相萃取芯片中的洗脱液压回缓冲盘管中;然后多位选择阀的入口切换至与多位选择阀的第五出口连通,并保持旋转切换阀处于第一工作状态下;启动第一注射泵注射模式,将洗脱液注入微流控反应芯片的微通道中;
s8:启动鼓气装置,开始向芯片中鼓入气体;然后控制微流控反应芯片底部的温控装置开始加热,加热温度为水和乙腈的共沸点温度;
s9:将多位选择阀的入口切换至与多位选择阀的第七出口连通,然后启动第一注射泵抽吸模式,将第六试剂瓶中预先存储的ch3cn溶液抽吸至缓冲盘管中,再将多位选择阀的入口切换至与多位选择阀的第五出口连通,将ch3cn溶液注入微流控反应芯片的微通道中;
s10:保持干燥气体持续鼓入微通道中,对乙腈与水形成的共沸物进行去除;
s11:除水至干后,将旋转切换阀切换至第二工作状态下,并停止气体通入;
s12:将多位选择阀的入口切换至与多位选择阀的第六出口连通,然后启动第一注射泵抽吸模式,将第五试剂瓶中预先存储的三氟甘露糖的无水乙腈前体液抽吸至缓冲盘管中,然后控制温控装置升温加热至110℃;
s13:再将多位选择阀的入口切换至与多位选择阀的第五出口连通,将三氟甘露糖的无水乙腈前体液从微通道的通道出口注入微流控反应芯片;
s14:当前体液完全注入微通道中部位置后,利用第一注射泵不断地进行注射模式和抽吸模式的切换,使前体液与干燥的18f-混合物混合并不断搅拌反应;反应完全后,将旋转切换阀切换至第一工作状态下;
s15:将控制温控装置降温至100℃,持续向微通道的第二通道入口中通入干燥气体,使乙腈被蒸发去除;完全去除乙腈后,将旋转切换阀切换至第二工作状态下;
s16:将多位选择阀的入口切换至与多位选择阀的第八出口连通,将第七试剂瓶中预先存储的hcl溶液抽吸至缓冲盘管中;
s17:再将多位选择阀的入口切换至与多位选择阀的第五出口连通,将hcl溶液从微通道的通道出口注入微流控反应芯片;利用第一注射泵不断地进行注射模式和抽吸模式的切换,使hcl溶液与氟化反应后的混合物混合并不断搅拌反应;反应完全,得到粗产物
s18:将多位选择阀的入口切换至与多位选择阀的第九出口连通,将第八试剂瓶中预先存储的h2o抽吸至缓冲盘管中;
s19:再将多位选择阀的入口切换至与多位选择阀的第五出口连通,将h2o注入微流控反应芯片中,稀释粗产物;
s20:启动第一注射泵抽吸模式,将稀释后的粗产物全部抽取至缓冲盘管中,将多位选择阀的入口切换至与多位选择阀的第十出口连通,启动第一注射泵注射抽吸模式,将粗产物稀释液注入纯化芯片进行纯化。
作为优选,鼓入微通道的干燥气体为惰性气体,优选为氦气。
本发明相对于现有技术而言,具有以下有益效果:
1、本发明提供一种基于微流控技术的pet显像剂模块化集成合成系统,可用于合成正电子发射断层成像(pet)示踪剂,包括高效在线自动化合成18f-fdg、间接标记合成18f-奥曲肽。根据常规反应器的反应试剂比例、温度、时间等参数的研究基础,本发明提供的集成合成系统简化合成和纯化工艺,提高微流控氟代反应和水解反应的合成效率,用自行研究的设备及方法进行热合成fdg,初始的18f离子放射性大约在40mci,在一个半衰期后检测产物放射性为11mci,且tlc只有一个fdg的吸收峰,产物较纯净,目标产物fdg的热合成产率在50%左右,全部合成耗时78分钟。
2、本发明提供的集成合成系统体积小、成本低、收率高,能够根据不同合成路线灵活组合,具有完整实用且适于过度到产业化。
附图说明
图1为本发明提供的基于微流控技术的pet显像剂模块化集成合成装置结构示意图;
图2为用于合成反应中实现干燥过程的微流控芯片的一种结构示意图;
图3为微流控芯片的第一个使用状态示意图(试剂注入);
图4为微流控芯片的第二个使用状态示意图(干燥气体通入);
图5为微流控芯片的第三个使用状态示意图(滞留试剂逐渐干燥);
图6为微通道的第一个使用状态示意图(仅示出部分组件,其余简化省略);
图7为微通道的第二个使用状态示意图(仅示出部分组件,其余简化省略);
图8为微通道的第三个使用状态示意图(仅示出部分组件,其余简化省略);
图中:第一注射泵p1、第二注射泵p2、阴离子交换固相萃取芯片c1、纯化芯片c2、多位选择阀m1、缓冲盘管g、旋转切换阀m2、微流控反应芯片c3、第一试剂瓶t1、第二试剂瓶t2、第三试剂瓶t3、第四试剂瓶t4、第五试剂瓶t5、第六试剂瓶t6、第七试剂瓶t7、第八试剂瓶t8、第九试剂瓶t9。
具体实施方式
下面结合附图和具体实施方式对本发明做进一步阐述和说明。本发明中各个实施方式的技术特征在没有相互冲突的前提下,均可进行相应组合。需要说明的是,术语“左”、“中”、“右”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。
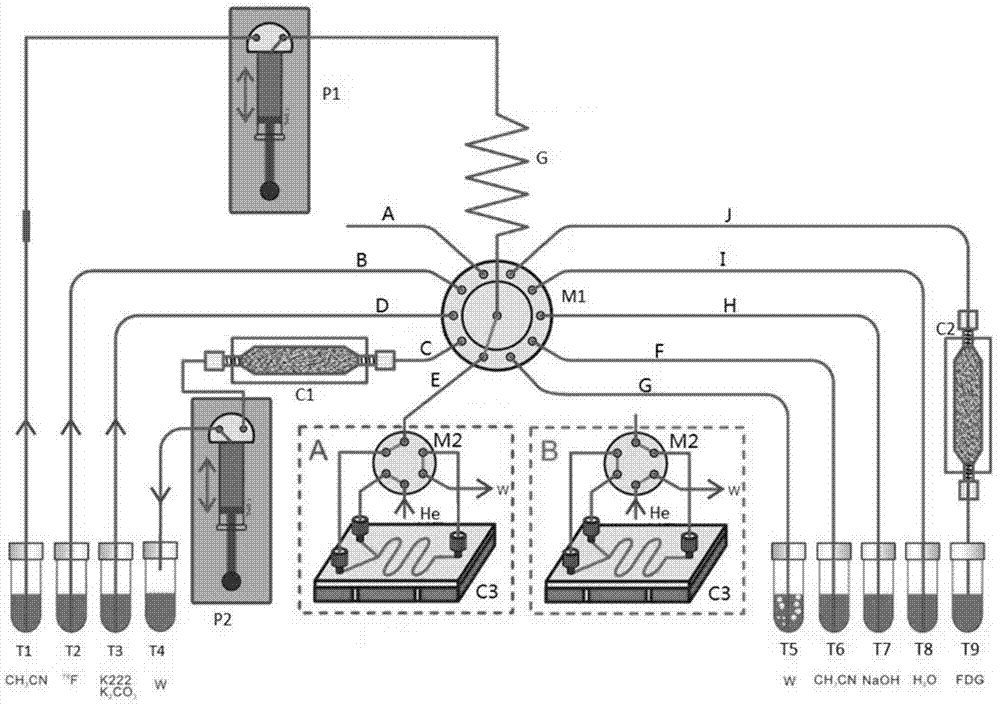
如图1所示,为本发明一个较佳实施例中所设计的基于微流控技术的pet显像剂模块化集成合成装置,其中具有第一注射泵p1和第二注射泵p2。第一注射泵p1和第二注射泵p2均采用三通式泵体结构,注射泵的注射腔出液口均设有三通阀,三通阀的入口与注射腔相连,而该入口与三通阀的另外两个出口择一连通,可通过管路切换连通不同的出口,以实现功能切换。且三通阀位于注射腔的上部,气体或液体从注射腔的顶部进入腔体。一般来说,一个出口用于放空或者连接废液瓶,另一出口用于吸液,由此能够在注射模式和抽吸模式之间切换。三通阀的入口和出口之间可双向流动。本实施例的合成装置中设有9个试剂瓶,用于存储或者接纳不同的试剂。
第一注射泵p1的第一出口通过缓冲盘管g连接多位选择阀m1的入口,第二出口通过管道连接第一试剂瓶t1。缓冲盘管g是一段较长的管道,其以盘旋的方式放置,可减小占地。由于管道较长,因此能够吸入足量的反应试剂。但在使用时,管道内尽量不保持充满空气的状态,而是将管内充满乙腈等溶液,否则当注射泵抽吸或者注射时,大量空气本身的可压缩性会导致注射量或者抽吸量无法控制。多位选择阀m1的入口位于阀体中心,该入口与多位选择阀m1的其他若干出口之间择一连通,出口为10个,以满足使用要求,逆时针顺次为第一出口~第十出口。
多位选择阀m1的第一出口通过a管道放空。多位选择阀m1的第二出口通过管道(记为b管)连接第二试剂瓶t2,多位选择阀m1的第三出口通过管道(记为d管)连接第三试剂瓶t3,多位选择阀m1的第四出口通过管道(记为c管)连接阴离子交换固相萃取芯片(采用填充qma树脂的富集芯片)c1的一端,阴离子交换固相萃取芯片c1的另一端连接第二注射泵p2的第一出口,第二注射泵p2的第二出口连接废液收集装置,即第四试剂瓶t4,且连接管道的出口应当悬空,保持与第四试剂瓶t4的液面不接触。多位选择阀m1的第五出口通过管道(记为e管)间接连接微流控反应芯片c3的通道入口。多位选择阀m1的第六出口通过管道(记为g管)连接第五试剂瓶t5。多位选择阀m1的第七出口通过管道(记为f管)连接第六试剂瓶t6。多位选择阀m1的第八出口通过管道(记为h管)连接第七试剂瓶t7。多位选择阀m1的第九出口通过管道(记为i管)连接第八试剂瓶t8。多位选择阀m1的第十出口通过管道(记为j管)连接纯化芯片c2的一端,纯化芯片c2的另一端连接纯化液收集装置,即第九试剂瓶t9。
上述装置中,除芯片内部管路外,各阀门、泵、试剂瓶等之间相连的流体管路均采用特氟龙材质。
在该装置中,利用第一注射泵p1、第二注射泵p2以及多位选择阀m1,可以实现从不同的试剂瓶中吸取溶液,按照任意顺序完成试剂注入和抽取。其工作原理如下:
首先,在第一试剂瓶t1中注入溶液,然后保持第一注射泵p1的注射腔与第一出口连通,多位选择阀m1的入口切换至与多位选择阀m1的第一出口连通,此时第一注射泵p1的注射腔可进行放空作业。第一注射泵p1进行初始化,排出注射腔的气体;然后第一注射泵p1的注射腔切换至与第二出口连通;启动第一注射泵p1抽吸模式,吸入第一试剂瓶t1中预先存储的溶液,由于管路中原先就有气体存在,所以会先进气体再进液体。这就需要保证左侧管内的气体体积比第一注射泵p1的体积小,只有这样才能进液。气体和液体进入第一注射泵p1之后,由于活塞是倒着放的,使得气体在上面,液体在下面。然后将第一注射泵p1的注射腔切换至与第一出口连通,将注射腔内的气体和液体打入缓冲盘管g中,再次将第一注射泵p1的注射腔切换至与第二出口连通并吸取溶液,将第一注射泵p1的注射腔切换至与第一出口连通,将注射腔内的液体打入缓冲盘管g中。不断重复直至缓冲盘管g内的气体就可以被完全排出,后续抽吸溶液时第一注射泵的动作就可以灵敏地得到反馈。但实际使用时,需保证其他溶液不与缓冲盘管g中已有溶液接触,因此可重新启动第一注射泵p1抽吸模式,向缓冲盘管g末端抽入一小段气体,作为隔离,由此完成试剂抽吸的准备工作。然后,通过多位选择阀m1的切换,按照预定的顺序,可从不同的试剂瓶中抽吸相应的试剂,再通过切换多位选择阀m1,将其注入不同的芯片中。
但需要注意的是,在抽取试剂过程中,如果一次就能将所需的试剂溶液抽到缓冲盘管中,也就是说,抽取管的管长或者说是管内的气体体积很少,当其先进入缓冲盘管之后,不会影响试剂溶液的进入。那么这时候可以将多位选择阀切换至与目标芯片相连,将所需量的试剂溶液推到芯片中去。再将多位选择阀切换至与大气相连,将多余的溶液和气体排出,只剩下在管中长约为1-2mm的气体作为隔离。如果一次不能将所需的试剂溶液抽到缓冲盘管中,也就是说,管长或者说是管内的气体体积很多,当其先进入缓冲盘管g之后,影响了试剂溶液的进入。那么这时候可以先抽取管中的部分气体,再将多位选择阀m1切换至与大气相连,将气体排出,再切换至与该管相连,由于多位选择阀m1的出口在不连通情况下是闭锁的,因此气体不会重新进入管内,下一次抽取时气体会不断减小直至抽到试剂溶液。然后将试剂溶液抽到缓冲盘管g中即可。如果所需的试剂溶液不能一次性抽到缓冲盘管g中,可以先抽一部分,再将多位选择阀g切换至与目标芯片相连,将试剂溶液推到芯片中去,再重新切换至与试剂瓶相连,继续抽试剂溶液,如此反复,直至可以将所需的试剂溶液全部推到芯片中去。
由于在pet显像剂合成过程中,部分试剂需要进行富集,因此第二注射泵p2的作用就是配合第一注射泵p1和多位选择阀m1完成该富集过程。当例如18f-之类的待富集试剂进入阴离子交换固相萃取芯片c1后,保持第二注射泵p2的注射腔与第二出口连通,第二注射泵p2进行初始化,排出注射腔的气。将第二注射泵p2的注射腔切换至与第一出口连通,启动第二注射泵p2的抽吸模式,将阴离子交换固相萃取芯片c1中的溶液通过负压抽到注射腔内;将第二注射泵p2的注射腔切换至与第二出口连通,启动第二注射泵p2的注射模式,将注射腔内的溶液注入废液收集装置。然后再用第一注射泵p1抽取洗脱溶剂,将其注入阴离子交换固相萃取芯片c1中,再利用第二注射泵p2的注射模式,利用空气将洗脱液推回缓冲盘管g,再注入目标芯片。
因此,上述系统能够通过不同的操作组合,实现各种试剂的转移、富集和混合反应,其微流控反应芯片c3可以根据实际进行调整。而针对合成18f-fdg、间接标记合成18f-奥曲肽等pet显像剂相关反应,其工艺中还存在脱水干燥、搅拌反应等多种特殊的工序,因此在本实施例中,在上述系统基础上,对于微流控反应芯片c3的结构做了优化设计,以实现这些特殊工序。
在本实施例的装置中,除了上述组件之外,还包括一个旋转切换阀m2,此处采用两位六通阀。另外,还有一个用于向芯片中鼓入气体的鼓气装置,鼓气装置可采用带减压阀的钢瓶实现,气体可采用惰性气体,此处采用氦气。微流控反应芯片c3底部设有用于调节微通道中流体温度的温控装置。微流控反应芯片c3中设有微通道,且微通道的两端分别设有两个通道入口和一个通道出口,两个通道入口分布设置于一条“v”型结构的连接管路的两个分叉口末端,两个入口各自通过一条支路通道汇流后,连通微通道的前端,分别将待干燥试剂和干燥气体通入微通道。微通道的第一通道入口与旋转切换阀m2的第一接口相连,微通道的第二通道入口与旋转切换阀m2的第二接口相连,鼓气装置的出气口与旋转切换阀m2的第三接口相连,旋转切换阀m2的第四接口放空,微通道的通道出口与旋转切换阀m2的第五接口相连,多位选择阀m1的第五出口与旋转切换阀m2的第六接口相连。如图1所示,两位六通阀通过旋转切换具有两种工作状态,不同时刻选择不同的状态。在第一工作状态(记为状态a)下,其第一接口与第六接口连通,第二接口与第三接口连通,第四接口与第五接口连通;在第二工作状态(记为状态b)下,其第一接口与第二接口连通,第三接口与第四接口连通,第五接口与第六接口连通。
下面以pet显像剂18f-fdg的合成为例,说明利用该装置进行合成的方法,其具体步骤依次执行如下:
s1:保持第一注射泵p1的注射腔与第一出口连通,多位选择阀m1的入口切换至与多位选择阀m1的第一出口连通,第一注射泵p1进行初始化,排出注射腔的气体;然后第一注射泵p1的注射腔切换至与第二出口连通;
s2:启动第一注射泵p1抽吸模式,吸入第一试剂瓶t1中预先存储的ch3cn溶液,然后将第一注射泵p1的注射腔切换至与第一出口连通,将注射腔内的气体和液体打入缓冲盘管g中,再次将第一注射泵p1的注射腔切换至与第二出口连通并吸取ch3cn溶液,将第一注射泵p1的注射腔切换至与第一出口连通,将注射腔内的液体打入缓冲盘管g中;不断重复直至缓冲盘管g内的气体被完全排出;
s3:启动第一注射泵p1抽吸模式,向缓冲盘管g中抽入一段气体,用于在管内已有的ch3cn溶液与后续将被抽入管内的其他溶液之间形成分隔段;
s4:将多位选择阀m1的入口切换至与多位选择阀m1的第二出口连通,启动第一注射泵p1的抽吸模式,将第二试剂瓶t2内预先通过回旋加速器得到的18f-溶液抽吸至缓冲盘管g中;将多位选择阀m1的入口切换至与多位选择阀m1的第四出口连通,启动第一注射泵p1注射模式,将18f-溶液注入阴离子交换固相萃取芯片c1中;
s5:保持第二注射泵p2的注射腔与第二出口连通,第二注射泵p2进行初始化,排出注射腔的气体;
s6:将第二注射泵p2的注射腔切换至与第一出口连通,启动第二注射泵p2的抽吸模式,将阴离子交换固相萃取芯片c1中的溶液通过负压抽到注射腔内;将第二注射泵p2的注射腔切换至与第二出口连通,启动第二注射泵p2的注射模式,将注射腔内的溶液注入废液收集装置;
s7:将多位选择阀m1的入口切换至与多位选择阀m1的第三出口连通,启动第一注射泵p1的抽吸模式,将第三试剂瓶t3中预先存储的k2.2.2/k2co3溶液吸至缓冲盘管g中;然后将多位选择阀m1的入口切换至与多位选择阀m1的第四出口连通,启动第一注射泵p1注射模式,将k2.2.2/k2co3溶液注入阴离子交换固相萃取芯片c1中,对18f-离子进行洗脱;再启动第二注射泵p2的抽吸模式,向注射腔中吸入空气,然后将第二注射泵p2的注射腔切换至与第一出口连通,启动第二注射泵p2的注射吸模式利用空气将阴离子交换固相萃取芯片c1中的洗脱液压回缓冲盘管g中;然后多位选择阀m1的入口切换至与多位选择阀m1的第五出口连通,并保持旋转切换阀m2处于第一工作状态下;启动第一注射泵p1注射模式,将洗脱液注入微流控反应芯片c3的微通道中;
s8:启动鼓气装置,开始向芯片中鼓入气体;然后控制微流控反应芯片c3底部的温控装置开始加热,加热温度为水和乙腈的共沸点温度;
s9:将多位选择阀m1的入口切换至与多位选择阀m1的第七出口连通,然后启动第一注射泵p1抽吸模式,将第六试剂瓶t6中预先存储的ch3cn溶液抽吸至缓冲盘管g中,再将多位选择阀m1的入口切换至与多位选择阀m1的第五出口连通,将ch3cn溶液注入微流控反应芯片c3的微通道中;
s10:保持干燥气体持续鼓入微通道中,对乙腈与水形成的共沸物进行去除;
s11:除水至干后,将旋转切换阀m2切换至第二工作状态下,并停止气体通入;
s12:将多位选择阀m1的入口切换至与多位选择阀m1的第六出口连通,然后启动第一注射泵p1抽吸模式,将第五试剂瓶t5中预先存储的三氟甘露糖的无水乙腈前体液抽吸至缓冲盘管g中,然后控制温控装置升温加热至110℃;
s13:再将多位选择阀m1的入口切换至与多位选择阀m1的第五出口连通,将三氟甘露糖的无水乙腈前体液从微通道的通道出口注入微流控反应芯片c3;
s14:当前体液完全注入微通道中部位置后,利用第一注射泵p1不断地进行注射模式和抽吸模式的切换,使前体液与干燥的18f-混合物混合并不断搅拌反应;反应完全后,将旋转切换阀m2切换至第一工作状态下;
s15:将控制温控装置降温至100℃,持续向微通道的第二通道入口中通入干燥气体,使乙腈被蒸发去除;完全去除乙腈后,将旋转切换阀m2切换至第二工作状态下;
s16:将多位选择阀m1的入口切换至与多位选择阀m1的第八出口连通,将第七试剂瓶t7中预先存储的hcl溶液抽吸至缓冲盘管g中;
s17:再将多位选择阀m1的入口切换至与多位选择阀m1的第五出口连通,将hcl溶液从微通道的通道出口注入微流控反应芯片c3;利用第一注射泵p1不断地进行注射模式和抽吸模式的切换,使hcl溶液与氟化反应后的混合物混合并不断搅拌反应;反应完全,得到粗产物
s18:将多位选择阀m1的入口切换至与多位选择阀m1的第九出口连通,将第八试剂瓶t8中预先存储的h2o抽吸至缓冲盘管g中;
s19:再将多位选择阀m1的入口切换至与多位选择阀m1的第五出口连通,将h2o注入微流控反应芯片c3中,稀释粗产物;
s20:启动第一注射泵p1抽吸模式,将稀释后的粗产物全部抽取至缓冲盘管g中,将多位选择阀m1的入口切换至与多位选择阀m1的第十出口连通,启动第一注射泵p1注射抽吸模式,将粗产物稀释液注入纯化芯片c2进行纯化。
上述过程表明,利用第一注射泵p1、第二注射泵p2以及多位选择阀m1、旋转切换阀m2的精密配合,可以实现复杂的18f-fdg合成。当然,对于其他的pet显像剂合成,本装置也能够同样实现。
上述装置中,微流控反应芯片c3内的18f-干燥工序时通过干燥氦气推动试剂在微通道内形成液膜实现的,这要求微通道内壁具有一定的亲水性,可采用石英等材料制成。进一步的,在另一实施例中,设计了一款用于合成反应中实现干燥过程的微流控芯片,其结构示意图如图2所示。该微流控芯片中设有微通道4。微流控芯片可采用石英、硅酸盐玻璃、硼酸盐玻璃等与待干燥试剂不反应的耐腐蚀材质制成。微流控芯片的一端设有两个通道入口,其中第一通道入口1作为待干燥试剂的入口,第二通道入口2作为干燥气体的入口,两个通道入口分布设置于一条“v”型结构的连接管路的两个分叉口末端,两个入口各自通过一条支路通道汇流后,连通微通道4的前端,分别将待干燥试剂和干燥气体通入微通道4。微通道4的末端设有通道出口3,干燥气体或者气液混合物将从该出口流出。微通道4呈蛇形弯曲分布于芯片中,其沿程设有多个凹形腔5。本实施例中的凹形腔5呈半椭圆形,由通道空腔位置向芯片基材一侧凹陷,其长轴方向与微通道4的内壁垂直。凹形腔5朝向微通道4的内表面尽量保持光滑,无死角。凹形腔5主要连续、成对设于微通道4的直线段,在微通道4的拐弯段可不设置。凹形腔5的开设角度优化为水平开设,即芯片水平状态下,将凹形腔5水平布置于微通道4的两侧,两侧的通道壁分别向基材一侧凹陷。凹形腔5的最低位置尽量不低于微通道4的底部。微流控芯片尺寸为100mm×40mm×2mm,微通道4的横截面呈矩形的厚度为1mm,宽度为1.8mm,通道有效长度为850mm,通道有效容积为1530μl。凹形腔5的底面水平,且保持与微通道4底面平齐,其厚度也均与微通道4保持一致,尽量减小死体积。
下面说明在合成反应中利用该微流控芯片实现干燥过程的方法。首先将待干燥的液体试剂6通过微通道4的第一通道入口1注入微通道4上游位置,注入过程可采用注射泵等设备,且为了保证液体试剂6不会残留在支路通道中,可以在注射完液体试剂6后再用部分气体将液体试剂6推进至“y”型结构的交汇点下游。
如图3所示,然后通过第二通道入口2向微通道4中通入干燥气体7。干燥气体7推动液体试剂6继续向微通道4的下游移动,且沿程经过各个凹形腔5时,充满腔体并在表面张力的作用下滞留于腔体内。因此,液体试剂6沿程流动过程中,滞留试剂8不断填充沿程的凹形腔5中,微通道4中的试剂量不断减小。在需要精确定量的合成反应中,应保证所有注入的待干燥试剂均被留在微通道4中干燥,而不能被干燥气体带出管道,因此需保证注入微通道4的待干燥试剂量(以体积计)不大于微通道4沿程所有凹形腔5的有效容积,减少液相中需保留的物质的损失,保证了向后续合成提供准确计量的反应原料。一般来说,所有凹形腔5的有效容积最好大于待干燥试剂量,以提高可靠性。
如图4所示,当微通道4内的液体试剂6被完全填充至凹形腔5中后,或者多余的液体试剂6已在干燥气体7推动下排出通道出口3后,继续保持干燥气体持续通入,凹形腔5内的滞留试剂8表面随干燥气体流经而不断蒸发,直至试剂完全干燥,如图5所示。
被干燥后留在各凹形腔5中的物质可通过向通道入口注入其他溶剂,将其溶解后在气体推动下从通道出口3排出,并注入其他微流控芯片继续后续反应。或者,也可以将其他试剂注入微通道4中,直接在通道内进行反应。当然,在实际的干燥过程中,若微通道4的表面材质具有一定的亲水性,也会有部分液体试剂6铺展在通道表面形成液膜,此部分液膜也会与凹形腔5中的滞留试剂一样,被干燥气体7不断蒸发。
微流控芯片的底部设置有加热器,在反应过程中实现温度控制,加热器优选采用加热芯片等微型结构实现。凹形腔的形式可以做调整,例如也可以采用图6所示形状。
另外,在上述芯片结构基础上,还可以进一步提供一种优选方式,即微通道中包含顺次连接的第一管段、第二管段和第三管段,在中间的第二管段上设置上述凹形腔。当然,需要时,另外两个管段也可以设置。
该改进结构能够实现管道内实际的搅拌反应。其工作过程如下:首先,通过通道入口,将需要参与反应的液体试剂全部注入微流控反应芯片中的微通道内,再注入部分气体使液体试剂被推至第二管段中,达到如图6所示状态。然后通过阀切换(两位六通阀切换至第二工作状态b)封闭微通道的通道入口,保持微通道中除与第一注射泵p1的出气口相连的通道出口外,其余均保持密闭。然后控制第一注射泵p1对微通道往复施加正压和负压,使第一管段和第三管段中气体压差方向间歇性变化,在压力差推动下第二管段中的液体试剂往复流动,如图7为第一注射泵p1正压下的状态,图8为第一注射泵p1负压下的状态。由于凹形腔处表面不平整,因此当试剂流经此处时会发生紊流,使液体试剂扰动混合均匀,实现了类似搅拌状态的反应。
另外,上述搅拌状态反应也可以通过另一种方式实现。即将温控装置设置成三个,第一管段、第二管段和第三管段下方分别设有独立控制的加热器。同样通过阀切换保持第一管段和第三管段均密闭,两个管段中初始的气体温度和压力相同,温控装置通过控制两个管段中的温度不同,使两者产生温度差,进而产生压力差,使第二管段中的液体试剂被推动着来回往复。该方式还可以实现反应压力大小的调节,内部的压力是通过左右两个加热器的温度来调节的,即第一管段和第三管段下方的加热器。左右两个加热器的温度较高,则整体压力较大,反之压力较小。因此,反应仅需要进行搅拌混匀时,仅启用左侧加热器和右侧加热器并保持两者之间具有温差即可。当反应需要较大压力时,可在保持两者之间具有相对温差的同时,同时提升两者的绝对温度。当反应还需要加热时,可再启用第二管段下方的加热器,提高试剂温度。
下面基于图1所示的装置,或者基于它的任意一种改进装置,以合成18f-fdg、间接标记合成18f-奥曲肽为例,说明其具体应用方法。
应用例1高效在线自动化合成18f-fdg
该合成过程依次包括(1)f-的富集、(2)f-的干燥、(3)氟化反应、(4)水解反应和(5)粗产物纯化。
(1)f-的富集
①第一注射泵初始化(p1):保持第一注射泵p1的注射腔与第一出口连通,多位选择阀(m1)的入口切换至与多位选择阀(m1)的第一出口连通,第一注射泵(p1)进行初始化,排出注射腔的气体;然后第一注射泵(p1)的注射腔切换至与第二出口连通;
②排气:启动第一注射泵(p1)抽吸模式,吸入第一试剂瓶(t1)中预先存储的ch3cn溶液,然后将第一注射泵(p1)的注射腔切换至与第一出口连通,将注射腔内的气体和液体打入缓冲盘管(g)中,再次将第一注射泵(p1)的注射腔切换至与第二出口连通并吸取ch3cn溶液,将第一注射泵(p1)的注射腔切换至与第一出口连通,将注射腔内的液体打入缓冲盘管(g)中;不断重复直至缓冲盘管(g)内的气体被完全排出;
③抽气:保持多位选择阀(m1)的入口与多位选择阀(m1)的第一出口连通,启动第一注射泵(p1)抽吸模式,向缓冲盘管(g)中抽入一段气体,用于在管内已有的ch3cn溶液与后续将被抽入管内的其他溶液之间形成分隔段;
④核素富集:将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第二出口连通,启动第一注射泵(p1)的抽吸模式,将第二试剂瓶(t2)内预先通过回旋加速器得到的18f-溶液抽吸至缓冲盘管(g)中;将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第四出口连通,启动第一注射泵(p1)注射模式,将18f-溶液注入阴离子交换固相萃取芯片(c1)中;
⑤第二注射泵(p2)初始化:保持第二注射泵(p2)的注射腔与第二出口连通,第二注射泵(p2)进行初始化,排出注射腔的气体;
⑥排废液:将第二注射泵(p2)的注射腔切换至与第一出口连通,启动第二注射泵(p2)的抽吸模式,将阴离子交换固相萃取芯片(c1)中的溶液通过负压抽到注射腔内;将第二注射泵(p2)的注射腔切换至与第二出口连通,启动第二注射泵(p2)的注射模式,将注射腔内的溶液注入废液收集装置;
⑦核素洗脱:将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第三出口连通,启动第一注射泵(p1)的抽吸模式,将第三试剂瓶(t3)中预先存储的k2.2.2/k2co3溶液吸至缓冲盘管(g)中;然后将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第四出口连通,启动第一注射泵(p1)注射模式,将k2.2.2/k2co3溶液注入阴离子交换固相萃取芯片(c1)中,对18f-离子进行洗脱;再启动第二注射泵(p2)的抽吸模式,向注射腔中吸入空气,然后将第二注射泵(p2)的注射腔切换至与第一出口连通,启动第二注射泵(p2)的注射吸模式利用空气将阴离子交换固相萃取芯片(c1)中的洗脱液压回缓冲盘管(g)中;然后多位选择阀(m1)的入口切换至与多位选择阀(m1)的第五出口连通,并保持旋转切换阀(m2)处于第一工作状态下;启动第一注射泵(p1)注射模式,将洗脱液注入微流控反应芯片(c3)的微通道中;
(2)f-的干燥
①启动鼓气装置,开始向芯片中鼓入氦气;然后控制微流控反应芯片(c3)底部的温控装置开始加热,加热温度为水和乙腈的共沸点温度;
②将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第七出口连通,然后启动第一注射泵(p1)抽吸模式,将第六试剂瓶(t6)中预先存储的ch3cn溶液抽吸至缓冲盘管(g)中,再将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第五出口连通,将ch3cn溶液注入微流控反应芯片(c3)的微通道中;
③保持干燥气体持续鼓入微通道中,对乙腈与水形成的共沸物进行去除;
④除水至干后,将旋转切换阀(m2)切换至第二工作状态下,并停止气体通入;
(3)氟化反应
①将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第六出口连通,然后启动第一注射泵(p1)抽吸模式,将第五试剂瓶(t5)中预先存储的叠氮辅基前体化合物的无水乙腈溶液抽吸至缓冲盘管(g)中,然后控制温控装置升温加热至100℃;
②再将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第五出口连通,将叠氮辅基前体化合物的无水乙腈溶液从微通道的通道出口注入微流控反应芯片(c3);
③当前体液完全注入微通道后,利用第一注射泵(p1)不断地进行注射模式和抽吸模式的切换,使前体液与干燥的18f-混合物混合并不断搅拌反应;反应完全后,将旋转切换阀(m2)切换至第一工作状态下;
(4)水解反应
①将控制温控装置降温至100℃,持续向微通道的第二通道入口中通入干燥气体,使乙腈被蒸发去除;完全去除乙腈后,将旋转切换阀(m2)切换至第二工作状态下;
②将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第八出口连通,将第七试剂瓶(t7)中预先存储的hcl溶液抽吸至缓冲盘管(g)中;
③再将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第五出口连通,将hcl溶液从微通道的通道出口注入微流控反应芯片(c3);
④利用第一注射泵(p1)不断地进行注射模式和抽吸模式的切换,使hcl溶液与氟化反应后的混合物混合并不断搅拌反应;
⑤反应完全,得到粗产物;
(5)粗产物纯化
①将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第九出口连通,将第八试剂瓶(t8)中预先存储的h2o抽吸至缓冲盘管(g)中;
②再将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第五出口连通,将h2o注入微流控反应芯片(c3)中,稀释粗产物;
③启动第一注射泵(p1)抽吸模式,将稀释后的粗产物全部抽取至缓冲盘管(g)中,将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第十出口连通,启动第一注射泵(p1)注射抽吸模式,将粗产物稀释液注入纯化芯片(c2)进行纯化。
以上各个程序步骤经调试后,可由计算机控制,全自动化合成完成。
应用例2间接标记合成18f-奥曲肽
本应用例采用的装置同实施例1,区别点在于:多位选择阀(m1)中有12个出口,第十一出口、第十二出口分别通过管道连接第十试剂瓶(t10)、第十一试剂瓶(t11);部分试剂瓶中存储的液体不同,顺序注射的步骤和注射泵抽取及注射的体积不同。
该合成过程依次包括(1)f-的富集、(2)f-的干燥、(3)氟化反应、(4)氟代叠氮辅基与奥曲肽的click反应和(5)粗产物纯化。
(1)f-的富集
①第一注射泵初始化(p1):保持第一注射泵p1的注射腔与第一出口连通,多位选择阀(m1)的入口切换至与多位选择阀(m1)的第一出口连通,第一注射泵(p1)进行初始化,排出注射腔的气体;然后第一注射泵(p1)的注射腔切换至与第二出口连通;
②排气:启动第一注射泵(p1)抽吸模式,吸入第一试剂瓶(t1)中预先存储的ch3cn溶液,然后将第一注射泵(p1)的注射腔切换至与第一出口连通,将注射腔内的气体和液体打入缓冲盘管(g)中,再次将第一注射泵(p1)的注射腔切换至与第二出口连通并吸取ch3cn溶液,将第一注射泵(p1)的注射腔切换至与第一出口连通,将注射腔内的液体打入缓冲盘管(g)中;不断重复直至缓冲盘管(g)内的气体被完全排出;
③抽气:保持多位选择阀(m1)的入口与多位选择阀(m1)的第一出口连通,启动第一注射泵(p1)抽吸模式,向缓冲盘管(g)中抽入一段气体,用于在管内已有的ch3cn溶液与后续将被抽入管内的其他溶液之间形成分隔段;
④核素富集:将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第二出口连通,启动第一注射泵(p1)的抽吸模式,将第二试剂瓶(t2)内预先通过回旋加速器得到的18f-溶液抽吸至缓冲盘管(g)中;将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第四出口连通,启动第一注射泵(p1)注射模式,将18f-溶液注入阴离子交换固相萃取芯片(c1)中;
⑤第二注射泵(p2)初始化:保持第二注射泵(p2)的注射腔与第二出口连通,第二注射泵(p2)进行初始化,排出注射腔的气体;
⑥排废液:将第二注射泵(p2)的注射腔切换至与第一出口连通,启动第二注射泵(p2)的抽吸模式,将阴离子交换固相萃取芯片(c1)中的溶液通过负压抽到注射腔内;将第二注射泵(p2)的注射腔切换至与第二出口连通,启动第二注射泵(p2)的注射模式,将注射腔内的溶液注入废液收集装置;
⑦核素洗脱:将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第三出口连通,启动第一注射泵(p1)的抽吸模式,将第三试剂瓶(t3)中预先存储的k2.2.2/k2co3溶液吸至缓冲盘管(g)中;然后将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第四出口连通,启动第一注射泵(p1)注射模式,将k2.2.2/k2co3溶液注入阴离子交换固相萃取芯片(c1)中,对18f-离子进行洗脱;再启动第二注射泵(p2)的抽吸模式,向注射腔中吸入空气,然后将第二注射泵(p2)的注射腔切换至与第一出口连通,启动第二注射泵(p2)的注射吸模式利用空气将阴离子交换固相萃取芯片(c1)中的洗脱液压回缓冲盘管(g)中;然后多位选择阀(m1)的入口切换至与多位选择阀(m1)的第五出口连通,并保持旋转切换阀(m2)处于第一工作状态下;启动第一注射泵(p1)注射模式,将洗脱液注入微流控反应芯片(c3)的微通道中;
(2)f-的干燥
①启动鼓气装置,开始向芯片中鼓入氦气;然后控制微流控反应芯片(c3)底部的温控装置开始加热,加热温度为水和乙腈的共沸点温度;
②将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第七出口连通,然后启动第一注射泵(p1)抽吸模式,将第六试剂瓶(t6)中预先存储的ch3cn溶液抽吸至缓冲盘管(g)中,再将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第五出口连通,将ch3cn溶液注入微流控反应芯片(c3)的微通道中;
③保持干燥气体持续鼓入微通道中,对乙腈与水形成的共沸物进行去除;
④除水至干后,将旋转切换阀(m2)切换至第二工作状态下,并停止气体通入;
(3)氟化反应
①将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第六出口连通,然后启动第一注射泵(p1)抽吸模式,将第五试剂瓶(t5)中预先存储的叠氮辅基前体化合物的无水乙腈溶液抽吸至缓冲盘管(g)中,然后控制温控装置升温加热至100℃;
②再将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第五出口连通,将叠氮辅基前体化合物的无水乙腈溶液从微通道的通道出口注入微流控反应芯片(c3);
③当前体液完全注入微通道后,利用第一注射泵(p1)不断地进行注射模式和抽吸模式的切换,使前体液与干燥的18f-混合物混合并不断搅拌反应;反应完全后,将旋转切换阀(m2)切换至第一工作状态下;
(4)氟代叠氮辅基与奥曲肽的click反应
①将控制温控装置降温至95℃,持续向微通道的第二通道入口中通入干燥气体,使乙腈被蒸发去除;完全去除溶剂后,将旋转切换阀(m2)切换至第二工作状态下;
②将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第八出口连通,将第七试剂瓶(t7)中预先存储的奥曲肽的乙腈溶液抽吸至缓冲盘管(g)中;
③再将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第五出口连通,将奥曲肽的乙腈溶液注入多位选择阀(m1)和旋转切换阀(m2)之间的特氟龙管中;
④将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第十一出口连通,将第十试剂瓶(t10)中预先存储的碘化亚铜的乙腈溶液抽吸至缓冲盘管(g)中;
⑤再将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第五出口连通,将碘化亚铜的乙腈溶液注入多位选择阀(m1)和旋转切换阀(m2)之间的特氟龙管中;
⑥将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第十二出口连通,将第十一试剂瓶(t11)中预先存储的抗坏血酸纳的乙腈溶液抽吸至缓冲盘管(g)中;
⑦再将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第五出口连通,将抗坏血酸纳的乙腈溶液从微通道的通道出口注入微流控反应芯片(c3);
⑧利用第一注射泵(p1)不断地进行注射模式和抽吸模式的切换,使反应物混合并不断搅拌反应;
⑨反应完全,得到粗产物;
(5)粗产物纯化
①将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第九出口连通,将第八试剂瓶(t8)中预先存储的h2o抽吸至缓冲盘管(g)中;
②再将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第五出口连通,将h2o注入微流控反应芯片(c3)中,稀释粗产物;
③启动第一注射泵(p1)抽吸模式,将稀释后的粗产物全部抽取至缓冲盘管(g)中,将多位选择阀(m1)的入口切换至与多位选择阀(m1)的第十出口连通,启动第一注射泵(p1)注射抽吸模式,将粗产物稀释液注入纯化芯片(c2)进行纯化。
以上各个程序步骤经调试后,均可由计算机控制,全自动化合成完成。
上述为本发明中的基于微流控技术的pet显像剂模块化集成合成系统的两个具体应用,当然,还可以利用该pet仪合成其他正电子发射断层成像(pet)示踪剂。
以上所述的实施例只是本发明的一种较佳的方案,然其并非用以限制本发明。有关技术领域的普通技术人员,在不脱离本发明的精神和范围的情况下,还可以做出各种变化和变型。因此凡采取等同替换或等效变换的方式所获得的技术方案,均落在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!