一种18F标记Cys‑AnnexinV的方法及其应用与流程
一种18F标记Cys-AnnexinV的方法及其应用技术领域本发明属于PET显像领域,具体涉及一种18F标记AnnexinV的方法及其应用。
背景技术:
细胞凋亡(Apoptosis)又称程序性细胞死亡(ProgrammedCellDeath,PCD),是不同于坏死和意外死亡的、由基因调控的细胞主动性死亡过程。作为细胞生命周期中的重要组成部分,细胞凋亡的过程中伴随着一系列的生物分子及细胞形态学的改变。其中,细胞膜脂质双层中的磷脂酰丝氨酸(PS)由细胞膜内层翻转至外层,进而暴露于细胞表面,是细胞凋亡早期事件,发生在凋亡细胞形态学的改变之前,也是凋亡级联反应的初始事件。PS的外翻作为凋亡细胞被吞噬细胞识别的标志,将会进一步引起胞浆的皱缩、染色质的浓集及核内DNA降解等现象。因此,外翻的PS作为凋亡检测的靶点,具有较高的时效性,可早期检测细胞凋亡。目前,在利用检测外翻的PS来获知细胞凋亡情况的技术中,正电子断层显像(positronemissiontomography,PET)是常用的技术手段之一,其主要是利用11C、13N、15O或18F等放射性核素标记的、可与PS特异性结合的物质作为显像剂,通过显像剂在代谢中聚集与分布的呈像,来获知细胞凋亡的情况,从而达到诊断的目的。在可与PS特异性结合的物质中,以AnnexinV作为PET显像剂的相关技术具有良好的应用前景。AnnexinV(膜联蛋白V,又称AnnexinA5和AnxA5)是一种人体内源性蛋白,属于Ca2+依赖性磷脂结合蛋白家族,含有319各氨基酸,包括70-80个氨基酸重复单元,分子量约为35kD。研究表明,AnnexinV与PS特异性结合的亲和力高达10-9mol/L,其在被放射性核素标记、进而作为PET显像剂进行体内细胞凋亡的显像时,可实时监测体内凋亡的发生并且可实现细胞凋亡的活体无创显像,因此,已成为监测活体细胞凋亡领域的研究热点。在对AnnexinV进行正电子核素标记的技术中,以18F标记AnnexinV的18F-SFB-AnnexinV最为常见。但是,由于18F-SFB-AnnexinV是通过功能基团(18F-SFB)连接AnnexinV中赖氨酸残基上的氨基,进而标记上放射性核素的,而一分子的AnnexinV蛋白中含有21个赖氨酸残基,因此,18F-SFB标记在AnnexinV上的位置是不确定的,甚至标记上的个数也不确定。另外,AnnexinV中的一些赖氨酸残基处在AnnexinV与PS结合的活性区域附近,18F-SFB与该处的赖氨酸残基连接则会影响AnnexinV与PS的亲和性。这些均会导致18F-SFB-AnnexinV在细胞凋亡显像时特异性较低。为实现对AnnexinV的定位标记,且不影响AnnexinV与PS的亲和性,进而提高AnnexinV凋亡显像的特异性,现有技术中出现了对AnnexinV进行修饰,研究新的AnnexinV蛋白变体的相关技术。例如,2008年Li,Xuehe等用18F-FBABM对N端接一个半胱氨酸的AnnexinV蛋白进行标记,研究结果显示,AnnexinV经上述修饰后不影响其与PS结合的亲和力,但是18F-FBABM与蛋白的标记率比较低,仅为37%,无法实现更为高效标记。中国专利文献CN102690345A中公开了一种在大肠杆菌中克隆、表达并纯化得到的新的AnnexinV变体,该变体仅在天然AnnexinV的C-末端添加了1个半胱氨酸(Cys-AnnexinV),该变体已证实可用于99mTc的标记。
技术实现要素:
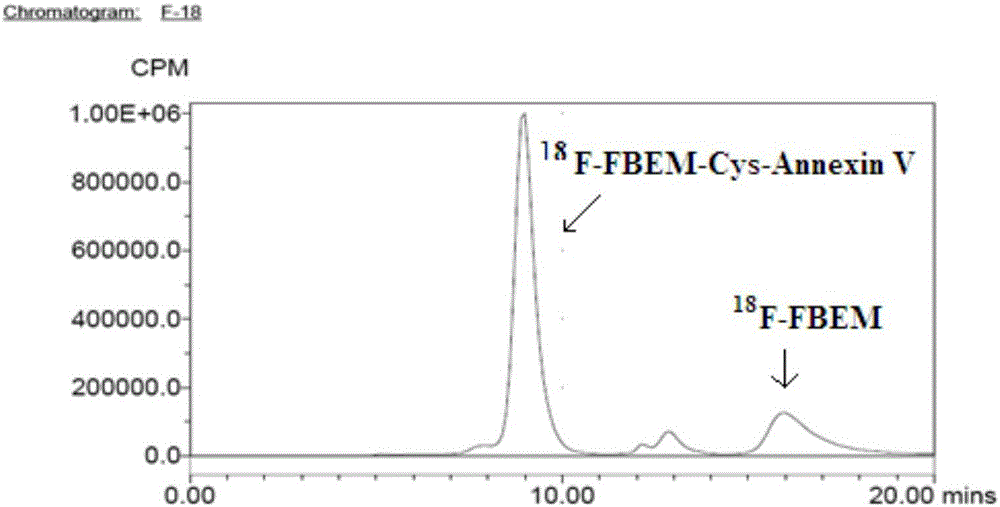
本发明所要解决的第一个技术问题是现有技术中的18F标记AnnexinV的方法无法实现对AnnexinV进行定位标记、标记率低、无法保证AnnexinV与PS较好的亲和性的问题,进而提供一种可实现18F定位标记Cys-AnnexinV的、标记后Cys-AnnexinV与PS保持良好的亲和性的高标记率的18F标记Cys-AnnexinV的方法。本发明解决的第二个技术问题是现有技术中的18F标记AnnexinV的PET显像剂特异性较低、无法实现良好的显像效果,进而提供一种特异性高、显像效果良好的18F标记Cys-AnnexinV的PET显像剂。本发明的18F标记Cys-AnnexinV的方法,采用18F-FBEM标记Cys-AnnexinV。具体包括以下步骤:取18F-FBEM与Cys-AnnexinV溶解于溶剂中,混合均匀,形成反应液,在30-40℃下反应至生成标记产物18F-FBEM-Cys-AnnexinV。进一步的,本领域技术人员可根据原料的溶解等性质选取溶剂,优选的,所述溶剂为乙醇、水、磷酸盐缓冲液、柠檬酸盐缓冲液中的一种或多种。进一步的,在所述反应液中,所述18F-FBEM的放射性活度为1-1000MBq/mL。所述Cys-AnnexinV的浓度为0.2-20mg/mL。本发明的18F标记Cys-AnnexinV的方法,还包括采用缓冲液调节所述反应液的pH值至5-8的步骤。当然,所述缓冲液只要可以实现将反应液的pH值调节至所需范围内即可,优选的,所述缓冲液为磷酸盐缓冲液、柠檬酸盐缓冲液中的一种或两者的混合液。根据上述方法制备得到的标记产物18F-FBEM-Cys-AnnexinV,可应用与PET显像领域。所述的18F-FBEM-Cys-AnnexinV在制备PET显像剂中的应用。本发明提供的PET显像剂,包括18F-FBEM-Cys-AnnexinV。本发明所述的18F-FBEM,即N-[2-(4-[18F]氟苯甲酰氨基)乙基]马来酰亚胺,其结构式如下:所述Cys-AnnexinV为AnnexinV的变体蛋白,在天然的AnnexinV的C-末端添加1个半胱氨酸,其结构如下:所述18F-FBEM与Cys-AnnexinV的标记反应过程如下所示:本发明旨在讨论18F标记Cys-AnnexinV的方法,所用的原料18F-FBEM与Cys-AnnexinV可采用本领域技术人员常规方法得到。例如,所述Cys-AnnexinV可采用中国专利文献CN102690345A中记载的在大肠杆菌中克隆、表达并纯化得到的AnnexinV变体的方法得到。本发明的上述技术方案,相比现有技术具有以下优点:(1)本发明的18F标记Cys-AnnexinV的方法,采用18F-FBEM标记Cys-AnnexinV。首先,AnnexinV的三维结构显示,其N-端和C-端都位于分子膜结合点的对面,在重组过程中对AnnexinV的两端进行修饰并不影响重组蛋白在Escherichiacolli的表达或折叠,也不改变其与膜PS结合的亲合性,因此,在AnnexinV的C-末端添加1个半胱氨酸得到的Cys-AnnexinV,其与PS结合的亲合性并未受到影响。与此同时,经过修饰得到的Cys-AnnexinV可与18F-FBEM基团实现高选择性的连接。Cys-AnnexinV的C端的游离巯基与18F-FBEM上的双键发生特异性连接,可较好的保证18F的定位标记,避免了标记位置、标记数量的不确定带来的显像特异性低的问题。(2)本发明标记方法,步骤简单易行,且标记结果直观准确。经实验表明,本发明的标记方法,标记率可达80%以上,且标记产物与反应中可能出现的杂质(如放射性杂质18F-FBEM等)能够明显区分,易于制备成PET显像剂。(3)本发明的PET显像剂,包括18F-FBEM-Cys-AnnexinV,标记后的18F-FBEM-Cys-AnnexinV与Cys-AnnexinV具有相近似的性能,作为显像剂应用于检测时,可直观反映出细胞的凋亡情况,且显像结果与原位末端标记法检测细胞凋亡的结果相一致,结果准确。并且,实现了定位标记的18F-FBEM-Cys-AnnexinV,其显像特异性优异,可实现良好的显像效果。附图说明为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明,其中图1为本发明标记前体Cys-AnnexinV的HPLC色谱图;图2为实施例1中标记蛋白18F-FBEM-Cys-AnnexinV的HPLC色谱图;图3为实施例1中纯化后18F-FBEM-Cys-AnnexinV的HPLC色谱图;图4为实施例1中18F-FBEM的HPLC色谱图(TSKGEL凝胶柱,tR=15.9min);图5为实施例1中19F-FBEM的HPLC色谱图(反相C18柱,UV检测tR=5.4min);图6为实施例1中18F-FBEM的HPLC色谱图(反相C18柱,同位素检测tR=5.5min);图7为实施例5中18F-FBEM-Cys-AnnexinV在正常小鼠体内的MicroPET显像图及部分脏器的时间活性曲线图;图8为实施例6中18F-FBEM-Cys-AnnexinV在正常小鼠体内的血药清除曲线;图9为实施例7中大鼠肝脏凋亡模型注射18F-FBEM-Cys-AnnexinV1h后的显像图,箭头所指为肝脏区域,模型鼠肝脏摄取是对照组的5.18倍;图10为实施例7中大鼠肝脏凋亡模型注射18F-FBEM-Cys-AnnexinV2h后的显像图,箭头所指为肝脏区域,模型鼠肝脏摄取是对照组的10.41倍;图11为实施例8中原位末端标记法检测大鼠凋亡肝脏细胞的荧光显微镜图。具体实施方式实施例1以18F-FBEM标记Cys-AnnexinV本实施例中,Cys-AnnexinV由江苏靶标生物医药研究所有限公司提供。采用18F-FBEM对Cys-AnnexinV进行18F标记,具体包括以下步骤:(1)18F-FBEM的制备:以4-三甲胺苯甲酸乙酯三氟磺酸盐为原料,与18F发生取代反应后,得到4-三甲胺苯甲酸乙酯三[18F]氟磺酸盐,向其中加入0.5mL浓度为0.5mol/L的NaOH溶液,使其碱性水解,再加入0.7mL浓度为1mol/L的盐酸溶液,将其酸化,得到4-[18F]氟苯甲酸;将得到的4-[18F]氟苯甲酸与N-(2-氨基乙基)马来酰亚胺、氰基膦酸二乙酯以及N,N-二异丙基乙胺混合均匀,反应得到18F-FBEM。(2)18F标记:将步骤(1)中得到的18F-FBEM通过萃取柱转换成18F-FBEM乙醇溶液,取100μL放射性活度为37MBq的18F-FBEM乙醇溶液加入到1000μL的浓度为1mg/mL的Cys-AnnexinV的磷酸缓冲液中,混合均匀后,得到pH值为8.0的反应液,将所述反应液置于35℃水浴中反应30min,即得到标记产物18F-FBEM-Cys-AnnexinV。将上述方法得到的标记产物18F-FBEM-Cys-AnnexinV采用高效液相色谱(HPLC)法,上TSKGEL凝胶柱(SWG2000swxL),以浓度为0.05M(即mol/L,下同)、pH值为7.0的磷酸缓冲液为流动相,流动相的流速为0.8mL/min,紫外检测波长为278nm,同时设置有同位素检测仪,进行检测。再以相同的检测条件检测未标记的Cys-AnnexinV以及18F-FBEM溶液。如图1、2、4所示,分别为Cys-AnnexinV、18F-FBEM-Cys-AnnexinV以及18F-FBEM的HPLC色谱图。通过图1、图2与图4的对比可知,18F-FBEM-Cys-AnnexinV的保留时间(tR)为9.2min,与没有标记的Cys-AnnexinV的保留时间相一致,而18F-FBEM溶液的保留时间(tR)为15.9min。通过分析图1,计算得到标记率为83.7%。将得到的标记产物18F-FBEM-Cys-AnnexinV经PD-10柱纯化后,得到的18F-FBEM-Cys-AnnexinV的放化纯大于95%,其HPLC色谱图如图3所示。为了更进一步的确认18F-FBEM,将HPLC中的TSKGEL凝胶柱换成反相C18柱,以标准品19F-FBEM作对照,以乙腈/水(45/55,v/v)为流动相,流动相的流速为1.0mL/min,紫外检测波长为254nm,并设置有同位素检测仪,进行检测。其HPLC色谱图其如图5和图6所示。上述结果表明,本发明的18F-FBEM标记Cys-AnnexinV的方法,具有较高的标记率(83.7%),标记产物18F-FBEM-Cys-AnnexinV与18F-FBEM能很好的分离,经纯化后18F-FBEM-Cys-AnnexinV的放化纯大于95%。实施例2以18F-FBEM标记Cys-AnnexinV本实施例中,Cys-AnnexinV为采用中国专利文献CN102690345A中记载的方法制备得到。采用18F-FBEM对Cys-AnnexinV进行18F标记,具体包括以下步骤:(1)18F-FBEM的制备:采用与实施例1相同的方法制备得到。(2)18F标记:取步骤(1)中得到的18F-FBEM配制为放射性活度为1MBq/mL的乙醇溶液,取100μL的18F-FBEM乙醇溶液加入到1000μL的浓度为0.2mg/mL的Cys-AnnexinV的水溶液中,混合均匀后,得到反应液,将所述反应液置于30℃水浴中反应30min,即得到标记产物18F-FBEM-Cys-AnnexinV。按照与实施例1相同的方法对得到的标记产物18F-FBEM-Cys-AnnexinV进行测定,计算得到标记率为82.0%。实施例3以18F-FBEM标记Cys-AnnexinV本实施例中,Cys-AnnexinV由江苏靶标生物医药研究所有限公司提供。采用18F-FBEM对Cys-AnnexinV进行18F标记,具体包括以下步骤:(1)18F-FBEM的制备:采用与实施例1相同的方法制备得到。(2)18F标记:取步骤(1)中得到的18F-FBEM配制为放射性活度为1000MBq/mL的乙醇溶液,取100μL18F-FBEM溶液加入到1000μL的浓度为20mg/mL的Cys-AnnexinV的柠檬酸盐缓冲液中,混合均匀后,调节pH值至5,得到反应液,将所述反应液置于40℃水浴中反应30min,即得到标记产物18F-FBEM-Cys-AnnexinV。按照与实施例1相同的方法对得到的标记产物18F-FBEM-Cys-AnnexinV进行测定,计算得到标记率为81.7%。实施例4以18F-FBEM标记Cys-AnnexinV本实施例中,Cys-AnnexinV由江苏靶标生物医药研究所有限公司提供。采用18F-FBEM对Cys-AnnexinV进行18F标记,具体包括以下步骤:(1)18F-FBEM的制备:采用与实施例1相同的方法制备得到。(2)18F标记:取步骤(1)中得到的18F-FBEM配制为放射性活度为500MBq/mL的乙醇溶液,取100μL18F-FBEM乙醇溶液加入到1000μL浓度为10mg/mL的Cys-AnnexinV的磷酸盐与柠檬酸盐混合的缓冲液中,混合均匀后,得到反应液,将所述反应液置于40℃水浴中反应30min,即得到标记产物18F-FBEM-Cys-AnnexinV。按照与实施例1相同的方法对得到的标记产物18F-FBEM-Cys-AnnexinV进行测定,计算得到标记率为83.2%。实施例518F-FBEM-Cys-AnnexinV在小鼠体内的MicroPET显像本实施例通过18F-FBEM-Cys-AnnexinV在小鼠体内的生物分布,说明该标记化合物的生物学分布特点符合作为显像剂的要求。具体操作如下:取ICR小鼠2只,用异氟烷麻醉后,使其平躺在microPET的床上,四肢用胶带固定,取实施例1中标记得到的18F-FBEM-Cys-AnnexinV,配制放射性活度为4.5MBq的生理盐水溶液,取0.2ml分别经尾静脉注射入小鼠体内,动态扫描采集60min,图像重建采用FBP法。选择感兴趣部位(本实施例中为心脏,肝脏和肾脏),计算时间和放射性剂量之间的曲线,如图7所示。根据图7可知,18F-FBEM-Cys-AnnexinV主要是经肾脏代谢,在注射后16分钟(约1000秒)的时候,肾脏中的放射性摄取达到最大值,随后慢慢下降,到注射后1小时的时候,肾脏、肝脏和心脏的放射性摄取基本接近。上述结果表明,18F-FBEM-Cys-AnnexinV在肾脏的代谢较快,适合其作为显像剂的快速降低显像本底的要求。实施例618F-FBEM-Cys-AnnexinV在小鼠体内的血药清除实验取ICR小鼠5只,取实施例1中标记得到的18F-FBEM-Cys-AnnexinV,配制放射性活度为3.7MBq的生理盐水溶液,取0.2ml分别经尾静脉注射入小鼠体内,于注射后5,15,30,45,60,90,120min分别采血10μL,用γ计数仪测量放射性计数,计算每克血液百分注射剂量率(%ID/g,每克血液的放射性计数/注射入大鼠体内总放射性计数×100%)。用DAS2.0软件拟合,分析18F-FBEM-Cys-AnnexinV在正常小鼠体内的药代动力学曲线,如图8所示,符合二室模型特征,药代公式为:C=2.359e-0.062t+3.288e-0.005t,分布相半衰期(T1/2α)为11.261min,清除相半衰期(T1/2β)为134.62min,平均血浆清除率(CL)为0.031L/min/kg,药-时曲线下面积(AUC0→∞值)为643.123%ID/g×min。上述实验结果表明:18F-FBEM-Cys-AnnexinV在血液中的清除符合蛋白在血液中清除的一般规律。实施例7大鼠肝脏凋亡模型的18F-FBEM-Cys-AnnexinV的MicroPET显像选择SD大鼠4只(卫生部核医学重点实验提供),体重280-290g,以5mg/kg的放线菌酮剂量制备大鼠肝脏凋亡模型,3只大鼠分别经尾静脉注射放线菌酮溶液,另1只大鼠注射生理盐水作对照。3小时后,取实施例1中标记得到的18F-FBEM-Cys-AnnexinV,配制放射性活度为7.4MBq的生理盐水溶液,取0.2ml分别经尾静脉注射入大鼠体内,注射显像剂后1h和2h分别进行MicroPET显像,各静态采集10min。如图9-10所示,左侧为模型鼠,箭头处为凋亡肝脏显像,右侧为正常对照鼠,在左侧模型鼠的MicroPET显像图中可观察到肝脏部位有明显的放射性浓聚。经计算,在注射后1h和2h显像时,模型鼠肝脏的放射性摄取(%ID/g)分别是对照组肝脏的5.18倍和10.41倍。上述实验结果表明:化学药物诱导的肝凋亡细胞对18F-FBEM-Cys-AnnexinV的摄取明显高于正常肝细胞,说明18F-FBEM-Cys-AnnexinV具有显现细胞凋亡的能力。实施例8大鼠凋亡肝脏的原位末端标记法(TUNEL)检测TUNEL法用于单细胞水平凋亡免疫组化检验和量化分析,其原理为标记DNA断裂位,详细步骤如下:(1)将实施例7中显像结束后的大鼠处死,立即取出肝脏,用福尔马林液固定;将大鼠肝脏样本经福尔马林液固定24h后,石蜡包埋,切片,每片厚度4-5μm;(2)二甲苯脱蜡30min,梯度乙醇水化后PBS冲洗,每次1min;(3)滴加蛋白酶K,37℃孵育30min后,PBS洗涤3次;(4)滴加TUNEL检测液(购自碧云天生物技术研究所),37℃避光孵育1h,PBS洗涤3次;(5)用抗荧光淬灭封片液封片后,100倍荧光显微镜下观察。如图11所示,左侧为模型鼠,右侧为对照组,图中箭头所指为发荧光的凋亡小体,模型鼠的肝脏可见较多的发荧光的凋亡小体,而对照组的肝脏中发荧光的凋亡小体就很少。这个结果与18F-FBEM-Cys-AnnexinV的大鼠肝脏凋亡显像的结果相一致,说明18F-FBEM-Cys-AnnexinV标记化合物作为显像剂能够显示大鼠肝脏的凋亡情况。实施例9:18F-FBEM-Cys-AnnexinV与18F-SFB-AnnexinV的对比现有技术中,以18F-SFB为基础计算18F-SFB-AnnexinV的标记率为20-25%(Jian-ChengZhu,FengWang,WeiFang,etal,18F-annexinVapoptosisimagingfordetectionofmyocardiumischemiaandreperfusioninjuryinaratmodel,JRadioanalNuclChem(2013)298:1733–1738.)。而本发明中以18F-FBEM为基础计算18F-FBEM-Cys-AnnexinV的标记率大于80%(如实施例1-4所示),由此可见,本发明的技术方案,标记率远远高于现有技术。现有技术中得到的18F-SFB-AnnexinV,在放线菌酮诱导的大鼠肝脏凋亡模型的显像中,18F-SFB-AnnexinV注射后2h,模型组肝脏的放射性摄取是对照组的3-9倍(KevinJ.Yagle,JanetF.Eary,JonathanF.Tait,etal,Evaluationof18F-AnnexinVasaPETImagingAgentinanAnimalModelofApoptosis,JOURNALOFNUCLEARMEDICINE,Vol.46,No.4,658-666)。也许正是由于18F-SFB标记位置的不确定,导致上述18F-SFB-AnnexinV凋亡显像的特异性有所降低,使模型组肝脏的放射性摄取与对照组的比值在3-9的范围内。而本发明得到的18F-FBEM-Cys-AnnexinV在放线菌酮诱导的大鼠肝脏凋亡模型的显像中,注射后2h,模型组肝脏的放射性摄取是对照组的10.41倍(如实施例7所示),明显高于现有技术,说明18F-FBEM-Cys-AnnexinV的凋亡显像的特异性高于现有技术的18F-SFB-AnnexinV。综上所述,本发明的18F标记Cys-AnnexinV的方法可实现高标记率,且应用于显像时放射性摄取高、Cys-AnnexinV与PS的亲和性较好,显像特异性高,作为PET显像剂可实现较为理想的显像效果。显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1